-
Medical journals
- Career
Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
Authors: S. Oravec; A. Dukát; P. Gavornik; M. Čaprdna; M. Kučera
Authors‘ workplace: II. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MU Dr. Andrej Dukát, CSc., FESC
Published in: Vnitř Lék 2010; 56(9): 967-971
Category: 60th Birthday - Andrej Dukat MD, Csc., FESC
Overview
Nové vyšetrovacie postupy v biochemickej analýze lipoproteínov umožňujú identifikovať a kvantifikovať aterogénne lipoproteíny plazmy včítane malých denzných LDL a charakterizovať lipoproteínové spektrum ako neaterogénny lipoproteínový profil fenotyp A a aterogénny lipoproteínový profil fenotyp B. Identifikácia neaterogénnej hypercholesterolémie (48 %), aterogénnej hypertriacylglycerolémie (93 %), aterogénnej normolipémie (13 %) u pacientov s artériovou hypertenziou a identifikácia aterogénnej normolipémie u kontrolnej skupiny zdravých probandov (7 %) je zásadným prínosom novej laboratórnej diagnostiky.
Kľúčové slová:
aterogénne lipoproteínové spektrum – neaterogénna hypercholesterolémia – aterogénna normolipémiaÚvod
Artériová hypertenzia je jedno z najčastejších kardiovaskulárnych ochorení. Trpí na ňu temer 20 % dospelej populácie a adolescentov. Patrí s dyslipoproteinémiou a abúzom nikotínu medzi kardinálne rizikové faktory rozvoja aterosklerotických zmien v artériách, s predilekciou koronárne, mozgové a periférne artérie [1]. Klinicky ide o trvalé zvýšenie krvného tlaku (TK) na hodnoty ≥ 140/85 mm Hg v dospelej populácii. Podľa SZO/ISH (International Society of Hypertension) z roku 1993, pre osoby stredného veku sa odporúčajú hodnoty pre krvný tlak 140/85 mm Hg, u osôb starších ako 70 rokov veku sú hodnoty krvného tlaku do 160/95mmHg deklarované ako normálne [2]. V patogenéze artériovej hypertenzie dochádza k narušeniu 2 základných mechanizmov v kontrole krvného tlaku:
- minútového objemu a
- periférnej cievnej rezistencie.
Následkom čoho je spustenie kaskády patomechanizmov, ktoré vyústia do vzniku artériovej hypertenzie s následným poškodením srdca, do multiorgánového poškodenia, terminálne s ich zlyhaním [3].
Klasifikácia artériovej hypertenzie [2,3]:
A. Primárna (esenciálna) hypertenzia (95 % hypertonikov)
- etiológia:
- multifaktoriálna,
- genetické faktory,
- vonkajšie vplyvy (↑Na, ↓K, ↓Mg, ↓Ca, hyperlipoproteinémia, obezita, stres),
- porucha vnútorných regulačných mechanizmov (vazodilatačných a vazopresorických), spojených s dysfunkciou endotelu.
B. Sekundárna hypertenzia (2–5 % hypertonikov), kedy artériová hypertenzia je symptómom iného primárneho ochorenia (napr. endokrinné poruchy, cievne poruchy, orgánové poškodenie a pod.).
Dyslipoproteinémia, ktorá často sprevádza artériovu hypertenziu (AH), znásobuje riziko rozvoja AH a urýchľuje manifestáciu orgánovej ischémie [4–6].
Inovovaná laboratórna diagnostická metóda v oblasti porúch metabolizmu lipoproteínov, elektroforéza lipoproteínov na polyakrylamidovom géli Lipoprint LDL systém, umožňuje identifikovať a kvantitatívne vyhodnotiť aterogénne lipoproteíny prítomné v lipoproteínovom spektre séra/plazmy vyšetrovanej osoby. Vyhodnocuje lipoproteínové spektrum a určuje neaterogénny lipoproteínový profil ako fenotyp A, resp. ako aterogénny lipoproteínový profil fenotyp B [7,8] podľa toho, či v lipoproteínovom spektre prevládajú neaterogénne alebo aterogénnne lipoproteínové entity. Aterogénne lipoproteínové spektrá sa vyznačujú bohatým zastúpením aterogénnych lipoproteínov veľmi nízkej hustoty (VLDL), intermediárnej hustoty IDLc a IDLb, a predovšetkým prítomnosťou malých denzných lipoproteínov nízkej hustoty, „mdLDL“. V prípade mdLDL ide o silne aterogénne LDL subpopulácie, ktoré vytvárajú frakciu LDL 3–7. Ako ich názov naznačuje, sú menšie, s priemerom menším než 26,5 nm, resp. 265 Å (Angström), a flotujú v hustotnom rozmedzí medzi d = 1,048–1,065 g/ml, to znamená vyššom než flotujú LDL 1, LDL 2 (d = 1,019) [9–12]. Na deliacom polyakrylamidovom géli (PAG) pri elektroforéze lipoproteínov [13,14] ich možno identifikovať ako jemné pásy na anodickej strane gélu, hneď za HDL frakciou, ktorá putuje na čele delených lipoproteínov. Malé denzné LDL sú silne aterogénne pre ich biologické vlastnosti charakterizujúce ich silný aterogénny potenciál (tab. 1) [10,11].
Table 1. Malé denzné LDL sú viac aterogénne pre [10,11]. ![Malé denzné LDL sú viac aterogénne pre [10,11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/967fa7e2f83effc24cf59eb010acb694.jpeg)
Doteraz publikované odborné práce v oblasti AH a dyslipoproteinémie len ojedinele pracujú s technikami, ktoré kvantitatívne vyhodnocujú množstvo aterogénnych lipoproteínov. Predmetná štúdia je zameraná na identifikáciu aterogénnych lipoproteínov v lipoproteínovom spektre novo diagnostikovaných pacientov s artériovouhypertenziou.
Cieľ práce
Cieľom predkladanej štúdie je:
- a) zistiť zastúpenie aterogénneho alebo neaterogénneho lipoproteínového profilu u pacientov s novo zistenou AH a porovnať ho s lipoproteínovým spektrom u kontrolnej skupiny zdravých normolipemických probandov,
- b) analýzou prostanoidov (prostacyk-lín a tromboxan A2) v plazme testovaných osôb hodnotiť integritu cievneho endotelu.
Pacienti a metódy
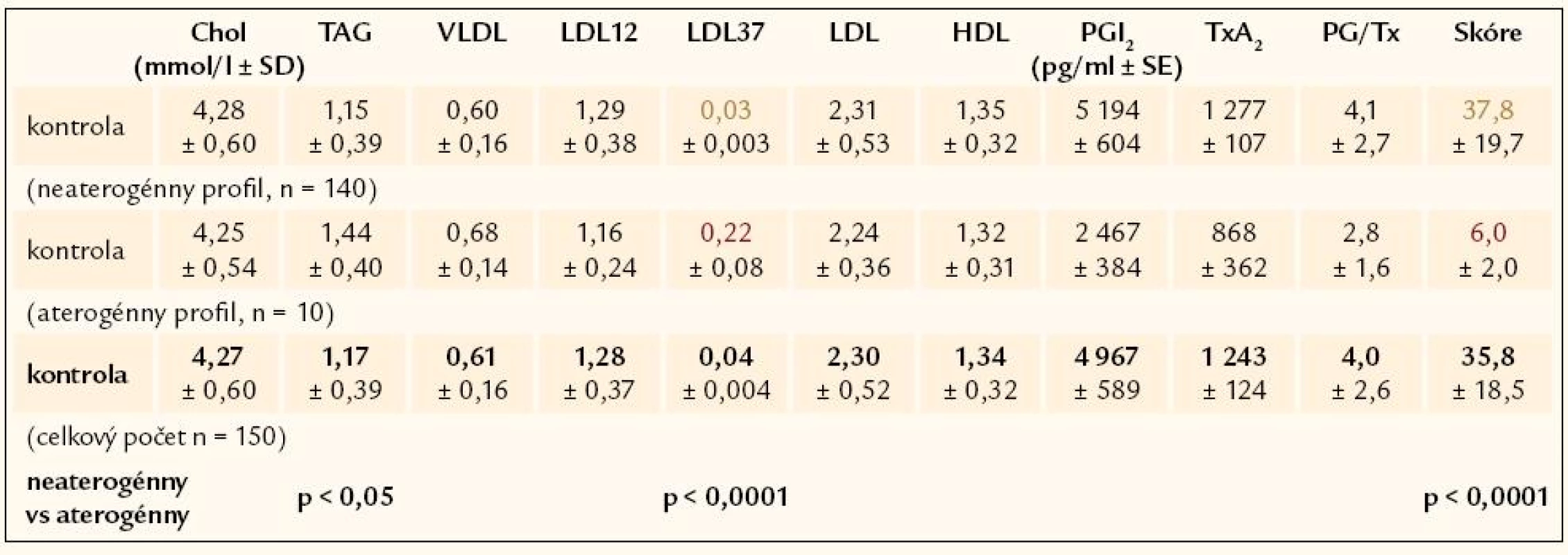
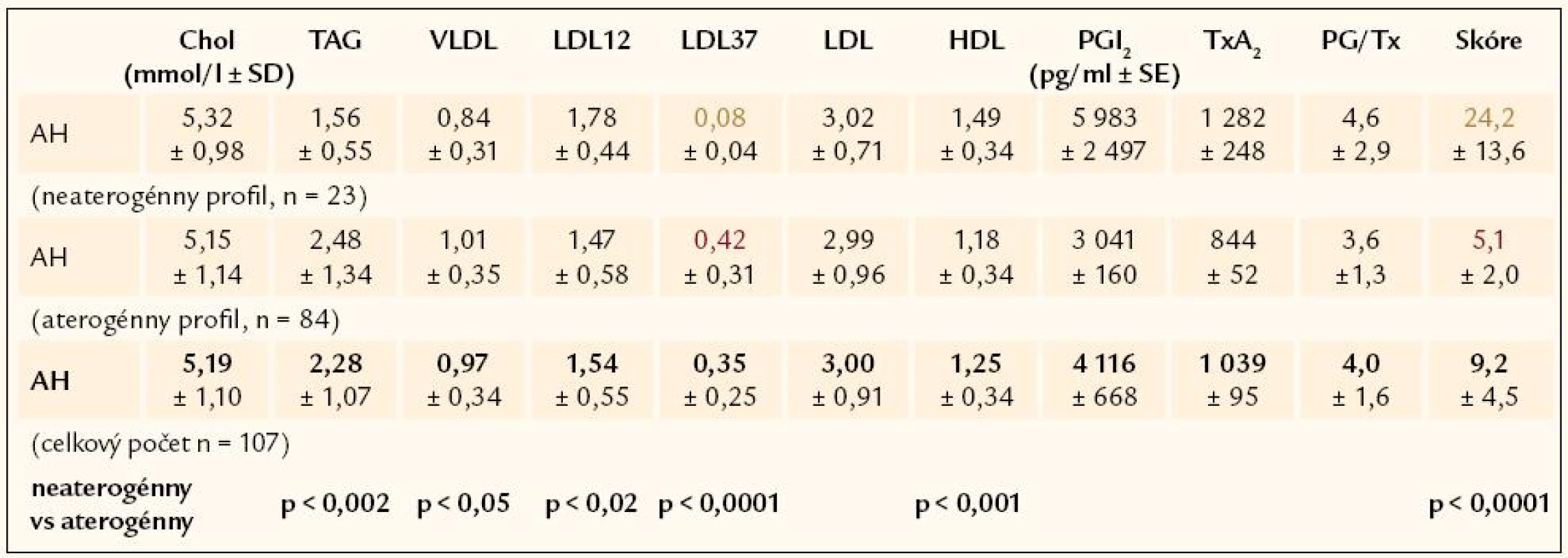
Bolo vyšetrených 107 novo zistených hypertonikov, u ktorých sa pri opakovanom meraní krvného tlaku zistili hodnoty systolického krvného tlaku ≥ 150 mm Hg a hodnoty diastolického krvného tlaku ≥ 90 mm Hg. Priemerná hodnota systolického krvného tlaku bola 172 ± 19 mm Hg a diastolického tlaku101 ± 11 mm Hg. Súbor tvorilo 66 mužov a 41 žien (priemerný vek žien 51,0 ± 13,4 rokov a priemerný vek mužov 50 ± 17,6 rokov).
Kontrolnú skupinu tvorilo 150 zdravých normotenzných probandov bez manifestných známok ochorenia kardiovaskulárneho systému a bez biochemických známok poruchy metabolizmu lipidov.
Zo sledovaných biochemických parametrov sa analyzovala sérová koncentrácia celkového cholesterolu a triacylglycerolov enzymatickou metódou CHOD-PAP, firmy Roche SRN.
Koncentrácia lipoproteínov a ich subpopulácií v sére sa stanovila elektroforetickou metódou Lipoprint LDL systém, Quantimetrix, CA, USA a určil sa fenotyp lipoproteínového profilu: neaterogénny fenotyp A a aterogénny fenotyp B [13]. Lipoprint LDL systém simultánne analyzoval 12 lipoproteínových tried a ich subpopulácií. Koncentrácia lipoproteínov sa vyjadrila obsahom cholesterolu v jednotlivých lipoproteínových triedach, resp. lipoproteínových entitách, napr. VLDL-cholesterol.
V ďalšom sa vypočítalo Skóre Aterogénneho Rizika (SAR) ako pomer neaterogénnych a aterogénnych lipoproteínov plazmy. Hodnoty SAR nad 10,8 charakterizujú neaterogénny lipoproteínový profil a hodnoty pod 9,8 určujú aterogénny lipoproteínový profil. Hodnoty medzi 9,8 a 10,8 predstavujú šedú zónu.
Plazmatická koncentrácia prostanoidov: prostacyklínu (PGI2), resp. jeho chemicky stabilnej formy 6-keto-PGF1α a tromboxanu A2 (TxA2), resp. jeho chemicky stabilnej formy tromboxanu B2, sa analyzovala ELISA metódou firmy DRG, USA.
Krv sa odobrala pacientom po 12-hodinovom lačnení z v. cubiti, získala sa EDTA-plazma, ktorá sa použila na analýzu biochemických parametrov.
Výsledky sa vyhodnotili štatisticky nepárovým Studentovým t-testom.
Výsledky
V súbore 107 novozistených hypertonikov sa zistil asi 87% výskyt hyperlipoproteinémie: v 21,5 % hypercholesterolémia, v 38,3 % hypertriacylglycerolémia a v 27,1 % kombinovaná hyperlipémia. Len u 13,1 % pacientov s hypertenziou sa zistila normolipémia (tab. 2).
Table 2. Percentuálne zastúpenie hyperlipoproteinémie u pacientov s artériovou hypertenziou. 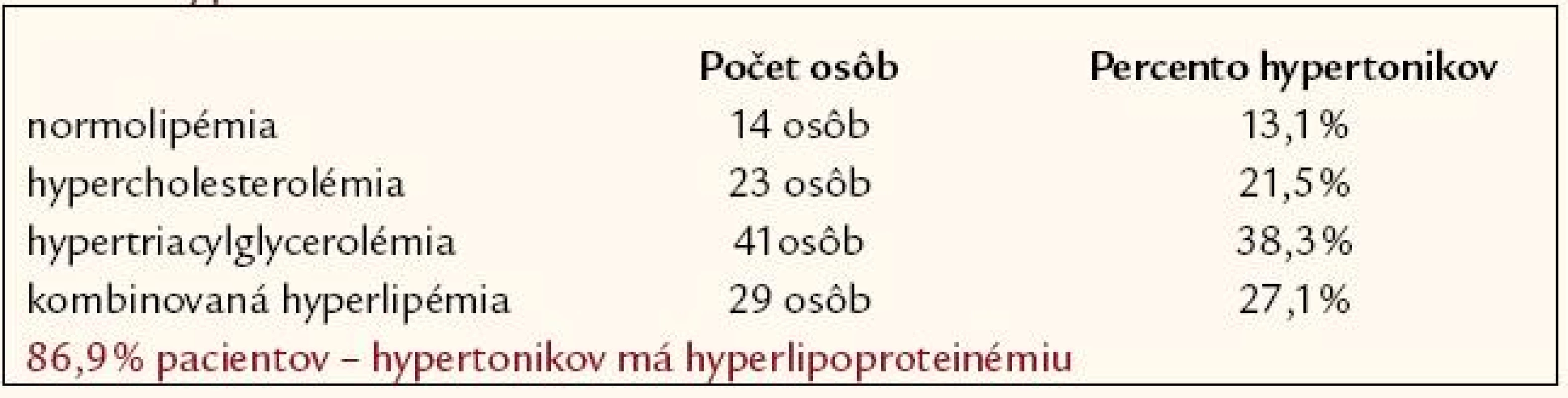
Pri štrukturovaní skupiny hypertonikov podľa výskytu aterogénneho a neaterogénneho lipoproteinového profilu sa zistilo temer 80% (78,5%) zastúpenie aterogénneho lipoproteínového profilu u pacientov s artériovou hypertenziou (tab. 3).
Table 3. Delenie hypertonikov podľa výskytu aterogenity vs neaterogenity lipoproteínového spektra (fenotyp B vs fenotyp A) (n = 107). 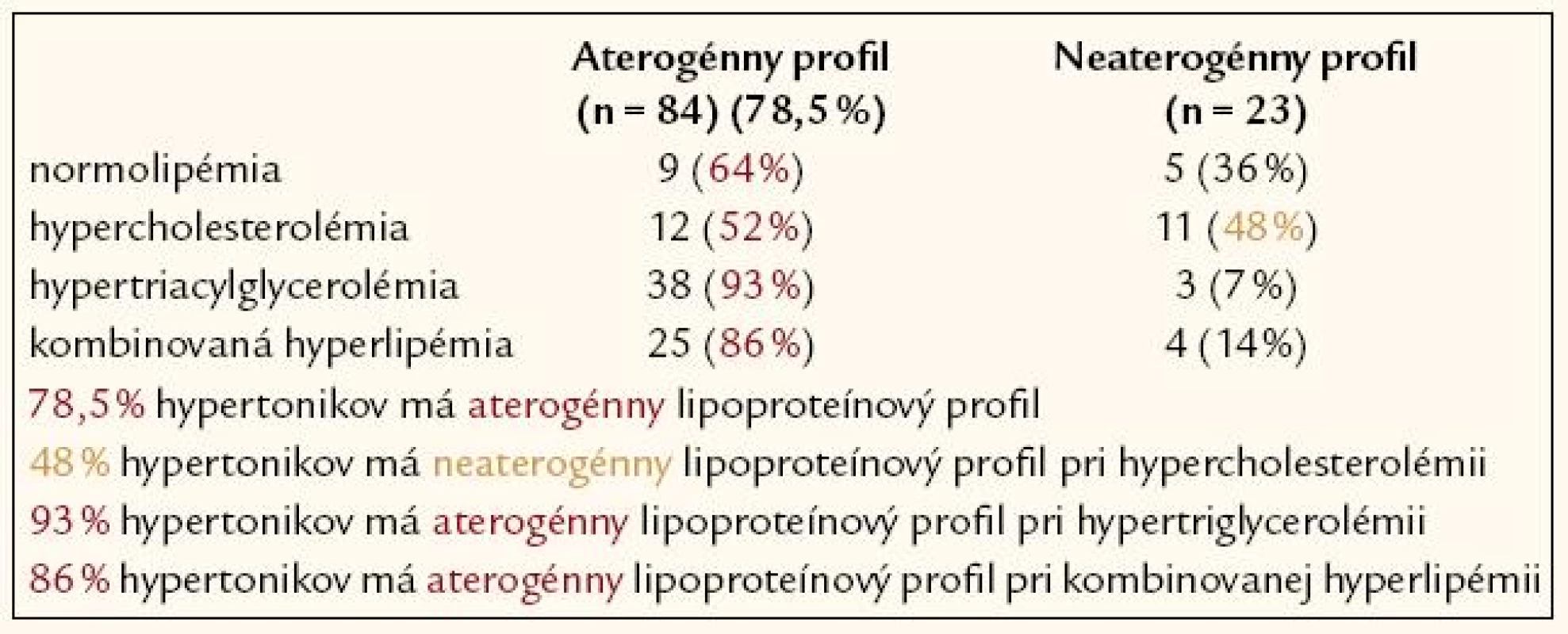
Aterogénna hypercholesterolémia sa potvrdila u 52 % testovaných hypertonikov s hypercholesterolémiou. Naopak, hypertonici so zistenou hypertriacylglycerolémiou alebo hypertonici s kombinovanou hyperlipémiou majú aterogénne lipoproteínové zastúpenie vo vysokom percente: 93% výskyt aterogénneho lipoproteínového spektra pri hypertriacylglycerolémii a 86% výskyt pri kombinovanej hyperlipémii (tab. 4 a 5).
Hypertonickí pacienti s normolipémiou majú vysoké, až 64% zastúpenie aterogénneho spektra lipoproteínov.
Diskusia
Lipoprint LDL systém Quantiemtrix, CA, USA kvantitatívne analyzuje koncentráciu aterogénnych lipoproteínov v plazme a určuje fenotyp lipoproteínového spektra: aterogénny alebo neaterogénny [8–10,13].
Určovanie aterogenity lipoproteínoveho profilu predstavuje novum v doterajšej interpretácii lipidových parametrov a posúva interpretácia hyperlipoproteinémie nad rámec doteraz zabehnutej schémy. Relativizuje sa výpovedná hodnota hyperlipémie aj normolipémie. Sme konfrontovaní s novou klinicko diagnostickou skutočnosťou. Je to fenomén „aterogénna normolipémia“. Takúto lipoproteínovú konšteláciu nachádzame aj v kontrolnej skupine zdravých a predstavuje temer 7 % probandov, ktorí tvoria kontrolnú skupinu. Jej výskyt v populácii nie je zanedbateľný a podľa literárnych údajov [8] až 24 % obyvateľstva má aterogénnu normolipémiu. Aterogénna normolipémia rozširuje rizikovú skupinu osôb ohrozenú vznikom akútnej kardiovaskulárnej alebo cerebrovaskulárnej príhody o ďalšiu početnú skupinu obyvateľstva. Doteraz ju tvorili prevažne pacienti s aterogénnou dyslipoproteinémiou. Rozdiel medzi osobami s aterogénnou normolipémiou a pacientmi s diagnostikovanou poruchou metabolizmu tukov vidíme v medicínskom prístupe k týmto dvom rizikovým skupinám obyvateľstva. Zatiaľ čo osoby, u ktorých sa potvrdila poruchu metabolizmu lipoproteínov, sú v medicínskom dispenzári a sú liečení, aterogénni normolipemici nie sú identifikovaní, a teda nie sú liečení. Možno sa domnievať, že sú – viac ako dispenzarizovaní pacienti s dyslipoproteinémiou – vystavení nebezpečiu vzniku náhlej akútnej koronárnej, alebo mozgovo cievnej príhody, často končiacej fatálne. Takže až akútna koronárna, alebo mozgovo cievna príhoda môže byť prvou manifestáciou a zároveň aj fatálnou komplikáciou cievneho ochorenia u týchto zdanlivo zdravých osôb.
Prekvapivé je zistenie, že len 52 % pacientov s hypercholesterolémiou má aterogénny lipoproteínový profil. Naopak u hypertonikov s čistou hypertriacylglycerolémiou, ale aj kombinovanou hyperlipémiou (čiže pri lipoproteínovej konštelácii, kde triacylglyceroly v krvi sú zvýšené) je aterogénne spektrum prítomné vo vysokom percente: 93 % pri čistej hypertriacylglycerolémii a 86 % pri kombinovanej hyperlipémii. Naše zistenia podporujú tie práce a literárne údaje o aterogénnej lipoproteínovej konštelácii, resp. aterogénnej triáde, ktoré upozorňujú na hyperetriacylglycerolémiu ako na dôležitý rizikový faktor vzniku kardiovaskulárneho ochorenia [4,11,15–19]. Predmetné zistenie by mohlo byť podnetom k prehodnoteniu úlohy hypercholesterolémie a predovšetkým hypertriacylglycerolémie v etiopatogenéze kardiovaskulárnych ochorení. Poukazuje na dôležitú rolu triacylglycerolov a hypertriacylglycerolémie v patofyziologickom prepojení so vznikom artériovej hypertenzie a fenoménu aterosklerózy ako takej.
Z uvedených faktov sa dá predpokladať úloha hypertriacylglycerolémie v etiopatogenéze artériovej hypertenzie, ktorá je porovnateľná s úlohou hypercholesterolémie a dokonca možno predikovať významnejšiu úlohu hypertriacylglycerolémie v etiopatogenéze artériovej hypertenzie, než sa jej pripisovala doposiaľ.
V lipoproteinovom spektre testovaných osôb štúdie, t.j. u pacientov s AH a aj u probandov kontrolnej skupiny zdravých, sa dajú identifikovať silne aterogénne mdLDL [4–6]. Tie určujú fenotyp lipoproteínového spektra podľa ich početného zastúpenia v lipoproteínovom profile: aterogénny alebo neaterogénny. Ako vidieť v tab. 4 a 5, malé denzné LDL sú určujúce pri deklarovaní aterogénneho lipoproteínového profilu nielen u osôb s AH, ktorí majú hyperlipoproteinémiu, ale aj pri normolipémii kontrolnej skupiny.
Sekrécia prostacyklínu (PgI2) a tromboxanu A2 (TxA2) endotelovou bunkou charakterizuje endotelovú funkciu. Poškodenie endotélia vedie k poklesu endotelovej sekrécie prostanoidov a k zníženiu pomeru PgI2/TxA2. V našom súbore osôb s artériovou hypertenziou sa potvrdil proporčný poklesu endotelovej tvorby oboch prostanoidov oproti kontrolnej skupine a upozorňuje na porušenú endotelovú funkciu u hypertonikov, i keď sekrečný pokles nebol výrazný a neviedol k zmene pomeru PGI2/TxA2. Takéto zistenie by sa dalo vysvetliť krátko trvajúcou alebo nezávažnou AH, ktorá ešte nedokázala navodiť výraznú poruchu endotelovej syntézy prostanoidov.
Skóre aterogénneho rizika (SAR) ako pomerná hodnota neaterogénnych a aterogénnych lipoproteínov v sére je novo zavedené skóre k vyjadreniu aterogénneho rizika testovanej osoby. Predstavuje kvantitatívny pomer neate-rogénnych lipoproteínov k aterogénnym lipoproteínom plazmy/séra. Namerané hodnoty skóre v štúdii s pacientmi s artériovou hyperzenziou dobrekorelujú s fenotypom lipoproteínového profilu testovaných osôb, ktorý generuje Lipoprint LDL systém.
Novo zavedené skóre naďalej vyžaduje ďalšie testovania v klinických štúdiách. Jeho predikcia aterogénneho lipo-proteínoveho profilu v doterajších klinických štúdiách je vysoká a možno sa nádejať dobrou klinicko diagnostickou upotrebiteľnosťou vypočítaného SAR u rizikových pacientov [20–23].
Záver
- Identifikácia početného zastúpenia aterogénnej hypertriacylglycerolémie (86–93 %) u novo diagnostikovaných hypertonikov a identifikácia aterogénnej normolipémie (7 %) je jednoznačným prínosom novej laboratórnej diagnostiky.
- Malé denzné LDL (mdLDL) sú rozhodujúce pre určenie aterogenity lipoproteínového spektra hyperlipoproteinémie, ale aj normolipémie.
doc. MU Dr. Stanislav Oravec, CSc.
www.fnspba.sk
e-mail: stanislavoravec@yahoo.com
Sources
1. Felmeden DC, Spencer CG, Blann AD et al. Low ‑ density lipoprotein subfractions and cardiovascular risk in hypertension: relationship to endothelial dysfunction and effects of treatment. Hypertension 2003; 41 : 528 – 533.
2. Whitworth JA. World Health Organisation (WHO), International Society of Hypertension Writing Group. 2003 World Health Organization (WHO)/ International Society of Hypertension (ISH) statement on management of hypertension. J Hypertension 2003; 21 : 1983 – 1992.
3. Horký K. Systémová arteriální hypertenze. In: Klenner P et al (eds). Vnitřní lékařství. Praha: Galén 1998 : 137 – 149.
4. Rubies ‑ Prat J, Ordónez ‑ Llanos J, Martin S et al. Low ‑ density lipoprotein particle size, triglyceride ‑ rich lipoproteins and glucose tolerance in non‑diabetic men with essential hypertension. Clin Exp Hypertens 2001; 23 : 489 – 500.
5. Landray MJ, Edmunds E, Li ‑ Saw ‑ Hee FL et al. Abnormal low ‑ density lipoprotein subfraction profile in patients with untreated hypertension. QJM 2002; 95 : 165 – 171.
6. Zhao CX, Cui YH, Fan Q et al. Small dense low ‑ density lipoproteins and associated risk factors in patients with stroke. Cerebrovasc Dis 2009; 27 : 99 – 104.
7. Austin MA. Triglyceride, small dense low ‑ density lipoprotein and the atherogenic lipoprotein phenotype. Curr Atheroscler Rep 2000; 2 : 200 – 207.
8. Van J, Pan J, Charles MA et al. Atherogenic lipid phenotype in a general group of subjects. Arch Pathol Lab Med 2007; 131 : 1679 – 1685.
9. Austin MA, Hokanson JE, Brunzell JD. Characterization of low ‑ density lipoprotein subclasses: methodologic approaches and clinical relevance. Curr Opin Lipidol 1994; 5 : 395 – 403.
10. Berneis KK, Krauss RM. Metabolic origins and clinical significance of LDL heterogeneity. J Lipid Res 2002; 43 : 1363 – 1379.
11. Packard CJ. Triacylglycerol ‑ rich lipoproteins and the generation of small dense low ‑ density lipoprotein. Biochem Soc Trans 2003; 31 : 1066 – 1069.
12. Shoji T, Hatsuda S, Tsuchikura S et al. Small dense low ‑ density lipoprotein cholesterol concentration and carotid atherosclerosis. Atherosclerosis 2009; 202 : 582 – 588.
13. Hoefner DM, Hodel SD, O’Brien JF et al. Development of a rapid quantitative method for LDL subfractionation with use of the Quantimetrix Lipoprint LDL system. Clin Chem 2001; 472 : 266 – 274.
14. Oravec S. Nová laboratórno ‑ medicínska pomoc v diagnostike dyslipoproteínemií a kardiovaskulárnych ochorení: Identifikácia LDL podskupín. Med Milit Slov 2006; 8 : 28 – 32.
15. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiol 1998; 81 : 7B – 12B.
16. Cullen P. Evidence that triglycerides are an independent coronary heart disease risk factor. Am J Cardiol 2000; 86 : 943 – 949.
17. Packard CJ. Triacylglycerol ‑ rich lipoproteins and the generation of small dense low ‑ density lipoprotein. Biochem Soc Trans 2003; 31 : 1066 – 1069.
18. Taskinen MR. Diabetic dyslipidaemia: from basic research to clinical practice. Diabetologia 2003; 46 : 733 – 749.
19. Haffner SM. The metabolic syndrome: inflammation, diabetes mellitus and cardiovascular disease. Am J Cardiol 2006; 97 : 3A – 11A.
20. Oravec S. Identifikácia subpopulácií LDL triedy – Aktuálny prínos v diagnostike porúch metabolizmu lipoproteínov a ochorení kardiovaskulárneho systému. Med Milit Slov 2006; 8 : 32 – 34.
21. Oravec S. Nové perspektívy v diagnostike porúch metabolizmu lipoproteínov – prínos v interpretácii výsledkov. Med Milit Slov 2007; 9 : 42 – 45.
22. Oravec S. Nové možnosti posúdenia kardiovaskulárneho rizika u pacientov s obezitou a metabolickými ochoreniami. Med Milit Slov 2007; 9 : 46 – 49.
23. Oravec S. Den drohenden Herztod erkennen – und vermeiden. Der Mediziner 2010; 4 : 6 – 7.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 9-
All articles in this issue
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Liečime správne pacientov s claudicatio intermittens?
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Metabolický syndróm a tuhosť aorty
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career