-
Medical journals
- Career
Rivaroxaban a inhibitory faktoru Xa v klinické praxi
Authors: M. Penka
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc.
Published in: Vnitř Lék 2010; 56(9): 920-926
Category: Reviews
Overview
Antitrombotická prevence a léčba představují jedno z nejrozšířenějších medicínských opatření v oblasti, která patří stále k nejčastějším příčinám mortality, ale i morbidity. V současnosti jsou k léčbě či prevenci tromboembolické nemoci používány hepariny, pentasacharidy a warfarin. Tyto léky mají ale řadu nežádoucích účinků a dalších nevýhod, které nutí hledat nové možnosti, jež by naplňovaly představy o „ideálním antitrombotickém léku“. K těm patří především selektivita účinku, absence nežádoucích projevů, možnost pohodlného podávání bez nutnosti laboratorní kontroly a nízká cena. Pozornost je z výše uvedených důvodů zaměřena především na možnost ovlivnění trombinu, ať již jako cíle přímých inhibitorů, nebo inhibitorů systému generace trombinu, tedy aktivovaného faktoru Xa plazmatického systému krevního srážení (F Xa). Dosavadní opatření spočívala v injekčním podávání léků, výše zmíněné úsilí se zaměřuje na možnosti perorální léčby.
Klíčová slova:
koagulace – trombóza – antitrombotikum – inhibitor Xa – rivaroxabanÚvod
Systém krevního srážení vykazuje za normálních okolností rovnovážný stav, který udržuje krev v uzavřeném cévním systému v tekutém stavu. K narušení této rovnováhy dochází na lokální úrovni v důsledku porušení celistvosti cévní výstelky nebo ze systémových důvodů aktivace krevního srážení v důsledku působení trombofilních dispozic. Lokální důvody nutnosti reparace cévní výstelky nebo zástavy krvácení po poranění cévy lze pokládat za fyziologické pochody, kdežto systémová nadměrná aktivace krevního srážení s případnou tvorbou sraženin je již vpravdě patologickým procesem.
V případech nadměrného srážení krve lze jako prvořadá uplatňovat antitrombotická opatření. Zmíněná opatření se liší podle toho, zda se jedná o postižení tepenného nebo žilního systému, zda se jedná o postižení jedné lokality, nebo proces systémový. Z „klasických“, dlouhodobě užívaných antitrombotik jsou známy – kyselina acetylsalicylová k prevenci a léčbě tepenné trombózy a heparin a kumarinové preparáty (warfarin) k řešení především žilních afekcí. Zmíněné způsoby antitrombotických intervencí se někdy v rozličných modifikacích kombinují.
V souvislosti s podáváním antitrombotických léků se mohou vyskytovat potíže pramenící z nežádoucích projevů, nedostatečné či kolísající úrovně léčby, těžkostí spojených s nezbytným laboratorním sledováním a následnou úpravou dávky nebo problematické organizace péče či nespoluprací nemocného.
Z tohoto důvodu se hledají stále nové léky, u nichž by byly odstraněny těžkosti spojené s jejich podáváním a které by splňovaly ideál požadavků na takovou léčbu kladených. Tab. 1 uvádí požadavky na ideální antitrombotikum.
Table 1. Požadavky na ideální antitrombotickou léčbu. 
Současné poznatky o krevním srážení poskytují představu o místě nejvýhodnějšího zaměření léčby a ukazuje se, že se jedná buď o iniciální kroky aktivace koagulace, kde hraje nejvýznamnější roli tkáňový faktor (TF), dále pak fázi generaci trombinu protrombinovým komplexem, resp. aktivovaným faktorem X (F Xa), a konečně a samozřejmě i účinek trombinu na přeměnu fibrinogenu ve fibrin (obr. 1). Možnost ovlivnění zmíněných „uzlových“ míst se liší a dnes existují medikamenty s nepřímým či přímým účinkem na tom kterém místě. Lze vcelku jednoduše říci, že čím je účinek léku komplikovanější, tím častější jsou pochopitelně také vícečetné problémy při jeho použití. Proto se dnes hledají především léky s přímým účinkem a v tomto směru se pozornost zaměřuje zejména na přímé inhibitory trombinu a přímé inhibitory F Xa.
Image 1. Hemokoagulační procesy. 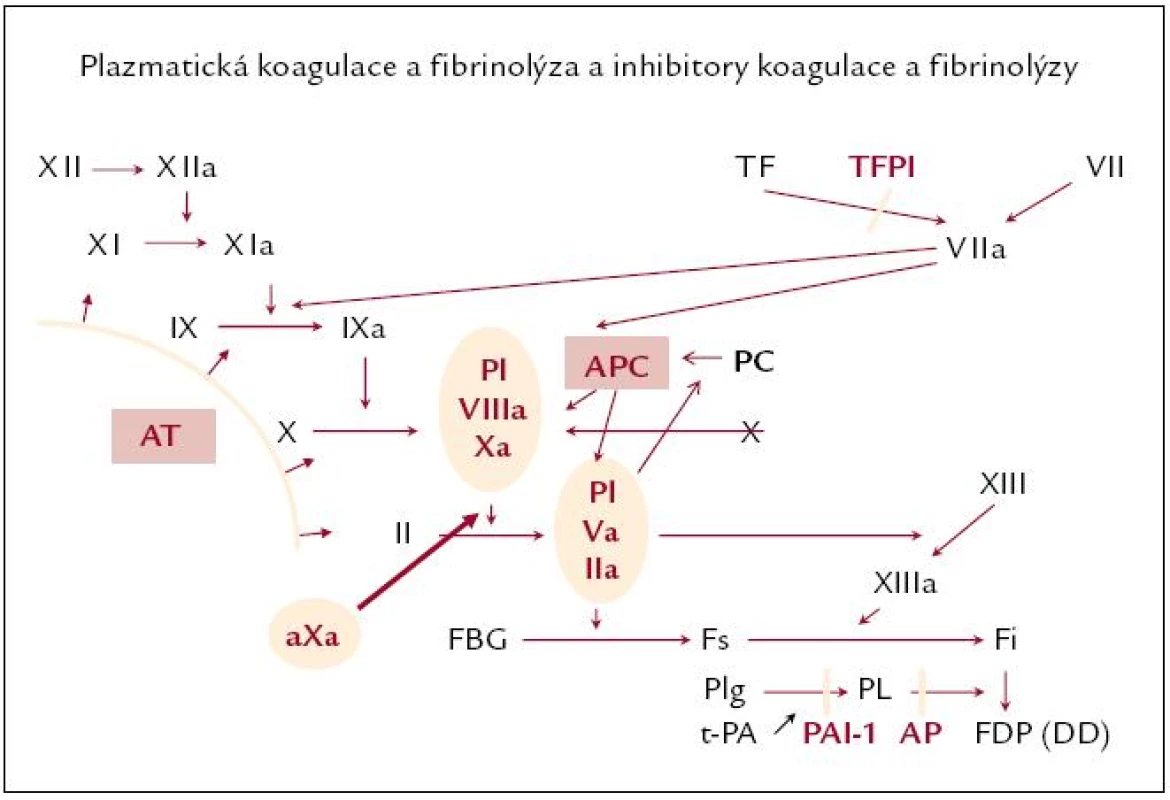
XII – faktor XII, TF – tkáňový faktor, TFPI – inhibitor tkáňového faktoru, AT – antitrombin, Xa – aktivovaný faktor X, PC – protein C, APC – aktivovaný protein C, aXa – anti‑Xa aktivita, FBG – fibrinogen, Fs – solubilní fibrin, Fi – insolubilní fibrin, TAFI – trombinem aktivovatelná inhibice fibrinolýzy, Plg – plazminogen, Pl – plazmin, PAI-1 – plazminogen aktivátor inhibitor 1, t- PA – tkáňový aktivátor plazminogenu, DD – D‑dimery, FDP – fibrinogen- fibrinové degradační produkty Nejvýznamnější látkou s antitrombotickým účinkem je dosud heparin, jehož účinek byl identifikován na počátku minulého století (McLean, Howell) a od té doby se pracuje stále na zdokonalení jeho struktury, neboť v jeho původní podobě nefrakcionované látky získané ze zvířecích tkání se jedná o směs s nestandardní strukturou. Po zjištění, že funkčně významnou strukturou heparinu je sekvence pentasacharidů, bylo přirozenou snahou získání jejich koncentrátu. Tomu předcházela frakcionace a izolace fragmentů heparinů a získání tzv. nízkomolekulárních preparátů (low molecular weight heparin – LMWH), jejichž molekulová hmotnost nepřesahovala 6 000 Daltonů. Jejich účinek byl dominantně zaměřen na inhibici faktoru Xa, jež významně překračovala anti IIa inhibici, tedy ten účinek, který je častěji komplikován krvácením a který snižuje koagulační potenciál, neboť brání přeměně fibrinogenu ve fibrin. Navíc všechny účinky heparinu jsou nepřímé, zprostředkovány antitrombinem.
Jsou hledány nové možnosti: na úrovni TF se jedná o tifacogin, NAPc2 a F VIIai, ve fázi rozbíhající se koagulace protein C (v aktivní či neaktivní podobě), pentasacharidy či přímé inhibitory F Xa – razaxaban, rivaroxaban a další, a na finální úrovni přeměny fibrinogenu ve fibrin, resp. přímé inhibitory trombinu – dabigatran [1].
Inhibitory faktoru Xa
Nepřímé inhibitory F Xa jsou syntetická analoga pentasacharidové sekvence vázající antitrombin, která jsou součástí heparinu včetně nízkomolekulárních preparátů. Jsou chemicky modifikována tak, aby došlo k navýšení afinity k antitrombinu (AT). Řetězec molekuly je však příliš krátký na to, aby došlo i k vazbě trombinu, proto je inhibice specifická pouze pro F Xa. Tím se vlastnosti těchto léků stávají odlišnými od nízkomolekulárních heparinů [1]. Po vazbě nepřímých inhibitorů na antitrombin dochází v jeho molekule ke konformační změně, která vede k asi 300násobnému zvýšení jeho afinity k F Xa [4]. Vytváří se ireverzibilní komplex AT/F Xa. Poté se však z komplexu uvolňuje pentasacharid, který může opět vázat další molekulu antitrombinu [2,4].
Mezi antitrombotika, jimiž je blokována funkce F Xa, je nutno zařadit i faktor X s inhibovaným aktivním místem (F Xai), který již byl také vyzkoušen na zvířecích modelech [5].
Přímé inhibitory F Xa se vážou stechiometricky 1 : 1 a blokují interakci F Xa s jeho substráty. Současně dostupné přímé inhibitory vážou nejen volný F Xa, ale i F Xa vázaný na destičkách či fosfolipidových površích v protrombinázovém komplexu [2,3], což může představovat léčebnou výhodu ve srovnání s heparinem, nízkomolekulárními hepariny i nepřímými inhibitory F Xa. Při působení těchto látek vzniká dostatečné množství trombinu k aktivaci trombocytů, a tím je udržena i tvorba primární hemostatické zátky. Předpokládá se tedy i menší krvácivá tendence nežli u konvenčních antikoagulancií či přímých inhibitorů trombinu [1].
Do této skupiny je zařazena řada látek, ať již přirozených, rekombinantních, nebo syntetických [6].
Přirozené přímé inhibitory faktoru Xa
Tick Anticoagulant Protein (TAP) je polypeptid s 60 aminokyselinami izolovaný z Ornithodos moubata. Na zvířecích pokusech byla zjišťována antitrombotická účinnost srovnatelná s heparinem.
Antistasin – protein obsahující 119 aminokyselinových zbytků, izolovaný ze slinných žláz pijavice Haementeria officinalis. Po parenterální aplikaci na zvířecích modelech byla zjišťována sice antitrombotická účinnost, ale vývoj léku byl zastaven pro vysokou imunogenicitu.
Lefaxin je izolován ze slin pijavice Haemeneteria depressa.
Threostasin je polypeptid z 82 aminokyselin – zatím nejúčinnější inhibitor Xa izolovaný z pijavic. Vzhledem k tomu, že jde o cizorodé proteiny, předpokládá se i u nich významná imunogenicita.
Řada látek s účinkem přímých inhibitorů F Xa prokázala svou účinnost na zvířecích modelech: ZK-807834 byl použit na léčbu arteriální i žilní trombózy u králíků [25], FXV673 při arteficiálním arteriálním postižení u psů [26], RPR120844 v prevenci žilní trombózy u králíků [27]. U diseminované intravaskulární koagulace na krysích modelech byl účinný preparát JTV-803 [28]. Na krysích modelech byl testován zPD-198961 [29], jakož i další preparát SS457, který byl testován z pohledu účinnosti rekombinantního F VIIa v zástavě krvácení po léčbě právě tímto preparátem [30].
Syntetické přímé inhibitory faktoru Xa
DX-9065a je nepeptidový argininový derivát o malé molekule synteticky připravený. V intravenózním podání byl testován u pacientů s akutním koronárním syndromem, při perkutánní koronární intervenci (XaNADU-ACS). Perorální preparát byl zkoušen pro profylaxi při ortopedických operacích kolene [7].
Razaxaban (DPC906) je použit ve fázi II klinického testování pro profylaxi trombózy při náhradě kolenního kloubu v perorálním podání. Podobně další perorální preparát LY517717 je podáván v II. fázi při elektivních kyčelního a kolenního kloubu. V ještě pokročilejší fázi testování jsou apixaban, betrixaban, edoxaban,DU-176b.
Rivaroxaban – BAY 59-7939 (Xarelto®) je syntetická látka, která se přímo váže (oxazolidinovou strukturou na chlorothiofenovou a morfolinovou doménu) na faktor Xa a způsobuje jeho inhibici. Afinita rivaroxabanu k faktoru Xa je asi 1 000krát vyšší než k jiným serinovým proteázám; inhibiční koncentrace IC50 koresponduje s 21 nM. Rivaroxaban reaguje nejen s volným, ale i s vázaným faktorem Xa, přitom neinhibuje přímo trombin a neovlivňuje ani krevní destičky. Po perorálním podání se rychle vstřebává, k maximu účinku dochází za 1–4 hod a účinek trvá asi 9–12 hod. Biologická dostupnost činí u dávky 10mg 80–100%. Velikost plochy pod křivkou je závislá na dávce, k ustálení koncentrace dochází 7. den, přičemž nedochází ke kumulaci léku.
Asi 2/3 léku jsou metabolizovány na neaktivní metabolity prostřednictvím systémů CYP3A4 a CYP2J2, ale i mechanizmy na cytochromech nezávislými. Metabolity rivaroxabanu v plazmě neprokazujeme. 1/3 aktivní látky se vyloučí nezměněná ledvinami, další asi 1/3 taktéž ledvinami, ale ve formě neaktivních metabolitů a asi 1/3 látky se vyloučí stolicí. Jeho biologický poločas činí u ortopedických pacientů asi 7–11 hod. Variabilita farmakokinetiky je střední s kolísáním mezi 30 a 40%. Zvyšuje se v den operace. Rivaroxaban slouží také jako substrát pro P-gp a BCRP [8].
Co se týče farmakodynamiky – je pozorováno dávce odpovídající prodloužení protrombinového času, závislé na použití testovací soupravy. Dochází také k prodloužení APTT, rovněž závislému na dávce. Přes uvedené není doporučeno sledování účinku léku laboratorní kontrolou za účelem úpravy jeho dávky, a to ani přesto, že je možné stanovit přímo i anti Xa aktivitu [7].
Současnou indikací rivaroxabanu je prevence žilního tromboembolizmu u nemocných po totálních náhradách kyčle nebo kolene (viz níže), kdy se podává pooperačně v paušální dávce 10mg p.o. (viz níže). Účinek léku před však pokládá využití i v jiných indikacích tromboembolické nemoci (viz níže).
Kontraindikací podání rivaroxabanu je krvácení, závažnější nedostatečnost jater či ledvin, těhotenství a kojení a přecitlivělost na některou z pomocných látek (laktóza) přípravku. U nemocných s onemocněním ledvin s poklesem glomerulární filtrace pod 15ml/min se nedoporučuje lék podávat a opatrnosti je třeba u nemocných s clearance pod 30ml/min a při méně závažné poruše u osob užívajících léky snižující krevní srážení. U jaterních chorob (především cirhózy jater) je třeba opatrnosti u nemocných s jaterní nedostatečností dosahující 8 bodů stupnice dle Child Plugha, tedy stupně B. Ve spojitosti s podáváním jiných induktorů CYP3A4 (karbamazepin, fenytoin, rifampicin, fenobarbital) může docházet ke snižování účinnosti rivaroxabanu. Nedoporučuje se rovněž podávání rivaroxabanu spolu s většinou azolových antimykotik (ketokonazol, itrakonazol, varikonazol, posakonazol) nebo inhibitory proteáz HIV. V kombinaci s enoxaparinem dochází sice k prodloužení krvácivosti, avšak rozdíl není hodnocen jako klinicky relevantní. Současné podání rivaroxabanu s enoxaparinem je s opatrností možné [9].
Těhotným a kojícím matkám rivaroxaban nepodáváme, protože v tomto směru chybí zkušenosti. Navíc rivaroxaban prochází placentou a do mateřského mléka a může vést ke krvácení [10].
Ve fázi I klinického zkoušení projevoval rivaroxaban velmi dobrou toleranci a nezávislost na věku, pohlaví a tělesné hmotnosti.
Rivaroxaban prošel dvěma studiemi klinického zkoušení fáze II v rámci antitrombotické prevence v ortopedii, kde byl srovnáván jeho účinek s účinkem enoxaparinu. Jedna studie zahrnující 722 nemocných se týkala zajištění antitrombotické prevence u nemocných po totální náhradě kyčelního kloubu a druhá s celkovým počtem 621 nemocných po totální náhradě kolenního kloubu. Obě studie byly randomizované, dvojitě slepé, v obou byl podáván rivaroxaban ve dvojí denní dávce a srovnáván s efektem enoxaparinu v dávce 40mg předoperačně podaného u nemocných s totální náhradou kyčle anebo 2krát 30mg u nemocných po totální náhradě kolene. Výsledek byl kontrolován bilaterální venografií a bylo zjištěno, že výskyt hluboké žilní trombózy nebo plicní embolie či celková mortalita se pohybovaly mezi 16,1 a 24,4% u nemocných léčených rivaroxabanem proti 27,8% léčených enoxaparinem. Statisticky významný byl výskyt krvácivých projevů v závislosti na dávce – od 5 do 60mg. Nejlepší efektivitu a bezpečnost měla dávka rivaroxabanu v rozmezí 5–20mg.
Další studie II. fáze byly provedeny po elektivní náhradě kyčelního kloubu (ODIXa KNEE) a při léčbě akutní žilní trombózy (ODIXa DVT) [12].
Účinnost a bezpečnost léku v profylaxi trombózy u ortopedických pacientů byla hodnocena ve studiích fáze III s názvem RECORD 1–4 (REgulations of Coagulation in major Ortopedic surgery reducing the Risk of DVT and PE [13–16]. Rivaroxaban v dávce 10mg 1krát denně byl srovnáván s enoxaparinem v dávce 40mg, resp. 2krát 30mg po TEP kolenního kloubu v celkovém podání 35 dní, resp. 12 dní (tab. 2). Primárním cílem studie bylo zjistit rozdíl v četnosti výskytu epizod žilního tromboembolizmu potvrzeného zobrazovacími metodami a mortalita v jednotlivých skupinách.
Table 2. Výsledky studií RECORD 1–4. 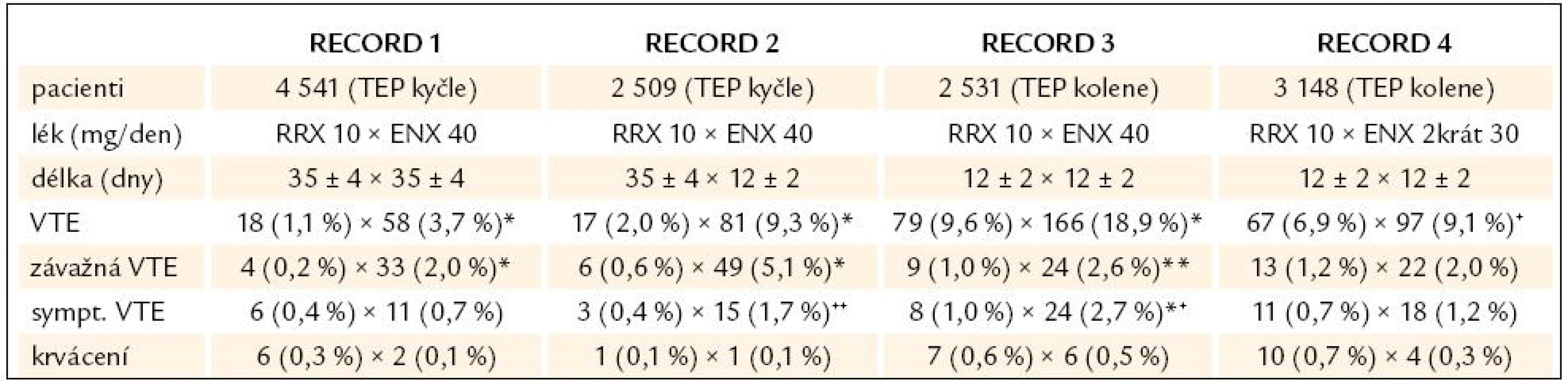
*p < 0,001, **p = 0,01, +p = 0,012, ++p = 0,004, *+p = 0,005 Rivaroxaban u pacientů po elektivní endoprotéze kyčle nebo kolene statisticky i klinicky významně snížil riziko tromboembolických komplikací ve srovnání s enoxaparinem a je vysoce účinný v prodloužené profylaxi po endoprotéze kyčle a kolenního kloubu.
Riziko krvácivých komplikací je nízké, srovnatelné s enoxaparinem.
Byla potvrzena účinnost a bezpečnost použitého dávkovacího schématu rivaroxabanu: pooperační podání, 1 tableta 1krát denně.
Celkový počet závažných nežádoucích účinků byl zaznamenán u 10,03% pacientů léčených enoxaparinem a u 8,26% pacientů léčených rivaroxabanem. Nejčastějším nežádoucím účinkem v obou skupinách byla anémie, zvýšení jaterních transamináz včetně GGT a u rivaroxabanu nevolnost.
V případě předávkování léku a výskytu krvácivých projevů není k dispozici specifické antidotum a je třeba provádět symptomatická opatření a nespecifickou hemostyptickou léčbu, u závažného, resp. život ohrožujícího krvácení se při neúspěchu výše uvedených opatření podává rF VII [17], případně preparát FEIBA [18]. Vzhledem k vysoké vazbě rivaroxabanu (92–95%) na plazmatické bílkoviny (především albumin) nelze očekávat úspěšné odstranění léku dialýzou.
V souvislosti s tromboembolickou nemocí byl rivaroxaban testován ve studiích EINSTEIN DVT a EINSTEIN PE [19], kde byl opět srovnáván účinek rivaroxabanu s enoxaparinem. Rivaroxaban byl podáván v dávce 2krát 15mg 21 dní, posléze 20mg 1krát denně po dobu 3, 6 či 12 měsíců, enoxaparin 2krát denně po 5 dní s následnou warfarinizací s nastavením INR do terapeutického rozmezí 2,9–3,0 po stejně dlouhou dobu s rixaroxabanem. Pokračováním byla studie EINSTEIN EXTENSION [20], kdy se po termínu ukončení antitrombotické léčby podával části nemocných rivaroxaban dále, zatímco jiným (srovnávaná skupina) ne. Výsledky této studie byly prezentovány H. Bullerem na poslední konferenci Americké hematologické společnosti v prosinci minulého roku a vyzněly ve prospěch rivaroxabanu velmi příznivě.
Studie ROCKET AF (Rivaroxaban Once Daily Oral Direct factor Xa Inhibition Compared with Vitamin K antagonists for Prevention of Stroke and Embolism Trial in Atrial Fibrilation) je zaměřena na testování účinnosti rivaroxabanu u nemocných s fibrilací síní (dávka 20mg srovnávána s léčebnou dávkou warfarinu s INR 2,5) [21], zatímco studie ATLAS ACS TIMI 46 (The Anti Xa Therapy to Lower Cardiovascular Events in Addition to Aspirin With or Without Thienopyridine Threapy in Subjects with Acute Coronary Syndrome) [22] je zaměřena na určení tolerance dávky rivaroxabanu (podávaného spolu s antiagregační léčbou kyselinou acetylsalicylovou) u nemocných s koronárním syndromem, při srovnání s duální terapií kyselinou acetylsalicylovou v kombinaci s thienopyridiny.
Klinické hodnocení rivaroxabanu lze shrnout do výsledků následujících studií fáze III [21] (tab. 3).
Table 3. Klinické hodnocení rivaroxabanu. 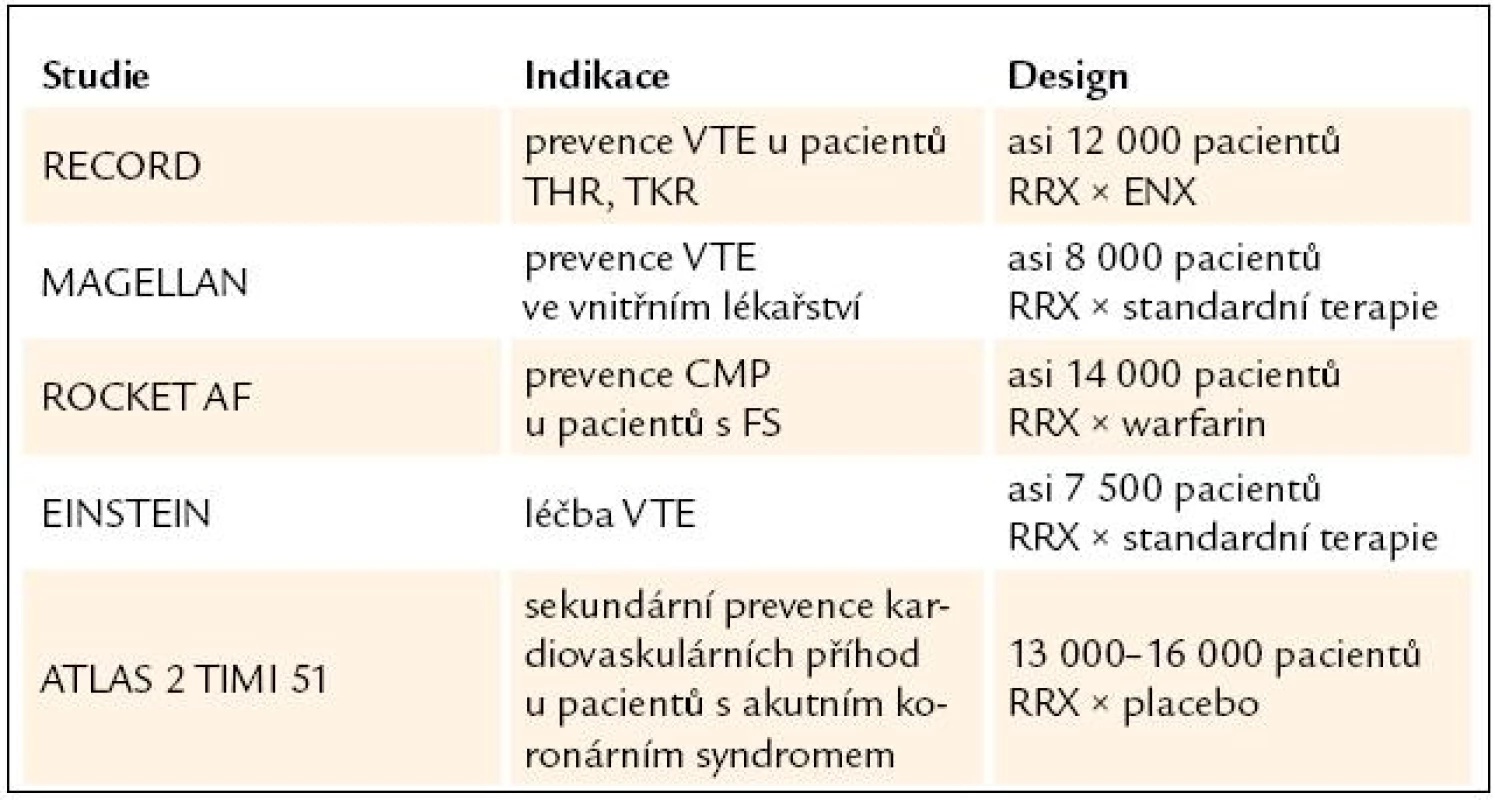
Není bez zajímavosti, že se takřka současně objevují dva antitrombotické léky – rivaroxaban (Xarelto) a dabigatran (Pradaxa), léky, na které odborná veřejnost netrpělivě čekala a které spojuje vedle základního požadavku protisrážlivého účinku hned několik aspektů: perorální podání a absence nutnosti sledování účinku léku laboratorní kontrolou za účelem úpravy jeho dávkování. Doporučena je u obou léků paušální dávka. Zásadním rozdílem mezi oběma léky je odlišnost místa dominantního účinku každého z obou preparátů v procesu krevního srážení. Výše zmíněné vyvolává v každém případě logický požadavek vzájemného srovnání (tab. 4) [23].
Table 4. Srovnání rovarixabanu (Xarelto®) a dabigatranu (Pradaxa®). 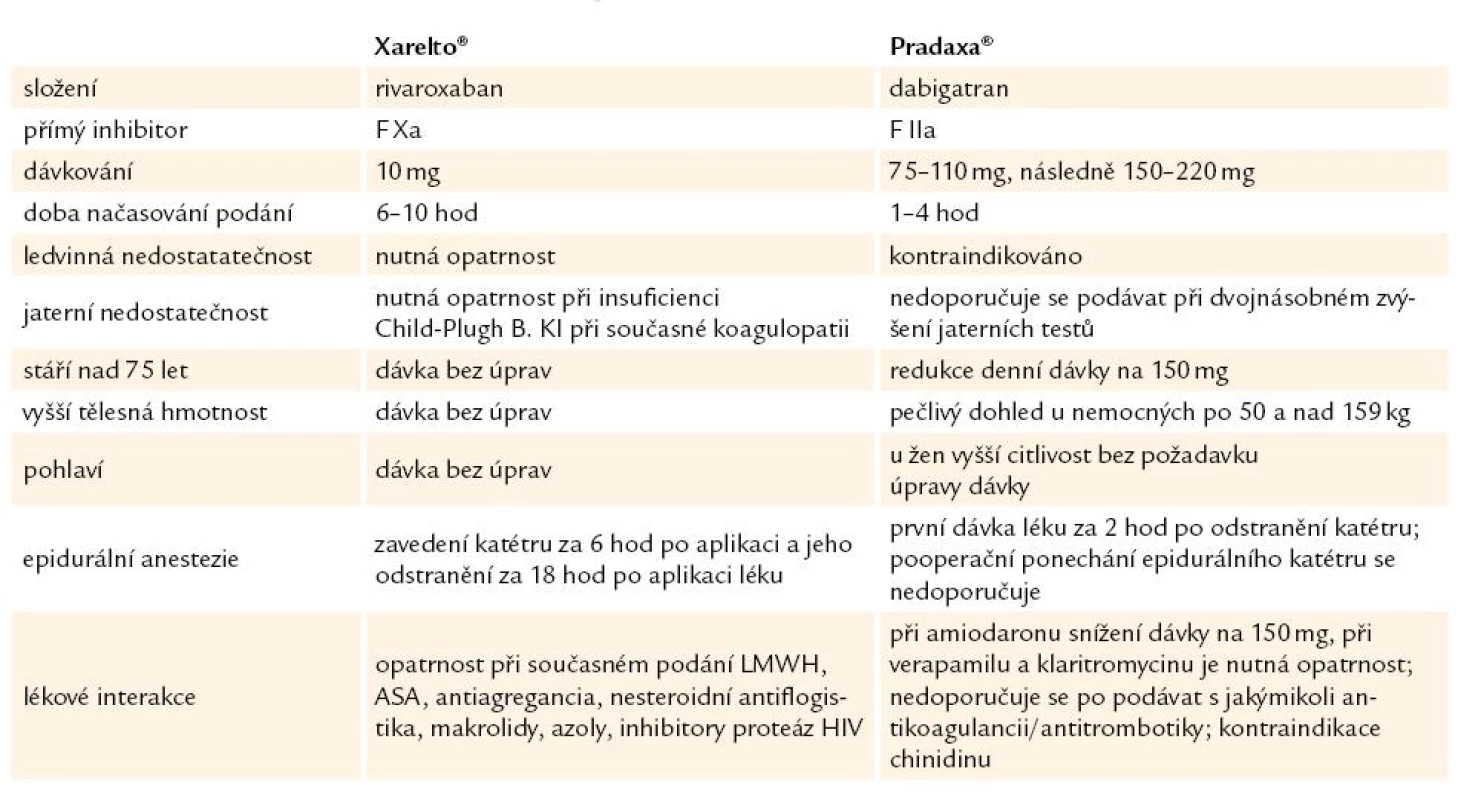
Přirozeně se nabízí také otázka, zda je možné vymezit specifické indikace pro ten či onen preparát, zda lze či zda je třeba, upřednostnit v odlišných indikacích inhibitor faktoru Xa nebo inhibitor trombinu.
Z obecných teoretických principů lze dovozovat, že anti Xa účinek brání apozici trombu a mohl by být využit tehdy, je li trombus již přítomen a má li se docílit jeho odbourávání zamezením jeho zvětšování při současné stimulaci fibrinolýzy. Naopak inhibitory trombinu by se mohly hodit spíše k primární prevenci, kdy se snažíme za každou cenu zabránit tvorbě trombu, a to i za cenu zvýšeného rizika krvácení. V prvé řadě se však opíráme přitom především o tíhu doporučení existujících studií, které jsou u obou preparátů koncipovány obdobným způsobem.
Nepřímé inhibitory faktoru Xa
Danaparoid. Jde o směs glykosaminoglykanů (heparan sulfát 84%, dermatan sulfát 12%) s predominantním anti Xa působením. Poměr aktivity anti Xa/F IIa je u této látky 22 : 1 v porovnání s hodnotou 1 : 1 u nefrakcionoveného heparinu či 3–4 : 1 u nízkomolekulárních heparinů [5]. Nejčastěji je užíván u heparinem indukované trombocytopenie.
Dávkování preparátu je upravováno dle tělesné hmotnosti nemocného. Při renální insuficienci je nutná redukce dávek. Většina pacientů nemusí být k úpravě léčby monitorována, pokud by však byla kontrola nutná, musí být metodika stanovení anti Xa aktivity nastavena přímo na danaparoid.
Fondaparinux (Arixtra). Jde o jediný preparát skupiny, který byl schválen k běžnému použití US FDA (US Food and Drug Administration) a EMEA (Eupropean Medicine Evaluation Agency) [31].
Fondaparin je sulfátovaný pentasacharid, který nepřímo inhibuje faktor Xa. Tvoří přitom přechodné nekovalentní vazby s antitrombinem a katalyzuje jeho konformační změnu, která vede k expozici argininového rezidua. S jeho pomocí pak dochází k vazbě na faktor Xa. Tím se zvyšuje vazba asi 300krát. Fondaparin vede také k inhibici faktorů VIIa a IXa, ale tato inaktivace je asi 25násobně slabší nežli inhibice F Xa a antikoagulační vlastnosti preparátu významněji neovlivňuje [32]. I když fondaparinux může vést ke vzniku anti PF4/heparin protilátek, k vazbě na destičkový faktor 4 (PFA4) takřka nedochází, a proto riziko heparinem indukované trombocytopenie není téměř žádné [33,34]. Po subkutánní aplikaci dosahuje lék maximální koncentrace za 1,7 hod a má poločas 17 hod, což umožňuje aplikaci preparátu jednou denně. Je vylučován ledvinami a může se kumulovat při renální insuficienci. Při snížení kreatininové clearence pod 30ml/min je jeho podání kontraindikováno.
Pro profylaxi žilního tromboembolizmu byl fondaparin podáván v dávkování 2,5mg subkutánně jednou denně, k léčbě se užívá dávkovací schéma závislé na tělesné hmotnosti – pro pacienty o hmotnosti 50–100kg dávka 7,5mg s.c. denně, pro nemocné < 50kgdávka 5mg, pro ty s hmotností> 100kg dávka 10mg. Dávky byly testovány v II. fázi klinického zkoušení ve studii Rembrandt.
Preparát je schválen pro léčbu akutní hluboké žilní trombózy, plicní embolie, pro antitrombotickou prevenci u ortopedických výkonů. V Evropě je navíc schválena profylaxe trombózy u rizikových interních pacientů, u akutních koronárních syndromů [1,34] a k profylaxi trombózy ve všeobecné chirurgii [32].
Vzhledem k tomu, že u fondaparinunení zjišťována heparinem indukovaná trombocytopenie, je třeba dle výsledků in vitro studií i klinicky potvrdit možnost jeho využití u nemocných s HIT [35].
U většiny nemocných kontrola léčby fondaparinuxem není nutná. Fondaparinux má minimální efekt na aktivovaný srážecí čas (ACT) a aktivovaný parciální tromboplastinový čas (aPTT) a neovlivňuje protrombinový test [36]. Je li laboratorní monitorování prováděno, musí být stanovení anti Xa kalibrováno přímo na daný preparát.
V proběhlých klinických studiích jsou krvácivé komplikace při podávání fondaparinu srovnatelné s jinými antitrombotiky podávanými v téže indikaci (nefrakcionovaný heparin, nízkomolekulární hepariny). Je však nutno zdůraznit, že do studií byli zařazováni nemocní s nízkým rizikem krvácení. Riziko krvácení se zdá být vyšší u nemocných s renální insuficiencí, u pacientů pod 50kg tělesné hmotnosti a při zahájení léčby v prvních 6 hod po operačním výkonu [1]. Tak jako i u jiných novějších antitrombotik, i v tomto případě je problém chybění specifického antidota. V případě závažného krvácení lze použít aktivovaný faktor VII [37].
Idraparinux. Jde o modifikovaný hypermetylovaný derivát fondaparinuxu (viz níže), který váže antitrombin s tak velkou afinitou, že se poločas léku vyrovná poločasu antitrombinu (80–130 hod). Tento dlouhý poločas umožňuje dávkování jednou týdně v subkutánní aplikaci [1,7].
Idraparinux byl ve studiích původně testován jako takový, později jeho biotinylovaná forma, která má oproti původní formě výhodu v možnosti okamžité reverzibility efektu avidinem.
Ve III. fázi klinického zkoušení byl idraparin použit pro léčbu žilního tromboembolizmu (Van Gogh DVT, Van Gogh PE). V léčbě žilní trombózy byla prokázána ekvivalence idraparinuxu se standardním režimem (LMWH + warfarin), při léčbě plicní embolie byl však idraparinux významně méně účinný. Nedostatky této studie, zejména nízké dávkování v počátku léčby u plicní embolie, měly být testovány s novou biotinylovanou formou ve studii CASSIOPEA. Idraparinux v dlouhodobé prevenci cévní mozkové příhody při fibrilaci síní byl testován ve studii AMADEUS. V této studii byl idraparinux o něco méně účinný než standardní režim, navíc vyvolával četnější krvácení. Studie AMADEUS byla proto předčasně ukončena. Nedostatky této studie měla napravit studie BORREALIS AF s novou biotinylovanou formou idraparinuxu. Preparát by mohl být léčebnou alternativou pro nemocné, u nichž je léčba perorálními antikoagulanciemi problematická [1,38].
Závěr
Nová antitrombotika, která blokují funkci faktoru Xa, mají ve srovnání s klasickými antitrombotiky typu heparinu, nízkomolekulárních heparinů a warfarinu některé výhody. Patří mezi ně malé ovlivnění funkce trombocytů, chybění farmakologických interakcí s kyselinou acetylsalicylovou, nesteroidními antirevmatiky, s warfarinem, chybění vazby na jiné proteiny, možnost aplikace jednou denně. Některé preparáty (rivaroxaban) jsou schváleny pro perorální aplikaci. První indikací je prevence tromboembolických komplikací v ortopedii, kde se rivaroxaban ukázal jako účinnější a stejně bezpečný jako enoxaparin.
Jaký budou mít tyto preparáty přínos v léčbě či profylaxi žilní či arteriální trombózy, ukáže až širší zavedení do klinické praxe.
prof. MU Dr. Miroslav Penka, CSc.
www.fnbrno.cz
e-mail: m.penka@fnbrno.cz
Sources
1. Geerts W. Factor Xa inhibitors. Hematology 2004, American Society of Hematology Education Program Book: 428 – 431.
2. Hirsh J, O’Donnell M, Weitz JI. New anticoagulants. Blood 2005; 105 : 453 – 463.
3. Weitz JI, Hirsh J. New antithrombotic drugs. In: Colman RW, Hirsh J, Marder VJ et al (eds). Hemostasis and thrombosis. Philadelphia: Lippincott Williams & Wilkins 2001 : 1529 – 1544.
4. Turpie AG. Pentasaccharides. Semin Hematol 2002; 39 : 158 – 171.
5. Moll S, Roberts HR. Overview of anticoagulant drugs for the future. Semin Hematol 2002; 39 : 145 – 157.
6. Bultas J, Karetová D. Nové trendy farmakoterapie kardiovaskulárních chorob. Vnitř Lék 2004; 50 (Suppl 1): S37 – S58.
7. Weitz JI, Hirsch J, Samama MM. New anticoagulant drugs: the seventh ACCP conference on antithrombotic and thrombolytic therapy. Chest 2004; 126 (Suppl 3): 265S – 286S.
8. Turpie AG. Oral, direct factor Xa inhibitors in development for the prevention and treatment of thrombembolic diseases. Arterioscler Thromb Vasc Biol 2007; 27 : 1238 – 1247.
9. Kubitza D, Haas S. Novel factor Xa inhibitors for prevention and treatment of thrombembolic diseases. Expert Opin Investig Drugs 2006; 15 : 843 – 855.
10. Piccini JP, Patel MR, Mahaffey KW et al. Rivaroxaban, an oral direct factor Xa inhibitor. Expert Opin Investig Drugs 2008; 17 : 925 – 937.
11. Turpie AG, Fischer WD, Bauer KA et al. ODIXa ‑ Knee Study Group. BAY 59 - 7939: An oral, direct factor Xa inhibitor for the prevention of venous thrombembolism in patients after total knee replacement. A phase I dose‑ranging study. J Tromb Haemost 2005; 3 : 2479 – 2486.
12. Agnelli G, Gallus A, Goldhaber S et al. Treatment of acute, symptomatic, proximal deep vein thrombosis with the oral, direct factor Xa inhibitor rivaroxaban (BAY 59 - 7939) – The ODIXa ‑ DVT dose‑ranging study. World Congress Cardiology 2006. Abstract P4569.
13. Eriksson BI, Borris LC, Friedman RJ et al. RECORD1 Study Group. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358 : 2765 – 2775.
14. Kakkar AK, Brenner B, Dahl OE et al. RECORD2 Investigators. Extended duration rivaroxaban versus short‑term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double‑blind, randomised controlled trial. Lancet 2008; 372 : 31 – 39.
15. Lassen MR, Ageno W, Borris LC et al. RECORD3 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358 : 2776 – 2736.
16. Turpie AG, Bauer KA, Berkowitz SD et al. RECORD4 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial. Lancet 2009; 373 : 1673 – 1680.
17. Tinel H, Huetter J, Perzborn E. Recombinant factor VIIa partially reverses the anticoagulant effect of high‑dose rivaroxaban – a novel, oral Factor Xa inhibitor – in rats. J Thromb Haemost 2007; 5 (Suppl 2): Abstract P ‑ W ‑ 652.
18. Perzborn E, Tinel H. FEIBA reverses the effect of a high dose of rivaroxaban in rats. Pathophysiol Haemost Thromb 2008; 36: A40.
19. Buller HR. Once daily treatment with an oral, direct factor Xa inhibitor – rivaroxaban (BAY 59 - 7939) – in patients with acute symptomatic deep vein thrombosis. The EINSTEIN - DVT dose‑finding study. World Congress Cardiology 2006. Abstract P4568.
20. Buller HR. Once - daily oral rivaroxaban versus placebo in the long‑term prevention of recurrent symptomatic venous thromboembolism. The Einstein‑Extension Study. Blood 2009; 114: Abstract No LBA – 2.
21. Haas S. Rivaroxaban – an oral, direct Factor Xa inhibitor – lessons from a broad clinical study programme. Eur J Haematol 2009; 82 : 339 – 349.
22. Gibson CM, Mega JL, Hammett CJ et al. Randomized comparison of rivaroxaban, an oral direct factor Xa inhibitor, with placebo in patients with acute coronary syndromes: the ATLAS ACS - TIMI 46 trial. Circulation 2008; 118 : 2311.
23. Kvasnička J. Nová perorální antitrombotika – poznámky pro praxi. ČSTH 2009.
24. Fischer WD, Ericsson BI, Bauer KA et al. Rivaroxaban for thromboprophylaxis after orthopedic surgery: Pooled analysis of two studies. Blood Coagulation, Fibrinolysis and Cellular Haemostasis. Thromb Haemost 2007; 97 : 931 – 937.
25. Abendschein DR, Baum PK, Martin DJ et al. Effects of ZK - 807834, a novel inhibitor of factor Xa, on arterial and venous thrombosis in rabbits. J Cardiovasc Pharmacol 2000; 35 : 796 – 805.
26. Rebello SS, Kasiewski CJ, Wang W et al. Role of short‑term inhibition of factor Xa by FX673 in arterial passivation: A study in a chronic model of thrombosis in conscious dogs. J Cardiovasc Pharmacol 2001; 38 : 288 – 297.
27. Bostwick JS, Bentley R, Morgan S et al. RPR120844, a novel, specific inhibitor of coagulation factor Xa inhibits venous thrombosis in the rabbit. Thromb Haemost 1999; 81 : 157 – 160.
28. Asakura H, Ontachi Y, Mizutani T et al. Beneficial effect of JTV - 803, a new synthetic inhibitor of activated factor X, against both lipopolysaccharide‑induced and tissue factor‑induced disseminated intravascular coagulation in rat models. Blood Coagul Fibrinolysis 2002; 13 : 233 – 239.
29. Chi L, Peng YW, Gipson G et al. In vitro and in vivo antithrombotic activity of PD - 19891, a novel synthetic factor Xa inhibitor. J Cardiovasc Pharmacol 2004; 44 : 493 – 500.
30. Wong PC, Pinto DJ, Knabb RM. Effects of recombinant factor VIIa on the antithrombotic and bleeding time effects of SS457, a direct factor Xa inhibitor, in rats. Arterioscler Thromb BASF Biol 2004; 24: E – 66.
31. Fareed J, Hoppensteadt DA, Bick RL. Management of thrombotic and cardiovascular disorders in the new millennium. Clin Appl Thromb Hemost 2003; 9 : 101 – 108.
32. Robinson DM, Wellington K. Fondaparinus sodium: a review of its use in the treatment of acute venous thromboembolism. Am J Cardovasc Drugs 2005; 5 : 335 – 346.
33. Hyers TM. Management of venous thromboembolism: past, present and future. Arch Intern Med 2003; 163 : 759 – 768.
34. Mehta SR, Yusuf S, Granger CB et al. MICHELANGELO OASIS 5 Steering Committee. Design and rationale of the MICHELANGELO Organization to assess strategies in acute ischemic syndromes (OASIS) - 5 trial program evaluating fondaparinux, a synthetic factor Xa inhibitor, in patients with non‑ST‑segment elevation acute coronary syndromes. Am Heart J 2005; 150 : 1107.
35. Savi P, Chong BH, Greinacher A et al. Effect of fondaparinux on platelet activation in presence of heparin‑dependent antibodies: a blinded comparative multicentre study with unfractionated heparin. Blood 2005; 105 : 139 – 144.
36. Tobu M, Iqbal O, Messmore HL et al. Influence of different anticoagulant agents on fibrinopeptide a generation. Clin Appl Thromb Hemost 2003; 9 : 273 – 292.
37. PERSIST Investigators. A novel long‑-acting synthetic factor Xa inhibitor (SanOrg34006) to replace warfarin for secondary prevention in deep vein thrombosis: a phase II evaluation. J Thromb Haemost 2004; 2 : 47 – 53.
38. Penka M, Buliková A, Matýšková M. Nová antitrombotika. Postgrad Med 2009; 11 : 124 – 132.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 9-
All articles in this issue
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Liečime správne pacientov s claudicatio intermittens?
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Metabolický syndróm a tuhosť aorty
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

