-
Medical journals
- Career
Přínos jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
Authors: J. Vaníček 1; P. Krupa 1; Z. Adam 2
Authors‘ workplace: Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MU Dr. Petr Krupa, CSc., 2Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 1
Published in: Vnitř Lék 2010; 56(6): 585-590
Category: 65th Birthday - Petr Svacina, MD
Overview
Zobrazovací metody jako RTG, CT, MR a PET jsou klíčové v diagnostice mnohočetného myelomu. Jejich volba, vzájemná kombinace a návaznost jsou důležité pro včasné a správné určení této diagnózy. Jen klinické zkušenosti s tímto onemocněním v návaznosti na vhodnou zobrazovací diagnostiku vedou k účinné léčbě.
Klíčová slova:
mnohočetný myelom – zobrazovací metody – aktivita mnohočetného myelomuÚvod
Mnohočetný myelom je maligní onemocnění, u něhož se předpokládá maligní mutace na úrovni B lymfocytu, který proliferuje a vyzrává v klonální plazmatické buňky. Tyto buňky ve většině případů tvoří monoklonální imunoglobulin, který může způsobovat poškození organizmu a dále produkují četné cytokiny, které se také podílejí na projevech nemoci a mimo jiné aktivují osteoklasty a způsobují osteolýzy.
Klasickou trojicí příznaků tvoří únava, bolesti kostí a opakované infekce. Nejčastějším příznakem nemoci jsou bolesti v zádech či bolesti jiných částí skeletu, u 70 % nemocných je přítomna anémie, u některých je již v době stanovení diagnózy zvýšená koncentrace kreatininu a u 10 – 20 % chorých je v době stanovení diagnózy přítomna hyperkalcemie.
Mnohočetný myelom se může hlásit i dalšími pestrými příznaky (schéma 1):
- příznaky plynoucí z poškození kostí: typická je progresivně se zhoršující bolest páteře, která může vyústit do patologických fraktur,
- spinální komprese na podkladě extramedulární expanze – neurologické příznaky paraparézy či paraplegie při kompresi míchy, případně příznaky komprese nervových kořenů,
- poškození ledvin,
- anémie, typicky normochromní, normocytární, méně často leukopenie a trombocytopenie,
- hyperkalcemie (polyurie, polydipsie, dehydratace, oblenění peristaltiky, nevolnost, porucha vědomí),
- opakované bakteriální infekce,
- hyperviskozita (bolesti hlavy, epistaxe, krvácení z dásní),
- příznaky amyloidových depozit (nefrotický syndrom, kardiální selhání),
- příznaky hypo případně hyperkoagulace (krvácení nebo tromboembolické příhody),
- trvale vysoká sedimentace erytrocytů a koncentrace celkové bílkoviny.
Schéma 1. Příznaky mnohočetného myelomu. 
U jednotlivých nemocných může být přítomen jen jeden, ale i více z uvedených příznaků.
Cílem následujícího sdělení je probrat současné metody, které mohou informovat o poškození skeletu.
RTG snímky skeletu
Při prvním podezření je obvykle snímkována cíleně pouze bolestivá oblast.
Pokud je podezření, že by pacient mohl mít mnohočetný myelom, doporučuje se provést screeningové snímky skeletu [29]. Přibližně 80 % pacientů s myelomem má v době diagnózy zřetelná osteolytická ložiska na snímku skeletu. Nejčastěji postiženými oblastmi jsou obratle (66 %), žebra (45 %), lebka (40 %) (obr. 1), pažní kosti (40 %), pánev (30 %), dlouhé kosti (25 %) (obr. 2). Nicméně zcela výjimečná jsou ložiska v kostech distálně od kolen či loketního kloubu. V případě dlouhých kostí může být RTG snímek východiskem k rozhodování o postupu při osteolytickém defektu kosti dle uvedeného Mirelsova skóre (tab. 1). Pacienti s nízkým skóre mohou profitovat z radioterapie, pacienti s vysokým skóre z ortopedické vnitřní fixace. Ložiska, která narušují kortikalis, nebo ložiska s průměrem větším, než je 2/ 3 průměru kosti, způsobují ve velmi vysokém procentu brzy patologické fraktury, a proto jsou indikací k preventivní osteosyntéze.
Image 1. Osteolytické ložisko lebky na předozadním RTG snímku. 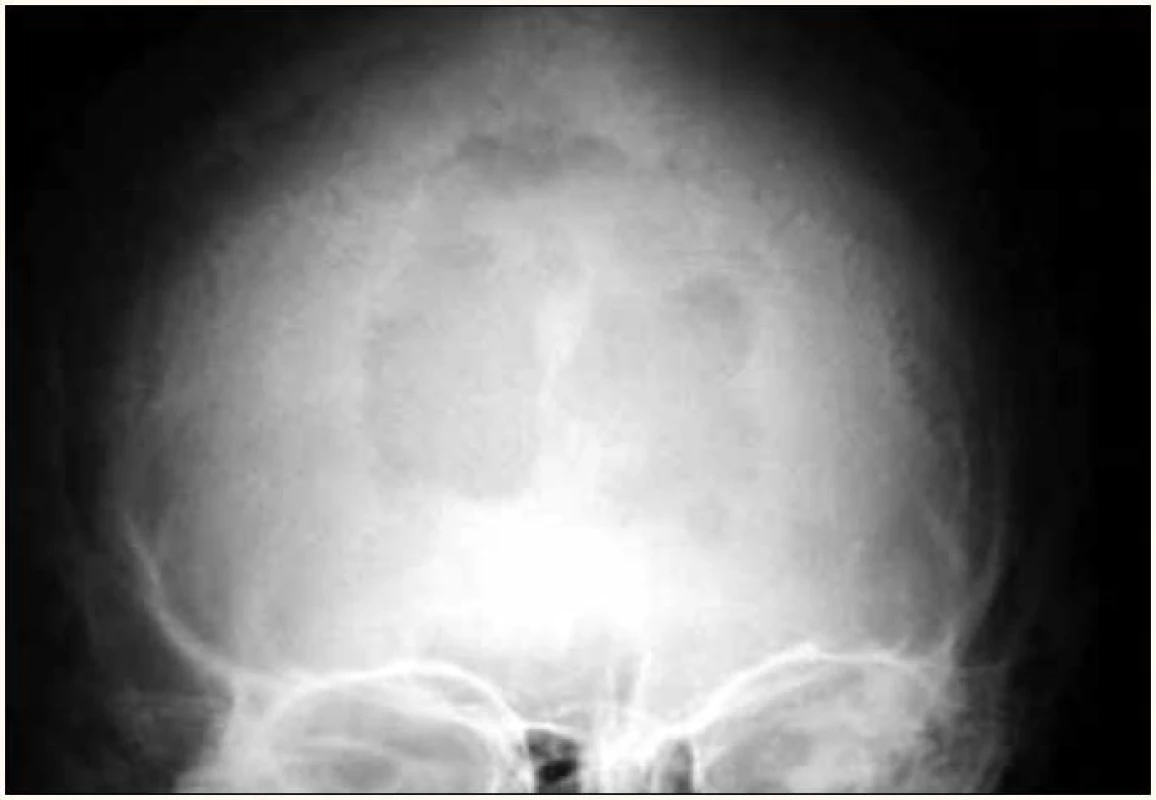
Image 2. Osteolytické ložisko femuru vpravo u osteosyntetického materiálu na RTG snímku pánve. 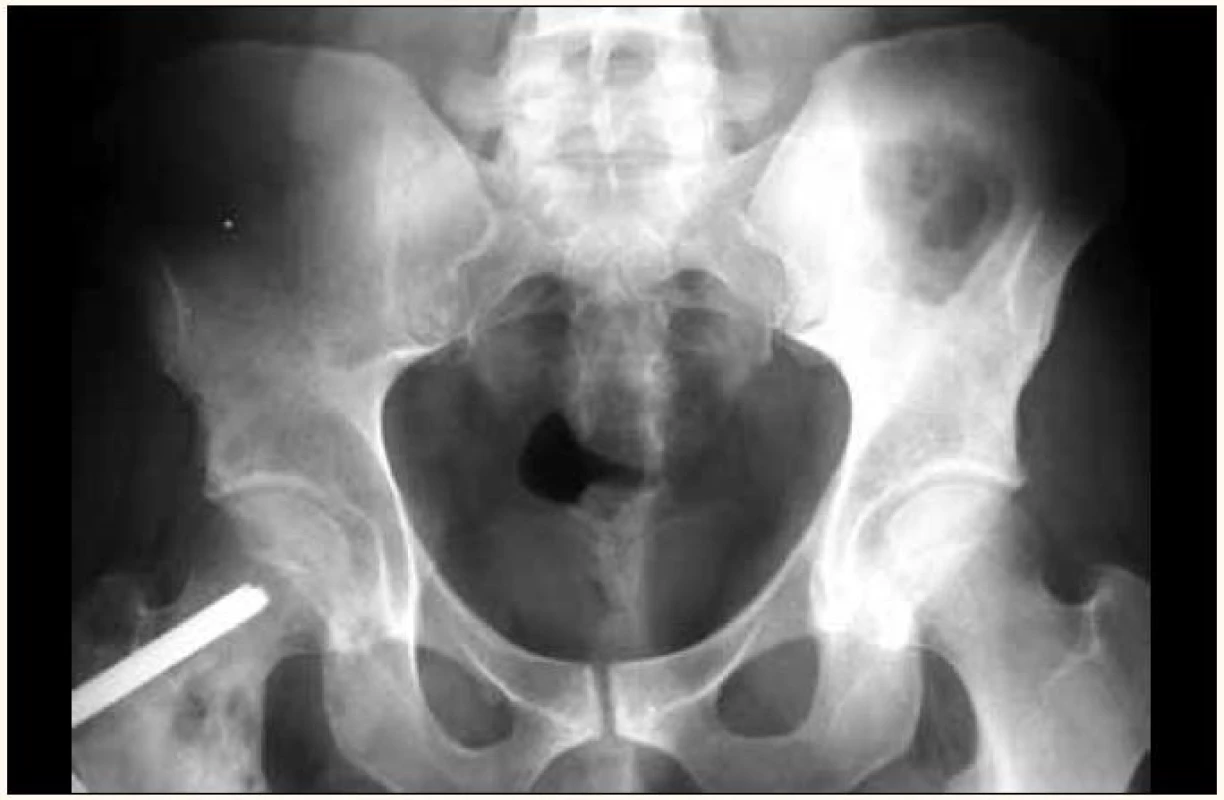
Table 1. Mirelsovo skóre [29]. ![Mirelsovo skóre [29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/86d2b06647b4f02852ca8bce264158c6.jpg)
Pacienti, kteří mají již na RTG snímku zřetelné ložisko, i když zatím bezpříznakové, mají vysoké riziko progrese do symptomatického onemocnění s mediánem intervalu od zjištění symptomatického ložiska do klinicky zřetelných symptomů kostního poškození 8 měsíců. Proto při zjištění osteolytického ložiska se doporučuje ihned zahájit léčbu, a to i při nepřítomnosti klinických příznaků nemoci.
Vstupní vyšetření skeletu představuje sice určitou zátěž pro pacienta, ale nahrazení celotělovou magnetickou rezonancí z kapacitních důvodů není zatím možné. Výhodou vstupního RTG vyšetření je rychlé získání informací o stavu skeletu. Nevýhodou je nízká senzitivita. Ložisko odvápnění je vidět po vymizení nejméně 30 % hydroxyapatitu a v některých lokalizacích je pro zviditelnění ložiska nutný ještě větší úbytek hydroxyapatitu, až 60 %.
Další nevýhodou RTG snímkování skeletu je skutečnost, že některé části skeletu se ze snímků hodnotí velmi obtížně (sternum, žebra, lopatky). RTG snímky však nelze používat k hodnocení kostní denzity, vyjádření o míře osteoporózy na základě RTG snímků je velmi nepřesné.
Mnohdy je přítomna bolest způsobená osteolýzou a na RTG snímku bolestivé části skeletu není zřetelné nic patologického. To je situace, kdy je indikováno zobrazení metodou MR nebo CT [17].
U velké většiny nemocných nedochází k hojení osteolytických ložisek ani v kompletní remisi, proto radiografické zobrazení nelze použít k potvrzení léčebné odpovědi, lze ji však použít pro průkaz nových ložisek, a tedy progrese nemoci.
Doporučený rozsah screeningového vyšetření skeletu u mnohočetného myelomu:
- zadopřední snímek hrudníku,
- předozadní a laterální snímky C, Th, L páteře,
- snímky femorů, humerů a pánve,
- snímky lebky,
- případná další podezřelá oblast, pokud není zobrazena v rámci výše uvedeného screeningového rozsahu.
Distální úseky skeletu, předloktí a bé-rec se obvykle v rámci screeningu nesnímkují, protože ložiska v těchto oblastech jsou velmi vzácná.
MR zobrazení
Pro časné stanovení rozsahu nemoci je největším pokrokem magnetická rezonance (MR). Na MR zobrazení je možné rozeznat patologickou infiltraci kostní dřeně a odlišit ji od fyziologické kostní dřeně, a to podstatně dříve, než vznikne závažné poškození minerální kostní struktury. Typická myelomová ložiska mají nízkou intenzitu signálu při T1 váženém zobrazení a vysokou intenzitu signálu při T2 váženém zobrazení a STIR (short time inversion recovery) zobrazení a dále obvykle vykazují zvýraznění (enhancement) po aplikaci konstrastní látky – gadolinia. S pomocí MR lze získat informace o typu postižení kostní dřeně (fokální, difuzní či kombinace obou těchto možností).
Nízká masa myelomových buněk má obvykle normální obraz, zatímco velká masa obvykle způsobuje difuzní hypointenzní signál při T1 váženém zobrazení a difuzní hyperintenzní signál při T2 váženém zobrazení se zvýrazněním (enhancementem) po aplikace gadolinia.
Uvedené změny však nejsou pro myelom specifické, fokální či difuzní změny mohou být variantou normy nebo být výsledkem jiných patologických procesů (depozita železa, amyloidu nebo reaktivní hyperplazie kostní dřeně).
MR zobrazení páteře tedy má potenciál informovat o míře postižení skeletu a o extramedulární propagaci nemoci. Výsledky MR zobrazení mají prognostickou informaci. Např. nález více než 10 ložisek v páteři výrazně zvyšuje pravděpodobnost patologické fraktury v této oblasti.
Nálezy patologické infiltrace na MR mohou dlouho předcházet vzniku jednoznačného osteolytického ložiska, zřetelného na RTG snímku.
MR má potenciál rozlišit kompresivní frakturu, vzniklou na základně osteoporózy anebo na základě patologické infiltrace obratle (obr. 3) [33].
Image 3. Vícečetné kompresivní fraktury hrudních obratlů při MR vyšetření, hypersignální – světlé jsou při infiltraci myelomem, tmavší jsou při osteoporóze. 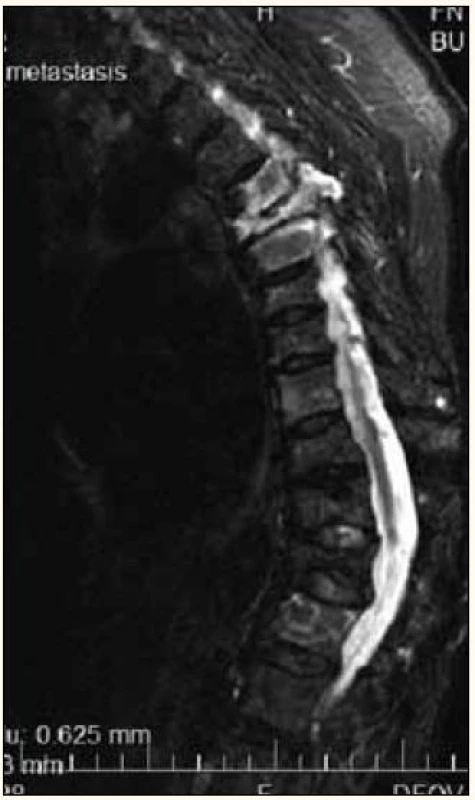
Změny v kostní dřeni po léčbě je však obtížnější interpretovat, proto MR skeletu se standardně nepoužívá k vyhodnocování úspěchu léčby, ale dominantně k určování rozsahu kostního a mimokostního postižení, a to jak při vstupním stanovení diagnózy, tak v průběhu nemoci při podezření na její progresi (obr. 4) [29].
Image 4. Infiltrace sterna myelomem v MR obraze. 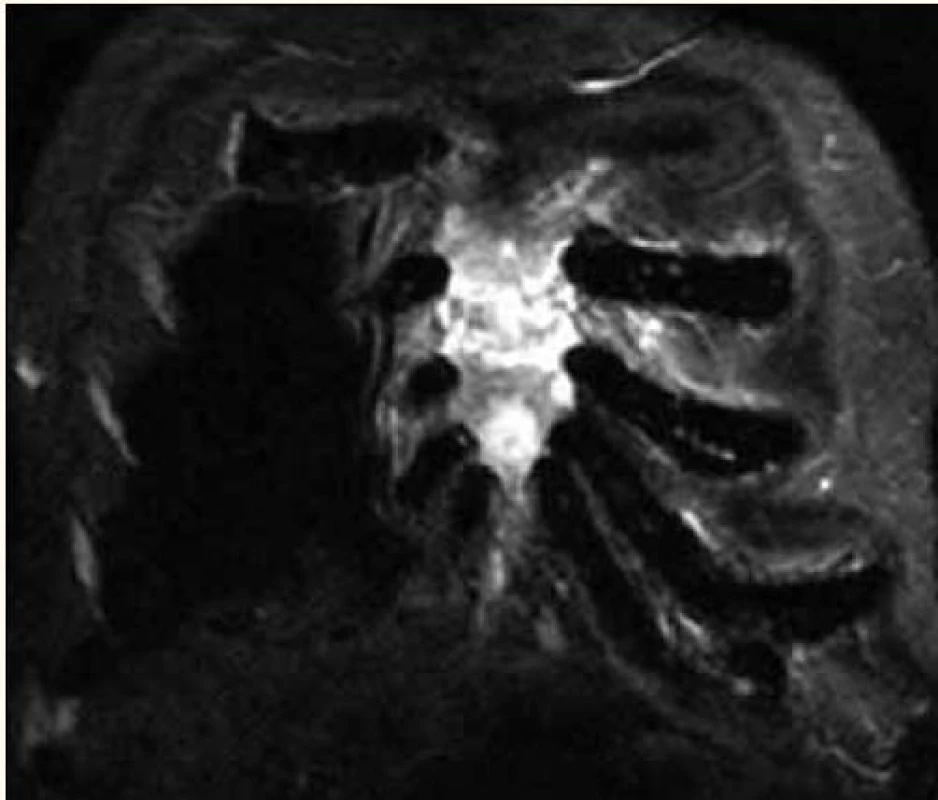
Doporučené indikace MR:
- Akutně provedené MR zobrazení je metodou volby při podezření na míšní kompresi u pacientů s mnohočetným myelomem, dokonce v případech, kdy na RTG snímku není zřetelná kompresivní fraktura.
- MR celé páteře je nutné provést u pacientů se solitárním plazmocytomem, protože toto vyšetření může najít další ložiska, změnit klasifikaci i léčebný postup.
- MR vyšetření je vhodné cílit na oblasti podezřelé z poškození myelomem, které mají nejasný nebo negativní nález na klasickém radiografickém či CT zobrazení, neboť tato vyšetření dávají komplementární informace.
- V průběhu nemoci se MR zobrazení doporučuje k objasnění nových symptomů, nevysvětlených předchozími vyšetřeními.
- MR vyšetření je optimální pro průkaz vaskulární nekrózy hlavice krčku femoru.
CT zobrazení
CT zobrazuje přesněji minerální struktury hydroxyapatitu než MR, nemá však potenciál tak dobře prokázat patologickou měkkotkáňovou infiltraci kosti, jak to umí MR, extramedulární propagaci myelomu však znázorní. Díky vysoké rozlišovací schopnosti lze s pomocí CT dobře zobrazit malá lytická ložiska, která nejsou zřetelná na klasickém RTG snímku.
Pro tuto vysokou rozlišovací schopnost je vhodné pro objasnění nejasných změn na klasickém RTG snímku. Také v případě bolesti určité části skeletu bez zřetelné patologie na běžném RTG snímku může být CT přínosem. CT je vhodné také jako metoda volby pro zobrazení těch částí skeletu, které nelze dobře zviditelnit klasickým rentgenovým snímkem: lopatky, žebra, sternum (obr. 5 – 7).
Image 5. Osteolytická ložiska manubria sterna v CT obraze. 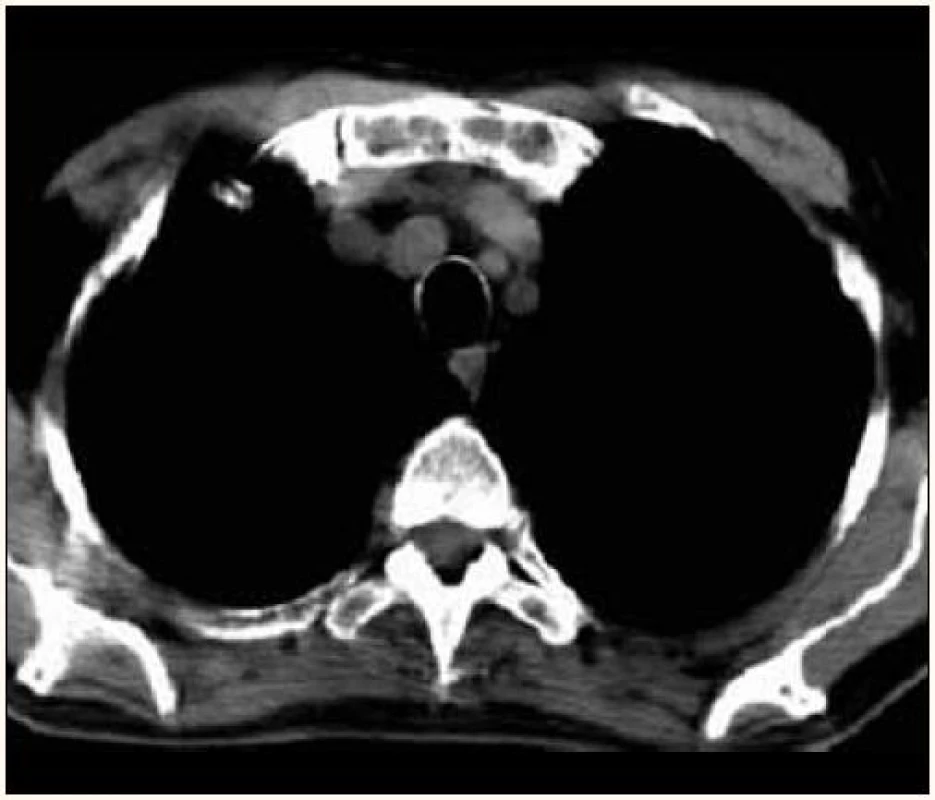
Image 6. Menší osteolytické ložisko hrudního obratle a hlavičky žebra vlevo v CT obraze. 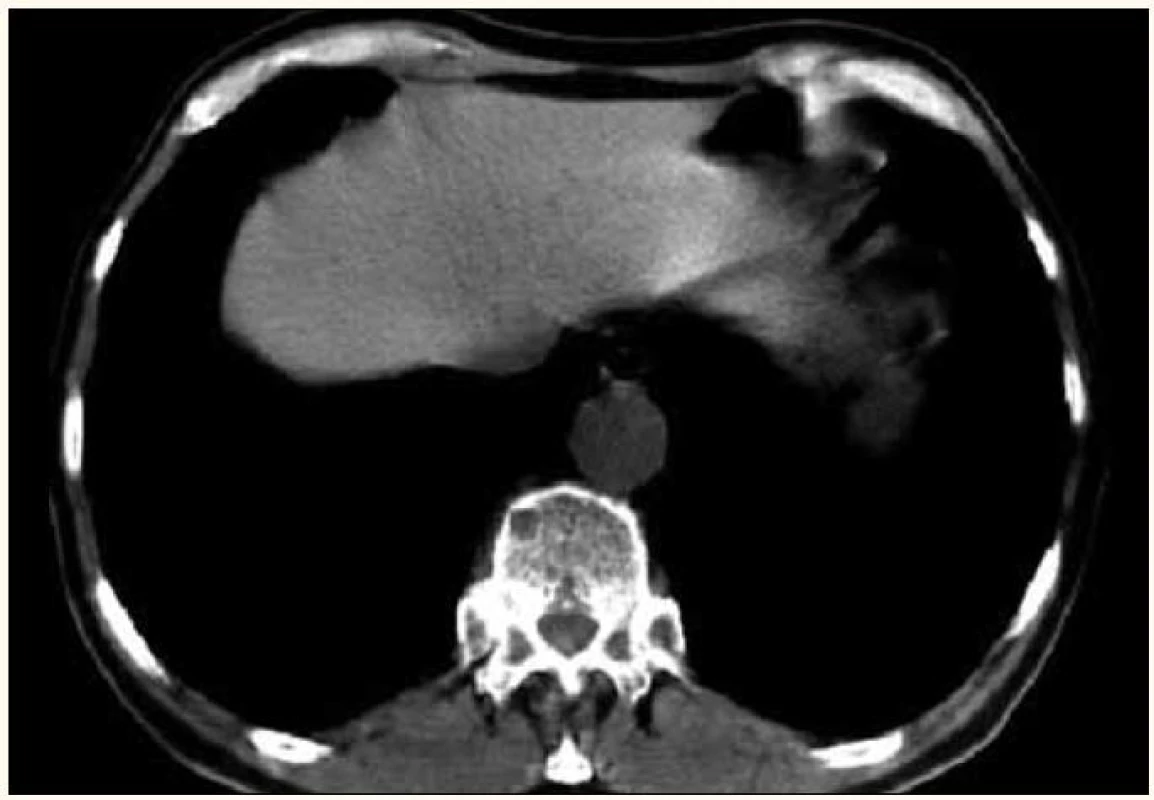
Image 7. MR snímek prokazuje myelomová ložiska dvou mediálních konců žeber vlevo (stejný nemocný jako na obr. 6). 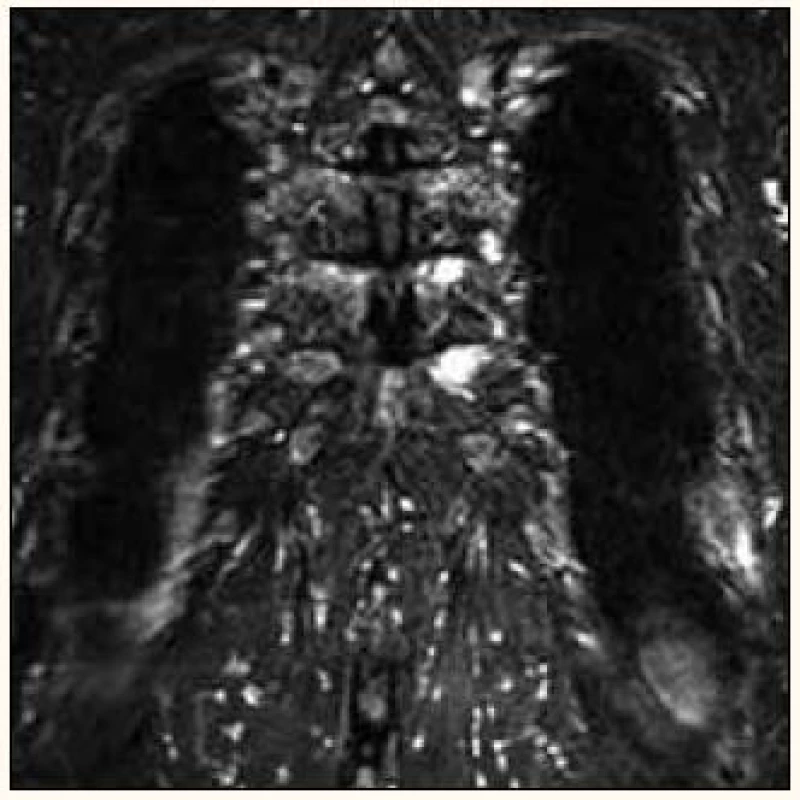
CT umožňuje také provést cílenou perkutánní punkci kostní dřeně z obratlů či jiných struktur, a stanovit tak diagnózu. Tento postup je optimální v případech, kdy je jednoznačný patologický nález v jednom či ve více obratlích a kdy trepanobiopsie lopaty kosti kyčelní neprokáže maligní infiltraci a pacient/ pacientka nemá zřetelný tumor plic či prsu. Včas odebrat histologický vzorek z patologického ložiska je postup lege artis, zatímco často provádění pátrání po takzvaném „origu“ znamená jen ztrátu času [12,16,17,25,29].
Doporučené CT indikace:
- podezření na míšní kompresi v případě, kdy nelze provést MR vyšetření (magnetický kov v těle či klaustrofobie pacienta),
- CT páteře pro objasnění, zda je, či není destrukce obratlů v případě bolestivosti, a to i v případě, že MR této oblasti je negativní,
- nejasné nálezy na klasické radiografii, suspektní ložiska v těch částech skeletu, která nelze dobře zobrazit klasickou radiografií, jako jsou žebra, sternum a skapula (obr. 6),
- symptomy postižení kosti v případě, že klasická radiografie byla zcela negativní, zde může CT odhalit to, co na klasickém RTG snímku není viditelné,
- CT je vhodné provést při podezření na měkkotkáňovou infiltraci, určení jejího rozsahu a je možné provést pod CT navigovanou biopsie této tkáně,
- monitorování aktivity nemoci není doporučováno s výjimkou sledování extramedulárních myelomových mas,
- v průběhu nemoci je CT indikováno v případně nevysvětlených symptomů, při suspektní progresi nemoci s podezřením na novou frakturu.
Scintigrafie skeletu Tc pyrofosfátem
Klasická scintigrafie skeletu je založena na průkazu ložisek se zvýšenou intenzitou mineralizace, do nichž se také ukládá aplikovaný technecium-pyrofosfát. Zobrazení maligního ložiska technecium-pyrofosfátem je tedy podmíněnou přítomností osteoneogeneze.
Vzhledem k tomu, že pro kostní ložiska mnohočetného myelomu je typická aktivní osteolýza a žádná či minimální osteoneogeneza, tak detekce ložisek mnohočetného myelomu ve skeletu má nižší senzitivitu než detekce klasickým RTG snímkem [29,32].
Klasická scintigrafie skeletu někdy umožnila znázornit ložiska v oblasti žeber, skapuly či sterna, kde jsou špatně znázornitelná klasickou radiografií [18], ale CT je více senzitivní. Proto se dnes provádění scintigrafie skeletu u pacientů s myelomem nedoporučuje.
Pozitronová emisní tomografie pomocí fluorodeoxyglukózy
Velkým přínosem pro stanovení rozsahu postižení je pozitronová emisní tomografie pomocí fluorodeoxyglukózy (FDG-PET), případně PET-CT.
Pomocí FDG-PET je možné získat informaci o rozsahu skeletárního postižení a zároveň informaci o případných extramedulárních (měkkotkáňových) ložiscích. Zjištění extramedulárního ložiska je velmi nepříznivý prognostický faktor. Překvapením někdy bývá zjištění duplicitní malignity.
Popisovaným limitem FDG-PET je špatné znázorňování subcentrimetrových ložisek myelomových buněk.
FDG-PET zobrazení je možné použít k vyhodnocení účinnosti radioterapie v případě velkých solitárních plazmocytomů. Přetrvávání aktivity po léčbě signalizuji nepříznivou prognózu a nedostatečně účinnou léčbu. Někteří autoři popsali vyhodnocení efektu cytostatické léčby a příznivou prognózu u nemocných s normalizací původně patologického nálezu na FDG-PET. Tento postup však nedoznal standardního rozšíření.
Přetrvávající pozitivita PET po ukončení vysokodávkované chemoterapie korelovala s nepříznivou prognózou těchto nemocných [6]. Plošně se však vyhodnocování průběhu nemoci pomocí FDG-PET nepoužívá, za vhodné se považuje vyhodnocování průběhu nemoci u pacientů s nesekrečními či oligosekrečním myelomem.
Ačkoliv FDG-PET u myelomu se již několik let používá, stále ještě musíme konstatovat, že jeho indikace nejsou ještě pevně definovány. Při plánování FDG-PET je vhodné respektovat doporučený odstup 4 týdnů od poslední chemoterapie a 3 měsíců od poslední radioterapie [29]. U nádorů nevykazujících intenzivní PET aktivitu, mezi něž patří i mnohočetný myelom, je vhodný odstup od operačního zákroku, neboť při hojení tkání může docházet k falešně pozitivním výsledkům.
Vyšetření FDG-PET představuje metodu, která se používá výběrově, její přesné indikace i mnohočetného myelomu se postupně vyvíjejí.
Radioizotopové zobrazení pomocí 99Tc - sestamibi (MIBI)
Druhou běžně používanou radioizotopovou vyšetřovací metodou je zobrazení pomocí látky zvané sestamibi, ve zkratce MIBI (plným jménem 99mTc - 2 - methoxy - isobutyril - isonitril), značené radioaktivním techneciem. Sestamibi je látka, která se mimo jiné kumuluje v mitochondriích, kterých je v myelomových buňkách více než v okolních strukturách. Proto lze pomocí MIBI také zobrazit rozsah mnohočetného myelomu a zjistit případná extramedulární ložiska. Výsledkem četných studií testujících MIBI zobrazení mnohočetného myelomu bylo potvrzení, že vychytávání MIBI koreluje s dalšími parametry nemoci [29].
Při srovnání RTG, MIBI a MR zobrazení páteře bylo zjištěno, že rozsah postižení páteře na MIBI zobrazení byl menší než při MR zobrazení, ale celkové postižení skeletu bylo při MIBI zobrazení větší než na klasických RTG snímcích [3,21].
Při srovnání PET versus MIBI zobrazení bylo zjištěno, že MIBI zobrazení detekovalo ložiska, které nebyla zřetelná na RTG snímku a více ložisek než FDG-PET. MIBI aktivita korelovala lépe s množstvím plazmocytů v kostní dřeni než při FDG-PET zobrazení [19]. Při interpretaci je vhodné přihlédnout ke skutečnosti, že MIBI znázorňuje přítomnost myelomových ložisek, zatímco FDG-PET znázorňuje aktivitu buněk těchto ložisek.
Doporučená indikace pro FDG-PET a MIBI zobrazení:
- solitární plazmocytom – nález dalších ložisek změní klasifikaci a léčebný postup
- podezření na extramedulární šíření myelomových hmot, pokud není provedeno MR vyšetření
- vyhodnocení léčby ložiskových plazmocytomů o velkém rozměru (průměr > 5 – 10 cm), které často nedostatečně reagují na léčbu
- v průběhu léčby není FDG-PET ani MIBI doporučováno pro rutinní použití u všech pacientů. Za vhodné se považuje pouze u vybrané skupiny nemocných s nesekrečním nebo s extramedulární mnohočetným myelomem
Stanovení hustoty kostní tkáně metodou DEXA (dual energy X ray absorbtion scanning)
Dexa je klasický postup pro měření míry osteoporózy. Nízká denzita bederních obratlů zvyšuje riziko vzniku patologických fraktur. Nicméně zjištěná denzita závisí na spondylóze, osteofytech a kompresivních frakturách obratlů. Proto je vyhodnocení výsledku u pacientů s myelomem obtížnější.
MUDr. Jiří Vaníček, Ph.D.
www.fnusa.cz
e-mail: vanicek@fnusa.czDoručeno do redakce: 14. 5. 2010
Sources
1. Adam Z, Bednařík J, Neubauer J et al. Doporučení pro časné rozpoznání postižení skeletu maligním procesem a pro časnou diagnostiku mnohočetného myelomu. Vnitř Lék 2006; 52 (Suppl 2): 9 – 13.
2. Adam Z, Bolčák K, Staníček J et al. Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG ‑ PET) u mnohočetného myelomu. Vnitř Lék 2006; 52 : 207 – 214.
3. Alper E, Gurel M, Evrensel T et al. 99mTc ‑ MIBI scintigraphy in utreated stage III multiple myeloma. Comparison with X‑ray skeletal survey and bone scintigraphy. Nucl Med Commun 2003; 24 : 537 – 242.
4. Anderson KC, Alsina M, Bensinger W et al. National Comprehensive Cancer Network (NCCN). Multiple myeloma. Clinical practice guidelines in oncology. J Natl Compr Canc Netw 2007; 5 : 118 – 1147.
5. Barosi G, Boccadoro M, Cavo M et al. Management of multiple myeloma and related ‑ disorders: guidelines from the Italian Society of Hematology (SIE), Italian Society of Experimental Hematology (SIES) and Italian Group for Bone Marrow Transplantation (GITMO). Haematologica 2004; 89 : 717 – 741.
6. Durie BG, Waxman AD, D’Agnolo A et al. Whole ‑ body 18FDG PET identifies high risk myeloma. J Nucl Med 2002; 43 : 1457 – 1463.
7. Durie BG, Kyle RA, Belch A et al. Scientific Advisors of the International Myeloma Foundation. Myeloma management guidelines: a consensus report from the Scientific Advisors of the International Myeloma Foundation. Hematol J 2003; 4 : 379 – 398.
8. Kay NE, Leong T, Bone N et al. T ‑ helper phenotypes in the blood of myeloma patients on ECOG phase III trials E9486/ E3A93. Br J Haematol 1998; 100 : 459 – 463.
9. Lenhoff S, Hjorth M, Holmberg E et al. Impact of survival of high dose therapy with autologous stem cell support in patients younger then 60 years with newly diagnosed multiple myeloma: a population‑based study. Nordic Myeloma Study Group. Blood 2000; 95 : 7 – 11.
10. D’Sa S, Abildgaard N, Tighe J et al. Guidelines for the use of imaging in the management of myeloma. Br J Haematol 2007; 137 : 49 – 63.
11. Harrouseau JL, Greil R, Kloke O. ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow‑up of multiple myeloma. Ann Oncol 2005; 16 (Suppl 1): i45 – i47.
12. Horger M, Claussen CD, Bross ‑ Bach U et al. Whole‑blood low‑dose multidetector row ‑ CT in the diagnosis of multiple myeloma: an alternative to convetional radiography. Eur J Radiol 2005; 54 : 289 – 297.
13. Chaloupka R, Grosman R. Zásady operačního ošetření maligních nádorů páteře. Acta Spondylologica 2002; 1 : 39 – 41.
14. Chaloupka R, Vlach O, Grosman R. Dlouhodobé výsledky po operační léčbě maligních nádorů krční páteře. Brno: Scripta Medica, Univ. Masarykiana 1998; 71 (Suppl 5): 154 – 156.
15. Imrie K, Esmail R, Meyer RM. The role of high‑dose chemotherapy and stem ‑ cell transplantation in patients with multiple myeloma: a practice guideline of the Cancer Care Ontario Practice Guidelines Initiative. Ann Intern Med 2002; 136 : 619 – 629.
16. Lecouvet FE, Vande Berg BC, Malghem J et al. Magnetic resonance and computed tomography imaging in multiple myeloma. Semin Musculoskelet Radiol 2001; 5 : 43 – 55.
17. Lecouvet FE, Malghem J, Michaux L et al. Skeletal survey in advanced multiple myeloma: radiographic versus MR imaging survey. Br J Haematol 1999; 106 : 35 – 39.
18. Ludwig H, Kumpan W, Sinzinger H. Radiography and bone scintigraphy in multiple myeloma: comparative analysis. Br J Radiol 1982; 55 : 173 – 181.
19. Mileshkin L, Blum R, Seymour JF et al. A comparison of fluorine 18 - fluoro‑deoxyglucose PET and technetium ‑ 99m sestamibi in assessing patients with multiple myeloma. Eur J Haematol 2004; 72 : 32 – 37.
20. Mirels H. Metastatic disease in long bones. A proposed scoring systém for diagnosing impending pathologic fractures. Clin Orthop Relat Res 1989; 415 (Suppl): S4 – S13.
21. Mirzaei S, Filipits M, Keck A et al. Comparison of Technetim ‑ 99m MIBI imaging with MRI for detection of spine involvement in patients with multiple myeloma. BMC Nucl Med 2003; 3 : 2 – 12.
22. Mysliveček M, Nekula J, Bačovský J. Zobrazovací metody v diagnostice a sledování mnohočetného myelomu. Vnitř Lék 2006; 52 (Suppl 2): 46 – 54.
23. Nekula J. Zobrazovací metody páteře a páteřního kanálu. Hradec Králové: Nukleus 2005.
24. Neubauer J, Adam Z, Pour L. Jak rozlišit, zda je kompresivní fraktura obratle způsobena osteoporózou nebo mnohočetným myelomem? Vnitř Lék 2006; 52 (Suppl 2): 83 – 87.
25. Neubauer J, Reptko M. Metodika kostních biopsií perkutánním způsobem za navigace CT. Vnitř Lék 2006; 52 (Suppl 2): 71 – 73.
26. Rajkumar SV, Fonseca R, Dispenzieri Aet al. Methods for estimation of bone marrow plasma cell involvement in myeloma. Predictiove value for response and survival in patients undergoing autologous stem cell transplantation. Am J Hematol 2001; 68 : 269 – 275.
27. Ryška P, Řehák S, Odrážka K et al. Postavení perkutánní vertebroplastiky a kyfoplastiky v léčbě onkologického onemocnění páteře. Čas Lék Čes 2006; 10 : 804 – 809.
28. Řehák S, Maisnar V, Málek V et al. Pozdní diagnostika páteřního postižení u myelomu. Neurol pro Praxi 2005; 6 : 171 – 174.
29. D’Sa, Abildgaard N, Tighe J et al. Guidelines for the use of imaging in the management of myeloma. Br J Haematol 2007; 137 : 49 – 63.
30. Schmidt GP, Schoenberg SO, Reiser MF et al. Whole ‑ body MR imaging of bone marrow. Eur J Radiol 2005; 55 : 33 – 40.
31. Ščudla V, Nekula J, Bačovský Z et al. Nukleární magnetická rezonance v hodnocení páteře u mnohočetného myelomu. Čs Revmatol 1997; 5 : 51 – 52.
32. Tamir R, Glanz I, Lubin E et al. Comparison of the sensitivity of 99mTc methyl diphosphonate bone scan whit the skeletal X‑ray survey in multiple myeloma. Acta Haematol 1983; 69 : 236 – 242.
33. Uetani M, Hashmi T, Hayashi K. Malignant and benign compression fractures: diferentiation and diagnostic pitfalls on MRI. Clin Radiol 2004; 59, 124 – 131.
34. Smith A, Wisloff F, Samson D. Guidelines on the diagnosis and management of multiple myeloma 2005. Br J Haematol 2006; 132 : 410 – 451.
35. Zemanová M, Pika T, Ščudla V. Osteoporóza jako dominantní projev nesekreční formy mnohočetného myelomu. Onkol Péče 2006; 10 : 24 – 26.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 6-
All articles in this issue
- Plicní hypertenze – neobvyklá komplikace syndromu bakteriálního přerůstání – editorial
- Existuje diurnální variabilita big endotelinu a NT‑proBNP u nemocných s těžkým chronickým srdečním selháním?
- Normalizovaný smoothness index a parametrický populační RDH index telmisartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Plicní hypertenze – neobvyklá komplikace hemolýzy a syndromu bakteriálního přerůstání
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Registr BRNO 2: farmakoterapie po infarktu myokardu
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
- Psychologický náhled na problémy onkologických pacientů a ošetřujícího týmu
- Preventivní podání antibiotik a probiotik u těžké akutní pankreatitidy
- Přínos jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Příspěvek k hodnocení sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a v jednotlivých klinických stadiích mnohočetného myelomu
- Kontinuálne monitorovanie tkanivovej glukózy
- Význam senzitivity baroreflexu pre stratifikáciu kardiovaskulárneho rizika u hypertonikov
- Prevencia a liečba končatinovocievnej ischemickej choroby
- Zmeny v lipoproteínovom spektre pri končatinovo- cievnej ischemickej chorobe
- Vysoké školy musí mít nejen kvalitní výuku, ale také účinnou kontrolu kvality znalostí a schopností studentů (produktů) vysoké školy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

