-
Medical journals
- Career
Diferenciální diagnostika eozinofilie
: Z. Adam; M. Tomíška; M. Krejčí; L. Pour
: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc.
: Vnitř Lék 2009; 55(Suppl 1)(Supplementum 1): 125-144
Zvýšený počet eozinofilů je projevem mnoha různých patologických stavů. Nejčastější příčinou jsou alergické nemoci. Fyziologický je vzestup eozinofilů jako důsledek postižení tkání parazity. Eozinofilie může provázet některá orgánová onemocnění či onemocnění pojiva. Primární vzestup počtu eozinofilů může být způsoben patologickým (benigním nebo maligním) klonem T‑lymfocytů, které svými cytokiny stimulují proliferace a diferenciaci eozinofilní řady. Primární porucha může být však také přímo v myeloidní řadě. Některé mutace myeloidních buněk, které souvisejí s nekontrolovanou eozinofilní myeloproliferací, byly popsány, jiné čekají na svou identifikaci. Cílem textu je popsat všechny stavy, jejichž důsledkem je vzestup počtu eozinofilů v periferní krvi, a podat návod k diferenciální diagnostice.
Klíčová slova:
eozinofilie – hypereozinofilní syndrom – eozinofilní leukemieÚvod
Údaje o incidenci eozinofilie v české či slovenské populaci jsme nenalezli, a proto uvádíme výsledky epidemiologického šetření v Britské Kolumbii v Kanadě. Celkem byly vyhodnoceny diferenciální obrazy 38 086 pacientů. Zvýšený počet eozinofilů (> 0,7 × 109/l) byl nalezen u 60 pacientů s jinak normálním počtem krvinek. Eozinofilie byla očekávaná u 17 pacientů, o nichž bylo již před vyšetřením známo, že mají alergie a parazitární choroby. Neočekávaným byl objev eozinofilie u 43 pacientů. Tito pacienti byli podrobně vyšetřeni s následujícím závěrem:
- u 23 případů zůstala eozinofilie neobjasněná i po dokončení všech plánovaných vyšetření
- u 7 osob bylo nově potvrzeno astma bronchiale
- u 5 osob byl nově diagnostikován alergický ekzém
- u 3 osob bylo nově diagnostikováno parazitární onemocnění
- u 2 osob šlo o lékovou alergii
- u 1 osoby bylo při vyšetřování nově diagnostikováno maligní onemocnění
- u 1 osoby byla v rámci vyšetřování eo-zinofilie potvrzena kolagenní choroba
Incidence eozinofilie u pacientů s jinak normálními počty krvinek byla < 0,2 %, konkrétně 157,6/100 000 vyšetřených pacientů.
Důležitou výpovědí této práce je zjištění, že zvýšený počet eozinofilů není vzácným problémem, ale relativně častějším nálezem, s nímž jsou lékaři často konfrontováni. Naštěstí incidence život ohrožujícího idiopatického hypereozinofilního syndromu je podstatně menší, jen 0,5/100 000 obyvatel. Další důležitou výpovědí této studie je, že příčina eozinofilie často zůstane po počátečních vyšetřeních neodhalena a nezbývá nic jiného, než tyto pacienty dlouhodobě sledovat.
Proto tento článek je věnován diferenciální diagnostice eozinofilií.
Základní informace o eozinofilech
Diferenciace eozinofilů a jejich dislokace
Eozinofilní granulocyty jsou terminálními produkty kmenových krvetvorných buněk, které se diferencují směrem do myeloidní linie a z ní následně do bazofilní-eozinofilní linie.
Poločas eozonofilů v krevním oběhu před migrací do tkání, kde je jich minimálně 100krát více než v krvi, se pohybuje od 6 do 12 hod. Nejvíce eozinofilů lze nalézt v orgánech s epiteliálním povrchem, který se dostává do styku se zevními alergeny (respirační, gastrointestinální a distální genitouretrální trakt). Zde mohou eozinofily přežívat řádově týdny.
Počet eozinofilů v krvi kolísá v závislosti na věku pacienta, denní době, námaze a na vlivech okolního prostředí se sezónními alergeny. Počet eozinofilů je nejnižší ráno a nejvyšší v noci. Tyto rozdíly, které jsou reciproční k aktuální sérové hladině kortisolu, mohou dosahovat až 40 %. Horní hranice normálního počtu eozinofilů se pohybuje kolem 0,65 × 109/l. Za jejich patologický vzestup lze považovat počet eozinofilů ≥ 0,7 × 109/l. Absolutní počet eozinofilů se dnes považuje za podstatně důležitější údaj než jejich relativní četnost.
Hranice normálních a zvýšených hodnot se však mohou v různých publikacích lišit. Tefferi ve svém přehledu z roku 2006 uvádí následující hranice:
- fyziologické (normální) hodnoty: < 0,5 × 109/l
- mírná eozinofilie: 0,5–1,5 × 109/l
- střední eozinofilie: 1,5–5,0 × 109/l
- závažná eozinofilie: > 5 × 109/l
Struktura eozinofilů a jejich funkce
Buněčné jádro je nejčastěji bilobální. Nejvýraznějším odlišovacím znakem od ostatních granulocytů jsou eozinofilní granula, která obsahují následující látky:
- hlavní bazický katonický protein (major basic protein)
- eozinofilní katonický protein (eosinofil cationic protein)
- eozinofilní neurotoxin (eosinophil-derived neurotoxin)
- eozinofilní peroxidáza (eosinophil peroxidase)
Dále se při kontaktu s parazitem uvolňují:
- cytokiny (interleukiny a tumor necrosis factor)
- lipidové mediátory – leukotrieny
Všechny tyto látky obsažené v granulech eozinofilů zprostředkují obranu proti parazitům, ale také alergické reakce a podílejí se na zánětlivé reakci v tkáni.
Hlavní funkcí eozinofilů je cytotoxická reakce namířená hlavně proti parazitárním (helmintickým) infekcím. Při kontaktu s parazitem dochází k tzv. „degranulaci eozinofilů“. To znamená, že z granulí eozinofilů se uvolní výše uvedené proteiny, které mají potenciál zahubit parazita.
Bohužel, tytéž bílkoviny mohou poškozovat i zdravé tkáně hostitele. Např. v případě idiopatického hypereozinofilního syndromu jsou ukládány produkty eozinofilních granulí k přiléhajícím srdečním myocytům, způsobují zánět a trombózu, což nakonec způsobí endomyokardiální fibrózu a restriktivní kardiomyopatii. Dále eozinofily obsahují plazminogen, s jehož pomocí mohou odstraňovat fibrinová depozita.
Eozinofily mohou fagocytovat bakterie, kvasinky a prvoky, ve srovnání s neutrofily je však jejich fagocytární aktivita podstatně slabší. Eozinofily obsahují také antiinflamatorní enzymy, které pomáhají regulovat na mastocytech závislou okamžitou hypersenzitivní reakci. Vznik eozinofilie s následným zničením parazita či poškozením tkáně zobrazuje schéma 1.
Schéma 1. Etiopatogeneze eozinofilie a idiopatického hypereozinofilního syndromu. 
Regulace tvorby eozinofilů
Tvorba eozinofilů v kostní dřeni je regulována četnými faktory. Stimulována je cytokiny produkovanými T lymfocyty, z nichž nejúčinnější je interleukin 5, interleukin 3 a granulocyte monocyte-colony stimulating factor (GM CSF). Tyto látky jsou hlavními faktory odpovědnými za proliferaci eozinofilů a jsou také chemotaktickými faktory, které stimulují migraci eozinofilů do tkání. Jejich geny jsou lokalizovány na chromozomu 5q31–q33.
Eozinofilie je tedy reakce na specifickou T buněčnou imunitní odpověď, obvykle na zevní alergeny nebo na parazitární (helmintickou) infekci, výjimečně na jiné infekce (mykotické nebo bakteriální). Časná stadia vývoje eozinofilů stimulují oba dva typy T lymfocytů (Th1 a Th2) produkcí GM CSF a IL 3. Hlavním stimulem eozinofilní proliferace je však IL 3 produkovaný Th2 lymfocyty.
Chemotaxe, přestup eozinofilů do tkání, je pod vlivem C-C chemokinů (eotaxin, CCR3, PAF a RANTES), dále pak endoteliálních adhezivních molekul a integrinů.
Paraziti jsou celosvětově nejčastější příčinou eozinofilie, jen v Evropě a v Severní Americe jsou nejčastější příčinou alergické reakce. Dalšími příčinami eozinofilie jsou některé plicní choroby a také autoimunitní a maligní choroby.
Pacienti s eozinofilií, u nichž byly vyloučeny tyto známé vyvolávající příčiny, mají tzv. idiopatickou eozinofilii.
Pestrost etiologického původu eozinofilií a skutečnost, že ne vždy byl etiologický původ eozinofilie prokázán, a přesto eozinofily závažně poškozovaly nemocné, vedla v roce 1968 Hardyho a Andersona k vytvoření pojmům hypereozinofilní syndrom a posléze idiopatický hypereozinofilní syndrom. V roce 2008 to bylo právě 40 let a mezitím poznání výrazně postoupilo, a proto i náplň termínu hypereozinofilní syndrom se výrazně pozměnila a lze říci, že s pokroky molekulární biologie se každoročně poznatky upřesňují.
Základní etiologické dělení eozinofilie
Základní rozdělení příčin získané eozinofilie je však již mnoho let stabilní:
- sekundární eozinofilie (cytokiny indukovaný reaktivní fenomén)
- klonální eozinofilie (přítomné histologické, cytogenetické nebo molekulární znaky myeloidního maligního – klonálního – onemocnění)
- idiopatická eozinofilie – není prokázána vyvolávající příčina, a tedy sekundární původ, ani není prokázána klonální příčina. Hypereozinofilní syndrom je pak podmnožinou idiopatické eozinofilie, kdy je přítomno více než 1,5 × 109/l eozinofilů a je prokázáno poškozování orgánů a tkání eozinofily.
Navíc dle definice WHO musí v případě hypereozinofilního syndromu být negativní výsledek testů na přítomnost aberantní populace T lymfocytů, produkujících výše uvedené cytokiny stimulující eozinofilní proliferaci.
Přehled příčin získané eozinofilie uvádí tab. 1.
1. Příčiny získané eozinofilie. Podle [37]. ![Příčiny získané eozinofilie. Podle [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c8119e5c884ca3f6fcef8caf20e803d7.jpeg)
Tab. 2 dělí příčiny eozinofilie na více a méně pravděpodobné s přihlédnutím k absolutnímu počtu ezinofilů v periferní krvi. Pravděpodobnost ireverzibilního orgánového postižení však nezávisí na absolutním počtu všech eozinofilů, ale na počtu metabolicky aktivních eozinofilů s toxickými granulacemi.
2. Pravděpodobné a méně pravděpodobné příčiny eozinofilie. Podle [38]. ![Pravděpodobné a méně pravděpodobné příčiny eozinofilie. Podle [38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a977e4a85d409007fb648355ce5daf85.jpeg)
V následném textu probereme jednotlivé formy sekundární eozinofilie, klonální eozinofilie a pak idiopatickou hypereozinofilii a hypereozinofilní syndrom.
Sekundární eozinofilie
Infekce
Parazitární infekce
Parazitární choroby lze nomenklaturně rozdělit na parazitující prvoky (protozoa) a na parazitující červy (vermes), pro které se v lékařství používá termínu helminti. Nejčastějšími protozoárními parazitózami v našich zemích jsou toxoplazmóza (Toxoplasma gondii), trichomonáza vaginální přenosná sexuálně (Trichomonas vaginalis) a z alimentárních přenosných nemocí je to giardióza (Giardia lamblia, synonymem Giardia intestinalis). Ostatní jsou v našich podmínkách výjimečné či jsou vázány na imunokompromitované pacienty. Infekce parazitujícími prvoky může probíhat zcela bez eozinofilie nebo může dojít k dočasnému a nízkému vzestupu počtu eozinofilních leukocytů s výjimkou trichomonázy, u níž se počet eozinofilů nezvyšuje. Mírná eozinofilie v případě závažné gastroduodenální infekce prvokem Giardia lamblia se připisuje více poruše permeability kapilár a vstřebávání alergenů z potravy než vlastním prvokům.
Parazitární infekce helminty lze rozdělit na infekce dutinové (z nichž převažují infekce střevní) a infekce tkáňové. Toto dělení má význam z hlediska diagnostiky i z hlediska provázejícího počtu eozinofilů. Pokud je přítomnost hlístů omezena jenom na střevní dutinu, kde se hlíst vylíhne i dospívá, nebývá eozinofilie vysoká, na rozdíl od tkáňových parazitů. V případech helmintů, kteří migrují cévním oběhem do alveolů, odkud se s hlenem dostávají do laryngu, jsou spolykány a ve střevě dospívají, dochází k výraznému vzestupu počtu eozinofilů právě v době migrace parazita přes plicní tkáň. Výše eozinofilie kopíruje aktivitu tkáňových parazitů, je vysoká při migraci parazitů tkáněmi a klesá po jejich opouzdření. Parazitární choroby, které lze získat v České republice (tzv. autochtonní infekce), zobrazuje tab. 3, kde je uvedena i jejich hlavní charakteristika a způsob diagnózy.
3. Vybrané vlastnosti častých a méně častých a utochtonních (domácích) helmintických infekcí. 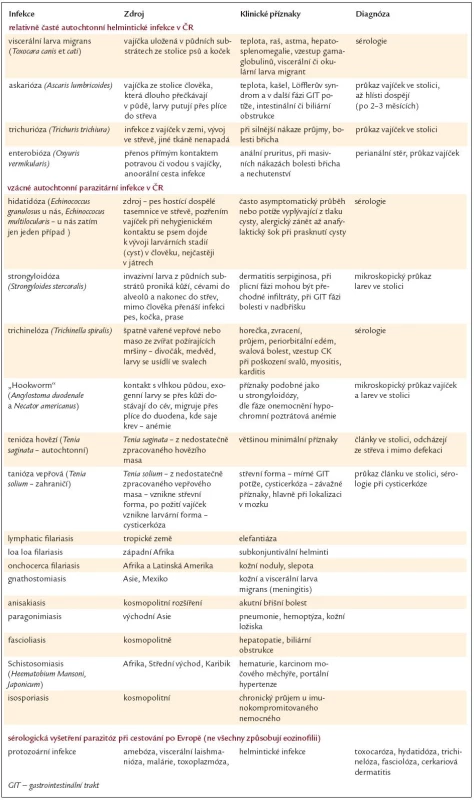
Při vyšetřování přítomnosti parazitární infekce je extrémně důležitá přesná cestovatelská anamnéza. Netýká se to jen cest mimo kontinent, ale i v Evropě jsou endemické oblasti pro určité parazitární choroby. Např. v některých přímořských zemích Evropy (Nizozemsko, Bretaň, Skotsko, Německo, Belgie a Dánsko) lze při konzumaci nevařených mořských ryb získat parazitární infekci nazývanou anisakóza (Anisaka simplex). Ve Francii lze získat při konzumaci salátu z řeřišnice potoční helmintózu vyvolanou motolicí Faciola hepatica.
Proto je konzultace odborného parazitologa vhodná u všech pacientů s eozinofilií, kteří se v předchozí době pohybovali mimo rámec naší malé republiky.
Základním vyšetřením je opakovaný odběr stolice na vyšetření přítomnosti vajíček helmintů či jejich částí. Dále se vyšetřuje krev na sérologický průkaz titru protilátek proti nejčastějším nebo z anamnézy suspektním parazitům. Výjimečně se vyšetřuje moč a případně tkáňová biopsie. V určitých případech jsou přínosem také zobrazovací metody, např. ultrazvuk a CT v diagnostice echinokokózy.
Rozsah sérologického vyšetření člověka, který neopustil naši republiku, by měl zahrnovat: larvární toxokarózu, trichinelózu, hidatidózu (echinokózu) a při nejasných kožních příznacích lze prokazovat sérologicky cerkáriovou dermatitidu způsobenou ptačími motolicemi. Ta má však jen kožní příznaky. V případě, že vyšetřovaný pacient cestoval, je vhodné na žádanku vypsat data a místa pobytu nebo přímo s parazitologem domluvit rozsah požadovaných sérologických vyšetření.
Neparazitární infekce
Fungální infekce, hlavně kokcidiomykóza a aspergilóza, může způsobit eozinofilii. Eozinofilie může být patrná i v některé fázi infekční nemoci (nejčastěji při brucelóze, mykobakteriální infekci a chlamydiální pneumonii). U záškrtu dosahuje počet eozinofilů maxima ve 3. týdnu a pak se rychle snižuje.
U pacientů s eozinofilií na podkladě alergické reakce způsobí akutní bakteriální nebo virová infekce pokles počtu eozinofilů.
Alergické choroby
V průmyslových zemích jsou alergie nejčastější příčinou eozinofilie (senná rýma, alergická rýma, astma, reakce na léky či jiné látky). Tyto alergie však způsobují nejčastěji jen mírný (0,5–0,7 × 109/l), výjimečně střední vzestup počtu eozinofilů.
Alergická rýma
Je nejčastější příčinou mírné eozinofilie. Pacienti jsou si vědomi sezónnosti potíží. Počet eozinofilů v krvi odpovídá závažnosti potíží. Vyšetření nosního sekretu a biopsie nosní sliznice (časté polypy) prokáže eozinofilní infiltraci.
Astma
U většiny pacientů s astmatem dochází občas k vzestupu počtu eozinofilů, ať je příčina astmatu jakákoliv. Eozinofilie je však obvykle nízká, kolem 0,8 × 109/l. U pacientů, jejichž astma je vyvoláváno zevními látkami organického charakteru (rizikové pracovní provozy), je eozinofilie obzvláště častá.
Pozor, pokud u pacienta s astmatem přesáhne počet eozinofilů hranici 1,5 × 109/l, je nutné podrobnější vyšetření s cílem vyloučit alergickou bronchopulmonální aspergilózu nebo Churg-Straussův syndrom.
Eozinofilní cystitis
Je velmi vzácnou jednotkou, nejčastěji alergického původu, způsobující dysurii, hematurii, suprapubickou bolest a někdy retenci moče. Často se dává do souvislosti s exogenními příčinami a i s lékovou alergií.
Léková alergie, lékový hypersenzitivní syndrom (drug rash with eosinophilia and systemic symptomes – DRESS syndrome)
Léky mohou pro některé pacienty představovat alergeny a iniciovat velmi pestrou škálu různých nežádoucích projevů. Naštěstí tyto reakce nejsou časté, incidence eozinofilií způsobených lékovou alergií je menší než 0,1 %, ačkoliv vybraná léčiva mohou způsobovat eozinofilii poměrně často (preparáty zlata, hydantoináty). Formy lékových alergických reakcí demonstruje tab. 4.
4. Léky způsobené alergické reakce s eozinofilií a jejich nejčastější příčiny. Podle [37– 38]. ![Léky způsobené alergické reakce s eozinofilií a jejich nejčastější příčiny. Podle [37– 38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/df79c83387615d750276f092e2e64c36.jpeg)
Eozinofilie byla popsána po četných lécích: antibiotika, antituberkulotika, antimykotika, antiflogistika, antipsychotické léky, fenotiaziny, chlorpromazin, antiepileptika, hydantoináty, barbituráty, antidiabetika, antikoagulancia a protinádorové léky. Dále uvádí literatura také allopurinol, halotan i metyldopu jako příčinu eozinofilie. Z cytostatik vyvolává eozinofilii převážně jen fludarabin nebo cladribin. Mezi uvedenými léčivy, které vyvolávají eozinofilii, není patrná jakákoliv podobnost.
Incidence lékové eozinofilie není vyšší u pacientů s alergií či s familiárním výskytem atopických chorob, ale je vyšší u pacientů s nedostatečnou funkcí jater či ledvin, podobně jako je tomu u pomalých alkylátorů.
Nejčastějšími reakcemi doprovázejícími lékovou alergickou reakci je kožní raš, makulopapulózní exantém, výjimečně jiná forma postižení kůže až exfoliativní dermatitis a často teplota s bolestmi kloubů a svalů. Méně častá je hmatná lymfadenopatie. Výrazná lymfadenopatie (nazývané též pseudolymfom) je nejčastěji popisována po antikonvulzivech. V některých případech odpovídal histologický obraz extirpovaných uzlin premaligním změnám a také lze najít popisy případů, kdy lymfadenopatie po antikonvulzivech přešla v maligní lymfoproliferaci. Dále bylo v rámci lékové alergie popsáno poškození jater, ledvin, srdce nebo plic, někdy následované úmrtím pacienta. Jiné prameny uvádějí, že pokud dojde k poškození vnitřních orgánů, zejména jater, tak se mortalita tohoto DRESS syndromu pohybuje kolem 40 %. Paradoxní je, že po allopurinolu, který má snižovat koncentraci kyseliny močové v séru, a tedy chránit ledviny před urátovou litiázou, bylo popsáno těžké poškození ledvin se závažnou renální insuficiencí a erytrodermií. Allopurinol má relativně široké spektrum projevů hypersenzitivních reakcí, jak uvádí Raymond.
Interval mezi zahájením užívání léku a vznikem polékové alergické reakce je nejčastěji 2–6 týdnů. V některých případech byl tento interval delší a dosahoval až 3 měsíců. Pokud je lék příčinou eozinofilie, vysazení léku navodí ústup potíží. Pokud však tato poléková alergie již vyvolala závažnější klinické problémy, je nutné ústup potíží urychlit přidáním glukokortikosteroidů. Počet eozinofilů se může po vysazení léku normalizovat řádově ve dnech až týdnech. V literatuře lze však najít popisy případů s výraznými kožními projevy a s poškozením ledvin dávané do souvislosti s allopurinolem, u nichž se ještě po 100 dnech počet eozinofilů nenormalizoval i přes trvající glukokortikoidní léčbu, byť se jejich počet po aplikaci glukokortikoidů výrazně zmenšil. Lze z toho usoudit, že léky mohou někdy indukovat dlouhodobější zvýšení specifické T buněčné populace, která nevymizí ihned s vysazením léků, a kdy eozinofilie tedy přetrvává déle.
Pokud je požadován průkaz etiologické souvislosti, je možné souvislost mezi lékem a eozinofilií prokázat obnovením podávání léku. Eozinofilie nebo jiné formy alergické reakce se v tomto případě objeví do 10 dnů.
Vzhledem k tomu, že klinický obraz polékových alergických reakcí je velmi pestrý, je navržen termín lékový hypersenzitivní syndrom (drug hypersensitivity syndrome) nebo též léková kožní reakce s eozinofilií a systémovými příznaky (drug rash with eosinophilia and systemic symptoms – DRESS syndrome) pro celé spektrum těchto problémů. Jeho kritéria uvádí tab. 5.
5. Kritéria lékového hypersenzitivního syndromu a jeho diferenciálně diagnostické možnosti. Podle [39]. ![Kritéria lékového hypersenzitivního syndromu a jeho diferenciálně diagnostické možnosti. Podle [39].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8d45b11b66791ca428a4afbd3882d04b.jpeg)
Eozinofilní syndromy s plicní manifestací a další plicní choroby
Pulmonální eozinofilní stavy jsou charakterizovány plicními ložisky tvořenými eozinofilními infiltráty. Tato plicní eozinofilní ložiska mohou, ale nemusí být provázena vaskulitidou.
Kombinace eozinofilie provázené respiračními příznaky, často astmatického charakteru, představuje spolu s plicními infiltráty nevelké spektrum nozologických jednotek, které jsou zahrnovány do kategorie plicních eozinofilních syndromů, shrnutých do tab. 6. Popisy respiračních chorob provázených eozinofilií se překrývají s alergickými příčinami, neboť mezi nimi není ostré hranice. Eozinofilní syndromy s plicní manifestací představují zatím neúplně vysvětlené změny, kdy zdánlivě nepříbuzné příčiny způsobují eozinofilii. Typickými a nejznámějšími jednotkami je Löfflerův syndrom, alergická bronchopulmonální aspergilóza, chronická eozinofilní pneumonie, akutní eozinofilní pneumonie a alergická granulomatózní vaskultitida (angiitis), zvaná též Churg Straussův syndrom.
6. Plicní eozinofilní syndromy. Podle [37– 38]. ![Plicní eozinofilní syndromy. Podle [37– 38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/dfd1e369f420041308f3ef6c2b495ec5.jpeg)
Löfflerův syndrom
Löfflerův syndrom představuje přechodné, samoustupující onemocněnís plicními infiltráty a eozinofilií u asymptomatických či minimálně symptomatických pacientů. Toto onemocnění mizí řádově v týdnech. Löfflerův syndrom má obvykle zevní příčiny, nejčastěji parazity migrující přes plicní parenchym (Ascaris lumbricoides, Strongyloides stercoralis, Toxocara canis, Toxocara cati) nebo některé léky či chemikálie. Krátké trvání (< 6 měsíců) Löfflerova syndromu jej obvykle odliší od idiopatického hypereozinofilního syndromu.
Alergická bronchopulmonální aspergilóza
Alergická bronchopulmonální aspergilóza musí být odlišena od astmatu. Charakteristické jsou pro ni infiltráty patrné na RTG snímku plic, okamžitá kožní hypersenzitivní reakce na antigeny z mikroba Aspergilus fumigatus, zvýšené sérové koncentrace IgE, přítomnost precipitujících protilátek a případné bronchiektazie. Tato mykotická choroba může také způsobovat eozinofilii > 0,7 × 109/l, ale jen u 20 % těchto pacientů přesahují eozinofily hodnotu 1,5 × 109/l.
Churg-Straussův syndrom
U nekomplikovaného astmatu jen zcela, ale zcela výjimečně přesahuje počet eozinofilů 2 × 109/l. Vyšší počet eozinofilů spojený se zhoršením plicních funkcí může ohlašovat nejen výše uvedenou alergickou bronchopulmonální aspergilózu, ale také Churg-Straussův syndrom, zvaný též alergická granulomatózní vaskulitida (angiitis).
Churg Straussův syndrom je považován též za variantní formu polyarteritis nodosa. Je charakterizován plicními infiltráty s eozinofilí a systémovou vaskulitidou. Často předcházejí sinusitidy a astmatické potíže. Nejvýraznější abnormalitou Churg-Straussova syndromu je výrazná eozinofilie, která často přesahuje 5 × 109/l eozinofilů. Pacienti mívají závažné projevy astmatu, v 10 % problémy s paranazálními dutinami a také poškození 2 či více mimoplicních orgánů na podkladě vaskulitidy. Nejčastěji se jedná o mononeuropatii nebo polyneuropatii, ale může jít také o postižení gastrointestinálního traktu vaskulitickými změnami připomínajícími projevy eozinofilní gastroenteritidy.
Stanovení diagnózy Churg-Straussova syndromu není jednoduché, a proto je vhodné držet se publikovaných diagnostických kritérií (tab. 7). Churg Straussův syndrom lze diagnostikovat na základně klinických nálezů, jeho potvrzení biopsií se však považuje za neopominutelné. Histologický obraz zahrnuje nekrotizující vaskulitidu malých arterií a vén s extravaskulárními granulomy.
7. Diagnostická kritéria Churg-Straussova syndromu. Podle [40]. ![Diagnostická kritéria Churg-Straussova syndromu. Podle [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2ba42d7d6b15e9ed5443c7405513b7e6.jpeg)
V rámci diferenciální diagnostiky Churg-Strassova syndromu je nutno uvést, že u některých pacientů jej nelze odlišit od idiopatického hypereozinofilního syndromu.
Podobný plicní obraz jako Churg--Straussův syndrom může způsobit také Wegenerova granulomatóza s vysokým titrem antineutrofilním cytoplazmatických protilátek (ANCA), ta je však eozinofilií provázena jen výjimečně. Naproti tomu eozinofilie velmi často provází tzv. „polyangiitis overlap syndrom with eosinophilia“ neboli smíšený polyangiitický syndrom s eozinofilií, který se dominantně projevuje vaskulitidou v různých částech těla. Do této jednotky by bylo možné zařadit také publikované případy eozinofilní vaskulitidy s kožními projevy, bez projevů plicních.
Churg Straussův syndrom se léčí glukokortikoidy. Byly popsány případy nedostatečně reagující na glukokortikoidy, u nichž došlo k zásadnímu zlepšení po aplikaci interferonu a. Prognóza pacientů s neléčeným Churg Straussovým syndrom je fatální.
Chronická plicní eozinofilní pneumonie
U některých pacientů s eozinofilií a plicními infiltráty se nenalezne žádná vyvolávající příčina. Mnoho těchto případů je řazeno do kategorie chronické plicní eozinofilní pneumonie. Její příčina je neznámá. Na RTG snímku plic jsou patrné periferní infiltráty, které byly popsány jako fotografický negativ snímku plicního edému. Tento nález je spolu s nálezem eozinofilie a dobrou léčebnou odpovědí na glukokortikosteroidy dostatečným kritériem pro tuto jednotku.
Chronické i akutní eozinofilní pneumonie jsou nepravidelně provázeny zvýšeným počtem eozinofilů nad hodnotu 1,5 × 109/l. Eozinofilie v periferní krvi je pouze malé kritérium eozinofilní pneumonie. Velká kritéria této choroby jsou odvozena od postižení plicního parenchymu, jde o kašel, horečku, dušnost, RTG patrné zastínění způsobené plicními infiltráty. Pro stanovení diagnózy je zásadní průkaz eozinofilních krvinek v těchto infiltrátech pomocí bronchoalveolární laváže. Tuto jednotku lze také považovat za prognosticky příznivý eozinofilní syndrom.
Akutní eozinofilní pneumonie
Akutní eozinofilní pneumonie je vzácná choroba s akutním horečnatým průběhem s masivními eozinofilními plicními infiltráty, ale nezvýšeným počtem eozinofilů v periferní krvi. Její diagnózu lze stanovit opět z bronchoalveolární laváže.
Maligní choroby
Mnoho maligních chorob je provázeno mírným vzestupem počtu eozinofilů a většina pacientů s tímto nálezem má již metastázy a špatnou prognózu. Eozinofilie asociovaná s maligními chorobami je jen výjimečně výrazná. Nejčastěji je nalézána u pacientů s plicními tumory nebo hematologickými chorobami (Hodgkinův lymfom, nehodgkinské lymfomy, obzvláště T typu, akutní lymfatická leukemie). Eozinofilie dále provází metastatické nebo nekrotické solidní karcinomy (uteru, cervixu, tlustého střeva, plic či štítné žlázy). Počet eozinofilů doprovázejících maligní onemocnění může stoupat a klesat v závislosti na průběhu nemoci. V případech maligních lymfoproliferativních onemocnění může eozinofilie předcházet roky jejich manifestaci. Po úspěšné léčbě maligního lymfoproliferativního onemocnění může eozinofilie vymizet a relabovat řádově měsíce před zřetelným relapsem maligní choroby.
Další stavy spojené s eozinofilií
Mezi eozinofilní syndromy ne zcela jasné etiologie, ale pravděpodobně související s T buněčnou imunitní odpovědí, patří následující choroby:
- idiopatický epizodický angioedém s eozinofilií
- hypereozinofilní dermatitis
- eozinofilní celulitida (Wellsův syndrom)
- eozinofilní myositidy
- eozinofilní fascitida
- eozinofilní gastroenteritidy
- eozinofilní pneumonie
Tyto relativně benigní nemoci s eozinofilií obvykle poškozují jen jeden orgán a počet eozinofilů v krvi může a nemusí být zvýšený.
Eozinofilní kožní syndromy a další kožní choroby
Kožní choroby, které by provázela výrazná eozinofilie, jsou vzácné. Atopická dermatitida, eozinofilní celulitida, pemphigoid, dermatitis herpetiformis a psoriáza mohou být spojené s eozinofilií. Může jít také o epizodický angioedém s eozinofilií a s urtikou. Bulózní pemphigoid může být rovněž provázen eozinofilií. Dále také některé vzácné kožní choroby (vaskulitis a granulomatózní choroby) mohou být provázeny hypereozinofilií a eozinofilní kožní infiltrací.
Eozinofilní celulitis (Wellsův syndrom)
Eozinofilní celulitis (Wellsův syndrom) je vzácná kožní choroba z kategorie prognosticky příznivých eozinofilních syndromů, která je v 50 % případů provázena také výraznou eozinofilií. Wellsův syndrom se projevuje postižením kůže a podkoží formou podobající se flegmóně. Kožní projevy začínají pruritem, následuje zarudnutí a kopřivkové morfy, které přecházejí ve velké erytematózní plochy. Morfy postupně mění barvy ze světle červené do červenohnědé. Histologické vyšetření prokáže infiltraci koria lymfocyty a granulocyty, mezi nimiž převažují eozinofily.
Podobně jako u idiopatického hypereozinofilního syndromu byly i u pacientů s eozinofilní celulitidou popsány atypické klonální populace T lymfocytů a zvýšená koncentrace interleukinu-5 v séru.
Eozinofilní celulitis (Wellsův syndrom) se léčí glukokortikosteroidy, případně Dapsonem.
Revmatoidní artitida a jiné kolagenní choroby
V případě revmatoidní artritidy se eozinofilie vyskytuje jen u pacientů s těžkým průběhem a závažnými komplikacemi (pleurálním a perikardiálním výpotkem). Výrazná eozinofilie je spíše výjimečným doprovodným příznakem revmatoidních chorob.
Speciální eozinofilní syndromy s infiltrací pohybového aparátu eozinofily
V literatuře jsou popsány četné speciální a velmi vzácné syndromy, jejichž podstatou je infiltrace některé části pohybového aparátu eozinofily s následujícím poškozením. Jak bylo uvedeno výše, pokud infiltrace postihuje pouze jeden typ tkáně, jsou tyto nemoci řazeny do prognosticky příznivějších eozinofilních syndromů. U většiny těchto jednotek není známa vyvolávající příčina. Důležité je odlišit tyto eozinofilní myopatie od běžnějších zánětlivých chorob pojiva, jako je polymyositis, dermatomyositis a systémový lupus erytematodes.
Odborná literatura popisuje tzv. eozinofilní myopatii, kterou člení na 3 podtypy, fokální eozinofilní myositis, eozinofilní polymyositis a eozinofilní perimyositis. Podstatou všech těchto chorob je zánětlivá infiltrace uvedených tkání s převahou eozinofilů. Projevuje se abnormalitami elektromyografické křivky, zvýšením aktivity kreatinfosfokinázy v séru a různě intenzivně vyjádřenou eosinofilií. V některých případech eozinofilní polymyositidy je normální počet eozinofilů v periferní krvi.
Syndrom eozinofilní fasciitidy (Schulmanův syndrom) je příbuzný sklerodermii, které se značně podobá makroskopickým postižením kůže a podkoží a odlišuje se eozinofilií, infiltrací podkoží eozinofily a přítomností hypergamaglobulinemie. Někteří autoři jej označují jako variantu sklerodermie bez Raynnaudova fenoménu a bez viscerálního postižení. Histologické vyšetření tkáně prokáže eozinofilní infiltraci fascie, která může přesahovat i na sval. Počet eozinofilů v periferní krvi nemusí být u eozinofilní fascitidy vysoký, pouze 15 % postižených má počet eozinofilů nad hranicí hypereozinofilního syndromu. Choroba odpovídá na kombinovanou léčbu glukokortikoidy a imunosupresivy, např. cyklofosfamidem.
Kimurova choroba je podobné onemocnění mladých mužů. Projevuje se podkožními infiltráty v oblasti hlavy a krku a je spojena s regionální lymfadenopatií. Histologický obraz zahrnuje folikulární hyperplazii a eozinofilní infiltráty.
Wellsův syndrom je charakterizován edametozními zarudlými plaky, které velmi svědí.
Omennův syndrom je forma kombinovaného imunodeficitu s vysokou mortalitou. Projevuje se u dětí rašem, hepatosplenomegalií a lymfadenopatií. Dále se objevují časté infekce a alopecie. Tato forma nemoci je bez alogenní transplantace fatální.
Dále veškeré autoimunitní nemoci pojiva mohou být provázeny eozinofií (lupus erytematodes, polyartritis nodosa, sklerodermie) a také sarkoidózou.
Eozinofilní syndromy s manifestací v oblasti zažívacího traktu a autoimunitní choroby střeva
Z klasických autoimunitních střevních chorob může někdy Crohnova choroba a ulcerózní kolitida způsobovat mírnou eozinofilii.
Nápadná eozinofilie se objevuje o osob s eozinofilní gastroenteritidou, často provázenou atopickou anamnézou. Eozinofilní gastroenteritida může být součástí multisystémového a prognosticky nepříznivého idiopatického hypereozinofilního syndromu, nebo může být samostatnou, prognosticky příznivější jednotkou. Etiopatogenetickým mechanizmem je infiltrace gastrointestinálního traktu eozinofily. Eozinofilní gastroenteritida může způsobit abdominální bolesti bez průjmů a bez obstrukčních příznaků. Závažnější stavy provází nevolnost, zvracení, křeče, bolesti kolem pupku, malabsorpce a obstrukce. Eozinofilní gastroenteritida může způsobit i akutní příhodu břišní a vést k probatorní laparotomii.
Eozinofilní gastroenteritis se dělí na 3 podtypy. Mukózní podtyp se projevuje průjmy, ztrátou bílkovin, anémií a malabsopcí. Subtyp s infiltrací muscularis mucosae se může projevit obstrukcí až ileózním stavem. Nejvzácnější je subserózní forma, která způsobuje ascites a difuzní bolesti břicha. U tohoto posledního subtypu jsou popisovány nejvyšší počty eozinofilů v krvi.
Eozinofilní gastroenteritidu lze diagnostikovat jedině histologickým vyšetřením biopsie z patologicky změněné části trávicí trubice. Histologie prokáže eozinofilní infiltraci. Postiženou část trávicí trubice, vhodnou k bioptickému vyšetření, lze znázornit radiografickým vyšetřením. To může prokázat granulomy nebo rigiditu stěny. Pomoci může i endosonografie. Zvýšený počet eozinofilů v krvi může provázet tuto jednotku, není však podmínkou, podobně jako u eozinofilní fasciitidy (Schulmanova syndromu). Samostatná eozinofilní gastroenteritis obvykle dobře reaguje na glukokortikoidy.
V rámci diferenciální diagnózy abdominálních bolestí se zvýšeným počtem eozinofilů v periferní krvi připadá v úvahu také vaskulitida (Churg Straussův syndrom, polyarteritis nodosa), ulcerózní kolitida, Crohnova choroba, kolagenní choroby (systémová skleróza, dermatomyositida, polymyositida), mastocytóza, maligní lymfomy a adenokarcinomy zažívacího traktu, potravinová alergie.
Eozinofilní syndromy související s toxickou stravou
Zvláštním případem byla epidemie syndromu toxického oleje, která postihla 19 000 španělských konzumentů stolního oleje kontaminovaného denaturovaným řepkovým olejem a způsobila 315 úmrtí. Tento syndrom se také projevoval eozinofilií, generalizovanou lymfadenopatií, plicními infiltráty, postižením svalů a zažívacího traktu.
S konzumací závadné potravy je také spojen syndrom eozinofilie-myalgie související s L-tryptofanem, který mimo eozinofilii způsobuje rovněž myalgie, neuropatie a dlouhodobou svalovou slabost.
Imunologické příčiny eozinofilie
Imunologické příčiny eozinofilie zahrnují hyper IgE syndrom, izolovaný deficit IgA, Wiskott-Aldrichův syndrom, systémový lupus erytematodes a další kolagenní choroby.
Hypereozinofilní syndrom způsobený T lymfocyty
T lymfocyty způsobují všechny reaktivní eozinofilie. V některých případech známe příčinu a pak je eozinofilie klasifikována dle této příčiny (léky, paraziti apod.), nebo příčinu neznáme a pak jednotka spadá to kategorie idiopatického hypereozinofilního syndromu, pokud splňuje jeho kritéria uvedená výše. Morfologie eozinofilů odpovídá zralým buňkám, ale může však i zde docházet ke vzniku morfologických odchylek, které jsou způsobeny zvýšenou koncentrací některých cytokinů (interleukinu-3), a proto nelze morfologické odchylky hodnotit jako průkaz klonálního leukemického vzniku eozinofilů.
Na hypereozinofilní syndrom mediovaný T lymfocyty lze usuzovat v případech neprokázané klonální eozinofilie, nebo při prokázané klonální populaci T lymfocytů. Někdy lze nalézt v periferní krvi klonální populaci aberantního klonu (CD 3–, CD4+, CD8–) nebo (CD3+, CD4–, CD8–), případně jen (CD3–, CD4+) nebo (CD3+, CD4–) T-buněk produkujících vysoké koncentrace výše uvedených interleukinů, signalizujících Th2 profil těchto buněk. Uvedené dvojitě negativní (CD3+, CD4–, CD8–) buňky se fyziologicky nalézají mezi nezralými thymocyty a tvoří nepatrný zlomek z cirkulujících lymfocytů. Buňky typu CD3–, CD4+ nemají fyziologický protějšek. Dalším typem T-buněk provázejícím eozinofilii jsou T-buňky (CD3+) exprimující aktivační marker CD25 a současně ještě další dva povrchové znaky, CD16 a CD56, což jsou znaky NK buněk, které se běžně nenacházejí na T-buňkách. U pacienta s eozinofilní celulitidou bylo detekováno zvýšení počtu (CD3+, CD4+) buněk.
Další metoda identifikace klonality T lymfocytů je průkaz rearanžování informace pro T buněčné receptory.
Pacienti s hypereozinofilií způsobenou T lymfocyty mají častěji vysokou koncentraci imunoglobulinu IgE a polyklonální hypergamaglobulinemii.
Zvýšené IgE je slabým pozitivním prognostickým faktorem. Pacienti se zvýšeným IgE mívají častěji benigní průběh než pacienti s nezvýšeným IgE, i když to neplatí absolutně. Eozinofilie je v případě zvýšeného IgE spojena častěji s reakcí na neznámý antigen, tedy mediovaná T lymfocyty, a tedy příznivější než v případech klonální leukemické eozinofilie. Skupina pacientů s idiopatickou eozinofilií a zvýšeným IgE má často klinické příznaky omezené pouze na kůži (pruritus, urtika) a jejich onemocnění dobře reaguje na glukokortikoidy.
Polyklonální eozinofilie následkem proliferace určitého typu T-buněk(Th2 lymfocytů), které produkují interleukin 5 a některé další cytokiny, je druhým etiopatogenetickým mechanizmem eozinofilie. Interleukin 5 specificky stimuluje proliferaci a diferenciaci buněk eozinofilní řady a inhibuje jejich apoptotický zánik. Zvýšená produkce interleukinu-5 Th2 lymfocyty byla opakovaně prokázána v četných případech eozinofilie, včetně parazitárních i alergických nemocí a Omennova syndromu. Th2 buňky také zvýšeně produkují Il-4 a Il-13, které jsou zodpovědné za hyperprodukci imunoglobulinu IgE. Výsledkem je vzestup počtu polyklonálních eozinofilů.
Za fyziologických okolností dochází k této T lymfocyty mediované eozinofilii při parazitárních infekcích. Za patologických okolností dochází k této reakci u alergických stavů, autoimunitních onemocnění a nakonec i u maligních lymfomů, obzvláště T typu.
Příčiny, které směrují eozinofily do určitých tkání, které po aktivaci poškozují, zatím zůstávají neobjasněny.
Obecně nutno podtrhnout, že identifikace atypické T buněčné populace u pacientů s eozinofilií ještě neznamená diagnózu maligního lymfomu, ale může jeho vzniku o několik let předcházet, stejně jako může předcházet vývoji myelodysplastického syndromu.
Klonální eozinofilie
Eozinofilní myeloproliferace spojené s přestavbou genu PDGFRA
Eozinofilie je primární či sekundární proces. Primární eozinofilní myeloproliferace lze rozdělit do skupin klonální eozinofilie s přítomností či nepřítomností typické cytogenetické abnormality či jiné histologicky definované nemoci, s níž kauzálně souvisí. Eozinofilie může dále provázet četné další choroby: akutní leukemie, CML, MDS, klasické i atypické myeloproliferativní poruchy.
Z atypických myeloproliferativních chorob může být eozinofilie přítomna u chronické eozinofilní leukemie, dále u systémové mastocytózy, chronické myelomonocytární leukemie a u neklasifikované myeloproliferativní choroby.
Klinické výzkumy z poslední let odhalily souvislost mezi mutací genů pro tzv. platelet derived growth factor receptor α (PDGFRA) a β (PDGFRB) a klonální eozinofilií. Klinickými projevy se tyto případy eozinofilie podobaly projevům molekulárně nedefinovanému hypereozinofilnímu syndromu, systémové mastocytóze nebo chronické eozinofilní leukemii či chronické myelomonocytární leukemii, případně neklasifikované myeloproliferativní chorobě. Z klinického průběhu nelze tedy na přítomnost mutace PDGFRA usuzovat.
To může souviset i s tím, že existuje více variant aktivujících mutací PDGFRA. Gen PDGFRA kóduje tyrozinkinázový receptor PDGFRA a je lokalizován na chromozomu 4 v pozici q12. Jako první byla popsána translokace t(1;4)(q44;q12), která má za následek fúzi genu PDGFRA s genem FIP1L1 za vzniku fúzního genu FIP1L1-PDGFRA. K aktivaci PDGFRA může dojít také v důsledku dalších chromozomálních translokací. Např. t(4;22)(q12;q11), která má za následek vznik fúzního genu BCR/PDGFRA. Postupně byly rozeznávány další geny, které po fúzi s genem PDGFRA jsou zřejmě zodpovědné za vznik hypereozinofilního syndromu – chronické eozinofilní leukemie citlivé na léčbu imatinibem. V současnosti je známo celkem 6 různých fúzních partnerů genu PDGFRA. Vedle již zmíněných FIP1L1 a BCR jsou to KIF5B, CDK5RAP2 a nejnověji také STRN lokalizovaný v pozici 2p22 a gen ETV6 lokalizovaný v pozici 12p13.
Každá z výše uvedených cest, které vedou k mutaci genu PDGFRA, vede k tvorbě konstitutivně aktivované tyrozinkinázy, která má potenciál transformovat hemopoetickou buňku. Tato tyrozinkináza indukovala v pokusu na zvířeti myeloproliferativní chorobu.
Fúzní gen FIP1L1 byl nalezen asi u 12–14 % všech pacientů s eozinofilií, většinou u mužů, incidence dalších fúzních genů není zatím doložena.
Vzhledem k tomu, že tyto molekulárně definované případy eozinofilie měly současně histologický obraz odpovídající systémové mastocytóze, navrhl v roce 2006 Tefferi pro tuto jednotku termín FIP1L1-PDGFRA pozitivní systémová mastocytóza – chronická eozinofilní leukemie.
Vyšetření fúzního genu FIP1L1-PDGFRA se považuje za vhodné u všech nemocných s eozinofilií při myeloproliferativní chorobě.
Detekovat fúzní gen FIP1L1-PDGFRA není však možné pomocí klasické cytogeneticky, je zapotřebí použít metodu FISH nebo metody PCR.
Důležitým znakem této nemoci je excelentní senzitivita na léčbu imatinibem. Někdy jsou dostačující nízké dávky imatinibu, jen 100 mg denně. Léčba imatinibem je v případě eozinofilie s uvedenými genovými přestavbami doporučována i v případě, že nejsou vyvinuty symptomy nemoci, neboť má potenciál zabránit následných kardiovaskulárním změnám.
Klinický průběh: odpovídá systémové mastocytóze – chronické eozinofilní leukemii, neboli též klasické dříve popisované myeloidní variantě hypereozinofilního syndromu.
Léčba: v případě pozitivity FIL1L1--PDGFRA je lékem volby imatinib, který má potenciál v dávkách 100–400 mg denně navodit kompletní remisi. Podobných výsledků léčby bylo dosaženo i tehdy, pokud fúzním partnerem genu PDGFRA v translokaci byl na místo FIP1L1 některý z genů BCR, KIF5B, CDK5RAP2, STRN nebo ETV6.
Musíme upozornit, že v několika výjimečných případech s klinickými příznaky bylo zahájení léčby imatinibem provázeno šokovým stavem. Lze mu předcházet systémovým podáním glukokortikoidů 1 mg/kg v průběhu iniciálních 1–2 týdnů.
Eozinofilní myeloproliferace spojená s přestavbou genu PDGFRB
Gen PDGFRB je lokalizován na chromozomu 5, v oblasti 5q33. K jeho aktivaci dochází různými chromozomálními translokacemi, např. t(5;12)(q33;p13), která vede ke vzniku fúzního genu ETV6-PDGFRB. Popsáno bylo dalších 8 genů, které mohou být fúzními partnery genu PDGFR v translokaci. Důsledkem translokace t(5;12)(q33;p13) je relativně vzácná myeloproliferativní choroba s eozinofilií, která postihuje dominantně muže. Počty eozinofilů bývají poměrně vysoké a někdy je zvýšen i počet monocytů v periferní krvi.
Klinický průběh: odpovídá chronické myelomonocytární myeloproliferaci nebo chronické eozinofilní leukemii, neboli též atypické CML či hybridnímu onemocnění typu MPD/MDS s eozinofilií.
Léčba: také u této myeloproliferace je účinný imatinib, v popsaných případech byla použita dávka 400 mg imatinibu denně.
Diagnózu lze stanovit na základě průkazu přestavby genu PDGFRB.
Eozinofilní myeloproliferativní syndrom 8p11, synonymem FGFR1 eozinofilní myeloproliferativní syndrom
Myeloproliferativní syndrom 8p11 je známý pod označením human stem cell leukemie/lymphoma syndrome. Je asociován s mutací receptoru 1 fibroblastového růstového faktoru (fibroblast growth factor receptor-1 – FGFR-1). Obvyklým typem mutace jsou translokace postihující chromozom 8 v oblasti 8p11 a mnoho různých partnerských chromozomů. Výsledkem translokací je juxtapozice tyrozinkinázové domény receptoru FGFR1, která má vždy za následek konstitutivní aktivaci této kinázy.
Klinický průběh: klinicky se tato myeloproliferace projevuje eozinofilií, myeloproliferativními a myelodysplastickými znaky, lymfadenopatií, zvýšeným výskytem současného maligního T lymfomu. Nemoc má agresivní dvojfázový průběh. Relativně krátká chronická fáze je následována transformací do akutní myeloidní leukemie s velmi agresivním průběhem. Translokace 8p11 je přítomna jak v myeloidní, tak v lymfatické linii.
Léčba: imatinib u této formy myeloproliferace není účinný, vzhledem ke špatné prognóze se zde doporučuje alogenní transplantace kostní dřeně.
Systémová mastocytóza s mutací genu KIT
Systémová mastocytóza je klonální poruchou pluripotentní krvetvorné buňky, která je charakterizována kožním nálezem typu urtica pigmentosa, a symptomy, které vznikají na základě uvolnění mediátorů z mastocytů: průjem, urtika, pruritus, flush, synkopy, osteoporóza, hepatosplenomegalie, ascites a cytopenie.
Patogeneze souvisí s mutací nejméně dvou genů, KIT a PDGFRA. Nejvíce případů molekulárně definované systémové mastocytózy je spojeno s aktivující mutací genu KIT. Mutace nejčastěji zasahují juxtamembránovou nebo transmembránovou doménu receptoru KIT.
Rozpoznání těchto mutací má terapeutické konsekvence. Standardní typ kinázy KIT je inhibován imatinibem. V důsledku aktivujících mutací genu KIT vznikají jak varianty proteinů KIT senzitivní na imanitib (např. mutant V560G), tak varianty k imanitibu rezistentní (např. mutant D816V).
Léčba: imatinib je používán jako lék první volby u systémové mastocytózy spojené s mutacemi genu PDGFRA nebo také u nonD816V mutace genu KIT. Imatinib však nemá naději na úspěch v případech s mutací D816 genu KIT. V tomto případě se používají léčebné postupy shodné s léčbou molekulárně nedefinované systémové mastocytózy.
Cytoredukční léčba interferonem α nebo 2-chlordeoxyadenosinem je doporučována pouze u agresivní formy nemoci, u indolentní formy systémové mastocytózy se nepoužívá. Je otázka, jak dalece léčebné postupy pozmění nové blokátory tyrozinkináz, dasatinib a nilotinib.
Chronická eozinofilní leukemie molekulárně nedefinovaná
Chronická eozinofilní leukemie je mye-loproliferativní onemocnění bez průkazu známé genetické aberace, nesplňující kritéria jiného myeloproliferativního onemocnění. Uvedeme jak novější definici dle Tefferiho z roku 2006, tak i WHO definici této nemoci.
Tefferi doporučuje používat tento termín pro následující případy:
- onemocnění svými klinickými projevy splňuje kritéria hypereozinofilního syndromu a cytogenetické či molekulárně biologické vyšetření potvrzuje klonální myeloproliferaci
- onemocnění svými klinickými projevy splňuje kritéria hypereozinofilního syndromu a je prokázán zvýšený počet blastů v kostní dřeni či periferní krvi
WHO definuje chronickou eozinofilní leukemii počtem eozinofilů > 1,5 × 109/la přítomností zvýšeného počtu blastův periferní krvi anebo v kostní dřeni< 20 % (tab. 8).
8. Kritéria chronické eozinofilní leukemie a hypereozinofilního syndromu dle WHO klasifikace (Jaffe 2001). 
Pacienti splňující tuto diagnózu mají často cytogenetické odchylky jiného typu, než bylo uvedeno v případech molekulárně definovaných eozinofilních myeloproliferací. Nejčastěji je v těchto případech popisována trisomie 8, translokace t(10;11)(p14;q21) a translokace t(7;12)(q11;p11). Obecně lze říci, že molekulárně nedefinovaná CEL nereaguje na imatinib a léčebné postupy jsou shodné jako u jiných myeloproliferací včetně možnosti alogenní transplantace.
Idiopatická eozinofilie a idiopatický hypereozinofilní syndrom
Definice a incidence
Termín idiopatická eozinofilie je určen pro případy zvýšeného počtu eozinofilů, u nichž nebyl prokázán klonální ani reaktivní původ.
Idiopatický hypereozinofilní syndrom je podmnožinou idiopatické eozinofilie, je charakterizován následující definicí:
- počet eozinofilů v periferní krvi je ≥ 1,5 × 109/l po dobu 6 měsíců nebo do smrti způsobené důsledky eozinofilie
- není přítomna jiná rozpoznatelná příčina hypereozinofilie
- jsou příznaky orgánového poškození, např. kardiomyopatie, hepatosplenomegalie, plicní poruchy, horečky, anémie, ale i neurologické poruchy
Incidence hypereozinofilního syndromu je poměrně malá. Chorobou průměrně ročně onemocní jeden člověk z 200 000 obyvatel. Muži jsou postiženi 9krát častěji než ženy. Nejvíce se manifestuje u lidí ve věku 20–50 let.
Termínem idiopatický říkáme, že příčina není rozpoznána. Ale – poznatky molekulární biologie odebraly mnohé případy z této skupiny nemocných a přeřadily je do skupiny molekulárně definovaných myeloproliferativních chorob, takže termín idiopatický hypereozinovilní syndrom bude používán stále méně často, neboť se budou prohlubovat možnosti etiopatogenetické a molekulárně biologické diagnostice.
Na závažnost stavu lze usuzovat z morfologie eozinofilů. Eozinofily pacientů se závažnými problémy (kardiálními) vykazují četné funkční a biochemické odchylky, které signalizují, že eozinofily jsou aktivované. Tyto změny zahrnují zvýšenou metabolickou aktivitu, sníženou denzitu, zvýšenou protilátkami mediovanou cytotoxicitu, zvýšenou tvorbu leukotrienu C4 a morfologické alterace (cytoplazmatickou vakuolizaci, změny v počtu a velikosti granulí). Míra cytoplazmatické vakuolizace a hypogranularity koreluje se závažností kardiálního poškození.
V tab. 8 uvádíme kritéria chronické eozinofilní leukemie a hypereozinofilního syndromu dle WHO klasifikace.
Příznaky hypereozinofilního syndromu
Jak jsme již uvedli v úvodu, pro idiopatický hypereozinofilní syndrom je charakteristická eozinofilie s poškozením srdce (58 %), případně mozku a periferních nervů (54 %), nebo také poškození vícerých orgánů eozinofilními infiltráty. Pokud v rámci eozinofilie dochází k poškození pouze jednoho orgánu mimo srdce a CNS, lze tento stav nazvat eozinofilním syndromem (chorobou) s poškozením jednoho orgánu. Tyto stavy jsou uvedeny výše.
Více než 1/2 pacientů s idiopatickým hypereozinofilním syndromem má některý z následujících klinických příznaků: teplota neinfekčního původu, váhový úbytek, noční pocení. Dále bývají přítomny abnormality v krevním obraze, anémie, trombocytopenie, dále morfologicky abnormální eozinofily s výraznou vakuolizací, degranulací. Jsou také zjevné morfologické odchylky jádra, buď může segmentace (lobulace) chybět, nebo naopak dochází k hypersegmentaci (hyperlobulaci). Důležitým diagnostickým znakem idiopatického hypereozinofilního syndromu je masivní infiltrace vícerých orgánů zralými eozinofily. Může být přítomna i arteriitis při histologickém vyšetření srdce, plic, mozku či ledvin. Kardiopulmonální dysfunkce je hlavní příčinou morbidity a mortality.
Dále vyjmenujeme nejčastější formy orgánového poškození při idiopatickém hypereozinofilním syndromu.
Eozinofilní endomyokardiální choroba
U idiopatického hypereozinofilního syndromu bývá srdce postiženo poměrně často. Právě poškození srdce je hlavní příčinou mortality u tohoto syndromu. K poškození srdečního svalu dochází ve 3 stadiích:
- akutní nekrotické
- pozdější trombotické
- pozdní fibrotické stadium
První zánětlivé stadium je charakterizováno eozinofilní infiltrací endomyokradu. Tromby často postihují jednotlivé cípy mitrální a trikuspidální chlopně, nacházejí se na nástěnném endokardu a v hrotu obou komor. Ovlivňují funkci cípatých chlopní tím, že mohou vést obstrukci vtoku, nebo vedou naopak ke vzniku nedomykavosti chlopně. Velmi častým nálezem je ztluštění a porucha funkce zadního cípu mitrální chlopně. Vznik endomyokardiální fibrózy je posledním stadiem poškození komor. Vede k vývoji restriktivního typu kardiomyopatie. Poškozena může být jen jedna, ale i obě dvě komory. Stažlivost komor bývá zpočátku zachována, hlavní příčina ve vzniku symptomů srdečního selhání je v odporu tuhé komory vůči plnění v diastole – vzniká obraz diastolického srdečního selhání. Při postižení levé komory dominuje plicní kongesce, vzniká významná insuficience dvojcípé chlopně, je dilatovaná levá síň. Při postižení pravé komory jsou přítomny známky městnání před pravým srdcem: hepatomegalie, ascites, otoky dolních končetin až anasarka – je přítomna významná trikuspidální insuficience a dilatovaná pravá síň. Endomyokardiální poškození nakonec vede i k selhání systolické funkce komor.
Poškození srdce se projevuje známkami srdečního selhávání nebo komplikacemi charakteru tromboembolické příhody do CNS nebo periferního řečiště. Velmi často nás na srdeční poškození upozorní i síňové arytmie, především výskyt fibrilace síní.
EKG nálezy jsou nespecifické a zahrnují inverze T vlny (35 % nálezů) a upozorní na dilataci síně (28 % nálezů). Stejně nespecifický je i RTG nález. Hlavní diagnostickou metodou je echokardiografie. Ultrazvukové abnormity zahrnují zesílení stěny komor, zhrubění endokardu, dilataci obou síní. Echokardiografie stanoví význam poškození cípatých chlopní (především nedomykavost), funkci komor. K diagnostice trombů musíme často provést jícnovou echokardiografii. Právě echokardiografické studie prokázaly, že 40–50 % pacientů s hypereozinofilním syndomem má zároveň poškození srdce.
Postižení kardiovaskulárního systému je velmi častou příčinou úmrtí, a to i v situacích, kdy je nález v periferní krvi již normalizován léčbou. Pro přesné stanovení diagnózy je nejcitlivější metodou histologické vyšetření vzorku získaného endomyokardiální biopsií. K tomuto vyšetření sáhneme v diagnostických nejasnostech. Domníváme se, že pokud je hypereozinofilní syndrom diagnostikován a echokardiograficky zjištěna restriktivní kardiomyopatie, není o vzájemné souvislosti mnoho pochyb. Echokardiografii používáme k monitorování nemocných. Obvykle opakujeme vyšetření ve 3–6měsíčních intervalech. K monitorování kardiálního poškození lze také použít sledování koncentrací troponinu T.
Vznik poškození srdce není závislý na počtu eozinofilů, vzniká pouze v případech přítomnosti degranulovaných eozinofilů s vakuolami v cirkulaci, kdy lze v séru detekovat eozinofilní kationický protein, který někteří autoři považují za spolehlivý indikátor diagnózy eozinofilní myokarditis a efektu léčby.
Léčba kardiální insuficience je symptomatická. Opírá se o podání diuretik, digitalisu, inhibitorů ACE, za přítomnosti trombů je nutná antikoagulační léčba. Chirurgický přístup spočívá v endomyokardektomii, trombektomii, případně v náhradě chlopně nebo plastice chlopně.
Je zajímavé, že podobné kardiální příznaky byly popsány při eozinofiliích, jejichž příčiny byly považovány za benigní, jako jsou parazitární choroby nebo kolagenní choroby, u nichž byly pozorovány také pleurální infiltráty a výpotky. Onemocnění srdce provázené eozinofilií je známo již více než 60 let. Bylo popsáno Löfflerem, a proto nese název Löfflerova endomyokardiální fibróza. Onemocnění je histologicky totožné s tropickou endomyokardiální fibrózou. Původně se myslelo, že jde jen o nemoc srdce, ale nyní je již zřejmé, že se jedná o projevy stejného etiopatogenetického původu.
Postižení centrálního nervového systému
Postižení nervového systému je u hypereozinofilního syndromu běžné, neboť nervový systém je v tomto případě poškozován dvojím mechanizmem:
- mikroemboly ze srdce nebo mikrotromby při hyperkoagulačním stavu
- toxickými produkty uvolňovanými z eozinofilů
Výsledkem je buď difuzní, nebo celkové poškození funkce CNS, projevující se úpadkem intelektu, zapomnětlivostí, zmateností, ataxií, encefalopatií či špatnou koordinací pohybů. U hypereozinofilie jsou popisovány i periferní neuropatie manifestující se jako senzorické deficity a bolestivé parestézie.
Tromboembolická nemoc
Pacienti s idiopatickým hypereozinofilním syndromem mají zvýšený sklon k tromboembolickým příhodám, které postihují malý i velký krevní oběh. Tromboembolické příhody jsou častou příčinou smrti nemocných s hypereozinofilií. Běžně je u těchto nemocných nutná trvalá antikoagulační léčba. Příčinou trombotických a embolizačních příhod je aktivace trombocytů proteiny uvolňovanými z granulí eozinofilů. Poruchy koagulace však mohou také vyústit v diseminovanou intravaskulární koagulaci a z toho následující koagulopatii.
Plicní projevy
Při hypereozinofilním syndromu mohou být RTG vyšetřeními odhaleny plicní infiltráty, které jsou prchavé, trvají od několika hodin do několika dní. Projevují se přechodnou dušností a suchým kašlem. Jsou vyvolány sekvestrací eozinofilů v plicní tkáni. Kombinace hypereozinofilního syndromu a astmatu nejsou časté. Plíce jsou postiženy u 40 % nemocných s hypereozinofilním syndromem.
Postižení zažívacího traktu
Hypereozinofilní syndrom bývá často provázen pocitem dyskomfortu v trávicím traktu. Jen výjimečně mají nemocní s hypereozinofilním syndromem poruchy vstřebávání a průjmy. Příčinou postižení je infiltrace trávicí trubice a zvětšení mezenteriálních uzlin, může se vyskytnout eozinofilní kolitida a gastritida. Ačkoliv játra i ledviny bývají často zvětšené, nedochází k poškození jaterních funkcí.
Postižení pohybového aparátu
Mnoho nemocných s idiopatickým hypereozinofilním syndromem si stěžuje na bolesti ve svalech a svalovou slabost. V séru mají tito pacienti zvýšenou aktivitu svalových enzymů. Při bioptickém vyšetření svalů jsou patrné eozinofilní infiltráty kolem cév. Pro tyto projevy je někdy používán termín eozinofilní myozitida. Idiopatický hypereozinofilní syndrom též někdy zasáhne klouby s kloubními pouzdry a vyvolá příznaky budící podezření na revmatologické onemocnění.
Kožní postižení
Součástí hypereozinofilního syndromu jsou změny na kůži, obvykle ve formě kopřivkového výsevu nebo různě velkých makul, papulí, a dokonce i uzlíků. Histologickým podkladem těchto kožních útvarů jsou eozinofilní infiltráty soustředěné kolem kožních cév. U nemocných s hypereozinofilií byl popsán i Raynaudův fenomén.
Postižení ledvin
Zhruba u 1/5 pacientů s hypereozinofilním syndromem se objeví proteinurie a sekundární hypertenze při postižení ledvin. Předpokládá se, že vyvolávajícím momentem je poškození ledvinných cév.
Postižení zraku
U nemocných s hypereozinofilním syndromem byly popsány suché konjuktivitidy, episkleritidy a abnormality cév sítnice. Nemocný tyto změny vnímá nejčastěji jako rozmazané vidění.
Imunologické poruchy
U pacientů s hypereozinofilním syndromem jsou zjišťovány někdy extrémně zvýšené hladiny imunoglobulinu E. Také hladiny ostatních imunoglobulinů bývají vyšší.
Vyšetřovací postup u pacientů s eozinofilií
Eozinofilie je obvykle náhodným nálezem při laboratorním vyšetření. Při novém, překvapivém zjištění zvýšeného počtu eozinofilů v periferní krvi si lékař musí položit současně 2 otázky:
- Co je příčinou eozinofilie?
- Poškozují eozinofily tkáně, či orgány?
Odpovědi na tyto otázky musí být hledány také současně. Nalezení odpovědi na první otázku může trvat několik týdnů, ne li měsíců, zatímco odpověď na druhou otázku musí být získána během velmi krátké doby.
Základní vyšetření jsme rozdělili do 2 skupin, vždy po jednom tuctu otázek. Vyšetření 1–12 pomohou hledat odpověď na první otázku. Druhý tucet vyšetření (body 13–24) informuje o případném poškození orgánu či tkáně eozinofily.
Vyšetření možných příčin eozinofilie
- 1. Sledování dynamiky výsledků diferenciálního krevního obrazu, a to jak přístrojového, tak mikroskopického. Důležité je mikroskopické hodnocení velmi zkušeným morfologem, který je schopen dobře rozeznat zralé eozinofily od nezralých a také eozinofily s projevy aktivace (degranulace, vakuolizace, snížení denzity a hypersegmentace jádra). Pokud takové hodnocení eozinofilů chceme, je nutno o to požádat zkušeného morfologa. Počty jednotlivých typů eozinofilních krvinek by se měly uvést podobným způsobem, jako se uvádí rozpočet jednotlivých buněk neutrofilní řady. Morfolog musí znát možnosti cytochemického rozlišení patologických eozinofilů od fyziologických a také tato vyšetření opakovaně provádět. Pečlivé zhodnocení morfologie eozinofilů umožňuje určit pravděpodobnost kardiotoxických změn.
- 2. Základní koagulační vyšetření včetně vyšetření hyperkoagulačního stavu a případně aktivované fibrinolýzy: PT dle Quicka, aPTT, fibrinogen, TČ, ProCglobal, lýza euglobulinového koagula a D dimery kvantitativně (DD), etanolgelifikační test, antitrombin III, antifosfolipidové protilátky.
- 3. Běžná biochemická vyšetření: CRP, urea, kreatinin, kyselina močová, ionty, bilirubin, jaterní enzymy (ALT, AST, ALP, GMT, LD) a enzymy, jejichž aktivita v krvi se zvyšuje při poškození srdce (CK, CK-MB), moč a sediment, případně podrobnější vyšetření moče (kvantitativní proteinurie, Hamburgerův sediment).
- 4. Speciální biochemická vyšetření:kvantitativní vyšetření imunoglobulinů, včetně imunoglobulinu IgE. Odborná literatura doporučuje vyšetřitkoncentraci eozinofilního kationického proteinu a koncentraci interleukinu-5 v séru. Tato poslední dvě vyšetření však u nás nejsou běžně dostupná. Zvýšená koncentrace IgE je prognosticky příznivý faktor, který snižuje pravděpodobnost eozinofilní leukemie.
- 5. Vyšetření stolice na parazity (minimálně 3 vzorky odebírané ob den). Tato vyšetření by se měla opakovat v měsíčních intervalech, neboť např. infekce škrkavkami je ve stolici prokazatelná až po několika týdnech až měsících, když hlísti po průchodu přes plíce ve střevě dospějí a začnou tvořit vajíčka.
- 6. Sérologické vyšetření na endemické parazity, které nelze diagnostikovat při vyšetření stolice. Je li první sérologické vyšetření negativní, je vhodné je opakovat po 4–6týdenní pauze, která je nutná k sérokonverzi, neboli k vytvoření protilátek v množství dostačujícím pro sérologickou diagnostiku. Pokud náhodným vyšetřením je zachycena u symptomatického člověka hypereozinofilie, může být první vyšetření protilátek negativní a teprve při opakovaném vyšetření po několika týdnech až měsících se podaří detekovat protilátky např. proti toxokaře.
- 7. Hledání souvislosti s podávanými léky. Vhodné je vysazení léků, které nejsou vitálně indikované.
- 8. Při podezření na alergickou etiologii testy na atopii s vhodným spektrem alergenů.
- 9. Pátrání po přítomnosti maligní lymfoproliferativní choroby: CT či MR zobrazení mediastinálních i abdominálních uzlin a sonografické zobrazení periferních uzlin s následujícím histologickým vyšetřením zvětšených uzlin. Důležité je flow-cytometrické vyšetření periferní krve, s jehož pomocí je možné prokázat klonální proliferaci. Při podezření na klonální lymfoproliferaci v periferní krvi pak i komplexní vyšetření kostní dřeně, zahrnující nejen cytologii a histologii, ale také imunofenotypizaci dřeňových buněk a jejich cytogenetické vyšetření. Mimo běžnou imunofenotypizaci T-buněk se dnes doporučuje analýza přestavby (rearanžování) genu pro T-buněčný receptor, která může potvrdit klonální T-buněčnou proliferaci.
- 10. Pátrání po přítomnosti myeloproliferativního onemocnění pečlivým cytologickým a flow-cytometrickým vyšetřením periferní krve i kostní dřeně. Dnes nejdůležitějším vyšetřením je cytogenetické a molekulárně biologické vyšetření, které má potenciál prokázat klonální myeloproliferaci a dále specificky prokázat přestavbu genu PDGFRA (plateled derived growht factor receptor α) a vzniku některého pro eozinfilii typického fúzního genu. Fúzní gen FIP1L1-PDGFRα (značeného též FIP1L1-PDGFRA) kóduje specifickou tyrozinovou kinázu, která má důležitou roli v patofyziologii této nemoci. Průkaz této mutace předpovídá velmi dobrou léčebnou odpověď na preparát imatinib (Glivec). Podobně i při přestavbě genu PDGFRb (PDGFRB) a KIT dochází k eozinofilii, která reaguje na imatinib.
- 11. Vyšetření přítomnosti chorob pojiva a vaskulitid: protilátky proti cytoplazmě neutrofilních leukocytů (ANCA), cirkulující imunokomplexy (CIK), C3, C4 složky komplementu, revmatoidní faktor (RF), antinukleární faktor (ANA), soubor protilátek proti extrahovatelným nukleárním antigenům (ENA). V budoucnu se možná v této indikaci budou vyšetřovat adhezivní molekuly, intracelulární a vaskulární, ICAM a VCAM.
- 12. Sérologické vyšetření na HIV (human immunodeficiency virus 1) a u lidí pobývajících v endemických oblastech humánní lymfotropní virus 1 (HTLV-1), případně humánní herpesvirus 6 (HHV6).
Vyšetření prokazující poškození orgánů (tkání) eozinofily
Mimo vyšetření srdce nelze ostatní další uvedená vyšetření považovat za obligátní, ale spíše za fakultativní, která se volí cíleně dle anamnestických potíží. Pokud vznikne podezření na poškození určitého orgánu či tkáně, je na místě nejdříve provedení zobrazovacích vyšetření a následně odebrání bioptického vzorku na histologické (případně cytologické) zhodnocení.
- 13. Za nejdůležitější považujeme ta vyšetření, která umožní včasně potvrdit či vyloučit myokardiální eozinofilní poškození, neboť jak je dále uvedeno, pouze včasná léčba může zabránit nezvratným změnám. Základem je echokardiografické vyšetření, které by se dle ostatních ukazatelů svědčících pro možnost poškození myokardu mělo opakovat v 1–6měsíčním intervalu. Vyšetřující kardiolog musí zvážit, zda provede také transezofageální echokardiografii (TEE).
- 14. Se stejným účelem se opakovaně vyšetřují kardiální enzymy, CK, CK-MB i troponin a dále AST, ALT, LD. Délka intervalů mezi vyšetřeními závisí na morfologii eozinofilů.
- 15. Doporučuje se sledování vývoje EKG křivky.
- 16. Některá zahraniční pracoviště stanovují koncentraci kationického proteinu eozinofilů v séru. Jeho přítomnost v periferní krvi koreluje se vznikem myokardiálního poškození.
- 17. Při hraničních nálezech lze provést endomyokardiální biopsii, která může jednoznačně prokázat počátek eozinofilní myokardiální choroby. Na endokardu a v myokardiálním intersticiu jsou degranulované eozinofily. Imunohistochemicky lze prokázat depozita eozinfilního kationického proteinu monoklonální protilátkou EG2 (Kabi Pharmacia Diagnostics, Tokyo), která rozeznává společný epitop eozinofilního kationického proteinu a eozinofilního proteinu-X. Vyšetření materiálu elektronovou mikroskopií dává také typický diagnostický obraz.
- 18. Scintigrafie plic při podezření na plicní mikroembolizaci, provázející hyperkoagulační stav doložitelný výsledky koagulačních vyšetření nebo při podezření na embolizaci plynoucím z anamnézy.
- 19. RTG snímek plic k průkazu plicních eozinofilních syndromů – ten se provádí obligátně, případně funkční vyšetření.
- 20. Scintigrafie značenými granulocyty. V poškozených tkáních se kumulují nejen eozinofily, ale také granulocyty, a proto může vyšetření značenými neutrofilními granulocyty pomoci toto ložisko identifikovat.
- 21. Odborné neurologické vyšetření při podezření na poškození CNS.
- 22. Odborné oční vyšetření (pozadí i hodnocení perimetru) při podezření na poškození CNS
- 23. Vyšetření ledvin (clearence, kvantitativní proteinurie, Hamburgerův sediment).
- 24. Rozsáhlé pátrání po solidním tumoru, který vyvolal eozinofilii, obvykle není nutné, neboť většina případů eozinofilie asociované se solidními tumory se vyskytuje u pokročilé metastatické choroby, na rozdíl od hematologických malignit, u nichž se může objevovat v jejich počátku, nebo předcházet jejich vzniku řádově o měsíce až roky.
Léčba
Indikace k zahájení léčby
Pouhá hypereozinofilie, bez známek (průkazu) orgánového poškození, není indikací k léčbě, neboť to nakonec ani není idiopatický hypereozinofilní syndrom, chybí li orgánové poškození. Tito pacienti by měli být jen pravidelně a často sledováni, aby se zavčas odhalilo poškození nějakého orgánu, a tedy přechod pouhé idiopatické asymptomatické eozinofilie do symptomatického idiopatického hypereozinofilního syndromu. V literatuře lze nalézt četné popisy případů, kdy se počty eozinofilů dlouhodobě, řádově roky, pohybovaly nad 1,5 × 109/l, byly vyloučeny jiné příčiny hypereozinofilie a kdy byla dokonce prokázána atypická klonální populace T lymfocytů. V některých případech byl tento stav, který byl nazván premaligní klonální T lymfoproliferace s eozinofilií, stabilní po 2 desetiletí, zatímco u jiných postupně přešel v maligní T lymfoproliferativní onemocnění.
Léčbu lze považovat za indikovanou, pokud je prokázáno poškozování některého orgánu či tkáně eozinofily, nebo pokud eozinofily způsobily nějakou formu koagulopatie. Cílem léčby je redukovat patologicky zvýšené počty eozinofilů na fyziologické hodnoty a trvale je na těchto hodnotách udržet.
To jsou obecné pravdy, z nichž je třeba vycházet. Lékař, který vyšetřuje pacienta s eozinofilií, však zároveň ví, že v případě vznikající myokardiální eozinofilní choroby může jedině včasné zahájení léčby předejít nevratnému poškození srdce, a naopak oddálení zahájení léčby bude spojenou s trvale poškozenou funkcí srdce. Domníváme se, že toto dilema nelze řešit paušálním podáním prednisonu každému pacientovi se zvýšeným počtem eozinofilů, ale že jediným řešením je opakované provádění všech vyšetření, jejichž cílem je prokázat vznikající poškození srdce. Frekvence těchto vyšetření se odvozuje od pravděpodobnosti poškození srdce (morfologie eozinofilů).
T lymfocytární varianta hypereozinofilního syndromu
V případě, že máme podezření na eozinofilii vyvolanou klonální T lymfocytární proliferací (lymfoidní varianta hypereozinofilního syndromu), která nemá maligní charakter, navodí glukokortikoidy v průběhu jednoho dne rychlý pokles počtu eozinofilů. Tyto stavy jsou však vzácné a v literatuře jsou popisovány formou popisů jednotlivých případů. V případech, kdy glukokortikoidy nepomáhají, se podává interferon α a velké úspěchy měla protilátka proti interleukinu-5.
Myeloidní varianta hypereozinofilního syndromu
Druhou možností je chronické myeloproliferativní onemocnění s diferenciací převážně do eozinofilní řady (myeloidní varianta hypereozinofilního syndromu). Tyto případy nelze ovlivnit glukokortikoidy, ale je nutno použít stejné léky, jaké se používají pro léčbu chronické myeloidní leukemie, tedy imatinib, dříve se používal interferon α nebo hydroxyurea.
Interferon α by měl snižovat tvorbu interleukinu-5, a tím snižovat počty eozinofilů.
V případě průkazu fúzního genu FIP1L1/PDGFRA, genu PDGFRB a KIT má výborný léčebný efekt imatinib, který je však účinný i v případech klonální eozinofilní proliferace bez přítomnosti přestavby genu PDGFRA, takže terapeutický pokus s imatiniben je indikován u všech myeloproliferativních variant hypereozinofilního syndromu.
Imatinib (Glivec) je totiž nejenom inhibitor aktivity Abelsonovy tyrozinázové kinázy (ABL), ale také receptorů růstových faktorů (plateled derived growth receptor α a β – PDGFRA a PDGFRB) a receptoru faktoru kmenových buněk (stem cell factor receptor – KIT). Léčebné možnosti shrnuje schéma 2.
Schéma 2. Příčiny eozonifilie a možnosti jejího ovlivnění. 
K nejnovějším léčebným postupům patří mepolizumab, monoklonální protilátka proti IL 5.
Alogenní transplantace krvetvorné tkáně
U pacientů s nedostatečnou léčebnou odpovědí na výše uvedenou standardní léčbu je vhodné zvážit alogenní transplantaci krvetvorné tkáně, která je jedinou možností k zásadními zlepšení. Její provedení je však nutné ještě před nástupem závažných orgánových změn.
Chirurgické léčebné zákroky
V případě poškození srdce, obzvláště při poškození chlopní, je často přínosný kardiochirurgický zákrok, náhrada srdeční chlopně nebo anuloplastika. Pacienti s poškozením srdce vyžadují klasickou léčbu srdeční slabosti.
U pacientů s idiopatickým hypereozinofilním syndromem se splenomegalií byla testována také operační splenektomie. Nebyla však přínosná, počet eozinofilů se po operaci dále zvyšoval.
Antikoagulační léčba
V případě trombotických komplikací je nutná trvalá antikoagulační léčba. Zvážit by se měla při zjištění závažného hyperkoagulačního stavu.
Závěr
Zvýšený počet eozinofilů může provázet velký počet chorob, z nichž některé jsou dobře, jiné hůře léčebně ovlivnitelné. V některých případech je eozinofilie zcela asymptomatická a je otázkou, zda se příznaky nemoci neobjeví až po několika letech trvání eozinofilie.
Každopádně každý nález zvýšeného počtu eozinofilů vyžaduje pečlivé vyšetření, a pokud je rozpoznán patologický podklad tohoto zvýšení, tak i odpovídající léčbu.
Tato práce vznikla a byla podporována v rámci projektu MŠMT: LC 06027 a VZ 0021622434.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e mail: z.adam@fnbrno.czDoručeno do redakce: 25. 2. 2009
Sources
1. Adam Z, Elbl L, Bulíková A et al. Eozinofilie, idiopatický hypereozinofilní syndrom/chronická eozinofilní leukémie. Postgrad Med 2003; 5 : 471–487.
2. Bain BJ, Fletcher SH. Chronic eosinophilic leukemias and the myeloproliferative variant of the hypereosinophilic syndrome. Immunol Allergy Clin North Am 2007; 27 : 377–388.
3. Bohm M, Richter JE. Treatment of eosinophilic esophagitis: overview, current limitations, and future direction. Am J Gastroenterol 2008; 103 : 2635–2644.
4. Capovilla M, Cayuela JM, Bilhou-Nabera Cet al. Synchronous FIP1L1-PDGFRA-positive chronic eosinophilic leukemia and T-cell lymphoblastic lymphoma: a bilineal clonal malignancy. Eur J Haematol 2008; 80 : 81–86.
5. Carnero‑Alcázar M, Reguillo-Lacruz F,O’Connor F et al. Hypereosinophilic syndrome and myocardial fibrosis. Interact Cardiovasc Thorac Surg 2008; 7 : 928–930.
6. Cilloni D, Messa F, Martinelli G et al. WT1 transcript amount discriminates secondary or reactive eosinophilia from idiopathic hypereosinophilic syndrome or chronic eosinophilic leukemia. Leukemia 2007; 21 : 1442–1450.
7. Corradi D, Maestri R, Facchetti F. Postpartum Churg‑Strauss syndrome with severe cardiac involvement: Description of a case and review of the literature. Clin Rheumatol 2009. V tisku.
8. D’Angelo G, Hotz AM, Todeschin P. Acute lymphoblastic leukemia with hypereosinophilia and 9p21 deletion: case report and review of the literature. Lab Hematol 2008; 14 : 7–9.
9. do Prado AD, de Figueiredo CE, Marrone CD et al. Episcleris, arthrofasciitis and hypereosinophilia: primary hypereosinophilic syndrome or atypical Wegener’s granulomatosis? Rheumatol Int 2007; 28 : 89–90.
10. Duval A, Bergoin E, Maynadié M et al. Images in haematology. Hypereosinophilia as a presenting feature of anaplastic large cell lymphoma. Br J Haematol 2008; 140 : 363.
11. Estrada-Reyes E, Hernnández-Román MP, Gamboa-Marrufo JD et al. Hypereosinophilia, hyper‑IgE syndrome, and atopic dermatitis in a toddler with food hypersensitivity. J Investig Allergol Clin Immunol 2008; 18 : 131–135.
12. Garcia-Alvarez A, Sitges M, Garcia-Albeniz X et al. Atypical cardiac manifestation of hypereosinophilic syndrome and reversible cardiotoxicity to imatinib. Int J Cardiol 2008. V tisku.
13. González Delgado P, de la Sen Fernández ML, Soriano Gomis V et al. Cyclical hypereosinophilia with skin manifestations and a clonal T cell population. J Investig Allergol Clin Immunol 2008; 18 : 401–403.
14. Gotlib J, Cools J. Five years since the discovery of FIP1L1-PDGFRA: what we have learned about the fusion and other molecularly defined eosinophilias. Leukemia 2008; 22 : 1999–2010.
15. Haghpanah V, Lashkari A, Tavangar SM et al. Hypereosinophilia as the presentation of metastatic medullary thyroid carcinoma: a remarkable event. Am J Med Sci 2000; 334 : 131–132.
16. Helbig G, Stella-Hołowiecka B, Majewski M et al. A single weekly dose of imatinib is sufficient to induce and maintain remission of chronic eosinophilic leukaemia in FIP1L1-PDGFRA-expressing patients. Br J Haematol 2008; 141 : 200–204.
17. Husár R, Václavík J, Lukl J. Newly diagnosed Churga-Strauss syndrome in a female patient with suspect acute coronary syndrome. Vnitř Lék 2008; 54 : 1102–1105.
18. Chrobák L, Voglová J. Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie. Vnitř Lék 2005; 51 : 1385–1393.
19. Iwata H, Tsuboi N, Ishii T et al. Hypereosinophilia associated with increased serum levels of carcinoembryonic antigen. Intern Med 2008; 47 : 963–967.
20. Kahn JE, Blétry O, Guillevin L. Hypereosinophilic syndromes. Best Pract Res Clin Rheumatol 2008; 22 : 863–882.
21. Kalac M, Quintás-Cardama A, Vrhovac R et al. A critical appraisal of conventional and investigational drug therapy in patients with hypereosinophilic syndrome and clonal eosinophilia. Cancer 2007; 110 : 955–964.
22. Lee JH, Park HK, Heo J et al. Drug Rash with Eosinophilia and Systemic Symptoms (DRESS) syndrome induced by celecoxib and anti‑tuberculosis drugs. J Korean Med Sci 2008; 23 : 521–525.
23. Macků M, Rybníček P, Tomanová Y et al. Eosinofilie – nesnadný hlavolam. Pediatr pro Prax 2005; 6 : 35–37.
24. Nakagome K, Dohi M, Okunishi K et al. IL‑5‑induced hypereosinophilia suppresses the antigen‑induced immune response via a TGF‑beta‑dependent mechanism. J Immunol 2007; 179 : 284–294.
25. Nathan N, Guillemot N, Aubertin G et al. Chronic eosinophilic pneumonia in a 13-year-old child. Eur J Pediatr 2008; 167 : 1203–1207.
26. Oberholzer C, Nüesch R, Häusermann P. Urticaria and parasites: case report and general view over the most common pathogens of chronic urticaria. Praxis (Bern 1994) 2007; 96 : 865–870.
27. Quintás-Cardama A, Cortes J. Therapeutic options for patients with clonal and idiopathic hypereosinophia. Expert Opin Investig Drugs 2008; 17 : 1039–1050.
28. Roufosse F, Cogan E, Goldman M. Lymphocytic variant hypereosinophilic syndromes. Immunol Allergy Clin North Am 2007; 27 : 389–413.
29. Roufosse FE, Goldman M, Cogan E. Hypereosinophilic syndromes. Orphanet J Rare Dis 2007; 2 : 37.
30. Sade K, Mysels A, Levo Y et al. Eosinophilia: A study of 100 hospitalized patients. Eur J Intern Med 2007; 18 : 196–201.
31. Sheikh J, Weller PF. Advances in diagnosis and treatment of eosinophilia. Curr Opin Hematol 2009; 16 : 3–8.
32. Sheikh J, Weller PF. Clinical overview of hypereosinophilic syndromes. Immunol Allergy Clin North Am 2007; 27 : 333–355.
33. Sun CY, Hu Y, Chu ZB et al. Successful treatment of myeloid neoplasms associated with PDGFRA rearrangement with imatinib mesylate. Int J Hematol 2009; 89 : 66–70.
34. Šteruská M, Demečková E, Benžová M et al. Hypereozinofilný syndróm – leukemia, lymfómy, myeloproliferatívny a myelodysplastický syndróm s eozinofíliou. Hemat Transfuz 1994; 4 : 14–22.
35. Vaida I, Roszkiewicz F, Gruson B et al. Drug rash with eosinophilia and systemic symptoms after chlorambucil treatment in chronic lymphocytic leukaemia. Pharmacology 2009; 83 : 148–149.
36. Zavřelová A, Žák P. BCR/ABL negativní myeloproliferativní onemocnění s eozinofilií. Lék Zprav 2006; 51 : 197–198.
37. Tefferi A. Eosinophilia: secondary, clonal and idiopatic. Brit J Hematol 2006; 133 : 468–492.
38. Brigden ML. A practical workup for eosinophilia. Postgraduate Med 1999; 105 : 193–211.
39. Vaillant L. Drug hypersensitivity syndrome: drug rash, with eosinophilia and systemic symptoms – DRESS. J Dermatol Treatment 1999; 10 : 267–272.
40. Cottin V. Churg‑Strauss syndrome. J Allergy 1999; 54 : 535–551.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue Supplementum 1-
All articles in this issue
- Chronic cardiac failure treatment in an internal medicine ambulance
- Hypertensi on therapy in obese pati ents
- Differences between male and female pati ents in acute cardi ac failure
- New classificati on of Ph negative chronic myeloproliferative ne oplasi as
- Acute upper gastro intestinal bleeding
- Iron overlo ad – recent advances in pathogenesis and tre atment
- Treatment of chronic myeloid leukemia in era of imatinib
- Gastrointestinal lymphomas
- Present possibilities of diagnosis and treatment of systemic AL-amyloidosis
- Problems of haemostatic disorders in metabolic syndrome
- Prothrombotic state in NAFLD and its consequences
- Management of the diabetic patient with coronary artery disease
- Changes to the renal function results following marathon run, a 100-kilometre run and a 24-hour long‑term run
- Histiocytic disorders
- Differential diagnosis of eosinophilia
- Foreign relations of the Czechoslovak Hematology Society in 1951–1989
- Pati ent with di abetes – internal medicine pati ent
- Indicati on for examinati on of risk factors for veno us thrombosis
- Current advances in the care for pati ents with haemophili a
- Paedi atric tumo urs metastasizing to bone marrow and their haematological characterisati on
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnosis of eosinophilia
- Iron overlo ad – recent advances in pathogenesis and tre atment
- Histiocytic disorders
- Acute upper gastro intestinal bleeding
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

