-
Medical journals
- Career
Ovlivnění hemostázy při terapii náhradními roztoky
Authors: J. Máca; R. Kula; V. Chýlek
Authors‘ workplace: Anesteziologicko‑resuscitační klinika FN Ostrava, přednosta prim. MUDr. Jan Jahoda
Published in: Vnitř Lék 2009; 55(1): 27-36
Category: Reviews
Overview
Hemostáza je složitě regulovaný a významný homeostatický proces. Kriticky nemocný pacient je v průběhu hospitalizace vystaven působení různých zevních i vnitřních podnětů, které mohou hemostázu ovlivňovat. Jejich nedílnou součástí je i aplikace náhradních roztoků. Cílem této práce je popis hlavních mechanizmů vedoucích k narušení hemostatické rovnováhy při tekutinové terapii a možnosti jejich monitorace. Zabývá se jednotlivě všemi typy základních arteficiálních substitučních roztoků a jejich významem z hlediska vlivu na koagulaci. V rámci této problematiky upozorňuje dále i na jisté kontroverzní závěry a problémy, které vyplývají z výsledků provedených experimentálních a klinických studií. Lze konstatovat, že prakticky všechny náhradní roztoky mají potenciál hemostázu narušit. V klinické praxi mezi nejpřesnější metody stanovení těchto poruch hemostázy patří tromboelastografie, která má několik zásadních výhod oproti klasickému vyšetření koagulogramu. Charakter a míra ovlivnění závisí na množství, rychlosti podání a typu použitého roztoku.
Klíčová slova:
náhradní roztoky – hemostáza – tekutinová terapieObecná problematika tekutinové resuscitace
Tekutinová resuscitace (TR) patří mezi základní intervence terapeutického managementu pacientů na jednotkách intenzivní péče. Je nezbytnou podmínkou, i když bohužel ne jednoznačnou zárukou, která má potenciál zajistit za určitých podmínek hemodynamickou stabilitu kriticky nemocného pacienta v akutním stadiu onemocnění.
Také v elektivní medicíně patří terapie tekutinami neodmyslitelně k předoperačnímu zajištění pacienta, k optimalizaci v průběhu operačního výkonu a následně i k léčebné intervenci v pooperačním období.
Hlavní součástí TR je podávání přirozených i arteficiálních náhradních roztoků, popřípadě krevních derivátů. V průběhu posledních několika desetiletí se široká řada klinických prací věnovala této problematice ve snaze definovat potřebné množství, typ a vhodný algoritmus podání tekutin za účelem dosažení potřebného klinického efektu. S tímto neodmyslitelně souvisí i tematika zabývající se riziky, která vyplývají z podávání náhradních roztoků, zejména možnost negativního ovlivnění některých fyziologických funkcí organizmu.
Použitý typ a kvantita tekutinových preparátů se samozřejmě může výrazně lišit v závislosti na charakteru a míře závažnosti patologického procesu a také vzhledem ke stanoveným klinickým cílům. Jinými slovy, konkrétní patologický stav za daných okolností vyžaduje specifickou TR. Odlišnou strategii bude nutné užít u polytraumatu provázeného hypovolemickým hemoragickým šokem a u šoku kardiogenního. Rozdílnou TR bude vyžadovat také šok septický či popáleninový. Jiný postup zvolíme u pacienta s chirurgicky kontrolovaným krvácením a jiný u pacienta s pokračujícím krvácením. Míra této odlišnosti je často minimální, ale v některých klinických situacích může být zcela zásadní a z klinického hlediska může mít i jednoznačný vliv na prognózu pacienta.
V posledních letech se obecným trendem stala snaha o minimalizaci užití transfuzních přípravků (erytrocytárních koncentrátů a plazmy), zejména díky širokému spektru náhradních roztoků. Motivem je snaha o minimalizaci počtu nežádoucích účinků (inkompatibilita, infekce, alergické reakce, TRIM – transfusion‑related immunomodulation, TRALI – transfusion‑related acute lung injury) [37], které často přes všechna bezpečnostní opatření moderní medicíny aplikaci krevních derivátů doprovází. Nezanedbatelným faktorem je vlastní cena krevních derivátů.
Pro klinickou praxi je v současné době k dispozici řada roztoků a díky možnostem současných výrobních technologií se jejich počet neustále zvyšuje. Jednotlivé roztoky se liší svým molekulárním a iontovým složením, a z toho tudíž logicky plynou i odlišnosti ve fyzikálně‑chemických a farmakologických vlastnostech (farmakokinetika a farmakodynamika).
Obecně je nutné si položit otázku, který náhradní roztok je z hlediska minimalizace nežádoucích účinků pro použití u konkrétního pacienta, v konkrétním čase a za daného klinického stavu nejvýhodnější. Jednoznačná doporučení v souladu se systémem EBM nejsou k dispozici a ideální univerzálně použitelný náhradní roztok v současnosti neexistuje. Některé roztoky (dextrany, gely) užívané v dřívějších letech byly pro své nevýhody [5] z klinického užívání vyřazeny, některé jiné preparáty v praxi setrvávají celá desetiletí a současně se vyvíjejí a do praxe dostávají další nové preparáty. Průběžně jsou neustále srovnávány mezi sebou, nejčastěji z hlediska jejich rozdílného klinického hemodynamického efektu, ale i z důvodů ekonomických a farmaceutických. Tento trend bude pravděpodobně nadále pokračovat.
Stále trvá klasický spor týkající se výhod a nevýhod klinického užití krystaloidních ve srovnání s koloidními roztoky (krystaloid vs koloid) navzdory vzrůstajícímu množství informací o jejich klinické efektivitě a zkušenostem při jejich užití. V posledních letech navíc přibývají nové otázky při srovnávání jednotlivých druhů roztoků mezi sebou (koloid vs koloid, resp. krystaloid vs krystaloid). Diskuze se soustřeďuje především na nové preparáty založené na bázi hydroxyetylškrobu (HES) a dále na otázku balancovanosti krystaloidních roztoků.
Existují však i jiné otázky. Vzhledem k rozdílným farmakologickým vlastnostem různých typů roztoků se i jejich adekvátní množství potřebné k dosažení stanoveného klinického cíle může značně lišit. Míra ovlivnění vnitřního prostředí je pak dána také velikostí podaného objemu a rychlostí podání. Je tedy možné předem odhadnout, jaké množství daného náhradního roztoku, ve kterém časovém období a jak rychle je nutné podat při TR? Odpověď není jednoduchá a bývá ovlivněna řadou faktorů. Co v dané situaci ovlivňuje např. celkové nezbytné množství podaného roztoku? V tomto případě hraje významnou roli rovněž individuální faktor pacienta a také charakter konkrétní klinické situace (tab. 1).
Které důležité fyziologické funkce mohou být v rámci TR klinicky významně ovlivněny rychlým podáním velkého množství objemové náhrady? Jedná se např. o poruchu acidobazické rovnováhy (hyperchloremická acidóza při užití nebalancovaných krystaloidních roztoků), změny v imunitní odpovědi (alergické reakce při užití některých koloidů – dextrany), narušení funkce ledvin (porucha tubulárních funkcí u koloidů), porucha oxygenační funkce plic (riziko intersticiálního edému), změny GIT (riziko intraabdominálního kompartment syndromu [38]) atd.
Úkolem tohoto sdělení je nastínit, jakým způsobem mohou nejčastěji užívané roztoky ovlivňovat krevní srážlivost (hemostáza), a to na základě informací z řady recentních i starších klinických studií in vivo a in vitro.
In vitro klinické studie jsou na toto téma publikovány v naprosté převaze. Jejich jednoznačnou výhodou je možnost sledování a vyhodnocování dané problematiky za přesně definovaných laboratorních podmínek, možnost snadné reprodukovatelnosti měření, minimální etická komplikovanost a snížení rizika vlivu chirurgického a traumatického stresu. Jejich nevýhodou je naopak menší relevantnost ve vztahu k aplikaci výsledků do doporučení v klinické praxi, především pro vyloučení normálních homeostatických mechanizmů (např. přirozená regulace hladiny Ca2+, endokrinní vlivy, produkce cytokinů a další).
In vivo prací je publikováno srovnatelně menší množství. Jsou eticky omezené a také v nich významnou roli hraje faktor individuální schopnosti pacienta korigovat vnitřní nebo vnější zásahy do homeostatázy. Z klinického hlediska je jejich relevantnost a aplikovatelnost velice významná.
Hemostáza a její monitorace
Hemostáza je komplexní fyziologický proces tvorby a degradace krevní sraženiny se složitým systémem regulace v průběhu každé její fáze. Zahrnuje řadu faktorů ovlivňujících funkci krevních destiček v souvislosti s jejich aktivací a tvorbou primární zátky, dále krevní a tkáňové faktory s prokoagulačním a antikoagulačním efektem a v neposlední řadě také faktory regulující proces odbourávání vzniklého koagula (fibrinolýza). Řada těchto faktorů je přítomna, modifikována nebo přímo produkována pouze ve specifických tkáních (krevní buněčné elementy, buňky RES) a orgánech (játra, ledviny, plíce). Jejich výsledná interakce určuje konečný výsledek v podobě aktuálního stavu hemostázy na lokální a systémové úrovni. Za fyziologických podmínek jde o rovnovážný stav mezi prokoagulačními a antikoagulačními faktory. Za patologických podmínek pak může dojít ke klinicky významným změnám ve smyslu snížení schopnosti vytvářet koagulum (hypokoagulace), nebo naopak zvýšení pohotovosti k tvorbě koagula (hyperkoagulace). Celá řada zevních i vnitřních vlivů, primárně nesouvisejících s fyziologií hemostázy, může mít signifikantní dopad na celkový výsledek koagulačního procesu.
Kriticky nemocný pacient obvykle vyžaduje velké množství farmakologických a nefarmakologických (invazivních a neinvazivních) intervencí. Je proto logicky vystaven značnému riziku patologického ovlivnění krevní srážlivosti, a to v různé míře obou základních kvalit (tab. 2).
V klinické praxi se hemostáza obvykle primárně hodnotí základními koagulačními parametry (aPTT, PT), ev. doplněnými o další vypočítané parametry srovnávající časové parametry pacienta s odpovídajícími hodnotami normální plazmy. K vytvoření ucelenějšího obrazu je možné použít i další laboratorní parametry (D‑dimery, hladinu fibrinogenu nebo počet trombocytů, hladiny AT a další) (tab. 3). V současnosti existují i komplexnější techniky se schopností monitorace koagulace. Jedná se o metody vyšetření tzv. „plné“ krve (TEG® – obr. 1, SONOCLOT® – obr. 2). Jsou založeny na principu globálního měření biofyzikálních vlastností, resp. bioimpedance generovaného koagula, a následně i jeho odbourávání.
Image 1. Křivka TEG<sup>®</sup>. 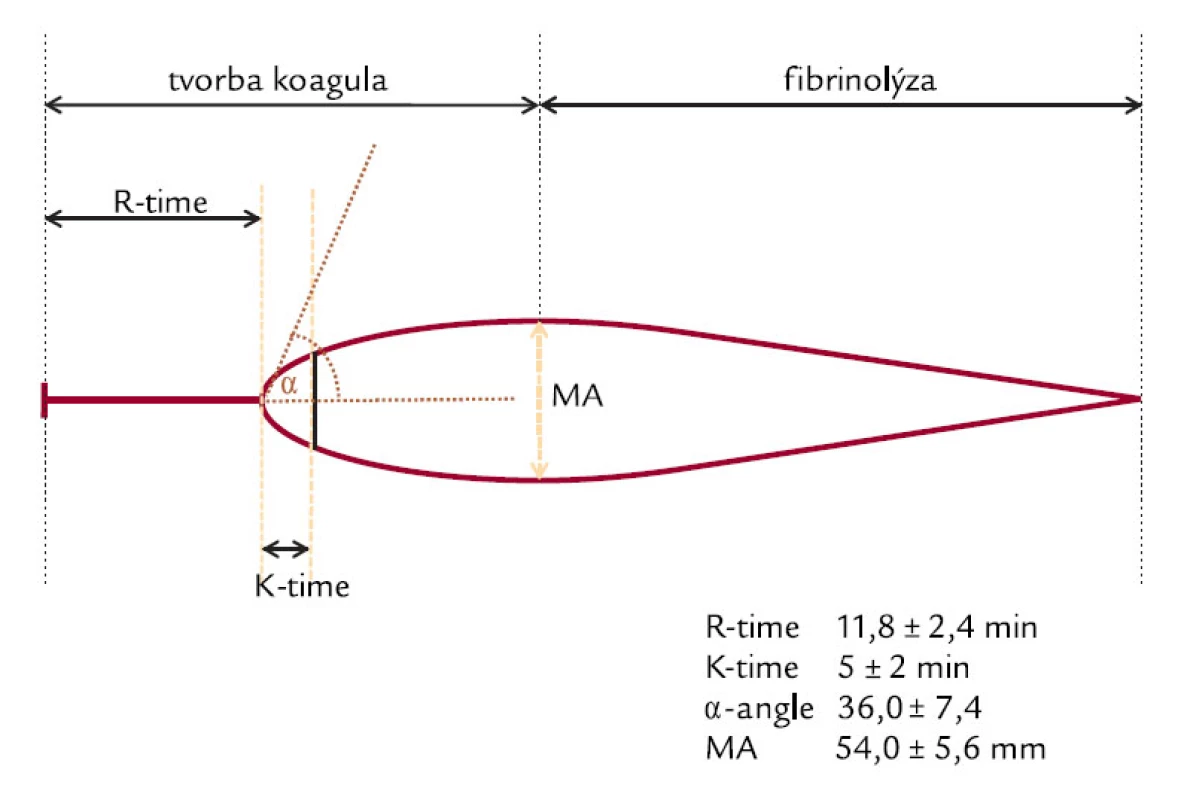
Image 2. Křivka SONOCLOT<sup>®</sup>. 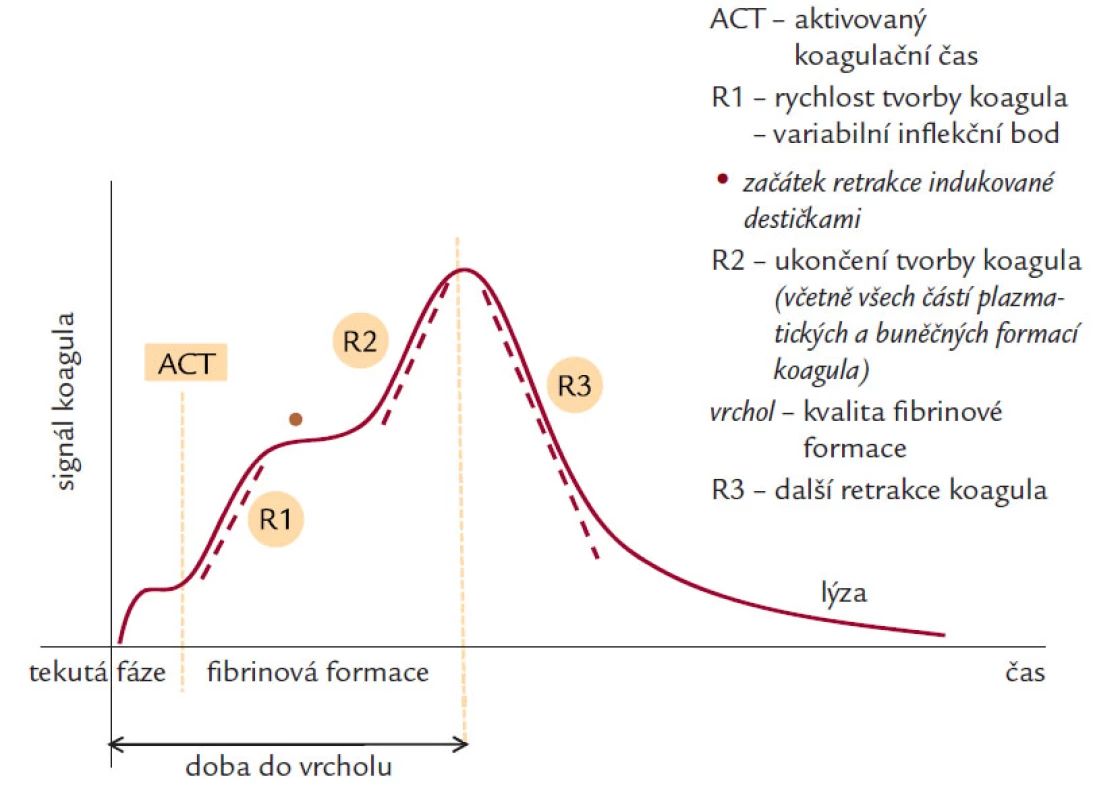
Vyšetření základních koagulačních parametrů (aPTT a PT) je zatížena řadou nevýhod. Z časového hlediska tento test umožní posoudit pouze iniciální fázi plazmatické koagulace, tzn. dobu do vytvoření asi 4 % trombinu [8]. Dále může poměrně častá přítomnost hypotermie u pacienta vést k dalšímu zkreslení přesnosti vyšetření v laboratorních podmínkách. Použití těchto základních parametrů má tedy značná omezení v klinické interpretaci (senzitivita a specificita vyšetření), a to zejména u kriticky nemocných pacientů. Často zaznamenáváme případy, kdy pacient s klinicky jednoznačnými krvácivými projevy má tzv. „normální“ koagulogram a naopak.
Zmíněné analytické přístrojové metody (TEG®, SONOCLOT®) mají naopak řadu výhod. Patří mezi ně schopnost zachytit stav hemostázy z globálního hlediska včetně podstatné části krevního srážení závislé na buněčných složkách (trombocyty, monocyty a další), a zejména hodnotit i pozdější fáze hemostatického procesu. V podstatě dávají přehled o celém průběhu tvorby definitivního trombu a také o fázi fibrinolýzy. Další výhodou je možnost jejich počítačového zpracování a vyhodnocení a rovněž jednoduché a rychlé použití bed-side. Např. v kardiochirurgii se již staly standardem perioperačního managementu a jsou významným vodítkem v plánování terapeutických intervencí. Patří k nejčastěji využívaným metodám vyšetřování koagulace v rámci klinických studií. V současné době existuje řada jejich modifikací (např. roTEG, rapidTEG a další), které umožňují posuzovat zvlášť parametry aktivace vnitřní a vnější cesty koagulační kaskády za použití různých aktivačních činidel a také snižují potenciální riziko zkreslení výsledků zevními (vibrace v okolí) a vnitřními vlivy (terapie heparinem, LMWH).
Obecný vliv náhradních roztoků na hemostázu
V zásadě existují dva základní mechanizmy, kterými náhradní roztoky (NR) ovlivňují proces koagulace. V první řadě se jedná o hemodiluci (HD) a v druhé o faktor vlivu molekul NR per se.
Hemodiluce (HD)
HD lze definovat jako snížení koncentrace přirozených složek krve (krevní elementy, plazmatické bílkoviny, organické a anorganické sloučeniny, ionty) vlivem aplikace náhradních roztoků. Její vliv a význam v procesu koagulace jsou často zkoumaným fenoménem řady klinických studií. V zásadě platí, že diluce může mít, v závislosti na množství a typu použitého roztoku, jak prokoagulační, tak i hypokoagulační efekt.
Prokoagulační efekt se popisuje především v souvislosti s podáním krystaloidních roztoků a význam je připisován i rychlosti aplikace [27]. Některé práce jej zaznamenaly i při podání koloidních roztoků. Např. nízká míra HD roztoky želatiny i HES způsobuje prokazatelné změny v některých TEG i SONOCLOT parametrech – zkrácení r-time, resp. zkrácení ACT [13,17,19,29]. Naopak hypokoagulační efekt byl pozorován při výrazné míře HD u všech typů NR.
V polovině minulého století byla poprvé publikována práce [41], ve které se zmiňuje skutečnost, že mírná hemodiluce krystaloidními roztoky vyvolá změny koagulace ve smyslu akcentace (prokoagulační efekt). Následovaly další práce potvrzující tento fakt v laboratorních podmínkách, při pokusech na zvířecích modelech i při zkoumání humánní krve. Janvir et al [12] ve své často citované práci prokázal souvislost HD s rizikem zvýšené incidence hluboké žilní trombózy (DVT) u pacientů, kterým byly peroperačně aplikovány krystaloidní roztoky ve srovnání se skupinou pacientů bez objemové substituce. Vzhledem k tomuto původně poměrně překvapivému zjištění se logicky objevil názor, zda zmíněný prokoagulační efekt není vyvolán, popř. zkreslen či akcentován, peroperačním chirurgickým či traumatickým stresem (tkáňové poškození) nebo vyplavením endogenních katecholaminů [42]. Tyto faktory jistě mohou do jisté míry ovlivnit parametry koagulace, např. traumatickým vyplavením prokoagulačních faktorů do systémové cirkulace, ale teorie, že jsou hlavní příčinou změn hemostázy u chirurgických a traumatologických pacientů, byla zpochybněna řadou dalších prací [21,27,29]. Závěrem těchto studií bylo konstatování, že peroperační stres a vliv anestézie či chirurgického traumatu není rozhodujícím faktorem ovlivňujícím hemostázu ve srovnání s HD. Bylo např. jednoznačně popsáno ovlivnění TEG parametrů ve smyslu akcentace koagulace in vivo po podání krystaloidního roztoku ještě před započetím chirurgického výkonu a přetrvávající dále v průběhu výkonu [27].
Ruttmann [29] ve své práci zkoumal cíleně efekt HD při podávání krystaloidních a koloidních roztoků a její vliv na koagulaci. Prokázal, že 20% diluce 0,9% NaCl i Haemaccelem in vitro působí v obou případech změny v TEG parametrech ve smyslu zvýšení rychlosti aktivace koagulace (zkrácení r-time) a zvyšuje rychlost narůstání koagula vlivem na aktivitu destiček a tvorbu fibrinu (zkrácení k-time a rozšíření a-angle). Parametr MA byl zvýšen jen v případě použití krystaloidů.
Mechanizmus, jakým HD vyvolává prokoagulační efekt, je pravděpodobně značně komplexní a všechny jeho aspekty doposud nebyly jednoznačně vysvětleny. Hlavní hypotéza předpokládá ovlivnění křehké rovnováhy mezi antikoagulačními a prokoagulačními faktory ve prospěch prokoagulace [10,19]. Jedná se zejména o vyšší citlivost hladin antitrombinu III a zřejmě i proteinu C a jeho kofaktoru proteinu S nebo relativně vyšší hladinu inhibitoru aktivátoru plasminogenu (PAI). Z dalších teorií je možné zmínit průkaz zvýšení trombinové geneze (stabilní hladina trombin‑antitrombin komplexů navzdory prohlubování HD [20]) anebo průkaz facilitace interakce destiček biologickými i arteficiálními povrchy přirozeně aktivujícími destičky [20]. Vliv na funkci krevních destiček byl ovšem zpochybněn prací Ruttmanna et al [43], kteří prokázali perzistenci prokoagulačního efektu HD i při eliminaci funkce destiček podáváním antiagregačního preparátu (aspirin).
V nedávné studii [30] byl také popsán možný vliv nižší hladiny Mg2+ v rámci rychlé HD, který se může podílet na akcentaci koagulace. Udržení hladiny Mg2+ při horní hranici normálního laboratorního rozmezí v rámci podávání náhradních roztoků pak vedlo k signifikantnímu snížení prokoagulačního efektu.
Prokoagulační efekt je tedy v podstatě přítomen u většiny NR při nižším stupni HD, a je tedy s ním nutné počítat v klinickém užití. V první řadě je však jedná o krystaloidní roztoky (NaCl 0,9 %, Ringerův roztok – R1/1, Ringer-laktát roztok – RL), kdy in vivo nastává prokoagulační efekt v intervalu 10–30 % HD. In vitro byl tento efekt pozorován v intervalu 20–50 % HD [34]. Při dalším zvyšování stupně HD lze obecně uzavřít, že cut-point, kdy nastává eliminace prokoagulačního a přechod do hypokoagulačního efektu, je přibližně v intervalu 50–60 % HD [10,19]. Při diluci nad 60 % dochází u všech NR k hypokoagulačnímu efektu. Tyto změny jsou zdůvodňovány mírou HD, neboť při hodnotách diluce nad 50 % je již přítomno tak významné snížení všech koagulačních faktorů, včetně změn ve viskozitě plazmy a počtu krevních destiček [24], že rovnováha se přesouvá ve prospěch hypokoagulace. Zároveň při takto významném stupni HD začíná hrát svou roli i signifikantní snížení hladin Ca2+ a fibrinogenu, a to především ve studiích in vitro, kde nemohou být dostatečně účinně zachovány přirozené korigující mechanizmy homeostázy.
Zajímavá je otázka tzv. vnitřní hemodiluce (autodiluce), což v podstatě znamená doplnění krevní ztráty vlastní intersticiální tekutinou. Vzhledem k tomu, že aplikace i.v. náhradních roztoků je praktikována až s příchodem moderní medicíny v posledních několika málo stoletích, mohl tento fyziologický mechanizmus doplnění objemu cévního systému z vnitřních „zásob“, doprovázený určitým stupněm akcentace koagulace (hemostatický efekt), hrát výhodnou roli i z evolučního hlediska. Ruttmann et al v roce 2002 ve svém editorialu [39] zmiňují výsledky svých pozorování, které poukazují na skutečnost, že autodiluce do 10 % objemu krve nezpůsobuje závažnější dysbalanci mezi antikoagulačními faktory a spontánně aktivovanými koagulačními faktory ve srovnání s významnější krevní ztrátou 20–30 %. Dále konstatuje, že krevní ztráta do 10 % objemu krve je u zdravého jedince v 1. fázi dostatečně účinně kompenzována sympatikotonií se zvýšením cévního tonu vedoucí k zachování adekvátní orgánové perfuze. Následně je deficit objemu krve doplněn pomalou reexpanzí tekutinou z intersticia. To vedlo autora k závěru, že nepatrný chirurgický zákrok provázený malou krevní ztrátou u jinak zdravého pacienta nevyžaduje tekutinovou terapii, a v případě, že je podání NR nutné, doporučuje podání nízkomolekulární HES (LMW HES) ke snížení rizika akcentace koagulace.
Vliv molekul per se
Ovlivnění koagulace samotným molekulárním složením roztoku (per se) je možné definovat jako jakékoliv jiné ovlivnění koagulace, které nelze vysvětlit pouhou hemodilucí. Týká se to v prvé řadě koloidních roztoků. Výsledkem je v naprosté většině případů hypokoagulační efekt.
U roztoků na bázi HES se např. jedná o disproporcionální snížení hladiny f VIII ve srovnání s prostou dilucí [13,19] nebo také tzv. „coating efekt“ HES vedoucí k negativnímu ovlivnění adhezivity a aktivace trombocytů suspektně extracelulárním mechanizmem. Konkrétně se zde jedná o snížení dostupnosti povrchových transmembránových fibrinogen‑binding glykoproteinů (GP IIb–IIIa) vazbou molekul roztoku škrobu [11].
Roztoky želatiny inkorporují své molekuly do struktury fibrin‑polymeru, snižují jeho stabilitu a zvyšují jeho náchylnost k lýze. Z dalších mechanizmů přichází v úvahu např. vazba molekul gelu s fibronektinem bránící v jeho účinné vazbě s fibrinem nebo fibrinogenem [19].
Krystaloidní roztoky – pomineme‑li hemodiluci – působí na acidobazickou rovnováhu (viz níže), což ve své podstatě lze také klasifikovat jako vliv molekul per se.
U některých roztoků, zejména koloidů, je tedy efekt na koagulaci dán výsledkem působení obou hlavních mechanizmů, a to mírou HD a současně vlivem molekul per se. Možný podíl na konečném efektu koloidu může mít i typ rozpouštědla (balancovaný nebo nebalancovaný krystaloid [26]).
Jednotlivé náhradní roztoky a jejich efekt na hemostázu
Krystaloidní roztoky (KR)
KR jsou roztoky iontů ve vodném prostředí. Hlavním mechanizmem, kterým KR ovlivňují hemostázu, je hemodiluce. Při nižším stupni HD mají krystaloidy obecně prokoagulační efekt, který je při vyšší míře ředění vystřídán hypokoagulačním efektem. Některé klinické práce zvažují i možný podíl negativního vlivu přidružené iontové dysbalance spojené s poruchou acidobazické rovnováhy (ABR).
Nejčastěji zkoumaným roztokem v klinických studiích je paradoxně nejméně užívaný isotonický substituční krystaloid: fyziologický roztok (F1/1, NaCl 0,9%, SSS – standart saline solution). NaCl 0,9% je svým složením v podstatě značně nefyziologický a podání většího objemu může mít kromě ovlivnění hemostázy i další negativní dopady (acidobazická dysbalance, intersticiální edém atd.).
V posledních letech se připisuje významná role studiu efektu nebalancovaných a balancovaných KR. Zjednodušeně řečeno, je za balancovaný KR označován roztok blížící se svým složením iontovému složení krevní plazmy. Při podávání nebalancovaných roztoků byl prokázán výše zmíněný výraznější vliv na acidobazickou rovnováhu, a to ve smyslu hyperchloremické acidózy [26,32]. Předpokládaná přímá souvislost mezi narušením ABR a koagulací ovšem jednoznačně potvrzena nebyla. Nebyl prokázán ani zásadní rozdíl v klinickém outcome pacientů s hyperchloremickou acidózou a u pacientů s normálním pH. Riziko acidobazické dysbalance se tedy jeví spíše jako sekundární, kdy nález iatrogenně vytvořené acidózy vyvolá zdánlivou potřebu další neadekvátní terapeutické intervence, např. opětovné podání nálože nebalancovaného náhradního roztoku. Existuje řada prací srovnávajících efekt těchto dvou skupin krystaloidů přímo na hemostázu pomocí TEG parametrů. Boldt et al [3] srovnali efekt relativně balancovaného roztoku a nebalancovaného roztoku na hemostázu in vivo. Výsledkem nebylo zjištění signifikantního rozdílu v TEG parametrech u pacientů podstupujících významný abdominální chirurgický zákrok, kteří dostávali peroperačně při volumoterapii Ringer-laktát anebo fyziologický roztok.
Obecně lze uzavřít, že v klinických studiích byl při použití KR prokázán in vitro prokoagulační efekt v intervalu od 20 % do 50 % HD a hypokoagulační efekt od 60 % [10]. V podmínkách in vivo byl prokázán prokoagulační efekt při HD od 10 % do 30 % [10,20], vyšší stupně HD in vivo jsou logicky limitovány metodou.
Koloidní roztoky
HES
HES (hydroxyaethyl starch, hydroxyetylškrob, modifikovaný větvený přirozený polymer amylopektinu) je bezesporu nejčastěji zkoumaným substitučním roztokem v posledních letech. Důvodem jsou jeho prokázané výhodné klinické vlastnosti, především vliv na makrocirkulaci i mikrocirkulaci, což je s výhodou užíváno při TR u řady diagnóz v kritické péči, např. u sepse s MODS.
Roztoky HES narušují koagulaci oběma hlavními mechanizmy (jak HD, tak i vlivem molekul roztoku per se). Je možné prokázat zásah prakticky do všech základních fází koagulace, především tvorby, stabilizace a degradace koagula (ovlivnění funkce destiček, ovlivnění hladiny koagulačních faktorů, ovlivnění tvorby fibrinpolymerů a ovlivnění fibrinolýzy) (tab. 4).
Po chemické stránce jsou roztoky škrobu charakterizovány řadou důležitých molekulárních parametrů (tab. 5). Některé z těchto parametrů, jako např. molekulová hmotnost (MW), molární substituce (MS) a C2/C6 poměr, ovlivňují farmakokinetiku a farmakodynamiku preparátu, a tudíž i rychlost degradace, distribuce a eliminace, potenciál objemové expanze a únik do třetího prostoru (intersticium, buňky RES). To může mít a často i má nepřímou souvislost s ovlivněním koagulace. Problematika vztahu některých molekulových vlastností HES (MW, MS, C2/C6 poměr) a hemostázy byla zkoumána řadou klinických studií. Mezi výsledky těchto prací doposud neexistuje jednoznačný konsenzus. Zajímavá je např. rozdílnost názorů na otázku, která z těchto hlavních molekulových charakteristik je dominantní determinantou negativního vlivu na koagulaci. Objevuje se zde i další problém: průkaz jednoznačného culprit faktoru by mohlo mít značný marketingový dopad. Obecný názor, že z hlediska negativního ovlivnění hemostázy je nejvýznamnější MW [22], byl zpochybněn prací Madjpoura et al [16]. Ten neprokázal signifikantní rozdíl v in vitro ovlivnění TEG parametrů u různých HES roztoků se stejnou MS a různými MW. Dle této práce se jeví jako nejpravděpodobnější, že nejvýznamnějším faktorem ovlivňujícím výsledek hemostázy je tedy spíše MS nebo C2/C6 poměr. Charakteristiky MS a C2/C6 poměr jsou studovány dále i v práci von Rotena [36], v níž bylo zjištěno, že při stejné MW měl HES roztok s nižší MS a nižším C2/C6 poměrem menší vliv in vitro na TEG parametry (HES 700/0,42/2,7 versus 700/0,51/7–14).
Vysvětlení této neshody by mohlo spočívat v technologii výroby, kdy při produkci nízkomolekulárního roztoku štěpením v sekvenci HMW-MMW-LMW dochází automaticky i k redukci v parametru MS, např. 0,7-0,5-0,4, a je‑li tedy izolovaně sledován a posuzován pouze parametr MW, může dojít ke zkreslení při interpretaci výsledků [36].
Dalším zkoumaným aspektem je vliv rozpouštědla (balancovaný vs nebalancovaný krystaloidní roztok). Při zkoumání této problematiky in vitro Roche [26] konstatuje, že typ rozpouštědla může být významným faktorem v determinaci výsledného vlivu HES na hemostázu. Jako výhodnější se jeví balancované roztoky. Závěr jeho práce uvádí, že HES o LMW a HES v balancovaném roztoku zachovávají lépe TEG parametry než HES s HMW a HES rozpuštěný v 0,9% NaCl.
Boldt ve svém editorialu [40] poukazuje na lepší funkci trombocytů (vyšší dostupnost GP IIb-IIIa) při použití balancovaného rozpouštědla u HMW HES s vysokou MS stejně tak jako u LMW HES s nízkou MS.
Obě tato zjištění ve vztahu k MW opět poukazují na výše uvedenou názorovou nejednotnost stran vztahu MS a MW a jejich ovlivnění koagulace a dále narušují i již uvedenou teorii o minimálních rozdílech mezi balancovanými a nebalancovanými KR ve vztahu k ovlivnění koagulace. Vysvětlení bude tedy jistě značně komplexnější. Roli zde také mohou hrát navíc i odlišnosti v metodice jednotlivých studií.
Nově vznikající diskuze a srovnávání kukuřičného a bramborového škrobu jako základu pro výrobu roztoků HES se prozatím jeví z hlediska vlivu na koagulaci jako málo významné. Její důvody jsou opět spíše marketingové. Hlavní rozdíly jsou ve struktuře molekuly amylopektinu (počet větvení, stupeň esterifikace fosfátovými skupinami apod.). Tyto fyzikálně‑chemické odlišnosti by mohly ve svém důsledku být příčinou mírně rozdílného ovlivnění farmakokinetických a farmakodynamických vlastností roztoku, a nepřímo tedy i koagulace [31]. Jamnicki et al 1998 prokazují mírnou augmentaci lýzy koagula způsobenou bramborovým škrobem ve srovnání s kukuřičným. V této problematice je ovšem nutný další výzkum k ověření významnosti ovlivnění koagulace z klinického hlediska.
Na základě výše uvedených informací je tedy možné říci, že lze – s jistým omezením – zhruba definovat požadavky na charakteristiku HES roztoku ve vztahu k minimalizaci ovlivnění koagulace. Nejvýhodnějším by se tedy mohl jevit roztok s nízkou MS a event. i nízkým MW, s malým rozptylem MW (medián MW), s nízkým C2/C6 poměrem v balancovaném roztoku. Nutná je kontrola hladiny ionizovaného Ca2+.
Z klinického hlediska je vhodné u vysoceobjemových náhrad roztoky HES dbát zvýšené opatrnosti u pacientů s rizikem krvácení (hemofilie, antiagregancia, antikoagulancia, rozsáhlá poranění, hepatopatie, trombocytopatie). Z preventivního hlediska se naopak vhodnou indikací může jevit podání pacientům s vysokým rizikem trombotických komplikací (trombofilie, onkologická, cévní, gynekologická operativa, obezita, ...). Predikce míry žádoucího efektu roztoků HES však zatím není možná.
Gely
Roztok gelu (želatina) obsahuje směs polypeptidů získaných štěpením hovězího kolagenu. Existují 3 základní subtypy: oxypolyželatina, urea-crosslinked želatina a succinylovaná modifikovaná želatina. Molekulová hmotnost gelu se pohybuje v intervalu s mediánem 30–35 kDa. Není stanovena limitace stran denní dávky [5].
Mechanizmus ovlivnění koagulačních parametrů je v zásadě obdobný jako u roztoků HES (oba hlavní mechanizmy, jak hemodiluce, tak vliv molekul roztoku per se) jen s významně menší in vitro a in vivo závažností [19]. Příčinou tohoto jevu je pravděpodobně rychlejší redukce molekul volného plazmatického gelu vazbou na fibronektin [17] a také promptní extravazace do intersticia a buněk RES [13]. Roztoky gelu in vivo redukují hladinu plazmatického fibronektinu a in vitro je prokázána jejich interference s polymerizací fibrin monomerů a inkorporace do struktury koagula s narušením jeho tvorby a makromolekulární struktury, a tím i jeho fyzikálních vlastností [17]. Stručný přehled některých prací týkajících se míry vlivu gelu na koagulační parametry (TEG a SONOCLOT) shrnuje tab. 6.
Dextrany
Dextrany jsou směsí glukózových polymerů s různou délkou a molekulovou hmotností (MW). K dispozici jsou dostupné 2 hlavní formy, 10% dextran 40 a 6% dextran 70, lišící se koncentrací a MW [5]. Od použití dextranů v klinické praxi se v posledních letech výrazně ustupuje pro jejich nežádoucí účinky. Mezi nejzávažnější patří možnost alergické až anafylaktické reakce, dále vliv na renální funkce s rizikem akutního renálního selhání na podkladě tubulárního poškození a také negativní vliv na hemostázu.
Mechanizmus ovlivnění koagulace je opět dvojí: HD a ovlivnění molekulami roztoku per se. Ve srovnání s HES a gely je vliv na hemostázu výraznější a lze ho pozorovat již při nižších hodnotách HD [19,24]. Byla popsána významná interference s funkcí krevních destiček [19], dále alterace iniciální tvorby fibrinové formace s alterací fibrinové morfologie a akcentací fibrinolýzy.
Albumin
Albumin je přirozený plazmatický protein. Je připravován jako neimunogenní a apyrogenní roztok v několika onkoticky různých formách: jako mírně hypoonkotický 4%, jako izonkotický 5% a jako hyperonkotický 20% a 25% koloidní roztok [5].
Albumin je velice dobře popsaným substitučním roztokem zkoumaným z mnoha hledisek týkajících se jeho použití v klinické praxi u kriticky nemocných pacientů. Stran koagulačních parametrů je popsán poměrně zásadní rozdíl v efektu in vitro a in vivo, kde je jeho vliv minimální a v podstatě se zanedbatelným klinickým dopadem. Albumin narušuje koagulaci oběma hlavními mechanizmy. Významnějším se jeví působení molekul albuminu per se, zejména ovlivnění fibrinové polymerizace přímou interakcí s fibrinem, kdy dochází k tvorbě menších fibrinových fibril [34]. Jorgensen et al (1979 a 1980) popsali tzv. heparin‑like efekt (akcentace vlivu AT na f Xa) a inhibici adheze trombocytů. V neposlední řadě se jedná o ovlivnění hladiny Ca2+ (kritická hranice hladiny ionizovaného Ca2+ je pokles pod 0,56 mmol/l) s nutností substituce jeho hladiny.
Hypertonické roztoky
Hypertonické roztoky mohou být na krystaloidní i na koloidní bázi (např. NaCl 3%, hyperHES a další). Užívají se v úzkých indikacích (např. u kraniocerebrárních poraněních s edémem mozku) a ve standardní tekutinové resuscitaci se uplatňují spíše méně a především v závislosti na zvyklostech pracoviště. Jejich ovlivnění koagulace je ve srovnání s roztoky izotonickými podstatně výraznější a mechanizmus odpovídá jejich molekulárně‑chemickému složení. Je nutno zmínit jejich výrazný vliv na hodnoty plazmatického iontogramu a z toho vyplývající dopad na acidobazickou rovnováhu.
Diskuze
V současné době neexistuje ideální roztok k použití při tekutinové terapii a s největší pravděpodobností se v nejbližších letech ani neobjeví. Z hlediska hemostázy se při tekutinové resuscitaci proto jeví jako nejvýhodnější užití kombinace koloidních a krystaloidních roztoků. Důvodem je možnost redukce celkového podaného množství jednotlivých roztoků a využití pozitivní interference v rozdílnosti efektu na hemostázu. Výběr roztoku pro tekutinovou terapii by se měl řídit nejen jeho farmakologickými vlastnostmi (složení, osmolarita, rozpouštědlo, balancovanost), ale také riziky vyplývajícími z možnosti ovlivnění dalších fyziologických funkcí (koagulace, renální funkce, imunitní reakce, únik do třetího prostoru atd.) a v neposlední řadě i individuálními faktory pacienta (vrozené nebo získané koagulopatie, sepse, typ poranění a plánované operativy atd.).
Klinické studie zabývající se problematikou vztahu volumoterapie a hemostázy přinášejí často výrazně rozporuplné výsledky. Na této nejednotnosti se jistě podílí metodologie studií a limity v možnostech vyšetřovacích metod, ale také vliv marketingu farmaceutických společností. Obecná shoda však existuje ve dvou zásadních faktorech:
- a) Všechny substituční roztoky ovlivňují koagulaci.
- b) Charakter a klinická závažnost ovlivnění jsou dány typem roztoku a mírou hemodiluce.
Tekutinová resuscitace patří mezi neodkladné terapeutické intervence používané u pacientů ohrožených selháním nebo se selhávajícími funkcemi životně důležitých orgánů. Rozdíl mezi tekutinovou terapií, tekutinovou resuscitací a masivní tekutinovou resuscitací je v podstatě dán množstvím a rychlostí podaného náhradního roztoku. Definice „masivnosti“ není v literatuře jednotně specifikována, nicméně někteří autoři považují za „masivní“ takové podání roztoků, při kterém je podáno více tekutiny, než je jeden intravaskulární objem (tzn. více než 72 ml/kg), u 100 kg vážícího pacienta. Z praktického hlediska to znamená aplikaci 7 000 ml náhradních roztoků a více. Za těchto okolností je jistě úvaha o možném ovlivnění hemostázy na místě.
Závěr
Zůstává řada nezodpovězených otázek, mezi nimiž dominuje absence jednoznačně doporučeného algoritmu při tekutinové resuscitaci u jednotlivých stavů, včetně typů použitých náhradních roztoků. Z hlediska designu klinických studií je komplikujícím prvkem běžná klinická praxe, kdy se náhradní roztoky (krystaloidy/koloidy) kombinují. Jakmile je nutno použít krevní derivát, situace se stává prakticky nepřehlednou.
Vzhledem k nepřetržitému vývoji a zavádění náhradních roztoků do praxe lze konstatovat jediné: z hlediska adekvátní a racionální strategie tekutinové resuscitace je stále na prvním místě znalost základních farmakokinetických a farmakodynamických charakteristik náhradního roztoku a znalost fyziologie a patofyziologie daného onemocnění, která v běžné klinické praxi zohlední také předchorobí a aktuální zdravotní stav pacienta. Jinými slovy, akutní levostranné selhání by mělo vést k jiné strategii tekutinové resuscitace než stav ischemicko‑reperfuzního postižení po polytraumatu.
Na základě těchto znalostí lze lépe přizpůsobit algoritmus substituční terapie a její monitoraci a na podkladě toho pak přesněji načasovat indikaci k terapii případných koagulačních poruch, které mohou negativně ovlivnit celkový výstup námi zvolené terapeutické strategie a také prognózu kriticky nemocného pacienta.
Doručeno do redakce: 21. 7. 2008
Přijato po recenzi: 3. 9. 2008
MUDr. Jan Máca
www.fnspo.cz
e‑mail: janmaca@email.cz
Sources
1. Barak M, Rudin M. Fluid administration during abdominal surgery influences coagulation in the postoperative period. Curr Surg 2004; 61 : 459–462.
2. Bickell WH, Bruttig SP. The detrimental effects of intravenous crystalloid after aortotomy in swine. Surgery 1991; 110 : 529–536.
3. Boldt J, Haisch G, Suttner S et al. Are lactated Ringer’s solution and normal saline solution equal with regard to coagulation? Anesh Analg 2002; 94 : 378–384.
4. Boldt J, Heesen M. Does the type of volume therapy influence endothelial‑related coagulation in the critically ill? Br J Anaesth 1995; 75 : 740–746.
5. Boldt J, Suttner S. Plasma substitutes. Minerva Anestesiol 2005; 71 : 741–758.
6. Boldt J. Volume replacement in the surgical patient – does the type of solution make a difference? Br J Anaesth 2000; 84 : 783–793.
7. Brummel-Ziedins K, Whelihan MF, Ziedins EG et al. The resucitative fluid you choose may potentiate bleeding. J Trauma 2006; 61 : 1350–1358.
8. Coats TJ, Brazil E, Heron M et al. Impairment of coagulation by commonly used resuscitation fluids in human volunteers. Emerg Med J 2006; 23 : 846–849.
9. Cotton AC, Guy GS, Morriss JA et al. The celullar, metabolic and systemic consequences of aggresive fluid resuscitation strategies. Shock 2006; 26 : 115–121.
10. Egli GA, Zollinger A. Effect of progresive haemodilution with hydroxyaethykl starch, gelatin and albumin on blood coagulation. Br J Anaesth 1997; 78 : 684–689.
11. Gamsjäger T, Gustorff G. The effect of hydroxyaethy starches on intracellular calcium in platelets. Anesth Analg 2002; 95 : 866–869.
12. Janvir SB, Davies G, Greenhalgh RM. Postoperative deep vein thrombosis caused by intravenous fluids during surgery. Br J Surg 1980; 67 : 690–693.
13. Konrad C, Markl T. The effects of in vitro hemodilution with gelatin, hydroxyeathyl starch and lactated Ringer’s solution on markers of coagulation: an analysis using SONOCLOTTM. Anesth Analg 1999; 88 : 483–488.
14. Kowalenko T, Stern S. Improved outcome with hypotensive resuscitation of uncontrolled hemorrhagic shock in a swine model. J Trauma 1992; 33 : 349–353.
15. Lehmann G, Marx G, Förster H. Bioequivalence comparison between hydoxyethyl starch 130/0.42/6 : 1 and hydroxyethyl starch 130/0.4/9 : 1. Drugs RD 2007; 8 : 229–240.
16. Madjpour C, Dettori N, Frascarolo P et al. Molecular weight of hydroxyethyl starch: is there an effect on blood coagulation and pharmacokinetics? Br J Anaesth 2005; 94 : 569–576.
17. Mardel SN, Saunders FM, Allen H et al. Reduced quality of clot formation with saline based plasma substitutes. Br J Anaesth 1998; 80 : 204–207.
18. Mg Loughlin TM, Fontana JL. Profound normovolemic hemodilution: hemostatic effect in patients and in a porcine model. Anesth Analg 1996; 83 : 459–465.
19. Mortier E, Ongenae M. In vitro evaluation of the effect of profound haemodilution with hydroxyaethyl starch 6%, modified fluid gelatin 4% and dextran 40 10% on coagulation profile measured by thromboelastography. Anaesth 1997; 52 : 1061–1064.
20. Ng KF, Lam CCK. In vivo effect of haemodilution with saline on coagulation: a randomized controlled trial. Br J Anaesth 2002; 88 : 475–480.
21. Ng KF, Lo JW. The development of hypercoagulability state, as measured by thromboelastography, associated with intraoperative surgical blood loss. Anaesth Intensive Care 1996; 24 : 20–25.
22. Niemi TT, Kuitunen AH. Hydroxyaethyl starch impairs in vitro coagulation. Acta Anaesth Scand 1998; 42 : 1104–1109.
23. Owens TM, Watson WC. Limiting initial resuscitation of uncontrolled hemorrhage reduces internal bleeding and subsequent volume requirements. J Trauma 1995; 39 : 200–207.
24. Petroianu GA, Liu J. The effect of in vitro hemodilution with gelatin, dextran, hydroxyaethyl starch, or Ringer’s solution on thromboelastograph. Anesth Analg 2000; 90 : 795–800.
25. Riddez L, Johnson H. Central and regional hemodynamics during crystalloid fluid therapy after uncontrolled intra-abdominal bleeding. J Trauma 1998; 44 : 433–439.
26. Roche AM, James MF, Bennet–Guerrero E et al. A head-to-head comparison of the in vitro coagulation effects of saline‑based and balanced electrolyte crystaloid and colloid intravenous fluids. Anesth Analg 2006; 102 : 1274–1279.
27. Ruttman TB, Jams MF. Effects on coagulation of intravenous crystaloid or colloid in patients undergoing peripheral vascular surgery. Br J Anaesth 2002; 89 : 226–230.
28. Ruttmann TG, James MFM, Aronson I. In vivo effect oh haemodilution with hydroxyethyl starch (200/0.5) and normal saline. Br J Anaesth 1998; 80 : 612–616.
29. Ruttmann TG, James MFM, Viljoen JF. Haemodilution induces a hypercoagulable state. Br J Anaesth 1996; 76 : 412–414.
30. Ruttmann TG, Montoya-Pelaez LF, James MF. The coagulation changes induced by rapid in vivo crystalloid infusion are attenuated when magnesium is kept at the upper limit of normal. Anesth Analg 2007; 104 : 1475–1480.
31. Sommermeyer K, Cech F, Schossow R. Differences in chemical structures between waxy maize – and potato starch‑based hydroxyethyl starch volume therapies. Transfus Altern Transfus Med 2007; 9 : 127–133.
32. Stephens R, Mythen M. Resuscitation fluids and hyperchloraemic metabolic acidosis. Trauma 2003; 5 : 141–147.
33. Stern SA, Dronen SC. Multiple resuscitation regimens in near fatal porcine aortic injury hemorhage model. Acad Emerg Med 1995; 2 : 80–81.
34. Tobias MD, Wambold D. Differential effects of serial hemodilution with hydroxyaethyl starch, albumin, and 0.9% saline on whole blood coagulation. J Clin Anesth 1998; 10 : 366–371.
35. Türkan H, Ural AU. Effects of hydroxyethyl starch on blood coagulation profile. Eur J Aneaesthesiol 1999; 16 : 156–159.
36. von Roten I, Madjpour C, Frascarolo Pet al. Molar substitution and C2/C6 ratio of hydroxyethyl strach: influence on blood coagulation. Br J Anaesth 2006; 96 : 455–463.
37. Kula R, Chylek V, Sklienka P et al. Přínos a vybraná rizika krevních převodů. Čes Gynekol 2006; 71 : 494–499.
38. Kula R, Szturz P, Sklienka P et al. Negative fluid balance in patients with abdominal compartment syndrome – Case Reports. Acta Chir Belg 2008; 108 : 100–102.
39. Ruttmann TG. Haemodilution enhances coagulation. Br J Anaesth 2002; 88 : 470–472.
40. Boldt J. The balanced concept of fluid resuscitation Br J Anaesth 2007; 99 : 312–315.
41. Tocantins LM. Clinical and physiologic aspects of blood coagulation. Ann West Med Surg 1950; 4 : 61–65.
42. Tuman KJ, Speiss BD, McCarthy RJ et al. Effects of progressive blood loss on coagulation as measured by thromboelastography. Anesth Analg 1987; 66 : 856–863.
43. Ruttmann TG, James MF. Pro-coagulant effect of in vitro coagulation is not inhibited by aspirin. Br J Anaesth 1999; 83 : 330–332.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 1-
All articles in this issue
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
- Incidence pankreatického karcinomu u osob s chronickou pankreatitidou
- Kardiovaskulární rehabilitace v současnosti
- Ovlivnění hemostázy při terapii náhradními roztoky
- Infarkt myokardu, remodelace levé komory a buněčná terapie
- Účinnost anti‑TNF‑α léčiv v běžné klinické praxi a náklady na tato léčiva
- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Kardiovaskulární rehabilitace v současnosti
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career







