-
Medical journals
- Career
Akutní perikarditida jako orgánová manifestace akutní infekce Chlamydia pneumoniae
Authors: M. Rýzlová; P. Gregor
Authors‘ workplace: III. interní-kardiologická klinika 3. lékařské fakulty UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC
Published in: Vnitř Lék 2008; 54(9): 866-870
Category: Case Report
Overview
Prezentujeme případ 52letého pacienta, který byl léčen na naší klinice pro velmi vzácnou akutní chlamydiovou perikarditidu (infekce Chlamydia pneumoniae) s velkým perikardiálním výpotkem. Klinický průběh onemocnění imponoval jako akutní systémové onemocnění. Popisujeme diferenciálně diagnostický algoritmus během hospitalizace i příslušnou podávanou terapii. Podobné případy jsou v literatuře popisovány jen velmi vzácně. V diskuzi je proveden rozbor možných orgánových manifestací při akutní i chronické infekci Chlamydia pneumoniae. Tato bakterie může kromě nejčastěji napadaného respiračního traktu být u člověka příčinou i vzdálených orgánových komplikací s postižením např. kloubů, plic, CNS i srdce. Lékem volby je vždy dlouhodobá antibiotická terapie (makrolidy, fluorochinolony či tetracykliny).
Klíčová slova:
Chlamydia pneumoniae – perikarditida – orgánové manifestaceÚvod
Příčiny akutní perikarditidy bývají různorodé. Mezi nejčastěji uváděné patří akutní infekce, hlavně virová, méně často již bakteriální či mykotická. Dále to mohou být příčiny imunologické (choroby pojiva, stav po akutním infarktu myokardu), maligní tumory, endokrinopatie (např. hypotyreóza) nebo perikarditida v rámci postperikardiotomického syndromu [1].
Popis případu
Na konci listopadu roku 2006 byl na naši kliniku přeložen z okresní nemocnice 52letý pacient s anamnézou 2 týdny trvajícího protrahovaného febrilního stavu nejasné etiologie a echokardio-grafickým nálezem většího perikardiálního výpotku.
Anamnesticky šlo o dosud zcela zdravého muže, aktivního sportovce. V osobní anamnéze jen udával asi 2 týdny před vznikem obtíží recentně odeznělý infekt horních cest dýchacích, který byl přeléčen krátkodobě Klacidem (6 dní!) s dobrým efektem.
Pro náhle vzniklý febrilní stav a dušnost, která se rozvinula po nadměrné fyzické aktivitě (pacient absolvoval tréninkovou zátěž), byl poté hospitalizován v okresní nemocnici. Zde byla diagnostikována levostranná bronchopneumonie, nasazena kombinovaná terapie Augmentin + Gentamicin a pro nález velkého perikardiálního výpotku a stále se nelepšící klinický stav byl pacient přeložen na naši kliniku.
Klinicky u pacienta od přijetí dominoval těžký febrilní stav se schváceností, suchým kašlem a bolestí v prekordiu.
Při fyzikálním vyšetření jsme nacházeli febrilního pacienta, poslech plic bilaterálně s krepitacemi nad bazemi, vlevo s naznačeným trubicovým dýcháním, mírnou hepatomegalií (hepar + 3 cm pod obloukem žeberním, nebolestivá).
V laboratorních výsledcích od přijetí dominovala výrazná elevace zánětlivých parametrů – CRP 302 mg/l, FW 90/110, krevní obraz byl v normě, taktéž byla přítomna mírná elevace transamináz (ALT 1,3 µkat/l a AST 1,52 μkat/l), kardiospecifické enzymy opakovaně negativní.
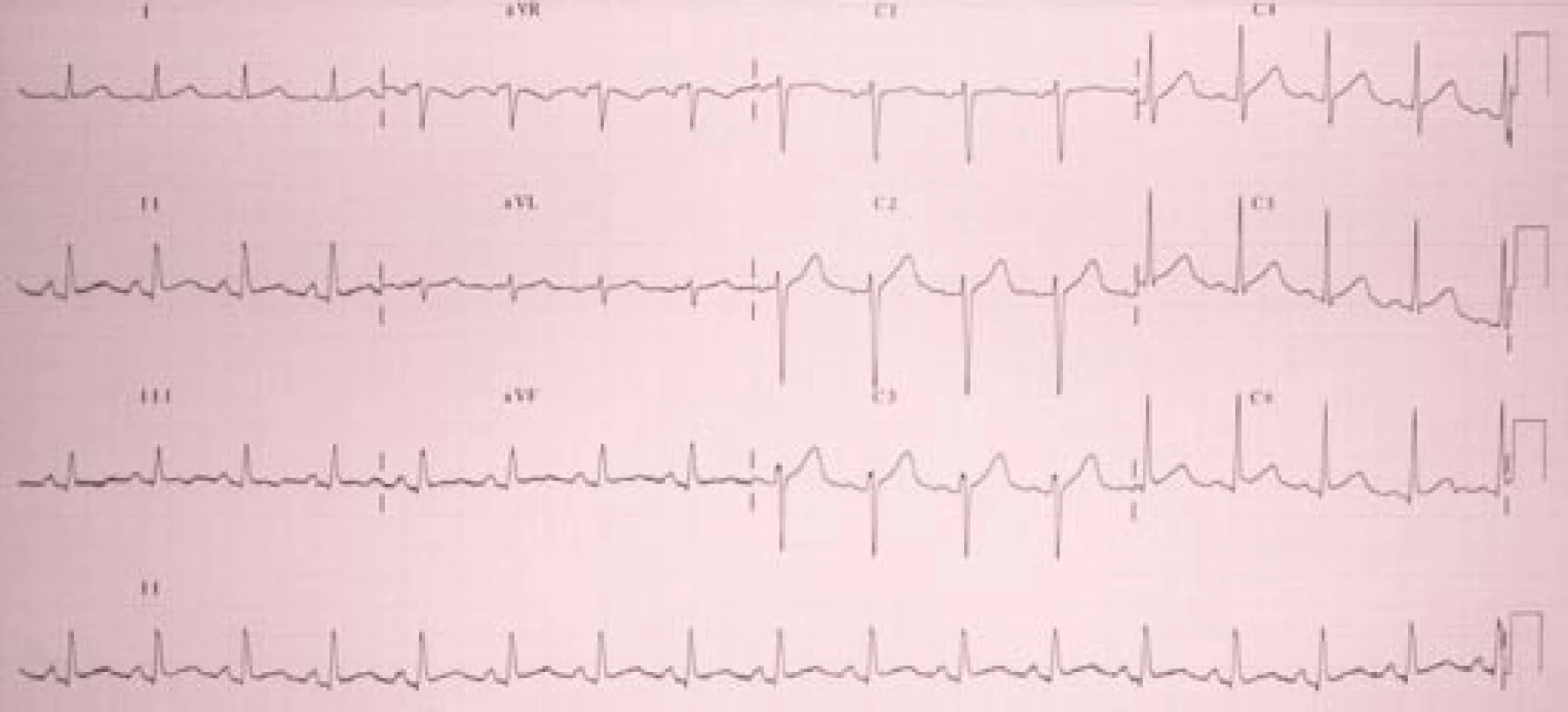
Na EKG jsme našli sinusovou tachykardii (akce 106/min), s 1mm elevacemi úseků ST v II, III, aVF, V2–V6 (obr. 1).
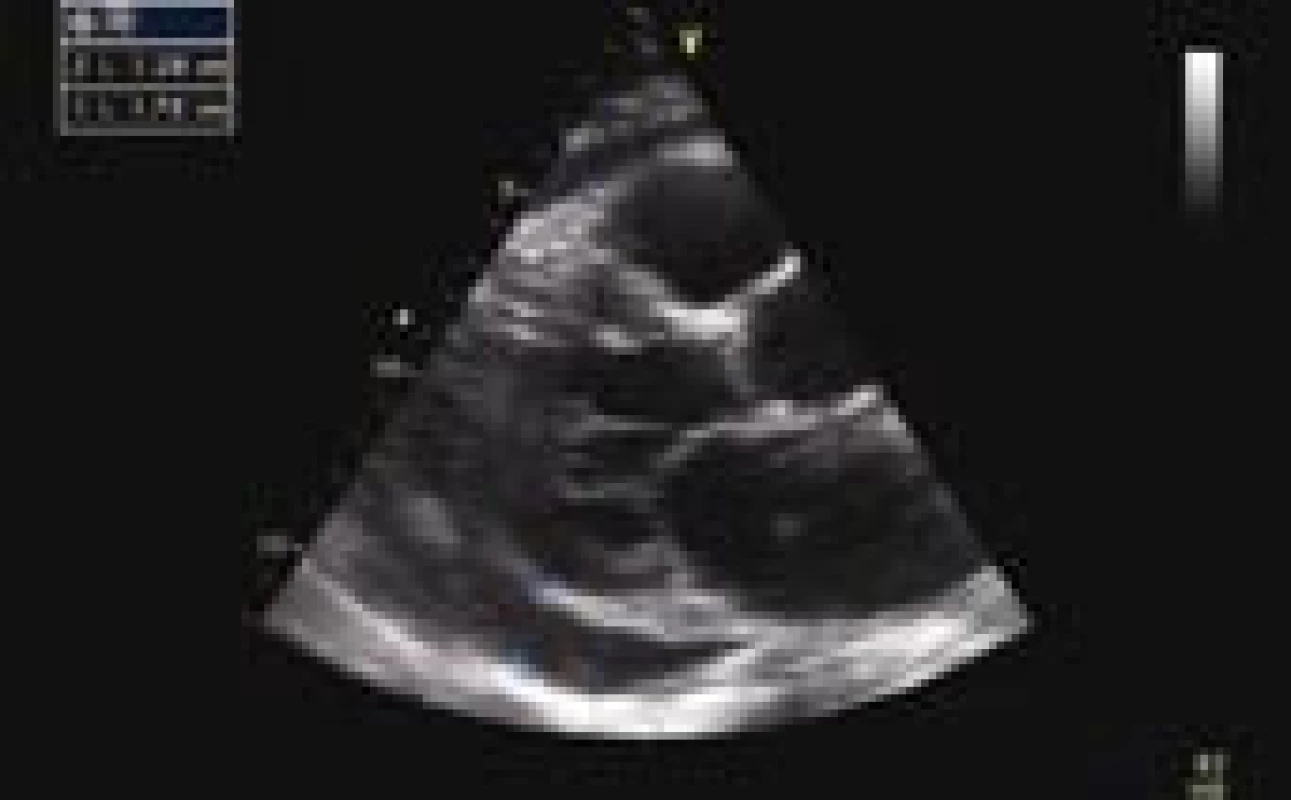
Z provedených zobrazovacích vyšetření vstupní ECHO prokázalo velký perikardiální výpotek (separace perikardu cirkulárně před PK 13 mm, za LK až 18 mm), bez známek tamponády (obr. 2). Provedené CT hrudníku potvrdilo perikardiální a taktéž levostranný pleurální výpotek a vyloučilo případnou embolii plicní. Na RTG plic byl levostranný infiltrát 3 × 2 cm (obr. 3). Ultrazvukové vyšetření břicha s normálním nálezem vyjma mírné splenomegalie (120 × 40 mm).
Image 3. RTG srdce a plic před terapií. 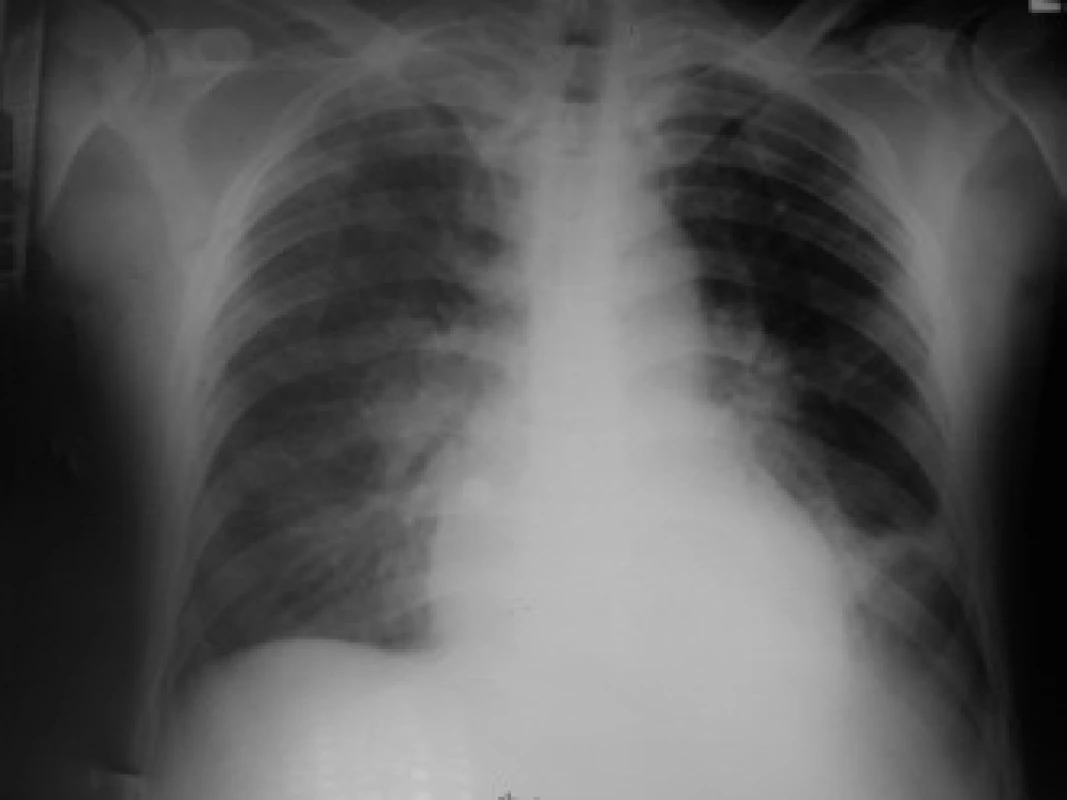
Pacientovi byla zprvu ponechána kombinovaná ATB terapie (Amoksiklav + Gentamicin), která však neměla zjevný klinický efekt, proto byly ATB dále změněny na Augmentin + Ciphin.
Opakovaně prováděné kultivace biologického materiálu (výtěry nosu, krk, pleurální výpotek, hemokultury, moč) byly negativní. Byla odeslána též širší sérologie (herpes viry, EBV, CMV, chlamydie, mykoplazma, toxokara, borrelie, toxoplazma, leptospiry, širší panel autoprotilátek).
V rámci diferenciální diagnostiky byla vyloučena hematologická malignita – provedením sternální punkce, celotělového PET vyšetření, leukoscanu a CT břicha. Předpokládala se spíše autoimunitní systémová choroba, kterou podporovaly nálezy hepatosplenomegalie, pozitivita autoprotilátek (pozitivní titr ANA 1 : 160, AntiJo-1, antikardiolipinové protilátky IgG i IgM), mírná mikroalbuminurie, pozitivní Coombsův test s přítomností tepelných autoprotilátek v krvi svědčící pro počínající autoimunitní hemolytickou anémii.
Proto byla dále ATB terapie ukončena a byla nasazena kortikoterapie (v denní dávce 60 mg Prednisonu).
Klinicky u pacienta došlo postupně k poklesu teplot, ale nadále přetrvávaly subfebrilie, laboratorně poklesly zánětlivé parametry (CRP 52 mg/l), na RTG plic vymizel levostranný plicní infiltrát, ECHO vyšetření však prokázalo progresi perikardiálního výpotku (separace perikardu za LK 26 mm/PK 11 mm).
Poté byla zjištěna sérologická pozitivita akutní chlamydiové infekce (pozitivní IgG i IgA metodou mikroimuno-fluorescence jak rodově, tak druhově specifické protilátky Chlamydia pneumoniae, Národní referenční laboratoř pro Chlamydie, SZÚ, Praha). Pacientovi byla nasazena terapie makrolidy (Klacid SR 500 mg po 12 hod) po dobu 6 týdnů, s postupným pomalým vysazením kortikoterapie za pečlivé monitorace hladin hemoglobinu.
Klinicky byl pacient nadále již afebrilní, došlo k postupné restituci perikardiálního výpotku ad integrum (během asi 6 týdnů – obr. 4), laboratorně po terapii Klacidem jsme taktéž prokázali vymizení tepelných autoprotilátek z krve a Coombsův test nadále zůstával negativní, stejně tak i titry autoprotilátek (ANA, antiJo-1).
Image 4. RTG srdce a plic po terapii. 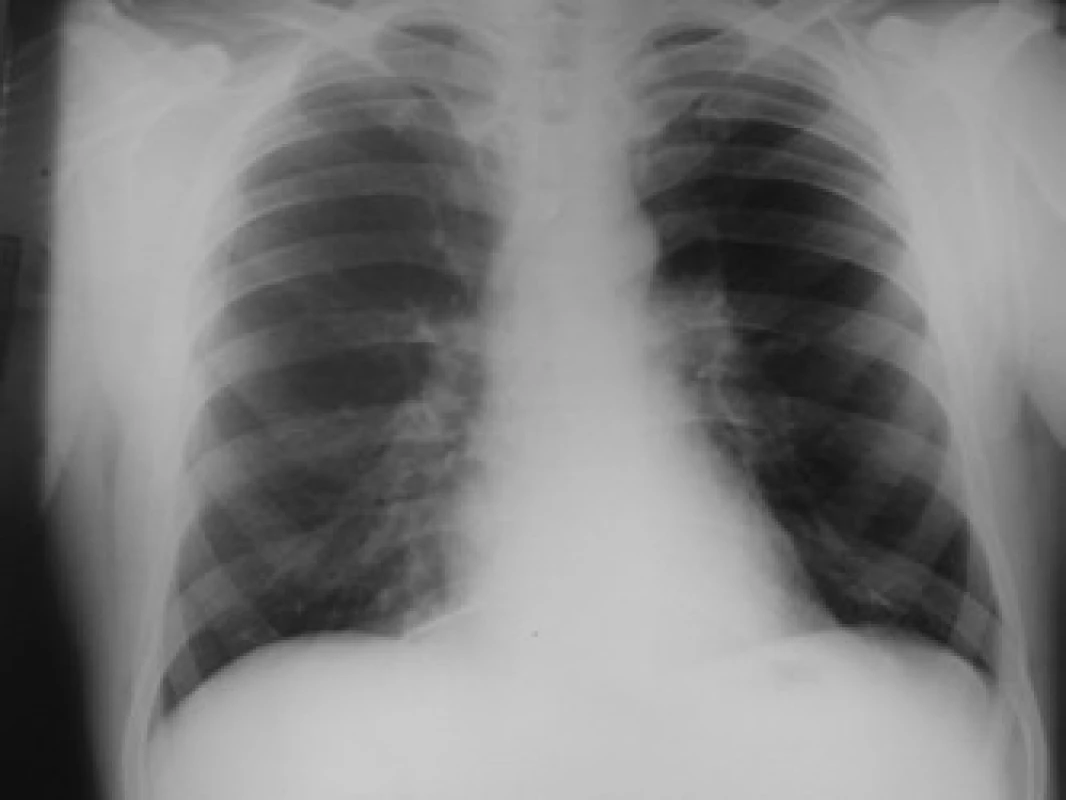
Kontrolní sérologie za 3 týdny potvrdila recentně proběhlou aktivní infekci Chlamydia pneumoniae (došlo k typické sérokonverzi protilátek – nárůstu titru druhově specifických protilátek a zároveň poklesu v titru rodově specifických protilátek).
Pacient byl i nadále v ambulantním sledování naší kliniky a po 4 týdnech od vysazení ATB terapie u něj došlo v březnu roku 2007 pravděpodobně k relapsu onemocnění (klinicky opět tlak za sternem, dle ECHO vyšetření nově malý perikardiální výpotek s 3 mm separací). Po nasazení kombinované ATB terapie (Klacid, Entizol) tyto nálezy rychle regredovaly. Nyní je již 9 měsíců zcela bez obtíží.
Závěr popisu případu
Popisujeme zde případ velmi vzácné akutní chlamydiové perikarditidy s velkým perikardiálním výpotkem, který se zprvu klinicky manifestoval jako akutní systémové onemocnění. Podobné případy jsou v literatuře popisovány jen velmi vzácně [2,3]. Na tuto etiologii je vhodné pomýšlet, pokud dojde k rozvoji perikarditidy u pacienta s akutní bronchopneumonií a negativními kultivačními nálezy.
Diskuze
Akutní infekce Chlamydia pneumoniae (CHP) může mít protrahovaný průběh. Po akutním primoinfektu, který většinou napadá respirační trakt a projeví se jako akutní bronchitida či pneumonie, se může manifestovat i formou perzistujících orgánových onemocnění.
CHP může být příčinou parainfekčně navozené reaktivní artritidy [4,5], kdy přítomnost DNA CHP byla v postižených kloubech prokázána ve vzorcích synoviální tkáně metodou PCR až u 12,7 % pacientů s různými typy artritid [4,6]. Takto spuštěný kloubní zánět je však vzácný (dle různých zdrojů od 2,2 do 10 % všech reaktivních artritid) [5,7,8]. Nutno dodat, že při kloubní infekci se etiologicky mnohem častěji uplatňuje jiný druh chlamydie, a to Chlamydia trachomatis [6,9], zvláště u osob po prodělané infekci urogenitálního traktu.
Prodělaná infekce CHP bývá spojována i s chronickým postižením plic. Několik prací prokázalo spojitost mezi pozitivní sérologií CHP a vyšší incidencí akutních exacerbací CHOPN či astma bronchiale [10–13]. U pacientů s akutní exacerbací astmatu byla prokázána jak prevalence protilátek (IgG, IgA) proti CHP, tak hladina titrů protilátek (IgG i IgA) signifikantně vyšší než u kontrolního vzorku osob [14]. Allegra et al prokázali u pacientů s akutní exacerbací astmatu až v 8 % známky aktivní infekce CHP [15]. Podobné nálezy potvrdil i Zaitsu u dětí, kdy prodělaná infekce CHP u kojenců byla spojena s vyšším rizikem rozvoje astma bronchiale v budoucnosti [16]. Spojitost mezi vznikem plicního karcinomu a prodělanou infekcí CP nebyla metaanalýzou dosavadních studií jednoznačně prokázána [17].
Postižení centrálního nervového sy-stému při akutní infekci CHP je vzácné. V literatuře jsou popisovány ojedinělé případy manifestace akutní meningoencefalitidy [18,19], syndromu Guillain‑Barré či cerebelární ataxie [20].
Diskutována je i možná spoluúčast chronické infekce CHP při vzniku roztroušené sklerózy, kdy jsou výsledky provedených studií rozdílné. Zatímco ně-kte-ré práce prokázaly jednoznačně vyšší přítomnost DNA CHP v mozkomíšním moku metodou PCR u pacientů s touto chorobu [21,22], jiné tuto skutečnost nepotvrdily [23], a tak se dnes souvislost chronické infekce CHP a vývoje roztroušené sklerózy stále diskutuje [24,25].
Akutní infekce CHP může postihnout vzácně i srdce. Popisovány jsou případy akutní chlamydiové endokarditidy [26], myo - a perimyokarditidy [27,28], které často probíhají velmi těžce až fulminantně, i akutní perikarditidy [2,3].
Účast protrahované infekce CHP byla v kardiologii řadu let spojována s možnou akcelerací koronární aterosklerózy. Tuto souvislost podporoval jak přímý nález chlamydií v aterosklerotických plátech koronárních tepen [29], tak několik studií poukazujících na možnou korelaci mezi pozitivní sérologií CHP a vyšším rizikem vzniku ICHS [30–33]. Poslední velké studie však neprokázaly ani vyšší incidenci ICHS [34], ani vyšší mortalitu na ICHS u pacientů se sérologickými známkami prodělané infekce CHP [35–37].
Také dlouhodobá ATB terapie u pa-cientů s akutní i chronickou formou ICHS nepřináší jasný benefit této terapie u žádné z forem ICHS [38–40].
Infekce CHP není vzácná a může být u člověka příčinou mnoha onemocnění. Proto je nutné na ni v rámci diferenciální diagnostiky pomýšlet, včas ji diagnostikovat (v našich podmínkách nejčastěji sérologicky) a dostatečně dlouho léčit příslušnou antibiotickou (ATB) terapií. Lékem volby jsou dnes hlavně makrolidová ATB (zejména azi-tromycin), ale je možno použít i tetracykliny a fluorované chinolony vyšší generace. Základní schéma dávkování a limitace příslušné ATB terapie uvádí tab. 1.
Table 1. Základní schéma dávkování a limitace příslušné antibiotické terapie. 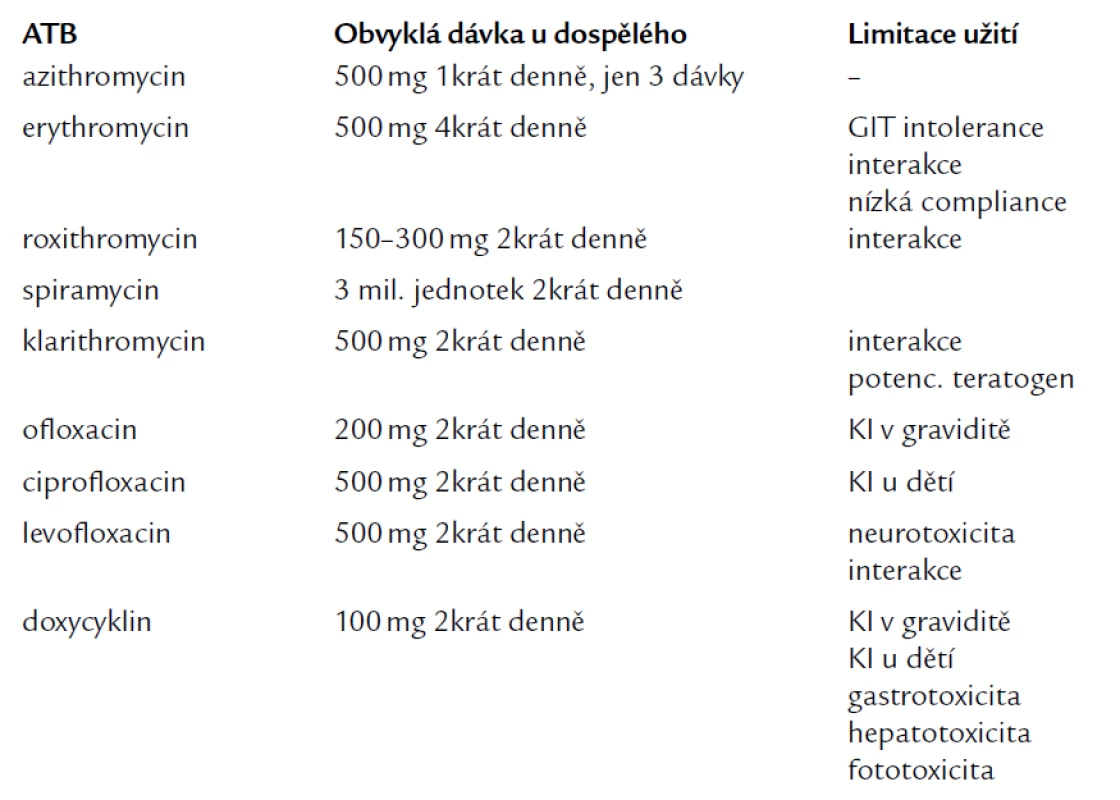
Makrolidová ATB vykazují v léčbě chlamydiových infekcí nejvyšší účinnost, a to z mnoha příčin. Jednak tím, že dosahují vysokých především tkáňových a buněčných koncentrací, které jsou pro eradikaci chlamydií zásadní (nejvyšší tkáňovou koncentraci dosahuje azitromycin), dále mají poměrně malé množství nežádoucích účinků (dominuje nesnášenlivost gastroin-testinálního traktu) a jejich použití je spojené s vysokou compliance pacienta (zvláště u azitromycinu při užívání 1krát denně). Vykazují také ně-kte-ré imunomodulační schopnosti – snižují produkci interleukinu-1-β a tumor necrosis faktoru (TNF), zlepšují chemotaxi neutrofilů, mají protektivní účinek na řasinky respiračního epitelu. Limitací použití většiny makrolidů (vyjma azitromycinu) je však interakce na cytochromu P 450, což znemožňuje jejich podání současně s léky, jako jsou např. astemizol, warfarin, theofylin či digoxin.
Délka podávání ATB záleží na délce trvání infekce. U akutních infekcí CHP (v převážné většině se jedná o respirační infekty) je doporučená délka podávání minimálně 10–14 dní. V případě chronického postižení (ať již respiračního traktu či systémových komplikací) se doporučená délka podávání prodlužuje až na několik týdnů (minimálně 6–8 týdnů) [41].
Doručeno do redakce: 4. 3. 2008
Přijato po recenzi: 27. 4. 2008
MUDr. Michaela Rýzlová
www.fnkv.cz
e‑mail: Michaela.Ryzlova@seznam.cz
Sources
1. Gibbs ChR, Watson RD, Singh SP et al. Management of Pericardial Effusion by Drainage: Survey of 10 Years’ Experience in a City Centre General Hospital Serving a Multiracial Population. Postgrad Med J 2000; 76 : 809–813.
2. Tanenbaum T, Heusch A, Henrich B etal. Acute hemorrhagic pericarditis in a child with pneumonia due to Chlamydophila pneumoniae. J Clin Microbiol 2005; 43 : 520–522.
3. Zver S, Kozelj M, Cernelc P. Chlamydia pneumoniae pneumonia with acute hemor-rhagic pericarditis in patient with acute leukemia. Haematologica 1997; 82 : 254.
4. Villareal Ch, Whittum-Hudson J, Hudson A. Persistent chlamydiae and chronic arthritis. Arthritis Res 2002; 4 : 5–9.
5. Hannu T, Puolakkainen M, Leirisalo-Repo M. Chlamydia pneumoniae as a triggering infection in reactive arthritis. Rheumatology (Oxford) 1999; 38 : 411–414.
6. Schumacher HR, Gérard HC, Arayssi TK et al. Lower prevalence of Chlamydia pneumoniae DNA compared with Chlamydia trachomatis DNA in synovial tissue of arthritis patients. Arthritis Rheum 1999; 42 : 1889–1893.
7. Melby KK, Kvien KT, Glennas A et al. Chlamydia pneumoniae as a trigger of reactive arthritis. Scand J Infect Dis 1999; 31 : 327–328.
8. Braun J, Laitko S, Treharne J et al. Chlamydia pneumoniae – a new causative agent of reactive arthritis and undifferentiated oligoarthritis. Ann Rheum Dis 1994; 53 : 100–105.
9. Fendler C, Laitko S, Sorensen H et al. Frequency of triggering bacteria in patients with reactive arthritis and undifferentiated oligoarthritis and the relative importance of the tests used for diagnosis. Ann Rheum Dis 2001; 60 : 337–343.
10. Laurila AL, Von Hertzen L, Saikku P. Chlamydia pneumoniae and chronic lung diseases. Scand J Infect Dis Suppl 1997; 104 : 34–36.
11. Hahn DL, Golubjatnikov R. Asthma and chlamydial infection: a case series. J Fam Pract 1994; 38 : 589–595.
12. Hahn DL, Dodge RW, Golubjatnikov R. Association of Chlamydia pneumoniae (Strain TWAR) infection with wheezing, asthmatic bronchitis and adult-onset asthma. JAMA 1991; 266 : 225–230.
13. Brandén E, Koyi H, Gnarpe J et al. Chronic Chlamydia pneumoniae infection is a risk factor for the development of COPD. Respir Med 2005; 99 : 20–26.
14. Miyashita N, Kubota Y, Nakajima M et al. Chlamydia pneumoniae and exacerbations of asthma in adults. Ann Allergy Asthma Immunol 1998; 80 : 405–409.
15. Allegra L, Blasi F, Centanni S et al. Acute exacerbations of asthma in adults: Role of Chlamydia pneumoniae infection. Eur Respir J 1994; 7 : 2165–2168.
16. Zaitsu M. The development of asthma in wheezing infants with Chlamydia pneumoniae infection. J Asthma 2007; 44 : 565–568.
17. Littman AJ, Jackson LA, Vaughan TL. Chlamydia pneumoniae and lung cancer: epidemiologic evidence. Cancer Epidemiol Biomarkers Prev 2005; 14 : 773–778.
18. Guglielminotti J, Lellouche N, Maury E et al. Severe meningoencephalitis: an unusual manifestation of Chlamydia pneumoniae infection. Clin Infect Dis 2000; 30 : 209–210.
19. Anton E, Otegui A, Alonso A. Meningoencephalitis and Chlamydia pneumoniae infection. Eur J Neurol 2000; 7 : 586.
20. Korman TM, Turnidge JD, Grayson ML. Neurological complications of chlamydial infection: Case report and review. Clin Inf Dis 1997; 25 : 847–851.
21. Sriram S, Stratton Ch, Yao S et al. Chlamydia pneumoniae infection of the central nervous system in multiple sclerosis. Ann Neurol 1999; 46 : 6–14.
22. Stratton CW, Wheldon DB. Multiple sclerosis: an infectious syndrome involving Chlamydophila pneumoniae. Trends Microbiol 2006; 14 : 474–479.
23. Hammerschlag MR, Zheng K, Fengmin L et al. Is Chlamydia pneumoniae present in brain lesions of patients with multiple sclerosis? J Clin Microbiol 2000; 38 : 4274–4276.
24. Bagos PG, Nikolopoulos G, Ioannidis A. Chlamydia pneumoniae infection and the risk of multiple sclerosis: a meta‑analysis. Mult Scler 2006; 12 : 397–411.
25. Hammerschlag MR, Gaydos CHA. Infectious causes of multiple sclerosis. C pneumoniae and MS: fact or fiction. Lancet Neurol 2006; 5 : 892–893.
26. Gdoura R, Pereyre S, Frikha I et al. Culture-negative endocarditis due to Chlamydia pneumoniae. J Clin Microbiol 2002; 40 : 718–720.
27. Gnarpe H, Gnarpe J, Gastrin B et al. Chlamydia pneumoniae and myocarditis. Scand J Infect Dis Suppl 1997; 104 : 50–52.
28. Walder G, Gritsch W, Wiedermann ChJ et al. Co-infection with two Chlamydophila species in a case of fulminant myocarditis. Crit Care Med 2007; 35 : 623–626.
29. Robinson-Taylor D, Thomas BJ. Chlamydia pneumoniae in atherosclerotic tissue. J Inf Dis 2000; 181 (Suppl 3): 437–440.
30. Kalayoglu MV, Libby P, Byrne GI. Chlamydia pneumoniae as en emerging risk factor in cardiovascular disease. JAMA 2002; 288 : 2724–2731.
31. Siscovick DS, Schwartz SM, Corey L et al. Chlamydia pneumoniae, herpes simplex virus type 1, and Cytomegalovirus and incident myocardial infarction and coronary heart disease death in older adults. Circulation 2000; 102 : 2335–2340.
32. Strachan DP, Carrington D, Mendall M et al. Relation of Chlamydia pneumoniae serology to mortality and incidence of ischaemic heart disease over 13 years in the caerphilly prospective heart disease study. BMJ 1999; 318 : 1035–1040.
33. Roivainen M, Viik-Kajander M, Palosuo T et al. Infections, inflammation and the risk of coronary heart disease. Circulation 2000; 101 : 252–257.
34. Danesh J, Whincup P, Walker M et al. Chlamydia pneumoniae IgG titres and coronary heart disease: prospective study and meta‑analysis. BMJ 2000; 321 : 208–213.
35. Wald NJ, Law MR, Morris JK et al. Chlamydia pneumoniae infection and mortality from ischaemic heart disease: large prospective study. BMJ 2000; 321 : 204–207.
36. Haim M, Tanne D, Battler A et al. Chlamydia pneumoniae and future risk in patients with coronary heart disease. Int J Cardiol 2004; 93 : 25–30.
37. Westerhout CM, Gnarpe J, Chang WC et al. No prognostic significance of chronic infection with Chlamydia pneumoniae in acute coronary syndromes: insights from the Global Utilization of Strategies to Open Occluded Arteries IV Acute Coronary Syndromes trial. Am Heart J 2007; 154 : 306–312.
38. Cannon CHP, Braunwald E, Carolyn H et al. Antibiotic treatment of chlamydia pneumoniea after acute coronary syndrome. N Engl J Med 2005; 352 : 1646–1654.
39. Danesh J. Antibiotics in the prevention of heart attacks. The Lancet 2005; 365 : 365–368.
40. Kuppuswamy VC, Gupta S. Antibiotic therapy for coronary heart disease: The myth and reality. Timely Top Med Cardiovasc Dis 2006; 10: E2.
41. Medková Z, Kalousek I, Jarčuška P. Chlamydiové infekce. Praha: Triton 2001, 73–106.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 9-
All articles in this issue
- Embolizace větví a. mesenterica superior jako komplikace direktní angioplastiky řešená lokální trombolýzou
- Vliv vazebného intervalu spontánní komorové extrasystoly na hodnoty turbulence srdečního rytmu
- Ischemická choroba srdeční s předčasnou manifestací u mladých pacientů
- Vztah mezi výsledkem nutričního screeningu a mortalito u na jednotce intenzivní metabolické péče
- Zánětlivá re akce a její význam v průběhu nádorového procesu
- Hypertenze u dialyzovaných pacientů
- BK virová infekce po transplantaci ledvin
- Budd‑Chiari syndrom – úloha hematologa v multidisciplinárním přístupu
- Poškození ledvin při mnohočetném myelomu a dalších monoklonálních gamapatiích
- Zobrazení izolované metastázy maligního melanomu v pravé srdeční komoře pomocí scintigrafie s 67Galium-citrátem
- Akutní perikarditida jako orgánová manifestace akutní infekce Chlamydia pneumoniae
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poškození ledvin při mnohočetném myelomu a dalších monoklonálních gamapatiích
- BK virová infekce po transplantaci ledvin
- Hypertenze u dialyzovaných pacientů
- Ischemická choroba srdeční s předčasnou manifestací u mladých pacientů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career