-
Medical journals
- Career
Léčba krvácení transfuzními přípravky a krevními deriváty
: A. Buliková; M. Matýšková; M. Penka
: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc.
: Vnitř Lék 2008; 54(6): 623-631
: Reviews
Předneseno na XIII. Pařízkových dnech s mezinárodní účastí Diagnostika a léčba krvácení v praxi, konaných v Novém Jičíně ve dnech 15. a 16. 3. 2007.
Správné použití transfuzních přípravků a krevních derivátů ovlivňuje jak péči o nemocného, tak i čerpání zdrojů zdravotní péče. Při krvácení a/nebo v situacích s rizikem krvácení jsou tyto produkty často indikovány. Autoři shrnují různá doporučení, zkušenosti, indikace a problémy v hemoterapii se zaměřením na krvácivé komplikace.
Klíčová slova:
krvácení - transfuzní přípravky - krevní deriváty - indikaceÚvod
Léčba krví, případně komponentami z ní vyrobenými se zdá být logickým vyústěním analýzy následků při a/nebo po krevní ztrátě. Této skutečnosti si byli vědomi různí experimentátoři v 17. a 18. století, kteří bez ohledu na náboženské předsudky, oficiální zákazy a nebezpečí osobní perzekuce podávali zvířecí krev - obvykle ovčí či hovězí - více než 150 let. První, kdo se oficiálně vědecky přihlásil k této problematice ve své lékařské disertační práci na Univerzitě v Edinburgu v roce 1816, byl John Henry Leacock. Podání lidské krve nazval léčbou vhodnou jak pro „krevní deficit“, tak pro krevní ztrátu. Tak vlastně vymezil nejen léčbu krví, ale i pojmy profylaktického a léčebného podání krve, resp. v současném pojetí z krve odvozených složek. „Otcem krevní transfuze“ je pak označován James Blundell, který studoval na téže univerzitě, znal závěry Leacockovy a musel jako gynekolog opakovaně přihlížet ženám umírajícím na poporodní krvácení. Jako první použil a také publikovat přímé podání humánní krve [1].
Ani současný pohled na podání složek krve však není tak jednoznačný. Znalost celé řady komplikací a nežádoucích účinků transfuzních přípravků a krevních derivátů, zkušenosti s léčbou nemocných odmítajících transfuzi z náboženských důvodů, resp. i stavy, které byly vyřešeny přes nemožnost podání krevní náhrady v dané situaci, vedly k formulování principů „bezkrevné medicíny“ [2]. To vše nás přivádí jednak k nutnosti jasně vymezit stavy, u nichž je podání složek krve nezbytné a současně i řádně dokumentovat účinnost a cost/benefit takto podané léčby. Zejména v této druhé oblasti je však transfuzní medicína teprve na prvních metrech za startovací čárou [3-5].
Přehled transfuzních přípravků a krevních derivátů, obecné principy
Transfuzní přípravky (TP) jsou řazeny mezi individuálně vyráběné léčivé přípravky, jsou vyráběny v zařízeních transfuzní služby. V ČR nejsou ošetřeny metodami patogenní inaktivace. Jsou vyráběny ze směsí krevních složek, maximálně od 10 osob. Jejich přehled a základní vlastnosti uvádí tab. 1 a 3 [6-7].
1. Přehled „buněčných“ transfuzních přípravků. 
Krevní deriváty (KD) jsou řazeny mezi hromadně vyráběné léčivé přípravky, jsou vyráběny komerčně ve frakcionačních centrech ze směsí plazmy od tisíců osob. Jsou povinně ošetřeny metodami inaktivace patogenů nebo jsou vyrobeny rekombinantními technikami. Z pohledu možného přenosu infekčních agens jsou považovány za bezpečnější než TP. Jejich přehled uvádí tab. 2.
2. Přehled krevních derivátů k léčbě krvácivých komplikací. 
3. Přehled plazmatických transfuzních přípravků. 
Mezi základní principy léčby složkami krve patří, že žádný transfuzní přípravek ani krevní derivát by neměl být užit v případech, v nichž existuje jakákoli jiná účinná léčebná strategie.
Kdykoli je to možné, pacient musí být poučen o výhodách a rizicích aplikované substituční léčby resp. o jiných důvodech podání KD, resp. TP.
Důvod aplikace transfuzního přípravku a/nebo krevního derivátu musí být zaznamenán do dokumentace nemocného. Z dokumentace by měl zřetelně vyplývat výsledek poskytnuté léčby včetně výskytu případných nežádoucích účinků.
Terapeutické podání složek krve je indikováno v případech, v nichž již krvácení u nemocného nastalo a nedostatek určité součásti krve je možné u pacienta na základě anamnézy, analýzy situace, klinického či laboratorního vyšetření prokázat nebo předpokládat.
Profylaktickým podáním složek krve nazýváme potřebu podání transfuzního přípravu nebo krevního derivátu v situaci, v níž na základě anamnézy, klinického a/nebo laboratorního vyšetření a analýzy předpokládané budoucí situace (tj. vysoké riziko spontánních krvácivých projevů, potřeba invazivního či operačního výkonu, resp. i jiné zátěžové situace) indikujeme jeho podání.
Indikace transfuzních přípravků u pacientů s krvácením nebo s rizikem krvácení
Erytrocytové transfuzní přípravky
Náhrada erytrocytů u krvácejících pacientů je poměrně častým léčebným krokem. Potřeba substituce erytrocytů však nikdy nevyplývá ze zhodnocení jednoho parametru krevního obrazu. Rozhodnutí pro transfuzi musí být založeno na komplexním zhodnocení stavu a je závislé na faktorech, jako jsou příčina anémie, její tíže, rychlost jejího vzniku, pacientova schopnost anémii kompenzovat, pokračující ztráta krve a zabezpečení určité rezervy před vznikem tkáňové hypoxie.
Při akutní ztrátě krve obvykle posuzujeme indikaci k podání [8]:
- podle odhadované ztráty: ještě při ztrátě 15-30 % cirkulujícího objemu (dospělí 800-1 500 ml) je potřeba náhrady erytrocytů nepravděpodobná, pokud není preexistující anémie, redukovaná kardiorespirační rezerva nebo pokud krvácení nepokračuje. Při ztrátě 30-40 % je již nutnost substituční léčby vysoce pravděpodobná, při ztrátě větší než 40 % (> 2 000 ml) ji zahajujeme neprodleně.
- podle koncentrace hemoglobinu:
- u proběhlé hemoragie - pacient již nekrvácí: není indikace transfuze erytrocytů při hodnotách přesahujících 100 g/l, vždy indikována při hodnotách < 70 g/l. U hodnot hemoglobinu mezi 100 a 70 g/l není indikace jednoznačná; u pacientů nad 65 let věku, pacientů s kardiovaskulární nebo respirační chorobou je indikací hladina < 80 g/l; vždy jsou brány v úvahu klinické projevy anemického syndromu;
- u trvajícího krvácení - udržujeme hladinu hemoglobinu > 80 g/l, podáváme ohřátou na 37 ºC, rychlostí až 100 ml/min, v život ohrožujících situacích, ev. 0 Rh negativní bez křížové zkoušky [9].
Anémie v souvislosti s operačními výkony: při hodnotách hemoglobinu > 100 g/l není žádná indikace k úpravě substituční léčbou před výkonem. U většiny nemocných je nutnost před - nebo perioperační substituce zvážit individuálně dle výchozí hladiny a předpokládaných ztrát, resp. typu operace, roli hraje i věk a pohlaví (u žen je absolutní hladina hemoglobinu obvykle nižší) [10]. Akutní normovolemická anémie s koncentrací hemoglobinu okolo 50 g/l podle studie na zdravých dobrovolnících nevede k neadekvátní oxygenaci, i pro pacienty podstupující koronární bypass je hodnota 80 g/l dostatečně bezpečná. U plánovaných operačních výkonů je ve všech případech potřeba zvážit indikaci autologní transfuze.
Podání jedné transfuzní jednotky (TU) erytrocytového přípravku vede ke zvýšení hladiny hemoglobinu asi o 10 g/l u dospělého jedince průměrné hmotnosti.
Čerstvě zmražená plazma (ČZP)
Plazma pro klinické použití může být připravena odběrem plné krve od dárců (v transfuzní medicíně zkratka P) anebo z aferézy (zkratka PA). V ČR je používána jako čerstvě zmražená (ČZP, resp. fresh-frozen plasma - FFP) a karanténní (uvolněna k použití za 6 měsíců po opakovaném vyšetření dárce).
ČZP je jedním z nejvíce používaných transfuzních přípravků v léčbě i profylaxi krvácení. Indikace podání shrnuje tab. 4 [11-13].
Indikace jednoznačné zahrnují stavy, u nichž je podání plazmy indikováno jako postup první volby. Indikace podmíněné znamenají alternativní podání plazmy jako možnost u stavů, u nichž je jiný typ léčby upřednostňován a plazma je indikována jako doplněk této terapie či při selhání prvního postupu.
I když se relativně dobře definovaným obsahem různých koagulačních faktoru (tj. asi 1 IU/ml) zdá být plazma užitečná v řadě klinických situací, její zřetelný klinický i laboratorní efekt je předmětem nejen rozpaků [4], ale zejména v oblasti profylaktického podání a malé změny v běžných koagulačních testech se zdá být její role jednoznačně přeceňována [14-17]. Přitom v profylaktickém podání před chirurgickými výkony je indikována přibližně 1/3 podané plazmy [18], některé zprávy navíc dokladují její podání při nezjištěném koagulačním nálezu (až v 33-39 %), případně při normální (INR < 1,0 asi 1 %), resp. jen hraniční (INR 1,0-1,3; 9-10 %) hodnotě protrombinového času [19].
Deficit jednoho faktoru
Vzhledem k tomu, že ČZP obsahuje více či méně všechny faktory krevního srážení, teoreticky by mohla být zdrojem jakéhokoli z nich. S ohledem na relativně nízkou koncentraci a z toho vyplývající potřebu velkého aplikovaného objemu, na řadu nežádoucích účinků je však používána v případech, v nichž není k dispozici protivirově ošetřený krevní derivát s nízkým obsahem jiných proteinů. V našich podmínkách se tak stává plazma nejčastěji zdrojem faktoru V, XI (v zahraniční dostupný derivát je značně trombogenní), méně často i zdrojem F XIII [11,12] - zejména v této poslední indikaci může být nahrazena kryoprecipitátem. Dávky a intervaly podání vychází z minimální hemostatické hladiny, poločasu jednotlivých faktorů a z předpokládaného obsahu velmi přibližně (s ohledem na naředění antikoagulačním roztokem) 1 mezinárodní jednotky (UI) faktoru v 1 ml plazmy (tab. 5).
5. Substituce plazmatických koagulačních faktorů a léčebné alternativy. 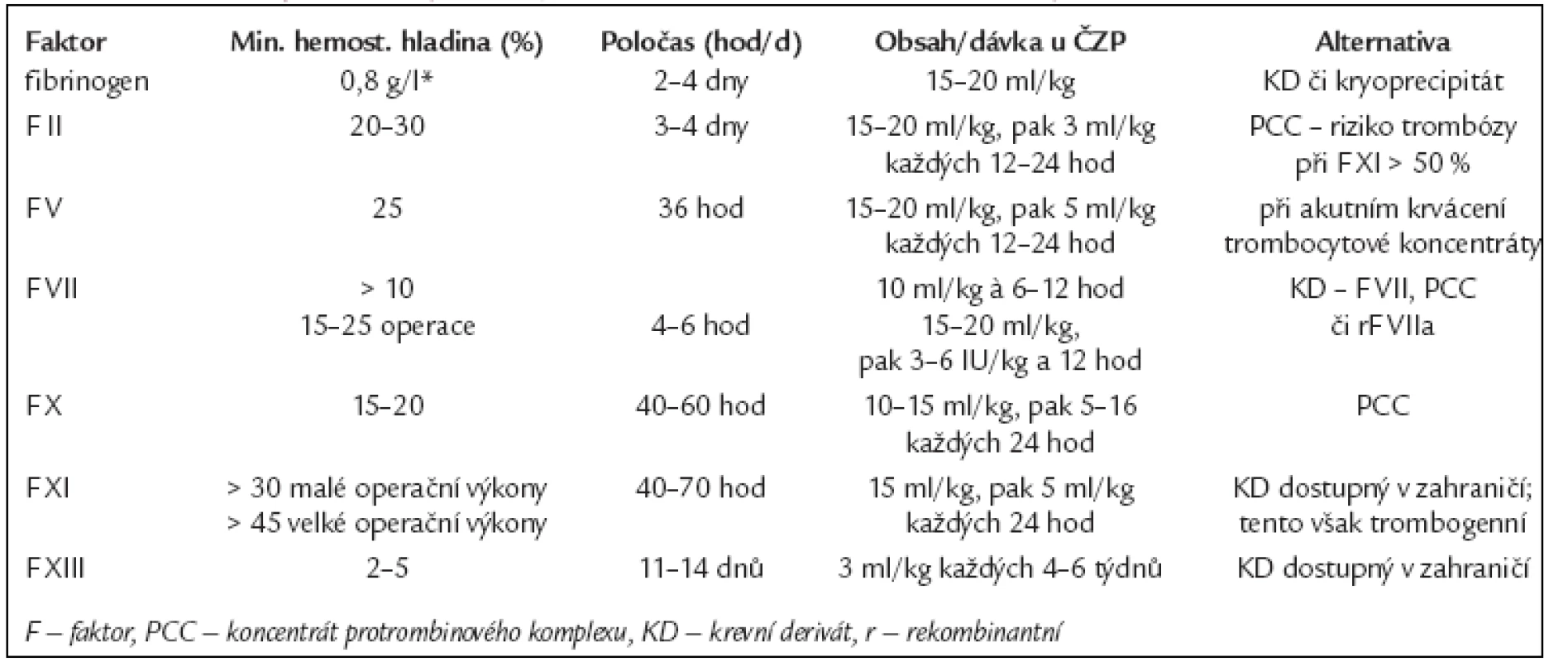
Diseminovaná intravaskulární koagulopatie
Krvácení, potřeba invazivního výkonu, resp. v některých případech i vysoké riziko spontánního krvácení mohou být spolu s výsledky laboratorních testů důvodem k použití ČZP v léčbě toho syndromu spolu s celou řadou dalších léčebných postupů, zejména těch, které ovlivňují vyvolávající příčinu. Je třeba připustit, že předpokládaná účinnost této léčby nebyla nikdy prokázána randomizovanými studiemi, stejně však nebyla nikdy potvrzena často zmiňovaná představa „přilévání benzinu do ohně“ [20]. Profylaktické podání plazmy v této indikaci nemůže rozvoji DIC zabránit, stejně tak nesnižuje množství podaných transfuzí [11].
Masivní krvácení/transfuze
Masivní krvácení může být definováno různě [21]:
- ztráta a náhrada 50 % celkového objemu krve v průběhu 3 hod
- ztráta krve 150 ml/min a větší
- ztráta krve 1,5 ml krve/kg tělesné hmotnosti za minutu v průběhu 20 min
- ztráty krve, které jsou tak rychlé a závažné, že přes adekvátní oběhovou náhradu a substituci erytrocytovými transfuzními přípravky převyšují kompenzační mechanizmy organizmu.
Při masivním krvácení dochází přes obvykle používanou léčbu krystaloidy, koloidy a erytrocytovými transfuzními přípravky k získané poruše krevního srážení. Tato může vlastní krvácení zhoršovat a vést ke vzniku bludného kruhu, který může vyústit ve smrt pacienta. Jde o komplikovaný děj, na kterém se podílí:
- hemodiluce z náhrady intravaskulárního objemu velkým množstvím objemových expandérů a erytrocytových koncentrátů, resp. i protrahovaným šokem
- hypotermie zapříčiňující destičkovou dysfunkci a neschopnost tvorby krevní sraženiny
- aktivace koagulace a fibrinolytické kaskády
- endoteliální postižení vedoucí k aktivaci koagulace, konzumpční koagulopatii až diseminované intravaskulární koagulaci
- acidóza při hemoragickém šoku, hypovolemii
- postižení jaterní syntézy plazmatických faktorů
- postižení clearence aktivovaných koagulačních faktorů z důvodu šokového stavu
- uvolnění tkáňového faktoru do cirkulace
V průběhu této poruchy hemostázy klesají jednotlivé parametry krevního srážení neproporcionálně - orientační schéma poskytuje tab. 6 [21].
6. Pokles jednotlivých faktorů krevního srážení v průběhu masivního krvácení a jeho léčby. 
Hladina fibrinogenu klesá nejrychleji při ztrátě asi 1,5násobku objemu, jeho hladina je obvykle okolo 1,0 g/l, počet trombocytů klesá naopak nejpomaleji - při ztrátě asi 1,5násobku objemu je vzácně pod 100 g/l - není-li jasná DIC.
Koagulopatie spojená s masivní transfuzí je obvykle více vyjádřena u velkých krevních ztrát vznikajících v důsledku traumatu, tzv. road to coagulopathy, nežli u krvácení vzniklého při elektivním chirurgickém výkonu - zde je možno obvykle zabránit šoku, acidóze, hypotermii, je možná časnější léčba [22].
Podání ČZP u koagulopatie spojené s masivním krvácení/transfuzí je obvykle indikováno jako lék první volby, podání by mělo být časné, dostatečnou rychlostí (obvykle však < 0,7 ml/kg/min, neboť vyšší dávky mohou být rizikové z projevů citrátové toxicity) a v dostatečných dávkách, tj. 10-20 ml/kg. Byly stanoveny parametry krevního srážení, které se ukazují být „limitujícími“ při masivním krvácení. Jsou-li zjištěny při suplementační léčbě ČZP, je již jen málo pravděpodobné, že se pouze jejím pokračujícím podáním podaří poruchu hemostázy zvládnout [23]. Tyto kritické hodnoty zahrnují hladinu fibrinogenu < 0,8 g/l, PT a aPTT > 1,8násobek normálních hodnot, aktivity jednotlivých faktorů < 20 %, aktivity komplexů faktorů < 40 %. V tomto případě je nutno použít doplňující či alternativní léčbu (fibrinogen, faktory protrombinového komplexu, rekombinantní faktor VIIa). Včasnost podání plazmy v této indikaci může mít taktéž své limitace, které jsou dané neznalostí krevní skupiny, dobou nutnou k rozpuštění a v případě této indikace i „ohřátí“ plazmy. Proces dodržení teploty rozpouštění maximálně v rozmezí 22-45 °C může mít na kvalitu plazmy zásadní vliv [24].
Chirurgické krvácení
Indikace ČZP se v tomto případě v zásadě neodlišuje od jejího podání při DIC a/nebo masivní hemoragii/transfuzi. Rozdíl je jen v tom, že obvykle je o pacientovi více informací, ať už z předoperačního vyšetření, ze zvážení rizik krvácení při vlastním výkonu nebo z „point of care“ typů vyšetření. Proto je obvykle možno zvážit různé alternativy a situace je většinou o něco méně naléhavá. Postupem volby může být tudíž jiný léčebný přístup - např. zrušení vlivu heparinu, podání antifibrinolytik, destičkových koncentrátů a podobně.
Zrušení účinku warfarinu
Řada doporučení, ať již expertních [7], nebo konsenzuálních [11] v této indikaci upozorňují, že plazma není lékem první volby; má jen částečný efekt vzhledem k nedostatečnému obsahu F II, VII, IX a X. Nutná korekce abnormálního protrombinového času (vyjádřeného hodnotou INR) by měla být provedena především p.o. nebo parenterální aplikací vitaminu K vždy v dávce nižší nežli 5 mg vzhledem k riziku vzniku warfarinové rezistence. U této léčby však musíme počítat s postupným rozvojem účinku v průběhu 6-24 hod po podání [25]. Při potřebě rychlé korekci hodnoty INR z důvodů krvácení či potřeby operačního výkonu se podle urgentnosti zásahu rozhodujeme mezi plazmou a koncentráty protrombinového komplexu [23]. Objem transfundované plazmy může být v této indikaci relativně velký a zejména pokud pacient současně masivně nekrvácí, může dojít k objemovému přetížení. Výpočet potřebné dávky je proveden na základě kalkulace:
počet ml plazmy = požadovaná – aktuální koncentrace faktoru × tělesná hmotnost
Přibližný přepočet hodnoty INR na % faktorů protrombinového komplexu uvádí tab. 7 [26].
7. Plazmatická koncentrace faktorů protrobminového komplexu podle hodnoty INR. 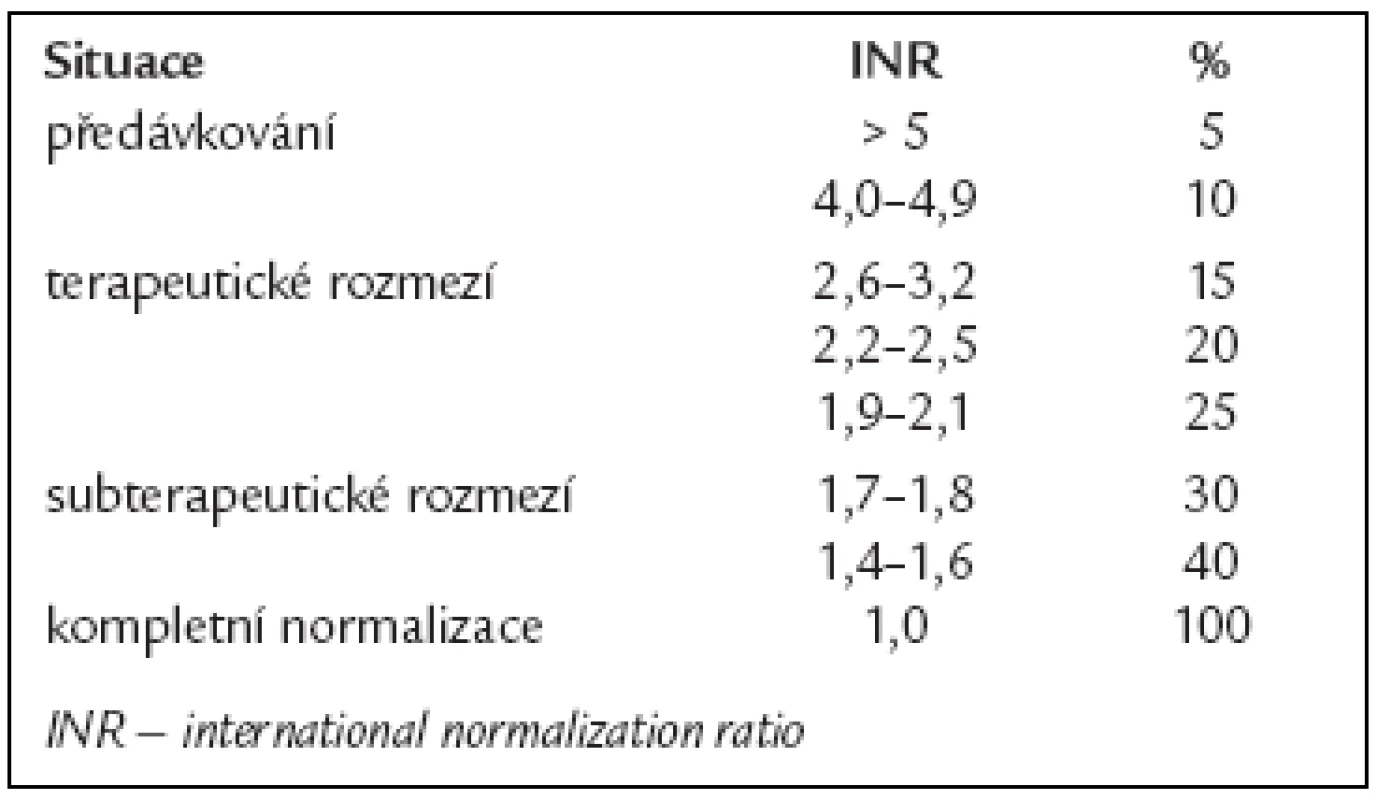
Neměli bychom zapomínat na doporučení, že některé invazivní výkony lze provést při zavedené antikoagulační léčbě v cílovém rozmezí bez potřeby její úpravy [27-30]. Patří mezi ně dentoalveolární výkony, endoskopické vyšetření včetně biopsie a operace katarakty.
Porucha jater
Při jaterním postižení dochází obvykle ke komplexním změnám v procesu krevního srážení. Poruchy jsou jak na úrovni primární hemostázy při sekundární trombocytopenii, koagulačních plazmatických faktorů i jejich inhibitorů, které jsou v játrech syntetizovány, tak i na úrovní fibrinolýzy, která bývá většinou aktivována. Podílí se i řada dalších vlivů, jako je porucha clearence aktivovaných faktorů krevního srážení a podíl konzumpční koagulopatie.
Přehled různých doporučení, která indikují podání ČZP při krvácení a/nebo při přípravě invazivního výkonu při hepatopatii, udává tab. 8 [31]. Lze konstatovat určitou nejednotnost ve vyjádření patologie v protrombinovém času: alternativně se používá vyjádření v sekundách, v poměru R, mezinárodním normalizovaným poměrem INR nebo jako procento aktivity faktorů. Zdá se, bohužel, že INR se běžně používá pro zjištění patologie a pro určení potřeby substituční léčby i u jaterních chorob, přestože není vhodný [28]; při srovnání aktivity faktorů u chorob jater a antikoagulovaných se stejnými hodnotami INR jsou účinné hladiny F V a F VII nižší v případě hepatopatie a jen hladina F II je srovnatelná. Použitím vyjádření INR může dojít u poruchy jater k podhodnocení stavu.
8. Přehled indikací podání CZP u jaterních chorob [30]. ![Přehled indikací podání CZP u jaterních chorob [30].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/51206f94c7ca37570b3d014aada753cf.png)
Podání ČZP má řadu limitací - není protivirově ošetřená (v ČR karanténní), její aplikace vyžaduje časovou prodlevu danou potřebou vyšetřením krevní skupiny, transportem, rozmražením a ohřátím na 37 °C. Plazma má omezené působení u preexistující koagulopatie vzhledem k proporcionálnímu zastoupení prokoagulačních faktorů a inhibitorů je limitovaná možnost zvrátit nepoměr koagulační rovnováhy přítomný před vznikem krvácení (antikoagulační léčba, krvácení u hepatopatie, DIC). Je zatížena rizikem objemového přetížení, svou roli hraje i odchylný poločas koagulačních faktorů a inhibitorů.
Kryoprecipitát (kryoprotein)
Kryoglobulinová frakce plazmy je získaná rozpuštěním ČZP, další centrifugací a koncentrací na objem 30-40 ml; má definovaný obsah fibrinogenu v g/ks. Slouží jako náhrada krevních derivátů - zejména koncentrátu fibrinogenu, méně často preparátů s obsahem F VIII, resp. von Willebrandova faktoru, případně preparátu s obsahem F XIII - v případě jejich nedostupnosti (indikace viz jednotlivé krevní deriváty). S výhodou může být použit při potřebě náhrady fibrinogenu zejména u diseminované intravaskulární koagulace. Při indikaci je třeba respektovat krevní skupinu v AB0 systému, nikoli však v Rh(D) systému. Jeho nevýhodou je nutnost znalosti krevní skupiny, potřeba rozmražení a podání většího počtu transfuzních jednotek (obvykle 3 k náhradě 1 g fibrinogenu), přípravek není protivirově ošetřen (je však vyráběn z karanténní plazmy).
Trombocytové transfuzní přípravky
Trombocyty pro klinické užití jsou vyráběny z odběru plné krve a získáním z „buffy coatu“; pak je terapeutická jednotka zajištěna směsí od 4-6 dárců, nebo z aferézy, v tomto případě je terapeutická jednotka připravena trombocytaferézou od jednoho dárce.
Indikací pro aplikaci trombocytových transfuzních přípravků je krvácení či profylaxe krvácení při trombocytopenii nebo vzácně při trombocytopatii (funkční porucha destiček).
Profylaktické podání
Řada prací dokumentuje, že profylaktické podání trombocytů je mnohem častější (65-70 %) nežli podání léčebných [32-36]. Efekt těchto podání je obtížně dokumentovatelný [37], neboť různé studie používají k hodnocení krvácivých projevů různé „konečné cíle“. Průměrné zvýšení počtu trombocytů po podání 1 terapeutické jednotky nemusí být vysoké např. 10,2 × 109/l, neboť značná část pacientů, až 27,3 %, na podání trombocytového koncentrátu nemusí reagovat [35]. Jsou-li tito vyloučeni, pak se průměrné navýšení počtu trombocytů pohybuje okolo 20 × 109/l [35,38].
K profylaxi spontánních krvácivých projevů je v současné době hranicí pro substituční léčbu obvykle hodnota trombocytů 10 × 109/l [32,35-38] u nemocných bez další poruchy krevního srážení, resp. u chronické stabilizované trombocytopenie. Ještě nižší hodnoty jsou akceptovatelné u pacientů s imunitně podmíněnou trombocytopenií bez významných krvácivých projevů.
K profylaxi krvácivých projevů při operačním či intervenčním výkonu je podání indikováno méně často [34] a hodnota počtu trombocytů je obvykle udávána hranicí 40-60 × 109/l [33,37,39] stratifikovaně dle typu zákroku. U výkonů s velmi vysokým rizikem krvácivých projevů je požadován počet trombocytů převyšujících hodnotu 75-100 × 109/l, obvykle při operačních výkonech na mozku a očích [37-39].
Terapeutické podání
U pacientů s krvácivými projevy a trombocytopenií je nejčastěji udávána hodnota počtu trombocytů mezi 40-50 × 109/l jako hraniční pro podání trombocytového transfuzního přípravku [33,37]. V některých případech (polytrauma či poranění centrálního nervového systému) může být hranicí i 100 × 109/l [37]. Nejčastějším důvodem podání je masivní krvácení/transfuze, diseminovaná intravaskulární koagulopatie nebo krvácivé projevy při chirurgických intervencích zejména při kardiopulmonálním bypassu [37].
Některé situace jsou považovány za nevhodné až kontraindikované pro substituční destičkovou léčbu. Mezi ně patří trombotická trombocytopenická purpura, u které by trombocytový koncentrát neměl být podán s výjimkou život ohrožujícího krvácení [37,38], případně i heparinem indukovaná trombocytopenie, u níž vzniká vysoké riziko arteriální trombotické příhody [37].
Indikace plazmatických derivátů u pacientů s krvácením či s rizikem krvácení
Koncentrát fibrinogenu
Fibrinogen je základním substrátem koagulačních reakcí vedoucích ke vzniku koagula - bez něj definitivní krevní zátka nevzniká nebo je insuficietní. Proto je určitá hladina fibrinogenu nutná pro normální hemostázu. Tato hladina je obvykle udávána mezi 0,5 až 1,0 g/l [40]. Podání 3 g fibrinogenu u dospělého člověka průměrné hmotnosti 70 kg zvýší hladinu fibrinogenu asi o 1 g/l. Stejné množství fibrinogenu obsahuje neméně 900 ml CZP, v níž však obsah fibrinogenu není jasně definován.
Profylaktické podání
Profylaktické podání koncentrátu je mnohem méně časté. Důvodem je vrozená anebo, méně často, získaná hypo - či afibrinogenemie před operačními výkony, v některých případech i dysfibrinogenemie [41]. Při operačním výkonu se snažíme docílit hladinu přesahující 1,0 g/l. V případě operačních výkonů na CNS by mělo být dosaženo hladiny přesahující 1,5 g/l [23]. Není-li přítomna zvýšená konzumpce fibrinogenu, pak lze při substituční léčbě počítat s poločasem více než 72 hod.
Při získané hypofibronogenemii není obvykle pokles fibrinogenu jedinou poruchou; v případě současné substituční léčby ČZP je možné zohlednit dávku fibrinogenu dodanou v tomto transfuzním přípravku, nicméně u získaných stavů je taktéž obvykle kratší poločas.
Terapeutické podání
Nejčastější indikací je porucha krevního srážení u masivního krvácení/transfuzi, diseminovaná intravaskulární koagulopatie, krvácení při poruše srážení u jaterní nedostatečnosti, případně krvácení u primární hyperfibrinolýzy, ev. i iatrogenní (podání trombolytik).
Při masivní hemoragii/transfuzi je podání fibrinogenu indikováno za předpokladu, že při probíhající substituci ČZP hladina fibrinogenu nedosahuje 0,8 g/l [23]. Navíc je nutno počítat s ovlivněním stanovení hladiny fibrinogenu metodou dle Clause v případě předchozího podání syntetických koloidních roztoků, které interferují se stanovením [42], a zjišťované hodnoty jsou „falešně vyšší“. Samotné podání fibrinogenu při diluční koagulopatii bylo na zvířecích modelech prokázáno jako příznivé pro redukci krevní ztráty a ovlivnění laboratorních nálezů [42]. Naopak nízké hladiny fibrinogenu jsou prognosticky nepříznivým ukazatelem pro poporodní krvácení [43].
Koncentráty fibrinogenu jsou obvykle považovány za trombogenní a spojené s rizikem možných trombotických komplikací. Některé literární údaje toto nepotvrzují [23,42].
Koncentráty protrombinového komplexu
Koncentráty protrombinového faktoru (Partial Prothrombin Complex - PPC) obsahují definované množství vitamin K dependentních faktorů a dle preparátu i vitamin K dependentních inhibitorů, tj. proteinu C a proteinu S (tab. 9). Indikací jeho podání je profylaxe či léčba krvácení u následujících stavů:
- při antikoagulační léčbě kumarinovými preparáty
- u hypovitaminózy K
- u pacientů s vrozenými deficity F II a F X (pro F IX a F VII jsou dostupné jednosložkové preparáty)
- u jaterních onemocnění
- u diseminované intravaskulární koagulace
- při získané koagulopatii u masivního krvácení, kterou nelze kompenzovat ČZP buď pro příliš rychle probíhající hemoragii, nebo pro riziko objemového přetížení pacienta
PPC jsou upřednostněny před plazmou zejména v situacích potřeby rychlé úpravy hodnoty protrombinového času [44,45]. Některé indikace, zejména ty, jenž jsou samy spojeny s rizikem trombózy či mikrotrombotizace, nejsou v novějších sděleních jednoznačně preferovány jako podání první volby. Dávkování lze odhadnout dle hodnoty INR - při hodnotách 2,0-3,9 asi 25 IU/kg, při hodnotách 4,0-5,9 35 IU/kg a při hodnotách INR převyšujících 6,0 dávka 50 IU/kg [25].
Obecně jsou PPC považovány za přípravky trombogenní zejména pro obsah protrombinu [46]. Z tohoto důvodu by měly v těchto indikacích užívány preparáty s nízkým obsahem aktivovaných faktorů (v našich podmínkách ne preparát FEIBA Baxter, ale Prothromplex Baxter), vždy by mělo být vzato v potaz riziko tromboembolizmu a/nebo podána vhodná antitrombotická profylaxe. Krevní derivát by měl být aplikován pomalu (rychlost mezi 1 ml/min až max 5 ml/kg) a pokud možno v malé jednotlivé dávce (do 30 IU/kg), přičemž je nutné vyhnout se současného podání antifibrinolytik. PCC s obsahem aktivovaných faktorů by měly být vyhrazeny pro léčbu a profylaxi krvácení nemocných s hemofilií a inhibitorem.
9. Koncentrát protrombinového komplexu – složení. 
Koncentráty faktorů VIII a IX
Tyto krevní deriváty jsou určeny k profylaxi a/nebo léčbě krvácení u pacientů s hemofilií A či B, resp. vzácně v případech získané hemofilie (tzn. při autoimunitním onemocnění s přítomností inhibitoru proti faktoru VIII, raritně proti faktoru IX) s nízkou hladinou inhibitoru (pod 5 Bethesda jednotek). K dispozici je více přípravků; v současné době častěji v našich podmínkách vyrobených z plazmy nežli za pomoci rekombinantní technologie.
Hladiny aktivity faktorů, na které je pacienta nutné nastavit a doba, po níž je potřeba tyto hladiny udržovat, závisí na typu krvácení nebo operačního výkonu a patří do sledování erudovaného hematologa. Obecně se předpokládá, že u faktoru IX dochází po podání 1 jednotky na kg k vzestupu o 1 %, u faktoru VIII ke vzestupu o 1,5-2 % [47].
Rekombinantní aktivovaný faktor VII
Rekombinantní aktivivaný faktor VII byl vyvinut v počátku 80. let minulého století jako lék pro pacienty s hemofilií a inhibitorem [48]. Od té doby byla získána řada zkušeností nejen s podáním u hemofiliků komplikovaných rozvojem protilátek proti F VIII, resp. F IX, ale i v řadě jiných indikacích, mezi jinými léčba a profylaxe krvácení u nemocných s deficitem F VII, F IX, krvácení u kardiochirurgických výkonů, u předčasně narozených dětí, krvácení u funkčních poruch trombocytů, u pacientů s traumaty či polytraumaty, u chorob jaterních, u antikoagulační léčby, u intrakraniální hemoragie, u poporodního krvácení, u získané hemofilie a v dalších indikací [49,50], přičemž preexistující porucha krevní srážlivosti již není podmínkou jeho podání a rekombinantní F VIIa je považován některými autory za univerzálně působící hemostatický přípravek [51,52].
V dávkách 100-140 µg/kg, ev. i opakovaně po 2-3 hod do zástavy krvácení může být použit i dle našich doporučení jako účinný přípravek k zástavně život ohrožující hemoragie.
Limitací účinku preparátu může být nízká hladina fibrinogenu (pod 0,5 až 1,0 g/l), hemoglobinu (pod 60-70 g/l), trombocytopenie (pod 20 × 109/l), acidóza (pH pod 7,2) a/nebo hypotermie. Proto léčba tímto přípravkem by měla být současně doplněna o terapii směřující k odstranění těchto nepříznivých podmínek [53].
Závěr
Transfuzní přípravky i krevní deriváty jsou nedílnou součástí léčby krvácení. Přes řadu různých doporučení a indikačních vymezení, přes existenci standardizovaných schémat však je u konkrétního nemocného jejich použití vždy závislé na náležitém zhodnocení celé klinické situace. Hemoterapie tak zůstává díky svému významu na straně jedné, ale taktéž vzhledem ke svým limitacím na straně druhé, jakýmsi „uměním“ a mocnou zbraní v rukou erudovaného lékaře.
MUDr. Alena Buliková, Ph.D.
www.fnbrno.cz
e-mail: abulik@fnbrno.cz
Doručeno do redakce: 4. 2. 2008
Sources
1. Schmidt PJ. Hemotherapy: from bloodletting magic to transfusion medicine. Transfusion 2006; 46 : 166-168.
2. Goodnough LT, Shander A, Spence R. Bloodless medicine: clinical care without allogeneic blood transfusion. Transfusion 2003; 43 : 668-676.
3. Heddle NM, Cook RJ, Webert KE et al. Methodologic issues in use of bleeding as an outcome in transfusion medicine studies. Transfusion 2003; 43 : 742-752.
4. Stanworth SJ, Brunskill SJ, Hyde CJ et al. Is fresh frozen plasma clinically effective? A systematic review of radomized controlled trials. Br J Hematol 2004; 126; 139-152.
5. Siegennthaler MA, Schneider PH, Tissott JD. Haemovigilance in a general university hospital: need for a more comprehensive classification and a codification of transfusion-related events. Vox Sanguinis 2005; 88 : 22-30.
6. Turek P. Properties of blood components and plasma fractions. In: Heier HE, Turek P, Walterová L (eds). ETSM Residential Course. Clinical transfusion medicine.2006 : 19-30.
7. Spence RK. Clinical use of plasma and plasma fractions. Best Pract Res Clin Haematol 2006; 19 : 83-96.
8. Murphy MF, Wallington TB. Blood Transfusion Task Force. Guidelines for the clinical use of red cell transfusions. British J Haematol 2001; 113 : 24-31.
9. Stainsby D, MacLennan S, Thomas D et al. British Committee for Standards in Haematology. Guidelines on the management of massive blood loss. Br J Haematol 2006; 135 : 634-641.
10. van Klei WA, Moons KGM, Rhwinwck Leyaaiua AT et al. A reduction in type and screen: Preoperative prediction of RBC transfusions in surgery procedures with intermediate transfusions risks. Br J Anaesthesia 2001; 87 : 250-259.
11. O´Shaughnessy DF, Atterbury C, Maggs PB et al. British Committee for Standards in Hematology, Blood Transfusion Task Force. Guidelines for the use of fresh-frozen plasma, cryoprecipitate and cryosupernatant. Br J Haematol 2004; 126 : 11-28.
12. Spence RK. Clinical use of plasma and plasma fractions. Best Pract Res Clin Haematol 2006; 19 : 83-96.
13. Walterová L. The role of platelets, FFP and coagulation factors. In: Heier HE, Turek P, Walterová L (eds). ETSM Residential Course. Clinical transfusion medicine. Liberec 29. 3.-2. 4. 2006.
.
14. Barnett SL, Cimo M, Matevosyan K et al. Study of coagulation factors in patients with mild prolongation of prothrombin time. Implication for neurosurgical patients. Neurosurgery 2004; 55; 487.
15. Holland LL, Foster TM, Marlar RA et al. Fresh frozen plasma is ineffective for correcting minimally elevated international normalized ratio. Transfusion 2005; 45 : 1234-1235.
16. Abdel-Wahab OI, Healy B, Dzik WH. Effect of fresh-frozen plasma transfusion on prothrombin time and bleeding in patients with mild coagulation abnormalities. Transfusion 2006; 46 : 1279-1285.
17. Stanworth SJ, Brunskill SJ, Murphy MF et al. Appraisal of the evidence for the clinical use of FFP and plasma fractions. Best Pract Res Clin Haematol 2006; 19 : 67-82.
18. Dzik W, Rao A. Why do physicians request fresh frozen plasma? Transfusion 2004; 44 : 1393-1394.
19. Palo R, Capraro L, Hovilehto S et al. Population-based audit of fresh-frozen plasma transfusion practices. Transfusion 2006; 46 : 1921-1925.
20. Levi M, de Jonge E, van der Poll T. Plasma and plasma components in the management of disseminated intravascular coagulation. Best Pract Res Clin Haematol 2006; 19 : 127-142.
21. Erber WN, Perry DJ. Plasma and plasma products in the treatment of massive haemorrhage. Best Pract Res Clin Haematol 2006; 19 : 97-112.
22. Hardy JF, de Moerloose P, Samama CM. The coagulopathy of massive transfusion. Vox Sanguinis 2005; 89 : 123-127.
23. Weippert-Kretschmet M, Karger R, Kretscher V. Peri-operative/post-traumatic haemostatic disorders: therapy. In: Heier HE, Turek P, Walterová L (eds). ETSM Residential Course. Clinical transfusion medicine. Liberec 29. 3.-2. 4. 2006 : 145-152.
24. Isaacs MS, Scheuermaier KD, Levy BL at al. In vitro efects of thawing fresh-frozen plasma at various temperatures. Clin Appl Thromb/Hemost 2004; 10 : 143-148.
25. Gumulec J, Kesseler P, Penka M et al. Krvácivé komplikace při léčbě warfarinem. Vnitř Lék 2006; 52 : 79-95.
26. Penka M, Buliková A, Gumulec J et al. Příprava nemocných na dlouhodobé antikoagulační léčbě kumariny k invazivním zákorkům. Vnitř Lék 2006; 52(Suppl 1): 35-40.
27. Bulik O. Extrakce zubů a antikoagulační terapie-srovnání různých postupu. Prakt Zubn Lek 2004; 52; 68-77.
28. Ansell J, Hirsh J, Poller H et al. The pharmacology and management of the vitamin K antagonists. Chest 2004; 2004 : 204S-233S.
29. Baglin TP, Keeling DM, Watson HG. Guidelines on oral anticoagulation (warfarin): third edition - 2005 update. Br J Haematol 2005; 132 : 277-285.
30. Ramsey G. Treating coagulopathy in liver disease with plasma transfusions or recombinant factor VIIa: an evidence-based review. Best Pract Res Clin Haematol 2006; 19 : 113-126.
31. Deitcher SR. Interpretation of the INR in patients with liver disease. Lancet 2002; 359 : 47-48.
32. McCullough J. Current issues with platelet transfusion in patients with cancers. Semin Hematol 2000; 37(Suppl 4): 3-10.
33. Arnold DM, Crowther MA, Cook RJ et al. Utilisation of platelet transfusion in the intensive care unit: indications, transfusion triggers, and platelet count responses. Transfusion 2006; 46 : 1286-1291.
34. Greeno E, McCullough G, Weinsdorf D. Platelet utilization and the transfusion trigger: a prospective analysis. Transfusion 2007; 47 : 201-205.
35. Cameron B, Rock G, Olberg B et al. Evaluation of platelet transfusion trigger in a tertiary-care hospital. Transfusion 2007; 47 : 206-211.
36. Corash L. How much do we know about the platelet transfusion threshold? Transfusion 2003; 43 : 691-693.
37. British committee of standards in haematology, blood transfusion task force: Guideline for the use of platelet transfusion. Br J Haematol 2003; 122 : 10-23.
38. Lasota Z, Gumulec J, Janek D et al. Substituční hemoterapie. Doporučení pro klinickou praxi v zařízeních EUROMEDNET [online]. Dostupné z
. 39. Brand A. Transfusion support in malignant diseases. In: Heier HE, Turek P, Walterová L (eds). ETSM Residential Course. Clinical transfusion medicine. Liberec 29. 3.-2. 4. 2006 : 67-75.
40. Feies D, Innerhofer P, Schobersberg W. Coagulation management in trauma patients. Curr Opin Anaestesiol 2002; 15 : 217-223.
41. Bátorová A, Horváthová D, de Moerloose P et al. Fenotypová a genotypová analýza vrodenej hypofibrinogenémia a dysfibrinogenémie. Vnitř Lék 2005; 51 : 802-808.
42. Fries D, Krismer A, Klinger A et al. Effect of fibrinogen on reversal of dilutional coagulaopahty: a porcine model. Br J Anaestesia 2005; 95 : 172-178.
43. Charbit B, Mandelbrot L, Samain E et al. The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost 2006; 5 : 266-273.
44. Lorenz R, Kiencast J, Otto U et al. Efficacy and safety of a prothrombin complex concentrate with two virus-inactivation steps in patients with severe liver damage. Eur J Gastrenterol Hepatol 2003; 15 : 15-20.
45. Lankiewitz MW, Hays J, Friedman KD et al. Urgent reversal of warfarin prothrombin complex concentrate. J Thromb Haemost 2005; 4 : 967-970.
46. Dusel CHH, Grundmann C, Eich S et al. Identification of prothrombin as a major thrombogenic agent in prothrombin complex concentrates. Blood Coagul Fibrinolysis 2004; 15 : 405-411.
47. Matýšková M. Poruchy krevního srážení. In: Penka M, Buliková A, Matýšková M et al. Hematologie. Praha: Grada Publishing 2001: Vol. 1, 131-166.
48. Hedner U, Kiesel W. Use of human factor VIIa in the treatment of two hemofilie A patients with high-titer inhibitors. J Clin Invest 1998; 71 : 1836-1841.
49. Roberts HR, Monroe DM, White GC. The use of recombinant factor VIIa in the treatment of bleeding disorders. Blood 2004; 104 : 3858-3064.
50. Mathew P, Simon TL, Hunt KE et al. How we manage request for recombinant factor VIIa (NovoSeven). Transfusion 2007; 47 : 8-14.
51. Levi M. Recombinant factor FVIIa: a general hemostatic agent? Not yet. J Thromb Haemost 2004; 2 : 1695-1697.
52. Roberts HR. Recombinant hemostatic agent? J Thromb Haemost 2004; 2 : 1691-1694.
53. Černý V, Cvachovec K, Kasal E et al. Zásady podpory koagulace u život ohrožujícího a neztišitelného krvácení. Anest Inten Med 2005; 6 : 314-315.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 6-
All articles in this issue
- Controlled hypothermia – editorial
- Comparative study of detection and evaluation of the size of oesophageal varices with the use of 12 and 20 MHz frequency radial endosonography vs. esophagogastroduodenoscopy
- Late recurrences of atrial fibrillation in patients after direct-current cardioversion
- Overcooling during mild hypothermia in cardiac arrest survivors - phenomenon we should keep in mind
- Hypertension in HIV positive patients
- Repolarization homogeneity in patients after acute myocardial infarction assessed from long-term 12-lead electrocardiographic recordings
- Treatment of haemorrhage with transfusion preparations and blood derivatives
- The 60th anniversary of the discovery of the LE (lupus erythematosus) cell
- Professor MUDr. František Pór’s School of Internal Medicine
- Preparation of patients with haemostatic disorder for invasive medical interventions
- Cancer personality: Current view and implications for future research
- The risk of cardiovascular diseases induced by radiotherapy
- Treatment of multiple angiomatosis involving the skeleton and the abdominal and thoracic cavities with interferon α, thalidomide and zoledronate
- Acute cholestasis following treatment with nimesulide and oral contraception - case report and review
- Imaging of stenosis of ramus interventricularis anterior by computed tomography and selective coronarography
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Treatment of haemorrhage with transfusion preparations and blood derivatives
- Late recurrences of atrial fibrillation in patients after direct-current cardioversion
- Imaging of stenosis of ramus interventricularis anterior by computed tomography and selective coronarography
- Cancer personality: Current view and implications for future research
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


