-
Medical journals
- Career
Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
Authors: M. Trněný 1; O. Bělohlávek 2; J. Kořen 1; R. Pytlík 1; J. Šálková 1; P. Klener 1
Authors‘ workplace: I. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Pavel Klener, DrSc. 1; Oddělení nukleární medicíny Nemocnice Na Homolce, Praha, přednosta doc. MUDr. Otakar Bělohlávek, CSc. 2
Published in: Vnitř Lék 2007; 53(9): 936-941
Category: Original Contributions
Overview
Cíl:
Hodnocení léčebné odpovědi je jedním z nejdůležitějších prognostických ukazatelů. Pomocí metabolického stanovení FDG-PET je umožněno rozlišit strukturální změny, které obsahují ještě viabilní lymfomovou tkáň od fibrotických reziduí.Metoda:
V rámci retrospektivní analýzy 96 nemocných s diagnózou difuzního velkobuněčného lymfomu (DLBCL) diagnostikovaných v letech 1999-2004 byl hodnocen prognostický význam výsledku FDG-PET vyšetření v průběhu intermediárního stagingu (po 2.-4. cyklu chemoterapie, celkem 69 nemocných) a na jejím konci (celkem 68 nemocných) pro dobu bez progrese (PFS) a celkové přežití (OS).Výsledky:
S mediánem sledování 30 měsíců byla ve skupině s intemediárním PET negativním výsledkem pozorována ve 3 letech PFS 80,7 % a OS 97,6 % oproti PFS 50,5 % (p < 0,005) a OS 71,5 % (p < 0,01). Pro PET pozitivní pacienty bylo riziko relapsu/progrese 4,8krát vyšší a riziko úmrtí 6,4krát vyšší. Při hodnocení PET výsledku na konci léčby byla u PET negativních PFS 81,7 % a OS 94,7 % proti PFS 29,4 % (p < 0,0001) a OS 57,5 % (p < 0,0001) u PET pozitivních pacientů. Pro PET pozitivní pacienty při ukončení chemoterapie bylo riziko relapsu/progrese 7krát vyšší a riziko úmrtí 12,9krát vyšší. Při hodnocení významu PET restagingu ve skupinách podle rizika dle mezinárodního prognostického indexu (IPI) se ukázalo, že výsledky si zachovávají signifikantní rozdíl jako pro PFS, tak pro OS s výjimkou OS ve skupině nemocných s vyšším rizikem hodnocených v rámci intermediárního restagingu.Závěr:
Předkládaná analýza dokládá prognostický význam PET vyšetření u nemocných s DLBCL hodnocených jak v rámci intermediárního restagingu, tak na konci chemoterapie. Zda bude mít význam měnit léčbu jen na základě PET vyšetření, je a bude předmětem prospektivních klinických studií.Klíčová slova:
lymfom - difuzní velkobuněčný lymfom (DLBCL) - FDG-PET - prognóza - prediktivní významÚvod
Základním klinickým prognostickým faktorem používaným při odhadování prognózy u nemocných s difuzním velkobuněčným lymfomem (DLBCL) je mezinárodní prognostický index (IPI) [12], rozdělující nemocné na skupinu s nízkým, středně nízkým, středně vysokým a vysokým rizikem signifikantně se lišící v prognóze. Mezi nejsilnější prognostické faktory patří odpověď na léčbu. Pacienti s DLBCL, kteří nedosáhnou kompletní remise, mají signifikantně horší prognózu než nemocní, kteří kompletní remise dosáhnou [6]. V současné době jsou pro hodnocení používaná konsenzuální kritéria používající ze zobrazovacích metod CT vyšetření [2]. Použití CT má však limitace, neboť zobrazuje strukturální abnormalitu, která však nemusí vždy odpovídat viabilnímu tumoru. Kromě histologické verifikace viability tumoru, kterou je nutné považovat za zlatý standard, se byl prokázán potenciální význam některých radionuklidových metod, jako je například galliová scintigrafie [8]. Od 90. let minulého stolení je do praxe zaváděna celotělová pozitronová emisní tomografie (PET) většinou s podáním 18F-fluorodeoxyglukózy [9]. Zdá se, že v oblasti hodnocení léčebné odpovědi bude mít tato metoda významné místo, v tuto chvíli však není ještě konsenzuálně považována za standardní hodnotící metodu, na jejímž základě by bylo možné činit terapeutické rozhodnutí.
Rozhodli jsme se provést retrospektivní analýzu nemocných s DLBCL léčených na našem pracovišti, při jejichž hodnocení byla použita PET metoda.
Soubor nemocných a metodika
Byli vytipováni nemocní s diagnózou difuzního velkobuněčného lymfomu B řady, u nichž byla použita k léčbě první linie chemoterapie obsahující antracyklinová antibiotika a u nichž bylo provedeno PET vyšetření v průběhu léčby (intermediární restaging) a/nebo na konci léčby chemoterapií. Celkem se jednalo o 96 nemocných, u nichž byla diagnóza určena mezi červencem roku 1999 a zářím roku 2004. Podmínkou pro zařazení nebylo provedení PET před zahájením chemoterapie.
Nemocní byli vyšetřeni standardními metodami (CT, trepanobiopsie a ev. další), zhodnoceno klinické stadium, mezinárodní prognostický index. Intermediární hodnocení léčby bylo prováděno po 2.-4. cyklu léčby a konečné na konci chemoterapie. Někteří nemocní byli po ukončení chemoterapie indikováni k radioterapii nebo provedení vysokodávkované terapie s autologní transplantací krvetvorby. Do analýzy bylo zavzato PET vyšetření pouze po chemoterapii, a nikoli již případné PET vyšetření po těchto dodatečných léčebných metodách.
PET vyšetření bylo prováděno s odstupem minimálně 7 dní po podání chemoterapie dříve popsaným způsobem [13].
Základním cílem bylo hodnocení doby do progrese (PFS - progression free survival), hodnocené jako období od zahájení chemoterapie do progrese onemocnění nebo úmrtí z příčiny základního onemocnění nebo léčby pro základní onemocnění. Dalším cílem bylo hodnocení celkového přežití (OS - overall survival). Oběma parametry byly srovnávány skupiny podle dosaženého PET výsledku (PET pozitivní či PET negativní) v intermediárním nebo konečném restagingu. Nemocní, u nichž nebylo možné jednoznačně rozhodnout, zda se jedná o PET pozitivní nález související jednoznačně s onemocněním, byly z hodnocení vyřazeni. Přežití bylo kalkulováno podle Kaplan-Maierovy metody a srovnáno pomocí log rank testu.
Výsledky
Charakteristika nemocných je uvedena v tab. 1. Celkem se jednalo o 96 nemocných (42 žen a 54 mužů) s věkovým mediánem 48 let (17-87). Více než 2/3 nemocných (67,6 %) bylo diagnostikováno v pokročilém klinickém stadiu (III a IV), hladina LDH byla zvýšena nad normu u 54,7 % nemocných. Podle IPI bylo možné hodnotit 91 nemocných a do skupiny s nižším rizikem (nízké a středně nízké riziko dle IPI) patřilo 46,2 % nemocných a do skupiny s vyšším rizikem (středně vysoké a vysoké riziko dle IPI) 53,8 % nemocných. Chemoterapie byla tvořena nejčastěji režimem CHOP (69 %), intenzifikovaným režimem MegaCHOP (30,2 %) a v jednom případě byl z důvodu kardiálních komplikací použit režim ICE. Radioterapie byla použita u 45,8 % nemocných a vysokodávkovaná terapie u 33,8 % nemocných.
Table 1. Charakteristika nemocných. 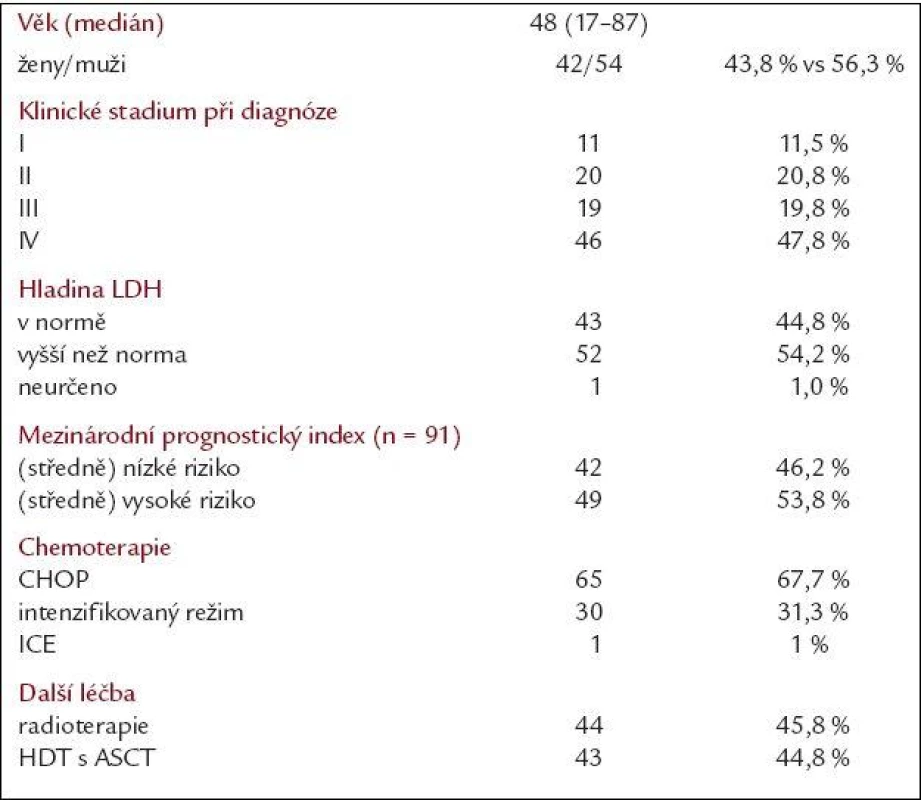
Hodnocení výsledků léčby
Při hodnocení dosaženého výsledku léčbu v rámci intermediárního restagingu standardními metodami byla konstatována kompletní remise nebo nejistá kompletní remise (CR/CRu) u 44,8 %, parciální remise (PR) u 45,7 % a stabilní onemocnění (SD) u 9,6 % nemocných (celkem hodnoceno 94 nemocných). Na konci chemoterapie dosáhlo CR/CRu 65,6 % nemocných, PR 18,8 % nemocných, SD 3,1 % nemocných a u 2,1 % nemocných byla konstatována progrese.
Pomocí PET bylo vyšetřeno v rámci intermediárního stagingu 69 nemocných, z toho byl u 22 (31,9 %) nález hodnocen jako pozitivní, u 43 (62,3 %) jako negativní a u 4 (5,8 %) jako nejistý (tab. 2). Na konci léčby bylo vyšetřeno 68 nemocných, z čehož byl nález hodnocen u 17 (25 %) jako pozitivní a u 48 (70,6 %) jako negativní, jako nejistý byl hodnocen u 3 (4,4 %) nemocných. V obou časových bodech (intermediární i konečný PET restaging) bylo vyšetřeno 46 nemocných (tab. 3). U 17 nemocných byl výsledek v obou případech negativní, u 9 nemocných v obou případech pozitivní, u 9 nemocných bylo intermediární PET vyšetření pozitivní a konečné negativní, u 3 nemocných byl intermediární PET výsledek nejistý a konečný negativní, u 3 nemocných byl intermediární vyšetření pozitivní a konečný výsledek nejistý.
Table 3. Pravděpodobnost PFS (doba do progrese), OS (celkového přežití) a rizika relapsu či smrti v případě PET pozitivity ve 3 letech od zahájení léčby. 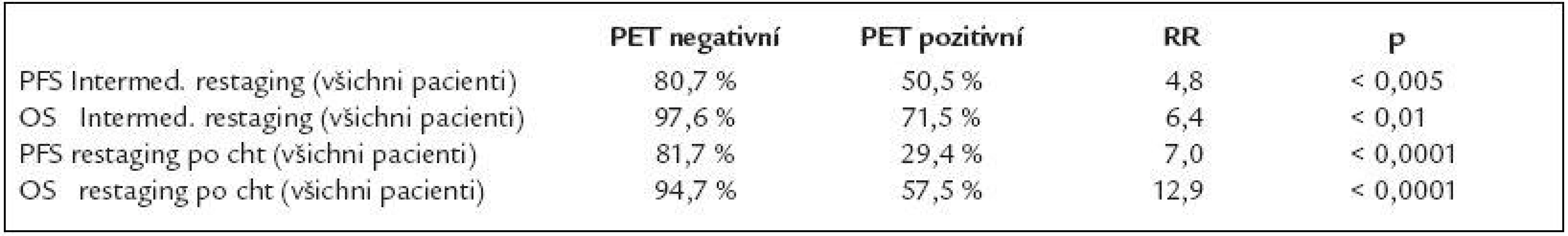
RR – relativní riziko pro PET pozitivní pacienty Relapsy a úmrtí
S mediánem sledování 30 (6-72) měsíců u žijících nemocných bylo zaznamenáno celkem 21 událostí vztahujících se k progresi (PFS) a 12 úmrtí. Ve skupině nemocných hodnocených PET vyšetřením v rámci intermediárního restagingu bylo pozorováno 5 progresí/relapsů z 43 PET negativních pacientů (11,6 %) proti 11 z 22 PET pozitivních pacientů (50 %) (p = 0,001). Při hodnocení počtu úmrtí byly zaznamenány 2 ze 43 PET negativních nemocných (4,7 %) oproti 7 z 22 PET pozitivních (31,8 %) (p = 0,01). Ve skupině nemocných hodnocených PET vyšetření na konci chemoterapie bylo zaznamenáno 6 progresí/relapsů ze 48 PET negativních pacientů (12,5 %) oproti 11 ze 17 PET pozitivních pacientů (64,7 %) (p < 0,0001) a zároveň byla ve skupině PET negativních zaznamenána 2 úmrtí (4,2 %) oproti 8 úmrtím (47,1 %) ze skupiny PET pozitivních nemocných (p < 0,0001).
U nemocných, kteří byli PET pozitivní v intermediárním restagingu, bylo riziko relapsu/progrese 4,8krát vyšší (CI 95 %; 2,0-16,3) oproti PET negativním pacientům (p < 0,005) a riziko úmrtí bylo 6,4krát vyšší (CI 95 %; 1,7-26,1) (p < 0,01). U nemocných, kteří byli PET pozitivní po ukončení chemoterapie, bylo riziko relapsu/progrese 7krát vyšší (CI 95 %; 4,7-50,1) oproti nemocným PET negativním (p < 0,0001), riziko úmrtí bylo 12,9krát vyšší (CI 95 %; 5,4-102,2) (p < 0,0001).
Přežití bez známek progrese (PFS) a celkové přežití (OS) (tab. 3)
Při hodnocení celé skupiny nemocných bylo dosaženo pravděpodobnosti PFS ve 3 letech 72,6 % (CI 95 %; 61,8-83,4 %) a OS 88,2 % (CI 95 %; 81,1-95,3 %).
Podle PET výsledku v intermediárním restagingu bylo dosaženo u PET negativních nemocných 3leté pravděpodobnosti PFS 80,7 % (CI 95 %; 64,0-97,4 %) oproti 50,5 % (CI 95 %, 29,5-71,5 %) (p < 0,005). Pravděpodobnost OS byla 97,6 % (CI 95 %; 92,9-100 %) oproti 71,5 % (CI 95 %; 52,1-90,9 %) (p < 0,01).
Podle PET výsledku po ukončení chemoterapie bylo dosaženo u PET negativních nemocných 3leté pravděpodobnosti PFS 81,7 % (CI 95 %; 67,4-95 %) proti 29,4 % (CI 95 %; 6-52,8 %) (p < 0,0001) a pravděpodobnost OS byla 94,7 % (CI 95 %; 87,4-100 %) oproti 57,5 % (CI 95 %; 33,4 -81,6 %) (p < 0,0001) (graf 1).
Graph 1. Pravděpodobnost doby do progrese (PFS) a celkového přežití (OS) podle výsledku FDG-PET (PET neg – negativní, PET poz – pozitivní) u všech pacientů. 
Při separátním hodnocení skupin podle IPI rizika byly nalezeny následující rozdíly (graf 2). Při intermediárním restagingu byl nalezen rozdíl v PFS ve skupině s nízkým rizikem 83,0 % proti 50,0 % (p < 0,05) a ve skupině s vyšším IPI rizikem 82,0 % proti 48,2 % (p = 0,05). Rozdíl v celkovém přežití byl významný ve skupině s nízkým IPI rizikem - 100 % vs 62,5 % (p < 0,01), ale ne ve skupině s IPI vyšším rizikem - 95,5 % oproti 77,1 %.
Graph 2. Doba do progrese (PFS) v jednotlivých rizkových skupinách podle IPI podle výsledku PET restagingu. 
Při hodnocení na konci chemoterapie byl rozdíl v PFS ve skupině nemocných s IPI nízkým rizikem 83,0 % oproti 31,3 % (p < 0,005) a ve skupině s vysokým IPI rizikem 81,7 % oproti 27,8 % (p < 0,005). U obou skupin byly nalezeny rozdíly v pravděpodobnosti OS, ve skupině s nízkým rizikem to bylo 100 % proti 60,0 % (p < 0,001) a ve skupině s vysokým rizikem 90,9 % proti 55,6 % (p < 0,05).
Diskuse
V předkládané studii dokládáme na základě retrospektivní analýzy nemocných s DLBCL léčených intenzivním režimem prognostický význam PET vyšetření v průběhu i na konci léčby. Dosažení remise je příznivým prognostickým faktorem spojeným s nižším rizikem relapsu a úmrtí na základní onemocnění. Prognostický význam je však zjištěn relativně pozdě - až na konci léčby. Snaha o identifikaci nemocných s vyšším rizikem relapsu na základě pomalého dosažení kompletní remise a úpravy léčby ve smyslu její intenzifikace pomocí vysokodávkované terapie s autologní transplantací se ukázala v holandské studii jako neúčinná [18]. Jedním z problémů je vytipování nemocných, u nichž je riziko relapsu skutečně signifikantně vyšší. Použití standardních kritérií (CT) má relativně malou pozitivní prediktivní hodnotu. Funkční metody, jako např. použití 67Ga-citrátu bylo s úspěchem použito jako metoda, která identifikuje nemocné s vysokým rizikem selhání léčby relativně časně, jak ukázal Janicek et al ve studii zaměřené na jeho použití po 2. cyklu intenzivní chemoterapie, nověji bylo toto pozorování potvrzeno Israelem et al [7,8]. Použití 67Ga-citrátu je však limitováno obtížně interpretovatelnými výsledky této metody při podbráničním postižení [7] a v některých případech i obtížně interpretovatelnou negativní prediktivní hodnotou v případě mediastinálního postižení u Hodgkinova lymfomu (HL) [4]. Metoda FDG-PET začala být do hodnocení rozsahu postižení i klinického hodnocení odpovědi u lymfomů zaváděna v 90. letech minulého století [10,14]. Metoda je vysoce senzitivní u nemocných s Hodgkinovým lymfomem, agresivními lymfomy, jako je DLBCL, vykazuje vysokou senzitivitu u nemocných s folikulárním lymfomem, ale je poměrně málo senzitivní u nemocných s indolentními lymfomy [3]. Poměrně záhy se ukázalo, že PET může rozlišit mezi viabilním reziduem nádoru a CT masou, která již neobsahuje zbytky nádoru, a může tak predikovat relaps jak u nemocných s HL, tak u NHL [9,15,16,19]. V rámci retrospektivní analýzy jsme jednak na menším souboru nemocných sami, a pak jsme spolu s vídeňskou skupinou ukázali, že výsledek PET vyšetření provedeného časně (v rámci intermediárního stagingu) může predikovat osud nemocných stejně jako výsledek vyšetření provedeného na konci léčby [13,17]. V námi předkládané analýze na souboru 96 nemocných s DLBCL ukazujeme, že riziko progrese je u nemocných PET pozitivních v časném restagingu 4,8krát vyšší než u nemocných PET negativních a při srovnání výsledků na konci chemoterapie je 7krát vyšší. Rozdíly v PFS byly potvrzeny jak ve skupině nemocných s iniciálně nižším rizikem dle IPI (83 % proti 50 %), tak i ve skupině s iniciálně vyšším IPI (82,0 % proti 48,2 %). Tyto výsledky odpovídají v současné době publikovaným datům z prospektivní francouzské studie [5], kde byl rozdíl ve dvouletém přežití bez významné události (EFS) 82 % u PET negativních proti 43 % u PET pozitivních (v naší studií 80,7 % proti 50 %). Rozdíl byl pozorován jak ve skupině s nižším, tak ve skupině s vyšším IPI. Za poměrně překvapivý nález jsme považovali zjištění, že ve skupině s vyšším rizikem nebyl ve srovnání nemocných s rizikem nižším větší rozdíl v době do progrese ani v celkovém přežití při hodnocení podle intermediárního stagingu. Jedním z vysvětlení by mohla být skutečnost, že ve skupině s nižším rizikem bylo provedení ASCT indikováno u 5 % nemocných proti 72 % ve skupině s rizikem vyšším. Terapie nebyla měněna na základě PET výsledku. V současné době stále platí konsenzus, že PET nelze užívat jako standardního hodnotícího kritéria odpovědi, i když se chystá jeho inkorporace do hodnotících kritérií [11]. Výhoda časného PET stanovení odpovědi by se mohla projevit v úpravě léčebné strategie, která by mohla být jiná u PET negativních nemocných (např. zkrácení doby léčby, vynechání radioterapie) a u PET pozitivních nemocných (např. intenzifikace léčby, zařazení vysokodávkované terapie, zařazení radioterapie). V současné době však neexistuje prospektivní studie, která by takový přístup ověřila. Nadto je otázka, jak například u nemocných, kteří jsou již z povahy vysokého rizika při zahájení léčby indikováni k vysoce intenzivní indukci včetně vysokodávkované terapie s ASCT, dále intenzifikovat léčbu. Rovněž bylo ukázáno, že nemocní PET pozitivní před provedením vysokodávkované terapie s ASCT mají signifikantně horší prognózu než nemocní PET negativní [1].
Přes řadu otevřených otázek týkajících se přesného zařazení PET vyšetření, integrace do standardních metod hodnotících léčebnou odpověď, adekvátní reakce na výsledek PET vyšetření, je tato metoda velmi slibným krokem. Na základě prospektivních studií zabývajících se úpravou léčby snad bude možné na některé z těchto otázek odpovědět a zařadit tak časnou léčebnou modifikaci k prospěchu nemocných.
Podpořeno grantem IGA MZ CR NR/8231 – 3
doc. MUDr. Marek Trněný, CSc.
www.vfn.cz
e-mail: trneny@cesnet.cz
Doručeno do redakce: 22. 1. 2007
Přijato po recenzi: 26. 1. 2007
Sources
1. Becherer A, Mitterbauer M, Jaeger U et al. Positron emission tomography with [18F]2-fluoro-D-2-deoxyglucose (FDG-PET) predicts relapse of malignant lymphoma after high-dose therapy with stem cell transplantation. Leukemia 2002; 16 : 260-267.
2. Cheson BD, Horning SJ, Coiffier B et al. Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas. NCI Sponsored International Working Group. J Clin Oncol 1999; 17 : 1244.
3. Elstrom R, Guan L, Baker G et al. Utility of FDG-PET scanning in lymphoma by WHO classification. Blood 2003; 101 : 3875-3876.
4. Ha CS, Choe JG, Kong JS et al. Agreement rates among single photon emission computed tomography using gallium-67, computed axial tomography and lymphangiography for Hodgkin disease and correlation of image findings with clinical outcome. Cancer 2000; 89 : 1371-1379.
5. Haioun C, Itti E, Rahmouni A et al. [18F]fluoro-2-deoxy-D-glucose positron emission tomography (FDG-PET) in aggressive lymphoma: an early prognostic tool for predicting patient outcome. Blood 2005; 106 : 1376-1381.
6. Haw R, Sawka CA, Franssen E et al. Significance of a partial or slow response to front-line chemotherapy in the management of intermediate-grade or high-grade non-Hodgkin's lymphoma: a literature review. Journal of Clinical Oncology 1994; 12 : 1074-1084.
7. Israel O, Mor M, Epelbaum R et al. Clinical pretreatment risk factors and Ga-67 scintigraphy early during treatment for prediction of outcome of patients with aggressive non-Hodgkin lymphoma. Cancer 2002; 94 : 873-878.
8. Janicek M, Kaplan W, Neuberg D et al. Early restaging gallium scans predict outcome in poor - prognosis patients with aggressive non-Hodgkin's lymphoma treated with high - dose CHOP chemotherapy. J Clin Oncol 1997; 15 : 1631-1637.
9. Jerusalem G, Beguin Y, Fassotte MF et al. Whole-body positron emission tomography using 18F - fluorodeoxyglucose for posttreatment evaluation in Hodgkin's disease and non-Hodgkin's lymphoma has higher diagnostic and prognostic value than classical computed tomography scan imaging. Blood 1999; 94 : 429-433.
10. Jerusalem G, Beguin Y, Fassotte MF et al. Whole-body positron emission tomography using 18F-fluorodeoxyglucose compared to standard procedures for staging patients with Hodgkin's disease. Haematologica 2001; 86 : 266-273.
11. Juweid ME, Wiseman GA, Vose JM et al. Response assessment of aggressive non-Hodgkin's lymphoma by integrated International Workshop Criteria and fluorine-18-fluorodeoxyglucose positron emission tomography. J Clin Oncol 2005; 23 : 4652-4661.
12. Shipp MA, Harrington DP, Anderson JR et al. A Predictive Model for Aggressive Non-Hodgkins Lymphoma. N Engl J Med 1993; 329 : 987-994.
13. Slaby J, Belohlavek O, Taborska K et al. Predictive features of positron emission tomography after two cycles of induction therapy in malignant lymphoma. Cas Lek Cesk 2002; 141 : 312-315.
14. Slaby J, Belohlavek O, Trneny M et al. Positron emission tomography (PET) in patients with malignant lymphomas - indications for the method as presented in case reports. Vnitr Lek 2001; 47(Suppl 1): 4-7.
15. Spaepen K, Stroobants S, Dupont P et al. Can positron emission tomography with [(18)F]-fluorodeoxyglucose after first-line treatment distinguish Hodgkin's disease patients who need additional therapy from others in whom additional therapy would mean avoidable toxicity? Br J Haematol 2001; 115 : 272-278.
16. Spaepen K, Stroobants S, Dupont P et al. Prognostic value of positron emission tomography (PET) with fluorine-18 fluorodeoxyglucose ([18F]FDG) after first-line chemotherapy in non-Hodgkin's lymphoma: is [18F]FDG-PET a valid alternative to conventional diagnostic methods? J Clin Oncol 2001; 19 : 414-419.
17. Trneny M, Jaeger U, Belohlavek O et al. Early Whole Body F18-FDG Positron Emission Tomography (PET) Restaging Has Significant Prognostic Impact in Diffuse Large Cell Lymphomas (DLCL-B) and Other Aggressive Lymphomas. Blood 2002; 100 : 768a.
18. Verdonck LF, van Putten WL, Hagenbeek A et al. Comparison of CHOP chemotherapy with autologous bone marrow transplantation for slowly responding patients with aggressive non-Hodgkin's lymphoma [see comments]. N Engl J Med 1995; 332 : 1045-1051.
19. Weihrauch MR, Re D, Scheidhauer K et al. Thoracic positron emission tomography using 18F - fluorodeoxyglucose for the evaluation of residual mediastinal Hodgkin disease. Blood 2001; 98 : 2930-2934.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 9-
All articles in this issue
- Výsledek celotělového FDG-PET vyšetření predikuje osud nemocných s difuzním velkobuněčným lymfomem jak při použití v intermediárním stagingu, tak při použití na konci standardní chemoterapie
- Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
- Immodin v léčbě imunoparalýzy nemocných v intenzivní péči
- Sérová hladina retinol-binding proteinu 4 u obéznych s inzulínovou rezistenciou a jedincov s diabetom 2. typu liečených metformínom
- QT dynamicita v rizikové stratifikaci u pacientů po infarktu myokardu
- Endoskopické nálezy v horním trávicím traktu u pacientů s jaterní cirhózou
- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Současné možnosti robotické kardiochirurgie
- Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí sérologických metod
- Primárny aldosteronizmus
- Inkretinová strategie léčby diabetes mellitus 2. typu - DPP-IV
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intraabdominální hypertenze na jednotkách intenzivní péče
- Únavový syndrom u onkologického pacienta: možnosti diagnostiky a léčby
- Primárny aldosteronizmus
- Včasné hemodynamické zmeny po rádiofrekvenčnej ablácii predsieňovokomorového spojenia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


