-
Medical journals
- Career
Hypopituitarizmus: substituční terapie
: V. Olšovská
: II. interní klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
: Vnitř Lék 2007; 53(7-8): 812-815
:
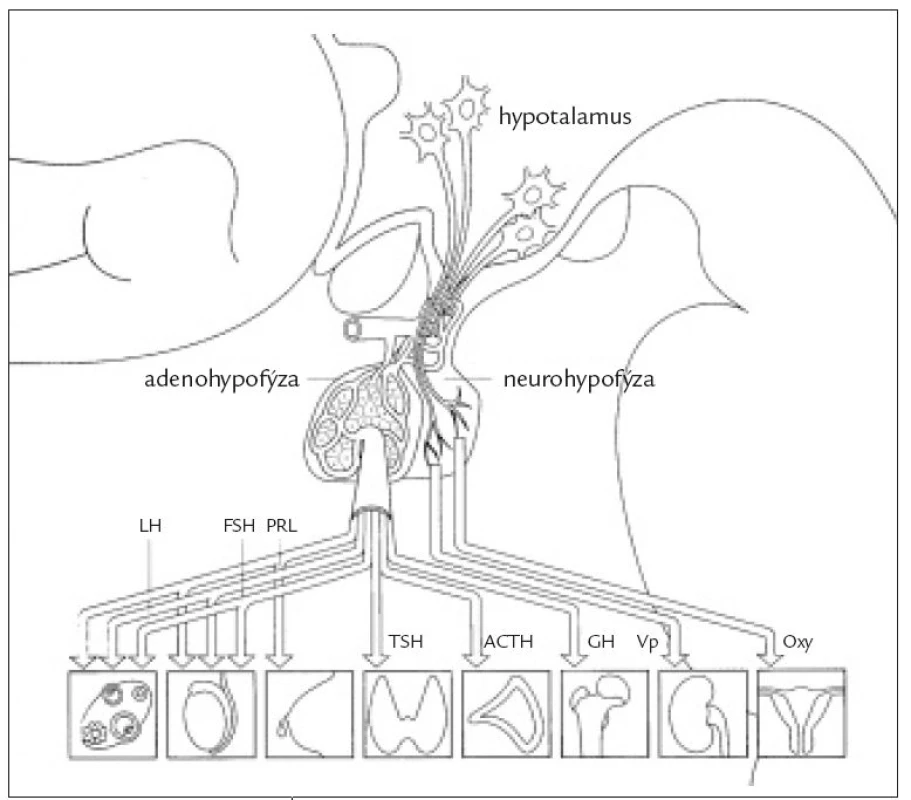
Hypopituitarizmus je stav spojený s nedostatečnou funkcí adenohypofýzy. Vzniká při destrukci větší části adenohypofýzy. Může se jednat o izolovaný deficit nebo kombinovanou poruchu – panhypopituitarizmus. Nejčastější příčinou jsou expanze v oblasti tureckého sedla, ozáření, traumata záněty, krvácení, poporodní ischemická nekróza (Sheehanův syndrom) nebo postižení hypotalamu. U idiopatického hypopituitarizmu zůstává příčina nejasná. Klinický obraz: u dětí bývá nejčastější deficit růstového hormonu, který se projevuje retardací růstu. Někdy se kombinuje s deficitem gonadotropinů, který je příčinou opoždění nástupu puberty. V dospělosti klinický obraz odpovídá stupni a typu postižení jednotlivých hypofyzárních funkcí. Diagnostika se řídí klinickým obrazem a laboratorním stanovením hypofyzárních hormonů spolu s hormony příslušných periferních žláz. U hraničních nálezů musíme k upřesnění diagnostiky použít dynamické stimulační testy. Terapie: expanzivní procesy v oblasti hypofýzy řešíme operací nebo ozářením, nejčastěji gama nožem. Přetrvávající hormonální deficity se pak substituují hormony periferních žláz. Hypokorticizmus léčíme hydrokortizonem v dávce 10 – 30 mg denně perorálně s respektováním diurnálního rytmu. Při zátěži je nutno upravit dávku a dekompenzaci stavu, pituitární krizi nebo operace je nutno zajistit parenterálním hydrokortizonem. Hypotyreózu léčíme tyroxinem, obvyklá substituční dávka se pohybuje kolem 50 – 150 μg denně. Dávku titrujeme podle klinického stavu a hladiny volného tyroxinu. Hypogonadizmus u mužů substituujeme testosteronem. U žen kombinací estrogenů a gestagenů cyklicky nebo kontinuálně. Chceme-li dosáhnout fertility, musíme u obou pohlaví přikročit k přechodnému podávání injekčních gonadotropinů nebo gonadoliberinu. Terapie růstovým hormonem je indikována u dětí a dále u dospělých s těžkým, klinicky manifestním deficitem GH, kde jeho podávání jednoznačně zlepšuje kvalitu života, vede k nárůstu netukové tělesné hmoty, kostní denzity a zlepšení metabolických parametrů.
Klíčová slova:
hypopituiarizmus - poruchy hypotalamu - substituční terapieÚvod
Hypopituitarizmus je stav spojený s nedostatečnou funkcí adenohypofýzy. Při postižení jednoho hypofyzárního hormonu hovoříme o izolovaném deficitu, který bývá častěji vrozený. Získaná postižení bývají spíše kombinovaná a výpadek všech funkcí adenohypofýzy se označuje jako panhypopituitarizmus. Diabetes insipidus se klasifikuje jako samostatná nozologická jednotka.
Příčiny vrozených poruch mohou být genetické, k poškození hypofýzy může také dojít in utero, případně perinatálně. Získané deficity způsobují nejčastěji expanze v oblasti tureckého sedla, stavy po ozáření hypofýzy, traumata včetně operačního, záněty (autoimunitní lymfocytární hypofyzitis, TBC, sarkoidóza), krvácení, poporodní ischemická nekróza (Sheehanův syndrom), hemochromatóza. Příčinou hypopituitarizmu může být i postižení hypotalamu (hypotalamický hypopituitarizmus), nejčastěji při tumorech v této oblasti (kraniofaryngeom, germinom). Hypotalamické syndromy, které se manifestují v dětství, mohou být důsledkem genetických defektů nebo poškozením při porodu. Kallmanův syndrom (olfaktogenitální dysplazie) je spojený s hypotalamickým hypogonadizmem a anosmií. Další porucha hypotalamického původu - Frölichův syndromu (dystrophia adiposogenitalis) je kombinací hypogonadizmu a obezity, u syndromu Praderové-Williho se jedná o postižení spojené s malým vzrůstem, obezitou, mentální retardací, hypogonadizmem a kryptorchizmem. U idiopatického hypopituitarizmu zůstává příčina nejasná (tab. 1).
Klinický obraz
U dětí bývá nejčastější deficit růstového hormonu, který je často izolovaný a projevuje se retardací růstu a pokud není léčen, pak hypofyzárním nanizmem. Někdy se kombinuje s deficitem gonadotropinů, který je příčinou opožděného nebo chybějícího nástupu puberty a rozvoje pohlavních znaků.
Při organickém postižení hypofýzy jsou častější vícečetná postižení hypofyzárních funkcí a obvykle (ale ne vždy) nejprve klesá sekrece růstového hormonu (GH), pak gonadotropinů (FSH, LH) a nakonec tyreotropinu (TSH) a adrenokortikotropinu (ACTH). Výjimku tvoří autoimunitní lymfocytární hypofyzitida, při níž bývá nejčastěji postižena funkce adrenokortikotropní a tyreotropní. Klinický obraz hypopituitarizmu odpovídá stupni a typu postižení jednotlivých hypofyzárních funkcí. Nedostatek růstového hormonu u dospělých osob se projevuje změnami tělesného složení s poklesem svalové a kostní hmoty, s nárůstem tukové hmoty, únavou, sníženou výkonností a sklonem k depresím. Součástí syndromu deficitu růstového hormonu u dospělých osob jsou metabolické změny, především dyslipidemie, snížená inzulinová senzitivita a prokoagulační stav, které mohou zvyšovat kardiovaskulární morbiditu postižených osob. Deficit LH a FSH vede k poklesu libida, potence, spermatogeneze, u žen k poruchám menstruačního cyklu (oligomenorea, amenorea), regresi pohlavních znaků, atrofii kůže, osteoporóze. Nedostatek tyreostimulačního hormonu způsobuje centrální hypotyreózu s únavností, spavostí, intolerancí chladu, hypotermií, bradykardií a prosáknutím podkoží. Snížená adrenokortikotropní funkce způsobuje centrální hypokorticizmus s únavností, intoleranci zátěže, v těžších případech hypotenzí s hyponatremií a sklonem k hypoglykemii. V důsledku akutního stresu (úraz, operace, infekce) se může u neléčených nebo nedostatečně léčených nemocných s panhypopituitarizmem vyvinout hypopituitární krize s projevy centrálního hypokorticizmu, při němž je v popředí těžká hypotenze, hyponatremie, hyperkalemie, porucha vědomí, případně i s projevy těžké hypotyreózy - respirační insuficiencí, hypotermií, bradykardií. Pokud dojde k akutnímu poškození funkce hypofýzy (krvácení do tumoru, traumata apod), dominují kromě neurologické a oční symptomatologie příznaky adrenokortikotropní insuficience (centrální hypotyreóza a hypogonadizmus se projeví až s odstupem po vyčerpání zásob hormonů v periferních žlázách a tkáních). Výpadek sekrece prolaktinu je vzácný a klinicky se neprojevuje.
Diagnostika
Podezření dané anamnézou (proběhlá onemocnění hypofýzy) a klinickým obrazem potvrdí laboratorní stanovení hypofyzárních hormonů spolu s hormony příslušných periferních žláz.
Obecně platí, že nízká hladina hormonu periferní žlázy při současně nízké nebo normální hladině tropního hormonu znamená centrální, tedy hypofyzární, eventuálně hypotalamickou hypofunkci. U hraničních nálezů musíme k upřesnění diagnostiky použít dynamické stimulační testy. Hladiny růstového hormonu kolísají u zdravých osob v sekrečních pulzech a zachycená nízká hladina GH nemusí znamenat jeho deficit. Proto je nutné vyšetřit i hladinu IGF-1 (inzulinu podobného růstového faktoru 1), která bývá snížená a deficit GH definitivně potvrdit stimulačními testy, nejčastěji inzulinovým tolerančním testem. Stejný test se hodí i pro posouzení kortikotropní funkce hypotalamohypofyzární osy. Ke stimulaci TSH a prolaktinu lze použít test s tyreoliberinem (TRH) a ke stimulaci gonadotropinů test gonadoliberinem (GnRH, LH-RH).
Ze zobrazovacích vyšetření je nejpřesnější je zobrazení hypofýzy magnetickou rezonancí, která je nutná k vyloučení organické léze, při expanzi je nutno doplnit vyšetření perimetru k vyloučení útlaku zrakové dráhy. Stanovení prolaktinu je nutností. Jednak umožní diagnostikovat prolaktinom a jednak samotná hyperprolaktinemie i bez organického procesu v hypofýze může být příčinou centrálního hypogonadizmu. V klinickém obrazu se centrální a periferní poruchy odlišují často menším stupněm klinických příznaků u centrálních forem, neboť periferní žláza si obvykle zachovává určitou schopnost bazální sekrece hormonů. U centrálního hypokorticizmu nejsou přítomny pigmentace jako u Addisonovy choroby, také nebývá alterována tvorba nadledvinových mineralokortikoidů (aldosteronu), jehož sekrece je řízena především systémem RAA.
Terapie
Expanzivní procesy v oblasti hypofýzy je nutné řešit chirurgicky, a pokud je prokázán hypopituitarizmus, vždy po předoperační substituci centrálního hypokorticizmu a hypotyreózy. Operují se expanze, které způsobují příznaky tlaku na okolí, progredují, nebo jsou větší než 2 cm. Kritérium velikosti je relativní, záleží na celkovém stavu nemocného, riziku a přínosu operace. Nejčastěji se operace provádějí transsfenoideálním přístupem, při velké paraselární nebo supraselární propagaci tumoru je někdy nutno operovat transkraniálně nebo kombinací obou metod. Případná rezidua tumoru nebo recidivy se ozařují gama nožem nebo (pokud velikost ložiska nebo vzdálenost od zrakové dráhy neumožní terapii gama nožem) frakcionovaně lineárním urychlovačem. Gama nůž je výhodnější pro možnost použití větší dávky a menším zasažením okolních tkání. Radioterapii lze použít i v případech, v nichž je operační zákrok velkým rizikem nebo ho pacient odmítá.
2. Klinický obraz neléčeného hypopituitarizmu. 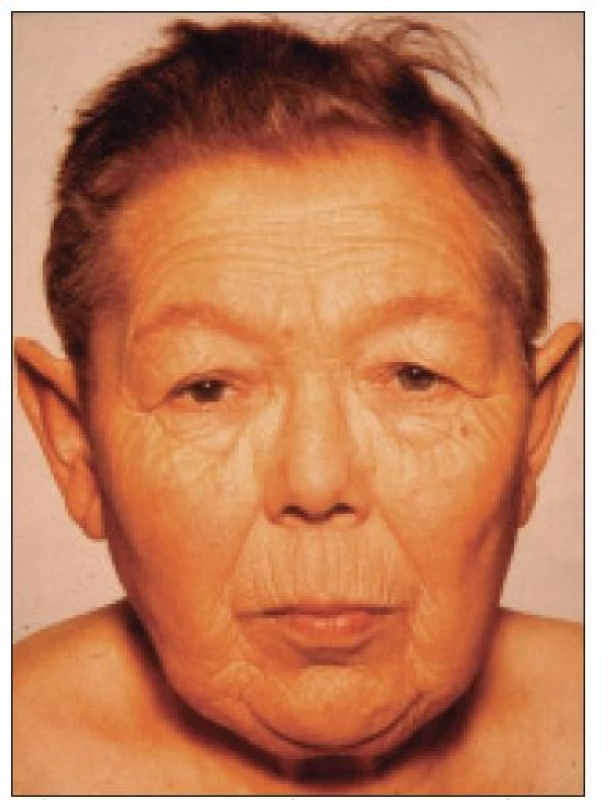
Přetrvávající hormonální deficity se substituují hormony periferních žláz.
Hypokorticizmus léčíme hydrokortizonem v dávce 10-30 mg denně perorálně s respektováním diurnálního rytmu - nejvyšší dávku ráno, menší v poledne, nejmenší nebo žádnou večer. Při zátěži (mimořádná námaha, horečnaté onemocnění, stres) pacient sám přechodně zvyšuje dávku na 2 - až 3násobek, vážnější úraz nebo operace je nutno zajistit parenterálním hydrokortizonem podobně jako u periferní formy hypokorticizmu. Parenterální aplikace je také nutná při nemožnosti perorálního příjmu, např. při zvracení. Pacient má být poučen a trvale nosit doklad upozorňující na hypokorticizmus. Při určení dávky se řídíme klinickým stavem a laboratorním nálezem (ionty, odpady kortizolu do moči za 24 hod, případně kortizolem v séru) a podáváme co nejmenší potřebnou dávku, kterou při zátěži nemocný zvyšuje. Místo hydrokortizonu lze užít prednison, léčba se pak obtížněji monitoruje. Mineralokortikoidy v substituci obvykle nebývají potřeba, osa renin-angiotenzin-aldosteron není porušena.
Hypotyreózu léčíme tyroxinem, obvyklá substituční dávka se pohybuje kolem 100 μg denně perorálně v jedné ranní dávce. Dávku titrujeme podle klinického stavu a hladiny volného tyroxinu.
Hypogonadizmus u mužů substituujeme testosteronem. Vhodné jsou preparáty schopné udržet dlouhodobě vyrovnanou hladinu - transdermální náplasti nebo injekční estery s velmi dlouhým poločasem (testosteron buciklát, cipionát nebo undekanoát), nebo podáváme testosteron undekanoát v tabletách po jídle (resorbuje se lymfou a obchází játra) 80-160 mg denně. U mladších mužů se nejčastěji používá intramuskulárně směs esterů Sustanon 250 mg 1krát za 2-4 týdny. U tablet se řídíme hlavně klinickým účinkem, u injekcí i podle hladiny testosteronu před další dávkou. U žen používáme kombinované estrogen-gestagenní přípravky, v mladším věku podávané k zachování menses cyklicky transdermálně nebo v tabletách. U starších žen je podáváme kontinuálně. Snažíme se o nejnižší potřebnou dávku, která udrží menses nebo (u kontinuálního podávání) hladinu estradiolu v normě pro folikulární fázi. Preferujeme přirozený estradiol a jeho estery před polosyntetickými deriváty. Injekční forma je méně vhodná, protože se jedná o chronickou léčbu. Gestageny jsou u žen s dělohou léčených estrogeny nutnou prevencí karcinomu endometria. Substituce pohlavními hormony periferních žláz je nutná k udržení sekundárních pohlavních znaků, libida, potence a zabrání atrofii periferních pohlavních orgánů. Chceme-li dosáhnout fertility, musíme u obou pohlaví přikročit k přechodnému podávání injekčních gonadotropinů nebo gonadoliberinu (u hypotalamických poruch) pulzní pumpou k dosažení zrání folikulu, ovulace a gravidity. Pouze v lehčích případech je možno stimulovat hypofýzu klomifenem, blokátorem estrogenních zpětnovazebných receptorů.
Terapie růstovým hormonem je indikována u dětí, u dospělých s přítomným těžkým, klinicky manifestním deficitem, kde jeho podávání jednoznačně zlepšuje kvalitu života, vede také k nárůstu netukové tělesné hmoty, kostní denzity a zlepšení metabolických parametrů. Podává se subkutánně 1krát denně, dávka se titruje podle hladiny IGF-1 pro daný věk a obvykle se pohybuje u dospělých osob kolem 1 IU (0,3 mg) denně.
Hypopituitární krizi léčíme rehydratací, parenterálním hydrokortizonem v infuzích fyziologického roztoku (200 mg intravenózně na počátku a dále 100 mg po 6-8 hod) a tyroxinem v kontinuální infuzi, perorálně nebo nazogastrickou sondou v dávce 100 μg/den. Tyroxin nasazujeme do substituce vždy až po zavedení terapie glukokortikoidy. Obvykle je nutná parenterální výživa, péče o vnitřní prostředí, u těžké centrální hypotyreózy často podpůrná nebo řízená ventilace a dočasná kardiostimulace. Je nutno řešit i vyvolávající příčinu stavu (infekce, krvácení do tumoru apod).
Závěr
S výjimkou hypopituitarizmu, který se upraví po operačním odstranění expanze hypofýzy a vzácných případů úpravy u těhotenské lymfocytární hypofyzitidy, se jedná o trvalá onemocnění s nutností celoživotní substituce, ale při správné terapii a dobré spolupráci nemocného s příznivou prognózou.
MUDr. Věra Olšovská, Ph.D.
www.fnusa.cz
e-mail: vera.olsovska@fnusa.cz
Doručeno do redakce: 21. 5. 2007
Sources
1. Kreze Aet al. Všeobecná a klinická endokrinológia. Bratislava: AEP 2004 : 144-152.
2. Larsen PR, Kronenberg H, Melme S et al. William’s Textbook of Endokrinology. Philadephia: SW Saunders 2002 : 252-261.
3. Stárka L, Zamrazil V et al. Základy klinické endokrinologie. Praha: Maxdorf 2005 : 60-66.
4. Cuneo RC, Salomon F, McGauley GA et al. The growth hormone deficiency syndrome in adults. Clin Endocrinol 1992; 37 : 387-397.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 7-8-
All articles in this issue
- Quo vadis, hypophysis? Some news and prospects
- Subclinical thyroids disease
- Aspiration cytology of the thyroid
- Autoimmune polyglandular syndromes: clinical aspects
- Endocrinology and nuclear medicine aspects of the treatment of thyroid tumours
- Hypopituitarism – substitution therapy
- Randomly discovered enlargement in the region of sella turcica
- Adrenal incidentalomas
- Differential diagnosing of hypercalcemias
- Glucocorticoids and osteoporosis
- Mineral-bone disorder with chronic kidney disease
- Oral treatment of type 2 diabetes mellitus
- Transplantation in the treatment of diabetes
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypopituitarism – substitution therapy
- Autoimmune polyglandular syndromes: clinical aspects
- Aspiration cytology of the thyroid
- Randomly discovered enlargement in the region of sella turcica
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career