-
Medical journals
- Career
Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
Authors: I. Žofková 1; P. Bubeníček 2; I. Sotorník 2
Authors‘ workplace: Endokrinologický ústav Praha, ředitel doc. MUDr. Vojtěch Hainer, CSc. 1; Nefrologická klinika IKEM Praha, přednosta prof. MUDr. Vladimír Teplan, DrSc. 2
Published in: Vnitř Lék 2007; 53(6): 709-714
Category: Reviews
Overview
Hypogonadizmus je častou komplikací nemocných s chronickým selháním ledvin (CHRI). Patogeneticky jde o postižení na úrovni hypotalamu vzniklý v důsledku centrálního útlumu pulzního generátoru gonadotropiny uvolňujícího hormonu (GnRH) a primárního postižení gonád. Příčina hypogonadizmu u dialyzovaných pacientů není zcela známa. Předpokládá se mj. také vliv útlumu produkce erytropoetinu a nežádoucí účinky komplikovaných léčebných postupů a malnutrice. U mužů se postižení manifestuje jako porucha sexuálních funkcí, útlum spermatogeneze, předčasná andropauza a těžký únavový syndrom. U dialyzovaných žen bývají časté menstruační poruchy, předčasná menopauza a anovulační cykly. Substituce androgenem, resp. estrogenem zlepší kvalitu života u obou pohlaví a zpomalí úbytek kostní hmoty. Kompletní remise hypogonadizmu bývá u velké části nemocných dosaženo transplantací ledviny. Předložená přehledná práce se zabývá patogenezí, diagnostikou a léčbou hypogonadizmu u dialyzovaných pacientů.
Klíčová slova:
chronické selhání ledvin - hypogonadizmus - hormonální substituceÚvod
Sexuální dysfunkce představuje jednu z nejčastějších komplikací chronické renální insuficience (CHRI), která podobně jako růstová retardace, osteodystrofie, anémie a abnormality dalších endokrinních funkcí snižuje kvalitu života hemodialyzovaných nemocných [2,3,21]. Nejčastější příčinou sexuální dysfunkce u těchto jedinců obou pohlaví je hypogonadizmus, který se spolu s druhotnou hyperparatyreózou, léčbou glukokortikoidy a imobilizací podílí na vzniku renální osteodystrofie [14]. Hypogonadizmus je mimoto spolu s nízkou produkcí erytropoetinu a IGF-I i ukazatelem prognózy hemodialyzovaných pacientů [16].
Klinická manifestace hypogonadizmu u dialyzovaných pacientů
Projevy deficitu androgenů (předčasná andropauza, poruchy libida, erektility, ejakulace, orgazmu a spermatogeneze lze podle našich zkušeností pozorovat zhruba u 50 % hemodialyzovaných mužů. U případů v důsledků nedostatečné produkce estrogenu a hyperprolaktinemie dochází k amenorey. U žen s lehce zvýšenou hladinou estradiolu lze zaznamenat oligomenoreu nebo polymenoreu a dysfunkční krvácení [17,18]. Časté jsou anovulační cykly a předčasná menopauza. Důsledkem hypogonadizmu jsou u obou pohlaví poruchy fertility. Souhrn poruch reprodukčních funkcí u mužů a žen je uveden v tab. 1 a 2. Hypogonadizmus má závažné důsledky pro vývoj hemodialyzovaných dětí, u nichž většinou dochází k opožděnému nástupu puberty s následným zpomalením vývoje vrcholu kostní hmoty. Popsány byly i případy předčasné puberty.
Table 1. Vliv CHRI (a chronické hemodialýzy) na funkci osy hypotalamus-hypofýza-testes. 
Table 2. Vliv CHRI na funkci osy hypotalamus-hypofýza-ovarium. 
Patogeneze hypogonadizmu u nemocných s CHRI
Patogeneze hypogonadizmu u nemocných s CHRI je multifakoriální. Základním mechanizmem je porucha regulace osy hypotalamus-hypofýza-gonády, a to na úrovni hypotalamu a hypofýzy a na úrovni gonád (obr. 1). Nedostatečnost cyklického uvolňování gonadotropiny uvolňujícího hormonu (GnRH) v hypotalamu vede k cyklickému útlumu sekrece gonadotropinů a k následnému potlačení produkce estrogenu i androgenu [9]. Tonická sekrece gonadotropinů je zachována.
Image 1. Osa hypotalamus-hypofýza-gonády u mužů a žen s CHRI. 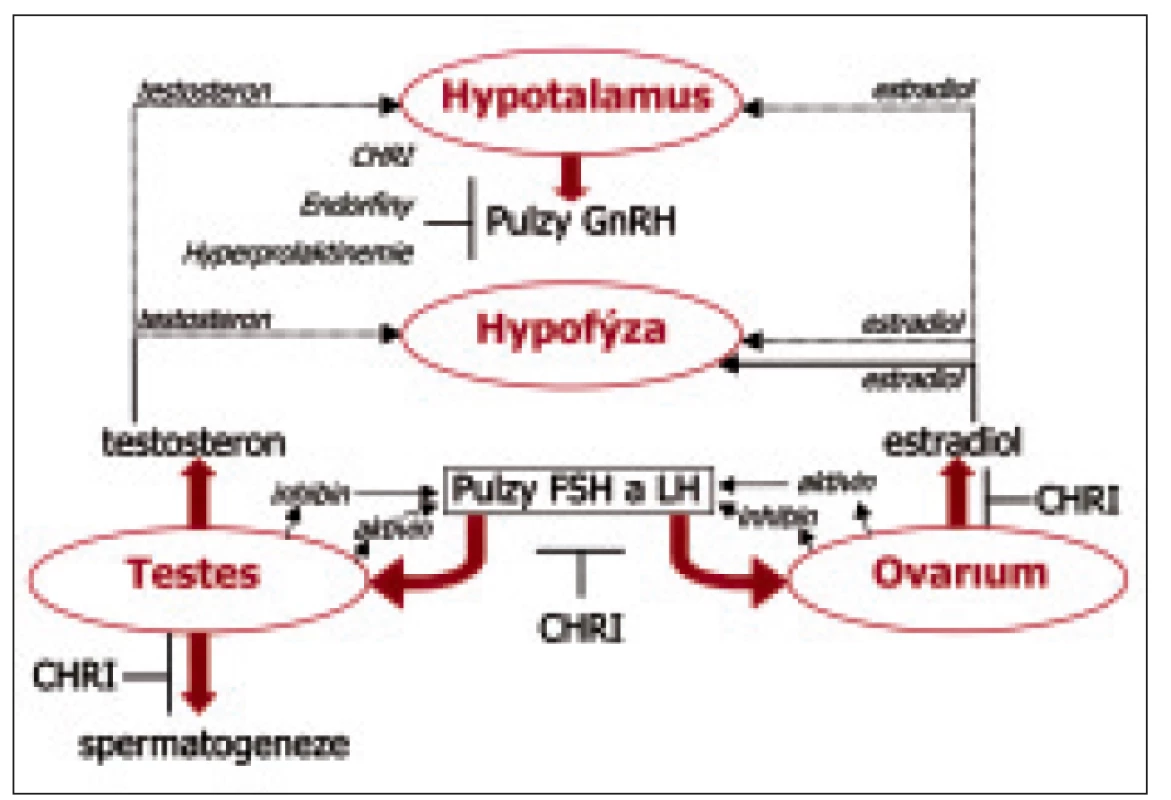
Přerušovaná čára: negativní zpětná vazba; plná čára: pozitivní zpětná vazba; estradiol a testosteron negativní zpětnou vazbou tlumí sekreci FSH a LH na úrovni hypotalamu i hypofýzy. Inhibin tlumí sekreci FSH a slaběji i LH, zatímco aktivin stimuluje FSH. U mužů LH stimuluje produkci testosteronu v Leydigových buňkách; FSH spolu s vysokou intratestikulární koncentrací testosteronu aktivují spermatogenezi. U žen FSH stimuluje vývoj folikulu, zatímco LH spouští ovulaci a zajišťuje přežívání žlutého tělíska. Vrchol sekrece estradiolu pozitivní zpětnou vazbou indukuje pulzatilní sekreci LH a následně i ovulaci [9]. Mechanizmus vzniku hypotalamického defektu není znám, přestože byly vysloveny některé hypotézy pokoušející se o jeho vysvětlení. Jednou z hypotéz je teorie neurotransmiterová, podle níž uremie zvyšuje produkci γ-aminomáselné kyseliny (GABA) v mozku. Protože GABA je hypotalamickým inhibičním neurotransmiterem, dochází k útlumu pulzního generátoru GnRH a celé osy hypotalamus-hypofýza-gonády [26]. Útlum osy může souviset i s nedostatečnou produkcí erytropoetinu, a to přímo nebo prostřednictvím anémie [29]. Z dalších útlumových mechanizmů přichází v úvahu velmi častá hyperprolaktinemie a retence endorfinů.
Nedostatečnost adenohypofyzárních funkcí u mužů i žen může být i primární, nezávislá na hypotalamické regulaci. Předpokládá se vliv zatím neidentifikovaného uremického faktoru, který blokuje sekreci gonadotropinů i funkci jejich receptorů.
U hemodialyzovaných mužů i žen bývá současně působením cytokinů a v důsledku anémie a vaskulárních změn primárně postižena funkce gonád (obr. 1). Snížená produkce testosteronu (estrogenu) a inhibinu gonádami aktivuje osu hypotalamus-hypofýza [25]. Je pravděpodobné, že se zde významnou měrou uplatňuje také chronická ztráta prekurzoru sexagenů, dehydroepiandrosteronu, jenž jako polární molekula prochází dialyzační membránou, zatímco vysokomolekulární peptidické gonadotropiny i GnRH jsou v důsledku snížené metabolické clearance retinovány.
Faktorem, modulujícím gonadální funkce, může být i nedostatečná noční sekrece melatoninu [15]. Význam šišinky ve vztahu k funkci osy hypotalamus-hypofýza-gonády nebyl zatím u nemocných s CHRI intenzivněji studován.
Nejasná je příčina hyperprolaktinemie. U většiny nemocných jde o poruchu diurnálního rytmu prolaktinu. Údaje o prokazatelné hyperprolaktinemii se různí. Podle našich zkušeností ji lze zaznamenat zhruba u 25 % chronicky hemodialyzovaných mužů a 75 % žen. Sekrece prolaktinu často až dvojnásobně přesahuje horní hranici normy, někdy až k hodnotám 1 100 ng/min/m2 (norma 300 - 370 ng/min/m2). Za fyziologických podmínek je stimulována TRH a tlumena dopaminem rovněž produkovaným v hypotalamu. U hemodialyzovaných mužů i žen je laktotropní funkce většinou zcela autonomní (neodpovídá na stimulaci TRH ani na inhibici dopaminem) [8]. Kromě zvýšené produkce prolaktinu se na hyperprolaktinemii podílí i jeho snížená clearance. Souvislost s druhotnou hyperparatyreózou nebyla potvrzena, neboť hladiny prolaktinu se v průběhu 6 měsíců po paratyreoidektomii neměnily [34]. Pravděpodobnější příčinou je vliv psychického stresu souvisejícího s hemodialýzou [6]. Byl také pozorován vztah hyperprolaktinemie k depleci zinku [5].
Jak již bylo zmíněno, hyperprolaktinemie je závažná tím, že dále tlumí pulzní sekreci GnRH a posléze FSH, LH a sexagenů a prohlubuje sexuální dysfunkci a indukuje gynekomastii u mužů a galaktoreu u žen. Negativní vliv hyperprolaktinemie na kostní hmotu nebyl jednoznačně potvrzen [19].
Manifestace sexuálních dysfunkcí nemusí souviset jen s hypogonadizmem. Závažnými patogeny mohou být i přidružené choroby (diabetická polyneuropatie, arteriální hypertenze a depresivní syndrom) a jejich velmi komplikovaná léčba.
Diagnostika hypogonadizmu
Vývoj klinické symptomatologie hypogonadizmu závisí na věku a trvání CHRI. Její nástup je časný (pokles energie a libida) nebo pozdní (depresivní ladění, úbytek svalové a kostní hmoty, zmnožení viscerálního tuku, u mužů gynekomastie a azoospermie), tab. 1. U žen velmi časně nastupují poruchy menstruačního cyklu a galaktorea (tab. 2). U pubertálních dětí se hypogonadizmus manifestuje růstovou retardací, sporým nebo chybějícím pubickým ochlupením, neodpovídajícím věku pubescenta, u chlapců malými testes a někdy eunuchoidními tělesnými proporcemi, u dívek pozdním nástupem menarche. Diagnózu hypogonadizmu potvrdí nízké sérové hladiny celkového i volného testosteronu (estradiolu), dihydrotestosteronu a DHEA a nízké (nebo nepřiměřeně vysoké) hladiny FSH a LH a vysoké hladiny prolaktinu. Hypotalamický defekt řízení gonadálních funkcí lze spolehlivě diagnostikovat klomifen-citrátovým testem.
Léčba hypogonadizmu a poruch sexuálních funkcí u mužů s CHRI
Přes vysokou prevalenci hypogonadizmu u CHRI je poměrně málo pozornosti věnováno jeho léčbě. Přesto je známo, že normalizace zpětnovazebné regulace osy hypofýza-gonády vede v mnoha případech ke klinickému zlepšení sexuálních funkcí u obou pohlaví [10-12,23]. Opakované hemodialýzy sice mohou hormonální homeostázu do určité míry přiblížit fyziologickým poměrům, ale ke klinicky významné kompenzaci hypogonadizmu nevedou [28]. Podstatně účinnější je hormonální substituce. Zatímco však podávání androgenů z důvodu anémie je jednoznačně přijímáno, z hlediska léčby sexuální dysfunkce nebylo dosaženo konsenzu. Autoři argumentují tím, že zvýšení hladin testosteronu nad dolní hranici normy nevede ke klinické odezvě a při vyšších dávkách stoupá riziko vedlejších účinků. Protože poločas eliminace testosteronu u CHRI je srovnatelný s hypogonadálními muži s normální funkcí ledvin, lze substituovat běžně doporučovanými dávkami androgenu. Léčba zlepší sexuální funkce, zmírní gynekomastii a obnoví celkový pocit pohody u většiny hemodialyzovaných hypogonadálních mužů. Svým obecně anabolickým působením má i širší pozitivní efekt. Zvýší citlivost tkání na inzulin a stimulací produkce erytropoetinu posune hladiny hemoglobinu k normě. Prostřednictvím androgenních receptorů na osteoblastech zrychlí novotvorbu kosti. Kromě tohoto přímého efektu zpomalí úbytek kostní hmoty i tím, že zvýší podíl svalové hmoty v neprospěch tuku, a tím zlepší funkci kostního mechanostatu. Zda androgeny sníží četnost fraktur u dialyzovaných mužů, bude třeba ověřit.
Formy androgenní substituce
Cílem androgenní substituce je dosažení normálních hladin testosteronu, dihydrotestosteronu a estradiolu. Poměrně nevýhodná je aplikace perorální - mesterolon (Proviron). Jde o slabý, relativně netoxický androgen, který je v důsledku „first-pass“ efektu rychle eliminován. Nemetabolizuje se na testosteron. Nevýhodou jsou i individuálních rozdíly ve střevní absorpci preparátu. Z perorálních androgenů dostupných v České republice je testosteron undekanoát (Undestor). Lepší zkušenosti byly získány s aplikací nitrosvalovou (50 - 400 mg esteru cypionátu nebo enantátu) s prokázanou účinností 2 - 4 týdny. Uspokojivých výsledků lze docílit se směsným preparátem Sustanon, testosteronem izobutyrátem (Agovirin) nebo depotním testosteron undekanoátem (Nebido). Z hlediska nástupu a trvání efektu a toxicity androgenu je u dialyzovaných mužů nejvhodnější aplikace transdermální ve formě gelů nebo náplastí. V dohledné době má být v České republice dostupný Androgel 50 a Tostran. Účinek transdermálních preparátů se dostaví do 24 hodin a v maximální intenzitě trvá zhruba 48 hodin. Zkušenosti s podkožními implantáty jsou zatím i ve světě malé. Z depotních nitrosvalových preparátů je ve světě využíván testosteron enantát a testosteron cypionát.
Farmakokinetika transdermálně aplikovaného testosteronu se při hemodialýze mění jen minimálně, takže ani v den hemodialýzy není třeba dávku měnit [27]. Noční aplikace transdermální nálepky s nandrolon dekanoátem přiblíží diurnální rytmus hladin sexagenů k normálním hodnotám. Vzhledem k metabolizaci testosteronu v játrech je u nemocných s postižením jaterních funkcí třeba dávku hormonu snížit.
Bezpečnost léčby androgeny
Dlouhodobé podávání testosteronu může mít řadu nežádoucích účinků, které se mohou manifestovat u dialyzovaných mužů ve stejné intenzitě jako u jedinců s normální funkcí ledvin. I u těchto mužů výskyt vedlejších účinků závisí na věku, dávce, formě aplikace a trvání léčby. Absolutní kontraindikací léčby androgeny je karcinom prostaty a mužský karcinom prsu. V tomto směru je třeba věnovat pozornost především starším mužům, u nichž mohou být ve tkáni prostaty přítomna nepoznaná mikroskopická karcinomatózní ložiska. Mírné zvýšení hodnot prostatického antigenu (PSA), které lze někdy zaznamenat i u mužů s normální prostatou, není kontraindikací substituce, nemocného však je nutno před nasazením substituce podrobně vyšetřit a sledovat dynamiku změn PSA v průběhu léčby. Při náhlém zvýšení hladiny PSA nebo při vzestupu jeho hladin o více než 0,75 µg/l za rok je třeba androgen neprodleně vysadit a pátrat po karcinomu prostaty. Substituce androgeny je kontraindikována u nemocných s polycytemií (s hematokritem > 52 %), se syndromem spánkové apnoe a u nemocných s dekompenzovanou kardiální nedostatečností. Závažným vedlejší účinkem léčby androgeny je karcinom jater. Je třeba pamatovat i na možnost zvýšení účinků antikoagulancií. Odpověď kardiovaskulárního systému na hormonální substituci je individuální. Androgen může zhoršit kardiální nedostatečnost, na druhé straně, je-li podáván v malých dávkách transdermálně, může zlepšit symptomatologii koronární nedostatečnosti [7]. Přínos léčby se zvážením rizik je třeba hodnotit u každého nemocného individuálně.
Androgen lze podávat i hemodialyzovaným chlapcům s opožděnou pubertou. Z důvodu prevence předčasného uzavření růstových štěrbin nebo virilizace se doporučuje aplikovat malé dávky v krátkodobých kůrách. Se substitucí androgenem je možno začít v období mezi 13. a 18. rokem v dávce 50 mg testosteronu měsíčně zhruba po dobu 18 měsíců. Poté je dávku testosteronu možno zvýšit na 100 - 150 mg měsíčně za sledování vývoje sekundárních pohlavních znaků. U chlapců poměrně častá gynekomastie komplikující substituci androgeny později ustoupí spontánně nebo po aplikaci antiestrogenu tamoxifenu (v dávce 2krát 10 mg denně po dobu zhruba 1 měsíce) [20].
Z dalších hormonů je zvažována léčba rekombinantním erytropoetinem, kterým se (nezávisle na erytropoetickém efektu) podařilo zvýšit klidové hladiny testosteronu (u žen estradiolu) a normalizovat hladiny FSH, LH, SHBG a prolaktinu dialyzovaných mužů [4,11-13,23,30,32].
Substituční léčba estrogeny u dialyzovaných žen
U premenopauzálních amenoroických žen nebo u žen s předčasnou menopauzou a zachovalou dělohou lze doporučit substituci estrogenem, u žen se zachovalou dělohou v kombinaci s gestagenem. Podávání hormonu navodí menstruační cyklus a upraví sexuální funkce [18]. Substituce estrogeny má význam i z hlediska zpomalení ztráty kostní hmoty. Podobně jako u mužů léčených androgeny je třeba i u žen zvážit všechna rizika, s nimiž je dlouhodobé podávání estrogenu spojeno, především sklon k tromboembolickým komplikacím. Řízení substituce estrogeny spadá do péče gynekologa.
Přestože hyperprolaktinemie koreluje s progresí ledvinové choroby, neustupuje při hemodialyzační léčbě. Při hladinách prolaktinu nad 100 ng/ml je třeba vyloučit prolaktinom. Přetrvává-li hyperprolaktinemie při běžné substituční léčbě, doporučuje se podávání některého z agonistů dopaminergních receptorů (bromokriptin, kabergolin, tergurid a quinagolid) [1].
Transplantace ledvin
Ke zlepšení funkce osy hypotalamus-hypofýza-gonády, k ústupu hyperprolaktinemie a obnovení spermatogeneze (eventuálně ovulace) může u některých mužů (a žen) s CHRI dojít zhruba do 6 měsíců po úspěšné transplantaci ledviny [24]. K obnovení fertility dochází zhruba u 60 % úspěšně transplantovaných žen. Ke klinicky prokazatelnému zlepšení gonadálních funkcí však nemusí dojít ani u jinak úspěšně operovaných pacientů, a to ani v případě normalizace hormonálních hladin. Jak ukázal Tsujimura [31], zlepšení sexuálních funkcí bylo zaznamenáno u 35,5 % operovaných mužů, zatímco u 28,1 % došlo k jejich zhoršení. Tauchmanova et al [29] u souboru 40 nemocných zjistili, že hladiny testosteronu u transplantovaných mužů byly pod dolní hranicí normy v 70 % případů, ostatní nemocní měli testosteron v dolním tercilu. U transplantovaných žen byly zaznamenány poruchy menstruačního cyklu až v 50 %. U 20 % žen došlo k předčasnému selhání ovariální funkce. Je pravděpodobné, že neúspěch transplantace souvisí s dlouhodobým podáváním imunosupresiv, které tlumí produkci sexagenů v gonádách a nadledvině nezávisle na funkci štěpu [22].
Závěr
Poruchy sexuálních funkcí jsou u chronicky hemodialyzovaných pacientů velmi časté a mohou souviset s hypogonadizmem nebo s dalšími přidruženými chorobami a jejich léčbou. Hypogonadizmus vzniká v důsledku dysregulace osy hypotalamus-hypofýza a současně i primárního útlumu funkce gonád. Protože hypogonadizmus snižuje kvalitu života dialyzovaných nemocných a zrychluje progresi renální osteodystrofie, je po důkladném zvážení prospěšnosti a rizika u vybraných jedinců doporučována léčba, která spočívá v substituci androgeny (nebo estrogeny), a to ve stejných dávkách a se srovnatelnými riziky jako u hypogonadálních jedinců s normální funkcí ledvin. Jednou z variant léčby hypogonadizmu je aplikace rekombinantního lidského erytropoetinu. Úplné kompenzace lze podle některých autorů docílit až u 30 % transplantovaných. Identifikace zatím neznámého uremického faktoru (nebo komplexu faktorů) postihujícího osu hypotalamus-hypofýza-gonády lépe objasní patogenezi hypogonadizmu u CHRI a umožní účinnou prevenci a léčbu závažných poruch reprodukce dialyzovaných nemocných. Nové poznatky v této dosud opomíjené oblasti medicíny přispějí k prodloužení a zlepšení kvality života těchto pacientů.
Poděkování
Práce vznikla za podpory grantu IGA MZ ČR č. NR/9055-4.
prof. MUDr. Ivana Žofková, DrSc.
www.endo.cz
e-mail: izofko@endo.cz
Doručeno do redakce: 11. 10. 2006
Přijato po recenzi: 22. 1. 2007
Sources
1. Barlier A, Jaquet P. Quinagolide - a valuable treatment option for hyperprolactinaemia. Eur J Endocrinology 2006; 154 : 187-195.
2. Bonomini V, Orsoni G, Sorrentino MA et al. Hormonal changes in hemodialysis. Blood Purif 1990; 8 : 54-68.
3. Burak W, Grzeszczak W, Trelewicz P et al. The effect of hemodialysis on levels of beta-endorphin in serum patients with chronic renal failure treated with erythropoietin. Przegl Lek 1996; 53 : 54-57.
4. Carlson HE, Graber ML, Gelato MC et al. Endocrine effects of erythropoietin. Int J Artef Organs 1995; 18 : 309-314.
5. Caticha O, Norato DY, Tambascia MA et al.Total body zinc depletion and its relationship to the development of hyperprolactinemia in chronic renal insufficiency. J Endocrinol Invest 1996; 19 : 441-448.
6. Cepicky P, Sulkova S, Stroufova A et al. The correlation of serum prolactin level and psychic stress in women undergoing a chronic hemodialysis programme. Exp Clin Endocrinology 1992; 99 : 71-72.
7. English K, Steed R, Diver M et al. Low dose transdermal testosterone therapy improves angina treshold in men with chronic stable angina. Circulation 2000; 102 : 1906-1911.
8. Hochstetler LA, Flanigan MJ, Lim VS. Abnormal endocrine tests in a hemodialysis patient. J Am Soc Nephrol 1994; 4 : 1754-1759.
9. Holley JL. The hypothalamic-pituitary axis in men and women with chronic kidney disease. Adv Chronic Kidney Dis 2004; 11 : 337-341.
10. Johansen KL. Treatment of hypogonadism in men with chronic kideny disease. Adv Chronic Kidney Dis 2004; 11 : 348-356.
11. Kokot F, Wiecek A, Grzeszczak W et al. Influence of erythropoietin treatment on follitropin and lutropin response to luliberin and plasma testosterone levels in haemodialyzed patients. Nephron 1990; 56 : 126-129.
12. Kook F, Wiecek A, Schmidt-Gay H et al. Influence of long-term erythropoietin therapy on endocrine abnormalities in haemodialyzed patients. Przegl Lek 1992; 49 : 43-49.
13. Lawrence IG, Price DE, Hewlett TA et al. Erythropoietin and sexual dysfunction. Nephrol Dial Transplant 1997; 12 : 741-747.
14. Lindberg JS, Moe SM. Osteoporosis in end-state renal disease. Semin Nephrol 1999; 19 : 115-122.
15. Luboshitzki R, Wagner O, Lavi S et al. Abnormal melatonin secretion in hypogonadal men: The effect of testosterone treatment. Clin Endocrinol 1997; 47 : 463-469.
16. Majdan M, Kotarski J, Ksiazek A et al. Relationship between some prognostic markers of HD patients and serum erythropoietin, insulin-like growth factor-1, leptin, parathormone and testosterone. Int Urol Nephrol 1999; 31 : 563-569.
17. Matuszkiewicz-Rowinska J, Skorzewska K, Radowicki S et al. Menstrual disturbances and alterations in hypophyseal gonadal axis in end-stage premenopausal women undergoing hemodialysis: a multi-center study. Pol Arch Med Wewn 2003; 109 : 609-615.
18. Matuszkiewicz-Rovinska J, Skorzewska K, Radowicki S et al. The benefits of hormone replacement therapy in pre-menopausal women with estrogen deficiency on haemodialysis. Nephrol Dial Transplant 1999; 14 : 1238-1243.
19. Petrovic MS, Prelevic GM, Balint-Peric LA et al. The effect of hyperprolactinemia on biohumoral parameters of bone metabolism in women of reproductive age on chronic hemodialysis. Srp Arch Celok Lek 1992; 120 : 15-18.
20. Poršová-Dutoit I. Léčba mužského hypogonadismu. In: Mužský hypogonadismus. Nedostatečná funkce mužských pohlavních žláz. Praha: Maxdorf 2005; 72-121.
21. Ramirez G, Bittle PA, Sanders H et al. The effects of corticotropin and growth hormone releasing hormones on their respective secretory axes in chronic hemodialysis patients before and after correction of anemia with chronic hemodialysis patients before and after correction of anemia with recombinant erythropoietin. J Clin Endocrinol Metab 1994; 78 : 63-69.
22. Reid IR. Glucocorticoid-induced osteoporosis and other forms of secondary osteoporosis. In: Meunier PJ (ed). Osteoporosis: Diagnosis and Management. London: Dunitz 1998, 233-250.
23. Resic H, Alajbegovic A, Sahovic V et al. Effect of erythropoietin on gonadotropic hormones and sexual function in patients on hemodialysis. Med Arch 2004; 58 : 113-115.
24. Saha MT, Saha HH, Niskanen LK et al. Time course of serum prolactin and sex hormones following succesfull renal transplantation. Nephron 2002; 92 : 735-737.
25. Sasagawa I, Tateno T, Suzuki Y et al. Circulating levels of inhibin in hemodialysis males. Arch Androl 1998; 41 : 167-171.
26. Schaefer F, Vogel M, Kerhoff G et al. Experimental uremia affects hypothalamic amino acid neurotransmitter milieu. J Am Soc Nephrol 2001; 12 : 1218-1227.
27. Singh AB, Norris K, Modi N et al. Pharmacokinetics of a transdermal testosterone system in men with end stage renal disease receiving maintenance hemodialysis and healthy hypogonadal men. J Clin Endocrinol Metab 2001; 86 : 2437-2445.
28. Soykan A, Boztas H, Kutlay S et al. Do sexual dysfunctions get better during dialysis? Results of a six-month prospective follow-up study from Turkey. Int J Impot Res 2005; 17 : 359-363.
29. Tauchmanova L, Carrano R, Sabbatini M et al. Hypothalamic-pituitary-gonadal axis function after successful kidney transplantation in men and women. Human Reprod 2004; 19 : 867-873.
30. Tokgoz B, Utas C, Dogukan A et al. Effects of long-term erythropoietin therapy on the hypothalamo-pituitary-testicular axis in male CAPD patients. Perit Dial Int 2001; 21 : 448-454.
31. Tsujimura A, Matsumiya K, Tsuboniva N et al. Effect of renal transplantation on sexual function. Arch Androl 2002; 48 : 467-474.
32. Valdes Socin A, Magis D, Betea D et al. Pituitary diseases in elderly patients with chronic renal insufficiency. Rev Med Liege 2002; 57 : 375-381.
33. Watschinger B, Watzinger U, Templ H et al. Effect of recombinant human erythropoietin on anterior pituitary function in patients on chronic hemodialysis. Horm Res 1991; 36 : 22-26.
34. Žofková I, Sotorník I. The effect of parathyroidectomy on thyrotropic and lactotropic functions in patients with renal osteodystrophy. Nephron 1995; 71 : 284-290.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 6-
All articles in this issue
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

