-
Medical journals
- Career
Genetické faktory a riziko kardiovaskulárnych ochorení
Authors: A. Teren; P. Gavornik
Authors‘ workplace: II. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Andrej Dukát, CSc.
Published in: Vnitř Lék 2007; 53(6): 678-693
Category: Reviews
Overview
Cieľom tejto práce je sumarizovať genetický podklad kardiovaskulárnych ochorení podľa doterajších poznatkov, so zameraním na genetické markery multifaktoriálnych foriem kardiovaskulárnych ochorení na podklade aterosklerózy, vrátane ich interakcie s klasickými rizikovými faktormi.
Kľúčová slová:
ateroskleróza - kardiovaskulárne riziko - deoxyribonukelová kyselina - genetika - polymorfizmusÚvod
Ľudský genóm možno v dnešnej dobe počítačov definovať ako zbierku informácií, programov, algoritmov a časo-priestorových plánov ich spúšťania a vypínania [18]. Popri fyzickej - materiálnej existencii dovoľujú jeho produkty existenciu a realizáciu abstraktných, do neživej formy transformovaných informácií [18]. Lekársky pohľad býva profesionálne zúžený na otázky ľudského tela (vrátane mysle), jeho zdravia a chorôb. Hľadá vzťah medzi genotypom a fenotypom, ktorý by mohol nejakým spôsobom využiť pre optimalizáciu fenotypu [143]. V poslednom čase došlo k značným zmenám v našom chápaní tohto vzťahu. Fertilizáciou vzniká zárodok s určitou výbavou aj so všetkými familiárnymi (dedičnými, hereditárnymi) „chybami“. Túto výbavu možno prirovnať k neotesanému balvanu, ako pracovnému materiálu. Od tejto chvíle je materiál pod vplyvom vonkajších faktorov. Možnosť zásahu do intenzity pôsobenia každého faktora sa počas života mení. Výsledkom je mnohopočetná, časopriestorová, situačná interakcia, ktorá vytvára podstatu biologickej i psychosociálnej existencie ľudského indivídua [58]. Vzťah medzi genotypom a fenotypom teda nie je priamočiary a historické klinické jednotky, tvorené vyložene z obrazov, ktoré sme získali pozorovaním fenotypu, nás vedú k nesúladu až rozporu medzi kategorizáciou príčin a klasifikáciou následkov [52,143].
Genetická determinácia sa na vzniku chorôb podieľa rôznou mierou. Od takmer absolútnej, prakticky stopercentnej genetickej podmienenosti až po takmer úplnú nezávislosť [18]. Najmenšou zodpovednou genetickou jednotkou je v detaile jeden nukleotid a jeho bodová mutácia. Existuje celý rad ochorení, ktoré možno takto klasifikovať - rôzne alely toho istého génu zodpovedajú rôznym klinickým jednotkám (napr. Duchennova a Beckerova svalová dystrofia, erozívna vitreoretinopatia a Wagnerova choroba) [13,18,42-44,145]. Na druhej strane identické alely toho istého génu na rôznom geno-enviromentálnom pozadí môžu mať rozdielne fenotypové prejavy [58,59]. Navyše mutovaný gén sa nemusí vôbec prejaviť. Ak sa znak u niektorých z nositeľov neprejaví, má neúplnú penetranciu. Ak sa znak vyskytuje u viacerých členov rodiny v odlišných formách (napr. ľahkej, stredne ťažkej a závažnej), hovoríme, že znak má variabilnú expresivitu [142]. Penetrancia teda prejav genetického znaku charakterizuje kvalitatívne a expresivita kvantitatívne. O výslednom fenotype často rozhoduje aj druhá alela, čiže genotyp daného lokusu (charakter genetickej informácie v príslušnej časti určitého chromozómu) a v konečnom dôsledku celá genetická výbava jedinca v rámci jednej bunky, označovaná ako genóm (tzv. efekt génového pozadia - „genetic background“) [80]. V prípade monogénových ochorení s dominanciou patogénnej alely a jej úplnou penetranciou (prejavom) je vplyv génového pozadia. Takéto ochorenia sa nazývajú aj alelové. Choroby, ktoré sú determinované expresiou kombinácie dvoch alel príslušného génu možno označiť ako genotypové. Ak sa akákoľvek patogénna alela určitého génu exprimuje vo forme toho istého fenotypu, ide o ochorenia génové a pokiaľ o penetrancii patogénneho fenotypu rozhodujú alelové variácie vo viacerých génoch, hovoríme o polygénových, multilokusových ochoreniach. Keďže žiadny gén neexistuje v úplnom vzduchoprázdne a celkom nezávisle od okolia, je zrejmé, že čím viac génov je v hre, tým väčší priestor sa utvára pre uplatnenie situačných vplyvov [80]. Tým viac sa od hodnotenia „buď - alebo“ blížime k pravdepodobnostnému postoju „asi, snáď“, vyjadreného ako náchylnosť (susceptibilita) alebo odolnosť [18,136]. Na vyjadrenie určitého chorobného stavu, ktorý vzniká interakciou génov a prostredia, používame termín multifaktoriálne ochorenia. Vo svetle poznania ľudského genómu tak vzniká v medicíne potreba nájsť nový súlad medzi príčinou a následkom.
Mnohotvárnosť ľudského genómu
Genetická informácia eukaryotických organizmov netvorí jeden celok, ale pomocou intrónov je podelená na rôzne dlhé úseky - exóny, ktoré sú vo forme ribonukleových kyselín (ribonucleic acid - RNA) pred jej transláciou dodatočne zložené. Expresia génov kontrolovaná prostredníctvom regulačných oblastí v ich štruktúre. Medzi esenciálne regulačné oblasti, ktorá sa nachádza aspoň v jednom exemplári na začiatku každého známeho génu, patrí promótor. V tejto oblasti sa rozvíja činnosť RNA polymerázy, nevyhnutnej pre prepis dedičnej informácie - transkripciu [80]. Na konci génu sa nachádza terminátor, ktorý ukončuje prácu polymerázy. Mozaikovitý charakter štruktúry s niekoľkými promotórmi alebo terminátormi umožňuje využitie jednej dedičnej informácie vo viacerých formách. Gén ako informačná jednotka v štruktúre nukleovej kyseliny tak nadobúda množstvo podôb [122,136]. Jeden a ten istý úsek vlákna deoxyribonukleové kyseliny (deoxyribonucleic acid - DNA) môže byť súčasťou viacerých génov - napr. jeden gén môže mať svoj začiatok umiestnený v rámci druhého génu prípadne v ňom môže byť celý umiestnený. Rovnako pamäťový úsek jedného génu môže byť regulačnou oblasťou iného génu [80]. Definovanie génu na úrovni DNA sa tak stáva neúplnym. Presnejšie by snáď mohol gén definovať úsek RNA, prepisovaný v celku.
Gény, ako ich chápeme na úrovni DNA, sa teda navzájom prekrývajú [18,80]. Vzhľadom na veľkosť intrónov nie je raritou umiestnenie jedného génu v rámci intrónu druhého génu. Ďalšou možnosťou je použitie každého reťazca určitého úseku dvojzávitnice DNA na prepis dvoch rôznych génov (tzv. mt gény) [122]. Uvedeným zaobchádzaním s dedičným materiálom možno podľa hesla „menej je niekedy viac“ vysvetliť, prečo náš genóm nie spomedzi všetkých organizmov ani zďaleka najrozsiahlejší. U vírusov (fágov) ide takéto šetrenie molekulou tak ďaleko, že rovnaký reťazec môže slúžiť na syntézu funkčne rôznych proteínov len podľa toho, v ktorom mieste je transkripcia zahájená - v RNA reprezentuje každú aminokyselinu v reťazci proteínu triplet nukleotidov, pričom posunom počiatočnej lokalizácie čítacieho rámca tripletov o jeden nukleotid možno získať z identickej sekvencie tri rôzne bielkoviny [2]. U eukaryotických organizmov je vďaka intrónom využitie DNA ešte znásobené rôznym poradím exónov v konečnom produkte. Týmto mechanizmom sa vysvetľuje podiel intrónov na evolúcii organizmov.
Ďalšou možnosťou je vznik funkčne odlišných bielkovín z RNA pomocou alternatívneho zostrihu intrónov pred transláciou (tzv. „alternative splicing“) alebo na základe odlišnej posttranslačnej úpravy proteínu. Uvedený mechanizmus sa bežne uplatňuje pri diferenciácii tkanív napr. kardiovaskulárneho systému [2,80,122].
Štruktúru génu ďalej dopĺňajú tzv. „CpG ostrovy“. Ide o regulačné sekvencie s motívom cytozín-guanín. Metylácia cytozínov vedie k útlmu prepisu príslušného génu.
Nie všetky gény v ľudskom genóme disponujú aktívne použiteľnou informáciou. Tzv. pseudogény sú úseky DNA, ktoré sa aktívnym génom veľmi podobali, ale väčšinou im chýbajú intróny, prípadne iné regulačné oblasti, nevyhnutné k prepisu [80]. Väčšina pseudogénov nie je transkripčne a translačne aktívna. Existujú však aj výnimky, prekladané počas určitých období života do proteínov. Výskyt pseudogénov je pomerne veľký a v niektorých oblastiach dokonca zodpovedá výskytu funkčných génov. Význam pseudogénov nie je celkom objasnený [18]. Predpokladá sa, že ide o určitú evolučne tlmenú, avšak udržiavanú zálohu informácií, ktorá zbiera chyby, vznikajúce počas replikácie DNA a pri opätovnej aktivácii počas evolúcie potenciálne zvyšuje variabilitu a tým aj možnosť nadobudnutia nových vlastností [58].
Evolúciu možno považovať za výsledok pôsobenia dvoch protikladných tendencií - konzervatívneho princípu stálosti, nemennosti a dynamického princípu neustálych zmien. V živej hmote sú tieto princípy vyvážene upevňujú a využívajú to, čo sa v súboji s vonkajšími i vnútornými podmienkami osvedčilo a na strane druhej neustále ponúkajú nové varianty riešenia [58,122].
Mnohotvárnosť ľudského genómu ako dôsledok jeho variability nadobúda v súčasnosti nový rozmer. Od rôznosti znakov, ako prejavov dedičných a environmentálnych vplyvov, prechádza medicína aj vďaka genetike k ich podstate a príčinám [18]. Každý jedinec na zemeguli je svojou genetickou výbavou jedinečný. Existencia odlišností spočíva v neprestajne vznikajúcich a miznúcich zmenách štruktúry genómu [58,142]. Vzácne variácie sú klasifikované ako mutácie. V prípade bežného výskytu v populácii ide o tzv. polymorfizmy [52]. Uvedený rozdiel vo frekvencii výskytu je daný zlúčiteľnosťou variácie so životom resp. vplyvom na reproducibilitu jedinca. Pre odlíšenie polymorfizmov a mutácií sa používa dohodnutá miera pre frekvenciu najčastejších alel určitého génu v populácii do 99 %. Pri prekročení tejto hodnoty sa prestáva hovoriť o polymorfizmoch a všetky ostatné alely sa považujú za mutácie odvodené od tejto štandardnej alely [18,52,80].
Medzi základné polymorfizmy na úrovni DNA patria jednonukleotidové odlišnosti - tzv. SNP (single nucleotide polymorphisms), používané aj na mapovanie genómu [52]. Poznaním ich presnej lokalizácie v DNA možno určiť polohu celých génových lokusov. Frekvencia ich výskytu sa pohybuje v intervale 1 SNP na 200 - 2 000 bázových párov. SNP majú svoju databázu, ktorá obsahuje milióny variácií a neustále sa rozrastá (http://www.ncbi.nlm.nih.gov/SNP/).
Polymorfizmy možno štatistickým dôkazom spájať s patologickými prejavmi. Následne je možné odhadnúť empirické riziko, keďže je zo skúseností známe, že u osôb s určitým genotypom dochádza k rozvoju daného ochorenia častejšie ako u osôb s iným genotypom v danom polymorfnom systéme [52,136,143]. Takýchto asociácií bolo doposiaľ identifikované veľké množstvo [13,42-44,57,69,165] Na overenie kauzality týchto štatistických vzťahov je potrebné objasnenie funkcie produktov zainteresovaných génov, ako sa to už deje napr. v systéme HLA a ďalších imunokompetentných molekúl [18].
Genetika kardiovaskulárneho systému
Kardiovaskulárne ochorenia patria medzi najrozšírenejšie, najzávažnejšie a najpálčivejšie nielen zdravotnícke, ale aj ekonomické a sociálne problémy takmer všetkých krajín súčasného sveta. Zapríčiňujú vysokú morbiditu, spojenú s dlhotrvajúcou invalidizáciou a asi polovicu úmrtí populácie, čo je dva razy viac ako na druhú najčastejšiu príčinu mortality - onkologické choroby [32]. Drvivá väčšina týchto ochorení vzniká na podklade systémových degeneratívnych zmien cievnych stien s predilekčným prejavom v ich určitých úsekoch. Tento proces je známy pod súhrnným názvom ateroskleróza (odtiaľ aterosklerózou podmienené kardiovaskulárne ochorenia - AS KVS). Na základe doterajších epidemiologických, experimentálnych a klinických prác sa pri vzniku aterosklerózy predpokladá súčinnosť viacerých rizikových faktorov a mechanizmov [32]. Ukazuje sa, že ide o patologický proces s multifaktoriálnym pozadím a významným etiologickým podielom dedičnej informácie [58]. Ukončenie „Projektu ľudského genómu“ (Human Genome Project) poskytlo výskumným tímom aj klinikom nové možnosti uplatnenia techník genetickej analýzy pri identifikáciu rizikových pacientov. V minulosti patrili medzi nozologické jednotky s objasnenou genetickou zložkou iba zriedkavé ochorenia, podmienené variáciou v jednom géne (napr. Brugada syndróm, Liddlov syndróm) [52]. Pozornosť sa v súčasnosti stále viac sústreďuje na odhaľovanie genetickej náchylnosti k bežným, multifaktoriálnym ochoreniam, s ktorými sa klinik stretáva v každodennej praxi [76]. Variácie génov pomerne často nie sú spojené priamo s AS KVS, ale ako ich markery sa podieľajú zlepšení diagnostiky a hodnotenia rizika pacienta. Ukázalo sa, že stupeň expresie určitých génov (množstvo detegovanej RNA alebo proteínu príslušného génu) odráža štádium ochorenia. Pokiaľ ide o asociáciu s určitými špecifickými klinickými podmienkami, ide o priame biomarkery týchto klinických stavov [34].
Pri identifikácii genetických markerov sa používajú štúdie kandidátnych génov, zamerané na jednotlivé gény oddelene a genomické štúdie, ktoré za zaoberajú výskumom genómu ako celku. Podľa dizajnu ich možno rozdeliť na dva hlavné typy:
- asociačné štúdie
- väzbové štúdie
Cieľom asociačných štúdií je demonštrovať, že určitý génový variant (obvykle SNP) je signifikantných rizikovým faktorom sledovaného patologického znaku (viď tab. 2). Výhodou asociačných štúdií je možnosť porovnávacích analýz v rámci rodín aj medzi podsúbormi pacientov verzus kontrol. Cieľom je testovať predpoklad asociácie ochorenia s predurčeným génom resp. setom génov (ide o tzv. „kandidátne gény“). Nevýhodou tohto dizajnu je, že asociáciu demonštrovanú v jednej štúdií sa obvykle nepodarí potvrdiť v nadväzujúcich projektoch [162]. Z množstva faktorov, ktorá sa podieľajú na nesúrodnosti dát, zohráva najvýznamnejšiu úlohu inkonzistencia v definovaní chorobných fenotypov, nedostatočná veľkosť súborov, etnický profil sledovanej populácie (frekvencia SNP značne varíruje v jednotlivých etnikách), falošne pozitívne a falošne negatívne asociácie a stratifikácia populačnej vzorky [34].
Jedným z prístupov na odstránenie uvedených nepresností je identifikácia skupín markerov, prenášaných v rodinách resp. v populácií spolu. Tieto súbory variácií sa označujú ako haplotypy (súbor variantov, prítomných na jednom chromozóme) [40]. Ľudský genóm tak môže byť usporiadaný podľa oblastí obmedzenej variability, ktoré za nazývajú „haplotypové bloky“ [29]. Haplotypové bloky pozostávajú obvykle z tisícov nukleotidov a zrejme zahŕňajú globálnu variabilitu dedičnej informácie [127]. Na detekciu bežných haplotypov je potrebných iba niekoľko, pre príslušný haplotyp špecifických SNP-ov. Tieto SNP sa nazývajú ako „značkové“ (tzv. „haplotype tag-SNP“) a sú pre každý haplotyp špecifické [127]. Ideálna je aplikácia haplotypov do dizajnov asociačných štúdií, čo by značne rozšírilo ich záber a tým aj validitu výstupov, pokrývajúc globálnu variabilitu genómu. V súčasnosti sú tag-SNP definované iba pre menšinu génov. Zmenu majú priniesť projekty typu haplotypová mapa (haplotyp map - HAP-MAP) a Národný kardiopulmohematologický inštitút (the National Heart, Lung, and Blood Institute - NHLBI) riadené Programy aplikácie celogenómového výskumu (Programs in Genomic Applications - PGA), zamerané na celogenómové mapovanie kľúčových tag-SNP. Haplotypová asociačná analýza po prebratí nových výkonných a pritom cenovo dostupných techník zrejme nahradí terajšie analýzy asociácií individuálnych SNP. Medicínsky význam celogenómového prístupu sa podarilo demonštrovať v štúdii, definujúcej gény spojené so zvýšenou náchylnosťou (susceptibilitou) k infarktu myokardu (IM) [109].
Druhou formu výskumu sú väzbové štúdie („linkage studies“), často aplikované celogenómovo. Cieľom je identifikovať oblasti chromozómov - lokusov, ktoré môžu obsahovať gény, zodpovedné za príslušné ochorenie. Rozdiely oproti asociačnému dizajnu sú zhrnuté v tab. 1.
Table 1. Asociačné a väzbové štúdie. 
Na rozdiel od asociačných štúdií, vyžaduje dizajn väzbových štúdií porovnanie údajov z DNA pokrvne príbuzných jedincov na detekciu lokusov, ktoré sú dedené nenáhodne (t.j. v rodinách) vo vzťahu k sledovanému ochoreniu. Výhodou tohto typu štúdií je, že nie je a priori potrebná vstupná hypotéza, predkladajúca konkrétne genetické determinanty ochorenia [52]. Regióny (lokusy), identifikované väzbovými štúdiami, však obvykle zahŕňajú milióny bázových párov a stovky génov. Preto sa následne uskutočňujú asociačné analýzy jednotlivých génov v rozsahu pozitívneho väzbového signálu, s cieľom overiť asociáciu lokusu s ochorením a identifikovať konkrétne variácie génov, zodpovedných za túto asociáciu. Ide o časovo aj finančne náročný proces, ktorý bol už niekoľkokrát aplikovaný úspešne. Uskutočnili sa aj celogenómové štúdie asociačného typu [34]. Veľké nádeje sú v tomto prípade vkladané do identifikácie haplotyp-špecifických-SNP pre celý genóm, čím sa zníži náročnosť celogenómových štúdií s asociačným a stanú sa dominantnou metódou pri definícii patogénnych alelových variácií [127].
Genetické markery sú varianty (alely) v kóde DNA, ktoré sú samostatne alebo v kombinácii s inými faktormi spojené s prítomnosťou špecifického patologického znaku. V prípade monogénových ochorení umožňujú genetické štúdie priamočiare stanovenie klinickej diagnózy prostredníctvom analýzy DNA stanovenia expresie génu pomocou reverzné polymerázové reťazové reakcie (real time polymerase chain reaction - RT-PCR) resp. „Western blotting“ (analýzy proteínových produktov génov).
Pre multifaktoriálne, polygénové ochorenia s vysokou prevalenciou je však identifikácia genetických markerov oveľa obtiažnejšia. Interaktívna „sieť“, pozostávajúca z množstva génov, je veľmi rozsiahla a podmieňuje rozvoj chorobného stavu komplexne, zahŕňajúc navyše interakcie genetických, environmentálnych a fyziologických vplyvov. Obzvlášť to platí pre kardiovaskulárne ochorenia ako je napr. srdcové zlyhanie, kedy sa ako významný ukázal komplexný prístup sledovania genómu ako celku [143] v záujme urýchliť hľadanie genetických faktorov polygénnych ochorení sa aplikujú rôzne techniky, vrátane genómových skenov, mikročipových profilov expresie génov (tzv. „microarray gene profiling) a RT-PCR (polymerázová reťazová reakcia s použitím reverznej transkriptázy) [60]. Popri štúdiu na ľudských populáciách má aj v humánnej genetike naďalej nezastupiteľnú pozíciu výskum s použitím zvieracích modelov [22].
Viaceré známe markery s významným diagnostickým a prognostickým potenciálom pre kardiovaskulárne ochorenia sú zhrnuté v tab. 2. Markery, ktorých prítomnosť je spojená s vysokou pravdepodobnosťou ochorenia (tzv. vysokoprediktívne faktory), by mohli byť užitočné v diagnostickom procese, ako aj pri odhade prognózy ochorenia či účinnosti terapie. Markery s malou prediktívnou epidemiologickou silou môžu zas poskytovať nové poznatky o patofyziológii ochorenia alebo o nových možnostiach liečby [52,80]. Niektoré variácie majú funkčný dopad zmenou expresie alebo štruktúry produktu jedného až viacerých génov, podieľajúcich sa na rozvoji ochorenia. Naopak markery bez vplyvu na funkciu sú pomerne často lokalizované v blízkosti variantov s funkčným dopadom tak, že v populácii s často dochádza k ich spoločnému prenosu medzi generáciami (tzv. väzbová nerovnováha - linkage disequilibrium). Uvedená skupina markerov má nielen prediktívnu hodnotu, ale umožňuje tiež odhaľovanie variantov s priamym patologickým efektom na príslušný gén, s ktorým sa spoločne prenáša. Vysoká pozornosť sa venuje už vyššie spomenutým jednonukleotidovým polymorfizmom (SNP), najmä vďaka nenáročným postupom ich stanovenia a vysokej frekvencie ich výskytu v ľudskom genóme [18]. V súčasnosti prichádzajú stále nové informácie o ďalších genetických markeroch jednotlivých štádií aterotrombózy, pričom nové poznatky by mali pomôcť pochopiť dedičnosť a patofyziológiu s dopadom na klinickú prax a zlepšením prognózy, prevencie a liečby kardiovaskulárnych ochorení na podklade aterosklerózy (viď tab. 3)
Table 2. Vybrané gény, ktorých variácie sú spojené s kardiovaskulárnymi chorobami na podklade ateréosklerózy a s pridruženými stavmi. 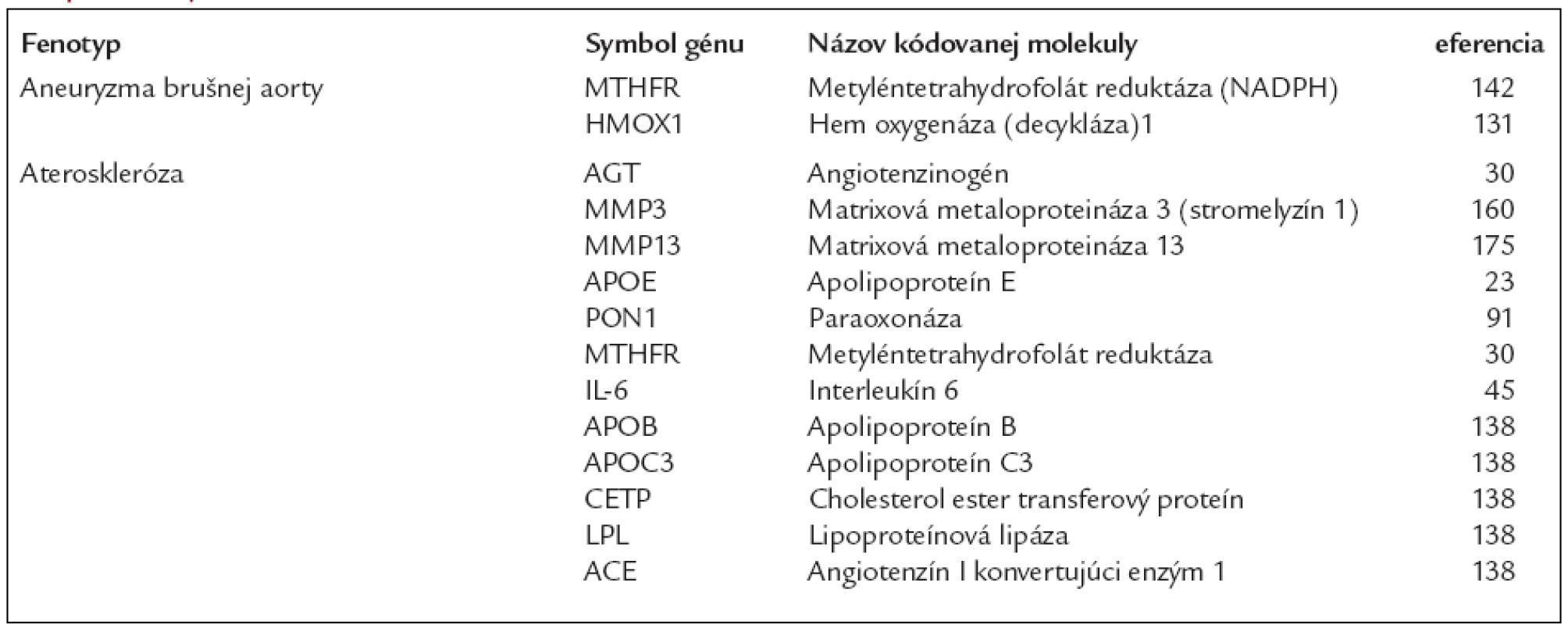
Table 3. Medicínsky význam genetických markerov. 
Za „zlatý štandard“ genetického výskumu u človeka boli tradične považované štúdie na dvojičkách (gemelilogický výskum) [136]. Fenotypové rozdiely u identických dvojčiat odrážajú vplyv odlišných faktorov prostredia, zatiaľ čo dizygotné dvojčatá môžu byť použité na výskum malých genetických rozdielov, keďže sú často, najmä v detstve, vystavované podobným environmentálnym vplyvom [18]. Štúdie na dvojičkách priniesli množstvo nových poznatkov aj o genetickej báze kardiovaskulárnych ochorení. Touto metódou bola prvýkrát demonštrovaná dedivosť krvného tlaku. Ďalším príkladom je úspešná aplikácia gemelilógie v štúdiách, testujúcich špecifické polymorfizmy angiotenzín II konverzjúceho enzýmu (ACE) vo vzťahu k hypertrofii myokardu resp. k infarktu myokardu. Iným príkladom výskum na dvojičkách v projektoch, objasňujúcich význam génu, kódujúceho peroxyzómovým proliferátorom aktivovaný receptor - PPAR ako aj ďalších génov v patogenéze obezity [88].
Jedným z najdôležitejších aspektov, určujúcich úspešnosť a reproducibilitu asociačných aj väzbových štúdií, je zadefinovanie sledovaného ochorenia resp. znaku (fenotypu). Obzvlášť to platí pre polygénne choroby, bežne sa vyskytujúce v populácii. Ako príklad možno spomenúť hypertenziu, ktorá je definovaná ako výška krvného tlaku nad 140/90 mm Hg. Z pohľadu genetiky však ide o hrubú charakteristiku patologického znaku, ktorá môže v analýzach pôsobiť ako mätúci faktor, keďže sa predpokladá značná heterogenita príčin vysokého krvného tlaku. Príčiny sú dané súhrou množstva genetických aj environmentánych faktorov v čase a priestore. Doterajšie genómové analýzy, hľadajúce „gén hypertenzie“ nepriniesli vzhľadom na nesúrodosť dát veľa svetla do tejto problematiky [115]. Tieto fakty iba dokumentujú kritický význam dôslednej definície skúmaného fenotypu, čo možno dosiahnuť jeho detailným patofyziologickým výkladom. Tak napríklad inzulínová rezistencia resp. senzitivita je často definovaná prostredníctvom glykémie nalačno, inzulinémie nalačno alebo pomocou indexov, vypočítaných z týchto parametrov, ktoré sú pomerne dostupné aj pre populačný výskum [64]. Ani tieto ľahko získateľné parametre však nie sú tak spoľahlivé, ako priame meranie inzulínovej senzitivity (predovšetkým intravenózny test glukózovej tolerancie a hyperinzulinemická euglykemická zámka), používané v rámci patofyziologických štúdií. Detailná definícia znaku vedie k odhaleniu fyziologických súvislostí, ako je to v prípade demonštrácie zdieľanej genetickej kontroly pre výšku krvného tlaku aj inzulínovej senzitivity [172]. Aplikácia euglykemickej svorky ako markera inzulínovej senzitivity spolu s vyššie opísaným haplotypovým prístupom umožnila identifikáciu génu lipoproteínovej lipázy ako markera inzulínovej senzitivity [39]. Ide o využitie tzv. „intermediárnych fenotypov“, čo sú skoré, subklinické štádiá patologických znakov, ktoré sa manifestujú v prirodzenom priebehu ochorenia [72]. Medzi detailne zadefinované fenotypy patrí odpoveď plazmatických hladín aldosterónu na infúziu angiotenzínu II pri hypertenzii (odlíšenie tzv. modulujúceho a non-modulujúceho fenotypu) a veľkosť LDL častíc pri dyslipidémii [3,123]. Znak tzv. „non-modulácie“ sa vyznačuje neschopnosťou angiotenzínu II regulovať sekréciu aldosterónu a prietok krvi obličkami u časti pacientov s esenciálnou hypertenziou. Novšie práce demonštrovali asociáciu tohto fenotypu s genotypom M235T v lokuse pre angiotenzinogén [55]. Ďalším príkladom intermediálneho fenotypu je vysoký výskyt zvýšenej koncentrácie voľného kortizolu v moči pri hypertenzii s nadmernou senzitivitou na prívod soli [84]. Pre aterosklerózu je referenčným intermediárnym fenotypom endoteliálna dysfunkcia. Analýza genetického pozadia v intermediárnych štádiách ochorenia je pomerne výhodná, keďže tieto štádiá sú obvykle detegovateľné u mladých, zdravých jedincov, bez anamnézy predchádzajúcej manifestácie ochorenia. Navyše samotný chorobný proces často spôsobuje sekundárne zmeny v sledovanom fenotype, čo môže výrazne ovplyvniť jeho vzťah ku genetickým markerom [143].
Monogénové kardiovaskulárne ochorenia
Výrazný progres sa zaznamenal v oblasti výskumu monogénových kardiovaskulárnych ochorení, manifestných vo forme hyperlipidémie, hypertenzie, hypertrofie myokardu alebo náhlej smrti [20,100,132,158]. Objasnenie patogenézy týchto zriedkavých, ale dramatických príkladov dedičnosti porúch v kardiovaskulárnom systéme poskytla nové poznatky implikovateľné do všeobecnej patogenézy kardiovaskulárnych chorôb resp. asociovaných stavov. Pilotná práca Browna a Goldsteina [37], zaoberajúca sa touto problematikou, prvýkrát charakterizovala molekulárnu bázu familiárnej hypercholesterolémie. Išlo o prevratný projekt, ktorý odhalil vzťah medzi perturbáciou metabolizmu cholesterolu, aterosklerózou a postihnutím koronárnych artérii na podklade aterotrombózy. Identifikácia kľúčových mutácií v géne pre LDL receptor, zodpovedných za vznik tejto metabolickej odchýlky, viedla k objavu 3-hydroxy, 3-metyl glutarylkoenzýmu A (hydroxymethyl-glutaryl Conezym A - HMG CoA - reduktázy, kľúčového regulátora metabolizmu cholesterolu. Tento poznatok následne poskytol priestor pre vývoj inhibítorov HMG CoA reduktázy (statínov), ktoré kompletne zmenili pohľad na terapiu kardiovaskulárnych ochorení na podklade aterosklerózy [67]. Deskripcia ďalších typov dedičných dyslipidémií (Tangierova choroba, sitosterolémia) umožnila pochopiť väčšinu mechanizmov cholesterolového transportu a metabolizmu [87,114]. Popis kľúčových metabolických dráh patogenézy monogénnych foriem dyslipidémií môže definovať genetické markery, ktoré by mohli byť rovnako relevantné pre bežnejšie, polygénne podmienené poruchy metabolizmu lipidov.
Objasnenie molekulárnej podstaty familiárnej hypertrofickej kardiomyopatie umožnilo detailný popis fundamentálnej patogenézy hypertrofie myokardu [128]. Aj keď je klinický korelát tohto fenotypu zameraný na všeobecné známky komorovej hypertrofie, je už dnes dokázaná expresia tuctov mutácií viac než desiatich rôznych sarkomérových proteínov v sprievode tohto kardiovaskulárneho end-pointu. Naproti tomu, určitá mutácia môže podnietiť rozvoj niekoľkých odlišných klinických fenotypov u rôznych príbuzných [128]. Uvedené pozorovania naznačujú prídatný efekt modulujúcich génov a environmentálnych vplyvov, určujúcich charakter exprimovaného fenotypu monogénových porúch a získaných komorbidít [18,143]. Objavy ako tento sú zdrojom dôležitých informácií, ktoré zdôrazňujú význam genetickej heterogenity zdanlivo jednotných klinických fenotypov, ako je ventrikulárna hypertrofia myokardu. Navyše ide o zistenia, podčiarkujúce signifikanciu komplexných interakcií medzi génmi navzájom resp. génov s prostredím, ako aditívnych determinantov klinickej manifestácie genetického faktora.
Ďalšie dôležité poznatky o patomechanizmoch kardiovaskulárnych rizikových faktorov priniesli štúdie monogénnych foriem hypertenzie [81]. Systematická analýza rodín s elevovaným resp. zníženým krvným tlakom definovala aspoň desať monogénne podmienených porúch. Zaujímavým bolo zistenie, že molekulárne charakteristiky týchto foriem hypertenzie sú v súlade s dlho známym Guytonovým modelom regulácie krvného tlaku a homeostázy sodíka, zameraných na obličky ako ústredný patofyziologický element. Vo všeobecnosti väčšina monogénnych porúch, narúšajúcich homeostázu krvného tlaku zahŕňa gény pre zložky renín-angiotenzín-aldosterónového systému a tiež pre dráhy iónového transportu. Detailné objasnenie príslušných patogenetických dráh môže následne viesť k odhaleniu ďalších génov a ich variácií, ktoré sa podieľajú na expresii polygénnych chorôb kardiovaskulárneho systému.
Genetické markery polygénnych foriem kardiovaskulárnych ochorení
Progres v definovaní genetického základu komplexných patologických znakov ako je hypertenzia, dyslipidémia a ateroskleróza je značne brzdený jednak komplexným charakterom ich patobiológie, jednak relatívne slabou výťažnosťou metód, využívaných v súčasnosti v klasickej genetike na identifikáciu monogénnych fenotypov. Ako už bolo spomenuté, vo svetovej literatúre je dostupných viac než tisíc publikovaných asociácií 1 - 2 SNP v 1 - 2 kandidátnych génoch s klinickými korelátmi kardiovaskulárnych ochorení (ICHS), ako aj s ich rizikovými faktormi ako je hypertenzia, parametre lipidového profilu, komorová hypertrofia. Dizajn väčšiny týchto štúdií však má viacero závažných nedostatkov, postrádajú adekvátnu štatistickú silu a pomerne často zlyháva ich potvrdenie v následných konformačných štúdiách [148]. Pri snahách detekovať signifikantnú koreláciu medzi konkrétnym SNP a špecifickým chorobným stavom existuje niekoľko obmedzení. Asociácia musí vykazovať dostatočnú silu a/alebo sa sledovaná alela musí byť v populácii s dostatočnou frekvenciou. Zriedkavé SNP na detekciu vyžadujú veľmi silnú prediktívnu hodnotu vo vzťahu k riziku rozvoja ochorenia, aj keď tieto alely sú v typickom prípade už identifikované prostredníctvom väzbovej analýzy [58]. SNP výrazne rozšírené v populácii sú preto užitočnejšie pri výskume kandidátnych génov, čo je však spojené s opomenutím vysoko rizikových variácií s nízkou frekvenciou výskytu. Navyše mnoho štúdií, ktoré uprednostnili 1 - 2 SNP pred analýzou haplotypov, definovaných na základe väzbovej nerovnováhy, nedokázalo adekvátne zhodnotiť význam sledovaného lokusu kandidátneho génu v roli rizikového faktora toho-ktorého ochorenia. Pri takých komplexných znakoch ako je aterotrombóza sa predpokladá len mierny resp. aditívny podiel každého zo setu zainteresovaných genetických markerov na náchylnosti k ochoreniu, čo len potvrdzuje inkonzistencia výsledkov ukončených projektov [143].
S postupným vývojom budú investigátori pravdepodobne opäť najviac profitovať z poznatkov, získaných v prvej generácii asociačných štúdií komplexných znakov. Do blízkej budúcnosti sú naplánované štúdie, zahŕňajúce klinické investigátorské siete a operujúce s jednotnými, štandardnými protokolmi fenotypov. Tento prístup má umožniť štandardizáciu dizajnovania rozsiahlych štúdií typu „case-control“, s dobre definovanou populáciou a použitím nových, vysoko efektívnych technológií genotypizácie. Vývoj databáz haplotypov pre kandidátne lokusy po celom genóme a značkovaných pomocou „tag-SNPs“, popri pokrokoch dosiahnutých v bioštatistike a bioinformatike uľahčí kvantifikáciu relatívneho podielu jednotlivých markerov na susceptibilite ku komplexným, multigénovým kardiovaskulárnym chorobám [89].
Novšie štúdie už započali implikáciu týchto postupov do kardiovaskulárnej medicíny. Ako príklad môže slúžiť projekt japonských investigátorov, ktorý u 2 819 pacientov s anamnézou IM a u 2 242 nepokrvných kontrol vybrali na genotypizáciu 112 polymorfizmov v 71 kandidátnych génoch. So zvýšeným rizikom IM boli asociované varianty v troch génoch: konexín-3, inhibitor plazminogénového aktivátora-1 a stromelyzín-3. Naznačuje to význam týchto variantov pre stratifikáciu rizika pacienta pred začatím preventívnych liečebných opatrení [174]. Iná štúdia analýzou variácií 62 kandidátnych génoch u pacientov s včasným rozvojom IM v osobnej anamnéze identifikovala ako silné rizikové markery polymorfizmy v génoch pre troch členov rodiny trombospondínu [152]. S postupnou kumuláciou reproducibilných dát budú môcť tieto markery nájsť uplatnenie aj pri stanovovaní kardiovaskulárneho rizika v bežnej klinickej praxi (viď tab. 1).
Farmakogenetika: terapia „šitá na mieru“?
Doteraz diskutované genetické markery boli zamerané na predikciu náchylnosti ku vzniku ochorenia. Farmakogenetika je veda, zaoberajúca sa výskumom genetických variant, ktoré ovplyvňujú odpoveď jedinca na farmakoterapiu. Funkčné varianty v génoch, kódujúcich enzýmy zodpovedné za metabolizmus liečiv, liekové transportéry a cieľové molekuly farmák, sú schopné modulovať farmakodynamiku a možno im pripísať značnú časť klinicky evidentnej interindividuálnej variability účinnosti/tolerancie preparátov u exponovaných pacientov. Genetické varianty môžu tiež vplyvom na expresné profily a/alebo funkčnosť proteínov, modulujúcich priebeh samotného chorobného procesu, modifikovať pomer terapeutického a potenciálne nežiaduceho efektu sledovanej intervencie v získaných podskupinách pacientov. Tak napríklad varianty adrenergných receptorov môžu mať vplyv na rozsah neurohumorálnej aktivácie sympatiku počas srdcového zlyhania [134]. V minulosti bola pozornosť farmakogenetiky venovaná predovšetkým liekovej toxicite. Súčasným hlavným cieľom je identifikácia genetických podkladov diverzity terapeutickej výťažnosti liečiv s následnou racionálnou selekciou pacientov, vhodných pre tú-ktorú intervenciu. Na potencionálny význam tejto vedy poukazuje aj neustále vzrastajúca prevalencia kardiovaskulárnych ochorení na podklade aterosklerózy v západných krajinách. Poznatky farmakogenetiky majú už teraz potenciál poskytnúť vyšší benefit kardiovaskulárnej terapie u miliónov ohrozených probandov prostredníctvom maximalizácie účinnosti preparátov a/alebo minimalizácie liekmi podmienenej morbidity.
Za posledné roky bolo zrealizovaných niekoľko štúdií, zameraných na farmakogenetiku kardiovaskulárnych ochorení na podklade aterosklerózy a modifikácie rizikových faktorov. Príkladom je interindividuálna variabilita účinnosti terapie statínmi na hladiny lipidov. Taq1 polymorfizmus v intróne 1 génu pre cholesterol-ester transferový proteín, je spojený s alteráciou koronarografiou detegovanej odpovede na pravastatín [77]. The Lipoprotein and Coronary Atherosclerosis Study demonštrovala u nositeľov delečnej alely D polymorfizmu inzercia/delécia (I/D) v géne pre angiotenzín I konvertujúci enzým (ACE) výraznejšiu odpoveď na terapiu fluvastatínom v podobe angiograficky dokumentovanej regresie koronárnej aterosklerózy [92]. V ďalšej štúdii bola homozygotnosť delečnej alely tohto polymorfizmu asociovaná s lepšou antihypertenzívnou odozvou na terapiu inhibítormi ACE [139]. Rovnako sa ukázal vplyv daného polymorfizmu na antihypertenzívny efekt hydrochlorotiazidu [133]. Iným príkladom je gén estrogénového receptora α. Jeden z intrónových polymorfizmov tohto génu bol spojený s vplyvom na hladiny HDL a E-selektínu v krvi, čo sú dva faktory s významným uplatnením v procese aterogenézy [48,49]. Niekoľko štúdií tiež potvrdilo účinok polymorfizmov apolipoproteínu E na citlivosť hladín lipidov voči liečivám [47,112]. V nasledujúcom období sa očakáva vzostup významu prediktívnych genetických markerov rizika ochorenia resp. účinnosti terapie v procese prevencie a liečby kardiovaskulárnych ochorení na podklade aterosklerózy, ako integrálna súčasť kardiovaskulárnej medicíny.
Závery
Výskum genetických markerov ochorení smeruje ku genomike (veda, zaoberajúca sa interakciami medzi génmi a prostredím, resp. génmi navzájom) a proteomike (veda o proteínových produktoch génov). Použitím nových metodík (napr. expressed sequenced tag - EST, metóda značkujúcich sekvencii expresie) sa získali informácie o množstve génov prekladaných do bielkovín v kardiovaskulárnom systéme za rôznych patologických podmienok [61]. V kardiovaskulárnom systéme bola zistená expresia asi 27 000 rôznych RNA, ktorých gény sú podľa umiestnenia na chromozóme zoskupené do tzv. klastrov [10,25]. V súčasnosti je tiež dostupný celý rad metód na kvantifikáciu a analýzu stupňa expresie RNA na úrovni celého genómu (DNA mikročipy, sériová analýza génovej expresie - SAGE). Expresia kódujúcich sekvencií celého genómu človeka môže byť vyšetrená na čipe rozsahu kreditnej pomocou rýchlej, efektívnej a finančne čoraz viac dostupnej metodiky. Ide o globálnu analýzu, ktorá predstavuje skok oproti tradičnému prístupu separátneho výskumu génov a umožní objasniť, ako proteínové produkty vytvárajú interaktívne siete, regulujúce najkomplexnejšie procesy v živom organizme [9,73,176].
Vyššie spomenuté technológie sľubujú detailnú identifikáciu molekulových dráh, zakomponovaných v patogenéze kardiovaskulárnych chorôb, upresnenie cieľov existujúcich liečiv a objavy cieľov pre nové liekové preparáty. Predpokladá sa napríklad, že angiotenzín II aktivuje niekoľko signálnych dráh, ktoré urýchľujú aterotrombózu a finálne štádiá ICHS. Uplatnením genomiky je možné tieto dráhy detailne popísať s identifikáciou nových cieľových génov, ktoré sú zodpovedné za kardiotoxicitu angiotenzínu [19]. Nedávno ukončené štúdie použili genomický prístup pri odlíšení rôznych foriem srdcového zlyhania, ako aj na detekciu molekulárnych zmien, vznikajúcich pri restenóze koronárnej artérie [60,95]. V inej štúdii boli použité mikročipy, ktoré porovnávali profil expresie prevažne „kardiovaskulárnych génov” v rôznych štádiách embryonálneho vývinu alebo v podmienkach hypoxie [153,154].
V prípade paralelného monitoringu množstva génov je možné detegovať expresné profily ako biomarkery určitého ochorenia resp. jeho štádia (niektoré klastre génov sú exprimované nadmerne a iné tlmene). Použité mikročipy môžu sledovať genóm v celku alebo sú prispôsobené na detekciu génov istej podskupiny (napr. génov pre apoptózu). Najnovšie boli tieto postupy použité pri detekcii chorobných profilov expresie v cirkulujúcich zápalových krvných elementoch, ktoré sú v kontakte so všetkými tkanivami a prenášajú v genóme informácie o ich patofyziologickom stave. Je známe, že zápalové bunky majú kľúčový význam v procese ruptúry AS plaku a reparácie tkanív v rámci akútnych ischemických syndrómov. Logicky tak reprezentujú telesný barometer homeostázy, ako aj odpovede organizmu na environmentálne noxy. Stratégia genomiky imunokompetentných buniek by teda mala priblížiť príslušné pochody aterotrombózy s odhalením ešte hodnotnejších markerov prognózy kardiovaskulárnych ochorení na podklade aterosklerózy [6,26,94,90,108,171].
Napriek veľkému záujmu o genóm a jeho funkčnú charakteristiku, vlastné uplatnenie genetickej informácie prebieha až na úrovni proteínu. Už dnes je dokázané, že z asi 30 000 génov sa v našich telách exprimuje viac do než 120 000 rôznych bielkovín a funkčnosť každej z nich môže byť dramaticky alterovaná posttranslačnými úpravami ako je fosforylácia, oxidácia, glykozylácia, ubikvitinylácia alebo nitrozylácia. Funkčnosť proteínov je ďalej dolaďovaná ich vzájomnými interakciami a lokalizáciou v bunke. Proteomika sa zaoberá vyššie spomínanými pochodmi a predstavuje ďalší zlom v molekulárnom výskume. Napriek relatívne mladej histórii tejto vedy už bola započatá analýza proteómu aj z pohľadu medicíny. Integrácia výkonných DNA mikročipov a proteomiky s doterajšími medicínskymi metódami (berúc do úvahy aj finančné hľadisko) a s vysoko senzitívnymi zobrazovacími metódami predpovedá ich veľký potenciál pre manažment pacienta v kardiovaskulárnej medicíne 21. storočia.
MUDr. Andrej Teren
II. interná klinika LF UK a FNsP
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
e-mail: ateren@hotmail.com
Doručeno do redakce: 23. 10. 2005
Přijato po recenzi: 17. 1. 2007
Sources
1. Abe M, Nakura J, Yamamoto M et al. Association of GNAS1 gene variant with hypertension depending on smoking status. Hypertension 2002; 40 : 261-265.
2. Alberts B et al. Molecular Biology of the Cell. Garland Publ. 1994
3. Allayee H, Aouizerat BE, Cantor RM et al. Families with familial combined hyperlipidemia and families enriched for coronary artery disease share genetic determinants for the atherogenic lipoprotein phenotype. Am J Hum Genet 1998; 63 : 577-585.
4. Alvarez R, Gonzalez P, Batalla A et al. Association between the NOS3 (-786 T/C) and the ACE (I/D) DNA genotypes and early coronary artery disease. Nitric Oxide 2001; 5 : 343-348.
5. Arimura T, Nakamura T, Hiroi S et al. Characterization of the human nebulette gene: a polymorphism in an actin-binding motif is associated with nonfamilial idiopathic dilated cardiomyopathy. Hum Genet 2000; 107 : 440-451.
6. Assmus B, Urbich C, Aicher A et al. HMG-CoA reductase inhibitors reduce senescence and increase proliferation of endothelial progenitor cells via regulation of cell cycle regulatory genes. Circ Res 2003; 92 : 1049-1055.
7. Babunova NB, Minushkina LO, Zateishchikov DA et al. Association of the T174M and M235T polymorphisms of the angiotensinogen gene with myocardial ischemia in the Russian population of the city of Moscow. Mol Biol (Mosk) 2003; 37 : 57-60.
8. Baker EH, Dong YB, Sagnella GA et al. Association of hypertension with T594M mutation in beta subunit of epithelial sodium channels in black people resident in London. Lancet 1998; 351 : 1388-1392.
9. Barrans JD, Allen PD, Stamatiou D et al. Global gene expression profiling of end-stage dilated cardiomyopathy using a human cardiovascular - based cDNA microarray. Am J Pathol 2002; 160 : 2035-2043.
10. Barrans JD, Ip J, Lam CW et al. Chromosomal distribution of the human cardiovascular transcriptome. Genomics 2003; 81 : 519-524.
11. Barrans JD, Stamatiou D, Liew C. Construction of a human cardiovascular cDNA microarray: portrait of the failing heart. Biochem Biophys Res Commun 2001; 280 : 964-969.
12. Batalla A, Alvarez R, Reguero JR et al. Synergistic effect between apolipoprotein E and angiotensinogen gene polymorphisms in the risk for early myocardial infarction. Clin Chem 2000; 46 : 1910-1915.
13. Bátorová A, Horváthová D, de Moerloose P et al. Fenotypová a genotypová analýza vrodenej hypofibrinogenémie a dysfibrinogenémie. Vnitř Lék 2005; 51 : 802-808.
14. Benes P, Muzik J, Benedik J et al. The C766T low-density lipoprotein receptor related protein polymorphism and coronary artery disease, plasma lipoproteins, and longevity in the Czech population. J Mol Med 2001; 79 : 116-120.
15. Bergman RN, Zaccaro DJ, Watanabe RM et al. Minimal model-based insulin sensitivity has greater heritability and a different genetic basis than homeostasis model assessment or fasting insulin. Diabetes 2003; 52 : 2168-2174.
16. Biggart S, Chin D, Fauchon M et al. Association of genetic polymorphismsin the ACE, ApoE, and TGF beta genes with early onset ischemic heart disease. Clin Cardiol 1998; 21 : 831-836.
17. Bolla MK, Miller GJ, Yellon DM et al. Analysis of the association of a heat shock protein70-1 gene promoter polymorphism with myocardial infarction and coronary risk traits. Dis Markers 1998; 13 : 227-235.
18. Brdlička R. Lidský genóm na rozhraní tisíciletí. Grada publishing 2000 : 2-91.
19. Campos AH, Zhao Y, Pollman MJ et al. DNA microarray profiling to identify angiotensin-responsive genes in vascular smooth muscle cells: potential mediators of vascular disease. Circ Res 2003; 92 : 111-118.
20. Crook ED. The genetics of human hypertension. Semin Nephrol 2002; 22 : 27-34.
21. Dai K, Gao W, Ruan C. The Sma I polymorphism in the von Willebrand factor gene associated with acute ischemic stroke. Thromb Res 2001; 104 : 389-395.
22. Dalloz F, Osinska H, Robbins J. Manipulating the contractile apparatus: genetically defined animal models of cardiovascular disease. J Mol Cell Cardiol 2001; 33 : 9-25.
23. Davignon J, Gregg RE, Sing CF. Apolipoprotein E polymorphism and atherosclerosis. Arteriosclerosis 1988; 8 : 1-21.
24. De Bacquer D, De Backer G, Langlois M et al. Haptoglobin polymorphism as a risk factor for coronary heart disease mortality. Atherosclerosis 2001; 157 : 161-166.
25. Dempsey AA, Dzau VJ, Liew CC. Cardiovascular genomics: estimating the total number of genes expressed in the human cardiovascular system. J Mol Cell Cardiol 2001; 33 : 1879-1886.
26. DePrimo SE, Wong LM, Khatry DB et al. Expression profiling of blood samples from an SU5416 Phase III metastatic colorectal cancer clinical trial: a novel strategy for biomarker identification. BMC Cancer 2003; 3 : 3.
27. Ferrarotti I, Zorzetto M, Beccaria M et al. Tumour necrosis factor family genes in a phenotype of COPD associated with emphysema. Eur Respir J 2003; 21 : 444-449.
28. Fortunato G, Rubba P, Panico S et al. A paraoxonase gene polymorphism, PON 1 (55), as an independent risk factor for increased carotid intima-media thickness in middle-aged women. Atherosclerosis 2003; 167 : 141-148.
29. Gabriel SB, Schaffner SF, Nguyen H et al. The structure of haplotype blocks in the human genome. Science 2002; 296 : 2225-2229.
30. Gardeman NA, Stricker J, Humme J et al. Angiotensinogen T174M and M235T gene polymorphisms are associated with the extent of coronary atherosclerosis. Atherosclerosis 1999; 145 : 309-314.
31. Garenc C, Perusse L, Chagnon YC et al. The alpha 2-adrenergic receptor gene and body fat content and distribution: the HERITAGE Family Study. Mol Med 2002; 8 : 88-94.
32. Gavorník P. Ateroskleróza a iné choroby tepien. Univerzita Komenského Bratislava 1999.
33. Geraci MW, Gao B, Hoshikawa Y et al. Genomic approaches to research in pulmonary hypertension. Respir Res 2001; 2 : 210-215.
34. Gibbons M et al. Genetic Markers: Progress and Potential for Cardiovascular Diseases. Circulation 2004; 109: IV47-IV58.
35. Girerd X, Hanon O, Mourad JJ et al. Lack of association between renin-angiotensin system, gene polymorphisms, and wall thickness of the radial and carotid arteries. Hypertension 1998; 32 : 579-583.
36. Ghilardi G, Biondi ML, DeMonti M et al. Matrix metalloproteinase-1 and matrix metalloproteinase-3 gene promoter polymorphisms are associated with carotid artery stenosis. Stroke 2002; 33 : 2408-2412.
37. Goldstein JL, Brown MS. The LDL receptor defect in familial hypercholesterolemia. Implications for pathogenesis and therapy. Med Clin North Am 1982; 66 : 335-362.
38. Gonzalez P, Alvarez R, Batalla A et al. Genetic variation at the chemokine receptors CCR5/CCR2 in myocardial infarction. Genes Immun 2001; 2 : 191-195.
39. Goodarzi MO, Guo X, Taylor KD et al. Lipoprotein lipase is a gene for insulin resistance in Mexican-Americans. Diabetes 2004; 53 : 214-220.
40. Goodarzi MO, Guo X, Taylor KD et al. Determination and use of haplotypes: ethnic comparison and association of the lipoprotein lipase gene and coronary artery disease in Mexican-Americans. Genet Med 2003; 5 : 322-327.
41. Gretarsdottir S, Thorleifsson G, Reynisdottir ST et al. The gene encoding phosphodiesterase 4D confers risk of ischemic stroke. Nat Genet 2003; 35 : 131-138.
42. Gumulec J, Penka M, Richterová R et al. Glykoprotein IIb/IIIa destičkové membrány z hlediska jeho genetických změn. Vnitř Lék 2005; 51 : 845-853.
43. Gumulec J, Penka M, Richterová R et al. Glykoprotein Ia/IIa destičkové membrány z hlediska jeho genetických změn. Vnitř Lék 2005; 51 : 840-844.
44. Gumulec J, Penka M, Richterová R et al. Glykoproteiny destičkové membrány z hlediska jeho genetických změn. Vnitř Lék 2005; 51 : 833-839.
45. Haddy N, Sass C, Droesch S et al. IL-6, TNF-alpha and atherosclerosis risk indicators in a healthy family population: the STANISLAS cohort. Atherosclerosis 2003; 170 : 277-283.
46. Havndrup O, Bundgaard H, Andersen PS et al. A novel missense mutation, Leu390Val, in the cardiac beta-myosin heavy chain associated with pronounced septal hypertrophy in two families with hypertrophic cardiomyopathy. Scand Cardiovasc J 2000; 34 : 558-563.
47. Herd JA, Ballantyne CM, Stein EA et al. Apolipoprotein E genotypes and response of plasma lipids and progression-regression of coronary atherosclerosis to lipid-lowering drug therapy. J Am Coll Cardiol 2000; 36 : 1572-1578.
48. Herrington DM, Howard TD, Brosnihan KB et al. Common estrogen receptor polymorphism augments effects of hormone replacement therapy on E-selectin but not C-reactive protein. Circulation 2002; 105 : 1879-1882.
49. Herrington DM, Howard TD, Hawkins GA et al. Estrogen-receptor polymorphisms and effects of estrogen replacement on high-density lipoprotein cholesterol in women with coronary disease. N Engl J Med 2002; 346 : 967-974.
50. Hessner MJ, Dinauer DM, Kwiatkowski R et al. Age-dependent prevalence of vascular disease-associated polymorphisms among 2689 volunteer blood donors. Clin Chem 2001; 47 : 1879-1884.
51. Higashi K, Ishikawa T, Ito T et al. Association of a genetic variation in the beta 3 - adrenergic receptor gene with coronary heart disease among Japanese. Biochem Biophys Res Commun 1997; 232 : 728-730.
52. Hoffee PA. Medical Molecular Genetics. Fence Creek Publ 1998.
53. Holmer SR, Hengstenberg C, Mayer B et al. Lipoprotein lipase gene polymorphism, cholesterol subfractions and myocardial infarction in large samples of the general population. Cardiovasc Res 2000; 47 : 806-812.
54. Holweg CT, Baan CC, Niesters HG et al. TGF-beta1 gene polymorphisms in patients with end-stage heart failure. J Heart Lung Transplant 2001; 20 : 979-984.
55. Hopkins PN et al. Blunteed renal vascular response to angiotesin II is associated with the common variant of the angiotensinogene gene and obesity. Journal of Hypertension 1996; 14 : 199-207.
56. Hou L, Osei-Hyiaman D, Yu H et al. Association of a 27-bp repeat polymorphism in ecNOS gene with ischemic stroke in Chinese patients. Neurology 2001; 56 : 490-496.
57. Hudeček J, Dobrotová M, Hybenová J et al. Faktor V Leiden a slovenská populace. Vnitř Lék 2003; 49 : 845-850.
58. Hulín I et al. Patofyziológia. 5. ed. Bratislava: Slovak Acadamic Press 2002.
59. Hunter DJ. Gene-environment interactions in human diseases. Nature reviews genetics 2005; 6 : 287-298.
60. Hwang JJ, Allen PD, Tseng GC et al. Microarray gene expression profiles in dilated and hypertrophic cardiomyopathic end-stage heart failure. Physiol Genomics 2002; 10 : 31-44.
61. Hwang DM, Dempsey AA, Wang RX et al. A genome-based resource for molecular cardiovascular medicine: toward a compendium of cardiovascular genes. Circulation 1997; 96 : 4146-4203.
62. Chapman CM, Palmer LJ, McQuillan BM et al. Polymorphisms in the angiotensinogen gene are associated with carotid intimal-medial thickening in females from a community-based population. Atherosclerosis 2001; 159 : 209-217.
63. Chen Q, Reis SE, Kammerer CM et al. Association between the severity of angiographic coronary artery disease and paraoxonase gene polymorphisms in the National Heart, Lung, and Blood Institute-sponsored.
64. Cheng LS, Davis RC, Raffel LJ et al. Coincident linkage of fasting plasma insulin and blood pressure to chromosome 7q in hypertensive Hispanic families. Circulation 2001; 104 : 1255-1260.
65. Chiang FT, Chiu KC, Tseng YZ et al. Nucleotide(-258) G-to-A transition variant of the liver glucokinase gene is associated with essential hypertension. Am J Hypertens 1997; 10 : 1049-1052.
66. Cho Y, Somer BG, Amatya A. Natriuretic peptides and their therapeutic potential. Heart Dis 1999; 1 : 305-328.
67. Illingworth DR Lipid-lowering drugs. An overview of indications and optimum therapeutic use. Drugs 1987; 33 : 259-279.
68. Ireland H, Kunz G, Kyriakoulis K et al. Thrombomodulin gene mutations associated with myocardial infarction. Circulation 1997; 96 : 15-18.
69. Jáchymová M, Horký K, Jindra A et al. Esencialni hypertenze a Arg16Gly polymorfizmus genu pro Beta2-adrenergni receptor. Vnitř Lék 2005; 51 : 945-949.
70. Jia H, Hingorani AD, Sharma P et al. Association of the G(s)alpha gene with essential hypertension and response to beta-blockade. Hypertension 1999; 34 : 8-14.
71. Kanters JK, Larsen LA, Orholm M et al. Novel donor splice site mutation in the KVLQT1 gene is associated with long QT syndrome. J Cardiovasc Electrophysiol 1998; 9 : 620-624.
72. King RA, Rotter JI, Motulsky AG (eds.) The Genetic Basis of Common Diseases. 2nd ed. New York: Oxford University Press 2002.
73. Kohlmann A, Schoch C, Schnittger S et al. Molecular characterization of acute leukemias by use of microarray technology. Genes Chromosomes Cancer 2003; 37 : 396-405.
74. Kosachunhanun N, Hunt SC, Hopkins PN et al. Genetic determinants of nonmodulating hypertension. Hypertension 2003; 42 : 901-908.
75. Koschinsky ML, Boffa MB, Nesheim ME et al. Association of a single nucleotide polymorphism in CPB2 encoding the thrombin-activatable fibrinolysis inhibitor (TAF1) with blood pressure. Clin Genet 2001; 60 : 345-349.
76. Kubaszek A, Pihlajamaki J, Karhapaa P et al. The K121Q polymorphism of the PC-1 gene is associated with insulin resistance but not with dyslipidemia. Diabetes Care 2003; 26 : 464-467.
77. Kuivenhoven JA, Jukema JW, Zwinderman AH et al. The role of a common variant of the cholesteryl ester transfer protein gene in the progression of coronary atherosclerosis. The Regression Growth Evaluation Statin Study Group. N Engl J Med 1998; 338 : 86-93.
78. Kuroki S, Ikeda U, Maeda Y et al. Lack of association between the insertion/deletion polymorphism of the angiotensin-converting enzyme gene and vasospastic angina. Clin Cardiol 1997; 20 : 873-876.
79. Lacquemant C, Lepretre F, Pineda Torra I et al. Mutation screening of the PPARalpha gene in type 2 diabetes associated with coronary heart disease. Diabetes Metab 2000; 26 : 393-401.
80. Lewin B. Genes VII. Oxford Univ Press 2000.
81. Lifton RP, Gharavi AG, Geller DS. Molecular mechanisms of human hypertension. Cell 2001; 104 : 545-556.
82. Liew CC. Heart failure: a genomics approach. In: Van Eyk JE, Dunn MJ (eds.) Proteomic and Genomic Analysis of Cardiovascular Disease. Weinheim: Wiley-VCH Verlag GmbH & Co 2003 : 4-60.
83. Lin RC, Wang XL, Morris BJ. Association of coronary artery disease with glucocorticoid receptor N363S variant. Hypertension 2003; 41 : 404-407.
84. Lithfield WR et al. Increased urinary free cortisol: a potential intermediate fenotype for essential hypertension. Am J Hum Genet 1998; 31 : 569-574.
85. Lombardi R, Betocchi S. Aetiology and pathogenesis of hypertrophic cardiomyopathy. Acta Paediatr Suppl 2002; 91 : 10-14.
86. Lovati E, Richard A, Frey BM et al. Genetic polymorphisms of the renin-angiotensin - aldosterone system in end-stage renal disease. Kidney Int 2001; 60 : 46-54.
87. Lu K, Lee MH, Hazard S et al. Two genes that map to the STSL locus cause sitosterolemia: genomic structure and spectrum of mutations involving sterolin-1 and sterolin-2, encoded by ABCG5 and ABCG8, respectively. Am J Hum Genet 2001; 69 : 278-290.
88. Luft FC. Twins in cardiovascular genetic research. Hypertension 2001; 37(2 Part 2): 350-356.
89. Lusis G et al. Genetic Basis of Atherosclerosis. Circulation 2004; 110 : 1868-1873.
90. Ma J, Liew CC. Gene profiling identifies secreted protein transcripts from peripheral blood cells in coronary artery disease. J Mol Cell Cardiol 2003; 35 : 993-998.
91. Mackness B, Hunt R, Durrington PN et al. Increased immunolocalization of paraoxonase, clusterin, and apolipoprotein A-I in the human artery wall with the progression of atherosclerosis. Arterioscler Thromb Vasc Biol 1997; 17 : 1233-1238.
92. Marian AJ, Safavi F, Ferlic L et al. Interactions between angiotensin-I converting enzyme insertion/deletion polymorphism and response of plasma lipids and coronary atherosclerosis to treatment with fluvastatin: the Lipoprotein and Coronary Atherosclerosis Study. J Am Coll Cardiol 2000; 35 : 89-95.
93. Margaglione M, Cappucci G, Colaizzo D et al. C-reactive protein in offspring is associated with the occurrence of myocardial infarction in first-degree relatives. Arterioscler Thromb Vasc Biol 2000; 20 : 198-203.
94. Mayani H, Alvarado-Moreno JA, Flores-Guzman P. Biology of human hematopoietic stem and progenitor cells present in circulation. Arch Med Res 2003; 34 : 476-488.
95. Mazurek T, Zhang L, Zalewski A et al. Human epicardial adipose tissue is a source of inflammatory mediators. Circulation 2003; 108 : 2460-2466.
96. Mialet Perez J, Rathz DA, Petrashevskaya NN et al. Beta 1-adrenergic receptor polymorphisms confer differential function and predisposition to heart failure. Nat Med 2003; 9 : 1300-1305.
97. Morange PE, Juhan-Vague I, Scarabin PY et al. Association between TAFI antigen and Ala147Thr polymorphism of the TAFI gene and the angina pectoris incidence. The PRIME Study (Prospective Epidemiological Study of MI). Thromb Haemost 2003; 89 : 554-560.
98. Mori Y, Kim-Motoyama H, Ito Y et al. The Gln27Glu beta2-adrenergic receptor variant is associated with obesity due to subcutaneous fat accumulation in Japanese men. Biochem Biophys Res Commun 1999; 258 : 138-140.
99. Morrison AC, Bray MS, Folsom AR et al. ADD1 460W allele associated with cardiovascular disease in hypertensive individuals. Hypertension 2002; 39 : 1053-1057.
100. Murray A, Donger C, Fenske C et al. Splicing mutations in KCNQ1: a mutation hot spot at codon 344 that produces in frame transcripts. Circulation 1999; 100 : 1077-1084.
101. Nassar BA, Bevin LD, Johnstone DE et al. Relationship of the Glu298Asp polymorphism of the endothelial nitric oxide synthase gene and early-onset coronary artery disease. Am Heart J 2001; 142 : 586-589.
102. Niimura H, Patton KK, McKenna WJ et al. Sarcomere protein gene mutations in hypertrophic cardiomyopathy of the elderly. Circulation 2002; 105 : 446-451.
103. Nikitin AG, Gorashko NM, Minushkina LO et al. Association of the G7831A polymorphism of the ACE gene with myocardial ischemia in the Moscow population. Mol Biol (Mosk) 2003; 37 : 54-56.
104. Nishiuma S, Kario K, Yakushijin K et al. Genetic variation in the promoter region of the beta-fibrinogen gene is associated with ischemic stroke in a Japanese population. Blood Coagul Fibrinolysis 1998; 9 : 373-379.
105. Ogawa S, Emi M, Shiraki M et al. Association of estrogen receptor beta (ESR2) gene polymorphism with blood pressure. J Hum Genet 2000; 45 : 327-330.
106. Ohtoshi K, Yamasaki Y, Gorogawa S et al. Association of (-)786T-C mutation of endothelial nitric oxide synthase gene with insulin resistance. Diabetologia 2002; 45 : 1594-1601.
107. Okada H, Murakami S. Cytokine expression in periodontal health and disease. Crit Rev Oral Biol Med 1998; 9 : 248-266.
108. Ortlepp JR, Hoffmann R, Ohme F et al. The vitamin D receptor genotype predisposes to the development of calcific aortic valve stenosis. Heart 2001; 85 : 635-638.
109. Ozaki K, Ohnishi Y, Iida A et al. Functional SNPs in the lymphotoxin-alpha gene that are associated with susceptibility to myocardial infarction. Nat Genet 2002; 32 : 650-654.
110. Packard CJ, O’Reilly DS, Caslake MJ et al. Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease West of Scotland Coronary Prevention Study Group. N Engl J Med 2000; 343 : 1148-1155.
111. Patel R, Lim DS, Reddy D et al. Variants of trophic factors and expression of cardiac hypertrophy in patients with hypertrophic cardiomyopathy. J Mol Cell Cardiol 2000; 32 : 2369-2377.
112. Pedro-Botet J, Schaefer EJ, Bakker-Arkema RG et al. Apolipoprotein E genotype affects plasma lipid response to atorvastatin in a gender specific manner. Atherosclerosis 2001; 158 : 183-193.
113. Pereira AC, Cuoco MA, Mota GF et al. Hemochromatosis gene variants in patients with cardiomyopathy. Am J Cardiol 2001; 88 : 388-391.
114. Pritchard PH, Frohlich J. Apoprotein A-I and lecithin: cholesterol acyltransferase in a patient with Tangier disease. Adv Exp Med Biol 1986; 201 : 105-110.
115. Province MA, Kardia SL, Ranade K et al. A meta-analysis of genome-wide linkage scans for hypertension: the National Heart, Lung and Blood Institute Family Blood Pressure Program. Am J Hypertens 2003; 16 : 144-147.
116. Rasmussen ML, Folsom AR, Catellier DJ et al. A prospective study of coronary heart disease and the hemochromatosis gene (HFE) C282Y mutation: the Atherosclerosis Risk in Communities (ARIC) study. Atherosclerosis 2001; 154 : 739-746.
117. Reis MM, Higuchi Mde L, Benvenuti LA et al. An in situ quantitative immunohistochemical study of cytokines and IL-2Rin chronic human chagasic myocarditis: correlation with the presence of myocardial Trypanosoma cruzi antigens. Clin Immunol Immunopathol 1997; 83 : 165-172.
118. Risley P, Jerrard-Dunne P, Sitzer M et al. Promoter polymorphism in the endotoxin receptor (CD14) is associated with increased carotid atherosclerosis only in smokers: the Carotid Atherosclerosis Progression Study (CAPS). Stroke 2003; 34 : 600-604.
119. Rodriguez-Perez JC, Rodriguez-Esparragon F, Hernandez-Perera O et al. Association of angiotensinogen M235T and A(-6)G gene polymorphisms with coronary heart disease with independence of essential hypertension: the PROCAGENE study. Prospective Cardiac Gene. J Am Coll Cardiol 2001; 37 : 1536-1542.
120. Rook MB, Bezzina Alshinawi C, Groenewegen WA et al. Human SCN5A gene mutations alter cardiac sodium channel kinetics and are associated with the Brugada syndrome. Cardiovasc Res 1999; 44 : 507-517.
121. Rossi GP, Taddei S, Virdis A et al. The T-786C and Glu298Asp polymorphisms of the endothelial nitric oxide gene affect the forearm blood flow responses of Caucasian hypertensive patients. J Am Coll Cardiol 2003; 41 : 938-945.
122. Rosypal S. Úvod do molekulární biologie. Zväzky 1/2 a dodatok. Brno 1996, 1997.
123. Rotter JI, Bu X, Cantor RM et al. Multilocus genetic determinants of LDL particle size in coronary artery disease families. Am J Hum Genet 1996; 58 : 585-594.
124. Rutherford S, Johnson MP, Curtain RP et al. Chromosome 17 and the inducible nitric oxide synthase gene in human essential hypertension. Hum Genet 2001; 109 : 408-415.
125. Ryan AS, Nicklas BJ, Berman DM et al. The insertion/deletion polymorphism of the ACE gene is related to insulin sensitivity in overweight women. Diabetes Care 2001; 24 : 1646-1652.
126. Sasaoka T, Kimura A, Hohta SA et al. Polymorphisms in the plateletendothelial cell adhesion molecule-1 (PECAM-1) gene, Asn563Ser and Gly670Arg, associated with myocardial infarction in the Japanese. Ann N Y Acad Sci 2001; 947 : 259-269.
127. Sebastiani P, Lazarus R, Weiss ST et al. Minimal haplotype tagging. Proc Natl Acad Sci U.S.A. 2003; 100 : 9900-9905.
128. Seidman CE, Seidman JG Hypertrophic cardiomyopathy. In: Scriver CR, Beaudet AL, Sly WS et al (eds.). The Metabolic and Molecular Bases of Inherited Disease. 8th ed. New York: McGraw-Hill 2001 : 5433-5450.
129. Sharma P, Hingorani A, Jia H et al. Positive association of tyrosine hydroxylase microsatellite marker to essential hypertension. Hypertension 1998; 32 : 676-682.
130. Sharma P, Hingorani A, Jia H et al. Quantitative association between a newly identified molecular variant in the endothelin-2 gene and human essential hypertension. J Hypertens 1999; 17 : 1281-1287.
131. Schillinger M, Exner M, Mlekusch W et al. Heme oxygenase-1 gene promoter polymorphism is associated with abdominal aortic aneurysm. Thromb Res 2002; 106 : 131-136.
132. Schunkert H. Molecular genetics of congestive heart failure. Scand Cardiovasc J Suppl 1998; 47 : 37-43.
133. Schwartz GL, Turner ST, Chapman AB et al. Interacting effects of gender and genotype on blood pressure response to hydrochlorothiazide. Kidney Int 2002; 62 : 1718-1723.
134. Small KM, Wagoner LE, Levin AM et al. Synergistic polymorphisms of beta1 - and alpha2C-adrenergic receptors and the risk of congestive heart failure. N Engl J Med 2002; 347 : 1135-1142.
135. Spence JD, Malinow MR, Barnett PA et al. Plasma homocyst(e)ine concentration, but not MTHFR genotype, is associated with variation in carotid plaque area. Stroke 1999; 30 : 969-973.
136. Sršeň Š, Sršňová K. Základy klinickej genetiky a jej molekulárna podstata. Martin: Osveta 2000.
137. Stankovic A, Zivkovic M, Glisic S et al. Angiotensin II type 1 receptor gene polymorphism and essential hypertension in Serbian population. Clin Chim Acta 2003; 327 : 181-185.
138. Stavljenic-Rukavina A. Genetics of cardiovascular disease. J Internat Fed Clin Chem Available at http://www.ifcc.org/ejifcc/vol14no2/ 140206200305n.htm.
139. Stavroulakis GA, Makris TK, Krespi PG et al. Predicting response to chronic antihypertensive treatment with fosinopril: the role of angiotensin-converting enzyme gene polymorphism. Cardiovasc Drugs Ther 2000; 14 : 427-432.
140. Stepanov VA, Puzyrev VP, Karpov RS et al. Genetic markers in coronary artery disease in a Russian population. Hum Biol 1998; 70 : 47-57.
141. Stevens PA, Brown MJ. Genetic variability of the ET-1 and the ETA receptor genes in essential hypertension. J Cardiovasc Pharmacol 1995; 26: S9-S12.
142. Strauss E, Waliszewski K, Gabriel M et al. Increased risk of the abdominal aortic aneurysm in carriers of the MTHFR 677T allele. J Appl Genet 2003; 44 : 85-93.
143. Šašinka M, Šagát T et al. Pediatria. Košice: Satus 1998 : 154-192.
144. Šmarda J. Člověk v proudu dědičnosti, geny v lidském zdraví a nemoci. Praha: Grada Publishing 1999.
145. Špinarová L, Toman J, Hude P et al. Poruchy lamínů pri postižení srdce a kosterního svalstva. Vnitř Lék 2003; 49 : 637-641.
146. Tan KT, Dempsey A, Liew CC. Cardiac genes and gene databases for cardiovascular disease genetics. Curr Hypertens Rep 1999; 1 : 51-58.
147. Tan MS, Chang SY, Chang DM et al. Association of resistin gene 3-untranslated region 62G-A polymorphism with type 2 diabetes and hypertension in a Chinese population. J Clin Endocrinol Metab 2003; 88 : 1258-1263.
148. Tabor HK, Risch NJ, Myers RM. Candidate-gene approaches for studying complex genetic traits: practical considerations. Nat Rev Genet 2002; 3 : 391-397.
149. Tang DC, Prauner R, Liu W et al. Polymorphisms within the angiotensinogen gene (GT - repeat) and the risk of stroke in pediatric patients with sickle cell disease: a case-control study. Am J Hematol 2001; 68 : 164-169.
150. Terashima M, Akita H, Kanazawa K et al. Stromelysin promoter 5A/6A polymorphism is associated with acute myocardial infarction. Circulation 1999; 99 : 2717-2719.
151. Tiago AD, Badenhorst D, Skudicky D et al. An aldosterone synthase gene variant is associated with improvement in left ventricular ejection fraction in dilated cardiomyopathy. Cardiovasc Res 2002; 54 : 584-589.
152. Topol EJ, McCarthy J, Gabriel S et al. Single nucleotide polymorphisms in multiple novel thrombospondin genes may be associated with familial premature myocardial infarction. Circulation 2001; 104 : 2641-2644.
153. Ton C, Stamatiou D, Dzau VJ et al. Construction of a zebrafish cDNA microarray: gene expression profiling of the zebrafish during development. Biochem Biophys Res Commun 2002; 296 : 1134-1142.
154. Ton C, Stamatiou D, Liew CC. Gene expression profile of zebrafish exposed to hypoxia during development. Physiol Genomics 2003; 13 : 97-106.
155. Towbin JA, Bowles NE. The failing heart. Nature 2002; 415 : 227-233.
156. Tregouet DA, Barbaux S, Escolano S et al. Specific haplotypes of the P-selectin gene are associated with myocardial infarction. Hum Mol Genet 2002; 11 : 2015-2023.
157. Tybjaerg-Hansen A, Nordestgaard BG, Gerdes LU et al. Variation of apolipoprotein B gene is associated with myocardial infarction and lipoprotein levels in Danes. Atherosclerosis 1991; 89 : 69-81.
158. Tybjaerg-Hansen A. Rare and common mutations in hyperlipidemia and atherosclerosis, with special reference to familial defective apolipoprotein B-100. Scand J Clin Lab Invest Suppl 1995; 220 : 57-76.
159. Unkelbach K, Gardemann A, Kostrzewa M et al. A new promoter polymorphism in the gene of lipopolysaccharide receptor CD14 is associated with expired myocardial infarction in patients with low atherosclerotic risk profile. Arterioscler Thromb Vasc Biol 1999; 19 : 932-938.
160. Uzui H, Harpf A, Liu M et al. Increased expression of membrane type 3-matrix metalloproteinase in human atherosclerotic plaque: role of activated macrophages and inflammatory cytokines. Circulation 2002; 106 : 3024-3030.
161. Vaisanen SB, Rauramaa R, Luong LA et al. Stromelysin-1 and interleukin-6 gene promoter polymorphisms are determinants of asymptomatic carotid artery atherosclerosis. Arterioscler Thromb Vasc Biol 2000; 20 : 2657-2662.
162. Vickers MA, Green FR, Terry C et al. Genotype at a promoter polymorphism of the interleukin-6 gene is associated with baseline levels of plasma C-reactive protein. Cardiovasc Res 2002; 53 : 1029-1034.
163. Voet D, Voet JG. Straightening out the straighteners. Trends Biochem Sci 1993 18(12): 464.
164. Vohnout B, Raslova K, Gasparovic J et al. Lipid levels and their genetic regulation in patients with familial hypercholesterolemia and familial defective apolipoprotein B-100: the MEDPED Slovakia Project. Atheroscler Suppl 2003; 4 : 3-5.
165. Voločik G, Rosochová I, Kovács L. Vplyv polymorfizmu ACE génu na funkciu ľavej komory u chorých s diabetom 2. typu. Vnitř Lék 2003; 49 : 181-184.
166. von Beckerath N, Schusterschitz Y, Koch W et al. G protein beta 3 subunit 825T allele carriage and risk of coronary artery disease. Atherosclerosis 2003; 167 : 135-139.
167. Wang Q, Shen J, Splawski I et al. SCN5A mutations associated with an inherited cardiac arrhythmia, long QT syndrome. Cell 1995; 80 : 805-811.
168. Wang XL, Greco M, Sim AS et al. Effect of CYP1A1 MspI polymorphism on cigarette smoking related coronary artery disease and diabetes. Atherosclerosis 2002; 162 : 391-397.
169. Wascher TC, Paulweber B, Malaimare L et al. Associations of a human G protein beta3 subunit dimorphism with insulin resistance and carotid atherosclerosis. Stroke 2003; 34 : 605-609.
170. Wauters M, Mertens I, Chagnon M et al. Polymorphisms in the leptin receptor gene, body composition and fat distribution in overweight and obese women. Int J Obes Relat Metab Disord 2001; 25 : 714-720.
171. Whitney AR, Diehn M, Popper SJ et al. Individuality and variation in gene expression patterns in human blood. Proc Natl Acad Sci U.S.A. 2003; 100 : 1896-1901.
172. Xiang AH, Azen SP, Raffel LJ et al. Evidence for joint genetic control of insulin sensitivity and systolic blood pressure in Hispanic families with a hypertensive proband. Circulation 2001; 103 : 78-83.
173. Yamada Y, Ichihara S, Izawa H et al. Association of a G994-T (Val279-Phe) polymorphism of the plasma platelet-activating factor acetylhydrolase gene with myocardial damage in Japanese patients with nonfamilial hypertrophic cardiomyopathy. J Hum Genet 2001; 46 : 436-441.
174. Yamada Y, Izawa H, Ichihara S et al. Prediction of the risk of myocardial infarction from polymorphisms in candidate genes. N Engl J Med 2002; 347 : 1916-1923.
175. Yoon S, Kuivaniemi H, Gatalica Z et al. MMP13 promoter polymorphism is associated with atherosclerosis in the abdominal aorta of young black males. Matrix Biol 2002; 21 : 487-498.
176. Zhang W, Needham DL, Coffin M et al. Microarray analyses of the metabolic responses of Saccharomyces cerevisiae to organic solvent dimethyl sulfoxide. J Ind Microbiol Biotechnol 2003; 30 : 57-69.
177. Zhu H, Sagnella GA, Dong Y et al. Contrasting associations between aldosterone synthase gene polymorphisms and essential hypertension in blacks and in whites. J Hypertens 2003; 21 : 87-95.
178. Zito F, Di Castelnuovo A, Amore C et al. Bcl I polymorphism in the fibrinogen beta-chain gene is associated with the risk of familial myocardial infarction by increasing plasma fibrinogen levels. A case-control study in a sample of GISSI-2 patients. Arterioscler Thromb Vasc Biol 1997; 17 : 3489-3494
179. http://www.ncbi.nlm.nih.gov/SNP/
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 6-
All articles in this issue
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




