-
Medical journals
- Career
Pseudomembranózní kolitida
: D. Bergmann 1; J. Koten 1; Z. Beneš 1; P. Kohout 1; A. Chlumská 2
: II. interní klinika Fakultní Thomayerovy nemocnice s poliklinikou, Praha, přednosta MUDr. Zdeněk Beneš, CSc. 1; Bioptická laboratoř s. r. o., Plzeň, vedoucí lékařka prof. MUDr. Alena Skálová, CSc. 2
: Vnitř Lék 2007; 53(10): 1100-1107
: Reviews
Již zhruba 30 let je známo, že patologické pomnožení toxigenních kmenů Clostridium difficile může vést k rozvoji zánětu sliznice tračníku, který se v plně rozvinuté formě manifestuje jako pseudomembranózní kolitida. Pro onemocnění se v literatuře ujal obecný a zcela výstižný termín CDAD (Clostridium difficile - Associated Disease, případně Diarrhoea). Ve většině případů se onemocnění rozvine při podávání širokospektrých antibiotik, ovšem nelze opominout roli dalších důležitých patogenetických faktorů. Význam tohoto onemocnění v posledních letech stoupá, neboť v řadě rozvinutých zemí se objevují závažné epidemie vyvolané vysoce virulentním kmenem charakterizovaným jako ribotyp 027, toxinotyp III, pulsovar NAP1. CDAD je onemocnění potenciálně smrtící, ale při včasné diagnóze dobře léčitelné. Rozhodující roli v diagnostice má průkaz toxinů ve stolici, stále více se však uplatňuje i endoskopie. V léčbě má zásadní význam podání cílených antibiotik, za nejspolehlivější je tradičně pokládán metronidazol nebo perorálně podávaný vankomycin, slibnou efektivitu vykazují i některé další preparáty. Až ve 25 % případů však dochází k rekurenci choroby. Vzhledem k reálné hrozbě rozšíření vysoce virulentního kmene i na území ČR se připravuje zřízení národní referenční laboratoře pro typizaci Clostridium difficile.
Klíčová slova:
pseudomembranózní kolitida - Clostridium difficile - Associated Disease, případně Diarrhoea - CDAD - Clostridium difficileÚvod
Grampozitivní tyčka Clostridium difficile byla poprvé popsána ve 30. letech 20. století, nicméně až koncem 70. let 20. století byla odhalena příčinná souvislost mezi patologickým pomnožením jejích toxigenních kmenů a obávanou a v té době převážně smrtelnou pseudomembranózní kolitidou. Ukázalo se však, že toto onemocnění se nemusí vždy rozvinout do obrazu pablánového zánětu tračníku (a přesto může být závažné). V současnosti se proto v mezinárodní literatuře označuje obecnějším a z hlediska patogenetického zcela výstižným pojmem Clostridium difficile - associated disease, případně Clostridium difficile - associated diarrhea (CDAD) a morfologický pojem pseudomembranózní kolitida pak představuje jen jeho nejtěžší formu.
Nejčastěji se tato choroba objevuje v souvislosti s podáváním antibiotik, zvláště širokospektrých, při kterém dochází u části léčených pacientů ke změnám ve střevní mikroflóře. I po vysazení antibiotika často trvá úplná restituce mikroflóry až 3 měsíce. Na takovém terénu pak může, zvláště u jedinců s preexistujícím onemocněním GIT nebo imunitním deficitem jakékoliv etiologie, dojít k pomnožení toxigenních kmenů Clostridium difficile schopných prostřednictvím svých exotoxinů A a B vyvolat těžký zánět až nekrózu střevní sliznice. Někdy používaný termín postantibiotická kolitida je ne zcela přesným ekvivalentem pro CDAD. Sice vyzdvihuje rozhodující roli antibiotik, nicméně nepostihuje další patogenetické faktory a s nimi související (a zřejmě stále četnější) případy onemocnění vzniklé i bez přispění antibiotik.
Jde sice o onemocnění potenciálně smrtící, ale pokud je včas diagnostikováno, lze jej úspěšně vyléčit cíleně nasazenými baktericidními antibiotiky. V mnoha rozvinutých zemích jsou ovšem v posledních letech pozorovány epidemie onemocnění CDAD s těžkým průběhem, horší odezvou na léčbu a vysokou mortalitou. Příčinou je šíření hypervirulentního kmene Clostridium difficile charakterizovaného mnohonásobně vyšší produkcí toxinů a větší odolností vůči antibiotikům.
Tímto sdělením nelze obsáhnout celou problematiku CDAD, chtěli bychom však zde stručně shrnout známé skutečnosti a upozornit jak na nové poznatky, tak na některé známé rozpory.
Mikrobiologické a epidemiologické poznatky
Clostridium difficile je grampozitivní sporulující anaerobní tyčka, sama o sobě neinvazivní. Toxigenní kmeny produkují ve vegetativní fázi termolabilní toxiny A a B, kódované geny tcdA a tcdB. V jejich těsné blízkosti je lokalizován gen tcdR, regulující pozitivně produkci toxinů. Ta je naopak brzděna produktem dalšího genu označovaného tcdC. Zmíněné geny (ještě s genem tcdE) spolu na chromozomu sousedí a tvoří funkční komplex zvaný PaLoc (pathogenicity locus). Toxin A (enterotoxin) vyvolává apoptózu enterocytů a aktivuje zánětlivou kaskádu, toxin B (cytotoxin) vyvolává apoptózu řady buněk, zvláště fibroblastů a rovněž aktivuje zánětlivý proces. Virulence kmenů produkujících oba toxiny je větší než u těch, které produkují jen jeden. Kromě toxinů A a B produkují některé kmeny tzv. binární toxin kódovaný dvěma geny (cdtA a cdtB). Jeho úloha v patogenezi onemocnění ale zřejmě není zásadní. V současné době je kompletně přečten genom této bakterie. K typizaci kmenů pro epidemiologické sledování se používají molekulárně biologické metody - toxinotypizace (analýza polymorfizmu PaLoc), PCR ribotypizace (rRNA) a pulzní gelová elektroforéza (PFGE), umožňující rozlišit charakteristické „pulsovary“ genomu po rozštěpení restrikčními endonukleázami [1,2,3].
V novorozeneckém věku je Clostridium difficile včetně toxigenních kmenů běžnou součástí střevní flóry až u 50 % (15-70 %) zdravých jedinců. Výskyt klinicky manifestní CDAD v kojeneckém a raném dětském věku je přitom ojedinělý. Důvod není zcela jasný, vysvětluje se to odlišnou střevní flórou a (na modelech in vitro) nepřítomností receptoru pro toxin A na enterocytech [1,4].
V dospělosti je nosičství pozorováno u zhruba 3 % zdravých jedinců [1,4]. Tito asymptomatičtí nosiči toxigenních kmenů jsou méně náchylní k manifestnímu onemocnění CDAD. Odolnost vůči nemoci souvisí se schopností vyvinout protilátky proti toxinům. Převážně tedy onemocní ti jedinci, kteří se s mikrobem setkávají poprvé, například (či spíše většinou) ve zdravotnických zařízeních [5,6,33].
Spory Clostridium difficile jsou značně rezistentní vůči běžným dezinfekčním prostředkům a jsou schopny perzistovat i více než 5 měsíců, což umožňuje jejich udržování a šíření ve zdravotnických zařízeních akutní i dlouhodobé péče, kde potom výskyt onemocnění CDAD někdy nabývá i rázu vleklých epidemií. Clostridium difficile bylo v epidemiologických studiích prokazováno ve stolici až u 50 % hospitalizovaných pacientů, a to bez ohledu na léčbu antibiotiky, přičemž riziko akvizice stoupá s délkou hospitalizace. Přenos se děje rukama (např. zdravotnického personálu), kontaminovanými předměty a orofekálně [1].
CDAD je sice tradičně považováno za nozokomiální onemocnění, dle některých nových studií však stále více případů CDAD (7-30 %) vzniká v komunitě. Část těchto nemocných však měla v anamnéze nedávný pobyt v nemocnici, v ostatních případech mohou být rezervoárem blízcí jedinci dimitovaní z nemocnice, kojenci, domácí zvířata. Clostridium difficile je také nalézáno v půdě a ve vodním prostředí [1,4,7-9].
Od roku 2002 jsou publikovány z Kanady, USA, Velké Británie, severní Francie, Nizozemí, Belgie, Německa a některých vyspělých asijských zemí zprávy o epidemiích CDAD s velmi těžkým průběhem onemocnění, horší odpovědí na léčbu, vyšší četností rekurence a až 4krát vyšší mortalitou [3,10-16,18]. Zřejmou příčinou tohoto jevu je šíření hypervirulentního kmene charakterizovaného pomocí molekulárně biologických typizačních metod jako ribotyp 027, toxinotyp III a pulsovar NAP1, schopného produkovat až 20krát větší množství toxinu než ostatní patogenní kmeny. Předpokládanou příčinou této vlastnosti je deleční mutace genu pro regulaci produkce toxinů (tcdC) [17]. Další významnou charakteristikou tohoto kmene, která zřejmě usnadnila šíření ve vyspělých zemích, je rezistence vůči fluorochinolonům, které byly považovány dosud v tomto ohledu za relativně bezpečné a proto široce používány [21-23]. Pro ilustraci uvádíme data získaná v roce 2004 během epidemie v kanadské provincii Quebec, kdy incidence nemocnění byla 22,5 na 1 000 hospitalizovaných a hrubá 30denní mortalita byla 24,8 %, zatímco ve studii z roku 1997 byla incidence 6 na 1 000 hospitalizovaných a hrubá mortalita pouhých 1,5 %! [10]. V roce 2006 byl ribotyp 027 toxinotyp III izolován též ve střední Evropě, konkrétně v jednom případě v Rakousku (jednalo se ale o britskou turistku, další šíření kmene zatím nebylo potvrzeno) [19].
S ohledem na tyto skutečnosti byla při Evropské společnosti pro klinickou mikrobiologii a infekční lékařství (ESCMID) založena pracovní skupina nazvaná ESGCD [ESCMID Study Group on Clostridium difficile). I v České republice [kde CDAD nepodléhá epidemiologickému hlášení) se připravuje zřízení referenční laboratoře pro typizaci Clostridium difficile, která by s ESGCD měla spolupracovat. Je tedy již zcela bez pochyby, že se onemocnění CDAD stává nezanedbatelným problémem zdravotnictví v ekonomicky vyspělých zemích a další výzvou pro racionální používání antibiotik a ke zvýšení pozornosti věnované hygienickým návykům ve zdravotnictví.
Klíčové faktory v patogenezi CDAD
Ačkoli to neplatí absolutně, má podávání antibiotik v patogenezi onemocnění CDAD zásadní význam [4]. Schopnost indukovat pomnožení toxigenního kmene Clostridium difficile má prakticky jakékoli antibiotikum, a to bez ohledu na způsob podání a dávku. Snad jedinou výjimku tvoří aminoglykosidy, které se per os nepodávají a po parenterální aplikaci se nevylučují do střeva. Za nejvíce riziková antibiotika jsou považovány cefalosporiny II. a vyšší generace, linkosamidy, širokospektré peniciliny, zvláště potencované a v posledních letech, jak bylo již zmíněno, fluorochinolony vyšší generace [4,22,23]. V jednotlivých kazuistikách je zmiňován rozvoj pseudomembranózní kolitidy i v souvislosti s podáváním metronidazolu nebo vankomycinu - tedy antibiotik, která se právě v léčbě těchto onemocnění užívají. Ostatně Clostridium difficile je citlivé in vitro i k β-laktamovým antibiotikům a k linkosamidům, které jsou právě častými spouštěcími činiteli. Tato skutečnost není dosud jednoznačně vysvětlována, ale pravděpodobně se jedná o souhrn několika faktorů, které zvýhodňují při podání antibiotik Clostridium difficile oproti ostatním mikrobům: (a) mikrob osídluje hlubší prostředí ve střevní sliznici, kam je penetrace antibiotik omezena, (b) má pomalejší metabolizmus, (c) přirozená střevní flóra zabraňuje pomnožování Clostridium difficile. Její likvidací dojde k přemnožení, kdy stav citlivosti in vitro nelze srovnávat se stavem in vivo. To platí i pro dlouhodobé podávání metronidazolu a vankomycinu ve spojení s dalšími rizikovými faktory [4].
Mimo nesporný význam antibiotik v patogenezi CDAD existuje celá řada patologických stavů a okolností, které ke vzniku onemocnění přinejmenším predisponují. Obraz klinický i patologicko-anatomický odpovídající CDAD byl totiž popisován již před objevením antimikrobiálních léků (první popis je z roku 1893). V prvé řadě se jedná o onemocnění, která zhoršují pasáž trávícím traktem nebo zhoršují trofiku střevní sliznice - ischemické postižení tlustého střeva, stenózy střeva jakéhokoli původu, zvláště maligního, operační výkony na tlustém střevě (resp. jakákoli větší operace, zvláště u polymorbidních nemocných). Jako predisponující faktor jsou zmiňovány též idiopatické střevní záněty. U dětí se pseudomembranózní kolitida může vyskytnout jako komplikace Hirschsprungovy nemoci. Dále má význam stav imunitního systému - větší riziko vzniku CDAD představuje vysoký věk, malnutrice, léčba imunosupresivy a cytostatiky, maligní onemocnění, chronická renální insuficience a diabetes mellitus. Rovněž nemocní s AIDS mají vyšší riziko vzniku CDAD [1].
Na vzniku CDAD se může podílet i podávání řady léků. Kromě zmíněných cytostatik a imunosupresiv se jedná především o inhibitory motility trávícího traktu. Podezřelou skupinou léčiv jsou též inhibitory protonové pumpy, avšak výsledky epidemiologických studií jsou zde zcela protichůdné [24-26]. Význam nesteroidních antiflogistik zatím rovněž není jasně prokázán.
Význam hospitalizace, resp. jejího trvání pro vznik onemocnění byl již zmíněn výše.
Klinické projevy a laboratorní nálezy
Tíže klinických projevů a odstup manifestace choroby od začátku podávání antibiotik, resp. od jiného vyvolávajícího impulzu (např. operace) je značně variabilní. Nemoc se projeví nejčastěji 3-9 dnů po nasazení antibiotik, ale někdy až za řadu týdnů!
V typickém případě pozorujeme různě četné kašovité až vodnaté průjmy, většinou však nikoli profuzní jako u alimentárních nákaz. Ve stolici může být příměs hlenu, někdy má hnilobný zápach. Dosti častým příznakem jsou bolesti břicha, zvracení či teploty, ale rozhodně nejde o pravidlo. Pokud není choroba včas léčena, může se popsaný obraz komplikovat rozvojem subileózního až ileózního stavu, enterogenní sepse (toxického megakolon), případně perforací střeva. Nebezpečnost CDAD spočívá právě v tom, že rozvoj zmíněných komplikací může být nečekaně prudký a ze zdánlivě stabilizovaného stavu (zvláště u starších pacientů).
Variantou tohoto průběhu je plíživá CDAD s občasnou kašovitou stolicí, lehkou elevací markerů zánětu a pozvolným rozvojem těžké malnutrice (protein-losing enteropatie).
Ojediněle se nemoc může manifestovat jako pravostranná kolitida s obrazem bolestivosti v pravé jámě kyčelní, subileózního až ileózního stavu na tenkých kličkách, často bez průjmů. Klinický nález pak může falešně imponovat jako akutní apendicitida nebo ataka Crohnovy nemoc terminálního ilea, či jiná náhlá břišní příhoda.
Při laboratorním vyšetření bývá zpravidla nápadná leukocytóza (i přes 30 000/µl) s neutrofilií a případným posunem k nezralým elementům, různě výrazný vzestup CRP, často paradoxně nízký oproti markantní leukocytóze. Toto je pro onemocnění CDAD dosti typický rys a vždy by u nemocného s takovýmto nálezem měla být tato nemoc brána v úvahu, byť by byla jeho gastrointestinální symptomatika málo výrazná. Dále můžeme pozorovat pokles albuminu, minerálovou dysbalanci, eventuálně hyperazotemii prerenální povahy při dehydrataci (ev. renální při septickém šoku).
Vyšetřovací metody
CDAD je onemocnění s nevyzpytatelným průběhem. I v nejtěžších případech jej však lze úspěšně vyléčit specifickým antibiotickým režimem. Proto je především u pacientů s dramatickým klinickým a laboratorním nálezem potřeba rychle odlišit stavy, vyžadující principiálně jiný léčebný přístup (např. chirurgický zákrok). Zásadní význam v diagnostice CDAD mají následující metody.
1. Endoskopický obraz těžké pseudomembranózní kolitidy. Hyperemická edematózní sliznice pokrytá žlutobílými pablánami. 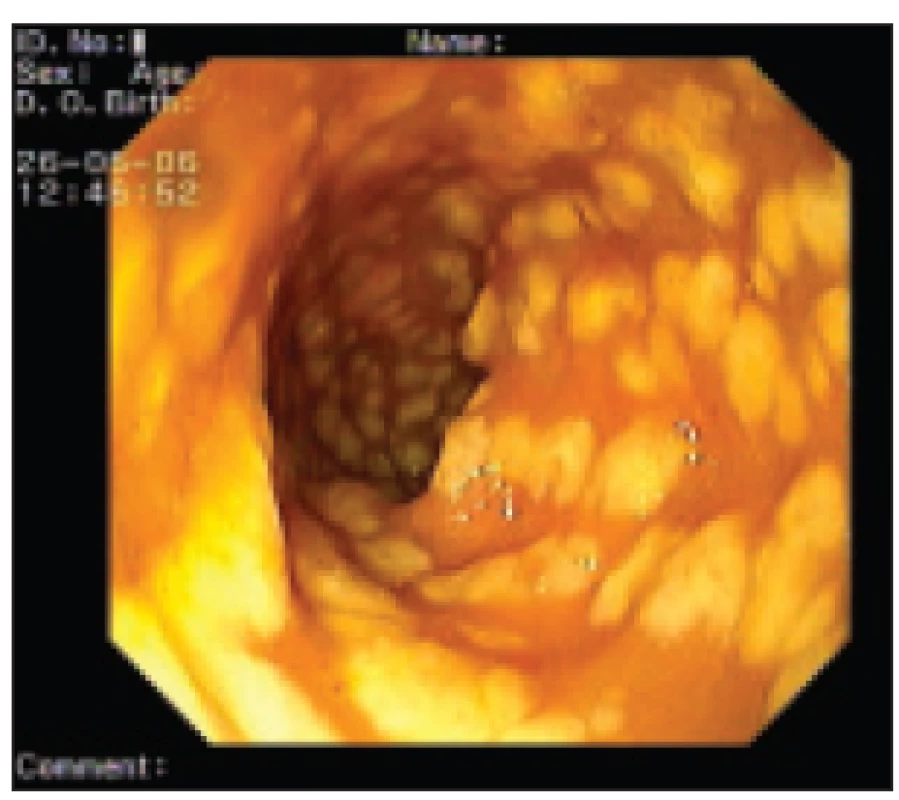
Podstatou pablán je fibrin, mucin, leukocyty a tkáňový detritus. V takovémto případě lze diagnózu stanovit snadno, nejsou-li však přítomny pablány, je endoskopický obraz nepříznačný (včetně biopsie). Ověřit diagnózu CDAD lze pak mikrobiologickými metodami (foto MUDr. Zdeněk Antoš, II. interní klinika FTNsP Praha) 2. Biopsie tračníku u plně vyvinuté pseudomembranózní kolitidy. 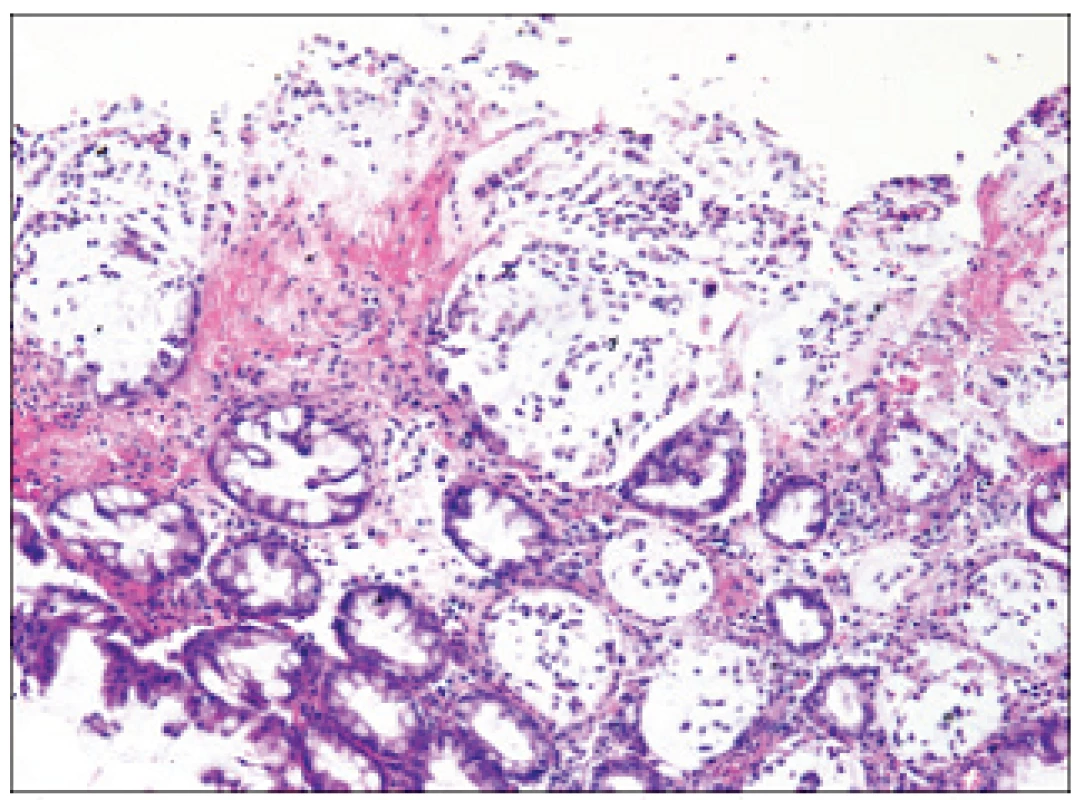
Detail pablány, kterou tvoří fibrinózní a polynukleární exsudát zakotvený v povrchové části sliznice. Epitel krypt je pod pablánou většinou nekrotický (foto doc. MUDr. Alena Chlumská, CSc., Bioptická laboratoř s.r.o., Plzeň) - A) při průkazu přítomnosti toxinu A nebo B (nebo toxigenního kmene CD) ze vzorku stolice je problémem skloubit dostatečnou senzitivitu a rychlost vyšetření. Negativita prvního vzorku pak může značně oddálit stanovení diagnózy. Za zlatý standard se považuje cytotoxický test prokazující nekrotizující efekt toxinu B na buněčné kultuře. Je sice nejcitlivější, avšak vyšetření je příliš nákladné a trvá minimálně 48 hod. Nejčastěji se v praxi používají testy na principu enzymové imunoeseje, přičemž senzitivita markantně stoupá, pokud se stanovuje současně toxin A i B - tehdy se pohybuje kolem 90 % (88-93 %), specificita vyšetření je prakticky 100 % [27]. Podmínku rychlosti také dobře splňuje test prokazující toxin na principu imunochromatografie, vykazuje však nízkou senzitivitu [18). Slibné výsledky též přináší PCR (detekující např. gen tcdB), senzitivita je srovnatelná s EIA [28]. Mikrobiologické kultivační vyšetření v případě CDAD v klinické praxi postrádá smysl, neboť anaerobní kultivace za účelem průkazu Clostridium difficile trvá 4-5 dní, a navíc sama o sobě nevypovídá nic o schopnosti kmene tvořit toxiny. Smysl má však v epidemiologickém výzkumu, pokud je ovšem svázaná s typizací nebo alespoň s průkazem toxigenicity.
- B) endoskopie - při respektování kontraindikací jde o metodu s téměř 100% specificitou a senzitivitou pro CDAD ve fázi pseudomembranózní kolitidy. U těchto nemocných lze nalézt hyperemickou edematózní sliznici pokrytou pablánami, tedy žlutobílými povlaky o velikosti kolem 5 mm, které mohou splývat ve větší celky. Pablány se většinou vyskytují na vrcholu řas. Po jejich stržení je na spodině patrný vřed. Někdy může sliznice mezi pablánami vypadat makroskopicky zcela normálně. Obraz pablánové kolitidy je prakticky nezaměnitelný a diagnóza je pak stanovena doslova „na první pohled“. Není-li však CDAD ve fázi pablán, jsou často přítomny jen zcela necharakteristické, okrskovité zánětlivé změny ve smyslu edému a zarudnutí, což senzitivitu i specificitu vyšetření výrazně sníží.
3. CT nález u těžké pseudomembranózní kolitidy. 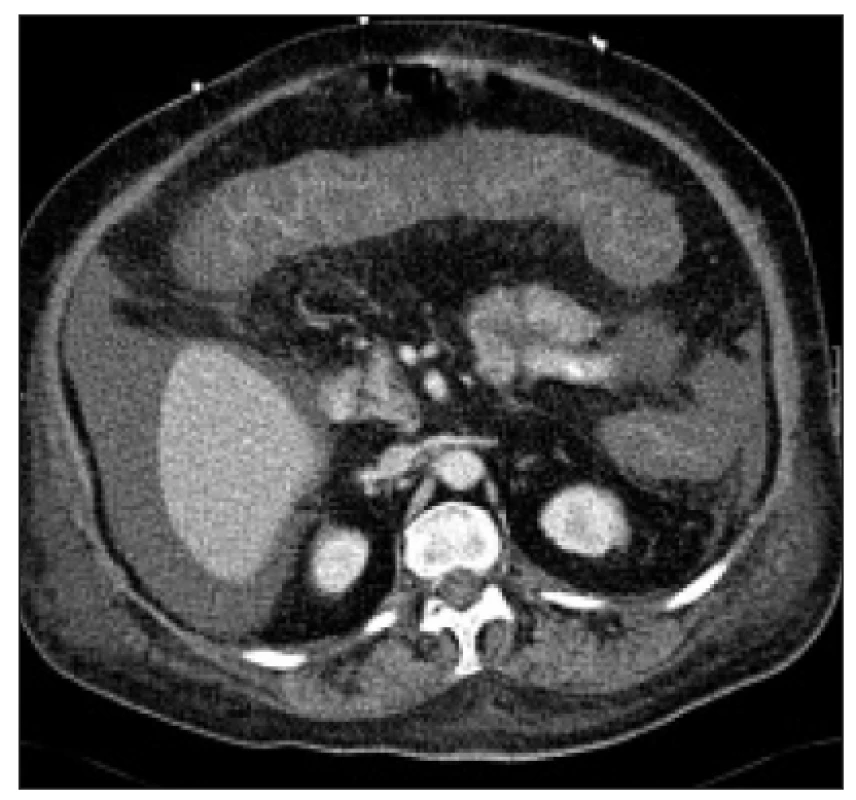
Je patrno edematózní ztluštění sliznice tračníku s prakticky vymizelým lumen a sníženým sycením. Přítomna je i volná tekutina v břišní dutině. Abdominální ultrasonografie by přinesla v tomto případě stejný obraz a navíc by měla v diagnostickém algoritmu přednost vzhledem k snadnější dostupnosti a „logistické“ nenáročnosti (foto MUDr. Jan Pavlíček, radiodiagnostické oddělení FTNsP Praha). Je samozřejmě žádoucí během vyšetření odebrat bioptické vzorky a případně i vzorky pro mikrobiologické vyšetření. Vzhledem k tomu, že při typickém průběhu bývají nejvýraznější patologické změny v sigmatu, je možno v určitých situacích omezit rozsah endoskopického vyšetření na sigmoideoskopii po rychlé přípravě klyzmatem. Jedná se o nemocné, u nichž představuje příprava na úplnou koloskopii nepřípustnou časovou prodlevu, nebo jejich stav představuje relativní kontraindikaci úplného vyšetření (většinou se jedná o kombinaci obojího). Vzhledem k charakteristickému obrazu nemoci pak v takovém případě lze stanovit diagnózu prohlédnutím i velmi krátkého úseku střeva. Pokud to ale stav nemocného umožňuje, je vhodné pokusit se o úplnou koloskopii, neboť CDAD může „nasedat“ na jinou patologii tračníku (např. maligní nebo benigní stenózu), nebo úplné vyšetření doplnit po vyléčení akutního onemocnění.
V literatuře je endoskopie (ačkoli jde o metodu dnes již široce dostupnou) tradičně považována za diagnostickou metodu až 2. řady, dokonce relativně kontraindikovanou. Nicméně nedávná britská studie prokázala jednoznačně vyšší senzitivitu pouhé sigmoideoskopie i ve srovnání s nejpreciznějšími mikrobiologickými metodami stanovení přítomnosti toxigenních klostridií [7].
Histologické vyšetření navazuje na endoskopii. Při plně vyvinuté pablánové kolitidě nacházíme v místě pablán nekrózy epitelu se zánětlivou infiltrací sliznice polymorfonukleáry. Pablány jsou tvořeny fibrinem, mucinem, leukocyty a buněčným detritem. Sliznice v okolí pablán může mít přiměřený nález, někdy je edematózní v důsledku toxického poškození cév. Floridní fáze zánětu je někdy histologicky obtížně odlišitelná od ulcerózní kolitidy. V optimálním případě se zánět poměrně rychle hojí odloučením pablán a reepitelizací sliznice. V případě prosté kolitidy nalézáme v histologickém obraze vcelku necharakteristickou zánětlivou infiltraci sliznice různého stupně.
V diagnostickém algoritmu mají s ohledem na stav nemocného místo i další zobrazovací metody. Při abdominální ultrasonografii je v těžších případech viditelné ztluštění stěny tračníku a bývá přítomna volná tekutina v břišní dutině. Nejedná se sice o patognomický nález, ovšem vzhledem k neinvazivnosti a značné flexibilitě této metody jde o užitečné vstupní vyšetření, které pomůže posoudit závažnost stavu. Stejný nález najdeme i při CT vyšetření, které ovšem v rámci diagnostiky CDAD indikujeme jen ojediněle.
Na nativním snímku břicha lze v pokročilých fázích onemocnění pozorovat úplné vymizení plynu v tračníku (resp. vymizení lumen) a s tím související ileózní stav na kličkách tenkého střeva.
Diferenciálně diagnostické poznámky
Již bylo zmíněno, že onemocnění CDAD může mít značně variabilní průběh i dobu „inkubace“, a že ostatně ani jednoznačná etiologická souvislost s léčbou antibiotiky nemusí být vždy prokazatelná. Je třeba se především vyhnout záměně s těmi akutními stavy, jež vyžadují zásah chirurga. Jedná se o fulminantně probíhající idiopatické střevní záněty (především ulcerózní kolitidu), případně divertikulitidu, a dále o komplikace operací na tlustém střevě, kde za náhlým zhoršením klinického stavu pacienta i laboratorního nálezu může stát jak insuficience anastomózy, tak CDAD, zvláště její již zmíněná „pravostranná“ forma. Zde je rozhodnutí o konzervativní léčbě či naopak chirurgickém zásahu zvláště složité. Jednotné řešení není a je nutno se rozhodovat od případu k případu. Lze doporučit zahájení ATB léčby CDAD tehdy, když anamnéza, klinický stav, laboratoř a sonografie vykazují výše zmíněné charakteristiky tohoto onemocnění. Pokud ne, je nutno provést urychleně další vyšetření směřující k jiným diagnózám vyžadujícím chirurgické řešení.
Pokud jde o postantibiotické průjmy jiné než klostridiové etiologie, ty mívají lehký průběh s rychlou úpravou po vysazení antibiotika a chybí lokální i celkové zánětlivé projevy (etiologicky se uplatňují některé enterobakterie, Pseudomonas aeruginosa, Staphylococcus sp., Candida albicans).
Léčebné principy
CDAD je ve své podstatě infekční onemocnění, je tedy žádoucí izolace nemocného pokud možno na infekčním oddělení s možností intenzivní péče. Není-li toto možné, je nutno zajistit alespoň bariérový systém ošetřování. Pokud jsou nemocnému podávána nějaká antibiotika, je třeba zvážit jejich vysazení nebo alespoň zvolit přípravek s užším spektrem. Rovněž je žádoucí vysazení medikace tlumící střevní peristaltiku, jakož i preparátů železa, které obecně podporují růst bakterií ve střevním lumen. Rozsah dalších léčebných opatření závisí na stavu nemocného. Těžší případy (tj. nemocní dehydratovaní, oběhově nestabilní, s projevy sepse, s poruchou pasáže GIT) vyžadují monitorované lůžko, zajištění centrální žíly, i.v. rehydrataci, parenterální výživu s výhodou kombinovanou s výživou enterální v dávkách podporujících trofiku střevní sliznice. Nemocným s lehkým průběhem je možno ponechat perorální příjem stravy.
Zásadní místo v léčbě CDAD má cílená antibiotická léčba po dobu 7-10 dní. V praxi se dlouhodobě osvědčily dva baktericidní přípravky, co se týče efektivity a rizika následné rekurence onemocnění považované dlouhodobě za zhruba rovnocenné [29,30]. Jedná se o metronidazol a vankomycin.
1. Metronidazol se po vstřebání do GIT opět secernuje biliární exkrecí. Účinné je tedy jak podání perorální (resp. enterální), tak parenterální. Výhodou přípravku je nízká cena, nevýhodou menší selektivita, a navíc během epidemií se zastoupením hypervirulentních kmenů bylo opakovaně pozorováno selhání léčby a vyšší četnost rekurencí [10,31]. Nadále je však lékem volby u lehkých a středně těžkých CDAD. Doporučovaná dávka při p.o. podání je 4 × 250 mg nebo 3 × 500 mg. Je třeba upozornit, že i léčba metronidazolem podporuje selekci vankomycin-rezistentního Enterococcus faecalis! Kontraindikací léčby metronidazolem je gravidita. Možnou alternativou metronidazolu je vzhledem výhodným farmakokinetickým vlastnostem ornidazol [18].
2. Vankomycin je glykopeptidové antibiotikum, které se při perorálním podání z trávícího traktu prakticky nevstřebává, což je pro léčbu CDAD velmi výhodná vlastnost. Zatím nebyla vůči vankomycinu popsána rezistence a lze jej doporučit k léčbě u závažnějších případů. Obyčejně postačuje dávka 4 × 125 mg podaná buď per os, nebo enterální sondou (u zvracejících pacientů), výjimečně u pacientů v ileózním stavu klyzmatem. Zmíněné dávkování zajistí dostatečnou koncentraci antibiotika ve střevním lumen, a tak nemá zřejmě smysl dávky navyšovat [32]. Nevýhodou vankomycinu je značně vyšší cena a riziko selekce vankomycin-rezistentního Enterococcus faecalis. Intravenózní podání vankomycinu nemá v této indikaci žádný smysl.
U pacientů s rozvojem subileózního až ileózního stavu je možno ve snaze odvrátit hrozící chirurgický zákrok zkombinovat enterálně podaný vankomycin s parenterálním metronidazolem.
S ohledem na šířící se pandemii hypervirulentních klostridií se hledají alternativy k tradičním přípravkům, neboť existují reálné obavy z jejich možného selhání. Slibně se jeví syntetická polymerní látka tolevamer, schopná vázat toxiny Clostridium difficile, jejíž efektivita u lehkých a středně těžkých CDAD je srovnatelná s vankomycinem [34]. Efektivita antibiotika nitazoxanidu je srovnatelná s metronidazolem [35]. Alternativou je rovněž další glykopeptidové antibiotikum teikoplanin (podávané v p.o. formě) [36]. Dobré výsledky u hypervirulentních kmenů vykazuje linezolid. V podobných případech zkoušená kyselina fusidová má menší efekt než metronidazol a rychle se rozvíjí rezistence [37]. Totéž platí pro rifaximin [18].
Diskutuje se i role iontměničů schopných vázat klostridiové toxiny (cholestipol, cholestyramin) v léčbě akutní CDAD. Proti jejich užívání hovoří schopnost navázat též podávaná antibiotika (jednoznačně vankomycin, teoreticky též metronidazol). Nelze ale vyloučit potenciální přínos těchto látek v prevenci rekurence CDAD, pokud se podají po ukončení antibiotické léčby [38].
Význam probiotik v algoritmu léčby CDAD není dosud zcela jasný. Prováděné výzkumy byly značně heterogenní jak metodikou, tak zvoleným preparátem. Signifikantně byl ve 2 studiích prokázán přínos podávání kvasinky Saccharomyces boulardii v prevenci rekurencí po akutním onemocnění. Přípravek obsahující tuto kvasinku je po několika letech opět v České republice k dispozici. Přínos ostatních probiotik, resp. probiotických směsí byl zatím potvrzen jen v prevenci postantibiotických průjmů v širším slova smyslu. Podání probiotických preparátů u rizikových pacientů užívajících širokospektrá antibiotika je tedy rozumným opatřením i v prevenci CDAD [39,40].
Chirurgické řešení je ultimum refugium v refrakterním ileózním stavu a/nebo při rozvoji septického šoku. Rozsah resekčního výkonu pak závisí na rozsahu postižení střeva. U toxického megakolon je ke zvážení Turnbullova dekompresní operace s možností aplikace antibiotik cestou cékostomie, což může odvrátit provedení kolektomie.
Rekurentní onemocnění
Po zvládnutí akutního stavu a vymizení symptomatiky trvá ještě několik týdnů dysmikrobie a citlivost k reinfekci (tedy k recidivě), resp. novému pomnožení toxigenních kmenů (tedy k relapsu). CDAD recidivuje respektive relabuje zhruba ve 25 % případů, přičemž rizikové faktory jsou opět identické - pokračující hospitalizace, vysoký věk, polymorbidita a znovunasazení širokospektrých antibiotik. V léčbě ataky rekurentní CDAD se doporučuje opět vankomycin nebo metronidazol ve stejných dávkách, efektivita obou preparátů je srovnatelná [30]. Vhodné je použít jiný přípravek než u předchozího onemocnění. Ostatní léčebná opatření jsou v závislosti na klinickém stavu též stejná. Do kombinace je případně možno přidat rifaximin (Normix), při jeho delším podávání dochází k rychlému rozvoji rezistence. Nově byla ale publikována dobrá zkušenost s podáním rifaximinu na 14 dní ihned po ukončení léčby vankomycinem [41].
Závěr
I když přesná statistika výskytu CDAD pomocí epidemiologických hlášení (jako je tomu u většiny jiných infekčních chorob) u nás zatím není zavedena, je na základě literárních údajů, přibývajících kazuistik i kongresových jednání v Evropě a USA jednoznačně patrný nárůst výskytu a virulence tohoto onemocnění. Protože konzervativní léčba je možná a úspěšná, pokud je nasazena včas, je nutné na tuto možnost pomýšlet vždy při výše popsaných obtížích, které se dostaví při nebo po antibiotické léčbě. Protiepidemická opatření v případě výskytu v nemocnici by neměla být zanedbávána. Nárůst četnosti této nemoci by měl být rovněž další pobídkou pro všechny lékaře k racionální indikaci antibiotické léčby - nejen tedy z důvodů narůstající rezistence mikrobů.
MUDr. David Bergmann
II. interní klinika Fakultní Thomayerovy nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4-Krč
e-mail: david.bergmann@ftn.cz
Doručeno do redakce: 8. 2. 2007
Přijato po recenzi: 16. 5. 2007
Sources
1. Thielman NM, Wilson KH. Antibiotic-Associated Colitis. In: Principles and Practice of Infectious Diseases. Elsevier 2005.
2. Rupnik M, Dupuy B, Fairweather NF et al. Revised nomenclature of Clostridium difficile toxins and associated genes. J Med Microbiol 2005; 54 : 113-117.
3. Geric B, Carman RJ, Rupnik M et al. Binary Toxin-Producing, Large Clostridial Toxin-Negative Clostridium difficile Strains Are Enterotoxic but Do Not Cause Disease in Hamsters. The Journal of Infectious Diseases 2006; 193 : 1143-1150.
4. Barbut F, Petit JC. Epidemiology of Clostridium difficile-associated infections. Clin Microbiol Infect 2001; 7 : 405-410.
5. Phillips C. Serum antibody responses to Clostridium difficile toxin A: predictive and protective? Gut 2001; 49 : 167-168.
6. Kyne L, Warny M, Qamar A et al. Asymptomatic Carriage of Clostridium difficile and Serum Levels of IgG Antibody against Toxin A. N Engl J Med 2000; 342 : 390-397.
7. Johal SS, Hammond J, Solomon K at al. Clostridium difficile associated diarrhoea in hospitalised patients: onset in the community and hospital and role of flexible sigmoidoscopy. Gut 2004; 53 : 673-677.
8. Gaynes RP, Rimland D, McDonald C. Community-Acquired Clostridium difficile-Associated Diarrhea (CDAD) among Outpatients in a VA Medical Center Atlanta. Abstract book, 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, September 27-30, 2006. Washington (USA): American Society for Microbiology 2006: L-1550.
9. Arroyo LG, Kruth SA, Willey BM et al. PCR ribotyping of Clostridium difficile isolates originating from human and animal sources. J Med Microbiol 2005; 54 : 163-166.
10. Pépin J, Valiquette L, Alary ME et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. Can Med Assoc J 2004; 171 : 466-472.
11. Pépin J, Valiquette L, Cossette B Mortality attributable to nosocomial Clostridium difficile-associated disease during an epidemic caused by a hypervirulent strain in Quebec. Can Med Assoc J 2005; 173 : 1037-1042.
12. McDonald LC, Killgore GE, Thompson A et al. An Epidemic, Toxin Gene-Variant Strain of Clostridium difficile. N Engl J Med 2005; 353 : 2433-2441.
13. Coignard B, Barbut F, Blanckaert K et al. Emergence of Clostridium difficile toxinotype III, PCR-ribotype 027-associated disease, France, 2006. Eurosurveillance 2006; 11 : 060914. (http://www.eurosurveillance.org).
14. Kuijper EJ, Van den Berg RJ, Debast S et al. Clostridium difficile Ribotype 027, Toxinotype III, the Netherlands. Emerg Inf Dis 2006; 12 : 827-830.
15. Weil HP, Van den Berg RJ, Kuijper EJ et al. Emerging Outbreaks of Clostridium difficile Associated Diarrhea (CDAD) in Three Hospitals in Northwestern Germany. Abstract book, 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, September 27-30, 2006. Washington (USA): American Society for Microbiology 2006: K-1012.
16. Kuijper EJ, Delmée M, Barbut F. Rapidly Spreading of Clostridium difficile PCR Ribotype 027, Toxinotype III in Europe. Abstract book, 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, September 27-30, 2006. Washington (USA): American Society for Microbiology 2006: K-348.
17. Kuijper EJ, Coignard B, Tüll P et al. Emergence of Clostridium difficile-associated disease in North America and Europe. Clin Microb Infect 2006; 12 : 2-18.
18. Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin Mikrobiol Inf Lék 2006; 12 : 247-251.
19. Indra A, Huhulescu S, Hasenberger P et al. First isolation of Clostridium difficile PCR ribotype 027 in Austria. Eurosurveillance 2006; 11 : 060914. (http://www.eurosurveillance.org).
20. Warny M, Pepin J, Fang A et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366 : 1079-1084.
21. Loo VG, Poirier L, Miller MA et al. A Predominantly Clonal Multi-Institutional Outbreak of Clostridium difficile-Associated Diarrhea with High Morbidity and Mortality. N Engl J Med 2005; 353 : 2442-2449.
22. Pépin J, Saheb N, Coulombe MA et al. Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficile-associated diarrhea: a cohort study during an epidemic in Quebec. Clin Infect Dis 2005; 41 : 1254-1260.
23. Vaessen N, Debast S, Choudry A et al. Fluoroquinolone-Use is a Major Risk Factor for Clostridium difficile NAP1/027-Associated Disease (CDAD). Abstract book, 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, September 27-30, 2006. Washington (USA): American Society for Microbiology 2006: K-350.
24. Dial S, Delaney C, Schneider V et al. Proton pump inhibitor use and risk of community-acquired Clostridium difficile-associated disease defined by prescription for oral vancomycin therapy. Can Med Assoc J 2006; 175 : 745-748.
25. Lowe DO, Mamdani MM, Kopp A et al. Proton Pump Inhibitors and Hospitalization for Clostridium difficile-Associated Disease: A Population-Based Study. Clin Infect Dis 2006; 43 : 1272-1276.
26. Husová L, Lata J, Husa P et al. Pseudomembranózní kolitida jako komplikace eradikační terapie infekce Helicobacterem pylori. Čes a Slov Gastroent 1999; 53 : 90-93.
27. Rüssmann H, Panthel K, Bader RC et al. Evaluation of three rapid assays for detection of Clostridium difficile toxin A and toxin B in stool specimens. Eur J Clin Microbiol Infect Dis 2007; 26 : 115-119.
28. Van den Berg RJ, Vaessen N, Endtz HP et al. Evaluation of real-time PCR and conventional diagnostic methods for the detection of Clostridium difficile-associated diarrhoea in a prospective multicentre study. J Med Microbiol 2007; 56 : 36-42.
29. McFarland LV. Alternative treatments for Clostridium difficile disease: what really works? J Med Microbiol 2005; 54 : 101-111.
30. Pépin J, Routhier S, Gagnon S et al. Management and Outcomes of a First Recurrence of Clostridium difficile-Associated Disease in Quebec, Canada. Clin Infect Dis 2006; 42 : 758-764.
31. Musher DM, Aslam S, Logan N. Relatively Poor Outcome after Treatment of Clostridium difficile Colitis with Metronidazole. Clin Infect Dis 2005; 40 : 1586-1590.
32. Beneš J, Vacek V. Postantibiotická pseudomembranozní kolitida: Mýty a skutečnost. Prakt Lék 1995; 75 : 504-509.
33. Zemanová E, Urban O, Chalupa J et al. Asociace infekce Clostridium difficile a pseudomembranózní kolitidy v nemocnici okresního typu. Vnitř Lék 2003; 49 : 645-649.
34. Louie TJ, Peppe J, Watt CK et al. Tolevamer, a Novel Nonantibiotic Polymer, Compared with Vancomycin in the Treatment of Mild to Moderately Severe Clostridium difficile-Associated Diarrhea. Clin Infect Dis 2006; 43 : 411-420.
35. Musher DM, Logan N, Hamill RJ et al. Nitazoxanide for the Treatment of Clostridium difficile Colitis. Clin Infect Dis 2006; 43 : 421-427.
36. De Lalla F, Nicolin R, Rinaldi E et al. Prospective study of oral teicoplanin versus oral vancomycin for therapy of pseudomembranous colitis and Clostridium difficile-associated diarrhea. Antimicrob Agents Chemother 1992; 36 : 2192-2196.
37. Norén T, Wullt M, Åkerlund T et al. Frequent Emergence of Resistance in Clostridium difficile during Treatment of C. difficile-Associated Diarrhea with Fusidic Acid. Antimicrob Agents Chemother 2006; 50 : 3028-3032.
38. Pantosti A, Luzzi I, Cardines R et al. Comparison of the in vitro activities of teicoplanin and vancomycin against Clostridium difficile and their interactions with cholestyramine. Antimicrob Agents Chemother 1985; 28 : 847-848.
39. Dendukuri N, Costa V, McGregor M et al. Probiotic therapy for the prevention and treatment of Clostridium difficile-associated diarrhea: a systematic review. Can Med Assoc J 2005; 173 : 167-170.
40. McFarland L Meta-Analysis of Probiotics for the Prevention of Antibiotic Associated Diarrhea and the Treatment of Clostridium difficile Disease. Am J Gastroenterol 2006; 101 : 812-822.
41. Johnson S, Schriever C, Galang M et al. Interruption of Recurrent Clostridium difficile-Associated Diarrhea Episodes by Serial Therapy with Vancomycin and Rifaximin. Clin Infect Dis 2007; 44 : 846-848.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 10-
All articles in this issue
- Changes in lipid metabolism in patients in the active phase of Crohn’s disease
- Cortisol levels are more closely associated with depressiveness and other psychopathologies than catecholamine levels
- Our experience in continuous administration of insulin using infusion dispenser at a metabolic intensive care unit (MICU)
- Endoscopic changes in the stomach and duodenal mucosa caused by minidose acetylsalicylic acid therapy and their prevention
- Achieving Bcl-2/IgH negativity in peripheral blood/bone marrow after therapy implies better prognosis for patients with follicular lymphoma
- The impact of statin therapy on bone density changes in postmenopausal women
- Analysis of the effect of circadian rhythm on the heart rate turbulence in patients without evidence of organic heart disease
- Pulmonary alveolar proteinosis
- Late coronary stent thrombosis and clopidogrel
- The MIAC (malnutrition, inflammation, atherosclerosis, calcification) syndrome
- Pseudomembranous colitis
- Incretin strategy in the treatment of type 2 diabetes mellitus – the DPP-IV inhibitor sitagliptin
- The benefit from ibandronate in the treatment of postmenopausal osteoporosis
- Chronic benign exsudative pericarditis – a case of familiar incidence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cortisol levels are more closely associated with depressiveness and other psychopathologies than catecholamine levels
- Pseudomembranous colitis
- Pulmonary alveolar proteinosis
- Our experience in continuous administration of insulin using infusion dispenser at a metabolic intensive care unit (MICU)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

