-
Medical journals
- Career
Redukce nevhodné a neúčelné farmakoterapie – deprescribing
Authors: E. Topinková
Authors‘ workplace: Geriatrická klinika 1. LF UK a VFN Praha
Published in: Geriatrie a Gerontologie 2020, 9, č. 1: 9-14
Category: Review Article
Overview
V posledních dvou dekádách dochází k významnému nárůstu počtu léčiv užívaných seniory. Polyfarmakoterapie přes nepochybný přínos v léčbě multimorbidních seniorů však představuje riziko spojené s lékovými interakcemi, nežádoucími polékovými reakcemi, rizikem preskripce potenciálně nevhodných léčiv, vyšším stupněm křehkosti a v některých studiích i zvýšenou mortalitou. Kritické posouzení preskribované a užívané medikace je nedílnou součástí každodenní klinické praxe geriatra. Novým trendem geriatrická farmakoterapie je „deprescribing“, chápaný jako systematické snižování nebo vysazení léků neindikovaných, ve stáří obecně či u konkrétního pacienta nevhodných, léků duplicitních a všech léků, které nekorespondují s cíli léčby a preferencemi pacienta. V článku se v české literatuře poprvé zaměřujeme na proces „deprescribingu“, vhodné nástroje pro jeho realizaci a na příkladu PPI uvádíme konkrétní postupy při jejich vysazování.
Klíčová slova:
revize lékového režimu – deprescribing – polyfarmakoterapie – Beersova kritéria 2019
Úvod
Senioři jsou nejrychleji rostoucím segmentem populace v Evropě a rozvinutých zemích. Podle farmakoepidemiologických studií spotřebují osoby starší 65 let více než jednu třetinu všech užívaných léků (1) a tato spotřeba má stoupající tendenci. Je to způsobeno rostoucí polyfarmakoterapií (polypragmazií) u stárnoucí populace, která je nejčastěji definována jako chronické užívání pěti a více různých léků. Důvody rostoucí preskripce jsou komplexní a podílí se na nich zavádění nových skupin léčiv pro dříve neléčitelná onemocnění, užívání většího počtu léků k léčbě jedné nemoci (např. diabetu, hypertenze, srdečního selhání), narůstající multimorbidita zejména ve věkové skupině velmi starých a dlouhověkých seniorů i zlepšená dostupnost zdravotní péče.
Polyfarmakoterapie ve stáří je častá. Zatímco v dospělé populaci užívá 5 a více léků méně než 20 % osob, v populaci 65letých a starších je to 30–70% a v rezidenčních zařízeních typu domovů pro seniory až 90 %. Navíc je polyfarmakoterapie zatížena spoustou preskripčních chyb (2). Tuto skutečnost potvrzují i výsledky šetření Ústavu lékového průvodce v domovech seniorů v ČR provedené klinickými farmaceuty, kdy u 18 % užívaných léků chyběla indikace pro jejich užívání, ve 14 % se jednalo o léky potenciálně nevhodné u seniorů (3), v dalších 14 % o nevhodnou dávku a v 10 % o nežádoucí účinky léků (4). Rezidenti užívali v průměru 8 léků.
Polyfarmakoterapie je spojena s celou řadou zdravotních problémů a komplikací, které odrážejí možné nežádoucí účinky léčiv, jejich vzájemných nevhodných interakcí a interakcí typu lék – nemoc (v podstatě jde o nedodržení relativních kontraindikací podání léků, nevhodných u konkomitující choroby) (3). U starších nemocných jsou tyto nežádoucí polékové reakce daleko častější, hovoříme o farmako-vulnerabilitě (5). Charakteristické pro farmakovulnerabilní osoby jsou vysoký věk nad 80–85 let, komplexní multimorbidita, demence, fyzická křehkost,porušená clearance farmak a celkové snížení orgánových fyziologických rezerv, které limitují délku přežití (limited life expectancy) (5, 6). Tyto faktory významně mění poměr riziko/přínos ve smyslu zvýšeného rizika nežádoucích účinků a nižšího přínosu farmakologické léčby (7). Odborná literatura upozorňuje na rizika polyfarmakoterapie jak farmakologická (častěji preskripce nevhodných léčiv, non-adherence, lékové interakce, nežádoucí účinky), tak zejména klinická (kognitivní pokles/delirium, pády a poranění, křehkost) i ekonomická (náklady na hospitalizace, ambulantní služby) (8, 9), pro přehled viz tabulka 1.
Table 1. Rizika polyfarmakoterapie a užívání medikace ve stáří rizikové (podle 7) 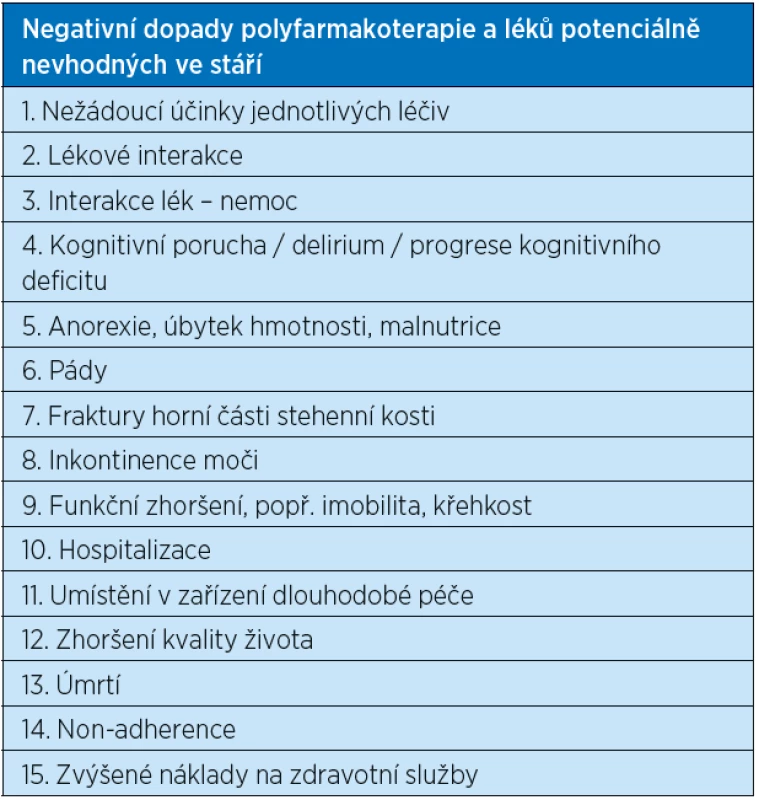
U pacientů se syndromem křehkosti s omezenou délkou přežití nemá farmakologická léčba oporu v klinických studiích, neboť tito pacienti nejsou do klinických studií zařazováni. Nemáme tedy vědecké důkazy, zda je u těchto pacientů léčba běžných chronických chorob účinná a bezpečná, zda zlepšuje kvalitu života, eventuálně zda prodlužuje přežití. To se týká například léčby hypertenze, dlouhodobé antikoagulace, hypolipidemické léčby a léčby diabetu. Některá doporučení již zohledňují funkční stav pacienta a modifikují cílové hodnoty s ohledem na celkové zdraví, funkční zdatnost/křehkost a mortalitní riziko. Řada nemocných však pokračuje v chronické léčbě bez potřebného periodického přehodnocování přínosu léčby a léčebných cílů. Diskutabilní je i zahájení nebo pokračování v preventivní léčbě, u které lze očekávat přínos v delším časovém horizontu, než je očekávané přežití, nebo která nezlepší, nebo dokonce zhorší kvalitu života (zátěž léčbou, „burden of treatment“). V těchto situacích pacienti i lékaři často zvažují, zda dále pokračovat v léčbě, či léčbu omezit nebo ukončit.
Deprescribing
Termín „deprescribing“, který dosud nemá v české odborné literatuře vhodný jednoslovný ekvivalent, byl poprvé použit v roce 2003 Woodwardem v souvislosti s vysazením medikace za účelem zlepšení výsledků zdravotní péče u pacientů s polyfarmakoterapií a potenciálně nevhodnou medikací (10).
V současnosti je „deprescribing“ definován Reevem a spol. jako „proces vysazení nevhodných léčiv pod supervizí lékaře s cílem omezení polyfarmakoterapie a zlepšení výsledků zdravotní péče“ (11). Scottova et al. definice z téhož roku (2015) popisuje „deprescribing“ jako „systematický proces identifikace a omezení či vysazení léků v případech, kdy přítomná či potenciální rizika poškození léčbou převyšují léčebný přínos, to vše v kontextu individuálních léčebných cílů s ohledem na funkční stav, očekávané přežití, hodnoty a preference“ (12). Přes absenci jednotné definice musíme chápat „deprescribing“ jako plánovaný vícestupňový proces racionální revize a úpravy předepisované a užívané medikace s ohledem na maximální bezpečnost pro pacienta a přínos v souladu se společnými cíli pacienta a lékaře (13). „Deprescribing“ tedy znamená především vysazení léků neindikovaných, ve stáří obecně či u konkrétního pacienta potenciálně nevhodných, léků duplicitních a všech léků, které nekorespondují s cíli léčby a preferencemi pacienta.
Podobný přístup je již dlouhá léta uplatňován v paliativní péči, kdy především u pacientů v konečných fázích života je doporučeno léčbu (medikaci) minimalizovat, podávat pouze léky zvyšující kvalitu života a komfort pacienta (symptomatická léčba), redukovat veškerou „zbytnou“ medikaci. I když v obecné rovině se u lékařů setkáme se souhlasným postojem s tímto stanoviskem, v praxi nebývá mnohdy uplatněno. U geriatrických nemocných v pokročilých fázích demence v ošetřovatelských ústavech v USA bylo opakovaně popsáno neúčelné podávání kognitiv, léků na osteoporózu, hypolipidemik a dalších preventivních léků v posledních týdnech života. Podobnou situaci nacházíme také v Evropě (14) i v českých zařízeních (15). V tabulce 2 uvádím pro ilustraci kritéria vypracovaná Holmesem et al. v roce 2008, která uvádějí nevhodné, tj. zbytné (nebo také „již nepotřebné“ či nepřínosné) léky u pacientů v pokročilých fázích demence (stadium Functional Assessment STage, FAST skóre 6E a 7ABC). Panel expertů zařadil léky do 4 skupin (vždy nevhodné, zřídkakdy vhodné, někdy vhodné a vždy vhodné). Podle Palliative Excellence in Alzheimer Care Efforts programu se někdy užívá i akronymem (PEACE kritéria). V tabulce 2 jsou uvedeny pouze skupiny vždy nevhodných a zřídkakdy vhodných léků u pacientů s těžkou demencí neschopných verbální komunikace, ležících a s inkontinencí moči i stolice.
Table 2. Příklad Holmesových et al. tzv.„PEACE kritérií“ pro nevhodné (zbytné) léky u pacientů v pokročilou demencí (24) 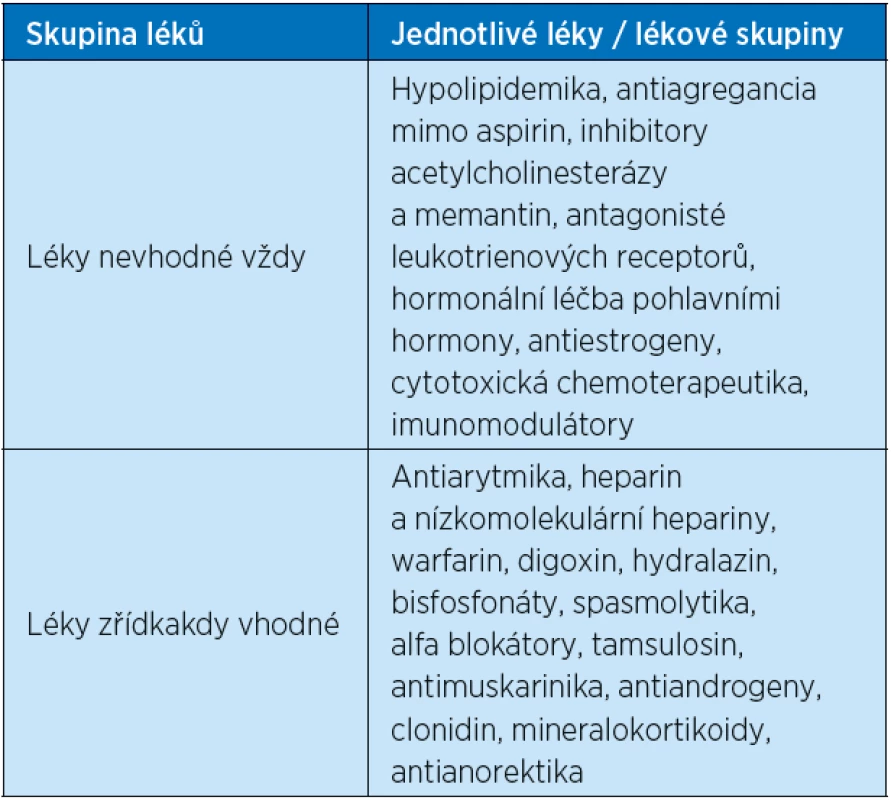
Zájem o „deprescribing“ narůstá teprve v poslední dekádě v souvislosti s publikovanými údaji o vysoké prevalenci rizikové (chybné) preskripce především v Kanadě, Austrálii a Spojených státech. Snad nejznámější nástroj pro klinickou praxi je seznam léčiv potenciálně nevhodných u starších osob, jejichž preskripci bychom se měli vyhnout, a pokud jsou předepsány, pokusit se je vysadit nebo zaměnit za bezpečnější alternativu. Jde o tzv. Beersova kritéria, Beersův seznam, který je pravidelně vždy po několika letech aktualizován Americkou geriatrickou společností, naposledy v roce 2019 (16). Pro českou odbornou veřejnost jsme v roce 2013 vytvořili na základě expertního konsenzu národní seznam potenciálně nevhodných léčiv reflektující dostupnost léčiv na našem trhu (3). Význam měla také americká kampaň „Choosing wisely“ (vybírej moudře, 2012; www.choosingwisely.org), která upozornila na nadužívání některých neúčelných, či dokonce rizikových diagnostických a terapeutických postupů včetně nadbytečného podání (nadužívání) léků. Na kampani spolupracovalo více než 60 odborných společností svými doporučeními. S úspěchem byla rozšířena i do dalších zemí. Česká internistická společnost se k této akci také připojila.
Možná rizika „deprescribingu“
Vysazování léků však není vůbec jednoduché a je spojeno s možnými riziky (17) a nežádoucími účinky z vysazení tzv. adverse drug withdrawal events (ADWE). Mezi ně patří syndrom z vysazení (např. při náhlém vysazení benzodiazepinů), rebound fenomén (při vysazení hypnotik), farmakokinetické a farmakodynamické změny (ukončení lékové interakce při vysazení jednoho z interagujících léků změní dosud navozený steadystate metabolismu druhého interagujícího léčiva). Může dojít také ke vzplanutí léčené nemoci nebo některých jejích příznaků. Obava z možného poškození pacienta a narušení vztahu a důvěry mezi pacientem a lékařem a mezi depreskribujícím lékařem a kolegy, kteří vysazovaný lék indikovali, jsou hlavní bariéry „deprescribingu“. Někdy hraje roli i strach lékaře nepostupovat podle publikovaných odborných doporučení a guidelines a z toho vyplývajících sankcí v případě komplikací. Další bariérou je nedostatek času, požadavky pacienta, který očekává předepsání léku, a lékař místo časově náročné diskuse raději pokračuje v zavedené léčbě.
Bezpečnost „deprescribingu“ lze zvýšit pečlivým individualizovaným přístupem ke každému pacientovi a strukturovaným postupem zahrnujícím plánování, postupné snižování dávky a pravidelné kontroly stavu pacienta během procesu vysazování i po vysazení konkrétní medikace. Je třeba zdůraznit, že poškození pacienta závažnou nežádoucí událostí z vysazení je velmi vzácné. Většina studií hodnotících efekt „deprescribingu“ je však jen observačních a na malých souborech, tedy dosud s nedostatečnou vědeckou evidencí. V této oblasti je třeba randomizovaných kontrolovaných studií s většími počty pacientů, abychom mohli přesněji určit výskyt nežádoucích událostí z vysazení a nejvhodnější postupy ke snížení tohoto rizika. V případě, že po vysazení léčby se znovu objeví symptomy nemoci, například depresivní příznaky po vysazení antidepresiva, je možné využít nefarmakologické postupy, zvolit méně rizikovou variantu antidepresiva nebo vrátit vysazený lék zpět do medikace. Zkušenost ukazuje, že „deprescribing“ lze realizovat za předpokladu, že existují dobré vztahy a důvěra mezi ošetřujícím lékařem a pacientem, popřípadě jeho rodinným pečovatelem. Podmínkou je také otevřená komunikace, ochota lékaře i pacienta založená na společném tzv. sdíleném souhlasném stanovisku (shared decision-making) obou. Předpokládá se také, že elektronický lékový záznam dostupný všem předepisujícím lékařům a lékárníkům, by mohl napomoci ve snižování preskripčních chyb.
Zatím není jasné, jak motivovat lékaře k revidování chronické polymedikace a následnému ukončení rizikové preskripce. V nedávno provedeném šetření v USA u 2475 předepisujících lékařů, které sledovalo, co by nejvíce usnadnilo zahájit a provést vysazení léku, uvedli lékaři na prvním místě: uvádět na předpisu u každého léku také jeho indikaci, na dalším místě pomoc dalšího zdravotníka při průběžném sledování pacienta během redukování dávky a vysazování a zapojení pacienta do rozhodnutí lék vysazovat/vysadit. Mohla by pomoci i možnost konzultace s klinickým farmaceutem (18, 19).
Jak postupovat při redukci polyfarmakoterapie
Statisticky nejčastějším lékařským úkonem je předepsání léku. Studenti lékařských fakult i mladí lékaři se učí, co a jak předepisovat. S termínem „deprescribing“ se na můj cílený dotaz nesetkal nikdo z kolegů a o tom, jak důležitá je pravidelná revize a kritické zhodnocení indikace, účinnosti a rizika léků zvláště u geriatrických nemocných a pacientů s excesivní polyfarmakoterapií (užívajících 10 a více léků), se při výuce ani na počátku praxe nesetkali. Většina starých pacientů neměla provedenou nikdy formální revizi své chronické medikace s následnou společnou rozvahou o možné změně léčby. Ale velká část geriatrických pacientů, pokud by k takovému rozhovoru s lékařem došlo, by uvítala snížení počtu užívaných léků. Ukazuje se také, že v případě, kdy pacient sám navrhne možnost některý lék redukovat, je „deprescribing“ snadněji realizovatelný, jak ukázala studie s vysazováním benzodiazepinů (20).
Pro praxi je důležité, aby byl lékař obeznámen s riziky (nevhodné a neúčelné) polyfarmakoterapie a koncepcí „deprescribingu“. Výhodná je spolupráce s klinickým farmaceutem, v některých zemích jsou v pilotních projektech zapojeni i lékárníci. Pacient by měl být podrobně zhodnocen a následně posouzen každý jednotlivý lék. Lékař by měl mít k dispozici praktický návod, jak vysazovat jednotlivou lékovou skupinu / jednotlivý lék. Pro potřeby lékařů byly vyvinuty nástroje/návody a protokoly s cílem usnadnit každý z těchto kroků. V systematickém přehledu zmiňují Thompson et al. celkem 15 nástrojů vycházejících z návrhu expertů, z nichž však jen 4 byly ověřeny a podpořeny klinickými studiemi (21). Proces „deprescribingu“ zahajujeme lékovou revizí (tab. 3).
Table 3. Deprescribing v postupných krocích 
Zhodnocení celého seznamu užívaných léků, léková revize
Prvním doporučovaným krokem „deprescribingu“ je zhodnocení všech předepisovaných léků a léků užívaných pacientem bez předpisu. Komplexní posouzení medikace označujeme jako lékovou revizi. K revizi medikace přistupujeme nejlépe na základě komplexního geriatrického vyšetření. Následně bychom měli identifikovat léky, které by bylo možné vysadit, tedy tzv. potenciálně nevhodnou preskripci. Pokud bychom zhodnotili, že je možné vysadit více léků, stanovit priority jejich vysazení (22).Většinou se zahajuje posouzením přínosu a rizika léku/ů a rozvahou, zda je medikace dostatečně účinná při dosahování cíle léčby a jak léčba pacienta zatěžuje. Jednotlivé nástroje pro „deprescribing“ se však liší jak rozsáhlostí a některé přímo definují pacienty, pro které je určen (například pacienti s pokročilou demencí, krátkým očekávaným přežitím, multimorbiditou, křehkostí) (23–26). Vybrané nástroje jsou uvedeny v tabulce 3.
Table 4. Nejčastější nástroje pro identifikaci nevhodné preskripce u geriatrických pacientů s komplexní nemocností (23–26) 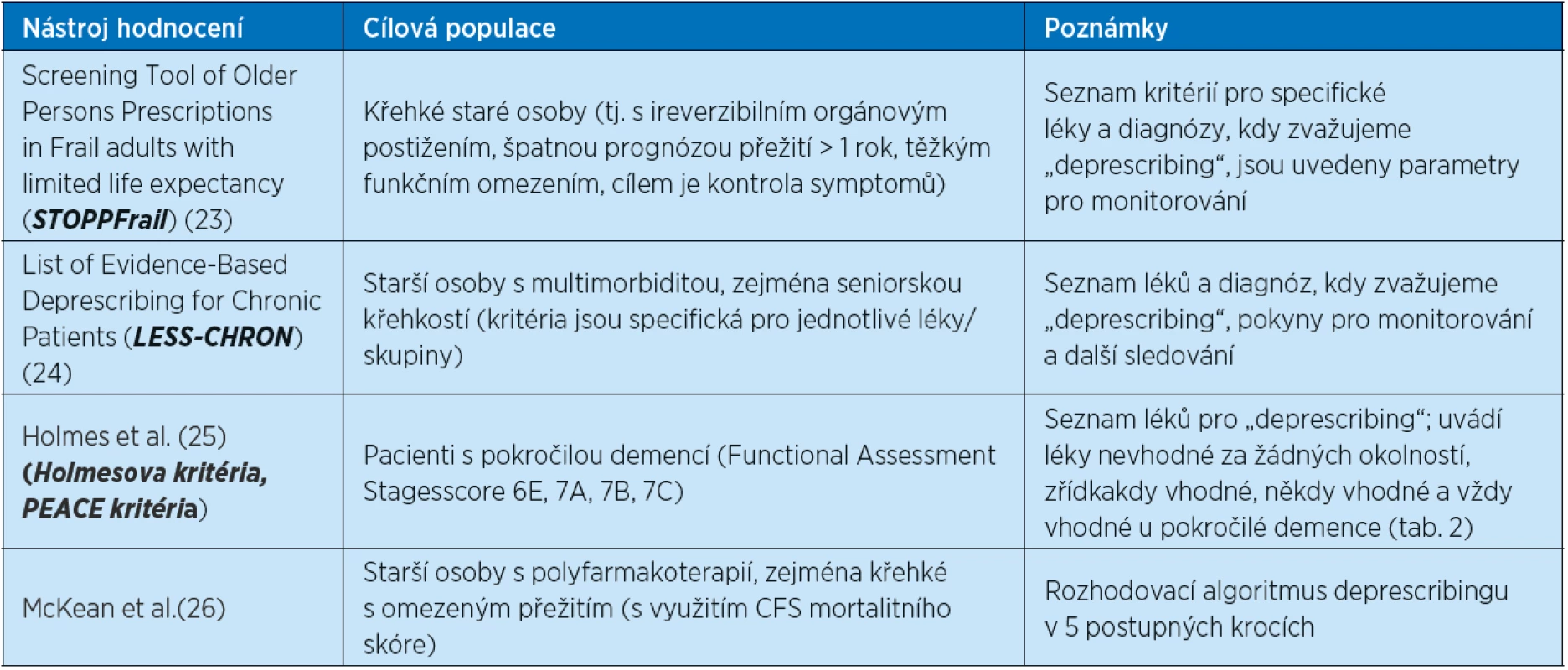
Nástroje pro „deprescribing“ zaměřené na jednotlivé lékové skupiny
Tyto nástroje přinášejí více praktických informací pro vysazování léků z jednotlivých lékových skupin. Uvádějí tak například indikace, přínos a rizika medikace, možný plán pro vysazení, zda je nutné postupné vysazování s redukcí dávky nebo lze lék vysadit okamžitě, a doporučují intervaly pro monitorování pacienta během a po ukončení podávání vysazovaného léku. Mohou být použity poměrně snadno v klinické praxi, i když vzhledem k omezenému testování těchto nástrojů v klinických studiích není jasné, zda jejich používání snižuje počty nevhodně užívaných léků a zda příznivě ovlivní zdraví a funkční stav pacienta.
Aktivně se na vývoji doporučení pro „deprescribing“ podílí několik výzkumných skupin. Kanadské konzorcium Canadian Deprescribing Network upozorňuje na problém nevhodné preskripce a možnosti řešení formou „deprescribingu“. Cílem je na národní úrovni omezit nevhodnou preskripci především u seniorů do letošního roku 2020. Na webových stránkách www.deprescribing.org lze nalézt již 5 guidelinů pro „deprescribing“ například perorálních antidiabetik, benzodiazepinů a hypnotik, inhibitorů cholinesterázy a memantinu, inhibitorů protonové pumpy a antipsychotik (27–30). Guidelines jsou určeny pro zdravotníky, jsou doplněny algoritmy a materiály pro pacienty a edukačním videem. Zdarma je dostupná aplikace pro mobilní telefony. Obrázek 1 zachycuje jako příklad algoritmus pro ukončení podávání PPI v anglickém jazyce, jak jej lze nalézt na webových stránkách.
Image 1. Algoritmus pro deprescribing inhibitorů protonové pumpy, www.deprescribing.org 
Závěr
Vysazení medikace nevhodné, neúčinné, či dokonce poškozující pacienta by mělo být nedílnou součástí správné klinické a správné preskripční praxe (27). V běžné praxi však naráží na mnoho bariér. I když lékař identifikuje takto rizikovou preskripci, je často obtížné až nemožné nevhodné léky jednoduše vysadit. Jednoduše proto, že neradi měníme naše zaběhnuté preskripční stereotypy (medical inertia) (31), snadno neměníme dříve osvědčené lékové kombinace, nemáme čas ani nervy přesvědčovat pacienta, který „chce jenom recept“. Je však třeba zvýšit povědomí o polyfarmakoterapii, nabídnout lékařům pomoc klinického farmaceuta (32) a praktické nástroje pro deprescribing. Právě geriatři ošetřující věkovou skupinu, kde je polyfarmakoterapie nejvíce rozšířena, by mohli demonstrovat, že je deprescribing nejen možný, ale i účelný a může zlepšit výsledky zdravotní péče, kterou poskytují. V České republice jsme v roce 2005 poprvé s PharmDr. Fialovou publikovali článek o potenciálně nevhodných léčivech a geriatři stáli v čele jeho rozšíření. Dnes je tento termín a Beersova kritéria známy velké části internistů a praktických lékařů. Lze jen doufat, že podobný vývoj bude mít s přispěním geriatrů i „deprescribing“.
prof. MUDr. Topinková Eva, CSc.
Geriatrická klinika 1. LF UK a VFN Praha
Sources
1. Kaufman DW, et al. Recent patterns of medication use in the ambulatory adult population of the United States: the Slone survey. JAMA 2002;287(3):337–344.
2. Onder G, Bonassi S, Abbatecola AM, et al. High prevalence of poor quality drug prescribing in older individuals: a nation wide report from the Italian Medicines Agency (AIFA). J Gerontol A Biol Sci Med Sci 2014;69(4):430–437.
3. Fialová D, Topinková E, Ballóková A, et al. Expertní konsenzus ČR 2012 v oblasti léčiv a lékových postupů potenciálně nevhodných ve stáří. Klin Farmakol Farm 2013; 27(1): 18–28.
4. Ústav lékového průvodce, projekt senior 2016:https://www.lekovypruvodce.cz/cs/seniori-v-domovech-jsou-casto-ohrozeni-nevhodnymi-leky
5. Thomsen LA, et al. Systematic review of the incidence and characteristics of preventable adverse drug events in ambulatory care. Ann Pharmacother 2007;41(9):1411–1426.
6. Topinkova E. Aging, disability and frailty. Ann Nutr Metab 2008;52(Suppl. 1): 6–11.
7. Mangin D, Bahat G, Golomb BA, et al. International Group for Reducing Inappropriate Medication Use & Polypharmacy (IGRIMUP): Position Statement and 10 Recommendations for Action. Drugs Aging 2018; 35 : 575–587.
8. Maher RL, Hanlon J, Hajjar ER. Clinical consequences of polypharmacy in elderly. Expert Opin Drug Saf 2014;13(1):57–65.
9. Kameníková L, Farghal H. Problematika polypragmazie, polymorbidity, adherence a compliance. Zdravotnictví a medicína 2014;18 : 25. Dostupné z: https://zdravi.euro.cz/clanek/problematika-polypragmazie-polymorbidity-adherence-a-compliance-477303
10. Woodward MC. Deprescribing: achieving better health outcomes for older people through reducing medications. J Pharm Pract Res 2003;33 : 323–328.
11. Reeve E, Gnjidic D, Long J, et al. A systematic review of the emerging definition of ,deprescribing‘ with network analysis: implications for future research and clinical practice. Br J Clin Pharmacol 2015;80(6): 1254–1268.
12. Scott IA, Hilmer SN, Reeve E, et al. Reducing inappropriate polypharmacy: the process of deprescribing. JAMA Intern Med 2015;175(5): 827–834.
13. Machado-Alba JE, Gaviria-Mendoza A, Machado-Duque ME, Chica L. Deprescribing: a new goal focused on the patient. Expert Opin Drug Saf 2017;16(2): 111–112.
14. Denholm R, Morris R, Payne R. Polypharmacy patterns in the last year of life in patients with dementia. Eur J Clin Pharmacol 2019;75(11):1583–1591.
15. Colloca G, Tosato M, Topinkova E, et al; Inappropriate drugs in elderly patients with severe cognitive impairment: results from the Shelter study. PLoS One 2012;7(10): e46669.
16. 2019 American Geriatrics Society Beers CriteriaUpdate Expert Panel. American Geriatrics Society 2019 updated AGS Beers Criteria for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2019; 67(4): 674–694.
17. Reeve E, Moriarty F, Nahas R, et al. A narrative review of the safety concerns of deprescribing in older adults and strategies to mitigate potential harms.Expert Opin Drug Saf 2018;17(1): 39–49.
18. Linsky A, Meterko M, Stolzmann K, Simon SR. Supporting medication discontinuation: provider preferences for interventions to facilitate deprescribing. BMC Health Serv Res 2017; 7(1): 447.
19. Reeve E, et al. People’s attitudes, beliefs, and experiences regarding polypharmacy and willingness to deprescribe. J Am Geriatr Soc 2013;61(9): 1508–1514.
20. Tannenbaum C, et al. Reduction of inappropriate benzodiazepine prescriptions among older adults through direct patient education: the EMPOWER cluster randomized trial. JAMA Intern Med 2014;174(6): 890–898.
21. Thompson W, Lundby C, Graabæk T, et al. Tools for deprescribing in frail older persons and those with limited life expectancy. A systematic review. J Am Geriatr Soc 2019; 67(1): 172–180.
22. Reeve E, Thompson W, Farrell B. Deprescribing: a narrative review of the evidence and practical recommendations for recognizing opportunities and taking action. Eur J Intern Med 2017;38: 3–11.
23. Lavan A, Gallagher P, Parsons C, et al. STOPPFrail (Screening Tool of Older Persons Prescriptions in Frail adults with limited life expectancy): Consensus validation. Age Ageing 2016;45 : 1–12.
24. Rodriguez-Pérez A, Alfaro-Lara ER, Albinana-Perez S, et al. Novel tool for deprescribing in chronic patients with multimorbidity: List of evidence-based deprescribing for chronic patients criteria. Geriatr Gerontol Int 2017;17 : 2200–2207.
25. Holmes HM, Sachs GA, Shega JW, et al. Integrating palliative medicine into the care of persons with advanced dementia: Identifying appropriate medication use. J Am Geriatr Soc 2008;56 : 1306–1311.
26. Mckean M, Pillans P, Scott IA. A medication review and deprescribing method for hospitalised older patients receiving multiple medications. Intern Med J 2016;46 : 35–42.
27. Farrell B, Mangin D. Deprescribing is an essential part of good prescribing. Am Fam Physician 2019;99 : 7–9
28. Farrell B, Black C, Thompson W, et al. Deprescribing antihyperglycemic agents in older persons: Evidence-based clinical practice guideline. Can Fam Physician 2017;63 : 832–843.
29. Reeve E, Farrell B, Thompson W, et al. Evidence-Based Clinical Practice Guideline for Deprescribing Cholinesterase Inhibitors and Memantine. 2018 (online). Dostupné z:http://sydney.edu.au/medicine/cdpc/resources/deprescribing-guidelines.php
30. Farrel B, Pottie K, Thompson W, et al. Deprescribing proton pump inhibitors. Can Fam Phys 2017; 63(5): 354–364.
31. Steinman MA, Landefeld CS.Overcoming Inertia to Improve Medication Use and Deprescribing.JAMA 2018;320(18): 1867–1869.
32. Martin P, Tamblyn R, Benedetti A, et al. Effect of a Pharmacist-Led Educational Intervention on Inappropriate Medication Prescriptions in Older Adults: The D-PRESCRIBE Randomized Clinical Trial. JAMA 2018;320(18): 1889–1898.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2020 Issue 1-
All articles in this issue
- Vážení kolegové, milí čtenáři,
- Normokalcemická primární hyperparatyreóza u starších nemocných. Klinické projevy a vývoj laboratorních parametrů
- Redukce nevhodné a neúčelné farmakoterapie – deprescribing
- Metabolický stav a nutrice u seniorů s renálním onemocněním a operační výkon
- Bolesti břicha ve stáří
- Orální zdraví seniorů
- Řešení poruch příjmu potravy u geriatrických pacientů cestou PEG: zkušenosti z Centra následné péče FN Motol
- Vznik prvního standardu ČANT nutriční péče v geriatrii – je důležitá multioborová spolupráce?
- Standard nutriční péče v geriatrii – obecné principy nutriční péče
- Test MM - Standard nutriční péče v geriatrii – obecné principy nutriční péče
- Nárůst počtu seniorů – hrozba, nebo výzva pro současnou medicínu?
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bolesti břicha ve stáří
- Řešení poruch příjmu potravy u geriatrických pacientů cestou PEG: zkušenosti z Centra následné péče FN Motol
- Orální zdraví seniorů
- Normokalcemická primární hyperparatyreóza u starších nemocných. Klinické projevy a vývoj laboratorních parametrů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

