-
Medical journals
- Career
Metabolický stav a nutrice u seniorů s renálním onemocněním a operační výkon
Authors: prof. MUDr. Vladimír Teplan, DrSc. 1,2,3; MUDr. Ondřej Gojiš, Ph.D. 4
Authors‘ workplace: Klinické a výzkumné centrum ISCARE, Centrum jednodenní chirurgie, Praha 1; Subkatedra nefrologie Institut postgraduálního, vzdělávání ve zdravotnictví, Praha 2; Katedra interních oboru a Interní klinika Lékařskáfakulta Ostravské univerzity, Ostrava 3; Ústav pro péči o matku a dítě, Praha 4
Published in: Geriatrie a Gerontologie 2020, 9, č. 1: 15-22
Category: Review Article
Overview
Se zlepšujícící se dostupností péče o nefrologicky nemocné a užitím moderních léčebných postupů roste počet nemocných ve vyšším věku. Předoperační vyšetření u seniorů zaměřené na poruchy metabolismu a výživy a jejich úpravu prováděné nefrology usnadňuje práci celému operačnímu týmu. Při rozhodování o přínosu výkonu posuzujeme nejen riziko pooperační mortality a morbidity, ale také důsledky výkonu pro funkční zdatnost (soběstačnost) pacienta a pro kvalitu jeho života. Dále posuzujeme nároky na charakter a rozsah pooperační péče včetně včasné přípravy na propuštění do domácího prostředí.
Přesné a zodpovědné předoperační vyšetření a metabolicko-nutriční příprava významně zlepšují operační prognózu rizikových seniorů.
Klíčová slova:
senior – nefrolog – metabolismus – nutrice – operace
Úvod
Se zlepšující se zdravotní péči a snahou o moderní léčebné postupy se prodlužuje průměrný věk populace a tím pacientů v seniorském věku rychle přibývá. Ze statistických dat vyplývá,že až 50 % seniorů potřebovalo nebo bude potřebovat operační výkon, a to většinou střední nebo i větší (1).
Předoperační vyšetření u seniorů prováděné praktickými lékaři a internisty by mělo usnadnit práci všem, kteří se budou na provedení operace dále podílet; anesteziologům, jejichž úkolem již není rizika a zejména rizikové komorbidity zjišťovat, ale podle zmapovaných rizik připravit strategii anestezie, a chirurgům s cílem provést nemocnému co nejbezpečněji navrženou operací. Předoperační vyšetření by mělo stanovit celkové operační riziko a chirurg by měl spolu s anesteziologem posoudit, zda je za stanoveného rizika i nadále indikována např. elektivní operace. Lékaři podílející se na pooperační péči by měli nalézt informace, co může nemocného v bezprostředním pooperačním období ohrožovat a co by se mělo sledovat pozorněji, aby toto riziko bylo co nejvíce sníženo (2). Vedle akutních operačních výkonů nebo výkonů z vitální índikace se ve většině případů jedná o výkony plánované, tj. elektivní. Zde je více časového prostoru ke zhodnocení aktuálního stavu pacienta s ohledem na rozsah plánovaného výkonu.
U pacientů s poškozením funkce ledvin by měl nepochybně sehrát významnou roli v celkovém posouzení a přípravě specialista – nefrolog. Je třeba vždy zhodnotit celkové riziko výkonu (operační i pooperační) s ohledem na co nejlepší dlouhodobý výsledek pro daného pacienta. Při posouzení přínosu výkonu posuzujeme u seniora nejen riziko pooperační mortality a morbidity, ale také důsledky výkonu pro funkční zdatnost (soběstačnost) pacienta a pro kvalitu jeho života. Dále posuzujeme nároky na charakter a rozsah pooperační péče,včetně včasné přípravy na propuštění do domácího prostředí. To platí zvláště u tzv. křehkých (frailty) geriatrických pacientů, kdy je třeba zhodnotit všechny nálezy v kontextu přidružené nemocnosti, s ohledem na individuální preference, sociální situaci i předpokládanou kvalitu a odhadovanou délku života (3).
Předoperační vyšetření musí vycházet z pečlivého zhodnocení anamnézy a klinického stavu spolu s vyhodnocením výsledků základních, eventuálně i speciálních laboratorních a pomocných vyšetření (4).
Žádaným výstupem předoperačního vyšetření je posouzení aktuální kondice pacienta a jeho funkčních rezerv s rozhodnutím o rozsahu plánovaného výkonu a jeho rizik. Výjimečné není ani odložení operace z objektivních důvodů či změna operační taktiky s ohledem na hrozící komplikace. Velmi významným kritériem v rozhodování však zůstává věk nemocných.
Kalendářní věk a věk biologický u nefrologických nemocných
Z klinické praxe je dobře známo, že existují významné rozdíly mezi kalendářním a biologickým věkem člověka (5). Věk biologický je také označován jako biologicko-funkční a je hodnocen dle funkční zdatnosti základních orgánových systémů. Významnou akceleraci změn představuje chronické onemocnění ledvin, zvláště pak jeho závažná forma chronická renální insuficience CKD 3–5, kdy se objevují četné průvodní metabolické změny následované změnami orgánovými (6). Pokles kardiorespirační kapacity, často spojený s chronickou metabolickou acidózou a minerálovou a vodní dysbalancí, je tak jednou z nejvýznamnějších změn.
Prodlužující se věk přináší sarkopenii, tj. progresivní úbytek svalové hmoty, ztrátu svalové síly a dynamiky. Zatímco u zdravých osob se objevuje ve věku (biologickém) nad 70–75 roků, u nemocných s chronickými onemocněními (kardiovaskulární, diabetes, renální insuficience) je častý i v mladších dekádách. Úbytek svalové hmoty nemocné omezuje po stránce motorické, ale má negativní vliv i na jejich přežívání (7).
Ledvina s věkem prodělává strukturální a funkční změny. Strukturální změny postihují glomeruly, tubuly i intersticiální prostor. Ubývá kůry v důsledku glomerulárního stárnutí a atrofie tubulů. Ledvina čtyřicetiletého člověka váží průměrně 250 gramů, osmdesátiletého 200 gramů. S tím souvisí řada funkčních změn. Klesá glomerulární filtrace, snižuje se efektivní průtok plazmy ledvinou. V tubulech se snižuje tubulární reabsorpce fosfátu i maximální vylučování glukózy a kyseliny paraaminohypurové. Pro distální nefron je zjišťována neschopnost maximálně vylučovat zátěž kyselinami, zhoršuje se zřeďovací schopnost, maximální koncentrační schopnost a konzervace sodíku.
Pokles koncentrační schopnosti má více důvodů. Jsou to:
Pokles glomerulární filtrace (GF) pro úbytek počtu fungujících nefronů.
Pokles dřeňové intersticiální tonicity způsobené osmotickou diurézou ve zbývajících nefronech. Ta zhorší reabsorpci NaCl ve vzestupném raménku Henleho kličky i recirkulaci urey.
Jen malé degenerativní změny v cévách dřeně způsobují poměrné zvýšení dřeňového průtoku krve a vymizení dřeňové tonicity.
Klesá citlivost distálního nefronu na ADH.
Studie prokazují, že GF klesají již po 35. roce života, ale to neplatí absolutně. Asi u 30 % starých osob k snížení GF nedochází. Ke snížení GF přispívá hypertenze nebo předcházející renální onemocnění. Pokles kreatininové clearance (C kr) s věkem je provázen snížením denního vylučování kreatininu (dU kreatininu). Je to výrazem poklesu svalové hmoty. Výsledkem je konstantní kreatininemie při poklesu Ckr. Vyšetřování dU kreatininu, užívané k posuzování úplnosti sběru moče, může ve stáří vést k falešným závěrům (pokles dU kreatininu tak nemusí znamenat neúplný sběr). C kr koreluje s činnou masou nefronů. Pokles GF ve stáří odpovídá celkové ztrátě homeostatické rezervy s menší kapacitou pro vylučování iontů, vody a léků.
Metabolické poruchy, poruchy vodního a minerálového metabolismu
Změny ve stáří jsou odrazem patofyziologických procesů, které významně postihují kardiovaskulární systém a dýchací ústrojí, avšak také vodní a elektrolytové hospodářství, hormonální regulaci i látkovou přeměnu. Pro vyšší věk je typická přítomnost více chorob současně (multimorbidita) (8). Ve stáří tak klesá srdeční výkon a regulační srdeční schopnost, což souvisí se změnami morfologickými (přestavba srdečního svalu) i funkčními (např. zvýšený výkon při hypertenzi, poruchy srdečního rytmu). Snížená funkční rezerva se projevuje neschopností zvýšit minutový srdeční výdej v závislosti na zvýšených požadavcích, objevují se známky insuficience. V důsledku městnavého selhávání srdečního dochází k poruchám vodního a elektrolytového hospodářství daných i poruchou činnosti ledvin, které je nutno při léčbě respektovat. Při větší námaze jsou zvýšeny nároky na přívod energie, a tedy i spotřeba kyslíku. Při snížené plicní kapacitě je obtížné dodávku zajistit; k tomu přistupují někdy i poruchy převodního systému (ischemického původu) a snížený výkon srdečních komor.
Mimo tyto obecné projevy dochází ve stáří k typickým změnám vodního a elektrolytového hospodářství a látkové přeměny, které je nutno respektovat při infuzní léčbě i léčebné výživě.
V průběhu stárnutí, přesněji řečeno s přibývajícím věkem, dochází ke změnám v renálních funkcích. Tyto změny se všeobecně přisuzují důsledkům arteriosklerotických změn renálního cévního řečiště. Znalost změn renálních funkcí je důležitá pro interpretaci poruch vnitřního prostředí u starších jedinců a tím i pro jejich adekvátní úpravu.
Jak známo, udržování homeostázy vnitřního prostředí je v podstatě umožňováno tím, že díky četným regulačním mechanismům a orgánovým funkcím jsou udržovány vztahy mezi:
příjmem vody a elektrolytů (potravou) a jejich průnikem z trávicího ústrojí do mimobuněčné tekutiny;
jejich vylučováním z organismu, zvláště ledvinami;
distribucí vody a elektrolytů do prostoru nitrobuněčného a mimobuněčného, což významně závisí na celkovém metabolickém stavu organismu.
Změny renálních funkcí mohou narušovat vylučování vody a elektrolytů. Charakteristickým příkladem je snížená schopnost konzervovat vodu následkem poklesu maximální koncentrační schopnosti ledvin. Sníženou resorpci osmoticky aktivních látek lze vysvětlit tak, že starší jedinci nejsou schopni za podmínek zřeďovací zkoušky vytvořit moč o tak nízké osmolaritě jako jedinci mladší. Stejně významné je i snížení schopnosti vyloučit nadbytek vody s následným nebezpečím její retence a vzniku intoxikace vodou vzhledem k snížení glomerulární filtrace a zřeďovací schopnosti ledvin. Vedle neschopnosti ledvin starších jedinců vytvářet dostatečně hypotonickou moč je nutno přihlédnout k další důležité skutečnosti, že totiž nejsou schopni dostatečně rychle vyloučit podanou vodní nálož (9).
Asi od 35 let věku nastává pozvolný pokles glomerulární filtrace (GF), která ve věku 80–90 let dosahuje přibližně poloviční hodnoty než u jedinců mezi 20–30 lety. Tento pokles GF je zřejmě důsledkem poklesu průtoku plasmy a krve ledvinou (10, 11, 12).
Specifické změny vodního a elektrolytového hospodářství
Vodní hospodářství
Obsah vody v organismu závisí na věku člověka, pohlaví a tělesné hmotnosti. U osob s normální hmotností je relativně stálý. Do věku kolem 50 let činí u muže 60 % (= 600 ml/kg), u ženy 50 % tělesné hmotnosti. Po 50. roce obsah vody postupně klesá, u muže až na 52 %, u ženy na 46 %. Množství vody v aktivních tkáních (lean body mass) je u muže i ženy stejné. Úbytek celkové tělesné vody ve stáří se děje zejména na účet její intracelulární složky. Při výrazné obezitě může být relativní obsah vody v organismu snížen až na 40 %, což vede k dalšímu poklesu rezervní kapacity pro extracelulární tekutinu a tím i ke snížené schopnosti zajišťovat homeostázu vodního a elektrolytového hospodářství (13).
Staří lidé si však často neuvědomují nedostatek tekutin. Pocit žízně je u nich oslaben, a hlavním příznakem nedostatku tekutin bývá nechutenství a apatie.
Mezi 30. a 70. rokem věku klesá hmotnost ledvin asi o 30 %, navíc se snižuje jejich funkce. Klesá glomerulární filtrace, ledviny mají sníženou koncentrační schopnost. Výsledkem je pokles osmolality moči až na 800 mmol/l. Vzhledem ke snížené kompenzační šíři funkce ledvin je k odstraňování produktů látkové přeměny nutno dodat denně navíc asi 500 ml tekutin.
Porušena je také termoregulace, klesá insenzibilní perspirace. Není-li příjem tekutin dostatečný, může dojít ke vzestupu sérových hladin katabolitů vylučovaných ledvinami (urea, kreatinin, k. močová). Při nedostatku tekutin trvajícím do 12 hodin (v předoperačním období) je organismus ještě schopen zabránit volumové dekompenzaci. Dochází však k poklesu hmotnosti a k pouze mírnému snížení diurézy (porušená koncentrační schopnost). Trvá-li však odnětí tekutin dále (nebo při velkých ztrátách tekutin či krve), mohou se rozvinout známky ireverzibilní metabolické dekompenzace, která může přejít v selhání ledvin (rerenální formy) a v kóma.
Vzhledem ke snížené kompenzační schopnosti kardiovaskulárního aparátu dochází u starých lidí snadněji k jeho selhávání. To často rozpoznáme teprve v pozdním stadiu, a je proto hůře ovlivnitelné. Z hlediska vodního a elektrolytového hospodářství se selhávání projevuje retencí sodíku a vody s následnou hyperhydratací. Dojde-li k retenci v extracelulárním prostoru, je to hyperhydratace izoosmolární. Při neadekvátní léčbě dehydratačních stavu (např. roztokem 5% glukózy) se významně zvětší množství bezsolutové vody a může se vyvinout naopak hypoosmolární hyperhydratace.
Léčebná opatření je třeba řídit podle zjištěných hodnot iontového a vodního metabolismu a jejich bilance. Je třeba varovat před schematickým použitím doporučovaných postupů pro dospělé pacienty mladšího věku, které by mohlo vést až k iatrogenním poškození nemocného.
Změny sodíku
Celkový obsah sodíku v organismu se ve stáří nemění. Extracelulární prostor je relativně zvětšen (asi 25 % proti 27 % prostoru intracelulárního), podíl sodíku v extracelulární tekutině stoupá o 10–15 %. Poklesem obsahu bílkovinných složek skeletu a objemu intracelulární tekutiny dochází ke ztrátám sodíku. Někdy vídáme u starých lidí lehkou a ještě fyziologickou hyponatremii s hodnotami sérového sodíku 128–132 mmol/l.
U starých lidí často zajišťujeme hyponatremické syndromy a je třeba rozlišit, zda se jedná o nedostatek Na+ (depleční syndrom) nebo o změnu v jeho rozložení a zředění (diluční syndrom).
Nedostatek sodíku, resp. jeho nízká hladina v krvi, je většinou důsledkem zvýšeného vylučování vody a sodíku při dlouhodobém podávání diuretik (saluretik). Klinicky se projevuje povšechnou únavností, slabostí a apatií až kómatem. Diagnózu potvrdí stanovení natremie a uvedené příznaky a dále frakcionované měření množství moči a exkrece sodíku, vyšetření celkových bílkovin a kreatininu v séru.
Hyponatremie při změně distribuce sodíku z extra-celulárního do intracelulárního prostoru vede ke zvýšení jeho koncentrace v buňkách. Lze ji pozorovat při srdeční insuficienci vyššího stupně, respirační insuficienci a při stavech s nedostatkem kyslíku. Průkaz je po metodické stránce svízelný, protože bývá současně přítomna hyponatremie dilučního typu.
Diluční hyponatremie je projev převodnění, „intoxikace vodou“, vzniklého v důsledku nadměrného příjmu tekutin nebo infuzí hypotonických roztoků, většinou při současné diuretické (saluretické) léčbě. Také při zvýšené sekreci adiuretického hormonu (např. při srdeční dekompenzaci) může dojít k diluční hyponatremii, jejímiž klinickými projevy jsou apatie, bolesti hlavy, nauzea a zvracení, které mohou až přejít v kóma, hypertenzi a bradykardii (při intrakraniální hypertenzi).
Snížený obsah sodíku v organismu vede také k poklesu pufrovací kapacity.
Při léčení postupujeme podle příčin hyponatremie. Substituční příjem sodíku závisí na základní poruše. Denní potřeba u zdravého člověka činí kolem 1 mmol/kg.
Změny draslíku a ostatních elektrolytů
Se stoupajícím věkem se snižuje celkové množství draslíku v organismu. Při zvýšeném průniku sodíku do buněk vystupuje draslík naopak do extracelulárního prostoru, klesá také obsah draslíku v kostech. Sníženo je i směnitelné kalium (muži: 18–33 roků = 40 mmol K+/kg, 51–75 roků = 39,7 mmol K+/kg). U řady geriatrických nemocných zjistíme hypokalemii nižší než 3,5 mmol/l. Její příčinou je zejména dlouhodobé podávání diuretik, na druhém místě karence vyvolané nesprávným složením potravy (nedostatečný příjem mléka a mléčných výrobků, masa, ovoce a brambor). Normální denní spotřeba draslíku je přibližně 50–150 mmol (2–6 g).
Po podání nadměrné dávky draslíku dochází u těchto nemocných relativně rychle k hyperkalemii, která je zaviněna sníženou funkcí ledvin, proto je nezbytné respektovat při doplňování kalia stav renálních funkcí a provádět substituci pozvolna.
Typickými projevy nedostatku draslíku u starých lidí jsou apatie, zácpa, edémy, zhoršení stávající ischemické choroby srdeční, klesá tolerance digitalisových přípravků, množí se poruchy rytmu.
Pokud jde o další elektrolyty, někdy se projevuje nedostatek hořčíku s rezultující kardiomyopatií, sekundárními kalcifikacemi a enzymatickými defekty, dále nedostatek vápníku, vedoucí k osteoporóze, tetanickým křečím, poruchám vědomí a srdečního rytmu. Chybení fosfátu vyvolává apatii, enzymové defekty a arytmie; může dojít i ke karenci chloridů.
Starý člověk reaguje promptně i na nevelké změny vodního a elektrolytového hospodářství často netypickou symptomatologií (apatie, oběhové poruchy, a dokonce bezvědomí).
Renální onemocnění a operační riziko
Při hodnocení pacienta s renálním onemocněním je nutné stanovit stupeň postižení ledvin. Kromě vzestupu urey, kreatininu, k. močové, výskytu acidózy, hyperkalemie, hypertenze, nefrotického syndromu s otoky je možno se setkat s anémií z nedostatku erytropoetinu a často i železa, rozvojem renální osteopatie při možné sekundární hyperparathyreoze (porucha aktivace vitaminu D v ledvinách v poloze 1 vede k hypokalcemii a hyperfosfatemii). Dysfunkce trombocytů u pokročilého postižení ledvin stupně CKD 4 prodlužuje krvácivost. Operace nemocného ohrožuje akutní dekompenzací chronické renální insuficience s ledvinným selháním a nutností dialyzační léčby, hyperkaliemií, hyperhydratací, krvácením a infekcemi. Je třeba si uvědomit možnost kumulace farmak vylučovaných ledvinami, zvláště při pooperačním snížení glomerulární filtrace. Je třeba se vyhnout nefrotoxickým antibiotikům, radiokontrastním látkám a renální funkci přizpůsobit dávkování sedativ a myorelaxancií. Nemocní by neměli dostávat také nesteroidní antirevmatika. Nemocní v chronickém dialyzačním programu mají mít poslední dialýzu v posledních 24 hodinách před operací s taktikou minimální těsné heparinizace či dialýzu bezheparinovou. Pokud jsou na peritoneální dialýze, je možno pokračovat, pokud se nejedná o intraabdominální výkon, jinak je nutné je převést na extrakorporální dialýzu. Nemocní po transplantaci ledviny zpravidla užívají ckalcineurinové inhibitory (cyklosporin nebo tacrolimus), které jsou metabolizovány cytochromem P 450, a tak hrozí interakce s mnoha dalšími farmaky, zejména diltiazemem, statiny, makrolidy, antimykotiky. Nutné je myslet na možné nespecifické navýšení kardiospecifických troponinů (14).
Akutní renální selhání nebo zhoršení preexistující poruchy funkce ledvin jsou v perioperačním období časté. Příčin zhoršujících renální funkce je více, nejčastěji se však jedná o ischemické poškození. Především se to týká vysoce rizikových výkonů a z pacientů hlavně diabetiků a nemocných s pokročilou aterosklerózou. Přispívá k tomu hypotenze během výkonu i případná nefrotoxicita podávané medikace, zejména aminoglykosidů. Rizikové je zjištěné předoperační zvýšení kreatininu přibližně na 150 µmol/l a více. Tito nemocní navíc mají i zvýšené riziko kardiovaskulárních a plicních komplikací. Normální hladina kreatininu a urey s normálním nálezem v moči téměř vylučuje významnější renální postižení kromě velmi starých nemocných a pacientů s cirhózou, kde hladina kreatininu nemusí dobře korelovat s glomerulární filtrací. Zde se doporučuje provést regulérní clearance kreatininu se sběrem moči za 24 hodin. Rizikem pro hrozící renální selhání je preexistující onemocnění ledvin ve spojení s poruchami vedoucími ke snížení prokrvení ledvin, jako jsou dehydratace, hypovolemie a sepse. Taktéž kardiální onemocnění se zmenšením minutového srdečního výdeje inklinují v důsledku časté perioperační vazokonstrikce v ledvinách ke snížení renální funkce. Dalším rizikem je cholestáza nebo cirhóza.
Opatření k minimalizaci zhoršení renálních funkcí při operaci spočívá v zajištění optimální hydratace, zvláště při nutném podání kontrastní látky. Dále se doporučuje den před operací nebo alespoň v operační den vysadit diuretika. Předpokládané ztráty tekutin během výkonu je velmi obtížné odhadovat a mnohem lépe se řeší objemové přetížení podáním diuretik než hypotenze vzniklá ztrátou intravaskulární a extravaskulární tekutiny. Je třeba monitorovat hladiny iontů a zabránit dysbalancím a výkyvům osmolarity. Pokud je třeba použít kontrastní látky, je u diabetiků vhodné preferovat méně nefrotoxické – neaniontové nízkoosmolární. Je možné preventivně podat parenterálně antioxidačně působící acetylcystein. Velmi významně pozitivní vliv má pre - a postoperační hydratace (14–18).
Nemocní s pokročilou formou renálního selhání nebo již v dialyzační léčbě často trpí deficitem vitaminů, malnutricí a zhoršením funkce leukocytů a dalších obranných mechanismů proti infekci v důsledku chronického působení různých uremických toxinů. Mají i zvýšené riziko krvácivých komplikací, proto musí být operační výkon veden šetrnou technikou s minimálním krvácením.
Operační riziko a věk
Operační riziko těsně koreluje s počtem komplikujících onemocnění. Věk nad 70 let značí samostatný rizikový faktor pro větší operační výkon (19, 20). Zvýšené riziko mají nemocní s těžkou demencí, kde operační mortalita dosahuje až 45 %. Senior hůře snáší protrahovanou operaci, například 30minutové prodloužení výkonu nad 2 hodiny znamená u seniorů nad 80 let zvýšení mortality o 17 %. Předoperační stratifikace rizik nezachycují zcela specifika geriatrických pacientů. Tradiční metody hodnotí jednotlivou orgánovou dysfunkci a méně hledí na celkové fyziologické postižení geriatrického pacienta. V poslední době se hovoří stále více o tzv. frailty syndromu, „syndromu křehkosti či o „syndromu zranitelnosti“ (21–23). Nemocní, spadající do této kategorie, jsou zvláště rizikoví pro operační výkon. Podle různých zdrojů je jejich operační riziko zvýšeno asi desetkrát oproti stejně starým osobám, které do této kategorie nezapadají. Syndrom zranitelnosti je vymezován v odborné literatuře velmi různými skórovacími systémy, jedním z nejjednodušších je definován následujícími charakteristikami: 1. zjištění neplánované ztráty hmotnosti o více než 5 kg v předchozím roce, 2. při fyzikálním vyšetření je patrná zřetelná sarkopenie, 3. je významně snížena síla úchopu, 4. subjektivně pacient udává pocit slabosti a vyčerpání, 5. chůze je významně zpomalena nebo se jedná o ležícího pacienta, 6. běžná fyzická aktivita je omezena, 7. je přítomna kognitivní dysfunkce. V rozvaze indikace k chirurgickému výkonu je vhodné vzít v úvahu i to, že asi u 13 % nemocných starších 60 let se po operaci trvající déle než 2 hodiny objevuje kognitivní pooperační dysfunkce trvající nejméně tři měsíce a u 3 % přetrvává i po jednom roce. Rizikovým faktorem je zejména již prodělaná mozková cévní příhoda a zhoršené kognitivní schopnosti přítomné před operací. Nalezení tří z těchto faktorů již zařazuje seniora do kategorie syndromu zranitelnosti.
Stanovení závažnosti operačního rizika – klasifikace ASA
Operační riziko se většinou stanovuje podle skórovacího systému se současným klinickým zhodnocením stavu pacienta. Skórovací systémy do svého bodování nikdy nezahrnou všechna rizika, jež má řada polymorbidních nemocných. Ideální rizikové skóre by mělo být objektivní, přesné, ekonomické a jednoduše proveditelné. Takové ovšem neexistuje. Nejznámější a u nás nejčastěji užívaná je orientační klasifikace ASA (American Society of Anesthesiologists) (tab. 1).
Table 1. Orientační klasifikace ASA 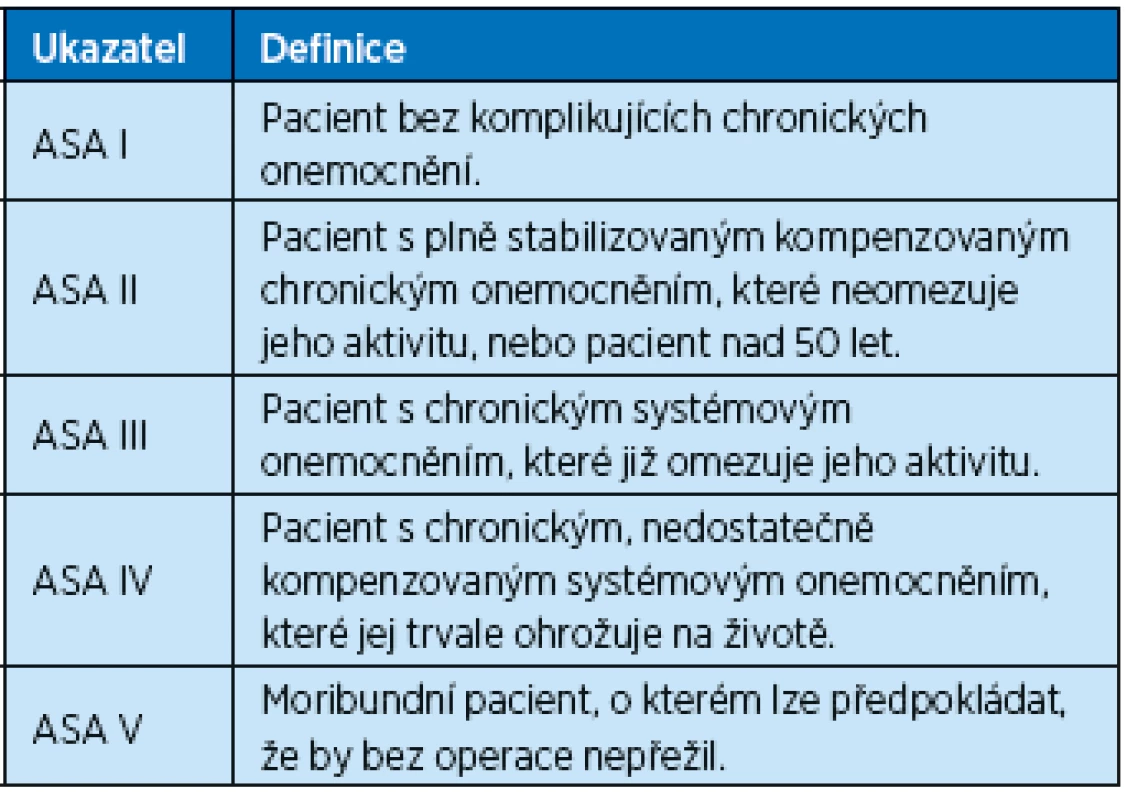
Výhodou tohoto rozdělení je jeho jednoduchost, zejména pro anesteziologa, který tak může jednoduše doložit anesteziologické riziko a míru pracovní zátěže během operace (20, 21). Klasifikace ASA však má řadu omezení. Nebere vůbec v úvahu rizikovost plánovaného operačního výkonu, všímá si orientačně jen rizik přítomných u samotného pacienta. Přibližná skupinová mortalita osob klasifikovaných jako ASA I činí podle různých autorů 0,06–0,1 % a ASA IV 7,8–23 %. Urgentní operace zvyšuje riziko 1,5krát až 2krát. Nicméně práce z poslední doby ukázaly, že skóre ASA má malou prediktivní hodnotu pro odhad individuálního rizika jednotlivého pacienta (1).
Poruchy výživy
U každého pacienta připravovaného k operaci je nutno zhodnotit stav jeho výživy. Orientačně lze malnutrici diagnostikovat při znalosti poklesu tělesné hmotnosti a hladiny albuminu, zhodnocením BMI a obvodu svalu a tukové řasy na paži nedominantní končetiny. Na rozdíl od preventivního podání parenterální výživy je doporučováno časné zahájení enterální výživy před výkonem i následně po výkonu. Obézní pacienti bez přidružených komorbidit překvapivě nemají zvýšené operační riziko. S výhodou je úprava nutričního stavu včas ještě v předoperačním údobí (8).
První orientace v nutričním riziku se zaměřuje se na tělesnou hmotnost (BMI< 18,5), hubnutí v poslední době (pokles hmotnosti o 10 % v posledních 6 měsících, nebo 5 % v posledních 3 měsících), hypometabolický stav (nízký příjem jídla pod 50 % normální denní potřeby v posledním týdnu), předchozí akutní onemocnění, které by bylo spojeno se zvýšeným proteinovým katabolizmem (odpad dusíku do moči > 20 g/den, albuminemie < 30 g/l). U takto diagnostikovaných nutričně rizikových osob následuje podrobnější stanovení.
Pokud chceme zabránit komplikacím spojeným s podvýživou seniorů, musíme na ni především myslet. U nemocných seniorů by měl být prováděn nutriční screening vždy. Nejvhodnější je formulář MNA určený pro seniory. Tento jednoduchý test pátrá po recentním snížení příjmu stravy, poklesu hmotnosti a přibližném složení těla. U seniorů je navíc doplněn o otázky týkající se tělesné aktivity, neboť právě tělesná aktivita nás informuje o stavu kosterní svaloviny, a tedy o zásobách bílkovin.
Nutné je sledování přijaté stravy. V této fázi nejde o nákladné postupy a nemocnému stačí podávat nutriční doplňky formou přídavků nebo sippingu. Neváháme však ani s včasným zahájením parenterální výživy. Celkový denní příjem energie by měl dosahovat 35–40 kcal/kg a bílkovin 1,5 až 2,0 g/kg. Podle některých autorů jsou tyto dávky krátkodobě i 30–35 kcal/kg, resp. 1,2–1,5 g/kg proteinu. Vždy však musíme respektovat úroveň renální funkce a metabolický stav pacienta.
Interval snížené tělesní aktivity by měl být i seniorů co nejkratší. Nutriční podpora nesmí nemocného imobilizovat; nelze tedy nemocného tlumit za účelem poskytnutí nutriční podpory (24).
Aktivní přístup k výživě a k rehabilitaci by měl pokračovat i po překonání akutního onemocnění. Znovunabytí svaloviny je totiž jev velmi pozvolný a trvá i několik týdnů až měsíců. V této době se doporučuje plnohodnotná a vyvážená strava, kterou je možno doplnit opět o nutriční doplňky neboli potraviny pro zvláštní lékařské účely. Takový postup výrazně snížil počet rehospitalizací akutně nemocných seniorů (tab. 2).
Table 2. Nutričně rizikový chirurgický pacient (Havel 2012) 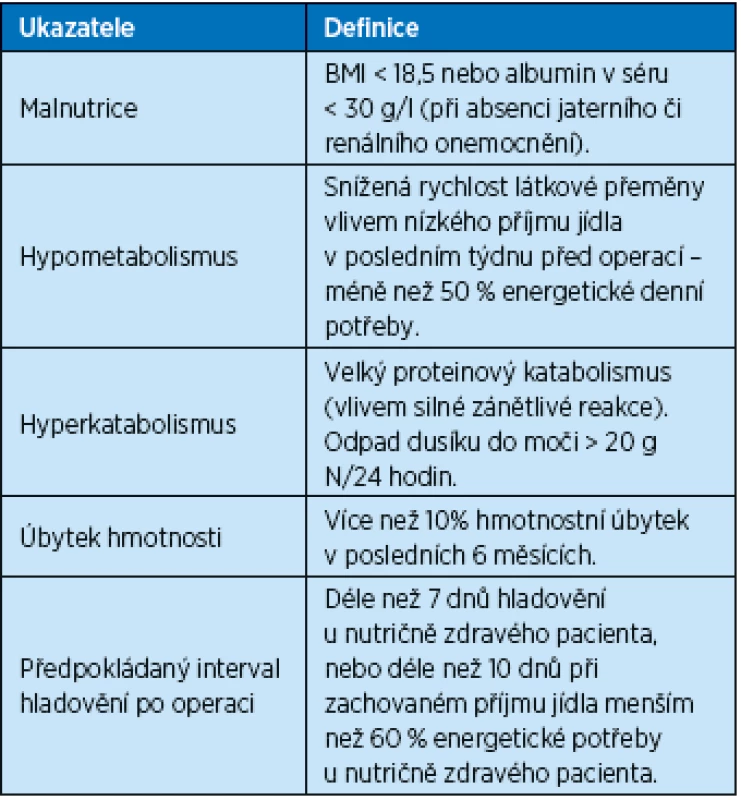
Pro stanovení funkční rezervy organismu před operací se používá anamnéza tolerované fyzické zátěže v běžném životě. Velkou operaci lépe tolerují osoby, které jsou schopny více než čtyřnásobně zvýšit klidový energetický výdej. To odpovídá rychlé chůzi při delší procházce, usilovnější práci na zahradě, stoupání do schodů (alespoň dvě patra). Exaktně stanovuje funkční rezervu organismu ergometrie s měřením spotřeby kyslíku a stanovením příslušného násobku metabolických ekvivalentů (1 MET = klidový energetický výdej).
Specifické změny látkové přeměny u seniorů
Celková potřeba energie je jen asi dvoutřetinová v porovnání s mladým člověkem (25 roků). Svalové tkáně ubývá, ze 44 % celkové tělesné hmotnosti v mládí na 27 % ve věku vyšším než 85 let. Antropometrie většinou zjišťuje ztluštění kožní řasy nad tricepsem a současně zmenšení obvodu paže (úbytek svaloviny). U starých lidí bývá omezena kapacita trávicích pochodů a resorpce, v důsledku metabolických poruch trpí nedostatkem bílkovin. Zvýšená tělesná hmotnost může být zaviněna nesprávnou výživou (značný význam má také pokles tělesné aktivity). Se stoupající nadměrnou hmotností se zvyšuje výskyt některých dalších onemocnění, jako jsou diabetes mellitus, dna, hypertenze, ischemická choroba srdeční, poruchy periferní cirkulace i hyperlipidemie (25).
Trávení a resorpce jsou méně efektivní a mohou být příčinou různých gastrointestinálních poruch. Malabsorpce a rezultující malnutrice mohou být zaviněny chronickou gastritidou, stavem po resekci žaludku nebo chronickou pankreatitidou. Se zhoršeným trávením a resorpcí je třeba počítat i při výživě podávané sondou: dostatečným zdrojem výživy mohou být chemicky nebo nutričně definované diety. U některých matabolických onemocnění lze ve stáří použít enterální výživu jako léčebnou metodu (dna, hyperlipoproteinemie), protože výživné směsi většinou neobsahují puriny ani cholesterol (26).
Ve věku nad 50 let výrazně stoupají nároky na přívod bílkovin a zejména esenciálních aminokyselin. Starému člověku je třeba dodávat denně 1,2–1,5 g bílkovin na kilogram tělesné hmotnosti, což odpovídá asi 30 % celkové dodávané energie. Toto množství je nutné k zajištění pozitivní dusíkové bilance, dostatečné odolnosti proti infekcím a hojení ran. (vzhledem ke snižující se funkci ledvin ve stáří je však nutná opatrnost při doporučování vysokých dávek bílkovin). Při indikovaném podávání je třeba sledovat koncentraci metabolických produktů degredace bílkovin v krvi.
Karence bílkovin je u starých lidí častá a jejími důvody jsou poruchy trávení, zhoršená schopnost žvýkaní při nedokonalé funkci chrupu, socioekonomické faktory (cena masa, příprava a nepravidelnost jídla). Nedostatek bílkovin vyvolává enzymové defekty, pokles plazmatických bílkovin, urychlení fyziologické senilní involuce, snižuje se duševní čilost, zhoršuje hojení ran a odolnost k infekčním chorobám klesá.
Denní dávka tuku nemá překročit 1g/kg/den, resp. 30 % dodávané energie. Limitujícími faktory jsou snížená vyčeřovací schopnost plazmy a sklon k hyperlipoproteinemiím. Při intravenózním podávání tuků je nutno průběžně sledovat hladiny triacylglycerolů a glykemie jako ukazatele využití tuků a jejich tolerance. Je také nutno kontrolovat cholesterolémii. Pro enterální výživu jsou zvláště vhodné přípravky s vysokým obsahem esenciálních mastných kyselin. Ovlivnění cholesterolemie docílené podáváním bezcholesterolové enterální výživy nepřineslo jednoznačné úspěchy.
U nemocných starších 65 let je nutno počítat vedle výskytu manifestního diabetu i s diabetem zatím latentním. Poruchy sacharidové přeměny nutí ke značnému omezení oligosacharidů v potravě; větší dávky sacharidů vyžadují uvolnění vyššího množství inzulinu, což má mj. za následek zvýšení lipogeneze a zbytečné zatížení již méně výkonného endokrinního pankreatu. Uvedené změny zjišťujeme zejména při postagresívním syndromu a kromě intolerance sacharidů vedou k nadbytečné tvorbě tuku. Denní dávka sacharidů by neměla být vyšší než 400 g (nebo 6 g /kg/den).
Podávání jiných oligosacharidů náhradou za glukózu může mít za následek zvýšenou produkci laktátu a urátů, proto i zde by měla být zachována určitá omezení, známá u jiných stavů. Při enterální aplikaci je vhodné snižovat dávku oligosacharidů, podáváme větší množství polysacharidů (degradační produkty škrobu). Snášenlivost laktózy bývá snížena pro poměrně častou insuficienci laktázy, proto ji raději nepodáváme.
Otázka obezity a operačního rizika je dosud neuzavřena. Většinou se předpokládá, že obézní pacienti mají větší operační riziko vyplývající zejména z horšího hojení ran, většího rizika venózního tromboembolismu a vzhledem k přidruženým chorobám, které jsou s obezitou spojeny. Toto je pravda, pokud mají tito pacienti další komorbidity (diabetes, ICHS, asthma, postižení jater či renální insuficience), ale nebylo to prokázáno do BMI 35 u jinak zdravého pacienta s obezitou (27, 28).
Předoperační nutriční příprava k úpravě malnutrice
Vzhledem k omezené efektivitě pooperační výživy v katabolickém stavu se zvyšuje důraz na předoperační intervenci malnutrice. Podmínkou efektivního ovlivnění předoperační malnutrice je odložitelnost operačního výkonu a efektivita nutriční intervence (29, 30). Zlepšování nutričního stavu je důvodem pro odložení elektivního výkonu tak, aby hladina albuminu v séru byla předoperačně vyšší než 30 g/l. U nádorových onemocnění, kde nelze operaci odkládat z důvodu rizika postupu nádorového bujení, je před odložitelnou operací doporučeno podávat u nutričně rizikových osob plnou nutriční podporu 10 dnů před operací.
Sipping je součástí dietní předoperační přípravy. Vhodné jsou komplexní nutriční přípravky v pestré škále chutí, která zvyšuje naději na lepší snášenlivost při dlouhodobějším připíjení. Přípravky se podávají po jídle, zejména pak před spaním, event. v noci při probuzení tak, aby nesnižovaly příjem běžného jídla během dne. V poslední době je kladen důraz na složení přípravků se změřením na snížené renální funkce u seniorů, pro predialyzační léčbu např. Fresubin Renal, pro dialyzované Nephro či nově české Nutrego Renal (konzervativní léčba spolu s dietou) a Nutrego HP (pro dialyzované).
Přípravky jsou specifické standardním příjmem proteinů s omezeným příjmem K aP, ve složení senior pak i dobrou tolerancí. U osob s problémem sníst větší objem potravy jsou vhodné přípravky s vyšší kalorickou denzitou (1,5–2,5 kcal/ml) či zavedení intrragastrické, intraduorenální sondy či výživou formou PEG.
V případě nedostatečného perorálního příjmu je enterální výživa upřednostňována před parenterální ve všech případech, kdy je tolerována. Většinou je aplikována tenkou sondou zavedenou nosem až do tenkého střeva. V současné době existuje široká nabídka firemních přípravků enterální výživy. V rámci předoperační přípravy mají přednost přípravky s vyšším obsahem bílkovin. V délce několika dnů před operací je využíván i efekt ω-3 mastných kyselin k modulaci pooperační proteolýzy. V naprosté většině případů vyhovují polymerní přípravky enterální výživy (celé molekuly bílkovin). Oligomerní přípravky (štěpené bílkoviny na peptidy) jsou výjimečně podávány u pacientů s poruchou trávení, krátkým střevem a intolerancí polymerní výživy. Jednotvárný sipping a nedobře monitorovaná enterální výživa jsou spojeny s rizikem nízké efektivity buď z důvodu nepodání ordinovaného, či vlivem
Závěr
S narůstajícím počtem nefrologických pacientů ve vyšších věkových dekádách a jejich multimorbiditou se stále více dostává do popředí nutnost správného a zodpovědného předoperačního vyšetření včetně stavu metabolismu a výživy, které usnadňuje rozhodovací proces dalšího postupu operačnímu týmu; anesteziologům, jejichž úkolem by nemělo být předoperační a operační rizika teprve zjišťovat, ale spolu s nefrologem připravit strategii bezpečné anestezie. Na prvním místě však chirurgům s cílem provést nemocnému co nejbezpečněji navrženou operací či její indikaci upravit. Předoperační vyšetření by mělo stanovit celkové operační riziko a chirurg by měl spolu s nefrologem a anesteziologem posoudit, zda je za stanoveného rizika i nadále indikována daná operace.
Při rozhodování o přínosu výkonu posuzujeme nejen riziko výkonu, pooperační mortality a morbidity, ale také důsledky výkonu pro funkční zdatnost (soběstačnost) pacienta a pro kvalitu jeho života. Dále také posuzujeme nároky na charakter a rozsah pooperační péče, včetně včasné přípravy na propuštění do domácího prostředí. To platí zvláště u tzv. křehkých (frailty) geriatrických pacientů, kdy je třeba zhodnotit všechny nálezy v kontextu přidružené nemocnosti, stavu jednotlivých vitálních orgánů a s ohledem k individuálním preferencím, sociální situaci i předpokládané kvalitě a odhadované délce života.
Je nepochybné, že přesné a zodpovědné předoperační interní vyšetření včetně individuální předoperační a následně postoperační péče významně zlepšuje celkovou operační prognózu rizikových pacientů a mělo by být nedílnou součástí všech operačních výkonů u seniorů.
prof. MUDr. Vladimír Teplan, DrSc.1-3, MUDr. Ondřej Gojiš, Ph.D.
1Klinické a výzkumné centrum ISCARE, Centrum jednodenní chirurgie, Praha
2Subkatedra nefrologie Institut postgraduálního vzdělávání ve zdravotnictví, Praha
3Katedra interních oboru a Interní klinika Lékařská fakulta Ostravské univerzity, Ostrava
4 Ústav pro péči o matku a dítě, Praha
Sources
1. Kotík L. Předoperační vyšetření dospělých, třetí přepracované vydání. Mladá fronta, Aesculap: Praha 2019.
2. Skalická H. Předoperační vyšetření – návody pro praxi. Praha: Grada Publishing 2007.
3. Topinková E. Předoperační vyšetření a perioperační péče. In: Topinková E. Geriatrie pro praxi. Praha: Galén 2005.
4. Blažek M, Havel E, Bělobrádková E. Předoperační vyšetření a příprava chirurgického pacienta. Interní medicína pro praxi 2012; 14(11): 422–428.
5. Gavorník P.nKalendarny vek a biologicko-funkčný organovaskulární vek člověka.nPrakt Lék 2018; 98(6): 275–276.
6. Teplan V, a kol. Funkční a metabolické změny vyššího věku. In: Nefrologie vyššího věku V.Teplan a kol. Praha: Mladá fronta, Aesculap 2015; 81–98.
7. Topinková E. Sarkopenie, revidovaná evropská diagnostická kritéria 2018. Geri a Gero 2019; 8(1): 14–19.
8. Teplan V, a kol. Metabolismus a ledviny. Praha: Grada Publishing 2000.
9. Nádvorníková H. Koncentrační schopnost ledvin. Praha: Avicenum 1983.
10. Sands JM. Urine concentration ability in the aging kidney. Sci Aging Knowledge Environ 2003: PE15.
11. Schück O. Examination of kidney function. Martinus Nijhof Publ 1984.
12. Silva FG. The aging kidney: a review-part II. Int Urol Nephrol 2005; 37 : 419–432.
13. Horáčková M. Biochemické změny u seniorů. In: Teplan V a kol. Nefrologie vyššího věku. Praha:Mladá fronta, Aesculap 2015 : 38–56.
14.Teplan V. Nefrologie – předoperační příprava. In: Skalická H. Předoperační vyšetření – návody pro praxi. Praha: Grada Publishing 2007;74–85.
15.Druml W, Cano N, Fiaccadori E, Teplan V. Nutritional support in renal disease. In: Basics in clinical nutrition,ed in chief L. Sobotka. Praha: Galén 2019; 422–433.
16. Esposito C, Plati A, Mazzullo T, et al. Renal function and function reserve in healthy elderly individuals. J Nephrol 2007; 20 : 617–625.
17. Fliser D, Franek E, Joest M, et al. Renal function in the elderly: impact of hypertension and cardiac function. Kidney Int 1997; 51 : 1196–1204.
18.Glassock J, Winearls C. Aging and the glomerular filtration rate: thruths and consequences.Trans Am Clin Climatol Assoc 2009; 120 : 419–429.
19. Kotík L. Předoperační vyšetření u nemocných před nekardiálním chirurgickým výkonem. Vnitř Lék 2011; 57(9): 722–727.
20. Drábková J. Starý člověk a zátěž operačního výkonu a kritického stavu. In: Kalvach Z, et al. Gerontologie a geriatrie. Praha Grada Publishing 2004; 382–393.
21. Kotík L. Geriatrický pacient a chirurgie. Vnitřní lékařství 2018; 64(11): 1067–1069.
22. Kubešová H, Weber P, Polcarová V, Meluzinová H. Předoperační vyšetření geriatrického nemocného.Postgraduální medicína 2004; 6 (3): 18–22.
23. Červený R. Předoperační vyšetření pacienta seniora. Geriatria 2006; 2 : 80–82.
24. Havel E.P erioperační nutrice a výživa chirurgických nemocných. In: Szitány P, Těšínský P a kol. Současné trendy v klinické výživě a intenzivní metabolické péči.Praha: IPVZ 2012.
25. Stanga Z, Allison S, Sobotka L. Nutrition in very old patients. In: Basics in clinical nutrition,ed in chief L. Sobotka. Praha: Galén 2019 : 611–628.
26. Ljungquist O, Hubner M, Soop M, Braga M. Perioperative nutrition. In: Basics in clinical nutrition,ed in chief L. Sobotka. Praha: Galén 2019 : 395–402.
27. Chourdakis M, Matos L,Chernesh and Bishoff S. Nutrition support in obese patients. In: Basics in clinical nutrition,ed in chief L. Sobotka. Praha: Galén 2019 : 542–550.
28. Teplan V, a kol. Obezita a ledviny. Praha: Mladá fronta, Aesculap 2018.
29. Vágnerová T. Nová kritéria pro diagnostiku malnutrice – co nám říkají? Geri a Gero 2019; 8(1): 20–26.
30. Zadák Z. Výživa v intenzivní péči. Praha: Grada Publishing 2009.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2020 Issue 1-
All articles in this issue
- Vážení kolegové, milí čtenáři,
- Normokalcemická primární hyperparatyreóza u starších nemocných. Klinické projevy a vývoj laboratorních parametrů
- Redukce nevhodné a neúčelné farmakoterapie – deprescribing
- Metabolický stav a nutrice u seniorů s renálním onemocněním a operační výkon
- Bolesti břicha ve stáří
- Orální zdraví seniorů
- Řešení poruch příjmu potravy u geriatrických pacientů cestou PEG: zkušenosti z Centra následné péče FN Motol
- Vznik prvního standardu ČANT nutriční péče v geriatrii – je důležitá multioborová spolupráce?
- Standard nutriční péče v geriatrii – obecné principy nutriční péče
- Test MM - Standard nutriční péče v geriatrii – obecné principy nutriční péče
- Nárůst počtu seniorů – hrozba, nebo výzva pro současnou medicínu?
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bolesti břicha ve stáří
- Řešení poruch příjmu potravy u geriatrických pacientů cestou PEG: zkušenosti z Centra následné péče FN Motol
- Orální zdraví seniorů
- Normokalcemická primární hyperparatyreóza u starších nemocných. Klinické projevy a vývoj laboratorních parametrů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

