-
Medical journals
- Career
Diagnostika MODY v ordinaci praktického lékaře
Authors: J. Urbanová 1; doc. MUDr. Ludmila Brunerová, Ph.D. 1; J. Brož
Authors‘ workplace: Diabetologické centrum II. interní klinika 3. LF UK a FNKV, Praha Přednosta: prof. MUDr. Michal Kršek, CSc. 1; Interní klinika 2. LF UK a FN Motol, Praha Přednosta: prof. MUDr. Milan Kvapil, CSc., MBA 2
Published in: Prakt. Lék. 2018; 98(4): 153-157
Category: Various Specialization
Overview
Ordinace praktického lékaře je místem, kde je diabetes mellitus diagnostikován velmi pravděpodobně nejčastěji. Pro MODY (Maturity Onset Diabetes of the Young) to platí ještě více vzhledem k jeho charakteristickým vlastnostem, tedy manifestaci obvykle v mladším věku (do 25 let) a většinou mírné hyperglykemii. I přes narůstající povědomí o tomto relativně častém typu diabetu jsou však pacienti při záchytu až v 90 % klasifikováni chybně a zůstávají dlouho či dokonce trvale ukryti pod diagnózou jiného typu diabetu, především 1. a 2. typu. Cílem tohoto článku je shrnout diagnostická kritéria pro MODY a napomoci tak jeho včasné diagnostice, zejména pak u těch pacientů s MODY, jež se skrývají pod již dříve mylně klasifikovaným typem diabetu.
Klíčová slova:
MODY – diagnostika – diferenciální diagnostika
ZÁKLADNÍ CHARAKTERISTIKY MODY
MODY (Maturity Onset Diabetes of the Young) představuje skupinu dědičných typů diabetu, podmíněných mutací v jednom z genů, které se podílejí na vývoji, diferenciaci či funkci β-buněk (1). Ze 14 doposud objevených genů (tab. 1) asociovaných s MODY (2) patří k nejčastěji postiženým: gen kódující enzym glukokinázu (GCK) a geny transkripčních faktorů zvaných hepatocytární nukleární faktory – 1α, vzácněji 4α a 1β (HNF1A, HNF4A a HNF1B) (1). Odhadován je minimálně 1–2% podíl MODY mezi ostatními typy diabetes mellitus (3). Obecně se MODY vyznačuje nástupem diabetu v mladém věku, nezávislostí na inzulinu a autozomálně dominantní dědičností (1). V klinické praxi na MODY proto vždy pomýšlíme u pacientů s nápadnou rodinnou anamnézou diabetu či jiných poruch glukózové homeostázy v linii jednoho z rodičů s časnou manifestací (do 25 let věku). Od diabetiků 1. typu se tito pacienti odlišují zejména dlouhodobě zachovalou endogenní sekrecí inzulinu, negativitou ostrůvkových autoprotilátek a od diabetiků 2. typu chyběním obezity a projevů inzulinové rezistence. Další charakteristické znaky se odvíjejí od konkrétního podtypu MODY (tab. 2).
Table 1. Typy MODY (upraveno podle Urbanová J, Brunerová L, Brož J. Diagnostika MODY – stručný přehled pro klinickou praxi. Vnitř. Lék. 2018; 64(4): 367–374) 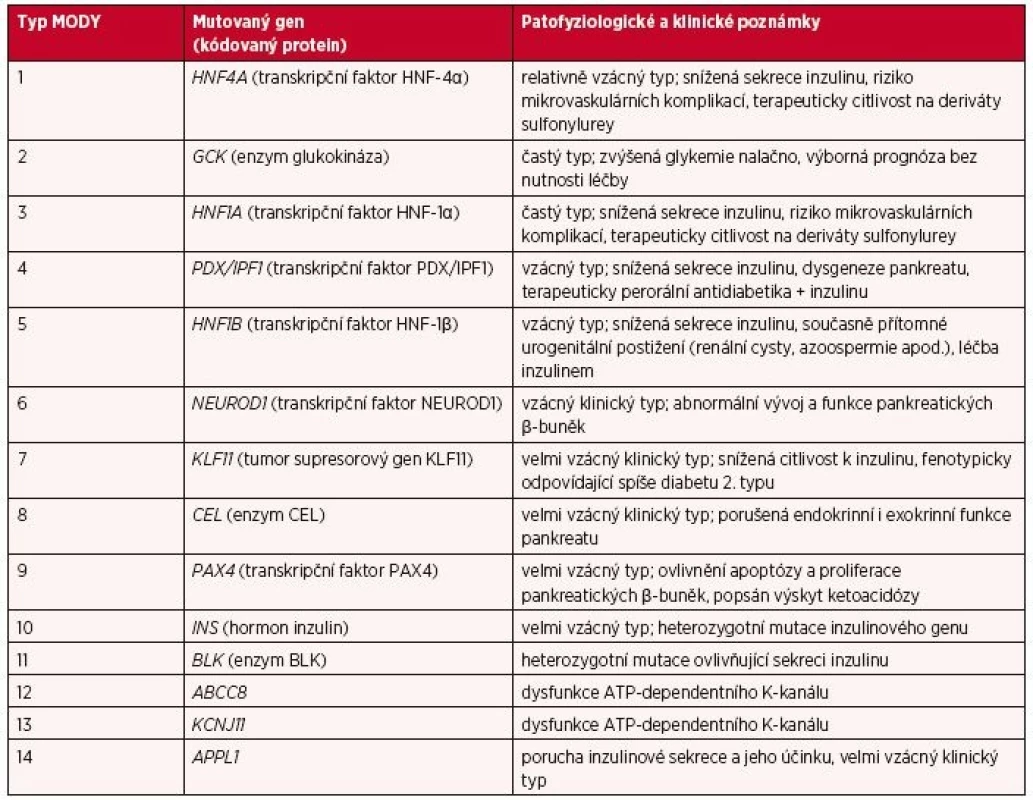
HNF – hepatální nukleární faktor, GCK – glukokináza, PDX1 – pancreatic and duodenal homeobox 1, IPF – insulin promoting factor, NEUROD – neurogenic differentiation, KLF – Krüppel-like factor, CEL – carboxylester lipase, PAX – paired box gene, INS – inzulin, BLK – B-lymfocytic kinase, ABCC8 – ATP -binding cassette, subfamily C, member 8, KCNJ11 – potassium channel, inwardly rectifying, subfamily J, member 11, APPL1 – Adaptor Protein, Phosphotyrosine Interaction, PH domain, and leucine zipper containing 1 Table 2. Klinické a laboratorní znaky čtyř nejčastějších podtypů MODY 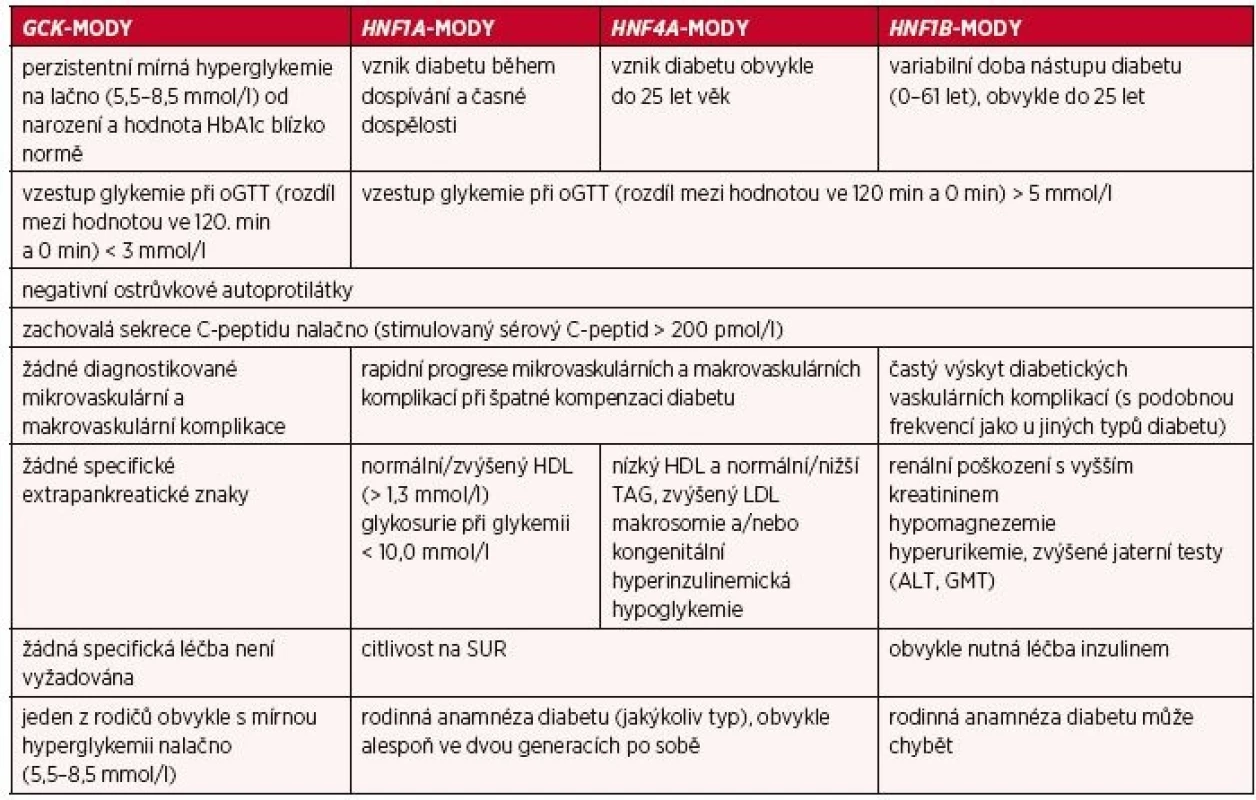
MODY – maturity onset diabetes of the young, GCK – glukokináza, HNF – hepatocytární nukleární faktor, HbA1c – glykovaný hemoglobin, oGTT – oral glukózový toleranční test, HDL – high density lipoprotein, LDL – low density lipoprotein, TAG – triacylglyceremie, ALT – alanine aminotransferáza, GMT – gamma glutamyl transferáza, SUR – deriváty sulfonylurey Přestože povědomí lékařů o MODY jako samostatném a relativně častém podtypu diabetes mellitus (zejména v zemích s možností genetického testování) narůstá, až 90 % pacientů s MODY je nesprávně zařazeno (4) a léčeno nejčastěji pod diagnózou diabetu 1. a 2. typu. Správná diagnóza bývá určena v průměru až o 13 let později (3). Přitom rozpoznání MODY zásadním způsobem mění dosavadní léčbu diabetu, pohled na prognózu a umožňuje predikci a včasný záchyt diabetu u potomků a dalších rodinných příslušníků pacienta.
Cílem článku je představit základní diagnostická kritéria čtyř nejčastějších podtypů MODY a zároveň na základě našich dosavadních zkušeností vyzdvihnout nejpodstatnější znaky, které mohou praktické lékaře na pacienty s MODY upozornit. Stran méně obvyklých podtypů MODY odkazujeme čtenáře v rámci zjednodušení textu na další zdroje (2).
CHARAKTERISTIKY NEJČASTĚJŠÍCH PODTYPŮ MODY
GCK-MODY
Mutace v genu pro glukokinázu způsobuje vzestup prahové hodnoty pro spuštění inzulinové sekrece (5). GCK-MODY je proto charakterizovaný perzistentní (od narození trvající) mírnou hyperglykemií nalačno (obvykle mezi 5,5 až8 mmol/l), která v dlouhodobém horizontu nevede k rozvoji vaskulárních diabetických komplikací (6), a proto (s výjimkou v období těhotenství) nevyžaduje žádnou specifickou antidiabetickou léčbu (7).
GCK-MODY zvažujeme zejména u pacientů, u nichž:
- a) byla často jen náhodně (např. v rámci screeningového vyšetření) diagnostikována asymptomatická hyperglykemie nalačno (obvykle do 8 mmol/l) a nevelká hodnota glykovaného hemoglobinu (HbA1c) (v 97 % případů do 56 mmol/mol u mladších 40 let a do 60 mmol/mol u starších 40 let (6))
- b) se glykemická porucha navzdory antidiabetické terapii v průběhu let víceméně nemění (8) – glykemie nalačno nepřesahuje 8 mmol/l a HbA1c se stabilně pohybuje mezi 38 a 60 mmol/mol
- c) i po mnoha letech trvání diabetu nezjistíme žádné chronické diabetické komplikace (6)
- d) je diabetes přítomen též u jednoho z rodičů (v situaci, kdy glykemie nalačno u rodičů doposud nebyla vyšetřena a rodinná anamnéza diabetu je negativní, zvažujeme v případě silného podezření na GCK-MODY vyšetření glykemie nalačno anebo HbA1c u obou rodičů (9))
Na možnost GCK-MODY skrývající se pod diagnózou diabetu 1. typu může (mimo výše uvedeného) upozorňovat též po mnoho let zachovalá endogenní inzulinová sekrece (měřitelnost C-peptidu nalačno i po stimulaci) a potřeba relativně nízkých dávek inzulinu. V případě chybně vedené diagnózy prediabetu a diabetu 2. typu může na GCK-MODY poukazovat neobézní habitus, jen malé ovlivnění hyperglykemie perorálními antidiabetiky (např. metforminem), relativně nízká postprandiální glykemie (při provedení orálního glukózového tolerančního testu (oGTT) dochází u 71 % pacientů nesoucích GCK mutaci k méně než 3 mmol/l vzestupu glykemie ve 120. minutě v porovnání s glykemií nalačno (10)), nepřítomnost vaskulárních diabetických komplikací a chybění syndromu inzulinové rezistence. Po potvrzení GCK-MODY molekulárně genetickým vyšetřením je možné úplně ukončit jakoukoliv stávající antidiabetickou terapii (7).
HNF1A-MODY, HNF4A-MODY
HNF1A-MODY a HNF4A-MODY charakterizuje postupné kvantitativní i kvalitativní zhoršování inzulinové sekrece, jež obvykle v průběhu dospívání či časné dospělosti vede nejprve k hyperglykemii po jídle, později též nalačno (1, 8). Diabetes lze velice dobře léčit deriváty sulfonylurey (SUR) (11). V případě špatné kontroly diabetu hrozí rapidní progrese vaskulárních komplikací (12).
Neakutní manifestace diabetu klasickými symptomy hyperglykemie u mladého, štíhlého pacienta s rozsáhlou anamnézou poruch glukózové homeostázy v rodině typicky poukazuje na možnost HNF1A-MODY a HNF4A-MODY. Klíčovým diskriminačním znakem MODY od diabetu 1. typu je chybění diabetické ketoacidózy (DKA) v době manifestace diabetu a negativita ostrůvkových autoprotilátek, po uplynutí tzv. honeymoon období (3–5 let od diagnostiky diabetu) stále měřitelná hladina C-peptidu na lačno (8, 13), dále pak poměrně nízká celková denní potřeba inzulinu (podle studie u pa-cientů s HNF1A-MODY obvykle do 0,3 j/kg, přičemž 30 % tvoří bazální inzulin (14)), chybění DKA při vynechání inzulinu (15) a velmi rychlá akcelerace vzniku diabetických vaskulárních komplikací v případě nedostatečné kompenzace diabetu (12). Pomocnými biomarkery diagnostiky HNF1A-MODY jsou glykosurie při relativně nízké glykemii (8) a výrazně snížená plazmatická hladina vysoce senzitivního C-reaktivního proteinu (16).
Od diabetiků 2. typu se jedinci s HNF1A-MODY odlišují nižším BMI (body mass index), nižší prevalencí hypertenze, nižší triacylglycerolemií (17) a normální či vyšší hodnotou HDL (tj. > 1,3 mmol/l) (18), popřípadě též dlouhodobě zachovalou citlivostí na SUR (v monoterapii nebo v kombinaci s metforminem) (14). U HNF4A-MODY naopak vyšší LDL a nižší HDL v séru připomíná klasický lipidogram diabetiků 2. typu (19). V některých případech diagnostiku HNF4A-MODY usnadňuje osobní anamnéza vyšší porodní hmotnosti (v průměru o 790 g), makrosomie (56 % případů) a transientní neonatální hyper-inzulinemické hypoglykemie (15 % jedinců) (20).
U pacientů s molekulárně geneticky potvrzenou diagnózou těchto podtypů MODY se lze pokusit o přechod ze stávající antidiabetické terapie na perorální léčbu SUR (11).
HNF1B-MODY
Na HNF1B-MODY upozorňuje současná přítomnost diabetu a abnormální struktury či funkce ledvin (cystická dysplazie ledvin, prosté renální cysty, malformace ledvin – podkovovitá ledvina, ageneze ledviny, nediabetická renální insuficience apod.) anebo urogenitálního traktu (kryptorchismus, anomálie uteru, ovarií apod.) (21), jejichž diagnostika většinou předchází vzniku a zjištění diabetu (22). Glykemickou poruchu provází též inzulinová rezistence (hyperurikemie, nízká plazmatická hladina HDL, vyšší triacylglycerolemie či elevace jaterních enzymů) (22), avšak na rozdíl od diabetiků 2. typu také hypomagnezemie (23), anamnéza nízké porodní hmotnosti (přibližně o 800 g) a transientního neonatálního diabetu (21).
PROBLÉMY V DIFERENCIÁLNÍ DIAGNOSTICE
Navzdory typickému klinickému obrazu MODY (tab. 2) představuje identifikace hrstky jedinců s MODY mezi ostatními pacienty s daleko běžnějšími typy diabetu nelehký úkol, neboť reálná klinická prezentace MODY může být velice různorodá a s projevy obvyklejších typů diabetu se překrývat (24). Podle nejnovějších poznatků tak může dojít k manifestaci MODY daleko později než tradičně do věku 25 let (25–28) a lze jej diagnostikovat také u pacientů s negativní rodinou anamnézou diabetu (29) (v případě HNF1B-MODY dokonce u více než poloviny případů (21), nadváhou či obezitou a inzulinovou rezistencí (24) nebo přítomností specifických ostrůvkových autoprotilátek (30, 31) a anamnézy DKA (32).
Navzdory příznačným charakteristikám MODY, jakými jsou vznik diabetu do 25 let, nezávislost na inzulinu a vícegenerační výskyt diabetu v linii jednoho z rodičů, je třeba mít na paměti, že vzhledem k rozmanitému klinickému obrazu MODY tyto tradiční znaky samy o sobě k odhalení, resp. diagnostice MODY, stačit nemusí. Nověji je doporučováno provedení molekulárně genetického testování u všech diabetických pacientů, diagnostikovaných do 30 let věku, jež mají nejméně za 3 roky od diagnózy zachovalou inzulinovou sekreci (tj. měřitelný C-peptid) bez ohledu na rodinnou anamnézu diabetu, stav autoimunity a přítomnost inzulinové rezistence (13).
ZÁVĚR
Čas věnovaný diferenciální diagnostice MODY v rámci rutinní klinické praxe má pro pacienta obrovský význam, neboť v případě správné identifikace MODY zásadním způsobem mění strategii vedení léčby diabetu (úplné ukončení antidiabetické terapie u GCK-MODY či případné převedení inzulinoterapie na perorální léčbu SUR u HNF1A-MODY a HNF4A-MODY) a pohled na riziko vzniku a progrese diabetických komplikací (prakticky nulové u GCK-MODY a naopak rapidní progrese při špatné kompenzaci HNF1A-MODY a HNF4A-MODY). Možnost genetického poradenství, včasný screening diabetu u potomků a rodinných příslušníků pacienta představují další benefity správného stanovení MODY. Z těchto důvodů by se měl lékař nad možností MODY zamyslet nejen u každého nového pacienta s diabetem, ale též alespoň jednou i u již diagnostikovaných a pod jinými typy klasifikovaných pacientů, u nichž diabetes kategoricky zcela nezapadá do obrazu diabetu 1. a 2. typu.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
MUDr. Jana Urbanová, Ph.D.
II. interní klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
e-mail: urbja@seznam.cz
Sources
1. Fajans SS, Bell GI. MODY: history, genetics, pathophysiology, and clinical decision making. Diabetes Care 2011; 34 : 1878–1884.
2. Online Mendelian Inheritance in Man. Maturity-onset diabetes of the young; MODY [online]. Dostupné z: https://www.omim.org/entry/606391 [cit. 6-6-2018].
3. Shields BM, Hicks S, Shepherd MH, et al. Maturity-onset diabetes of the young (MODY): how many cases are we missing? Diabetologia 2010; 53(12): 2504–2508.
4. Shepherd M, Miles S, Jones J, et al. Differential diagnosis: Identifying people with monogenic diabetes. J Diabetes Nurs 2010; 14(9): 342–347.
5. Byrne MM, Sturis J, Clement K, et al. Insulin secretory abnormalities in subjects with hyperglycemia due to glucokinase mutations. J Clin Invest 1994; 93(3): 1120–1130.
6. Steele AM, Wensley KJ, Ellard S, et al. Use of HbA1c in the identification of patients with hyperglycaemia caused by a glucokinase mutation: observational case control studies. PLoS One 2013; 8: e65326.
7. Stride A, Shields B, Gill-Carey O, et al. Cross-sectional and longitudinal studies suggest pharmacological treatment used in patients with glucokinase mutations does not alter glycaemia. Diabetologia 2014; 57(1): 54–56.
8. Ellard S, Bellanné-Chantelot C, Hattersley AT, European Molecular Genetics Quality Network (EMQN) MODY group. Best practice guidelines for the molecular genetic diagnosis of maturity-onset diabetes of the young. Diabetologia 2008; 51(4): 546–553.
9. Chakera AJ, Steele AM, Gloyn AL, et al. Recognition and management of individuals with hyperglycemia because of a heterozygous glucokinase mutation. Diabetes Care 2015; 38(7): 1383–1392.
10. Stride A, Vaxillaire M, Tuomi T, et al. The genetic abnormality in the beta cell determines the response to an oral glucose load. Diabetologia 2002; 45(3): 427–435.
11. Pearson ER, Liddell WG, Shepherd M, et al. Sensitivity to sulphonylureas in patients with hepatocyte nuclear factor-1alpha gene mutations: evidence for pharmacogenetics in diabetes. Diab Med 2000; 17(7): 543–545.
12. Isomaa B, Henricsson M, Lehto M, et al. Chronic diabetic complications in patients with MODY3 diabetes. Diabetologia 1998; 41(4): 467–473.
13. Shields BM, Shepherd M, Hudson M, et al. Population-based assessment of a biomarker-based screening pathway to aid diagnosis of monogenic diabetes in young-onset patients. Diabetes Care 2017; 40(8): 1017–1025.
14. Grzanka M, Matejko B, Szopa M, et al. Assessment of newly proposed clinical criteria to identify HNF1A MODY in patients with an initial diagnosis of type 1 or type 2 diabetes mellitus. Adv Med 2016; 2016 : 4243784.
15. Slingerland AS. Monogenic diabetes in children and young adults: challenges for researcher, clinician and patient. Rev Endocr Metab Disord 2006; 7 : 171–185.
16. McDonald TJ, Shields BM, Lawry J, et al. High-sensitivity CRP discriminates HNF1A-MODY from other subtypes of diabetes. Diabetes Care 2011; 34(8): 1860–1862.
17. Owen KR, Shepherd M, Stride A, et al. Heterogeneity in young adult onset aetiology alters clinical characteristics. Diabet Med 2002; 19(9): 758–761.
18. McDonald TJ, McEneny J, Pearson ER, et al. Lipoprotein composition in HNF1A-MODY: Differentiating between HNF1A-MODY and Type 2 diabetes. Clin Chim Acta 2012, 413(9–10): 927–932.
19. Murphy R, Ellard S, Hattersley AT. Clinical implications of a molecular genetic classification of monogenic β-cell diabetes. Nat Clin Pract Endocrinol Metab 2008; 4(4): 200–213.
20. Pearson ER, Boj SF, Steele AM, et al. Macrosomia and hyperinsulinaemic hypoglycaemia in patients with heterozygous mutations in the HNF4A gene. PLoS Med 2007; 4(4): e118.
21. Edghill EL, Bingham C, Slingerland AS, et al. Hepatocyte nuclear factor-1 beta mutations cause neonatal diabetes and intrauterine growth retardation: support for a critical role of HNF-1beta in human pancreatic development. Diabet Med 2006; 23(12): 1301–1306.
22. Chen YZ, Gao Q, Zhao XZ, et al. Systematic review of TCF2 anomalies in renal cysts and diabetes syndrome/maturity onset diabetes of the young type 5. Chin Med J (Engl). 2010; 123(22): 3326–3333.
23. Adalat S, Woolf AS, Johnstone KA, et al. HNF1B mutations associate with hypomagnesemia and renal magnesium wasting. J Am Soc Nephrol 2009; 20(5): 1123–1131.
24. Thanabalasingham G, Pal A, Selwood MP, et al. Systematic assessment of etiology in adults with a clinical diagnosis of young-onset type 2 diabetes is a successful strategy for identifying maturity-onset diabetes of the young. Diabetes Care 2012; 35(6): 1206–1212.
25. Bellanné-Chantelot C, Carette C, Riveline JP, et al. The type and the position of HNF1A mutation modulate age at diagnosis of diabetes in patients with maturity-onset diabetes of the young (MODY)-3. Diabetes 2008; 57(2): 503–508.
26. Lango Allen H, Johansson S, Ellard S et al. Polygenic risk variants for type 2 diabetes susceptibility modify age at diagnosis in monogenic HNF1A diabetes. Diabetes 2010; 59(1): 266–271.
27. Stride A, Shepherd M, Frayling TM, et al. Intrauterine hyperglycemia is associated with an earlier diagnosis of diabetes in HNF-1α gene mutation carriers. Diabetes Care 2002; 25 : 2287–2291.
28. Klupa T, Warram JH, Antonellis A, et al. Determinants of the development of diabetes (maturity-onset diabetes of the young-3) in carriers of HNF-1α mutations: evidence for parent-of-origin effect. Diabetes Care 2002; 25(12): 2292–2301.
29. Stanik J, Dusatkova P, Cinek O, et al. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia 2014; 57(3): 480–484.
30. Schober E, Rami B, Grabert M, et al. Phenotypical aspects of maturity-onset diabetes of the young (MODY diabetes) in comparison with Type 2 diabetes mellitus (T2DM) in children and adolescents: experience from a large multicenter database. Diabet Med 2009; 26(5): 466–473.
31. Urbanová J, Rypáčková B, Procházková Z, et al. Positivity for islet cell autoantibodies in patients with monogenic diabetes is associated with later diabetes onset and higher HbA1c level. Diabet Med 2014; 31(4): 466–471.
32. Průhová Š, Dušátková P, Neumann D, et al. Two cases of diabetic ketoacidosis in HNF1A-MODY linked to severe dehydration: is it time to change the diagnostic criteria for MODY? Diabetes Care 2013; 36(9): 2573–2574
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2018 Issue 4-
All articles in this issue
- Endometrióza a její vliv na plodnost a kvalitu života
- Diagnostika MODY v ordinaci praktického lékaře
- Význam chůze jako nejpřirozenější pohybové aktivity v životním stylu člověka
- Zobrazovací metody v těhotenství – indikace a kontraindikace a použití kontrastních látek
- Vplyv záťaže opatrovateľa na rodinné vzťahy
- Rizika importovaných nákaz pro obyvatele České republiky
- Zdravotní gramotnost seniorů
- Invalidním důchodem proti sociálnímu stresu?
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza a její vliv na plodnost a kvalitu života
- Zobrazovací metody v těhotenství – indikace a kontraindikace a použití kontrastních látek
- Invalidním důchodem proti sociálnímu stresu?
- Význam chůze jako nejpřirozenější pohybové aktivity v životním stylu člověka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

