-
Medical journals
- Career
Přehled dotazníků a škál hodnotících kvalitu života a non-motorické příznaky pacientů s Parkinsonovou nemocí
Authors: R. Kozáková; R. Bužgová
Authors‘ workplace: Ostravská univerzita v Ostravě, Lékařská fakulta, Ústav ošetřovatelství a porodní asistence Vedoucí: prof. PhDr. Darja Jarošová, Ph. D.
Published in: Prakt. Lék. 2018; 98(2): 59-64
Category: Of different specialties
Overview
U pacientů s Parkinsonovou nemocí (PN) je vhodné z důvodu rychlé progrese a specifickým příznakům nemoci poskytování multidisciplinární péče, jejímž cílem je udržení co nejlepší kvality života pacienta i jeho rodiny. V zahraničí jsou využívány dotazníky a škály k hodnocení stavu pacienta, zjišťování progrese nemoci a následnému zajištění individualizované péče. Cílem tohoto přehledového článku je popsat a analyzovat škály používané při hodnocení pacientů s PN v oblasti kvality života a non-motorických příznaků. Vyhledáváním v elektronických databázích bylo nalezeno osm specifických škál k hodnocení kvality života u pacientů s PN a dvě škály pro komplexní zhodnocení non-motorických symptomů u pacientů s PN. Všechny oblasti péče nejlépe pokrývá dotazník PDQ-39 (Parkinson’s Disease Questionnaire) určený pro hodnocení kvality života. Využití této škály je doporučováno v klinické praxi i ve výzkumu. Pro hodnocení non-motorických příznaků je nejčastěji využívána škála NMSQuest (Non-Motor Symptom Questionare) a NMSS (Non-Motor Symptom Scale).
Klíčová slova:
Parkinsonova nemoc – dotazníky – kvalita života – škály, non-motorickéÚVOD
Parkinsonova nemoc (PN) je poměrně časté neurodegenerativní onemocnění postihující více než 10 milionů lidí na celém světě (50). Dle údajů Národní datové základny paliativní péče ČR (UZIS) se PN řadí mezi druhou nejčastější příčinu úmrtí na neurodegenerativní onemocnění (45).
Kromě typických motorických příznaků (bradykineze, rigidita, klidový třes a posturální nestabilita) se PN projevuje také širokým spektrem non-motorických příznaků, které přispívají k významné morbiditě a invaliditě nemocného (21). Kvalitu života pacientů s PN, a to zejména v pozdních stadiích onemocnění, ovlivňují především tyto non-motorické příznaky: deprese, úzkost, kognitivní pokles, bolest, únava, nespavost a autonomní dysfunkce (zácpa, potíže s močením) (41, 44). Přestože je jejich výskyt poměrně častý, jsou v klinické praxi mnohdy nerozpoznány. Hlavním důvodem je nejen nedostatek spontánních stížností od pacientů, ale také absence systematického dotazování ze strany zdravotníků (3, 14). Je proto důležité identifikovat ty non-motorické symptomy, které nejvíce ovlivňují kvalitu života pacienta, přestože nemusí být během klinického vyšetření patrné (16, 19, 31, 34).
Motorické komplikace a výskyt non-motorických příznaků spolu úzce souvisí, např. zhoršení motoriky má negativní vliv na psychosociální pohodu pacientů a zvyšují jejich závislost na pomoci jiných při aktivitách denního života a sociální stigma. Vyúsťují do výrazného snížení kvality života pacientů, jejich rodiny a blízkých (11). Pro udržení kvality života pacienta je nutné jednotlivé příznaky nemoci opakovaně hodnotit v jednotlivých fázích nemoci z důvodu plánování vhodných intervencí multidisciplinárním týmem. Pro hodnocení kvality života a non-motorických příznaků jsou v zahraničí využívány různé škály i dotazníky, a to jak v klinické praxi, tak ve výzkumu. Vzhledem k příznakům a průběhu nemoci je vhodný multidisciplinární přístup s cílem optimalizovat kvalitu života pacienta i jeho rodiny od sdělení diagnózy až po smrt (23). Použití škál u pacientů s PN může pomoci multidisciplinárnímu týmu zhodnotit aktuální problémy pacienta a pomoci zajistit adekvátní, individualizovanou péči.
Cílem tohoto přehledového článku je popsat škály používané při hodnocení pacientů s PN v oblasti kvality života a non-motorických příznaků. Na základě tohoto přehledu budou vybrány vhodné škály, které budou v rámci projektu AZV MZ ČR č. 17-29447A s názvem „Neuropaliativní a rehabilitační přístup pro zachování kvality života pacientů v pokročilé fázi vybraných neurologických onemocnění“ validovány pro české prostředí.
METODIKA
Škály a dotazníky využívané při hodnocení pacientů s PN byly vyhledávány v elektronických databázích: Medline, Scopus, Proquest Public Health a Web of Knowledge (období 1965–2017). Klíčová slova pro vyhledávání byla následující: parkinsons disorders, scale, assessment, patient needs, measures, instrument, questionnaire, needs assessment, quality of life, non-motor. Do přehledu byly zařazeny škály splňující tato kritéria: Byla hodnocena reliabilita a validita, využití škály u pacientů s PN v různém prostředí péče. V přehledu škál je uvedena vnitřní konzistence, která vyjadřuje schopnost testu poskytovat shodné výsledky při opakování studií podobného charakteru. Celkem bylo nalezeno osm specifických škál určených k hodnocení kvality života pa-cientů a dvě škály pro komplexní zhodnocení non-motorických symptomů u pacientů s PN.
VÝSLEDKY A DISKUZE
Přehled specifických škál hodnotících kvalitu života a non-motorické symptomy u pacientů s PN je uveden v tabulce 1.
Table 1. Přehled škál hodnotících kvalitu života a non-motorické příznaky pacientů s PN 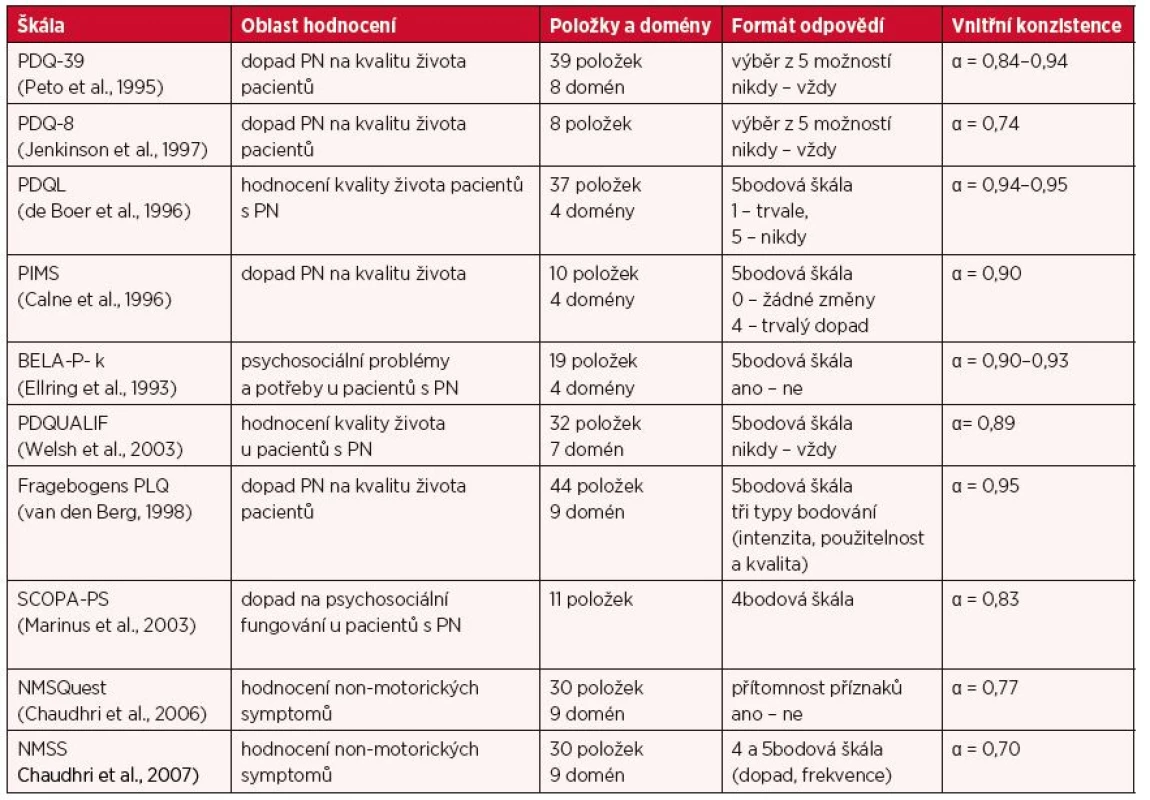
PDQ – Parkinson’s Disease Questionnaire, PDQL - Parkins-on’s Disease Quality of Life Questionnaire, PIMS - Parkinson’s Impact Scale, BELA-P-k – Belastungsfragebogen Parkinson kurzversion, PDQUALIF – Parkinson’s Disease Quality of Life scale, PLQ – Fragebogen Parkinson Lebens Qualität, SCOPA-PS – Scales for Outcomes in Parkinson’s disease – Psychosocial, NMSQuest – Non-Motor Symptoms Questionare, NMSS – Non-Motor Symptoms Scale Škály hodnotící kvalitu života pacientů
Nejznámějším a nejpoužívanějším dotazníkem k hodnocení kvality života pacientů s PN patří dotazník PDQ-39 (Parkinson’s Disease Questionnaire) (37). Zahrnuje 39 otázek sdružených do osmi domén: mobilita (deset položek), každodenní život (šest položek), emoce (šest položek), stigma (čtyři položky), komunikace (tři položky) a tělesné nepohodlí (tři položky). Respondenti vybírají z pěti možných variant odpovědí (nikdy, občas, někdy, často a vždy). Doba potřebná k vyplnění je 30 minut. Autoři vytvořili také zkrácenou verzi dotazníku PDQ-8 (24), která obsahuje pouze osm otázek, kdy každá otázka zahrnuje jednu doménu.
Podobně kvalitu života u pacientů s PN lze hodnotit dotazníkem PDQL (Parkinson’s Disease Quality of Life Questionnaire) (8). Tato stupnice má 37 položek, sdružených do čtyř domén: parkinsonské příznaky (14 položek), systémové příznaky (sedm položek), sociální funkce (sedm položek) a emoční funkce (devět položek). Existuje několik variant odpovědí: nikdy, občas, někdy, často a vždy.
V roce 1996 Calne et al. (6) vyvinuli stupnici PIMS (Parkinson’s Impact Scale), která hodnotí dopad PN z hlediska deseti aspektů života v oblasti emocionální, sociální a ekonomické. Jedná se o: 1. fenomén pozitivní sebeúcty (sebeúcta, štěstí, optimismus), 2. sebehodnocení negativních účinků (úroveň stresu, úzkost nebo deprese), 3. rodinné vztahy, 4. životní prostředí, 5. práce, 6. odchod z domova (pro práci, setkání atd.), 7. volný čas a rekreace, 8. bezpečnost (vyhýbání se zranění), 9. finanční jistota, 10. pohlaví. Jednotlivé aspekty jsou sdruženy do čtyř domén. Skóre položek dosahuje hodnot od 0 (žádná změna) do 4 (těžké). Nižší skóre ukazuje menší dopad PN na nemocného.
Další škálou k hodnocení kvality života u PN je PDQUALIF (Parkinson’s Disease Quality of Life scale) (48). Škála je sestavena z 33 položek pokrývajících osm domén: funkce a role ve společnosti, sebeobraz, sexualita, spánek, pohled na svět, tělesná zdatnost, nezávislost, funkce moči a globální hodnocení kvality života (HRQoL). Hodnotí se na pětibodové Likertově škále a konečný výsledek se pohybuje v rozmezí od 0 do 128 bodů, přičemž vyšší skóre udává horší celkovou kvalitu života.
Dotazník BELA-P-k (Belastungsfragebogen Parkinson kurz-version) byl vyvinut Max - Planck Institute v Mnichově jako součást standardizovaného psychologického rutinního testu pro pacienty s PN (10). BELA-P-k se skládá z 19 položek seskupených do čtyř subškál: 1. fyzické symptomy (otázky 1 až 5), 2. emoční symptomy (otázky 6 až 9), 3. sociální fungování (otázky 10 až 14), 4. partnerská vazba/rodina (otázky 15 až 19). Každá otázka má za cíl zkoumat konkrétní aspekty. Za prvé, přítomnost určitého problému, který je hodnocen dichotomickou hodnotou (ano nebo ne). U každého zvýrazněného problému musí pacient popsat: 1. vnímané nepohodlí spojené s tímto problémem a 2. možnou ztrátu osobní autonomie v důsledku tohoto problému. Oba tyto aspekty jsou hodnoceny na pětibodové Likertově škále.
Škála PLQ (Fragebogen Parkinson Lebens Qualität) navržená Bergem (47) obsahuje 44 položek, rozložených do devíti domén: deprese (pět položek), fyzický výkon (pět položek), koncentrace (čtyři položky), volný čas (pět položek), neklid (čtyři položky), omezení aktivity (šest položek), nejistota (pět položek), sociální integrace (pět položek) a úzkost (pět položek). Každá položka má skóre od 1 do 5. Vyšší skóre odráží horší HRQoL.
SCOPA-PS je nástrojem, který hodnotí dopad chronické progresivní nemoci na psychosociální fungování pacientů. Hodnotí potíže nemocného v posledním měsíci v práci, s domácími pracemi a v jiných úkolech. Obsahuje jedenáct položek s možným rozsahem 0 až 33 bodů. Každá položka se hodnotí od 0 do 3. Vyšší skóre odráží horší psychosociální fungování.
Škály hodnotící non-motorické příznaky
V současné době se v klinické praxi využívají následující škály ke komplexnímu zhodnocení non-motorických příznaků.
NMSQuest (Non-Motor Symptoms Questionare) (16) je 30položková škála určená k hodnocení non-motorických symptomů sdružených do devíti domén. Tyto domény jsou: gastrointestinální (osm položek), močové (dvě položky), sexuální (dvě položky), kardiovaskulární (dvě položky), apatie/pozornost/paměť (tři položky), halucinace/bludy (dvě položky), deprese/úzkost/anhedonie (dvě položky), spánek/únava (pět položek), bolest (jedna položka) a jiné příznaky (tři položky). Tato škála hodnotí přítomnost či nepřítomnost symptomů (možné odpovědi jsou ano a ne).
V roce 2007 byla vyvinuta škála NMSS (Non-Motor Symptoms Scale) (18), která hodnotí závažnost a frekvenci výskytů jednotlivých příznaků. Má 30 položek seskupených do devíti domén (kardiovaskulární, spánek/únava, nálada/apatie, percepčníproblémy/halucinace, pozornost/paměť, gastrointestinální, močové, sexuální dysfunkce a jiné příznaky). U jednotlivých položek se hodnotí jednak závažnost (0 až 3), tak i intenzita (1 až 4) příznaků. Maximální skóre, kterého lze dosáhnout je 360 bodů.
Jinou škálou hodnotící non-motorické aspekty denního života PN je první část MDS-UPDRS (Movement Unified Parkinson’s Disease Rating Scale) (15). Tato část škály se sestává z 13 položek, z toho je šest položek koncipovaných ve formě semistrukturovaného rozhovoru, které aplikuje vyšetřující a sedm položek je koncipovaných jako sebehodnotící dotazník, který vyplňuje pacient nebo jeho pečovatel. Tyto příznaky jsou rozděleny do následujících kategorií: neuropsychiatrické, kognitivní, autonomní a spánková dysfunkce.
Dalšími široce využívanými instrumenty pro upřesnění potíží pacientů s PN jsou škály SCOPA (Scales for Outcomes in Parkinson’s disease). Jednotlivé škály budou popsány níže v textu. Kognitivní funkce hodnotí SCOPA-COG, potíže se spánkem SCOPA-SLEEP. SCOPA-AUT se zaměřuje na posouzení autonomních dysfunkcí u pacientů s PN, které mají vliv na každodenní fungování a kvalitu života a SCOPA-DC (Scales for Outcomes in Parkinson’s disease – diary card) je vedena deníkovou formou, kdy po dobu 3 dnů jsou zaznamenávány potíže motorické, ale také týkající se spánku.
Hodnocení vybraných non-motorických příznaků
Deprese se může vyskytovat v kterékoliv fázi nemoci. Prevalence deprese u PN se odhaduje až u 40–60 % pacientů (38, 46). Pro hodnocení deprese u pacientů s PN se využívají dotazníky určené pro širší skupinu pacientů, jako je BDI (Beck Depression Inventory), HAM-D (Hamilton Rating Scale for Depression), HADS (Hospital Anxiety and Depression Scale), SDS (Zung Self-Rating Depression Scale), GDS (Geriatric Depression Scale) nebo MADRS (Montgomery-Asberg Depression Rating Scale).
Úzkost se u pacientů s PN se vyskytuje 2krát častěji v porovnání s běžnou populací. Rizikovými faktory pro vznik úzkostné poruchy jsou ženské pohlaví, mladší věk, výskyt motorických fluktuací a předchozí anamnéza úzkostných poruch (27). Současně je úzkost rizikovým faktorem výskytu deprese. Navíc úzkost může zhoršit i další parkinsonské příznaky – jak kognitivní, tak i motorické. Pro hodnocení úzkosti u pacientů s PN byla vytvořena specifická 12položková škála PAS (Parkinson Anxiety Scale) (28). Obsahuje tři subškály: přetrvávající úzkost (pět položek), epizodická úzkost (čtyři položky) a vyhýbavé chování (tři položky). Pro hodnocení úzkosti lze použít také dotazníky určené pro širší skupinu pacientů jako je HARS (Hamilton Anxiety Rating Scale), GAI (Geriatric Anxiety Inventory) nebo BAI (Beck Anxiety Inventory).
Apatie je definována ztrátou motivace, která se objevuje v emocionálních a intelektuálních činnostech a chování. Tento neuropsychiatrický příznak se vyskytuje s prevalencí u 30–40 % pacientů (43). Je jedním z hlavních determinantů snížené kvality života u PN (2), dokonce i v raných stadiích. V roce 2006 byla vyvinuta škála LARS (Lille Apathy Rating Scale) (43) pro pacienty s PN. Obsahuje 33 položek sdružených do devíti domén. Rozsah skóre se pohybuje mezi –36 a +36, což je nejvyšší skóre odpovídající vyššímu stupni apatie. V klinických studiích je často používanou škálou také AES (Apathy Evaluation Scale) nebo AS (Apathy Scale).
Poruchy kontroly impulzů (ICD) jsou skupinou psychiatrických poruch, jejichž podstatou je neschopnost odolat impulzu nebo pokušení provést nějaký čin škodlivý pro sebe nebo pro ostatní. U PN se jedná zejména o patologické hráčství, nakupování, přejídání se a hypersexualitu. Pro zhodnocení poruch kontroly impulzů u pacientů s PN byl vyvinut dotazník QUIP (Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease) (49). Zahrnuje 30 otázek a jeho zkrácená verze – QUIP-S, obsahuje pouze 13 otázek.
Zhoršené kognitivní funkce jsou pozorovány až u 26 % pacientů s PN (1). Kognitivní poruchy mírného stupně jsou časté již v časné fázi onemocnění (9, 39, 40) a mohou progredovat do demence u 20–40 % pacientů (5). Rozvoj demence u PN snižuje kvalitu života, zvyšuje stres pečovatele, zkracuje dobu setrvání pacienta v kruhu rodiny a urychluje jeho umístění do ústavní péče (42). Kognitivní funkce lze hodnotit škálou SCOPA-COG (30), která má deset položek rozdělených do čtyř domén (paměť, pozornost, exekutivní a zrakově-prostorové funkce) a její výsledné skóre se pohybuje v rozmezí od 0 do 43 bodů. Administrace trvá asi 15 minut. Jiným specifickým dotazníkem je PD-CRS (Parkinsonas Disease-Cognitive Rating Scale). Jedná se o 30položkovou screeningovou baterii, která zahrnuje subtesty k posuzování kortikálních a subkortikálních funkcí u pacientů s PN (35). Jednotlivé domény jsou: verbální paměť, pozornost, pracovní paměť, pojmenování, vizuokonstrukční schopnosti a verbální fluence. Celkové skóre je 30 bodů. Průměrná délka vyplnění škály je 20 minut. Dále by bylo možné použít následující testy: MMSE (Mini Mental State Examination), MoCA, (Montreal Cognitive Assessment) nebo PANDA (Parkinson Neuropsychometric dementia Assessment).
Únava je jedním z nejčastějších non-motorických příznaků PN (34). Pro hodnocení únavy u pacientů s PN byla vytvořena specifická 16položková škála PFS (Parkinson Fatigue Scale) (4), která hodnotí přítomnost únavy (sedm položek) a dopad únavy na každodenní fungování pacienta (devět položek). Celkové skóre škály je od 16 do 80 bodů. K dalším často používaným škálám se řadí FSS (Fatigue Severity Scale), MFIS (Modified Impact Scale Impact), FAI (Fatigue Assessment Inventory), FACIT-F (Functional Assessment of Chronic Illness Therapy-Fatigue), MFI (Multidimensional Fatigue Inventory), FSI (Fatigue Severity Inventory) nebo D-FIS (Fatigue Impact Scale for Daily Use).
Psychotické příznaky (halucinace, ztráta vhledu a bludy) postihují řadu pacientů s PN (3, 12). Výskyt komplexních vizuálních halucinací se pohybuje od 22 do 38 % (13). Rizikovými faktory pro vznik halucinací jsou starší věk, dlouhá doba onemocnění, kognitivní poruchy, závažnost symptomů PN, poruchy spánku (ospalost) a zrakové poruchy (13). Halucinace musí být identifikovány systematickým dotazováním pacienta. V roce 2012 vyvinuli výzkumníci specifickou škálu SEND-PD (Scale for Evaluation of Neuropsychiatric Disorders in Parkinson’s Disease) k posouzení závažnosti neuropsychiatrických symptomů u PN (32). Jedná se o 12položkovou škálu sdruženou do tří domén: psychotické symptomy, nálada/apatie a poruchy kontroly impulzů. Ve výzkumu je hojně užívanou škálou NPI (The Neuropsychiatric Inventory) (7), která posuzuje deset neuropsychiatrických domén: bludy, halucinace, agitovanost, deprese, úzkost, euforie, apatie, dezinhibace, podrážděnost a aberantní chování motorů. Další dvě podskupiny příznaků týkající se chuti k jídlu a spánku byly přidány později. Jinými škálami jsou např. BPRS (Brief Psychiatric Rating Scale); PANSS (Positive and Negative Syndrome Scale for Schizophrenia); SAPS (Scale for the Assessment of Positive Symptoms) nebo SANS (Scale for Assessment of Negative Symptoms).
Bolest je častějším příznakem na počátku onemocnění a její prevalence se zvyšuje s trváním onemocnění (26). Prevalence všech typů bolesti je u pacientů s PN vysoká. Podle některých výzkumů je chronická bolest přítomna u 30–85 % pacientů (33). V roce 2015 byla validována první 14položková škála k hodnocení bolesti u PN a tou je King’s PD Pain Scale (22). Škála hodnotí jak závažnost (0 až 3), tak frekvenci (0 až 4) bolesti u pacientů. Celkové skóre dosahuje hodnot od 0 do 168. Pro hodnocení bolesti lze použít také dotazníky určené pro širší skupinu pacientů, jako je VAS (Visual analog scale) nebo BPI (Brief Pain Inventory).
Poruchy spánku jsou přítomny asi u 66–90 % pacientů s PN (3), s vyšším výskytem u pacientů v pokročilé fázi onemocnění. Pro hodnocení nočního spánku (pět položek) a denního spánku (šest položek) byla vytvořena škála SCOPA-SLEEP. Podobně potíže se spánkem lze ohodnotit pomocí PDSS (The PD Sleep Scale) (20). Jedná se o 15položkovou škálu hodnotící nástup a udržení spánku, neklid, noční můry a halucinace, nokturii, motorické příznaky, únavu a ospalost během dne.
Autonomní dysfunkce v časných stadiích PN zahrnují zácpu, potíže s močením a sexuální dysfunkce (36). Další autonomní poruchy se pak objevují s progresí onemocnění. Prevalence autonomních poruch je variabilně hodnocena a pohybuje se v rozmezí od 14 do 80 %. SCOPA-AUT se zaměřuje na posouzení autonomních dysfunkcí u pacientů s PN, které mají vliv na každodenní fungování a kvalitu života. Obsahuje 23 položek a hodnotí následující funkce: gastrointestinální (sedm), močové (šest), kardiovaskulární (tři), termoregulační (čtyři), pupilomotorika (jedna) a sexuální (dvě položky pro muže a dvě položky pro ženy). Pacient u jednotlivých odpovědí volí z možností (nikdy, občas, pravidelně, často). Mimo posuzování přítomnosti příznaku je tedy do jisté míry hodnocena i závažnost symptomu.
Nonmotorické fluktuace (NMF) lze vyhodnotit pomocí dotazníku NoMoFa (Nonmotor Fluctuation Assessment Instrument) (25). Tento 28položkový dotazník se ptá na příznaky nemoci, které se vyskytují v souvislosti s léčbou PN. Celkové skóre NMF se pohybuje v rozmezí od 0 do 84 a zahrnuje období „ON“ a „OFF“, přičemž vyšší skóre odráží větší počet a závažnost NMF.
ZÁVĚR
Prevalence výskytu non-motorických příznaků u pacientů s PN je vysoká. Tyto příznaky se vyskytují ve všech stadiích onemocnění a jejich prevalence narůstá s délkou trvání a závažností onemocnění. Řada těchto příznaků není diagnostikována a léčena. Výzkumy ukazují, že deprese, úzkost a únava nejsou diagnostikovány u jedné poloviny pacientů a poruchy spánku ve více než 40 %, a přitom non-motorické příznaky mají rozhodující vliv na kvalitu života pacientů. Využití hodnotících dotazníků a škál může lékařům a ostatním členům multidisciplinárního týmu pomoci hodnotit progresi nemoci a aktuální potřeby pacienta pro péči. Pro další výzkum doporučujeme překlad vybraných dotazníků a jejich validaci pro možné využití v České republice.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
PhDr. Radka Kozáková, PhD.
Ústav ošetřovatelství a porodní asistence
Lékařská fakulta Ostravské univerzity
Syllabova 19, 703 00 Ostrava-Zábřeh
e-mail: radka.kozakova@osu.cz
Sources
1. Aarsland D, Perry R, Brown A, et al. Neuropathology of dementia in Parkinson’s disease: a prospective, community based study. Ann Neurol 2005; 58 : 773–776.
2. Benito-Leon J, Cubo E, Coronell C. Impact of apathy on health-related quality of life in recently diagnosed Parkinson’s disease: the ANIMO study. Mov Disord 2012; 27(2): 211–218.
3. Bonnet AM, Jutras MF, Czernecki V, et al. Nonmotor symptoms in Parkinson‘s disease in 2012: relevant clinical aspects. Parkinsons Dis 2012; 198316.
4. Brown RG, Dittner A, Findley L, Wessely SC. The Parkinson fatigue scale. Parkinsonism Relat Disord 2005;11 : 49–55.
5. Burn DJ, O’Brien JT. Use of functional imaging in parkinsonism and dementia. Mov Disord 2003; 18(Suppl 6): 88–95.
6. Calne S, Schulzer M, Mak E, et al. Validating a quality of life rating scale for idiopathic parkinsonism: Parkinson’s impact scale (PIMS). Parkinsonism Relat Disord 1996; 2(2): 55–61.
7. Cummings JL, Mega M, Gray K, Rosenberg-Thomson S, Carusi DA, Gornbein J. The Neuropsychiatric Inventory: Comprehensive assessment of psychopathology in dementia. Neurology 1994; 44 : 2308–2314.
8. De Boer AG, Wijker W, Speelman JD, De Haes JC. Quality of life in patients with Parkinson’s disease: Development of a questionnaire. J Neurol Neurosurg Psychiatry 1996; 61(1): 70–74.
9. Dubois B, Pillon B. Cognitive defi cits in Parkinson’s diseasse. J Neurol 1997; 244 : 2–8.
10. Ellgring H, Seiler S, Perleth B, et al. Psychosocial aspects of Parkinson’s disease. Neurology 1993; 43: S41–44.
11. Elman LB, Houghton DJ, WU GF, et al. Palliative care in amyotrophic lateral sclerosis, Parkinson’s disease, and multiple sclerosis. J Palliat Med 2007; 10(2): 433–457.
12. Forsaa EB, Larsen JP, Wentzel-Larsen T, et al. A 12-year population-based study of psychosis in Parkinson disease. Arch Neurol 2010; 67(8): 996–1001.
13. Fenelon G, Alves G. Epidemiology of psychosis in Parkinson’s disease. J Neurol Sci 2010; 289(1–2): 12–17.
14. Gallagher DA, Lees AJ, Schrag A. What are the most important nonmotor symptoms in patients with Parkinson‘s disease and are we missing them? Mov Disord 2010; 25(15): 2493–2500.
15. Goetz CG, Fahn S, Martinez-Martinin P, et al. Movement Disorder Society – sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS-UPDRS): process, format and clinimetric testing plan. Mov Disord 2007; 22 : 41–47.
16. Chaudhuri KR, Martinez-Martin P, Schapira AH, et al. International multicenter pilot study of the first comprehensive self-completed nonmotor symptoms questionnaire for Parkinson’s disease: the NMSQuest study. Mov Disord 2006; 21 : 916–923.
17. Chaudhuri KR, Pal S, DiMarco A, et al. The Parkinson’s disease sleep scale: a new instrument for assessing sleep and nocturnal disability in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2002; 73 : 629–635.
18. Chaudhuri KR, Martinez-Martin P, Brown RG, et al. The metric properties of a novel non-motor symptoms scale for Parkinson’s disease: Results from an international pilot study. Mov Disord 2007; 22 : 1901–1911.
19. Chaudhuri KR, Odin P, Antonini A, Martinez-Martin P. Parkinson’s disease: the non-motor issues. Parkinsonism Relat Disord 2011; 17(10): 717–723.
20. Chaudhuri, KR, Pal S., DiMarco A, et al. The Parkinson’s disease sleep scale: a new instrument for assessing sleep and nocturnal disability in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2002; 73(6): 629–635.
21. Chaudhuri RK, Rojo JM, Schapira AHV, et al. A proposal for a comprehensive grading of Parkinson‘s disease severity combining motor and non-motor assessments: meeting an unmet need. PLoS ONE 2013; 8(2): e57221.
22. Chaudhuri KR, Trenkwalder C, Rascol O, et al. King’s Parkinson’s disease pain scale, the first scale for pain in PD: An international validation. Mov Disord 2015; 30(12): 1623–1631.
23. The Irish Palliative Care in Parkinon’s Disease Group. Palliative care in people with Parkinson’s disease: Guidelines for proffesional healthcare workers on the assessment and management of palliative care needs in Parkinson’s disease and related Parkinsonian syndromes [on-line]. Dostupné z: https://www.ucc.ie/en/media/research/parkinsonscare/PalliativecareinPeoplewithParkinsonsdisease.pdf [cit. 2018-01-29].
24. Jenkinson C, Fitzpatrick R, Peto V, et al. The PDQ-8: Development and validation of a short-form Parkinson’s disease questionnaire. Psychol Health 1997; 12(6): 805–814.
25. Kleiner-Fisman G, Martine R, Lang AE, Stern MB. Development of a non-motor fluctuation assessment instrument for parkinson disease. Parkinsons Dis 2011; 2011 : 292719.
26. Lee MA, Walker RW, Hildreth TJ, Prentice WM. A survey of pain in idiopathic Parkinson’s disease. J Pain Symptom Manage 2006; 32(5): 462–469.
27. Leentjens AFG, Dujardin K, Marsh L, et al. Symptomatology and markers of anxiety disorders in Parkinson’s disease: a cross-sectional study. Mov Disord 2011; 26(3): 484–492.
28. Leentjens AFG, Dujardin K, Pontone GM, et al. The Parkinson anxiety scale (PAS): Development and validation of a new anxiety scale. Mov Disord 2014; 29(8): 1035–1043.
29. Marinus J, Visser M, Verwey, NA, et al. Assessment of cognition in Parkinson’s disease. Neurology 2003; 61 : 1222–1228.
30. Marinus J, Visser M, Martínez-Martín P, et al. A short psychosocial questionnaire for patients with Parkinson’s disease: the SCOPA-PS. J Clin Epidemiol 2003; 56(1): 61–67.
31. Martinez-Martin P, Jeukens-Visser M, Lyons KE, et al. Health related quality-of-life scales in Parkinson‘s disease: critique and recommendations. Mov Disord 2011; 26(13): 2371–2380.
32. Martinez-Martin P, Kurtis MM. Health-related quality of life as an outcome variable in Parkinson’s disease. Ther Adv Neurol Disord 2012; 5(2): 105–117.
33. Nègre-Pagès L, Regragui W, Bouhassira D, et al. Chronic pain in Parkinson’s disease: the cross-sectional French DoPaMiP survey. Mov Disord 2008; 23(10): 1361–1369.
34. Opara JA, Brola W, Leonardi M, Blaszczyk B. Quality of life in Parkinson’s disease. J Med Life 2012; 15(4): 375–381.
35. Pagonabarraga J, Kulisevsky J, Llebaria G, et al. Parkinson’s disease-cognitive rating scale: a new cognitive scale specific for Parkinson’s disease. Mov Disord 2008; 23(7): 998–1005.
36. Palma JA, Kaufmann H. Autonomic disorders predicting Parkinson’s disease. Parkinsonism Relat Disord 2014; 1 : 94–98.
37. Peto V, Jenkinson C, Fitzpatrick R, Greenhall R. The development and validation of a short measure of functioning and well being for individuals with Parkinson’s disease. Qual Life Res 1995; 4(3): 241–248.
38. Ravina B, Camicioli R, Como PG, et al. The impact of depressive symptoms in early Parkinson disease. Neurology 2007; 69(4): 342–347.
39. Rektorová I. Kognitivní a behaviorální poruchy u demence při Parkinsonově nemoci a u demence s Lewyho tělísky. Neurol pro praxi 2004; 1 : 15–21.
40. Rektorová I. Psychiatrické symtomy Parkinsonovy nemoci: diagnostika a léčba. Neurol pro praxi 2007; 8 : 291–294.
41. Shearer J, Green C, Counsell CE, Zajicek JP. The impact of motor and non motor symptoms on health state values in newly diagnosed idiopathic Parkinson‘s disease. J Neurol 2012; 259(3): 462–468.
42. Schrag A, Jahanshahi M, Quinn N. How does Parkinson’s disease affect quality of life? A comparison with quality of life in the general population. Mov Disord 2000; 15 : 1112–1118.
43. Sockeel PK, Dujardin D, Devos C, et al. The Lille apathy rating scale (LARS), a new instrument for detecting and quantifying apathy: validation in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2006; 77(5): 579–584.
44. Soh S-E, Morris ME, McGinley JL. Determinants of health-related quality of life in Parkinson’s disease: a systematic review. Parkinsonism Relat Disord 2011; 17(1): 1–9.
45. Švancara J, Sláma O, Kabelka L, a kol. Národní datová základna paliativní péče [online]. Praha: Ústav zdravotnických informací ČR, 2016. Dostupné z: http://www.paliativnidata.cz [cit. 2018-1-29].
46. Tom T, Cummings JL. Depression in Parkinson’s disease. Pharmacological characteristics and treatment. Drugs Aging 1998; 12(1): 55–74.
47. van den Berg M. Leben mit Parkinson: Entwicklung und psychometrische Testung des Fragenbogens PLQ. Neurol Rehabil 1998; 4 : 221–226.
48. Welsh M, McDermott MP, Holloway RG, et al. Development and testing of the Parkinson’s disease quality of life scale. Mov Disord 2003; 18(6): 637–645.
49. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol 2010; 67(5): 589–595.
50. World Health Organization. Neurological disorders: public health challenges. Geneva: WHO 2006.
Labels
Addictology Allergology and clinical immunology Anaesthesiology, Resuscitation and Inten Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric dermatology & STDs Paediatric gastroenterology Paediatric gynaecology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric clinical oncology Paediatric ENT Paediatric pneumology Paediatric psychiatry Paediatric radiology Paediatric urologist Diabetology Endocrinology Pharmacy Clinical pharmacology Physiotherapist, university degree Gastroenterology and hepatology Medical genetics Geriatrics Gynaecology and obstetrics Haematology Hygiene and epidemiology Hyperbaric medicine Vascular surgery Chest surgery Plastic surgery Medical virology Intensive Care Medicine Cardiac surgery Clinical speech therapy Clinical microbiology Nephrology Neonatology Neurosurgery Neurology Nuclear medicine Nutritive therapist Obesitology Ophthalmology Orthodontics Orthopaedics ENT (Otorhinolaryngology) Anatomical pathology Paediatrics Pneumology and ftiseology Burns medicine Occupational medicine General practitioner for children and adolescents General practitioner for adults Orthopaedic prosthetics Clinical psychology Radiodiagnostics Radiotherapy Rehabilitation Reproduction medicine Nurse Sexuology Forensic medical examiner Dental medicine Sports medicine Toxicology Trauma surgery Urology Laboratory Home nurse Phoniatrics Health Care Dental Hygienist Medical student
Article was published inGeneral Practitioner

2018 Issue 2-
All articles in this issue
- Přehled dotazníků a škál hodnotících kvalitu života a non-motorické příznaky pacientů s Parkinsonovou nemocí
- Přežití po resekci karcinomu jícnu
- Vztah pohybové aktivity rodičů a jejich dětí v českých rodinách s dětmi s normální tělesnou hmotností a dětmi s nadváhou/obezitou
- Ateroskleróza a imunita Arterie jako terciární lymfoidní orgán?
- Vplyv compliancie u diabetikov 2. typu liečených inzulínom v selfmonitoringu glykémie na kompenzáciu ochorenia
- Srovnání ankle brachial indexu s ultrasonografickým vyšetřením tepen dolních končetin u diabetiků
- Profesionální onemocnění hlášená v České republice v roce 2017
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přežití po resekci karcinomu jícnu
- Přehled dotazníků a škál hodnotících kvalitu života a non-motorické příznaky pacientů s Parkinsonovou nemocí
- Srovnání ankle brachial indexu s ultrasonografickým vyšetřením tepen dolních končetin u diabetiků
- Vztah pohybové aktivity rodičů a jejich dětí v českých rodinách s dětmi s normální tělesnou hmotností a dětmi s nadváhou/obezitou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

