-
Medical journals
- Career
Preeklampsie není jen komplikací v těhotenství
Authors: L. Greiffeneggová 1,2; D. Hrubá 1; P. Kaňová 1
Authors‘ workplace: Ústav ochrany a podpory zdraví LF MU, Brno, Přednostka: prof. MUDr. Zuzana Derflerová Brázdová, DrSc. 1; Katedra porodní asistence a zdravotnických záchranářů LF MU, Brno Přednosta: doc. MUDr. Igor Crha, CSc. 2
Published in: Prakt. Lék. 2017; 97(3): 117-122
Category: Of different specialties
Overview
V posledních dekádách se množí důkazy o zvýšeném riziku nemocí srdce a cév a renálních onemocnění u žen, jejichž těhotenství bylo komplikováno preeklampsií. Neexistují standardní doporučení pro sledování takto vnímavých žen, ačkoliv jejich včasné vyhledání, primární i sekundární prevence a léčba by mohly snížit možnou incidenci kardiovaskulárních onemocnění a závažných poškození ledvin. Je nezbytné vytvořit multidisciplinární doporučení založená na důkazech pro screening zvýšeně vnímavých žen a jejich potomků a pro další ovlivňování a řízení rizika.
Klíčová slova:
preeklampsie – kardiovaskulární riziko – selhání ledvin – standardizované řízení péče – multidisciplinárníÚVOD
V dostupné české odborné literatuře je preeklampsie (PE) zmiňována jen jako komplikace právě probíhajícího těhotenství. Naopak četné zahraniční prameny popisují střednědobé i pozdní následky prodělané preeklampsie jak v epidemiologických sledováních, tak i v klinických a experimentálních studiích zkoumajících mechanismus těchto souvislostí.
ZÁKLADNÍ INFORMACE O PREEKLAMPSII
Preeklampsie je klinický syndrom charakterizovaný manifestací hypertenze a proteinurie v průběhu těhotenství. Odborníci často rozlišují časnou formu (před 34. týdnem těhotenství) a formu pozdní, po tomto termínu. Někteří pokládají časnou formu PE z pohledu patofyziologie za odlišné onemocnění; od pozdního typu se liší neutrofilními funkcemi a hladinami cytokinů. Jsou přinášeny důkazy o tom, že časná forma PE zvyšuje riziko opakování potíží v konci těhotenství a že je také významným signálem pro predikci intrauterinní růstové retardace plodu (5).
Bylo prokázáno, že hypertenze je způsobena periferní vazokonstrikcí (37), zatímco proteinurie je vyvolána renálními lézemi, při kterých zmohutní endoteliální buňky v glomerulech. V důsledku toho zmizí endoteliální perforace a sníží se glomerulární filtrace; stav je označován jako glomerulární endotelióza (36).
Při zkoumání mechanismů vedoucích k PE byla koncem devadesátých let 20. století sledována teorie o účasti sympatického nervového systému. Zhou et al. zjistili, že aktivita sympatiku je u normotenzních netěhotných i těhotných žen podobná, zatímco u pacientek s PE byla až trojnásobně vyšší než u žen s fyziologickým průběhem těhotenství a více než dvojnásobně vyšší ve srovnání s netěhotnými hypertoničkami (45). Vysoká aktivita sympatického nervstva nebyla doprovázena korespondujícími změnami ve vylučování katecholaminů, a proto byla přisuzována podnětům z centrálního nervového systému. Po porodu se jak aktivita sympatiku, tak i arteriální krevní tlak u žen s PE snížily. Tuto hypotézu podpořila i úspěšná léčba PE sympatikolytickou terapií (29). Novější literatura však pokládá PE za následek defektů placenty v důsledku endoteliální dysfunkce, která je považována za ústřední součást patofyziologie PE.
Při fyziologickém těhotenství pronikají embryonální buňky cytotrofoblastu v matčině děložní stěně až do endotelu deciduálních arterií, které se následně remodelují na cévy s vysokou kapacitou a nízkou rezistencí (46). V těhotenství komplikovaném preeklampsií je hned od počátku invaze buněk cytotrofoblastu nekompletní, buňky jsou přítomné jen v povrchové vrstvě decidua, a proto nedochází k remodelaci spirálních arterií. Ty zůstávají vysoce rezistentní a zúžené. Cévy nesou známky endoteliální dysfunkce s poruchou vazodilatace. Zatímco ve fyziologickém těhotenství je cévní systém dimenzován tak, aby zajistil potřebné zásobování plodu kyslíkem a nutrienty, je celý proces manifestující se jako PE důsledkem zhoršené prostupnosti placenty (32).
Je možné, že produkty dysfunkce placenty při PE trvale poškozují cévní systém matky a narušují její angiogenní rovnováhu (35). Jsou nacházeny zvýšené hladiny anti-angiogenního faktoru sFlt1 (soluble fms-like tyrosine kinase 1) a naopak snížené hodnoty placentálního růstového faktoru PIGF; právě sledování poměru sFlt1 a PIGF je pokládáno za významný ukazatel zvýšeného rizika vývoje PE (31). Dále byly v krevním oběhu žen s PE nalezeny další faktory vylučované poškozeným endotelem (např. endothelin-1, fibronektin, trombomodulin a von Willebrandův faktor, což jsou markery oxidativního stresu), a rovněž zánětlivé cytokiny. Bohužel, dosavadní zkoumání neprokázalo, že by podávání antioxidačních vitaminů C a E mohlo být úspěšně používáno v prevenci PE (19).
Ke klinickému obrazu patří i zvýšení dalších zánětlivých markerů (C-reaktivního proteinu a fibrinogenu) a snížení hladiny vazodilatačních faktorů (prostacyklinu a NO) (28). Na rozdíl od fyziologického těhotenství je u PE pozorována zvýšená vnímavost na účinky angiotensinu II. Popsané změny mohou přetrvávat i po porodu a v dalším životě a pravděpodobně se mohou podílet na pozdních klinických projevech KVO (35, 46). Také matčiny mezenchymální nebo endoteliální kmenové buňky mohou být mediátory přetrvávající poruch kardiovaskulární regulace a dysfunkce placenty (35).
PE je systémové vaskulární poškození, což by mohlo vysvětlit pozorovaná přidružená postižení jater a mozku matky. Závažnou variantou PE je syndrom HELLP s hemolýzou, zvýšením jaterních enzymů, snížením počtu krevních destiček a roztroušenou intravaskulární koagulací. Cerebrovaskulární komplikace zahrnují hemoragické mozkové cévní příhody (46).
Obávanou komplikací PE je eklampsie, u níž se přidružují záchvaty.
Na vzniku PE se zřejmě alespoň částečně uplatňují genetické faktory (polymorfismus nukleotidů chromozomu 2g22) (19). PE je častější u žen, které mají výskyt PE v rodinné anamnéze, a to nejen ze strany matek, ale i otců. Výskyt PE v první graviditě je predikcí pro opakování komplikací i v dalších těhotenstvích (až 7krát častější pravděpodobnost). Rovněž vícečetné těhotenství zvyšuje riziko PE (8). Dalšími rizikovými faktory jsou matčin věk nad 40 let, její inzulinová rezistence, diabetes mellitus, obezita, hypertenze přítomná před otěhotněním, nemoci ledvin a chronický zánět (25), také početí po použití IVF-ISCI (41). Protektivní efekt má naopak kouření (4).
Diagnostika PE je založena na klinických měřeních krevního tlaku (> 140/90 torrů) a proteinurie (> 0,3 g/24 hodin). Jiné specifické laboratorní testy zatím neexistují; určitým pomocným vyšetřením jsou zvýšené hladiny sérového cholesterolu a naopak snížení hodnot NO (22).
V poslední době se potvrdila významná role sledování poměru sFlt-1/PIGF pro prognózu možného vývoje PE, přičemž jako rozhodující se pokládají hodnoty < 38, svědčící s velkou pravděpodobností o nízkém či nulovém riziku PE. Poměr má lepší výpovědní hodnotu než standardní měření hypertenze a proteinurie; umožní zahájit příslušnou péči i u asymptomatické ženy, dále sledovat klinicky stav a načasovat nejvhodnější termín porodu, ale vyloučí se zbytečné hospitalizace ženy, které ohroženy nejsou. Vyšetření hradí pojišťovna a je dostupné ve standardně vybavených laboratořích (22).
GLOBÁLNÍ DOPADY PREEKLAMPSIE A EKLAMPSIE
Odhaduje se, že preeklampsie se vyskytuje asi u 3–5 % těhotenství. Přesnější údaje nejsou k dispozici, protože onemocnění nespadá do hlášení pro národní registry a v různých studiích není ani jednotná diagnostika. V systematickém přehledu Abalose et al. prověřili celkem 11 637 studií a konstatovali, že pouze 78 z nich mohou použít pro další analytické zpracování (1). Národní údaje byly získány pouze ze sedmi zemí, nejvíce jich bylo z USA, v Evropě zejména ze Skandinávie. Pro kvalifikovaný odhad incidence preeklampsie v jednotlivých světových regionech použili makroekonomické indikátory, faktory vztahující se ke zdravotní péči a k charakteristice populace. Podle této studie se v letech 2002–2010 incidence PE pohybovala v hodnotách 1,2–4,2 %, v euroregionu 3,8 %. S těmito hodnotami korespondují i výsledky Robertse et al. (30), kteří hodnotili incidenci z nemocničních protokolů v Dánsku, Norsku, Švédsku, Skotsku, dvou států Austrálie a provincie Alberta v Kanadě: incidence PE se pohybovala mezi 1,4–4,0 %, časná PE byla vzácnější (0,3–0,7 %). Zajímavé zjištění přinesla studie finských autorů Kaaja et al. (16 ), kteří ve své zemi popsali značné geografické rozdíly v prevalenci PE (kdykoliv v průběhu života žen) v rozpětí od 7,9 do 13,9 %. Hodnoty prevalence korespondovaly s hodnotami rizikových faktorů KVO.
PE komplikující těhotenství je příčinou úmrtí matek. Riziko úmrtí během těhotenství je v rozvojových zemích 16 až 69 případů/10 000 těhotenství, ve vyspělých zemích jeden až dva případy/10 000 těhotenství; hlavní příčinou bývá eklampsie, jejíž výskyt narůstá tam, kde je nízká nebo dokonce žádná prenatální péče o matku a dítě a komplikace není diagnostikována v preeklamptickém stadiu. PE a eklampsie jsou spojeny s dalšími závažnými onemocněními ledvin, jater, oběhového a dýchacího ústrojí, a až s 10% indikací operačního porodu císařským řezem. PE porušuje vývoj plodu a zvyšuje pravděpodobnost perinatálního úmrtí. Děti, které přežijí, mají zvýšené riziko mozkových obrn, kardiovaskulárních onemocnění a diabetes mellitus v pozdějším životě (9).
Ve vyspělých zemích se během 20. století pojetí péče o zdraví matek a dětí změnilo z čistě domácí záležitosti na prioritu veřejného zdraví s odpovídající odpovědností státu. Na počátku 21. století byla péče o matku a dítě povýšena do základních lidských práv a cílem je redukovat dosavadní nerovnost mezi chudými a bohatými státy i jedinci (14).
POZDNÍ NÁSLEDKY PE PRO MATKY: ZVÝŠENÉ RIZIKO KARDIOVASKULÁRNÍCH ONEMOCNĚNÍ (KVO)
Na koronární nemoc srdeční umírají ženy častěji než muži. Poměrně často se u žen vyskytují klinicky němé průběhy KVO, takže jsou u nich častější smrtelné akutní infarkty myokardu, a to i u žen mladších 50 let (35). Během těhotenství prodělává matčina kardiovaskulární soustava řadu významných fyziologických adaptačních změn, které se mohou lišit i vlivem pohlaví plodu. Také metabolické změny u nekomplikovaných těhotenství mohou zvyšovat aterogenní potenciál, zejména u těch žen, které měly dyslipidemické nálezy ještě před otěhotněním (diabetičky, obézní). Některé studie sledovaly, zda souvisí kardiovaskulární riziko s počtem porodů. Halland et al. (11) popsali asociace jako křivku ve tvaru J, kde porod dvou dětí představoval nejmenší riziko pozdějších KVO. Protektivní úlohu má také kojení.
Vzhledem k dosavadním poznatkům o patogenezi preeklampsie se odborníci zaměřili na sledování vztahů ke kardiovaskulárním onemocněním žen, které v těhotenství PE prodělaly.
Řada velkých retrospektivních studií jednoznačně demonstrovala, že ženy s anamnézou PE v těhotenství, mají v pozdějším životě zvýšené riziko (KVO) (20, 33, 43). Riziko dále zvyšuje kombinace PE s předčasným porodem (27), nebo spontánním potratem (24).
Ještě významnější výsledky přinášejí longitudinální studie prospektivní, které sledují ostatní rizikové faktory KVO, a mohou tak přesněji definovat příspěvek, tedy atributivní riziko prodělané PE. První prospektivní studii publikovali už v roce 1997 Hannaford et al., ale protože nepoužívali standardní definici PE a KVO, jsou výsledky pokládány za orientační (12).
Izraelská studie sledovala po dobu 24–36 let více než 37 000 žen (z nich 1070 s PE) a zjistila, že relativní riziko věkově standardizovaných úmrtí je u žen s PE 2,1krát vyšší ve srovnání s kontrolním souborem (95% CI 1,8–2,5) a epidemiologicky se manifestuje až za 20 let po porodu. Hlavní podíl na úmrtnosti měly KVO (10).
Kalifornská studie „Child Health and Development“ sledovala po dobu 37 let 14 403 žen (481 s PE), jejichž průměrný věk byl v těhotenství komplikovaném PE 26 roků. Relativní riziko úmrtí na KVO bylo 2,14 (95% CI 1,29–3,57). Autoři rovněž popsali významné rozdíly mezi následky časné a pozdní PE: Ve věku 56 let přežívalo 85,9 % žen s časnou formou a 98,3 % žen s pozdní formou PE. Výsledky se nezměnily po zohlednění ostatních rizikových faktorů (hypertenze před otěhotněním, BMI, kouření, porod dítěte s intrauterinní růstovou retardací, socioekonomické poměry) (21). Autoři zdůrazňují, že v těhotenství je nutné diferencovat mezi PE a prostou hypertenzí bez proteinurie, která se zvýšeným rizikem KVO spojena není.
Metaanalytické zhodnocení pěti případových a deseti kohortových studií zahrnujících 116 175 žen s PE a 2 259 576 žen s fyziologickým těhotenstvím, se zaměřilo na hodnocení prevalence různých forem KVO u žen starších 56 let. Ženy s PE měly rizika zvýšená:
- u nemocí srdce RR 2,47 (95% CI 1,22–5,0)
- u cerebrovaskulárních nemocí RR 2,03 (95% CI 1,54–2,67)
- u nemocí periferních arterií RR 1,87 /95% CI 0,94–3,73)
- a relativní riziko úmrtnosti na KVN bylo 2,29 (95% CI 1,73–3,04)
Studie rovněž prokázala signifikantní vztahy k závažnosti předchozí PE: U slabé formy bylo RR srdečního onemocnění 2,00, u středně silné RR 2,99 a u závažné RR 5,36 (6).
Jiná metaanalýza (3) zpracovala výsledky retrospektivních a prospektivních studií publikovaných v letech 1960–2006, zahrnující celkem 3 488 160 žen, z toho téměř 200 000 s PE v anamnéze. Autoři mohli identifikovat, po jaké době se manifestuje zvýšené riziko pro různé typy KVO. Výsledky jsou uvedeny v tabulce 1.
Table 1. Zvýšené riziko KVO a počet let do manifestace od PE 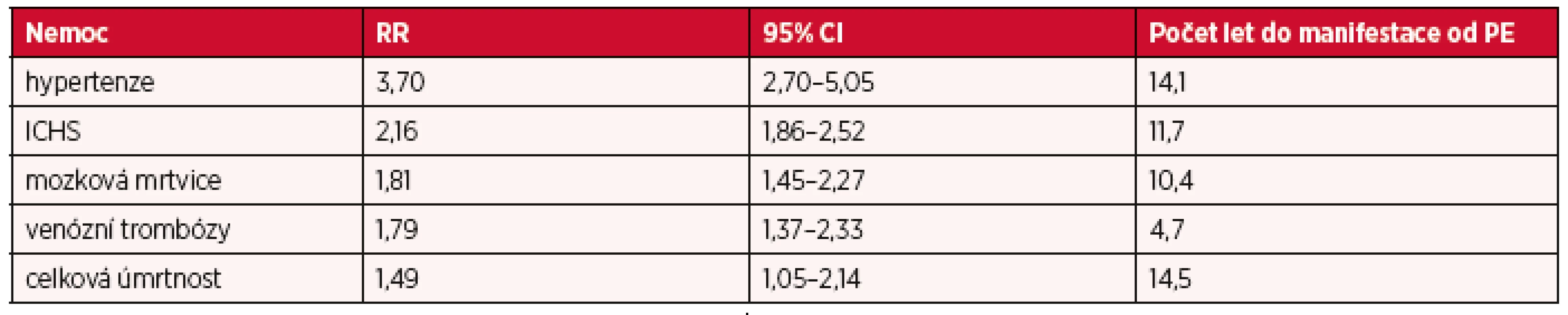
ICHS – ischemická choroba srdeční, RR – relativní riziko, CI – interval spolehlivosti Naopak prodělaná PE nezvyšovala riziko žádného rakovinového onemocnění (včetně rakoviny prsu) během 17 let po diagnóze PE (43).
Kanadští badatelé (34) odhadovali riziko vzniku KVN za 10 a za 30 let u žen s anamnézou PE a s fyziologickým těhotenstvím na základě jejich opakovaného vyšetření za 1, 3 a 5 let po porodu. Vysoký stupeň rizika mělo podle této studie za 10 let 18,2 % žen s PE a 1,7 % žen z kontrolní skupiny (OR 13,08, 95% CI 3,38–85,5). Vysoké riziko po 30 letech mělo 31,3 % žen s PE a 5,1 % žen s fyziologickým těhotenstvím (OR 6,43; 95% CI 3,48–23,23). Odhad rozdílů pro ještě delší časové období (celoživotní) byl rovněž velmi signifikantní: Vysoké riziko bylo u 41,4 % žen s PE a u 17,8 % žen kontrolních (OR 3,25; 95% CI 1,76–6,11). Do sledovaných rizikových faktorů byly zahrnuty: věk, BMI, kouření, hladiny sérových lipidů, krevního tlaku, glykemie na lačno a užívání hypotenziv (34).
Jedna z novějších studií se zabývala vývojem rizikových faktorů KVO u žen, jejichž těhotenství bylo komplikováno časnou PE, pozdní PE a prostou hypertenzí. Všechny sledované faktory (glykemie na lačno, hladiny celkového cholesterolu a triglyceridů) byly signifikantně nejvyšší u žen po časné PE, zatímco v souboru žen s prostou hypertenzí byly v průměru normální, nebo jen mírně zvýšené (39).
Kromě screeningu tradičních rizikových faktorů KVO je možné použít i moderní zobrazovací metody. White et al. (42) vyšetřovali kalcifikaci koronárních arterií pomocí počítačové tomografie (kalciové skóre) u žen průměrného věku 56 let, za cca 30 let po jejich porodu. U 60 % žen s komplikacemi v těhotenství (PE) a jen u 20 % žen s fyziologickým těhotenstvím byla v době šetření diagnostikována hypertenze a vyšší BMI. U 23 % žen s PE byla kalcifikace vyšší než 50 Agatsonových jednotek, zatímco u žádné ženy s fyziologickým těhotenstvím (OR 3,54; 95% CI 1,39–9,02). Autoři doporučují, aby toto vyšetření bylo zařazeno do screeningu vyhledávání osob s vysokým rizikem KVO.
Protože PE zahrnuje i poškození renálních funkcí, jsou cenné nálezy prospektivní studie norských autorů, kteří zjistili, že ještě 5 let po porodu přetrvává u žen s PE mikroalbuminurie a že se rovněž zvyšuje riziko závažných onemocnění ledvin (tzv. end-stage renal disease – ESRD) definované potřebou dlouhodobého léčení dialýzou nebo transplantací. U 477 žen z 570 000 se ESRD projevila v průměru za necelých 18 let po prvním těhotenství s PE a riziko se zvyšovalo s počtem těhotenství, během nichž byla PE diagnostikována: Při jednom těhotenství bylo RR 4,7 (95% CI 3,6–6,1), při dvou těhotenstvích RR 6,4 (95% CI 3,0–13,5) a při PE ve třech těhotenstvích bylo RR 15,5 (95% CI 7,8–30,8). Riziko se dále zvyšovalo, pokud PE byla spojena s předčasným porodem nebo porodem novorozence s intrauterinní růstovou retardací (40).
Holandští autoři (23) konstatují, že riziko vývoje ESRD po prodělané PE je zvýšené 5–12krát a doporučují zahrnout screening ledvinových funkcí do guidelines dlouhodobé poporodní péče o ženy po PE.
STŘEDNĚDOBÉ NÁSLEDKY PREEKLAMPSIE PRO ŽENY
Na přetrvávající riziko endoteliální dysfunkce, která se pokládá za příčinu klinických projevů PE, mohou upozornit i krátkodobější sledování několik měsíců po porodu. Ženy, které prodělaly PE, vykazovaly ještě po celý rok vyšší hodnoty krevního tlaku, srdeční tepové frekvence a poruchy vazodilatace než ženy s fyziologickým těhotenstvím. Naopak ženy, jejichž těhotenství probíhalo bez komplikací, měly dokonce lepší výsledky měření srdečních funkcí než jejich vrstevnice, které nikdy nebyly těhotné. Autoři vyslovují názor, že normální těhotenství přináší pozitivní dlouhodobý efekt na endoteliální funkce (2). Taková sledování usnadňují motivaci žen se zvýšeným rizikem, aby změnily svůj způsob života, výrazně eliminovaly známé preventabilní rizikové faktory KVO a jejich lékaři případně iniciovali včasné nasazené adekvátní terapie.
PREEKLAMPSIE JAKO RIZIKO PRO PLOD A V DĚTSTVÍ
Poškození plodů se po PE projevuje intrauterinní růstovou retardací, nezralostí, bronchopulmonální dysplazií; zvyšuje se také riziko perinatálního úmrtí (25).
U potomků matek s PE byly v jejich mladém věku nalezeny cévní dysfunkce v plicích i ostatních orgánech, nicméně mechanismus zprostředkující tento fenotyp zatím známý není. Autoři klinické studie porovnávali tlak v pulmonální arterii a dilataci zprostředkovanou krevním proudem (flow-mediated dilatation) v a. brachialis u 13letých potomků žen s PE a dětí narozených z fyziologických těhotenství. Hodnoty pulmonálního tlaku byly v průměru o 30 % vyšší a naopak hodnoty dilatace o 30 % menší u dětí matek s PE. Pulmonální arteriální tlak se snížil po inhalaci NO, jehož účinky byly významně (až 2krát) vyšší u dětí matek s PE ve srovnání s kontrolním souborem. Nicméně i po této léčbě u nich zůstával pulmonální tlak signifikantně zvýšen proti kontrolní skupině. Autoři spekulují, že v rizikovém těhotenství došlo k remodelování plicních cévních stěn plodu s následnými defekty v jejich struktuře. Rozdíly nebylo možné vysvětlit nějakou rozdílnou pulmonální mikrocirkulací, neboť difuzní kapacita CO2 byla u obou skupin stejná. Předpoklad souvislosti zvýšeného pulmonálního tlaku s PE podporuje i zjištění, že sourozenci těchto rizikových dětí, narození stejným matkám, u nichž však už těhotenství probíhalo fyziologicky, měli vaskulární funkce normální. Autoři uzavírají, že PE přispívá k pulmonální hypertenzi a možná i k pozdějšímu vývoji plicního edému a předčasným kardiovaskulárním onemocněním (15). Tyto hypotézy potvrdily už i některé epidemiologické studie popisující vyšší výskyt arteriální hypertenze a mozkové mrtvice u potomků narozených z PE těhotenství (17, 38).
Teorii o transgenetickém přenosu rizika KVO u dětí narozených z preeklamptických těhotenství ověřovala studie sledující biomarkery zánětu (C-reaktivní protein) a angiogeneze (fms-like tyrosine kinase) u matek a jejich potomků po porodu a za dalších 5 a 8 let. Jejich hodnoty byly při anamnéze PE zvýšené a navzájem korelovaly u matky a dítěte. Děti z PE těhotenství měly zvýšené hodnoty systolického krevního tlaku a cholesterolu a ty, které měly ještě nízkou porodní hmotnost, měly nižší index reaktivní hypertermie při periferní arteriální tonometrii, což svědčí i pro sníženou funkci endotelu. Obdobný nález byl i u matek těchto dětí. Autoři nenašli větší rozdíly ve stravování dětí z rizikové a kontrolní skupiny, nesledovali dobu kojení (18).
DOPORUČENÍ PRO ŘÍZENÍ KARDIOVASKULÁRNÍHO RIZIKA PO TĚHOTENSKÝCH KOMPLIKACÍCH
Přestože problematice preeklampsie a eklampsie se věnuje významná výzkumná pozornost, zůstává stále mnoho nejasností o etiologii a mechanismech vzniku těchto těhotenských komplikací. Nověji se pozornost soustřeďuje na prekoncepční období, ve kterém je možné aktivně vyhledávat ženy se zvýšenou vnímavostí k rozvoji pozdější PE. Zatím bylo konstatováno, že se u nich vyskytují častěji některé rizikové faktory, např. hypertenze, diabetes, zvýšená inzulinová rezistence, obezita, poruchy lipidového spektra, zvýšené koncentrace homocysteinu v plazmě. Odborníci vyslovují hypotézu, že ženy, u nichž se rozvine PE, jsou vnímavé k „metabolickému stresu“, který pro ně těhotenství představuje, a že metabolické abnormality a endoteliální poškození vyústí ve větší vnímavost ke KVO v pozdějším životě, takže těhotenství může být pokládáno za určitý „stresový test“ pro další vývoj zdraví (26).
S odkazem na tyto dosavadní znalosti zahrnula v roce 2011 American Heart Association do svých doporučení pro řízení kardiovaskulárních rizik jako další rizikové faktory preeklampsii, gestační diabetes mellitus a porod dítěte s nízkou porodní hmotností. Současně doporučuje sledování markerů KVO (krevní tlak, lipidové spektrum, glykemie na lačno, BMI) a poradenství o zdravé výživě, pohybové aktivitě a nekouření do rutinních prohlídek v prenatálních těhotenských poradnách, neboť jejich organizace představují významnou šanci pro odhalení časných známek kardiovaskulárního rizika u mladých a subjektivně zdravých žen (35).
V současné době neexistují obecně platná doporučení, v jakých termínech a které ukazatele sledovat u žen, které měly komplikace v těhotenství. Velký význam se přikládá poradenství k dodržování zásad zdravého životního stylu (výživa, pohybová aktivita, nekouření) a sledování reziduální hypertenze, proteinurie a hyperglykemie; intervence a vyšetření má provádět nejen ošetřující praktický lékař, ale i gynekolog v následných kontrolních prohlídkách v šestinedělí. Další stejně zaměřená vyšetření a poradenské intervence se doporučují za 12 měsíců po porodu a následně každých 5 let, která by mohla být spojena s preventivním screeningem rakoviny prsu a děložního čípku. Při patologických nálezech je žena předána do péče specialistů (kardiologů, nefrologů, internistů) (35).
Pro další výzkum se ještě dále doporučuje hodnocení kardiovaskulárního fenotypu pomocí makrovaskulárních funkcí a struktury (arteriální tloušťka, zobrazení karotid), mikrovaskulární difuze plynů a echokardiografie, a dále vytvoření biobanky ze vzorků krevní plazmy, moči, placenty odebraných v perikoncepčním období, v každém trimestru těhotenství, při porodu a za 6–12 týdnů, 6 a 12 měsíců po porodu (35).
Dosud jen ojedinělé studie se zaměřily na sledování znalostí lékařů o pozdních rizicích komplikací těhotenství pro ženy. Ve studii, která zkoumala znalosti lékařů v Bostonu, autoři zjistili, že internisté i gynekologové a porodníci mají značné mezery ve znalostech vztahů mezi PE a KVO a v odborných doporučeních nemají zahrnutou PE jak rizikový faktor KVO, přestože většina z nich provádí rutinně konzultace zaměřené na redukci kardiovaskulárního rizika: Pouze 9 % internistů a 38 % gynekologů bylo v tomto ohledu informováno a zaměřovalo pozornost na tuto rizikovou skupinu žen s PE v anamnéze (44).
Nizozemská společnost gynekologů a porodníků iniciovala založení multidisciplinární pracovní skupiny, sdružující gynekology, kardiology, radiology, praktické lékaře, epidemiology a zástupce sdružení pacientů, která pracovala na vytvoření guidelines pro řízení kardiovaskulárního rizika u žen po prodělaných komplikacích v těhotenství, včetně preeklampsie. Doporučení zahrnují jak primární prevenci (snížení preventabilních rizikových faktorů), tak i prevenci sekundární (včasné a opakované vyhledávání markerů KVO rizika) i vzdělávání žen (13).
K edukační intervenční vzdělávací studii přikročili ve státě Tennesee, kde se sestry zaměřily na ženy po prodělané PE, většina z nich byly Afro-američanky. Edukace byla zaměřena obecně na zvýšení znalostí o kardiovaskulárních onemocněních a jejich ovlivnitelných rizikových faktorech, na roli PE u těchto onemocnění a na vnímání vlastního rizika KVO podle ukazatelů životního stylu a dostupnosti sekundární prevence. Semináře byly doprovázeny telefonickými konzultacemi a názornou brožurou. Celý kurz významně zvýšil percepci osobního rizika a úpravu životního stylu (32).
ZÁVĚR
Mnoho studií dokumentovalo, že preeklampsie představuje významné riziko pro pozdější zvýšený výskyt kardiovaskulárních a ledvinových nemoci u matek i jejich potomků. V podmínkách České republiky je třeba zvýšit informovanost lékařů, ostatních zdravotníků i laické veřejnosti o významném riziku, které představuje PE pro pozdější závažná onemocnění žen a jejich potomků (KVO, poruchy ledvin) a ještě v porodnici motivovat ženy po prodělané PE k vyvarování se způsobu života zahrnujícího rizikové faktory (nezdravá výživa, špatný pitný režim, nízká pohybová aktivita, kouření).
Je nutné informovat ošetřujícího praktického lékaře o zvýšeném riziku a doporučit intervenční motivaci žen ke změně životního stylu a sledování rizikových faktorů v rámci sekundární prevence s případným včasným zahájením odpovídající léčby. Holandští autoři doporučují na základě získaných zkušeností vyšetření sérových lipidů, glykemie na lačno, CRP a fibrinogenu, albuminurie a krevního tlaku, a z nových biomarkerů se osvědčil rozpustný endoteliální selektin (SE selectin) jako ukazatel endoteliálních funkcí) a plazmový protein A (PAPPA), metaloproteinázy spojené s vnímavostí k tvorbě aterosklerotických plaků (7).
Na možnost zvýšeného rizika KVO a poruch plicních funkcí u dítěte je třeba upozornit i praktického pediatra, který o dítě přebírá péči.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Drahoslava Hrubá, CSc.
Ústav ochrany a podpory zdraví LF MU
Kamenice 5,
625 00 Brno
e-mail: hruba@med.muni.cz
Sources
1. Abalas E, Cuesta C, Grosso AJ, et al. Global and regional estimates of preeclampsia and eclampsia: a systematic review. Eur J Obstet Gynecol Reprod Biol 2013; 170(1): 1–7. http://dx.doi.org/10.1016/j.ejogrb.2013.05.005
2. Agatisa PK, Ness RB, Roberts JM, et al. Impairment of endothelial function in women with a history of preeclampsia: an indicator of cardiovascular risk. Am J Physiol Heart Circ Physiol 2004; 286: H1389–H1393.
3. Bellamy L, Casas J-P, Hingorani AD, Williams DJ. Pre-eclampsia and risk of cardiovascular disease and cancer in later life: systematic review and meta analysis. BMJ 2007; 335 : 974.
4. Conde-Agudelo A, Althabe F, Belizan JM, Kafury-Goeta AC. Cigarette smoking during pregnancy and risk of preeclampsia: a systematic review. Am J Obstet Gynecol 1999; 181 : 1026–1035.
5. von Dadaelszen P, Magee LA, Roberts JM. Subclassification of preeclampsia. Hypertens Pregnancy 2003; 22(2): 143–148.
6. McDonald SD, Malinowski A, Zhou Q, et al. Cardiovascular sequelae of preeclampsia /eclampsia: A systematic review and meta analyses. Am Heart J 2008; 156 : 918–930.
7. Drost JT, Maas AHEM, Hlewijn S, et al. Novel cardiovascular biomarkers in women with history of early preeclampsia. Atherosclerosis 2014; 237 : 117–122.
8. Duckitt K, Harrington D. Risk factors for preeclampsia at antenatal booking: systematic review of controlled studies. BMJ 2005; 333 : 330–365.
9. Duley L. The global impact of pre-eclampsia and eclampsia. Semin Perinatol 2009; 33 : 130–137.
10. Funai EF, Friedlander Y, Paltiel O, et al. Long-term mortality after preeclampsia. Epidemiology 2005; 16(2): 206–215.
11. Halland F, deRoo L, Morken NH, et al. Association of women’s reproductive history with long-term mortality and effect of socioeconomic factors. Obstet Gynecol 2015; 126 : 1181–1187.
12. Hannaford P, Ferry S, Hirsch S. Cardiovascular sequelae of toxaemia of pregnancy. Heart 1997; 77 : 154–158.
13. Heida K, Bots ML, de Groot CJ, et al. Cardiovascular risk management after reproductive and pregnancy related disorders: A Dutch multidisciplinary evidence-based guidelines. Eur J Prev Cardiol 2016; 23(17): 1863–1879.
14. Hunt P. Maternal health and human rights. Lancet 2008; 371 : 203–204.
15. Jayet PY, Rimoldi SF, Stuber T, et al. Pulmonary and systemic vascular dysfunction in young offspring of mothers with preeclampsia. Circulation 2010; 122 : 488–494.
16. Kaaja R, Kinnunen T, Luoto R. Regional differences in the prevalence of pre-eclampsia in relation to the risk factors for coronary artery disease in women in Finland. Eur Heart J 2005; 26 : 44–50.
17. Kajantie E, Eriksson JG, Osmond C, et al. Preeclampsia is associated with increased risk of stroke in the adult offspring: the Helsinki birth cohort study. Stroke 2009; 40 : 1176–1180.
18. Kvehaugen AS, Dechend R, Ramstad HB, et al. Endothelial function and circulating biomarkers are disturbed in women and children after preeclampsia. Hypertension 2011; 58 : 63–69.
19. Loset M, Johnson MP, Melton PE, et al. Preeclampsia and cardiovascular disease share genetic risk factors on chromosome 2q22. Pregnancy Hypertens 2014; 4 : 178–185.
20. Lykke JA, Langhoff-Roos J, Sibai BM, et al. Hypertensive pregnancy disorders and subsequent cardiovascular morbidity and type 2 diabetes mellitus in the mother. Hypertension 2009; 53 : 944–951.
21. Mongraw-Chaffin ML, Cirillo PM, Cohn BA. Preeclampsia and cardiovascular disease death: prospective evidence from the Child Health and Development Studies Cohort. Hypertension 2010; 56 : 166–171.
22. Nováková L. Jaká je hodnota testů na preeklampsii? Labor Aktuell 2016; 3 : 24–27.
23. Paauw ND, Luijken K, Franx A, et al. Long-term renal and cardiovascular risk after preeclampsia: towards screening and prevention. Clin Sci (Lond) 2016; 130(4): 239–246.
24. Pell JP, Smith GC, Walsh D. Pregnancy complications and subsequent maternal cerebrovascular events: a retrospective cohort study of 119.668 births. Am J Epidemiol 2004; 159 : 336–342.
25. Powe CE, Levine RJ, Karumanchi SA. Preeclampsia: a disease of the maternal endothelium. The role of antiangiogenic factors and implications for later cardiovascular disease. Circulation 2011; 123 : 2856–2869.
26. Powers RW, Roberts JM, Cooper KM, et al. Maternal serum soluble fms-like tyrosine kinase 1 concentrations are not increased in early pregnancy and decrease more slowly postpartum in women who develop preeclampsia. Am J Obstet Gynecol 2005; 193 : 185–191.
27. Ray JG, Vermeulen MJ, Schull MJ, Redelmeier DA. Cardiovascular health after maternal placental syndromes. CHAMPS: population-based retrospective cohort study. Lancet 2005; 366 : 1797–1803.
28. van Rijn BB, Veerbeek JH, Scholtens LC, et al. C-reactive protein and fibrinogen levels as determinants of reccurent preeclampsia: a prospective cohort study. J Hypertension 2014; 32 : 408–414.
29. Roberts JM, Myatt L, Spong CY, et al. Vitamins C and E: to prevent complications of pregnancy-associated hypertension. N Engl J Med 2010; 362 : 1282–1291.
30. Roberts ChL, Ford JB, Algert ChS, et al. Population-based trends in pregnancy hypertension and pre-eclampsia: an international comparative study. BMJ Open 2011; 1: e000101. doi 10.1136/bmjopen-2011-000101
31. Signore C, Mills JL, Qian C, et al. Circulating angiogenic factors and placental abruption. Prenat Diagn 2008; 28 : 852–858.
32. Spratling PM, Pryor ER, Moneyham LD, et al. Effect of educational intervention on cardiovascular disease risk perception among women with preeclampsia. J Obstet Gynecol Neonatal Nurs 2014; 43 : 179–189.
33. Smith GC, Pell JP, Walsh D. Pregnancy complications and maternal risk of ischaemic heart disease: a retrospective cohort study of 129.290 births. Lancet 2001; 357 : 2002–2006.
34. Smith GN, Pudwell J, Walker M, Shi-Wu Wen. Ten-year, thirty-year and lifetime cardiovascular disease risk estimates following a pregnancy complicated by preeklampsia. J Obstet Gynaecol Can 2012; 34(9): 830–835.
35. Staff AC, Redman ChWG, Williams D, et al. Pregnancy and long-term maternal cardiovascular Health. Progress through harmonization of research cohorts and biobanks. Hypertension 2016; 67 : 251–260. doi:10.1161/hypertensionaha.115.06.357
36. Stillman IE, Karumanchi SA. The glomerular injury of preeclampsia. J Am Soc Nephrol 2007; 18 : 2281–2284.
37. Thadhani R. Ecker JL, Kettyle F, et al. Pulse pressure and risk of preeclampsia: s prospective study. Obstet Gynecol 2001; 97 : 515–520.
38. Vatten LJ, Romundstad PR, Holmen TL, et al. Intreuterine exposure to preeclampsia and adolescent blood pressure, body size and age at menarche in female offsprings. Obstet Gynecol 2003; 101 : 529–533.
39. Veerbeek JHW, Hermes W, Breimer AY, et al. Cardiovascular disease risk factors after early-onset preeclampsia, late-onset preeclampsia and pregnancy-induced hypertension. Hypertension 2015; 65 : 600–606.
40. Vikse BE, Irgens LM, Leivestad T, et al. Preeclampsia and the risk of end-stage renal disease. N Engl J Med 2008; 359 : 800–809.
41. Wang JX, Knottnerus AM, Schuit G, et al. Surgically obtained sperm, and risk of gestational hypertension and preeclampsia. Lancet 2002; 359 : 673–674.
42. White WM, Mielke MM, Araoz PA, et al. A history of preeclampsia is associated with a risk for coronary artery calcification 3 decades later. Am J Obstet Gynecol 2016; 214(4): 519.e1-8.
43. Wilson BJ, Watson MS, Prescott GJ, et al. Hypertensive diseases of pregnancy and risk of hypertension and stroke in later life from cohort study. BMJ 2003; 326(7394): 845.
44. Young B, Hacker M, Rana S. Physicians’´ knowledge of future vascular disease in women with preeclampsia. Hypertens Pregnancy 2012; 31 : 50–58.
45. Zhou Y, Damsky Ch, Roberts JM, et al. Preeclampsia is associated with abnormal expression of adhession molecules by invasive cytotrophoblast. J Clin Invest 1993; 91 : 950–960.
46. Zhou Y, Damsky CH, Fisher SJ. Preeclampsia is associate with failure of human cytotrophoblast to mimic a vascular adhesion phenotype: on a cause of defective endovascular invasion in this syndrome? J Clin Invest 1997; 99 : 2152–2164.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2017 Issue 3-
All articles in this issue
- Péče zaměřená na pacienta: obecné aspekty a terminologické problémy
- Kombinovaná farmaka v léčbě obezity: minulost a současnost
- Preeklampsie není jen komplikací v těhotenství
- Vybrané ukazatele zdravotního stavu české populace – výsledky studie EHES 2014
- Strava založená na potravinách rostlinného původu v prevenci civilizačních onemocnění
- Srovnání paliativní péče v České republice a subsaharské Africe
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Preeklampsie není jen komplikací v těhotenství
- Kombinovaná farmaka v léčbě obezity: minulost a současnost
- Péče zaměřená na pacienta: obecné aspekty a terminologické problémy
- Vybrané ukazatele zdravotního stavu české populace – výsledky studie EHES 2014
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

