Detekce latentní tuberkulózy QuantiFERON-TB Gold test, možnosti a úskalí metody
:
V. Vroblová; K. Jankovičová; M. Trojáčková-Kudlová; J. Krejsek
:
Přednosta: prof. RNDr. Jan Krejsek, CSc.
; Lékařská fakulta a Fakultní nemocnice v Hradci Králové
; ÚSTAV KLINICKÉ IMUNOLOGIE A ALERGOLOGIE
; Univerzita Karlova v Praze
:
Prakt. Lék. 2009; 89(4): 204-209
:
Diagnostis
Tuberkulóza (TBC) je celosvětově rozšířené onemocnění postihující všechny věkové skupiny a zasahující jakékoliv orgány, především plíce. V závislosti na individuální imunitní reaktivitě infikovaného jedince, významně podmíněné genetickou dispozicí, může dojít buď k eliminaci mykobakterií, latentní infekci, nebo manifestnímu onemocnění. M. tuberculosis obsažené v granulomu pacientů s latentní infekcí, mohou přežívat i desítky let v těle postiženého bez známek onemocnění. Zmnožení těchto mykobakterií a reaktivace onemocnění nastává následkem přirozeného oslabení imunitního systému, nebo při užívání léků potlačujících imunitu. Testování pro latentní tuberkulózu je indikováno v případě zvýšeného rizika rozvinutí aktivní tuberkulózy. Tato situace nastává u jedinců, kteří byli v těsném kontaktu s aktivní tuberkulózou, u rizika reaktivace infekce vlivem narušené imunity nebo při suspektním nálezu na plicích.
Nová generace krevních testů založených na specifické buněčné imunitní reakci se zdá být vhodnou náhradou Mantoux testu (MT) pro diagnostiku latentní infekce M. tuberculosis.
QuantiFERON-TB Gold test využívá ELISA metodu pro hodnocení IFN-γ vytvořeného antigen specifickými T lymfocyty. QuantiFERON-TB Gold test byl schválen řadou národních autorizačních institucí (např. FDA, EU) pro použití v diagnostice latentní i aktivní infekce M. tuberculosis. Výhodou testu je minimální zátěž pro pacienta. Relativní nevýhodou QFT-G jsou však vyšší materiálové náklady. Ale díky jeho vyšší specifitě v porovnání s MT QFT-G test snižuje náklady za následné RTG vyšetření a další laboratorní testy. Dále snižuje náklady za neopodstatněnou profylaktickou léčbu falešně pozitivních pacientů hodnocených MT. Dle pravidel NICE je QFT-G test doporučován k vyloučení aktivní TBC. U latentní TBC naopak k potvrzení infekce, která může vést ke vzplanutí klinicky manifestní infekce v průběhu imunosupresivní léčby zvláště tzv. biologické.
Klíčová slova:
latentní tuberkulóza, QuantiFERON TB-Gold test, Mantoux test.
Profylaktická terapie je vysoce zatěžující a riziková. Používání testu „QuantiFERON-TB Gold test“ by mohlo snížit počet osob neopodstatněně vystavených této terapii (2, 15).
Princip testu
V případě infekce M. tuberculosis má pacient v krvi specifické efektorové TH1 T lymfocyty, které po stimulaci mykobakteriálními antigeny (ESAT-6, CFP-10 a TB 7.7) in vitro produkují interferon *gama. Jelikož jsou krevní buňky inkubované s mykobakteriálními antigeny maximálně 20 hodin, nedochází k aktivaci dlouhožijících paměťových buněk, které mohou v těle kolovat i několik let po proběhlé (vyléčené) infekci TBC. Koncentrace IFN-γ je poté stanovena v plazmě ELISA metodou. Výhodou tohoto krevního testu je, že obsahuje interní pozitivní kontrolu. Část krve je stimulována nespecifckým stimulátorem (PHA – phytohemaglutinin). Pokud je test proveden technicky správně, a pokud vyšetřovaná krev obsahuje imunokompetentní T lymfocyty, měla by být hladina INF-γ pozitivní kontroly vyšší než 0,5 UI/ml. Pokud je hladina INF-γ nižší, test nemůže být hodnověrně interpretován, protože jsou v krvi přítomny T lymfocyty suprimované přirozeně (např. v infekci HIV) nebo uměle (imunosupresiva), neschopné stimulace. Pozitivní kontrola odhalí pacienty s falešně negativním MT (20). (Obr. 1).
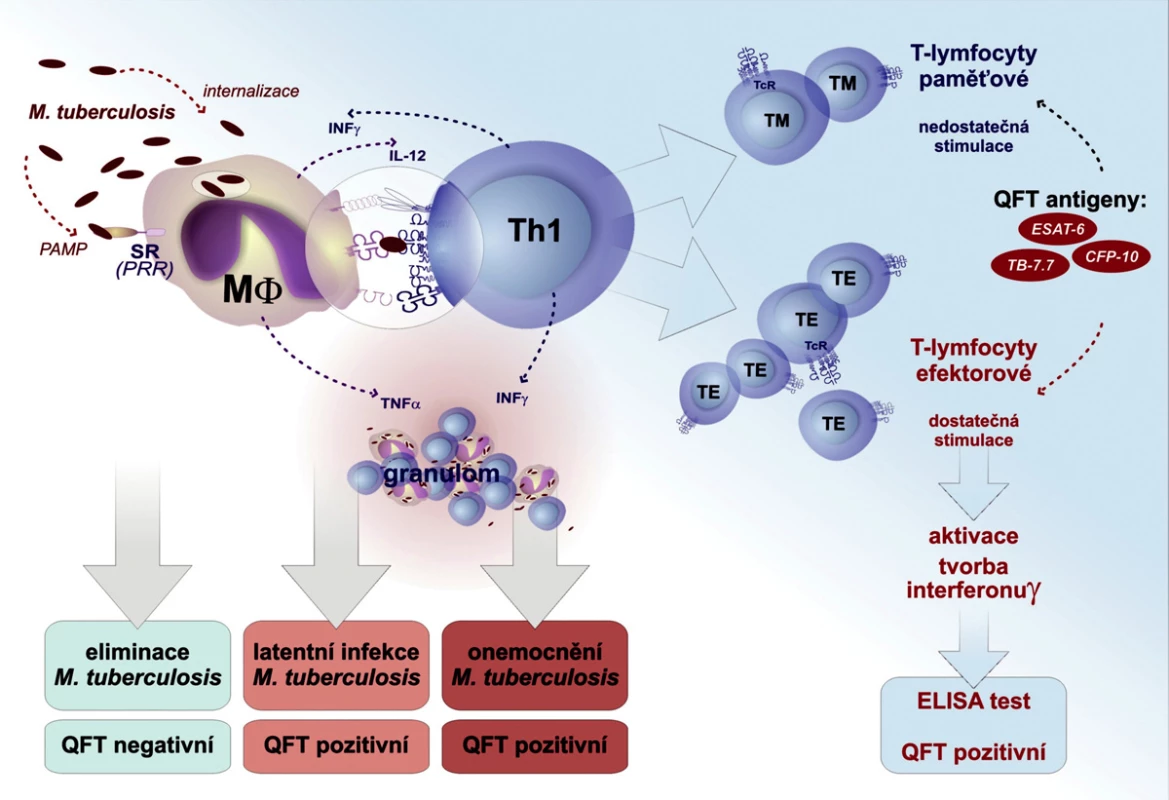
Senzitivita a specificita
Vzhledem k tomu, že neexistuje metoda považovaná za standard v diagnostice latentní infekce M. tuberculosis, je nemožné definovat přesnou specifitu a senzitivitu QuantiFERON-TB Gold testu v diagnostice LTBI. Senzitivita kožního testu podle Mantoux pro diagnózu aktivní tuberkulózy není vysoká. Specifita je nízká pro jeho zkříženou reaktivitu s BCG vakcínou. U 216 japonských studentů očkovaných BCG vakcínou, s nízkým rizikem infekce M. tubeculosis, byla zaznamenána specifita QFT-G 98,1 %. Z analýzy QFT-G testem 118 pacientů, kteří měli potvrzenou tuberkulózu kultivačními metodami, byla určena senzitivita 89,0 % (15). V jiné studii byla specifita (96,0 %) QFT-G testu určena ve skupině zdravých, BCG‑vakcinovaných korejských studentů medicíny. Senzitivita (81 %) byla určena mezi 54 pacienty s potvrzenou plicní tuberkulózou (9). U nerozdělené populace 318 hospitalizovaných pacientů zaznamenal Ferrara větší senzitivitu QFT-G testu (67 %) v porovnání s MT (33 %). Avšak 21 % pacientů mělo neurčitý výsledek QFT-G, všichni tyto pacienti byly negativní na MT. Ve většině případů se jednalo o imunosuprimované pacienty.
Neurčitý výsledek QFT-G testu pomáhá odlišit pacienty s falešně negativním výsledkem MT (6). Výhoda QFT-G testu byla prokázána také u dětí vyšetřovaných pro TBC infekci. QFT-G test je více specifický (100 %) než MT (58 %), odlišuje TBC od infekcí netuberkulovými mykobaktériemi a není ovlivňován BCG vakcinací (3, 16). Pro vyhledávání pacientů s aktivní tuberkulózou je výhodné QFT-G test využít pro jeho vysokou negativní prediktivní hodnotu k vyloučení infekce TBC. Negativní výsledek testu spolu s negativní mikroskopií a kultivací umožňuje vyloučit TBC infekci u imunokompetentních jedinců. Pro záchyt aktivní tuberkulózy není tento test vhodný pro jeho neschopnost odlišit aktivní od latentní formy infekce TBC.
Pozitivní výsledek QFT-G testu spolu s negativní mikroskopií a kultivací může pomoci ve vyhledávání osob s latentní infekcí, a tedy osob vhodných pro preventivní terapii TBC. Pro rozhodnutí, zda pacient podstoupí profylaktickou terapii, je důležitá přítomnost/nepřítomnost dalších rizikových faktorů (imigranti, bezdomovci, drogová závislost, RTG nález a jiné) (8, 19) Výsledek QFT-G, už ze své podstaty (stimulace specifickými antigeny), není ovlivněn přítomností jiných onemocnění, jakými jsou např. zápal plic, pneumokonióza, cirhóza jater, onemocnění ledvin, cukrovka (23).
Z práce Diela a spol. vyplývá, že QFT-G test je specifičtější indikátor LTBI v porovnání s MT u jedinců, kteří byli v těsném kontaktu s mikroskopicky ověřeným TBC zdrojem. Na kožní zkoušku MT reagovalo pozitivně 31 % jedinců, kteří byli v kontaktu s otevřenou TBC. QFT-G test odhalil pouze 10 % pozitivních jedinců. Většina pozitivních výsledků MT testu bylo spojena s BCG vakcinací.
Výrazně lepší shoda těchto dvou testů byla zaznamenána u pacientů, kteří nebyli očkováni BCG vakcínou (4) Vyhledávání LTBI má velký význam u lidí, kteří pracují ve zdravotnictví, protože jsou v neustálém riziku expozice pacienta s neodhalenou aktivní tuberkulózou. Kobashi a spol. také vyhodnotili QFT-G jako specifičtější metodu pro odhalení LTBI u jedinců, kteří byli v kontaktu s aktivní TBC než MT (11). Také Lee a spol. potvrdili, že QFT-G je vhodná metoda pro diagnostiku LTBI infekce u lidí pracujících ve zdravotnictví, a to hlavně pokud byli očkovaní BCG vakcínou (14). U lidí, kteří byli v kontaktu s aktivní TBC infekcí a mají negativní výsledek QFT-G testu, doporučuje CDC (Centrum for Disease Control and prevention – CDC, USA) potvrzení negativního výsledku za 8–10 týdnů od expozice.
Pro načasování QFT-G testu u vyšetřování LTBI nejsou zcela dostupné informace, proto CDC doporučuje vycházet z doporučení, které platí pro MT (21). Rangaka a spol. prokázali jasné snížení reaktivity MT u pacientů s HIV infekcí v porovnání s HIV negativními jedinci ze stejné komunity lidí. Takovéto výrazné snížení reaktivity nebylo zaznamenáno u QFT-G. Snížení pozitivity QFT-G bylo zaznamenáno u HIV pozitivních pacientů, kteří měli méně jak 0,25 x 109/l CD4+ T lymfocytů (18). Také Jones a spol. zaznamenali pozitivní korelaci mezi neurčitým výsledkem QFT-G testu a počtem CD 4+ T lymfocytů /ml (< 0,2 x 109/l) u HIV pozitivních pacientů. U HIV infikovaných pacientů je pozitivní výsledek QFT-G testu statisticky významněji více spojen s expozicí infekce M. tuberculosis a jinými rizikovými faktory TBC (bezdomovectví, užívání drog, imigranti) než pozitivní výsledek MT testu.
I když neexistuje žádná standardní metoda pro určení správnosti diagnostických metod latentní TBC, zdá se že QFT-G test lépe odráží riziko latentní infekce TBC u HIV pozitivních pacientů než MT (7, 22). Pozitivní výsledek QFT-G testu také lépe koreluje s mírou rizikových faktorů latentní TBC než Mantoux kožní test u pacientů léčených pro chronické zánětlivé onemocnění, malignity, HIV nebo cukrovku (10, 11).
U pacientů s neurčitým výsledkem CDC doporučuje opakovat test z nově odebraného vzorku krve (21). V Německu Diel a spol. prokázali, že využití QFT-G ve vyhledávání LTBI je cenově příznivé, pokud se provádí u MT pozitivních jedinců. Německá skupina tvrdí, že odhalováním falešně pozitivních MT pacientů pomocí QFT-G by snížili náklady za následné RTG vyšetření, další laboratorní testy a profylaktickou léčbu. (5).
Metodika
Vyšetřovanému pacientovi se odebere po 1 ml plné krve do tří speciálních vakuových zkumavek. Množství odebrané krve musí být přesné. Speciální odběrové zkumavky dodávané výrobcem se skladují při teplotě 4–25 °C. Zkumavky s odebranou krví se musí důkladně promíchat opakovaným obrácením zkumavek a vložit nejpozději do 16 hodin od náběru do temostatu (37 °C), kde se 16–20 hodin inkubují. Zkumavky již s odebranou krví se před vložením do termostatu nesmí ochlazovat ani zamrazovat. Uchovávají se se tedy při pokojové teplotě.
Během inkubace v termostatu dochází ke stimulaci antigen specifických efektorových T lymfocytů. Inkubace však nesmí přesáhnout 24 hodin, aby se zabránilo stimulaci dlouhožijících paměťových T lymfocytů. Po nejdéle 24 hodinách se oddělí plazma od buněk centrifugací (2 000–3 000 g, 15 minut), kdy gelová zátka oddělí buňky od plazmy. Získaná plazma, ve které se ELISA soupravou vyšetřuje přítomnost INF-γ produkovaného stimulovanými TH 1 lymfocyty, může být uskladněna 8 týdnů při 2–8 °C nebo až 3 měsíce při -70 °C.
Hodnocení
Je prováděno pomocí vyhodnocovacího schématu poskytovaného výrobcem. Výsledek testu je považován za pozitivní, pokud je ve zkumavce se specifickými antigeny (TB) o 0,35 IU/ml vyšší produkce interferonu než ve zkumavce bez antigenů (NIL). Přitom ve zkumavce stimulované mitogenem (MIT) by neměla být nižší hladina INF-γ než 0,5 IU/ml. Pokud je v MIT zkumavce nízká produkce interferonu, hodnotíme výsledek jako neurčitý, protože infekci M. tuberculosis tímto testem nemůžeme potvrdit ani vyvrátit. Taková situace může nastat u pacientů s extrémně nízkým počtem T lymfocytů nebo s jejich nedostatečnou schopností se aktivovat a produkovat INF-γ (např. imunosuprese), ale také z důvodu nevhodného odběru či manipulace s materiálem.
Naše zkušenosti
Na našem pracovišti (Ústavu klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové) jsme od ledna roku 2007 do prosince roku 2008 provedli 930 vyšetření QuantiFERON-TB Gold test. 11 % těchto vyšetření vyšlo s neurčitým výsledkem, tedy s nedostatečně proliferující pozitivní kontrolou. Více jak 62 % neurčitých výsledků jsme zaznamenali u imunosuprimovaných pacientů léčených pro autoimunitní chorobu. Z našeho souboru vyšetření jsme zaznamenali 13 % výsledků podporujících suspekci infekce Mycobacterium tuberculosis.
Klinické informace máme dostupné jen u 53 osob s pozitivním výsledkem QFT‑G. U sedmi z nich byla následně diagnostikována aktivní tuberkulóza; mezi nimi jsme zachytili i mimoplicní TBC (střevní). U 44 pacientů s pozitivním výsledkem QFT‑G se na základě RTG, osobní nebo rodinné anamnézy přepokládá LTBI. Někteří z nich byli vzhledem k plánované biologické terapii přeléčeni profylaktickou terapií. U dvou pacientů se vzhledem k nepřítomnosti dalších podporujících znaků nepředpokládá ani aktivní, ani latentní tuberkulóza.
Ze zkušeností, které jsme během tří let na našem pracovišti získali s QFT-G testem, jsme si ověřili nutnost přísného dodržování doporučení daných výrobcem pro odběr, inkubaci a skladování odebraného materiálu. Z tohoto důvodu je potřeba s těmito doporučeními seznámit klinické pracovníky, kteří zajišťují odběr krve a další preanalytické fáze v písemné podobě i ústně. Je nutné tyto zásady opakovat. To znamená informovat nejen lékaře, který indikuje pacienta pro vyšetření QFT-G testem, ale hlavně zdravotní sestru, která odběr provádí, a ostatní personál, který obstarává uschování a transport materiálu do laboratoře.
Setkáváme se hlavně se snahou zdravotníků odebranou krev, uchovávat v chladu (v lednici). Máme zkušenost neurčitých výsledku po takto nevhodně skladovém materiálu.
Při hodnocení výsledků QFT-G testu je opět nutné postupovat dle doporučení výrobce. Je velmi vhodné výsledky konzultovat s lékaři. Díky těmto konzultacím s kliniky dochází k objasnění neurčitých výsledků (imunosupresivní léčba, jiné nemoci), ale může odhalit případný problém v průběhu preanalytické/analytické fáze metody. Při jakékoliv nejistotě správně provedeného postupu (od lékaře až po laboratoř) je nutné výsledek testu opakovat, a to i bez ohledu na ekonomickou ztrátu. Opakování výsledku je vhodné i v případě kdy naměřené hodnoty jsou na hranici pozitivity, nebo svědčí pro záměnu jednotlivých zkumavek.
Závěr
Pro perspektivní zabránění šíření infekce M. tuberculosis, je podle převažujících názorů v rozvinutých zemí nutné nejen identifikovat a léčit infekčního jedince s aktivním onemocněním, ale je také potřeba vyhledávat a profylakticky léčit osoby s latentní infekcí M. tuberculosis, u kterých je až 10 % riziko reaktivace. U latentní infekce se nevyskytují žádné klinické symptomy, objevující se u aktivní TBC, a není ani žádná standardní metoda pro její diagnostiku. Tradičně je LTBI diagnostikována pomocí kožního testu podle Mantoux. Nová metoda QFT-G poskytuje některé výhody oproti MT v diagnostice latentní tuberkulózy.
Výhodou testu je minimální zátěž pro pacienta, která spočívá v jednorázovém odběru periferní krve. Jelikož se jedná o metodu ex vivo, pacient není ohrožen nežádoucí reakcí proti stimulujícím antigenům. Pro hodnocení výsledku není nutná druhá návštěva lékaře, a vyšetření není zatíženo subjektivní chybou. Nevýhodou QFT-G jsou relativně vyšší materiálové náklady. Díky jeho vyšší specifitě ale snižuje náklady za neopodstatněnou profylaktickou léčbu falešně pozitivních pacientů hodnocených MT. A v neposlední řadě eliminuje riziko poškození zdraví způsobené léčbou v jiných testech falešně pozitivních osob.
Dle pravidel NICE (National Institute of Health and Clinical Excellence – NICE) je QFT-G test doporučován ve spojení s ostatními diagnostickými metodami a klinickými příznaky k vyloučení aktivní TBC. U latentní TBC je naopak vhodný k potvrzení infekce u MT pozitivních jedinců samozřejmě v kontextu s historií pacienta, s jeho socioekonomickými podmínkami a dalšími rizikovými faktory. Jelikož QFT-G není schopen odlišit aktivní onemocnění od LTBI, je nutné před potvrzením suspekce LTBI vyloučit aktivní onemocnění TBC.
V České republice není ještě v odborných kruzích shoda, jak postupovat v péči o ty pacienty, kterým byla prokázána latentní infekce M. tuberculosis tímto testem. Trendy ze západní Evropy a USA zastávají názor takovéto případy léčit profylaktickou terapií. Ta je jednoznačně indikována u nemocných s pozitivitou testu QFT-G vykazujících současně další rizikové faktory pro rozvoj TBC.
Poděkování:
Práce byla podpořena rozvojovým projektem Fakultní nemocnice v Hradci Králové pro rok 2008.
Mgr. Vladimíra Vroblová
Ústav klinické imunologie a alergologie
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
E-mail: vroblvla@fnhk.cz
Sources
1. Beglinger, Ch., Dudler, J., Mottet, Ch. et al. Screening for tuberculosis infection before initiation of anti-TNF‑α therapy. Swiss Med. Wkly. 2007, 137, p. 621-622.
2. Brock, I., Weldingh, K., Lillebaek, T. et al. Comparison of tuberculin skin test and new specific blood test in tuberculosis contacts. Am. J. Respir. Crit. Care Med. 2004, 170, p. 65-69.
3. Detjen, A.K., Keil, T., Roll, S. et al. Interferon-γ release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin. Infect. Dis. 2007, 45, p. 322-328.
4. Diel, R., Nienhaus, A., Lange, C. et al. Tuberculosis contact investigation with a new, specific blood test in a low-incidence population containing a high proportion of BCG-vaccinated persons. Respir. Res. 2006, 7(77), p. 1-9.
5. Diel, R., Nienhaus, A. Loddenkemper, R. Cost-effectiveness of interferon-γ release assay screening for latent tuberculosis infection treatment in Germany. Chest 2007, 131(5), p. 1424-1434.
6. Ferrara, G., Losi, M., Meacci, M. et al. Routine hospital use of a new commercial whole blood interferon-γ assay for the diagnosis of tuberculosis infection. Am. J. Respir Crit. Care Med. 2005, 172, p. 631-635.
7. Jones, S., Gijsel, D., Wallach, F.R. et al. Utility of QuantiFERON-TB Gold in-tube testing for latent TB infection in HIV-infected individuals. Int. J. Tuberc. Lung Dis. 2007, 11, p. 1190-1195.
8. Kang, Y,A., Lee, H.W., Hwang, S.S. et al. Usefulness of whole-blood interferon-γ assay and interferon-γ enzyme-linked immunospot assay in the diagnosis of active pulmonary tuberculosis. Chest 2007, 132, p. 959-965.
9. Kang, Y.A., Lee, H.W., Yoon, H.I. Discrepancy between the tuberculin skin test and the whole-blood interferon-g assay for the diagnosis of latent tuberculosis infection in an intermediate tuberculosis-burden country. JAMA 2005, 293, p. 2756-2761.
10. Kobashi, Y., Mouri, K., Obase, Y. et al. Clinical evaluation of QuantiFERON TB-2G test for immunocompromised patients. Eur. Respir. J. 2007, 30, p. 945-950.
11. Kobashi, Y., Obase, Y., Fukuda, M. et al. Usefulness of QuantiFERON TB-2G, a diagnostic method for latent tuberculosis infection, in a contact investigation of health care workers. Int. Med. 2007, 46(18), p. 1543-1549.
12. Krejsek, J. Kopecký, O. Klinická imunologie. 1. vyd. Hradec Králové: Nucleus 2004. s. 509-520.
13. Křepela, K. Diagnostika a léčba tuberkulózy dětí a mladistvých v ČR. Pediatrie pro praxi, 2007, 8(4), s. 208-210.
14. Lee, S.S., Liu, Y., Huang, T. et al. Comparison of the interferon- γ release assay and the tuberculin skin test for contact investigation of tuberculosis in BCG-vaccinated health care workers. Scand. J. Infect. Dis. 2007, 40(5), p. 1-8.
15. Mori, T., Sakatani, M., Yamagishi, F. et al. Specific detection of tuberculosis infection. Am. J. Respir. Crit. Care Med. 2004, 170, p. 59-64.
16. Okada, K., Mao, T.E., Mori, T. et al. Performance of an interferon-gamma release assay for diagnosing latent tuberculosis infection in children. Epidemiol. Infect. 2007, 136(9), p. 1-9.
17. Palomino, J.C., Lečo, S.C., Ritacco, V. Tuberculosis 2007. From basic science to patient care. [on line]. Dostupný na www.Tuberculosis Textbook.com.
18. Rangaka, M.X., Wilkinson, K.A., Seldon, R. Effect of HIV-1 infection on T-cell-based and skin test detection of tuberculosis infection. Am. J. Respir. Crit. Care Med. 2007, 175, p. 514-520.
19. Ravn, P., Munk, M.E., Andersen, A.B. et al. Prospective evaluation of whole-blood test using Mycobacterium tuberculosis-specific antigens ESAT-6 and CFP-10 for diagnosis of active tuberculosis. Clin. Diagn. Lab. Immunol. 2005, 12(4), p. 491-496.
20. Richeldi, L. An update on the diagnosis of tuberculosis infection. Am. J. Respir. Crit. Care Med. 2006, 174, p. 736-742.
21. Controlling Tuberculosis in the United States – Recommendations from the American Thoracic Society, CDC, and the Infectious Diseases Society of America. MMWR Recommendations and Reports 2005, 54, p. 1-81. Dostupné na http://www. cdc.gov/mmwr/preview/mmwrhtml/rr5412a1.htm.
22. Vincenti, D., Carrara, S., Butera, O. et al. Response to region of difference 1 (RD1) epitopes in human immunodeficiency virus (HIV)-infected individuals enrolled with suspected active tuberculosis: a pilot study. Clin. Exp. Immunol. 2007, 150(1), p. 91-98.
23. Wu, H.P., Hua, C.C., Liu, Y.C. et al. Comparison of interferon-γ response between tuberculosis and non-tubercular Pneumonia. Inflamm. Res. 2007, 56, p. 11-16.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2009 Issue 4
Most read in this issue
- Lichen sclerosus
- Detection of latent tuberculosis, QuantiFERON-TB Gold test, possibilities and pitfalls of the method
- Microvascular decompression of cranial nerves – effect and risk of treatment
- Current overview of the diagnosis and treatment of cancer of the stomach
