-
Medical journals
- Career
Sarkopenie, myosteatóza a syndrom křehkosti u pacientů s cirhózou jater
Authors: D. Erhartová Kyselová 1,2; Irena Míková 1; Pavel Trunečka 1
Authors‘ workplace: Klinika hepatogastroenterologie, IKEM, Praha 2 Fyziologický ústav 1. LF UK, Praha 1
Published in: Gastroent Hepatol 2022; 76(4): 288-295
Category: Clinical and Experimental Gastroenterology: Review Article
doi: https://doi.org/10.48095/ccgh2022288Overview
U zdravých jedinců jsou kosterní svaly největší tkání v těle (30–40 % celkové tělesné hmotnosti) a jsou v nich uloženy tři čtvrtiny všech tělesných proteinů. Změny svalové soustavy, zejména ve smyslu snížení svalové hmoty a funkce, významně ovlivňují prognózu a průběh řady chronických onemocnění, včetně chronických onemocnění jater. Jejich přítomnost je asociována s vyšší morbiditou, mortalitou a horší kvalitou života pacientů. K popisu změn svalové tkáně jsou používány pojmy sarkopenie, myosteatóza a s poruchou svalstva úzce souvisí i komplexnější pojem „frailty“, syndrom křehkosti. Sarkopenie je definována jako snížení množství svalové hmoty a/nebo svalové funkce, k diagnostice se nejčastěji používá stanovení tzv. skeletal muscle index (SMI) na úrovni třetího lumbálního obratle (L3) dle CT. Myosteatóza je definována jako přítomnost tuku ve svalech jak intramyocelulárně, tak intermyocelulárně a je diagnostikována na základě stanovení denzity svalů na CT v úrovni L3 (skeletal muscle radiation attenuation – SM-RA). Syndrom křehkosti (frailty) zahrnuje kromě změn svalové tkáně a poklesu schopnosti pohybu i změny dalších orgánových systémů, jejichž důsledkem je snížení rezerv organizmu a vyšší riziko nepříznivého průběhu onemocnění. K diagnostice se využívají různé skórovací systémy, např. Fried Frailty Index nebo modifikovaný Liver Frailty Index (LFI) u pacientů s jaterní cirhózou. Základem léčby pacientů s poruchami svalové tkáně je léčba základního onemocnění (včetně transplantace jater u pokročilé cirhózy), zlepšení výživy, dostatečná fyzická aktivita a léčba eventuálního deficitu vitaminu D. V tomto přehledovém článku shrnujeme aktuální pohled na patofyziologii, diagnostiku a léčbu sarkopenie, myosteatózy a syndromu křehkosti u pacientů s jaterní cirhózou.
Klíčová slova:
sarkopenie – jaterní cirhóza – myosteatóza – syndrom křehkosti
Úvod
Svalová tkáň tvoří velkou část tělesné hmoty člověka a její změny, zejména ve smyslu ztráty množství a funkce, hrají významnou roli v patofyziologii řady chronických onemocnění, včetně gastroenterologických a hepatologických [1]. Alterace svalové tkáně ovlivňuje prognózu pacientů s onkologickými diagnózami (včetně pacientů s kolorektálním karcinomem), pacientů podstupujících velké chirurgické výkony (včetně hepatobiliárních výkonů) a v neposlední řadě pacientů s chronickými jaterními chorobami [2–4]. Úbytek množství i funkce svalové tkáně velmi úzce souvisí se syndromem křehkosti (frailty). Ačkoli není možno položit rovnítko mezi sarkopenii a tento syndrom, je sarkopenie jeho poměrně snadno a objektivně měřitelnou komponentou. V tomto textu se budeme věnovat zejména změnám svalové tkáně u pacientů s cirhózou, a to především s ohledem ke snadnému přístupu k objektivnímu hodnocení na základě dnes široce dostupných zobrazovacích metod. Řadu zmíněných doporučení, ať diagnostických, nebo terapeutických, lze využít nejen u pacientů s cirhózou, ale i s jinými gastroenterologickými diagnózami.
Přestože je vliv změn svalové tkáně na prognózu pacientů s pokročilým jaterním onemocněním (ale i jinými chorobami) dlouho známý, jde o mimořádně opomíjené téma jak při hodnocení rizikovosti pacientů, tak při jejich následné léčbě. V poslední době se tato problematika dostává více do popředí a celosvětově byla publikována řada doporučených postupů předních společností a odborných prací, z nichž v tomto přehledovém článku vycházíme.
Definice pojmů, patofyziologie a klinické důsledky
K popisu změn svalové tkáně jsou používány pojmy sarkopenie, myosteatóza a komplexnější pojem syndrom křehkosti (frailty). Každý ze tří pojmů v sobě zahrnuje jinou část problematiky spojené se změnami svalové tkáně u pacientů s cirhózou. Všechny tři pojmy spolu nicméně úzce souvisejí a mají i podobné klinické důsledky a vliv na prognózu pacientů.
Sarkopenie
Pojem sarkopenie pochází z řečtiny, kde „sarco“ znamená maso a „penia“ nedostatek, a je definována jako zmenšení množství svalové hmoty a/nebo svalové funkce. Je zapříčiněna stárnutím nebo přítomností akutního či chronického onemocnění, včetně pokročilých dlouhotrvajících jaterních chorob. Sarkopenie má velmi úzký vztah k malnutrici, která je definována jako nedostatek živin způsobený nedostatečnou výživou a vede ke změnám složení tělesné hmoty, včetně svalů. Ztráta svalové hmoty tvoří podstatnou součást definice malnutrice v doporučených postupech významných společností (ESPEN – European Society for Parenteral and Enteral Nutrition, ASPEN – American Society for Parenteral and Enteral Nutrition, ISHEN – International Society for Hepatic Encephalopathy and Nitrogen Metabolism). Malnutricí trpí podstatná část pacientů s pokročilou cirhózou (20–50 %) a její negativní vliv na prognózu pacientů je již dlouho známý [5,6]. Diagnostika malnutrice u cirhotiků je obtížná. Využití BMI (body mass index) a obvodu pasu pro diagnostiku malnutrice v populaci cirhotiků jsou nepřesné, protože jsou často významně zkresleny přítomností ascitu [7]. Nejednoznačná může být i interpretace výsledků běžných laboratorních testů (například prealbumin nebo albumin), které jsou snížené primárně v důsledku jaterního selhání.
Výskyt sarkopenie stoupá s pokročilostí jaterní cirhózy a činí přibližně 40 % u pacientů funkční třídy Child-Pugh B a 47 % u Child-Pugh C [8]. Závisí ale rovněž na etiologii jaterní cirhózy, běžnější je u cholestatických jaterních chorob a dle některých prací i u alkoholické cirhózy [9,10]. Obezita ani vysoké BMI nevylučují přítomnost sarkopenie, pro takové případy se používá pojem sarkopenická obezita. Trpí jí až 35 % cirhotiků a často se jedná o pacienty s metabolickou tukovou chorobou jater (MAFLD), jichž v poslední době s celosvětovou pandemií obezity a metabolického syndromu významně přibývá [11]. U obézních pacientů často není sarkopenie při fyzikálním vyšetření evidentní, ale o to víc je na ni třeba při klinické rozvaze myslet. Navíc se zdá, že přítomnost sarkopenie spolu s obezitou je spojena s horší prognózou než přítomnost sarkopenie nebo obezity samostatně [11].
Sarkopenie se vyskytuje u 22–70 % pacientů na čekací listině k transplantaci jater (LTx) [12]. V našem publikovaném souboru 134 kandidátů LTx v IKEM byla prevalence sarkopenie 47,6 %, vyšší prevalence byla u mužů (51,7 %) než u žen (47,6 %), což je trend popsaný nezávisle i v několika zahraničních studiích. Přítomnost sarkopenie zvyšuje mortalitu pacientů s jaterní cirhózou zejména u mužů [13,14]. V přítomnosti sarkopenie lze u cirhotika očekávat jednoleté přežití 77 % a pětileté 45 %. Sarkopenie je i významným rizikovým faktorem mortality pacientů na čekací listině k LTx, výskytu pooperačních komplikací (zejména infekcí) a úmrtí po LTx, a to nezávisle na pokročilosti onemocnění vyjádřené MELD skóre (Model for End-stage Liver Disease Score) [4,7]. Sarkopenie je také nezávislým rizikovým faktorem vzniku jaterní encefalopatie u cirhotiků [15]. Ze společenského a ekonomického hlediska s sebou přítomnost sarkopenie přináší i vyšší finanční náklady na zdravotní péči [16].
Svaly jsou největším úložištěm proteinů v těle a pro udržení dostatečné svalové hmoty je nezbytná rovnováha mezi tvorbou (proteosyntézou) a degradací (proteolýzou) proteinů. Pokročilá jaterní cirhóza vede k nerovnováze mezi těmito procesy mnoha patofyziologickými mechanizmy, mezi něž patří porucha výživy související s portální hypertenzí, katabolizmus při vyšší úrovni bazálního metabolizmu cirhotiků (hyperkinetická cirkulace, zkratování, systémová zánětlivá odpověď), fyzická inaktivita často potencovaná přítomností jaterní encefalopatie, metabolické poruchy (porucha signalizace inzulinu, zvýšená glukoneogeneze, hyperamonemie), hormonální změny (snížení testosteronu a růstového hormonu) a snížená proteosyntéza. Důležitým regulátorem svalové hmoty na molekulární úrovni je myostatin, což je peptid ze superrodiny TGF-b, který ve svalech inhibuje proteosyntézu a zároveň je schopen zvyšovat autofagickou proteolýzu [17]. Myostatin působí lokálně a svalová aktivita snižuje jeho expresi. U pacientů s cirhózou je naopak jeho exprese zvýšená, mimo jiné i v důsledku hyperamonemie, která tak hraje důležitou roli v patofyziologii sarkopenie. Kromě zvýšení exprese myostatinu vede hyperamonemie i k poruše mTOR signalizace s následným zvýšením aktivity autofagie, která je spolu s ubikvitin-proteazomovým systémem klíčová v degradaci svalových bílkovin [1]. Sarkopenii prohlubuje nižší fyzická aktivita u pacientů s jaterní encefalopatií, exprese myostatinu je naopak blokována svalovou aktivitou [4].
Sarkopenie postihuje kromě kosterního svalstva i myokard a svalstvo bránice, a prohlubuje tak slabost a nízkou toleranci zátěže u cirhotiků [18].
Myosteatóza
Myosteatóza je charakterizovaná vyšším obsahem intermyocelulárního a intramyocelulárního tuku a může se vyskytovat nezávisle na přítomnosti sarkopenie. Prevalence myosteatózy u cirhotiků vyšetřovaných před LTx je více než 50 % [1]. Podobně jako sarkopenie je i myosteatóza asociována s horším přežíváním cirhotiků, s vyšším rizikem rozvoje jaterní encefalopatie a vyšší mortalitou na čekací listině k LTx [15]. Přítomnost myosteatózy byla spojena i s horším přežíváním onkologických pacientů a pacientů po velkých chirurgických výkonech [2,3,19]. Přes určité společné rysy není klinický význam myosteatózy a sarkopenie identický.
Přítomnost myosteatózy byla nezávislým rizikovým faktorem nepříznivého průběhu po LTx, a to nezávisle na přítomnosti či stupni sarkopenie [20,21]. Dle retrospektivní analýzy 225 pacientů po LTx z Univerzitní nemocnice v Aachen trpělo myosteatózou 44 % pacientů, kteří měli významně vyšší riziko komplikací (p < 0,001), delší dobu pobytu po LTx na jednotce intenzivní péče (p < 0,001), celkovou dobu hospitalizace (p < 0,001) a o 44 % vyšší finanční náklady na peritransplantační péči [20]. Naproti tomu v recentní studii z Mayo Clinic, v níž bylo hodnoceno 265 kandidátů LTx indikovaných pro cirhózu při NASH nebo etylické etiologie, nebyla přítomnost myosteatózy spojena s nepříznivým průběhem (úmrtí nebo vyřazení z čekací listiny nebo nepříznivý potransplantační průběh) [22]. V prospektivním souboru 134 kandidátů LTx v IKEM byla prevalence myosteatózy 51,5 %. Pacienti s myosteatózou vyžadovali vyšší počet podaných erymas během LTx (p = 0,043) i po LTx (p = 0,002), vyšší počet operačních revizí (p = 0,037) a měli horší dlouhodobé přežívání po LTx než pacienti bez myosteatózy [21]. Kromě ztráty svalové hmoty je tak důležitá i kvalita svalů a horší prognózou mohou být ohroženi i pacienti s myosteatózou a normálním množstvím svalů (tj. bez sarkopenie).
Myosteatóza nevzniká pouze u obézních osob v důsledku ektopického ukládání nadměrného množství tuků po vyčerpání kapacity tukové tkáně, ale i u osob s normální či nízkou hmotností. Patogeneze myosteatózy není plně objasněna, roli hraje i inzulinová rezistence [1,23]. Nedostatečná reakce svalů na inzulin vede k poklesu vychytávání glukózy z periferní krve, snížení aktivace mTOR dráhy, poklesu proteosyntézy, zvýšení proteolýzy, jejichž důsledkem je snížení svalové hmoty a zřejmě i nahrazení svalové tkáně tukovou. Patologická akumulace tuků ve svalech vytváří prozánětlivý stav s produkcí prozánětlivých cytokinů a adipocytokinů, které následně ovlivňují imunitní reakci organizmu a vedou ke zvýšenému oxidačnímu stresu [1].
Myosteatóze je na rozdíl od sarkopenie věnována mnohem menší pozornost, diagnostika ani hodnocení stupně myosteatózy nejsou součástí recentních doporučených postupů AASLD (American Association for the Study of Liver Diseases) či EASL (European Association for the Study of the Liver). S ohledem k možnému klinickému významu, snadnému měření a narůstajícímu počtu pacientů s MAFLD se může význam stanovení myosteatózy v budoucnu zvyšovat.
Syndrom křehkosti (frailty)
Syndrom křehkosti (frailty) je definován jako stav snížené odolnosti vůči stresorům, který vyplývá z úbytku kapacity často více fyziologických systémů a vede ke zvýšení rizika nepříznivého průběhu onemocnění či výsledku léčebné intervence. Pojem křehkosti (frailty) pochází z geriatrie, nicméně se v poslední době stále častěji objevuje i v kontextu chronických onemocnění včetně cirhózy. Křehký fenotyp je spojen s vyšším výskytem pádů, zhoršenou pohyblivostí, vyšší frekvencí hospitalizace a úmrtí u starších nemocných (> 65 let věku) [24]. Patofyziologie syndromu křehkosti u pacientů s cirhózou není zcela jasná, zřejmě je důsledkem komplexní dysfunkce více orgánových systémů (neuromuskulárního, endokrinního, imunitního, ale například i změny střevního mikrobiomu). Pojem frailty je daleko komplexnější než sarkopenie, která popisuje pouze samotnou ztrátu svalové hmoty (tab. 1). Prevalence syndromu frailty v populaci čekatelů na LTx dle dostupných studií dosahuje 17–49 % [25], jeho přítomnost je rizikovým faktorem mortality na čekací listině k LTx [26]. S narůstajícím počtem pacientů starších 65 let na čekací listině k LTx v posledních letech bude zřejmě v budoucnu narůstat i počet pacientů splňujících kritéria syndromu křehkosti.
Table 1. Diagnostická kritéria pro sarkopenii a syndrom křehkosti u pacientů s cirhózou. Volně podle [24].
Tab. 1. Diagnostic criteria for sarcopenia and frailty syndrome in patients with cirrhosis. Freely according to [24].![Diagnostická kritéria pro sarkopenii a syndrom křehkosti u pacientů s cirhózou. Volně podle [24].<br>
Tab. 1. Diagnostic criteria for sarcopenia and frailty syndrome in patients with cirrhosis. Freely according to [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/51b137a79612945f446bf0111c9a4a3b.jpg)
Diagnostika
Metody využívané k diagnostice sarkopenie jsou značně heterogenní a využívají hodnocení jak svalové hmoty, tak i svalové síly. K hodnocení svalové síly se nejčastěji používá měření dynamometrem (většinou síla stisku ruky). K hodnocení množství svalové hmoty lze využít antropometrické hodnoty (měření obvodu končetin s korekcí na tloušťku podkoží), bioelektrickou impedanční analýzu nebo zobrazovacích metody, většinou výpočetní tomografii (CT), ale i denzitometrii (DEXA), ultrazvuk nebo magnetickou rezonanci (MR).
Nejrozšířenější a patrně nejpřesnější metodou je stanovení tzv. skeletal muscle index (SMI, index kosterního svalstva), který lze vypočítat jako plochu kosterního svalstva na příčném řezu v úrovni třetího bederního obratle (L3) z CT břicha vydělenou druhou mocninou výšky těla v metrech. Použít lze CT břicha s kontrastem i bez kontrastu. Dle FLEXIT (Fitness, Life Enhacement, and Exercise in Liver Transplantation Consortium) jsou hodnoty < 39 cm2/m2 pro ženy a < 50 cm2/m2 pro muže považovány za sarkopenii [27]. Tato metoda je k hodnocení sarkopenie doporučována i North American Working Group on Sarcopenia in Liver Transplantation [28]. Reprodukovatelnost vyžaduje správnou kalibraci CT přístroje.
Zdá se, že analogicky lze spočítat SMI ze snímků z MR a že hodnoty jsou ekvivalentní s těmi z CT [29]. Výhodou MR je absence radiační zátěže, nevýhodou je omezená dostupnost a vysoká cena. CT nebo MR břicha pacienti s cirhózou často podstupují i z jiné indikace (podezření na hepatocelulární karcinom, cirkulační poruchy jater, předtransplantační vyšetření), a výpočet SMI tak může být jednoduše doplněn. SMI je komplexnějším a přesnějším parametrem pro hodnocení přítomnosti sarkopenie než měření samotného musculus psoas major nebo indexu musculus psoas (PMI).
Přítomnost sarkopenie bychom měli vyšetřit u každého pacienta s cirhózou, neboť její časné odhalení dává největší možnost terapeuticky zasáhnout. CT břicha jen z důvodu stanovení SMI nemá být indikováno, přednost mají metody dostupnější v každodenní klinické praxi (například měření síly stisku ruky).
Hodnocení stavu svalové tkáně je standardní součástí předtransplantačního vyšetření všech kandidátů LTx a mělo by být i standardem u ostatních pacientů s pokročilým jaterním onemocněním zvažovaných k chirurgické intervenci. Všichni tito nemocní podstupují zobrazovací vyšetření (CT nebo MR), a lze proto snadno stanovit SMI. Samotná sarkopenie či vysoký stupeň frailty a s nimi spojené vyšší riziko pooperační nebo potransplantační morbidity a mortality by neměly být jediným důvodem ustoupení od chirurgické intervence nebo nezařazení pacienta na čekací listinu. Měly by se stát nedílnou součástí komplexního posuzování rizikovosti pacienta, zcela samozřejmě se tento požadavek týká kandidátů LTx. Takové rozhodování by nicméně mělo být multidisciplinární a velmi opatrné, neboť není jasně dané, jaké hodnoty jsou pro špatný outcome pacientů kritické. Jejich objektivizace může přispět ke stanovení hranic marné intervence. Přístup k posuzování je v současnosti velmi individuální a významně se liší mezi transplantačními centry, jednotlivými lékaři i pacienty [28].
Přítomnost sarkopenie u kandidátů LTx by nás měla vést ke snaze o terapeutickou intervenci a zlepšení stavu svalové tkáně, a tím zlepšení prognózy pacienta.
Myosteatóza se nejčastěji stanovuje rovněž při CT vyšetření (nejčastěji velkých svalů v okolí páteře), které neumí odlišit, zda se jedná o tuk lokalizovaný uvnitř myofilament (intramyocelulárně), či mezi nimi (intermyocelulárně). Jeden ze způsobů stanovení přítomnosti myosteatózy je měření atenuace záření v hounsfieldových jednotkách (HU) ve tkáni kosterních svalů (skeletal muscle radiation attenuation – SM - -RA) při transversálním CT vyšetření břicha (opět nejčastěji v úrovni L3). Kritické hodnoty jsou SM-RA < 41 HU u pacientů s BMI < 24,9 kg/m2 nebo SM-RA < 33 HU u pacientů s BMI ≥ 25 kg/m2 bez rozdílu pohlaví.
Pro posuzování přítomnosti a stupně křehkosti se v geriatrické populaci užívá například Fried Frailty Index (FFI) [30]. Jako proměnné zde vystupují: úbytek hmotnosti, únavnost, rychlost chůze, síla stisku ruky a součet týdenní fyzické aktivity (tab. 2) [24]. Dosahuje hodnot od 0 do 5 a hodnoty > 3 jsou diagnostické pro syndrom křehkosti. Pro měření křehkosti u pacientů s jaterním onemocněním byla vytvořena i specifická škála – Liver Frailty Index (LFI, obr. 1) [31]. V rámci LFI se hodnotí síla stisku ruky (výživa), počet zvednutí ze židle za 30 sekund (svalová síla) a udržení rovnováhy ve třech pozicích na minimálně 10 sekund (neuromotorická koordinace). Skóre dosahuje hodnot od 1 do 7 a pro přítomnost křehkosti svědčí hodnoty > 4,5 [31]. Kalkulátor LFI je k dispozici on-line (https: //liverfrailtyindex.ucsf.edu/), na odkazu je k dispozici i detailní popis jednotlivých částí vyšetření. Kombinace LFI a MELD-Na skóre byla přesnější v hodnocení rizika 3měsíční mortality na čekací listině než samotný MELD-Na [31]. Tento skórovací systém je ovšem třeba validovat i na dalších souborech.
Table 2. Fried Frailty Index (FFI). Volně podle [24].
Tab. 2. Fried Frailty Index (FFI). Freely according to [24].![Fried Frailty Index (FFI). Volně podle [24].<br>
Tab. 2. Fried Frailty Index (FFI). Freely according to [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/106e399e7dc222d8e6a099e25929b052.jpg)
Léčba a prevence
Pacienty, které identifikujeme jako rizikové, je nezbytné léčit, a snažit se tak zlepšit jejich celkovou prognózu. Léčba a prevence syndromu frailty, sarkopenie (a patrně i myosteatózy) vyžaduje především léčbu základního onemocnění (jaterní choroby), adekvátní výživu (vyšší kalorický příjem, suplementaci bílkovin včetně větvených aminokyselin [BCAA], pozdní večerní jídlo), tělesné cvičení, prevenci a léčbu jaterní encefalopatie, léčbu nedostatku vitaminu D a samozřejmě včasnou indikaci LTx [4,28]. Možnosti léčby shrnuje tab. 3.
Table 3. Možnosti léčby cirhotiků se sarkopenií.
Tab. 3. Treatment options for cirrhotic patients with sarcopenia.
U pacientů se sarkopenií před LTx nebo velkými chirurgickými výkony se setkáváme s novým pojmem prehabilitace [32]. Jedná se o komplexní přístup k rizikovým pacientům, který má za cíl před LTx nebo před velkým chirurgickým zákrokem zlepšit jejich celkový fyzický a nutriční stav, a tedy snížit riziko pooperačních komplikací a dobu stonání, včetně snížení finančních nákladů. Výsledky u chirurgických pacientů jsou slibné, v kohortě kandidátů LTx jsou data zatím omezená [33].
Výživa
Dle aktuálních doporučení EASL pro výživu pacientů s chronickým jaterním onemocněním je u pacientů s BMI < 30 kg/m2 doporučený denní energetický příjem minimálně 35 kcal/kg tělesné hmotnosti [6]. V případě přítomnosti ascitu je třeba hmotnost korigovat. Důležitý je i dostatečný denní přísun bílkovin (1,2–1,5 g/kg tělesné hmotnosti), který není třeba omezovat ani u pacientů s jaterní encefalopatií. Z důvodu omezení nočního lačnění je doporučeno pozdní večerní jídlo před spaním i časné ranní jídlo, jeho nejvhodnější složení není jasné, mělo by obsahovat proteiny. Lačnění by se cirhotici měli vyvarovat obecně, nejen v noci, což je vhodné brát na zřetel u plánování vyšetření a intervencí, které ho vyžadují (například UZ, gastroskopie).
Tělesné cvičení
Přestože má tělesné cvičení významný anabolický efekt na svaly, jedná se o mimořádně opomíjenou oblast léčby pacientů s pokročilým jaterním onemocněním. Tomu odpovídá i absence jasných doporučení podpořených důkazy o nejvhodnějším typu a rozsahu cvičení u pacientů s cirhózou. Většina dostupných studií se týká jen malých vzorků pacientů. Obecně je doporučena fyzická aktivita ve střední intenzitě > 30 minut denně 3–5× za týden. Celkový čas cvičení za týden by měl být 150–200 minut a měl by být zastoupen jak aerobní, tak silový trénink, ideálně v poměru 3 : 2 [34]. Vzhledem k absenci vhodných tělocvičen v nemocničních zařízeních cvičí v České republice v naprosté většině pacienti sami doma, což může významně limitovat správnost, a tedy i efektivnost cvičení. Studie sledující 53 pacientů s cirhózou navíc popsala, že až 76 % času, kdy jsou vzhůru, tráví sedavým způsobem života [35].
Farmakoterapie
Nedostatek vitaminu D je u pacientů s cirhózou častý, postiženo je 64–92 % pacientů, a přispívá k rozvoji sarkopenie. Je proto vhodné zkontrolovat jeho hladinu v krvi a případně ho suplementovat [36,37]. Doporučené cílové sérové hodnoty hydroxycholekalciferolu (25 (OH) D) jsou > 30 ng/ml (tj. 75 nmol/l) [6]. Nedostatek vitaminu D je častější u pacientů s cholestatickými jaterními chorobami (primární biliární cholangitida, primární sklerozující cholangitida).
Roli v patofyziologii vzniku sarkopenie hraje i nízká hladina testosteronu a růstového hormonu, u vybraných skupin pacientů lze zvážit hormonální léčbu (intramuskulární podání androgenů), nicméně výsledky studií mají nekonzistentní výsledky. Podávání testosteronu bylo navíc spojeno s vyšším rizikem rozvoje hepatocelulárního karcinomu a jistě takový postup nelze doporučit paušálně [6,38]. Podobně rozporuplné jsou i výsledky studií týkajících se podávání L-carnitinu.
Závěr
Vztah mezi množstvím a funkcí svalové tkáně, což jsou významné komponenty syndromu křehkosti, a výsledky léčebných intervencí je nesporný a byl prokázán v řadě kvalitních studií. Z důvodu centrálního postavení jater v proteosyntéze nabývají tyto poznatky mimořádného významu zejména u pacientů s těžkou poruchou jaterní funkce, zdaleka se ale netýkají jen pacientů zvažovaných k LTx.
V současné hepatologii, a to nejen transplantační, patří syndrom křehkosti, sarkopenie a myosteatóza mezi aktuální témata, protože se jedná o faktory významně ovlivňující prognózu pacienta, a to nezávisle na dosavadních predikčních modelech. Z tohoto pohledu je v současné klinické praxi nutné u každého cirhotika (ne) přítomnost sarkopenie zhodnotit, minimálně neinvazivně, a s touto informací náležitě pracovat při rozhodování o dalším postupu léčby pacienta. K dispozici jsou i klinicky využitelné testy křehkosti, jejich použití v praxi může narážet na nedostatek dedikovaného personálu, přesnému stanovení přítomnosti a stupně sarkopenie však nic nebrání. Sarkopenii a do jisté míry i syndrom křehkosti je možné považovat za modifikovatelné rizikové faktory jaterní cirhózy. Naprosto standardní součástí léčby cirhotiků by proto měla být edukace zaměřená na zásady správné výživy, vhodné tělesné aktivity a případně i včasné informování o perspektivách transplantační léčby a stejně tak o systému prehabilitace pacientů před náročnými léčebnými intervencemi. Tyto postupy nejsou v současnosti široce dostupné. Zlepšení situace by velmi prospělo vytvoření sítě vzdělaných nelékařských zdravotnických pracovníků, kteří by pacientům pomáhali s úpravou životosprávy, a to zejména s ohledem na stravování a tělesné cvičení, které by probíhalo ideálně ve specializovaných tělocvičnách a pod odborným ohledem.
Seznam použitých zkratek
AASLD – American Association for the Study of Liver Diseases
ASPEN – American Society for Parenteral and Enteral Nutrition
BCAA – branched chain amino acids
BMI – body mass index
CT – computed tomography
DEXA – dual-energy X-ray absorptiometry
EASL – European Association for the Study of the Liver
ESPEN – European Society for Parenteral and Enteral Nutrition
FLEXIT – Fitness, Life Enhacement, and Exercise in Liver Transplantation Consortium
FFI – Fried Frailty Index
HU – Hounsfield units
IKEM – Institut klinické a experimentální medicíny
ISHEN – International Society for Hepatic Encephalopathy and Nitrogen Metabolism
MAFLD – metabolic-associated fatty liver disease
MELD – model for end-stage liver disease
MR – magnetická rezonance
NASH – non-alcoholic steatohepatitis
LFI – liver frailty index
LTx – transplantace jater
PMI – index musculus psoas
SMI – sceletal muscle index
SM-RA – sceletal muscle radiation attenuation
TGF-β – transforming growth factor β
Poděkování
Děkujeme grafičce IKEM Kláře Maryníkové za obrázek 1.
Image 1. Liver Frailty Index (LFI). Výpočet: (–0,330 x síla stisku ruky dle pohlaví) + (–2,529 x počet zvednutí ze židle za 30 sekund) + (–0,040 x doba udržení rovnováhy ve třech pozicích) + 6.
Hodnoty vyšší než 4,5 jsou diagnostické pro přítomnost křehkého fenotypu. (Se svolením Kláry Maryníkové.)
Fig. 1. Liver Frailty Index (LFI). Calculation: (–0,330 x hand grip strength according to gender) + (–2,529 x number of lifts from a chair in 30 seconds) + (–0,040 x time to maintain balance in three positions) + 6.
Values higher than 4,5 are diagnostic for the presence of frailty phenotype. (With the permission of Klára Maryníková.)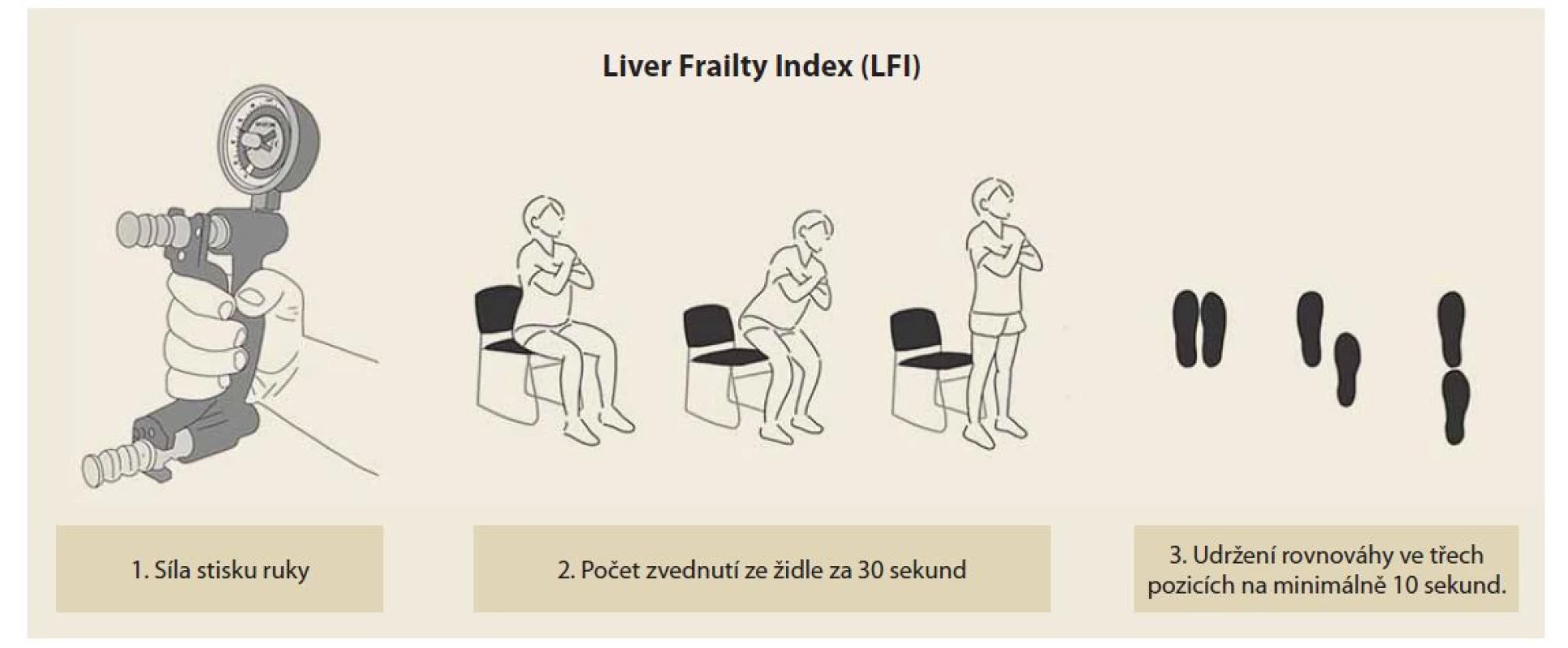
ORCID autorů
D. Kyselová ORCID 0000-0001-6652-653X,
I. Míková ORCID 0000-0001-7928-7558,
P. Trunečka ORCID 0000-0002-4753-4419.
Doručeno/Submitted: 28. 7. 2022
Přijato/Accepted: 2. 8. 2022
MUDr. Denisa Kyselová (Erhartová)
Klinika hepatogastroenterologie
IKEM
Vídeňská 1958/9
140 21 Praha 4
denisa.erhartova@ikem.czhttp://denisa.erhartova@ikem.cz
Sources
1. Nachit M, Leclercq IA. Emerging awareness on the importance of skeletal muscle in liver diseases: Time to dig deeper into mechanisms! Clin Sci (Lond) 2019; 133 (3): 465-481. doi: 10.1042/CS20180421.
2. Kazemi-Bajestani SMR, Mazurak VC, Baracos V. Computed tomography-defined muscle and fat wasting are associated with cancer clinical outcomes. Semin Cell Dev Biol 2016; 54 : 2–10. doi: 10.1016/j.semcdb.2015.09.001.
3. Kroenke CH, Prado CM, Meyerhardt JA et al. Muscle radiodensity and mortality in patients with colorectal cancer. Cancer 2018; 124 (14): 3008–3015. doi: 10.1002/cncr.31405.
4. Tandon P, Montano-Loza AJ, Lai JC et al. Sarcopenia and frailty in decompensated cirrhosis. J Hepatol 2021; 75 (Suppl 1): S147–S162. doi: 10.1016/j.jhep.2021.01.025.
5. Merli M, Riggio O, Dally L. Does malnutrition affect survival in cirrhosis? PINC (Policentrica Italiana Nutrizione Cirrosi). Hepatology 1996; 23 (5): 1041–1046. doi: 10.1002/hep.510230516.
6. Merli M, Berzigotti A, Zelber-Sagi S et al. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol 2019; 70 (1): 172–193. doi: 10.1016/j.jhep.2018.06.024.
7. Bischoff SC, Bernal W, Dasarathy S et al. ESPEN practical guideline: Clinical nutrition in liver disease. Clin Nutr 2020; 39 (12): 3533–3562. doi: 10.1016/j.clnu.2020.09.001.
8. Tantai X, Liu Y, Yeo YH et al. Effect of sarcopenia on survival in patients with cirrhosis: A meta-analysis. J Hepatol 2022; 76 (3): 588–599. doi: 10.1016/j.jhep.2021.11.006.
9. Dasarathy J, McCullough AJ, Dasarathy S. Sarcopenia in Alcoholic Liver Disease: Clinical and Molecular Advances. Alcohol Clin Exp Res 2017; 41 (8): 1419–1431. doi: 10.1111/acer.13425.
10. DiCecco SR, Wieners EJ, Wiesner RH et al. Assessment of Nutritional Status of Patients With End-Stage Liver Disease Undergoing Liver Transplantation. Mayo Clin Proc 1989; 64 (1): 95–102. doi: 10.1016/s0025-6196 (12) 65308-7.
11. Eslamparast T, Montano-Loza AJ, Raman M et al. Sarcopenic obesity in cirrhosis – The confluence of 2 prognostic titans. Liver Int 2018; 38 (10): 1706–1717. doi: 10.1111/liv.13876.
12. van Vugt JLA, Levolger S, de Bruin RWF et al. Systematic Review and Meta-Analysis of the Impact of Computed Tomography-Assessed Skeletal Muscle Mass on Outcome in Patients Awaiting or Undergoing Liver Transplantation. Am J Transplant 2016; 16 (8): 2277–2292. doi: 10.1111/ajt.13732.
13. Ebadi M, Tandon P, Moctezuma-Velazquez C et al. Low subcutaneous adiposity associates with higher mortality in female patients with cirrhosis. J Hepatol 2018; 69 (3): 608–616. doi: 10.1016/j.jhep.2018.04.015.
14. Kuo SZ, Ahmad M, Dunn MA et al. Sarcopenia Predicts Post-transplant Mortality in Acutely Ill Men Undergoing Urgent Evaluation and Liver Transplantation. Transplantation 2019; 103 (11): 2312–2317. doi: 10.1097/TP.0000000000002741.
15. Bhanji RA, Moctezuma-Velazquez C, Duarte-Rojo A et al. Myosteatosis and sarcopenia are associated with hepatic encephalopathy in patients with cirrhosis. Hepatol Int 2018; 12 (4): 377–386. doi: 10.1007/s12072-018-9875-9.
16. van Vugt JLA, Buettner S, Alferink LJM et al. Low skeletal muscle mass is associated with increased hospital costs in patients with cirrhosis listed for liver transplantation – a retrospective study. Transpl Int 2018; 31 (2): 165–174. doi: 10.1111/tri.13048.
17. Periyalwar P, Dasarathy S. Malnutrition in Cirrhosis: Contribution and Consequences of Sarcopenia on Metabolic and Clinical Responses. Clin Liver Dis 2012; 16 (1): 95–131. doi: 10.1016/ j.cld.2011.12.009.
18. Bhanji RA, Montano-Loza AJ, Watt KD. Sarcopenia in Cirrhosis: Looking Beyond the Skeletal Muscle Loss to See the Systemic Disease. Hepatology 2019; 70 (6): 2193–2203. doi: 10.1002/hep.30686.
19. van Dijk DPJ, Bakers FCH, Sanduleanu S et al. Myosteatosis predicts survival after surgery for periampullary cancer: a novel method using MRI. HPB (Oxford) 2018; 20 (8): 715–720. doi: 10.1016/j.hpb.2018.02.378.
20. Czigany Z, Kramp W, Bednarsch J et al. Myosteatosis to predict inferior perioperative outcome in patients undergoing orthotopic liver transplantation. Am J Transplant 2020; 20 (2): 493–503. doi: 10.1111/ajt.15577.
21. Míková I, Kyselová D, Kautznerová D et al. Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů. Gastroent Hepatol 2021; 75 (4): 311–322. doi: 10.48095/ ccgh2021311.
22. Bhanji RA, Narayanan P, Moynagh MR et al. Differing Impact of Sarcopenia and Frailty in Nonalcoholic Steatohepatitis and Alcoholic Liver Disease. Liver Transplant 2019; 25 (1): 14–24. doi: 10.1002/lt.25346.
23. Petersen MC, Shulman GI. Mechanisms of insulin action and insulin resistance. Physiol Rev 2018; 98 (4): 2133–2223. doi: 10.1152/ physrev.00063.2017.
24. Van Jacobs AC. Frailty Assessment in Patients with Liver Cirrhosis. Clin Liver Dis (Hoboken) 2019; 14 (3): 121–125. doi: 10.1002/cld.825.
25. Laube R, Wang H, Park L et al. Frailty in advanced liver disease. Liver Int 2018; 38 (12): 2117–2128. doi: 10.1111/liv.13917.
26. Lai JC, Feng S, Terrault NA et al. Frailty predicts waitlist mortality in liver transplant candidates. Am J Transplant 2014; 14 (8): 1870–1879. doi: 10.1111/ajt.12762.
27. Carey EJ, Lai JC, Wang CW, et al. A multicenter study to define sarcopenia in patients with end-stage liver disease. Liver Transplant 2017; 23 (5): 625–633. doi: 10.1002/lt.24750.
28. Carey EJ, Lai JC, Sonnenday C et al. A North American Expert Opinion Statement on Sarcopenia in Liver Transplantation. Hepatology 2019; 70 (5): 1816–1829. doi: 10.1002/hep.30828.
29. Tandon P, Mourtzakis M, Low G et al. Comparing the Variability Between Measurements for Sarcopenia Using Magnetic Resonance Imaging and Computed Tomography Imaging. Am J Transplant 2016; 16 (9): 2766–2767. doi: 10.1111/ajt.13832.
30. Fried LP, Tangen CM, Walston J et al. Frailty in older adults: Evidence for a phenotype. J Gerontol A Biol Sci Med Sci 2001; 56 (3): M146–M156. doi: 10.1093/gerona/56.3.m146.
31. Lai JC, Covinsky KE, Dodge JL et al. Development of a novel frailty index to predict mortality in patients with end-stage liver disease. Hepatology 2017; 66 (2): 564–574. doi: 10.1002/hep.29219.
32. Lai JC, Sonnenday CJ, Tapper EB et al. Frailty in liver transplantation: An expert opinion statement from the American Society of Transplantation Liver and Intestinal Community of Practice. Am J Transplant 2019; 19 (7): 1896–1906. doi: 10.1111/ajt.15392.
33. Lin FP, Visina JM, Bloomer PM et al. Prehabilitation-Driven Changes in Frailty Metrics Predict Mortality in Patients With Advanced Liver Disease. Am J Gastroenterol 2021; 116 (10): 2105–2117. doi: 10.14309/ajg.0000000000001376.
34. Tandon P, Ismond KP, Riess K et al. Exercise in cirrhosis: Translating evidence and experience to practice. J Hepatol 2018; 69 (5). 1164–1177. doi: 10.1016/j.jhep.2018.06.017.
35. Dunn MA, Josbeno DA, Tevar AD et al. Frailty as Tested by Gait Speed is an Independent Risk Factor for Cirrhosis Complications that Require Hospitalization. Am J Gastroenterol 2016; 111 (12): 1768–1775. doi: 10.1038/ajg.2016.336.
36. Corey RL, Whitaker MD, Crowell MD et al. Vitamin D deficiency, parathyroid hormone levels, and bone disease among patients with end-stage liver disease and normal serum creatinine awaiting liver transplantation. Clin Transplant 2014; 28 (5): 579–584. doi: 10.1111/ctr.12351.
37. Uchitomi R, Oyabu M, Kamei Y. Vitamin D and sarcopenia: Potential of vitamin D supplementation in sarcopenia prevention and treatment. Nutrients 2020; 12 (10): 3189. doi: 10.3390/nu12103189.
38. Nagasue N, Yukaya H, Chang YC et al. Active uptake of testosterone by androgen receptors of hepatocellular carcinoma in humans. Cancer 1986; 57 (11): 2162–2167. doi: 10.1002/1097-0142 (19860601) 57 : 11<2162:: aid-cncr2820571114>3.0.co; 2-6.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2022 Issue 4-
All articles in this issue
- Clinical and experimental gastroenterology
- Kvíz z klinické praxe
- Sarcopenia, myosteatosis and frailty in patients with liver cirrhosis
- Role of biological therapy in early Crohn’s disease: mini-review
- Colorectal carcinoma after liver transplantation
- Pelvic floor disorders of women from the point of coloproctologist‘s view
- Association of non-alcoholic fatty liver disease with cardiac structural impairment
- The selection from international journals
- Ivo Novotný, MD, PhD, left and endoscopic Brno will never be the same
- Report on the activities of the ČGS ČLS JEP committee in the period 2018–2022
- Professor Martin Freeman as a guest at Olomouc Live Endoscopy 2022
- That’s how time passed with PBC – it is necessary to move one step forward again
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Effect of ketamine, an NMDA-receptor antagonist, on gastric myoelectric activity in experimental pigs
- Lifestyle modification for improving anxiety and depression among patients with irritable bowel syndrome
- Liver cirrhosis in Roma patients from the perspective of the liver transplant centre
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pelvic floor disorders of women from the point of coloproctologist‘s view
- Ivo Novotný, MD, PhD, left and endoscopic Brno will never be the same
- Sarcopenia, myosteatosis and frailty in patients with liver cirrhosis
- Role of biological therapy in early Crohn’s disease: mini-review
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

