GNET tenkého střeva
Authors:
Málková Š. 1; Papík Z. 1; Navrátilová B. 2
Authors‘ workplace:
Endoskopické centrum, Oblastní nemocnice Náchod a. s.
1; Patologické oddělení, Oblastní nemocnice Náchod a. s.
2
Published in:
Gastroent Hepatol 2020; 74(6): 543-546
Category:
Digestive Endoscopy: Case Report
doi:
https://doi.org/10.48095/ccgh2020543
Overview
Souhrn: Kazuistika prezentuje vzácný maligní tumor duodenojejunálního přechodu s generalizací u starší polymorbidní ženy, který se projevil symptomy vysokého ileu. Tumor infiltroval téměř celou šíři stěny s výjimkou vrstvy mukózy a metastaticky postihoval lymfatické uzliny a nástěnné i viscerální peritoneum. Diagnóza byla stanovena po chirurgické resekci na základě histologického a imunohistochemického vyšetření, kde byla pozitivita S100 proteinu a synaptofyzinu.
Klíčová slova:
tumor tenkého střeva – vysoký ileus – imunohistochemie – GNET
Úvod
Maligní gastrointestinální neuroektodermální tumor (GNET) je vzácný agresivní maligní tumor, který se vyskytuje výhradně ve stěně gastrointestinálního traktu. GNET byl poprvé popsán jako „tumor bohatý na osteoklasty gastrointestinálního traktu s rysy připomínajícími sarkom jasných buněk (CCS) měkkých tkání“ v roce 2003 Zambranem et al [1].
Ačkoli GNET sdílí určité histologické znaky s CCS, je charakterizován nedostatkem melanocytů a přítomností obřích buněk podobných osteoklastům. Imunohistochemicky exprimuje S100 protein, vimentin, CD56 a transkripční faktor SOX-10 a je negativní na markery CD117 a melanocytové markery [2]. GNET může být patologem nevědomě dia gnostikován jako gastrointestinální stromální tumor (GIST), CCS nebo maligní tumor periferního nervu (MPNST) [3].
Popis případu
Žena, 71 let, byla přivezena rychlou záchrannou službou a následně hospitalizována na interním oddělení pro jednodenní anamnézu zvracení, bolesti břicha, bolesti na hrudi a slabost. Dietní chyby si nebyla vědoma. V osobní anamnéze se vyskytuje v březnu 2019 úraz v ebrietě, kdy si pacientka způsobila frakturu pánevní kosti vpravo a kontuzi v oblasti pravé orbity. Dle jejích dětí je neléčená hypertonička a alkoholička. Léky chronicky žádné neužívala.
Při vstupním fyzikálním vyšetření byla pacientka neklidná, stále měnila polohu. Verbální kontakt byl omezený, ale s plnou orientací. Nejevila známky hemodynamické nestability. Byla přítomna výrazná palpační bolestivost v levém podbřišku se slabě slyšitelnou peristaltikou, bez hmatné rezistence.
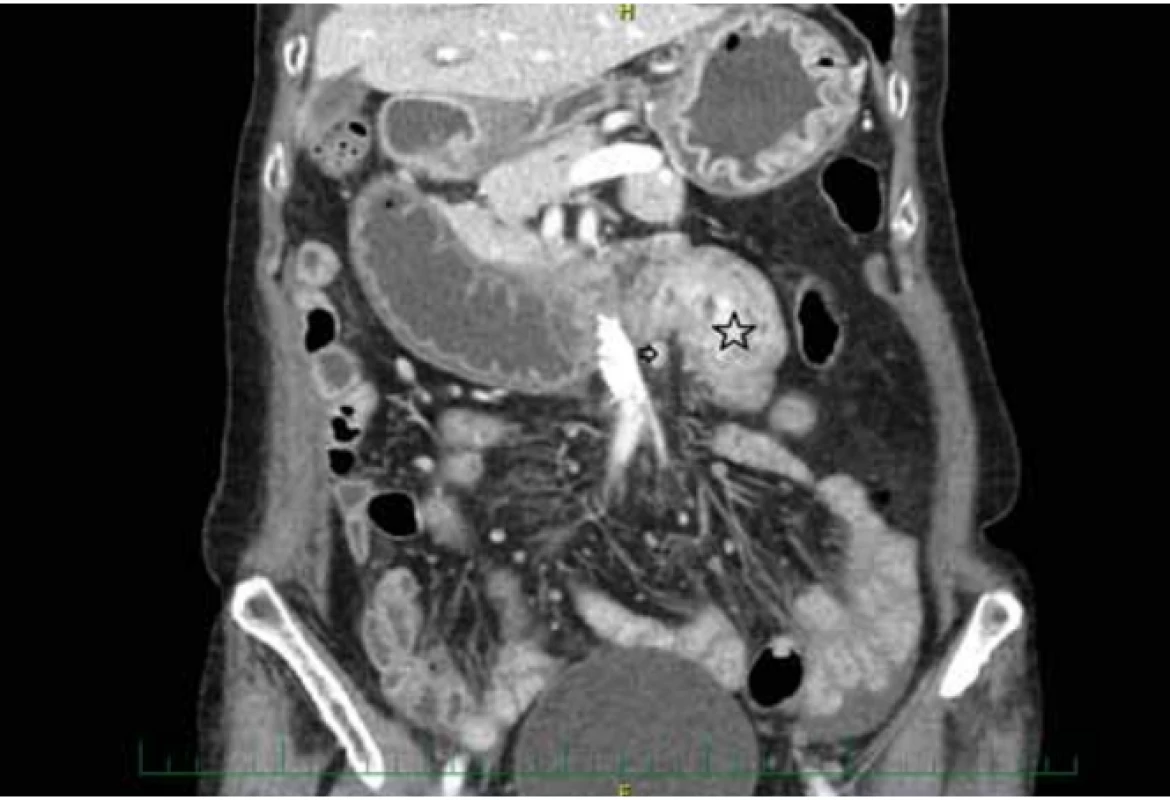
Z laboratorních výsledků byl vstupně normální krevní obraz, mírná elevace dusíkatých katabolitů s mírnou hypokalemií, mírná elevace pankreatické lipázy, normální hodnota CRP. Vstupně byl proveden RTG nativní snímek břicha vestoje, kde byla hladina tekutiny ve fornixu žaludku a ojedinělé hladinky v tenké kličce mezogastria vpravo. Dále bylo provedeno sonografické vyšetření břicha, kde byla popsána gastrektazie, dilatace proximálního duodena, tenkostřevní kličky a tračník s malou náplní. Vzhledem k nálezům bylo provedeno chirurgické konzilium se závěrem vysokého subileózního stavu na podkladě minerálové dysbalance. Chirurg v tu dobu neindikoval akutní chirurgickou intervenci a doporučil zavedení nazogastrické sondy, úpravu hydratace a minerálové dysbalance, gastroskopii po odeznění ileózního stavu a CT břicha v případě nejasností. O 3 dny později byl proveden kontrolní UZ břicha, kde bylo popsáno v oblasti duodenojejunálního přechodu prakticky cirkulární nepravidelné zesílení stěny střevní kličky na 14 mm v délce cca 7 cm bez dilatace proximálního duodena, s několika hypoechogenními uzlinami do velikosti 11 mm v okolí.
Následně byla provedena gastroskopie s nálezem těžké stagnační gastropatie celého těla a fundu žaludku, erytematózní antrální gastropatie, edém bulbu duodena s přítomností silně zapáchající stagnující tekutiny v žaludku a v sestupném raménku duodena. Tentýž den bylo provedeno CT břicha s nálezem vysokého ilea, jehož příčinou byla ohraničená intraluminální expanze velikosti cca 50 × 28 mm v oblasti duodenojejunálního přechodu, která se po podání kontrastní látky opacifikovala. V okolí byly patrné vícečetné onkosuspektní regionální lymfatické uzliny do 10 mm (obr. 1). Pacientka byla následně přeložena na chirurgické oddělení. Vyšetřovací proces byl doplněn o push-enteroskopické vyšetření s verifikací těžké stenozující jejunitidy. Tato oblast byla pro endoskop těžko prostupná a z této lokality byla odebrána endobio psie. Histologické vyšetření prokázalo jen diskrétní akutní zánět sliznice tenkého střeva, který nevysvětloval etiologii stenózy. Byla zavedena nazojejunální sonda k zajištění enterální nutrice. Koincidující clostridiová infekce (Clostridium difficile) byla přeléčena ATB (vankomycin 4 × 125 mg + metronidazol 3 × 500 mg).
Následovalo provedení RTG pasáže horní části gastrointestinálního traktu, kde byla popsána kritická stenóza duodenojejunálního přechodu. Po nutriční přípravě trvající 8 dní po sanaci clostridiové infekce bylo přistoupeno k chirurgickému řešení ilea. Při revizi dutiny břišní byly operatérem na mezenteriu celého tenkého střeva, mezotransverzu a nástěnném peritoneu nalezeny mnohočetné bělavé uzlíky do 3 mm (v.s. miliární metastázy) a v duodenojejunálním ohbí byl verifikován stenozující tumor o průměru 5 cm. Následovala resekce duodenojejunální flexury, end-to-end duodenojejuno-anastomóza, antekolická omega gastrojejuno-anastomóza s Braunovou spojkou a byla zavedena nazojejunální sonda. Výsledek histologie z resekátu a miliární metastázy z mezotransverza byl neobvyklý. Jednalo se o primární maligní tumor tenkého střeva metastazující do uzliny a šířící se po nástěnném peritoneu. Dle výsledků imunohistochemie a morfologie pomýšleli naši patologové na maligní gastrointestinální neuroektodermální tumor (gastrointestinální clear cell sarcoma-like tumor). Bločky byly odeslány k druhému čtení na vyšší pracoviště, kde byl závěr potvrzen. Na základě výsledků histologie bylo provedeno onkologické konzilium. Aktivní onkologická léčba vzhledem k performance statusu 4 nebyla indikována a byla doporučena paliativní symptomatická terapie. Pacientka byla 20. den po operaci přeložena do hospice a následně po 6 týdnech propuštěna do domácí péče.
Diskuze
GNET jsou vzácné agresivní zhoubné tumory, které se vyskytují převážně u dospělých mladších a středních let. Ve světové literatuře bylo dosud popsáno jen několik desítek případů [4]. Nejčastěji postihují tenké střevo, žaludek nebo tlusté střevo. Metastazují do jater a do mezenterických lymfatických uzlin. Projevují se bolestmi břicha, střevní obstrukcí nebo náhodnými nálezy při zobrazovacích vyšetřeních. Někdy mohou být přítomné nespecifické symptomy včetně hubnutí a anemie. Etiologie GNET není známa. Mikroskopicky obvykle roste v lamina muscularis propria, zasahuje do submukózy a subserózy s dobře ohraničeným okrajem. Může se také projevovat jako polypoidní hmota [2].
Mikroskopicky jde o vysoce buněčný nádor s chudým stromatem, který je složen z relativně monomorfních buněk střední velikosti. Buňky mají polygonální či protažený tvar a malé množství světlé nebo eozinofilní cytoplasmy. Jádra jsou centrálně uložená a často obsahují drobné bazofilní jadérko. Nádorové buňky rostou difuzně nebo jsou uspořádány ve špatně ohraničená hnízda, která jsou oddělená tenkými vazivovými septy. Méně časté je uspořádání pseudoalveolární, pseudopapilární, mikrocystické či trabekulární. V různém množství bývají přítomny vícejaderné obrovské buňky „osteklast-like“, možný je i průkaz nekrózy. Na rozdíl od melanomu a světlobuněčného sarkomu měkkých tkání chybí melaninový pigment [5].
Imunohistochemicky je typická silná difuzní exprese S100 proteinu, pozitivní bývá SOX-10, ostatní melanocytární markery jako HMB45, melanA či tyrosináza jsou negativní. Typická je rovněž přítomnost minimálně jednoho neuroendokrinního markeru, často synaptofyzinu, event. CD56 či neuron specifické enolázy. Markery asociované s gastrointestinálním stromálním tumorem (CD117, CD34, DOG1) jsou negativní, negativní je průkaz desminu, hladkosvalového aktinu, panCK a CD99 [5].
Na molekulární úrovni se v nádoru nachází translokace genů EWS (22q12) a CREB1 2q32.3, méně často je zastižena fúze genů EWS-ATF1 [5].
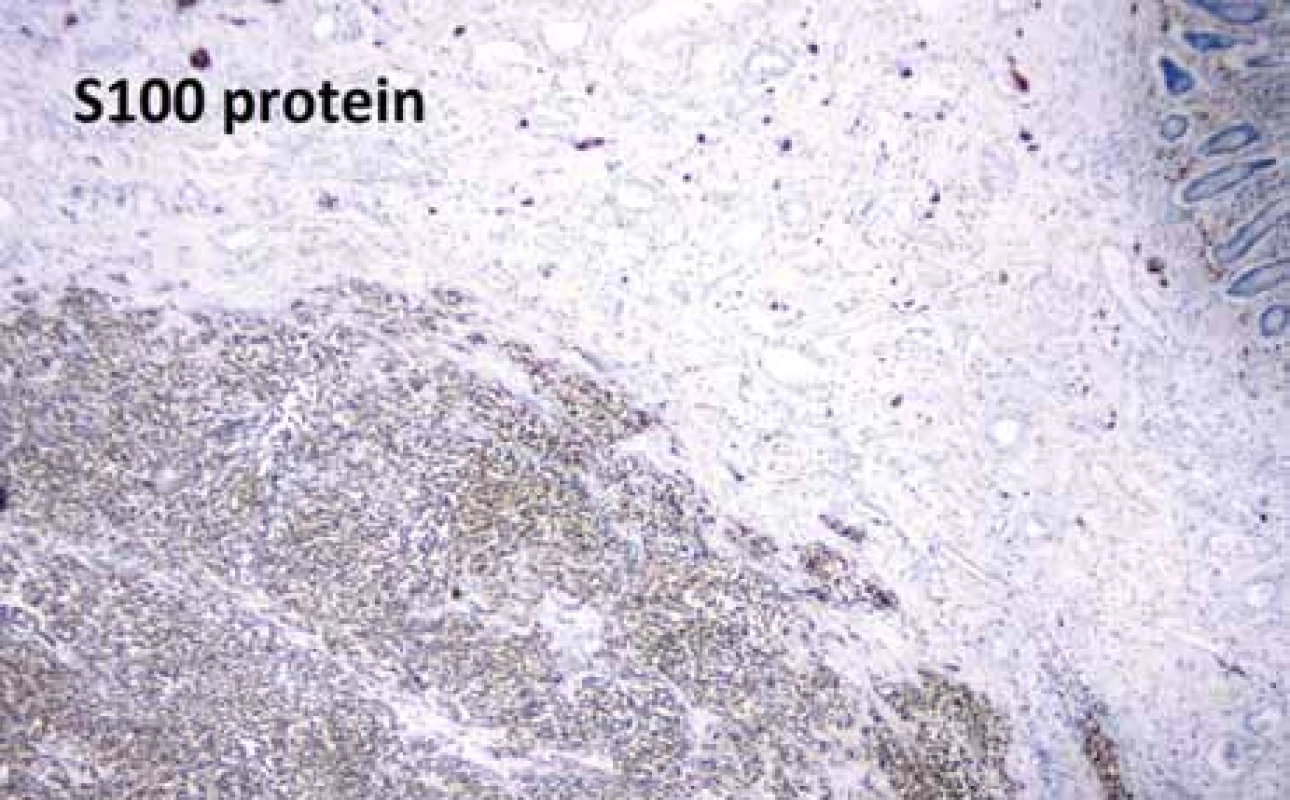
V našem případě se jednalo o tumor duodenojejunální flexury u starší polymorbidní ženy, který infiltroval stěnu tenkého střeva prakticky v celé jeho šíři (obr. 2), ale neinfiltroval vrstvu mukózy. Proto v endoskopickém obraze byly patrné pouze zánětlivé změny na sliznici (obr. 3). Metastaticky postihoval lymfatické uzliny a nástěnné i viscerální peritoneum. Tumor byl příznačného mikroskopického vzhledu pouze bez obrovských vícejaderných buněk (obr. 4). Typická byla rovněž imunohistochemická pozitivita S100 proteinu (obr. 5) a synaptofyzinu, negativní byly ostatní melanocytární markery a markery asociované s gastrointestinálním stromálním tumorem. Molekulární vyšetření jsme neprováděli vzhledem k pokročilému nádorovému onemocnění pacientky a plánované paliativní léčbě.
Fig. 2. Macrophotography of small bowell with tumor on section, tumor infiltration
marked in red.
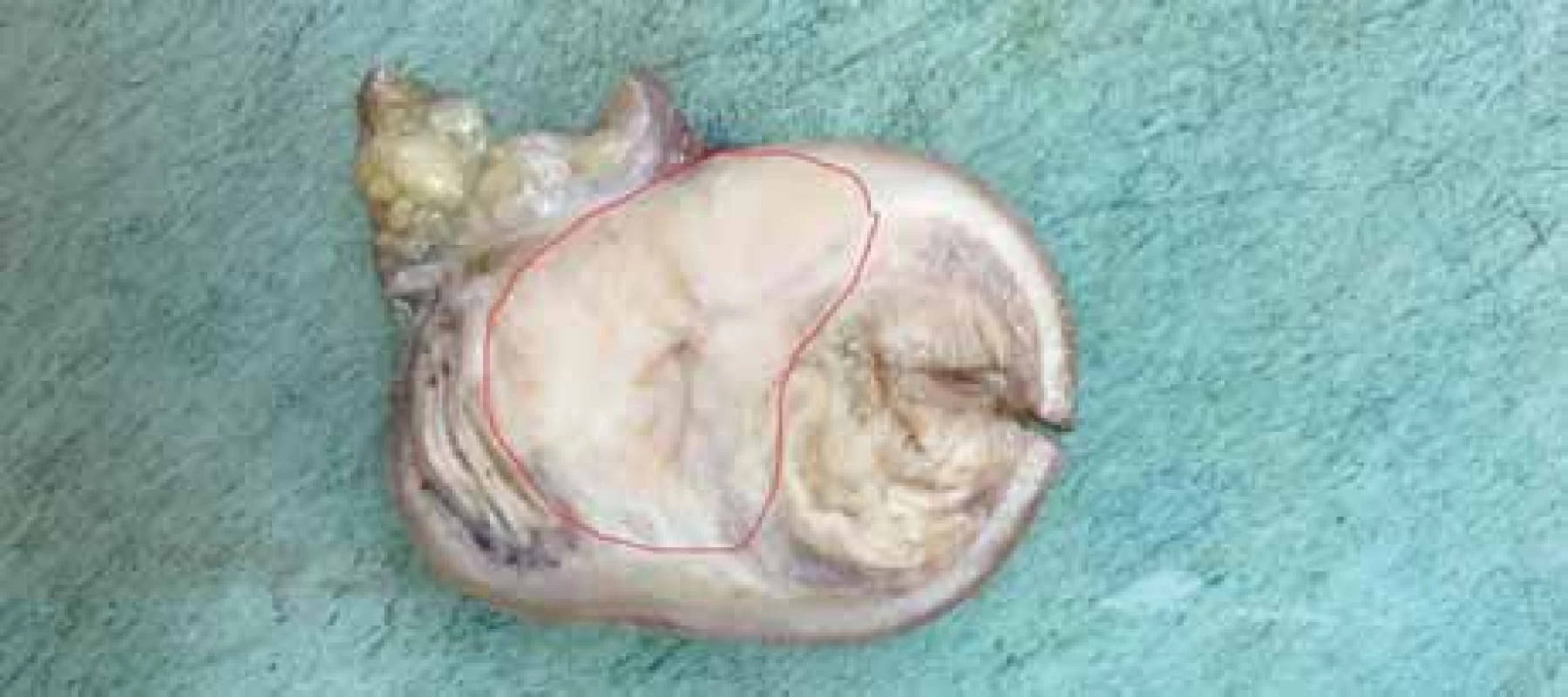
Fig. 3. Inflammatory changes of the
duodenojejunal junction in the enteroscopic image.
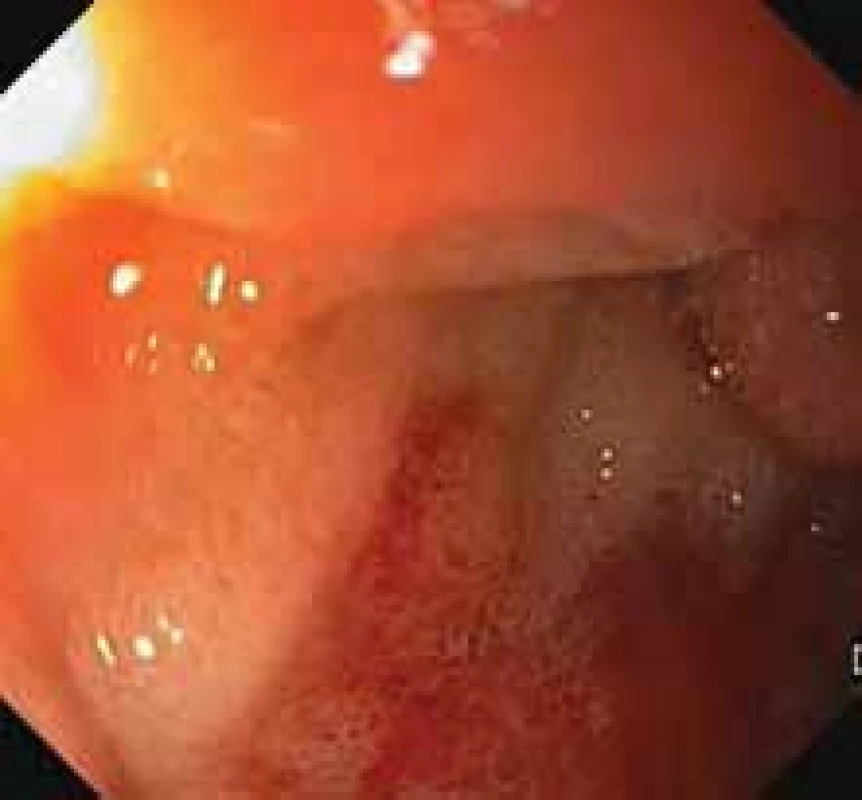
Fig. 4. Microscopic image of tumor cells, the largest of the tumor (solid arrows)
deposited in the muscle (empty arrow), magnifi cation 40x ( hematoxylin eosin).
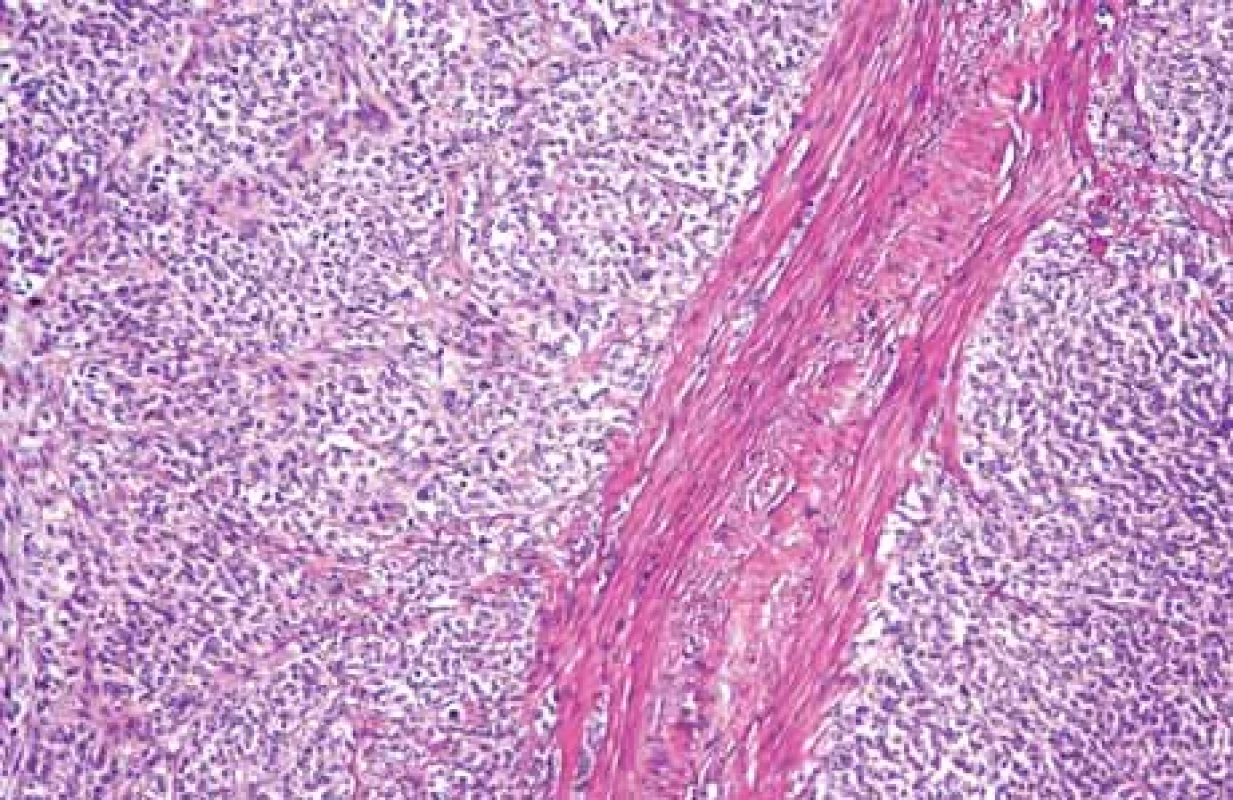
Fig. 5. Immunohistochemistry of S100 protein.
GNET je novotvar s vysokým rizikem lokální recidivy, v době dia gnózy často metastazující, což souvisí se špatnou prognózou [4]. Vzhledem k tomu, že se jedná o vzácné onemocnění, neexistují v současné době žádné standardní terapeutické postupy [4]. V literatuře je popsán případ s nejdelším přežitím, a to 7 let po chirurgické resekci a adjuvantní chemoterapii cisplatinou a etoposidem [5].
Závěr
GNET je extrémně vzácný maligní tumor gastrointestinálního traktu, který může být zaměněn za jiné neepiteliální gastrointestinální nádory [3]. Diferenciálně dia gnosticky přichází do úvahy neuroendokrinní tumor, kde jsou však nádorové buňky uniformního „blandního“ vzhledu a typicky vykazují pozitivitu chromograninu. Imunohistochemické vyšetření nám odliší GNET od GIST, sarkomu či melanomu. GNET roste ve stěně, dosahuje velkých rozměrů, a proto bývají prvními projevy až známky mechanického ilea. Na základě popsané morfologické charakteristiky GNET patří endoskopické metody společně s RTG vyšetřením mezi základní vyšetřovací postupy vedoucí ke stanovení definitivní dia gnózy i přes limitaci endobio ptického vyšetření. Jedinou a účelnou léčbou je provedení chirurgické resekce s lymfadenektomií a následnou adjuvantní chemoterapií. Poslední literární kazuistická sdělení popsala dosažení odpovědi na léčbu s everolimem (cca 5 měsíců) a sunitinibem (cca 3 měsíce). K určení optimalizace terapeutického postupu pro toto onemocnění chybí v současné době randomizované klinické studie.
Doručeno/Submitted: 22. 9. 2020
Přijato/Accepted: 5. 11. 2020
MUDr. Šárka Málková
Endoskopické centrum
Oblastní nemocnice Náchod a. s.
Purkyňova 446
547 01 Náchod
Sources
1. Zambrano E, Reyes-Mugica M, Franchi A et al. An osteoclast-rich tumor of the gastrointestinal tract with features resembling clear cell sarcoma of soft parts: reports of 6 cases of a GIST simulator. Int J Surg Pathol 2003; 11 (2): 75–81. doi: 10.1177/106689690301100202.
2. Huang GX, Chen QY, Zhong LL et al. Primary malignant gastrointestinal neuroectodermal tumor occuring in the ileum with intra-abdominal granulamotous nodules: A case report and review of the literature. Oncol Lett 2019; 17 (4): 3899–3909. doi: 10.3892/o1.2019.10060.
3. Alyosef MJ, Alratroot JA, ElSharkawy T et al. Malignant gastrointestinal neuroectodermal tumor: a case report and review of the literature. Dia gn Pathol 2017; 12 (1): 29. doi: 10.1186/s13000-017-0620-9.
4. Singh D, Atieh MK, Russell MA et al. Malignant Gastrointestinal Neuroectodermal Tumor (GNET) with prolonged disease-free survival after platinum-based chemotherapy. Case Rep Oncol Med 2020; 2020: 8880202. doi: 10.1155/2020/8880202.
5. Wang J, Thway K. Clear cell sarcoma-like tumor of the gastrointestinal tract: an evolving entity. Arch Pathol Lab Med 2015; 139 (3): 407–412. doi: 10.5858/arpa.2013-0547-RS.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2020 Issue 6
Most read in this issue
- Zobrazovací metody u neúrazových náhlých příhod břišních
- Syndrom arteria mesenterica superior v souvislosti s Crohnovou chorobou – kazuistika
- Eozinofilní enteritida – kazuistika vzácné manifestace onemocnění a stručný přehled novinek
- Eozinofilní ezofagitida – 10 let zkušeností pěti českých pediatrických endoskopických center
