-
Medical journals
- Career
Renální onemocnění pacientů s idiopatickými střevními záněty
Authors: V. Teplan 1 4; Honsová E. 5; Lukáš M. 1,2
Authors‘ workplace: Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE I. V. F. a. s., Praha 1; 1. LF UK, Praha 2; Subkatedra nefrologie, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 3; Katedra interních oborů LF OU, Ostrava 4; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 5
Published in: Gastroent Hepatol 2020; 74(3): 256-266
Category: Chapters from internal medicine: Review Article
doi: https://doi.org/10.14735/amgh2020256Overview
Gastroenterologická onemocnění a choroby ledvin se vyskytují často společně. U pacientů s idiopatickými střevními záněty (IBD – inflammatory bowel disease), především s komplikovanou formou Crohnovy nemoci s postižením terminálního ilea a následnou malabsorbcí žlučových solí a mastných kyselin, dochází ke zvýšené absorpci oxalátů ze střeva (enterická hyperoxalurie) a spolu se změněnou permeabilitou střevní sliznice a opakovanými atakami průjmů (s nízkým objemem moči a ztrátami magnezia) se zvyšuje riziko tvorby močových kamenů. Mohou být přítomny renální koliky, blokády močovodu s průvodnou infekcí močových cest a močové píštěle. Velmi významné je i posouzení vlivu dlouhodobého podávání mesalazinu (5-ASA) na rozvoj tubulointersticiální nefritidy (TIN), ať již toxoalergické, či nefrotoxické etiologie, které může být spojeno se závažným poškozením renální funkce až ledvinným selháním. Proto se doporučuje při této léčbě kontrola renálních funkcí zprvu ve tříměsíčních, následně nejpozději v šestiměsíčních intervalech. Relativně častý je i nález AA amyloidózy při dlouhodobém zánětlivém procesu. V současné době se dostává do popředí zájmu výskyt různých forem glomerulonefritid (GN) při IBD v přímé souvislosti s imunitní aktivitou onemocnění. Nejčastější je mezangioproliferativní GN s depozity imunoglobulinu A (IgA nefropatie Berger). Není vyloučeno ani poškození typu akutní GN při akutní exacerbaci střevního zánětlivého procesu. Poškození ledvin se může projevovat sníženou funkcí ledvin (glomerulární filtrace, koncentrační a acidifikační funkce ledvin) a rozvojem proteinurie, někdy až nefrotického charakteru. Specifická situace je u nemocných s IBD na biologické léčbě se současně závažným postižením ledvin (vč. TIN), kdy je z nefrologického hlediska indikována imunosupresivní léčba kortikoidy a azathioprinem.
Klíčová slova:
idiopatické střevní záněty – tubulointersticiální nefritida – glomerulopatie – urolitiáza
Úvod
Zánětlivá onemocnění střev (IBD – inflammatory bowel disease) jsou řazena mezi imunitně mediované choroby. IBD zahrnují Crohnovu chorobu (CD – Crohn’s disease), ulcerózní kolitidu (UC – ulcerative colitis) a blíže neklasifikované IBD [1,2]. Jde o choroby, které jsou často doprovázeny extraintestinálními komplikacemi; mezi nejčastější mimostřevní postižené lokality patří kůže, oči, klouby, játra a žlučové cesty [3]. Opakovaně je dokumentováno také postižení ledvin a močových cest zahrnující jednak nefrolitiázu, ale postižen může být též parenchym ledvin. Urolitiáza doprovázející IBD je charakterizována tvorbou kalcium oxalátových kaménků, zvláště u pacientů s CD s postižením terminálního ilea a následnou malabsorbcí žlučových solí a mastných kyselin. To vede ke zvýšené absorpci oxalátů ze střeva (enterická hyperoxalurie) a spolu se změněnou permeabilitou střevní sliznice a opakovanými atakami průjmů (s nízkým objemem moči a ztrátami magnezia) se zvyšuje riziko tvorby kamenů.
Postižení parenchymu ledvin je různorodé a může zahrnovat nemoci glomerulů i izolované postižení tubulointersticia. Indikací k biopsii ledvin bývá akutní nebo přetrvávající chronická renální insuficience, proteinurie vč. nefrotické a močový nález hematurie a proteinurie.
V biopsiích ledvin je u pacientů s IBD nejčastější diagnózou tubulointersticiální nefritida (TIN), dále glomerulonefritida (GN) a AA amyloidóza. U pacientů s CD s abscesy a píštělemi se může objevit klasická postinfekční GN. Setkat se lze s téměř jakoukoli patologií ledvin od vaskulárních změn u starších pacientů a kuřáků až po autoimunní onemocnění, jako jsou membranózní GN, fokálně-segmentární GN či rychle progredující GN.
V posledních letech se dostává do popředí zájmu mikrobiom střeva a jeho vliv na rozvoj a aktivitu různých zánětlivých autoimunních onemocnění vč. GN [4]. Také opakovaně dokumentované zlepšení renálních funkcí v situaci, kdy dojde k remisi IBD podporuje úvahu o etio-patogenetickém vztahu mezi IBD a GN [5,6].
Tubulointersticiální nefritida
Tubulointersticiální nefritida (TIN) je v morfologii charakterizována zánětlivou celulizací v intersticiu s poškozením tubulů (obr. 1,2). V akutní fázi onemocnění je obvykle edém intersticia a zánět může být tak denzní, že způsobuje destrukci tubulů, někdy granulomatózní. S přechodem do chronicity ubývá edému a přibývá intersticiální fibrózy, také se mění charakter zánětlivé celulizace, která se stává převážně kulatobuněčnou, s úbytkem polynukleárů, vč. eozinofilů.
Image 1. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 1. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).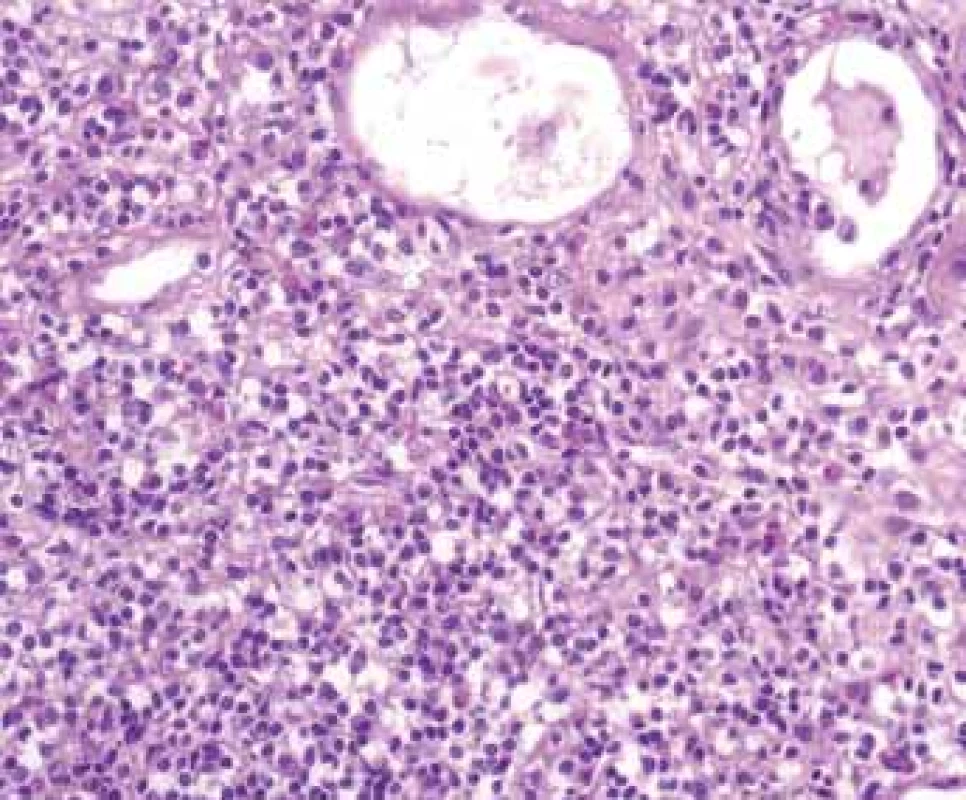
Tubulointersticiální nefritida s denzní smíšenou zánětlivou celulizací s destrukcí tubulů.
Tubulointerstitial nephritis with dense inflamed mixed cells and tubuli destruction.Image 2. Histologické nálezy u pacientõ s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 2. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).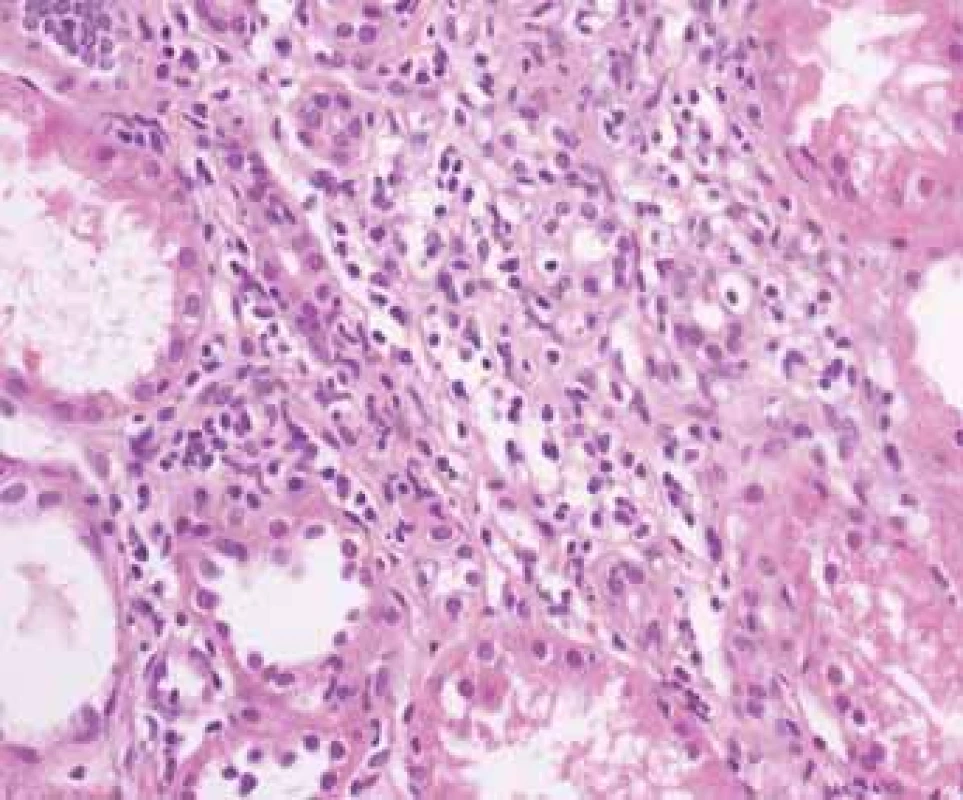
Tubulointersticiální nefritida s mírným zánětem s postižením tubulõ a s narůstající fibrózou.
Tubulointerstitial nephritis with mild inflammation and tubular damage with growing fibrosis.TIN je považována za komplikaci léčby mesalazinem (5-ASA) užívaným v udržovací léčbě střevního zánětu. Riziko rozvoje TIN je však považováno za relativně velmi nízké, postihující jednoho pacienta na cca 500 léčených. Většinou se jedná o reverzibilní změny, které po vysazení léčby vedou k úpravě renálních funkcí, ojediněle však bylo zaznamenáno trvalé poškození ledvinných funkcí. Podle mezinárodních i národních doporučení je vhodné provést kontrolu renálních funkcí před začátkem terapie a dále pravidelně v intervalu cca 6 měsíců během 1. roku a poté 1× ročně [7].
Akutní tubulointersticiální nefritida
Obvykle doprovází akutní fázi IBD a je častější v průběhu UC. Často má subklinický průběh, který je sice monitorovaný klinikem, ale důvodem k biopsii je jen ve výjimečných případech. Nejčastější příčinou akutní tubulointersticiální nefritidy (ATIN) u nemocných s IBD je podávání léků, mesalazinu, nesteroidních antirevmatik nebo některých antibiotik. Nefropatie vzniká buď přímým toxickým účinkem, nebo na podkladě hypersenzitivní reakce, výjimečně jejich kombinací [8].
Renální tubulární buňky jsou značně vulnerabilní k účinku toxinů. Přestože ledvinami protéká ve srovnání s jinými orgány velké množství krve, je perfuze okysličenou krví v oblasti dřeně, především vnitřní, primárně nízká. Dřeňový průtok je navíc vždy postkortikální. Tento nepoměr se může zvýšit při poklesu perfuzního tlaku, což přispívá k poškození tubulárních buněk při zvýšených metabolických požadavcích. Koncentrace toxické látky v tubulech se v důsledku zpětné resorpce vody, elektrolytů a močoviny zvyšuje. Některé toxické látky jsou vylučovány tubulární sekrecí nebo jsou resorbovány, vstupují tedy přímo do metabolizmu tubulární buňky. Protiproudový multiplikační systém zodpovídá za zvýšený koncentrační gradient směrem k renální papile a malé změny v pH moči mohou výrazně ovlivnit rozpustnost a elektrický náboj látek vylučovaných do moči.
Klinické projevy
Počáteční příznaky jsou pestré. Někteří nemocní mají obtíže doprovázející infekci močových cest, jako jsou teplota, dysurie, pyurie a bolesti v bedrech. Další mohou být oligosymptomatičtí, avšak s následnými projevy akutního selhání ledvin (vč. oligoanurie). Jindy renální funkce klesá v závislosti na projevech hypersenzitivní reakce (např. teplota, makulopapulózní exantém, eozinofilie). Nález v moči může být minimální, pouze se stopovou proteinurií či pyurií, ale často je překvapující s výraznou proteinurií, hematurií (mikro - či makroskopickou) nebo výraznou pyurií vč. eozinofilů. Ačkoli je eozinofilurie vzácná, je patognomonická pro toxoalergickou hypersenzitivní TIN.
U mnoha pacientů se rozvíjejí známky tubulárních dysfunkcí, jako je polyurie (defekt koncentrační schopnosti), deplece objemu cirkulující tekutiny (defekt v reabsorpci Na), hyperkalemie (defekt v exkreci K) a metabolická acidóza (defekt v exkreci kyselin). Ledviny jsou obvykle zvětšené v důsledku intersticiálního edému a intenzivně vychytávají radioaktivní galium či radionuklidem značené leukocyty. Interval mezi lékovou expozicí a rozvojem renální symptomatologie se pohybuje mezi 5 dny a 5 týdny [9].
Biomarkery u akutního poškození ledvin
V současné klinické praxi se diagnóza ATIN nejčastěji stanovuje měřením sérové koncentrace kreatininu. Při akutních změnách funkce ledvin však není hodnota kreatininu spolehlivým ukazatelem. Koncentrace kreatininu v séru může kolísat v širokém rozmezí v závislosti na věku, pohlaví, svalové hmotě, metabolizmu svalů, užívaných lécích a na stavu hydratace. Dále při akutních změnách glomerulární filtrace (GF) neodráží koncentrace kreatininu v séru – až do dosažení ustáleného stavu – přesně funkci ledvin. To může trvat i několik dní. Studie u zvířat přitom prokázaly, že rozvoji ATIN lze často zabránit nebo jej léčit, proto je třeba zasáhnout časně po vyvolávajícím podnětu [10].
Intenzivní výzkum v této oblasti byl vyvolán snahou zlepšit časnou diagnostiku. Klasické biomarkery v moči, jako jsou válce a frakční exkrece sodíku, nejsou dostatečně citlivé a jsou také nespecifické pro časné rozpoznání. Jiné tradiční biomarkery v moči, např. filtrované vysokomolekulární bílkoviny a bílkoviny nebo enzymy v tubulech, také plně nevyhovují pro nízkou specificitu a vysokou cenu standardizovaných metod stanovení. Nejčastěji sledované časné biomarkery jsou uvedeny v tab. 1.
Table 1. Biomarkery časného poškození ledvin.
Tab. 1. Biomarkers of early kidney damage.
Nejnovější močové biomarkery studované v heterogenní skupině pacientů s predikcí vzniku akutního poškození ledvin (AKI) do 12 hod. po inzultu jsou: inzulinu podobný růstový faktor vázající protein 7 (ILGFBP-7) a tkáňový inhibitor metaloproteinázy 2 (TIMP-2). Oba enzymy jsou indikátory zástavy buněčného cyklu v G1 fázi. Předpokládaným mechanizmem jejich exprese v tubulárních buňkách je odpověď na poškození blokádou cyklin-dependentních proteinkinázových komplexů v průběhu buněčného cyklu s krátkým přerušením v G1 fázi.
Renální biopsie zůstává nejjistější metodou pro diagnostiku TIN. Také identifikace přítomných buněk může pomoci při určení příčiny onemocnění.
Klinický průběh, prognóza a léčba
Klinická symptomatologie se rozvíjí za několik dní až týdnů od začátku podávání léku a není závislá na přijaté dávce. Objeví se zvýšená teplota, kožní exantém, artralgie, někdy jaterní léze, hematurie, eozinofilie a různý stupeň snížení funkce ledvin. Mírná proteinurie (< 1 g/24 h) a mikroskopická hematurie jsou vždy přítomny. Závažnější proteinurie až nefrotický syndrom se nalézají téměř vždy pouze v souvislosti s podáváním nesteroidních antiflogistik. Pokud se rozvine AKI, je většinou neoligoanurické a pouze výjimečně je nezbytné dialyzační léčení. V bioptickém obraze převládají známky intersticiálního zánětu s četnými lymfocyty, monocyty, makrofágy a eozinofily, někdy jsou nalezeny epiteloidní granulomy. V krevním obraze nacházíme vedle eozinofilie trombocytopenii a někdy známky hemolýzy při autoprotilátkách.
Pokud je přítomna déletrvající oligoanurie, je nemocný léčen jako při akutním poškození/selhání ledvin. U nemocných se většinou postupně upravují renální funkce, jakmile jsou odstraněny vyvolávající příčiny. Vyvolávajícím momentem může být i kombinace léků např. s alkoholem. Poškození menšího stupně však může přetrvávat. Byly ovšem popsány i případy ireverzibilního poškození. Kortikosteroidní léčba (např. prednison 1 mg/kg/den po 3 dny s následnou léčbou snižujícími se dávkami v dalších 7–10 dnech) může urychlit zlepšování renální funkce v případech hypersenzitivních či imunologických reakcí.
Chronická (neinfekční) tubulointersticiální nefritida
Chronická (neinfekční) tubulointersticiální nefritida (CHTIN) zahrnuje chronická onemocnění ledvin, u nichž vykazuje celkové či místní postižení převahu změn tubulointersticia nad změnami glomerulárními či vaskulárními. Protože určité tubulointersticiální změny jsou spojeny se všemi ledvinnými chorobami, rozdíly mohou být někdy i diskrétní. Dále pak může být přítomno více potenciálních příčin TIN (např. diabetes mellitus a infekce močových cest) u jednoho pacienta. Současná data ukazují, že až třetina případů chronického selhání ledvin vzniká na bázi chronické TIN. Okolo 10–20 % případů pak tvoří případy analgetické nefropatie [11,12].
Příznaky, objektivní nález a diagnóza
Určité klinické příznaky jsou společné všem typům chronických TIN. Symptomy ukazující progresi renálního onemocnění jsou často nepřítomny. Chybí otoky, proteinurie je minimální, hematurie není přítomna a krevní tlak je často normální nebo lehce zvýšený. Pokud je zjištěna závažná proteinurie či významná hematurie, znamená to komplikující glomerulární postižení. Mohou být přítomny známky tubulárních dysfunkcí tak, jak byly popsány výše. Nemocní s chronickou TIN na podkladě oxalózy, hyperkalcemie, hyperurikemie či sarkoidózy mohou mít urolitiázu.
Chronická TIN indukovaná podáváním mesalazinu
Postižení renálního parenchymu u pacientů s IBD není vyjímečné a vyskytuje se ve své méně závažné formě relativně často [13]. V literatuře bylo publikováno především ve formě kazuistik více než 50 sdělení spojených s různým stupněm poškození renální funkce [14–16]. Není zcela rozhodnuto, zda se jedná o formu toxoalergickou (nález poškození tubulárních funkcí bezprostředně navazující na zahájení podávání) či spíše nefrotoxickou spojenou s dlouholetým podáváním 5-ASA v dávce kolem 3 g/den [17]. Vzhledem k léčebné indikaci je častěji zjišťována u pacientů s UC. Renální symptomatologie je často klinicky němá a pouze kontroly močového nálezu (proteinurie tubulárního typu) a zhoršení renální funkce měřené koncentrací kreatininu či výpočtem GF mohou tyto poruchy časně zachytit [18,19]. Výjimečné není ani objevení se otoků při rozvoji nefrotického syndromu při velké proteinurii [20].
Bezprostředním opatřením je vysazení léku a kontroly koncentrace kreatininu a GF. Pokud dojde v horizontu do 3 měsíců ke zlepšení či dokonce normalizaci nálezu, je poškození ledvin reverzibilní [21]. Jestliže se tak nestane, je namístě renální biopsie, která podrobněji zhodnotí příčinu zhoršení renální funkce. Léčebným postupem je nasazení kortikoidů a azathioprinu a žádaný efekt může být dosažen v průběhu 3–6 měsíců [14]. Většinově dochází při menším poškození k úpravě (40–80 %), ale při dlouhodobém poškození již může dojít k vazivové přeměně renálního parenchymu a návrat renální funkce nebude úplný, či se dokonce rozvine ledvinné selhání [22]. V rámci prevence nefrotoxického účinku 5-ASA je proto u těchto nemocných nutné pravidelně kontrolovat základní renální funkce, tj. moč chemicky a sediment, proteinurii a koncentraci kreatininu, urey a GF, a to v intervalu 3–6 měsíců [23].
U rizikových osob, např. při již přítomné renální patologii, se doporučuje kontrola renálních tubulárních enzymů, z nichž nejdostupnější je NAG v moči (N-acetyl-b-D-glukosaminidáza je proximální tubulární lyzozomální enzym, jehož časný vzestup je detekován po expozici nefrotoxickým látkám), které mohou odhalit již časně se rozvíjející poškození [8]. Někdy může být projevem tubulárního poškození tzv. renální tubulární acidóza, která se vedle proteinurie může projevovat i závažnými minerálovými změnami, což u pacientů s frekventními průjmy může ještě prohloubit metabolické změny [24]. Nejčastěji se jedná o renální tubulární acidózu prvního (distální) nebo druhého typu (proximální), které jsou často spojeny se ztrátami bikarbonátů a kalia. Při obou formách se vyskytuje závažná hypokalemie, která je spojena s metabolickou acidózou (nikoli alkalózou, jak je běžné u metabolické hypokalemie). Biochemický nález může být často zkreslen současnými ztrátami kalia a bikarbonátů při frekventních průjmech. Pokud ani po jejich stabilizaci nedojde k úpravě kalemie a je nález malé proteinurie, či dokonce již zvýšené hladiny kreatininu, je třeba vždy pomýšlet na tuto formu poškození. Biopsie zde není přínosná, diagnóza se většinou opírá o funkční vyšetření ledvin zaměřené na vyšetření tubulárních funkcí [9].
Glomerulopatie
IgA glomerulonefritida
Mnoho let je nomenklatura zaměřená na IgA glomerulonefritidu (IgA GN) problematická. Klíčem k diagnóze je izolovaná nebo dominující přítomnost depozit IgA v mezangiu a existence, či neexistence systémového onemocnění. Podle těchto kritérií se IgA GN formálně dělí na primární „autoimunní“ a sekundární, která bude zřejmě také autoimunní, ale souvisí s dalším postižením. Je dobře doloženo, že IgA GN je relativně častá u pacientů s chronickými zánětlivými onemocněními sliznic, které pravděpodobně vedou při dlouhodobém průběhu u jedinců s predisponujícím genetickým pozadím k rozvoji onemocnění [25,26].
Jde o nejčastější diagnózu v biopsiích u pacientů s IBD. Morfologicky se neliší od pacientů s IgA GN bez IBD. Obecně je IgA GN morfologicky velmi proměnlivé onemocnění, což dobře dokládají některé dřívější klasifikační systémy, které kopírovaly morfologii podobnou lupusovým nefritidám. V mezangiu jsou izolovaná nebo dominující depozita IgA a ve světelné mikroskopii proliferace mezangia různého stupně (obr. 3,4). Postupně se vytvářejí segmentární sklerotizace a s jejich zvyšujícím se počtem se v klinickém obraze objevuje proteinurie. Sklerotizace v glomerulech jsou následovány fibrózou intersticia.
Image 3. Histologické nálezy u pacientõ s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 3. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).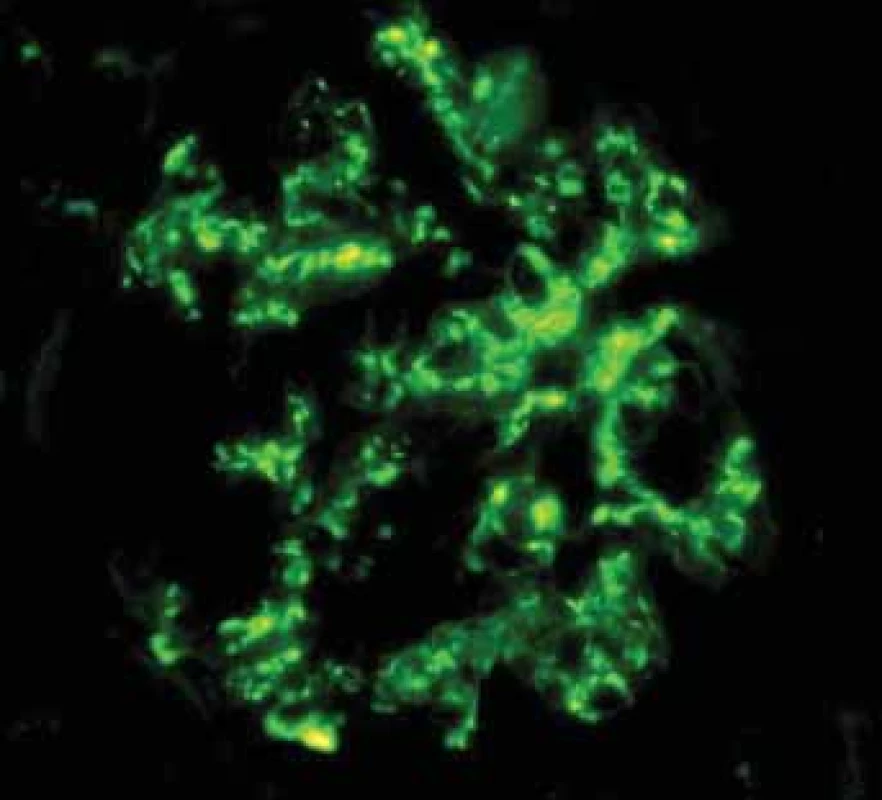
Depozita IgA v mezangiu charakterizují IgA glomerulonefritidu.
Deposits of IgA in mesangium are typical for IgA glomerulonephritis.Image 4. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 4. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).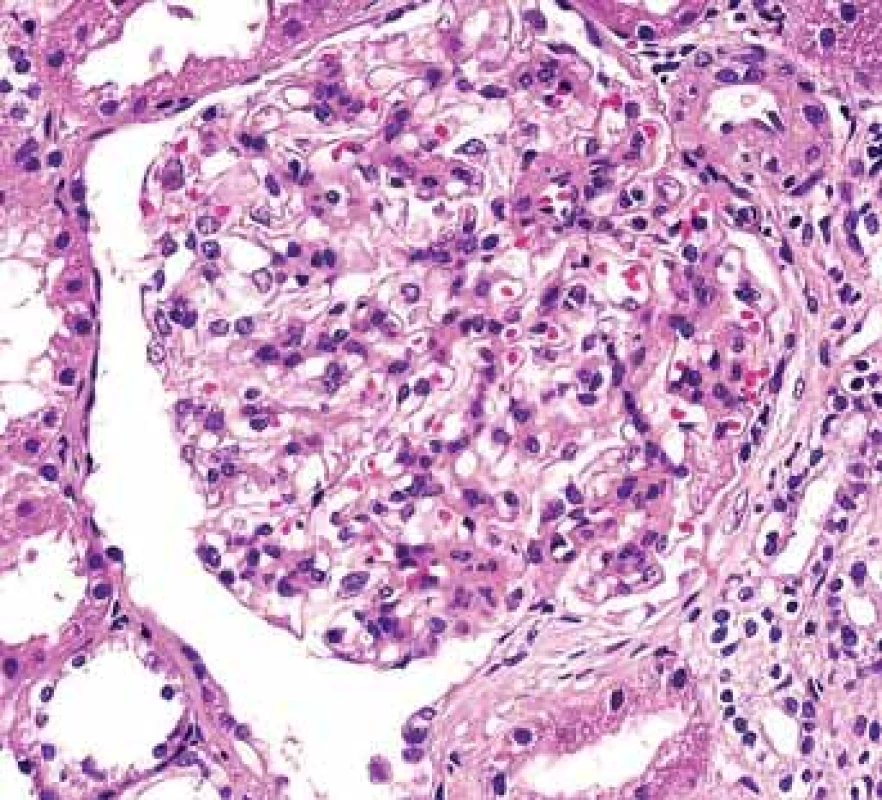
Mezangiální proliferace je typickou morfologií IgA glomerulonefritidy.
Mesangial proliferation is typical for IgA glomerulonephritis.Postinfekční glomerulonefritida
Především pacienti s CD mohou mít chronické hnisavé záněty vč. abscesů a píštělí v různých lokalitách. Vedle AA amyloidózy jsou také v riziku rozvoje klasické postinfekční GN (obr. 5, 6). Jde o onemocnění, jehož výskyt v bioptické praxi klesá a diagnóza bývá často překvapením.
Image 5. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig.5. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).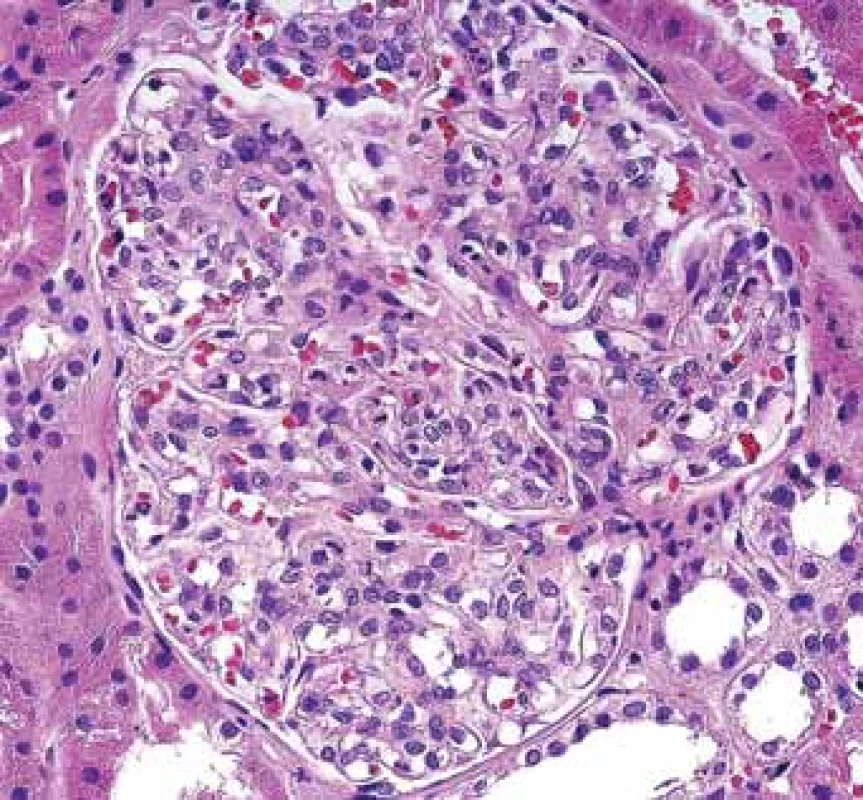
Zvětšený glomerulus s četnými polynukleáry v kapilárních luminech při tzv. postinfekční glomerulonefritidě.
Extended glomerulus with numerous polynuclears in capillary lumina in so-called postinfectious glomerulonephritis.Image 6. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 6. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).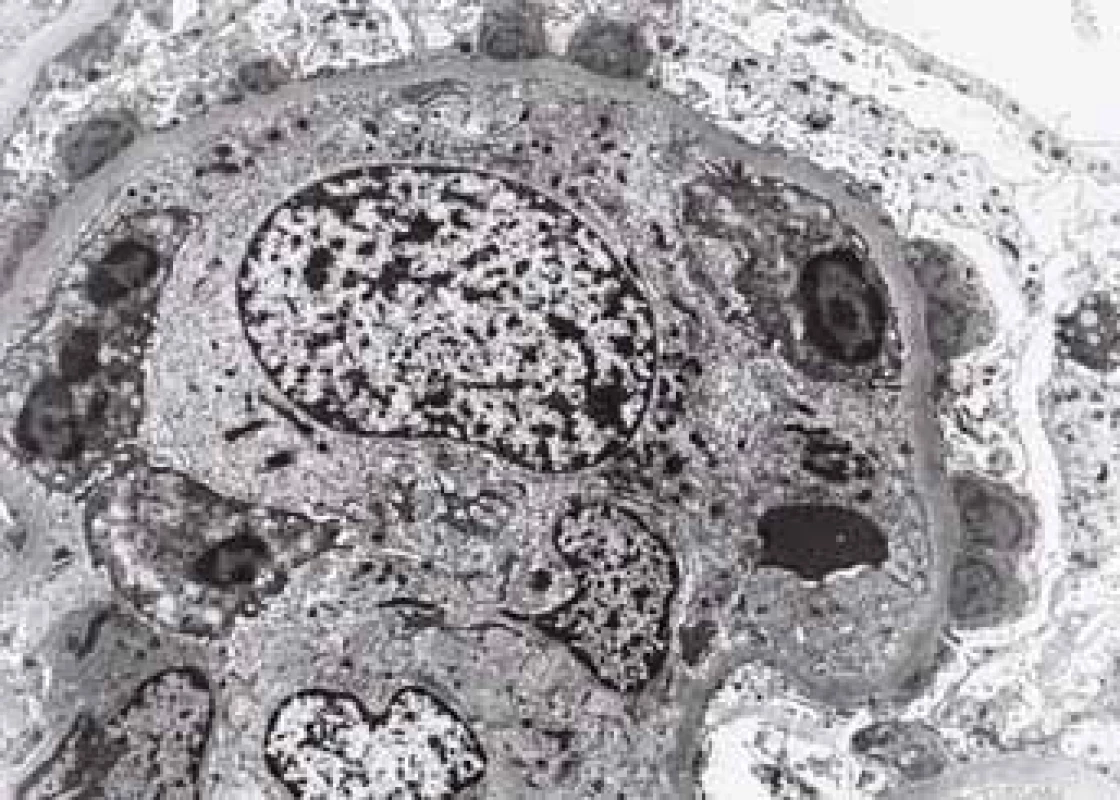
Typická hroudovitá depozita subepiteliálně při postinfekční GN.
Typical lumpy deposits subepithelially in postinfectious GN.Ostatní afekce glomerulů
Vzhledem k tomu, že ledvina nemá kolaterální cévní zásobení, objevuje se různorodé postižení související s cévní patologií v biopsiích ledvin starších pacientů prakticky vždy. To je jedním z důvodů, proč je interpretace patologie biopsií ledvin složitá. Dále je třeba dodat, že pacienti s IBD mohou mít jakékoli další onemocnění ledvin náhodně, zvláště ve vyšším věku. Patří sem vedle hypertenze a vaskulární nefrosklerózy diabetes a obecně onemocnění, jejichž výskyt se v populaci zvyšuje (např. choroby doprovázející klonální proliferace plazmatických buněk) [27]. Poškození glomerulů je obávanou komplikací při záchranné léčbě UC cyklosporinem A, nicméně v posledních letech, kdy se využívá nižší dávka léku 2 mg/kg (původně 5 mg/kg) a hladina cyklosporinu A v séru je trvale monitorována, je výskyt této komplikace prakticky eliminován.
Komplikace biologické léčby
Výjimečně se jako vedlejší účinky biologické léčby zvažují různé stavy způsobené dysregulací imunitního systému při léčbě látkami blokujícími tumor nekrotizující faktor a (TNFa). Léčba IBD inhibitory TNF je úspěšná, ale na druhé straně u malé části pacientů (cca 15–20 %) zvyšuje riziko infekčních komplikací (bakteriální, virová a mykotická onemocnění vč. reaktivace mykobakteriové infekce) a cca u 2–3 % pacientů hrozí rozvoj dalších autoimunních onemocnění (paradoxní autoimunitní reakce, jako je např. lupus-like syndrom, psoriáza apod.), vč. rozvoje GN s nekrózami a se srpky [28–30]. Vztah začátku onemocnění vč. laboratorních abnormalit k nasazení léčby inhibitory TNF stejně tak jako zlepšení symptomů po jejím vysazení u většiny pacientů favorizuje příčinnou souvislost oproti náhodné koincidenci [31].
Amyloidóza
Závažnou komplikaci projevující se většinou proteinurií, často nefrotickou, představuje AA amyloidóza doprovázející chronická zánětlivá onemocnění. CD je čtvrtou nejčastější příčinou AA amyloidózy v celosvětovém měřítku [32]. AA amyloid může být detekován ve sliznici střeva, což obvykle předchází rozvoji proteinurie o několik let. Amyloid má afinitu k cévním stěnám a v endoskopických biopsiích střev je bez speciální detekce zvláště v počátečních stadiích poddiagnostikován, protože jeho drobná a náhodně rozložená depozita nelze bez speciální detekce identifikovat (obr. 7,8). Detekce amyloidu a určení typu je bioptická diagnóza, která může být velmi komplikovaná, zvláště v počátcích onemocnění (obr. 9–11). Nejúspěšnější metodou v případě malých depozit je imunofluorescence, která umožní identifikaci lehkých řetězců a odlišení nejčastější AL amyloidózy [33].
Image 7. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 7. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).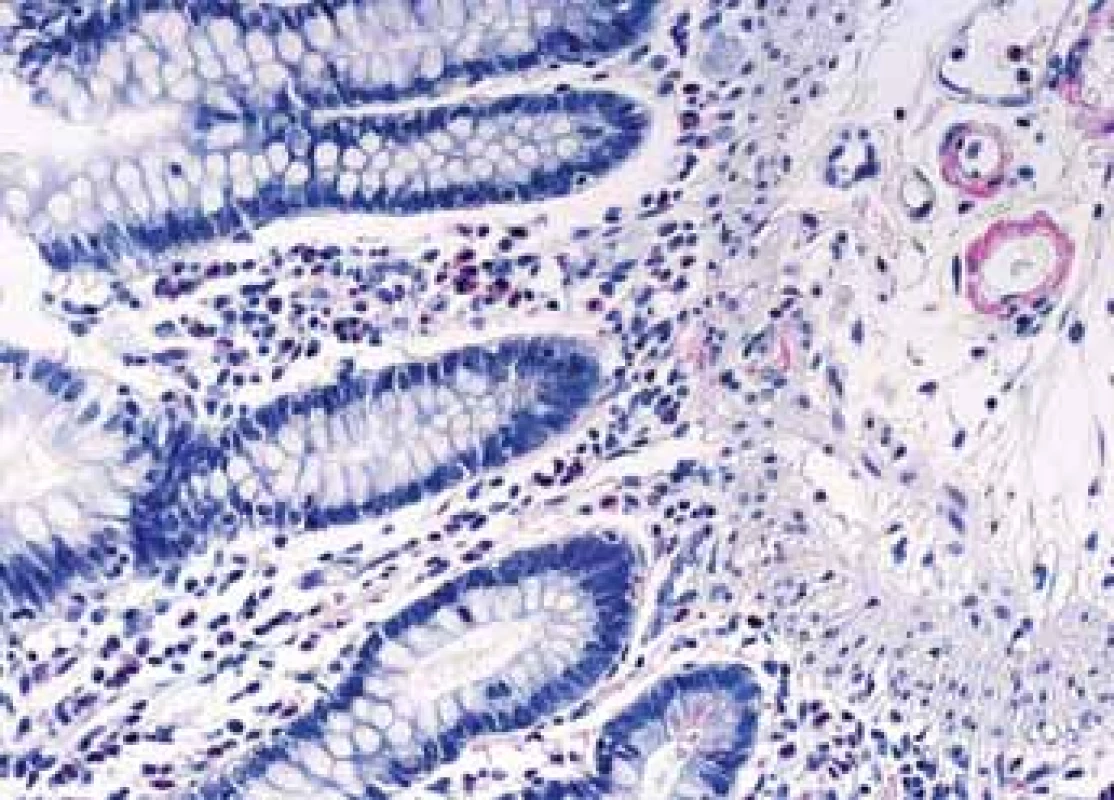
Drobná Kongo červeň AA pozitivní depozita v cévách sliznice tenkého střeva.
Small Kongo red AA positive deposits in vessels mucosa of thin intestine.Image 8. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 8. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis).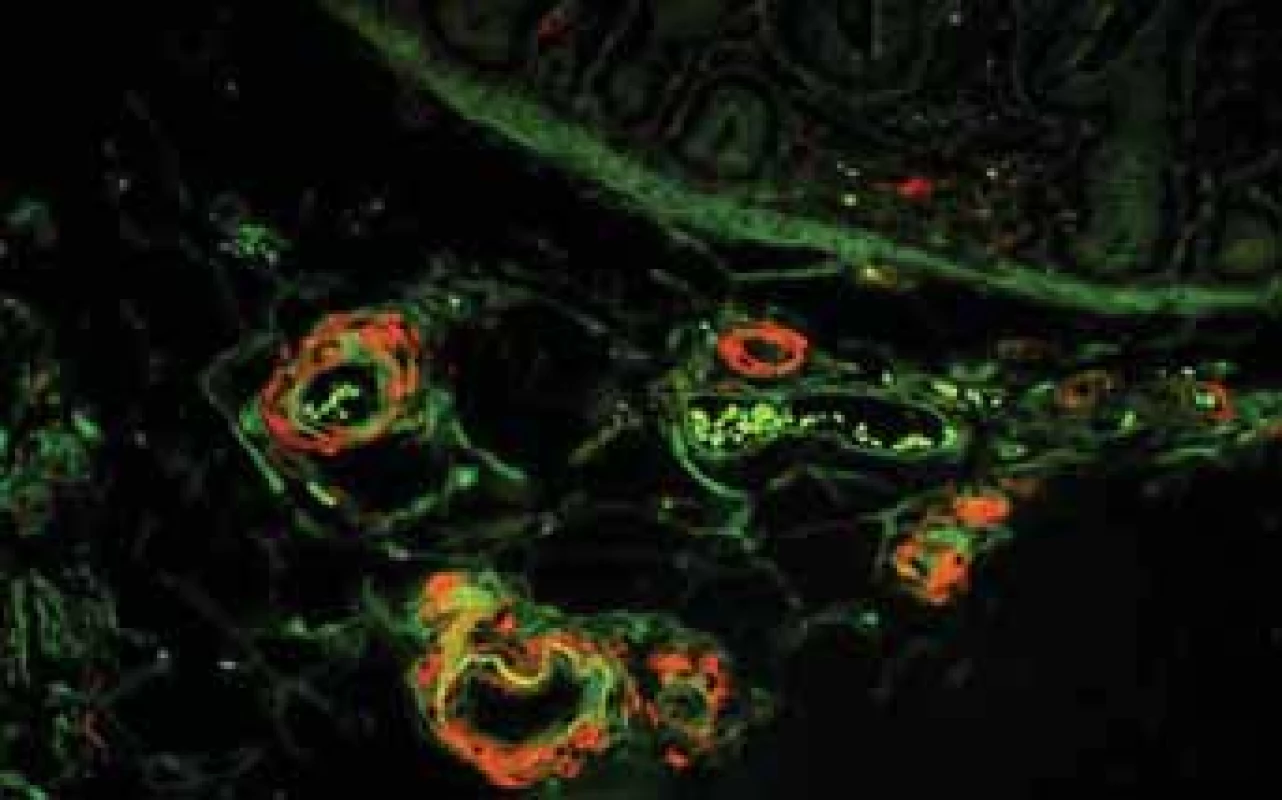
Kongo červeň vykazuje autofluorescenci a toho se využívá při detekci drobných depozit. Ve stěnách cév jsou drobná depozita červená.
Kongo red shows autofluorescency and it is used for small deposits detection. There are small red deposits in vessels wall.Image 9. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza). Glomerulus s Kongo červeň pozitivními depozity amyloidu.
Fig. 9. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis). Glomerulus with Kongo red positive deposits of amyloid.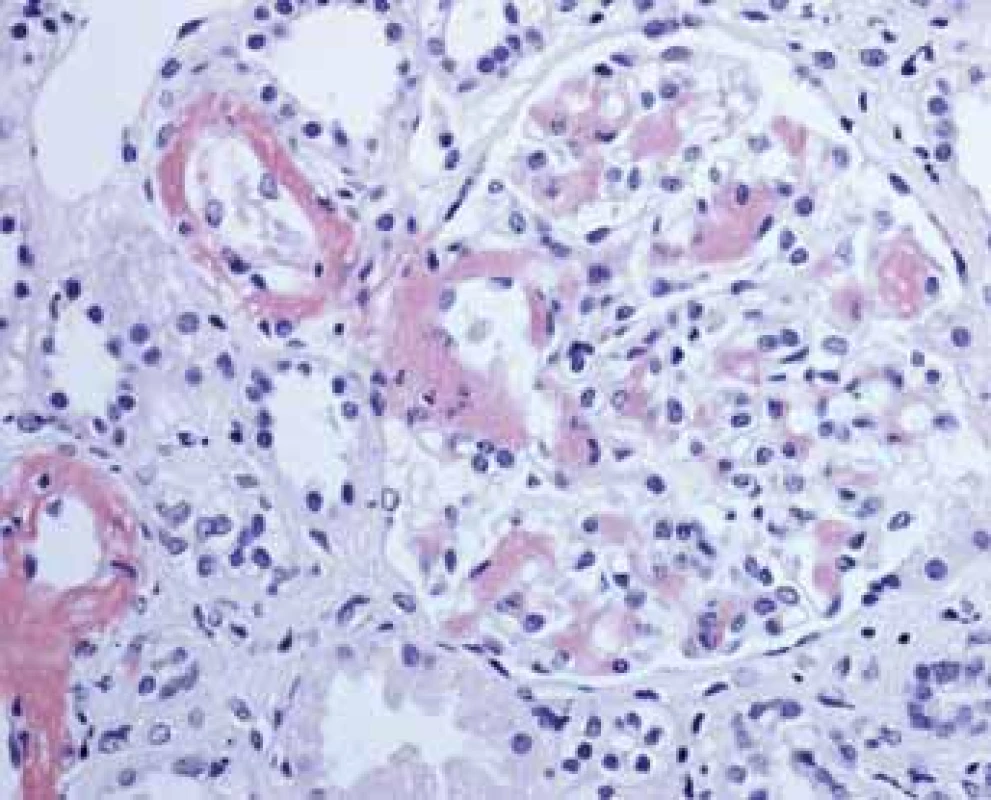
Image 10. Histologické nálezy u pacientů s IBD a renálnímmpostižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza). Autofluorescence Kongo červeně detekuje objemné depozitum ve stěně cévy a malá depozita v glomerulu.
Fig. 10. Biopsy pictures in IBD patients with renal illness (tubulointerstitial nephritis, glomerulonephritis, AA amyloidosis). Autofluorescency of Kongo red shows bulky deposit in vessel wall and small deposits in glomerulus.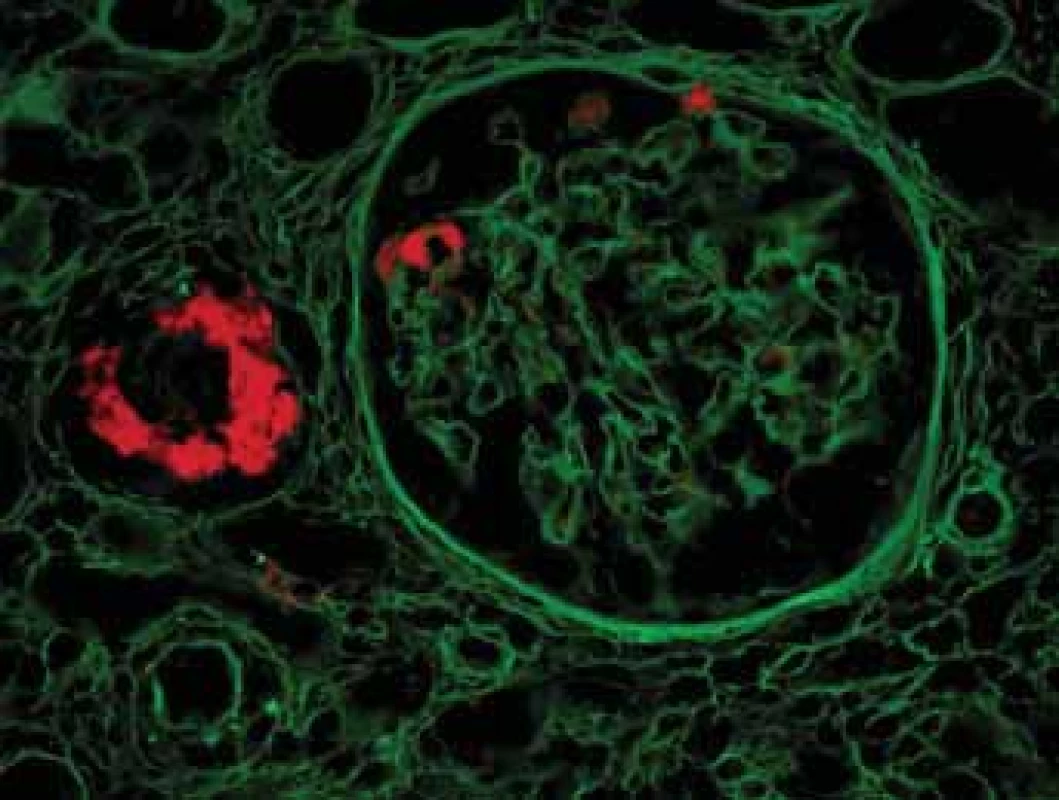
Image 11. Histologické nálezy u pacientů s IBD a renálním postižením (tubulointersticiální nefritida, glomerulonefritida, AA amyloidóza).
Fig. 11. Biopsy pictures in IBD patients with renal illness (tubulointerstitialnephritis, glomerulonephritis, AA amyloidosis).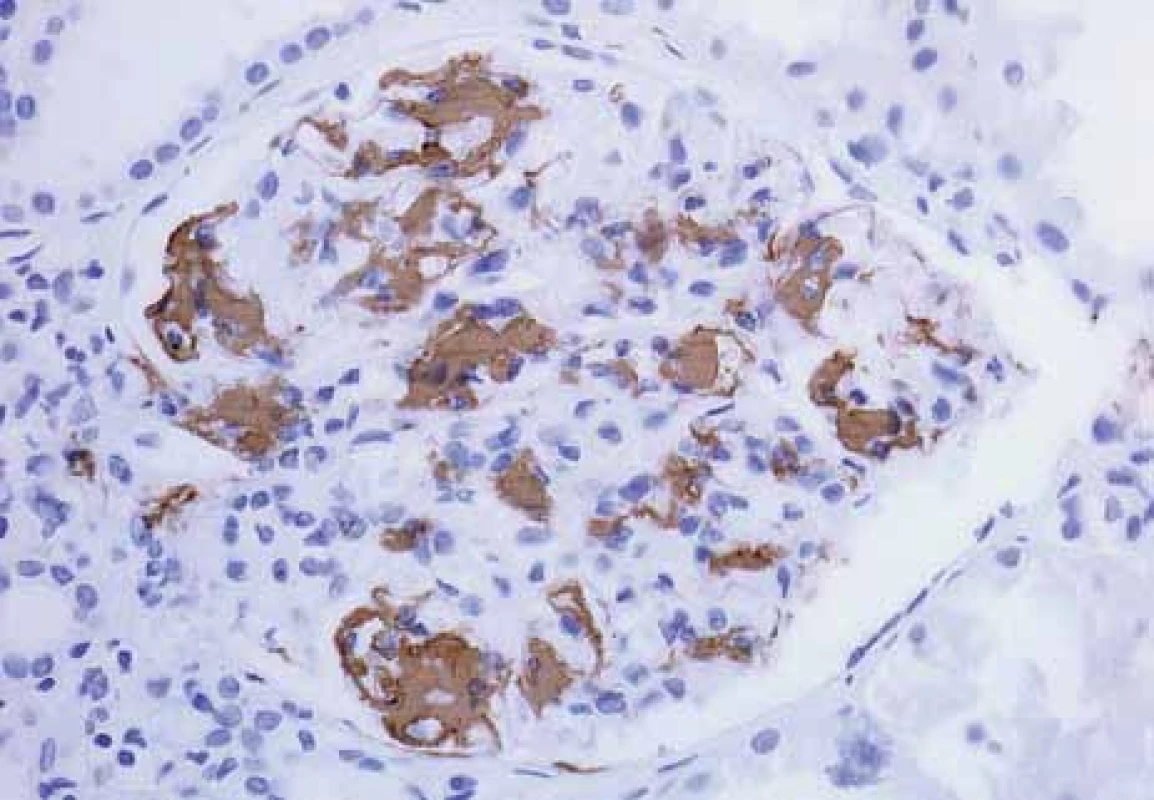
Imunohistochemický průkaz AA amyloidu; pozitivní depozita hnědě.
Immunohistochemistry confirmation of AA amyloid; positive deposits in brown.Urolitiáza
Urolitiáza je tvorba močových konkrementů (kamenů) v ledvinách a vývodných cestách močových. Je relativně častá u pacientů s IBD, především po větších resekčních výkonech na střevě. Jejich závažnost tkví nejen v akutních projevech renální koliky s blokádou odtoku moči, ale i v časté průvodné infekci. Navíc vzniklá symptomatologie může být překryta obtížemi při IBD, zvláště u pacientů s CD. Vedle nejčastějších konkrementů Ca-oxalátového typu mohou být přítomny i konkrementy jiného složení. Výjimečně se může jednat i o tkáňový detrit např. po nekróze renální papily. Močové konkrementy se mohou vyskytovat kdekoli v močových cestách a jsou častou příčinou bolestí, krvácení, obstrukce a sekundárníinfekce [9,27,32].
Prevalence a patogeneze
Prevalence urolitiázy je kolem 1,5–5 % v běžné populaci, u nemocných s IBD je významně častější, je zjišťována až u 20 % nemocných s CD. Recidivy urolitiázy jsou frekventní a odhadují se v průběhu 10 let až na 50–80 % případů. Na vzniku urolitiázy se mohou významně podílet četné faktory genetické (dvakrát častější výskyt urolitiázy v rodinách litiatiků), dietní (zvýšený příjem tmavých druhů masa, oxalátů v rostlinné potravě apod.), geografické (vyšší výskyt v horkém suchém klimatu) i sociálně-ekonomické (souvisí zřejmě s diet-ním režimem a větším příjmem potenciálně litiatických složek stravy u bohatších lidí se sedavým způsobem života). Urolitiáza vzniká vzájemnou interakcí tří složek:
- zvýšená koncentrace kamenotvorných látek v moči;
- přítomnost fyzikálních a chemických faktorů v moči vedoucích k tvorbě preformovaných jader konkrementů, např. krystalických jader tvořených solemi kyseliny močové;
- nedostatečná účinnost inhibitorů blokujících zvětšování krystalických jader konkrementů.
Enterická hyperoxalurie s malabsorpcí žlučových solí a mastných kyselin je častou komplikací IBD; především opakované ileální resekce jsou spojeny s výskytem nefrolitiázy a nefrokalcinózy. Nadbytek oxalátů je primárně vylučován ledvinami. Zvýšené močové vylučování oxalátů vede ke zvýšené saturaci moči Ca oxaláty, agregaci krystalů a vzniku urolitiázy či nefrokalcinózy. Prevence oxalátové litiázy zahrnuje vedle zvýšeného příjmu tekutin perorální podávání citrátu, magnezia, suplementu Ca, nutričně bilanční nízkooxalátové nízkotučné diety a též biologické ovlivnění střevní flóry (Oxalobacter formigenes, Bifidobacterium lactis apod.). Nové léčebné postupy u nemocných se zánětlivými onemocněními střeva zásadním způsobem změnily průběh onemocnění. Zda tato příznivá změna ovlivní prevalenci a rizikové faktory pro tvorbu močových kamenů, není dosud známo [32].
Nefrokalcinóza je označení nejčastěji kalciumoxalátových depozit v oblasti dřeně ledviny mimo kalichopánvičkový systém. Depozita kalcifikací jsou při endoskopickém vyšetření patrná jako podslizniční „konkrementy“. Nefrokalcinóza vzniká nejčastěji z metabolických příčin, jako je např. hyperkalciurie, změny pH moči, renální tubulární acidóza, sarkoidóza, Cushingův syndrom či hyperparatyreóza. Zvláštním typem je nefrokalcinóza při medullary sponge kidney, kdy vznikají kalciumfosfátová a kalciumoxalátová depozita v ektatických kanálcích distálních tubulů. Cystolitiáza vzniká na podkladě krystalizace ve stagnujícím roztoku moči. Cystolitiázu vyvolává často subvezikální obstrukce nejrůznější etiologie s chronickým reziduem, vzniká na cizích tělesech (stehy, katétry, stenty; po ipsačních aktivitách) a vzácně komplikuje parazitární onemocnění (bilharzioza).
Močové konkrementy se liší velikostí od mikroskopických krystalických jader až po kameny o velikosti několika centimetrů. Velké kameny zvané odlitkové (tvaru paroží) mohou skutečně vyplňovat celý renální kalichopánvičkový systém. Populační studie z posledních let v našem zeměpisném pásmu ukazují, že kolem 60 % močových konkrementů je složeno z kalciumoxalátu, více než 10 % je tvořeno solemi kalciumoxalátu a kalciumfosfátu, 5 % je z kyseliny močové, asi 1 % konkrementů je cystinových a další z fosforečnanu hořečnato-amonného (struvit) či jde o „infekční“ konkrementy. Četné mohou být také konkrementy smíšené. Kameny mohou mít charakteristickou barvu či vzhled, ale k přesnému určení jejich složení by měla být provedena krystalografická analýza (s chemickým rozborem).
Příznaky a objektivní nález
Některé konkrementy zůstávají dlouho klinicky němé. Pokud kameny způsobí blokádu jednoho či více kalichů, ledvinné pánvičky či ureteru, objevují se tupé bolesti v boku a v zádech či ostrá bolest spojená s renální kolikou. Měchýřové kameny působí suprapubické bolesti. Typické symptomy renální koliky zahrnují krutou intermitentní bolest, obvykle lokalizovanou v boku či v oblasti ledvin, a její vyzařování podél průběhu ureteru do genitálu či na vnitřní stranu stehna. Někdy mohou průvodní gastrointestinální symptomatologie (nauzea, zvracení, abdominální distenze, klinický obraz ilea) zakrýt renální původ obtíží. Časté bývají i zimnice, horečka, hematurie a časté močení, především tehdy, pokud se konkrement pohybuje ureterální peristaltikou směrem k močovému měchýři. Ledvina na straně postižené renální kolikou vykazuje při akutním stavu spojeném s blokádou ureterálním konkrementem přechodný pokles funkce, který může po odchodu konkrementu určitý čas přetrvávat [9].
Diagnóza
Na konkrementy v močových cestách pomýšlíme při symptomech renální koliky, při bolestech v boku, v kostovertebrálním úhlu, lumbální krajině, tříslech a genitálu (bez lokálního nálezu). Diagnózu podporuje vyšetření moči, sonografie a rentgenové nálezy. Klíčový význam pro časnou diagnostiku má sonografie, event. CT. Diferenciální diagnóza zahrnuje appendicitidu, cholecystitidu, peptický vřed a pankreatitidu. Vyšetření moči: je přítomna makro - či mikroskopická hematurie. Někdy též pyurie s bakteriurií. V sedimentu mohou být identifikovány různé krystaly, ale složení kamene by mělo být stanoveno krystalograficky. (Jedinou výjimku představuje nález typických šestiúhelníkových krystalů cystinu v koncentrovaném okyseleném vzorku, který je velmi suspektní pro cystinurii.)
Léčba
Malé solitární konkrementy, nekomplikované obstrukcí či infekcí, nevyžadují speciální léčbu. Udává se, že 70–80 % konkrementů může odejít spontánně. Vždy usilujeme o eradikaci močové infekce, vč. dlouhodobého podávání močových chemoterapeutik. Symptomatologii renální koliky utlumíme dle potřeby i opiáty, současně podáváme spasmolytika. Větší obturující konkrementy musí být někdy odstraněny operativně. Litotrypse pomocí extrakorporálních rázových vln (ESWL-LARV) výrazně zlepšila léčebné postupy u konkrementů do 1 cm, lokalizovaných v ledvinné pánvičce či v nejproximálnější části ureteru. Další alternativní metodou je perkutánní extrakce konkrementu (PEK) či ureterorenoskopické odstranění litiázy (URS), ev. s ESWL-LARV. Některé konkrementy v pánvičce a ureteru vyžadují i chirurgické řešení, především tam, kde jsou spojeny s infekcí. Konkrementy menší než 1 cm v dolním ureteru mohou být uvolněny endoskopicky, např. pomocí cystoskopicky zavedeného drátěného košíčku s postupným sestupem konkrementu. Konkrementy z kyseliny močové mohou být někdy zmenšeny či rozpuštěny dlouhodobou alkalizací (se současným podáváním inhibitorů xantinoxidázy – allopurinolu, ev. enzymaticky působícího febuxostatu). Přímá chemická disoluce močových konkrementů však zatím nebyla dostatečně úspěšná.
V diferenciální diagnostice se zaměřujeme zejména na konkrementy, které pacienty ohrožují vznikem urosepse nebo poškozením renálních funkcí. Zejména riziko urosepse nutí k aktivnímu přístupu. V první době je nutné založit dostatečnou derivaci moči. Podle konkrétní situace volíme mezí perkutánní nefrostomií a zavedením stentu. Stent je zdánlivě méně invazivní, ale při husté pyurii a těsné obstrukci s edémem urotelu je často nespolehlivou drenáží. Pouze dostatečná drenáž a celková terapie vč. vysokodávkovaných antibiotik je postupem, který má naději na úspěch. I dnes, v éře superinvazivních přístupů, můžeme pacienta na odděleních intenzivní péče ztratit při iniciálně nesprávném postupu. Pokud je nutno konkrement odstranit, volíme v současné době mezi endoskopickým přístupem (URS, PEK) nebo ESWL-LARV.
Otevřené urologické výkony byly prakticky opuštěny. Otevřenou operativou řešíme mimořádné situace jako nefrektomie těžce poškozených ledvin, které jsou zdrojem nezvládnutelné infekce, a výjimečné komplikace endoskopických výkonů. Při výběru endoskopické operace bereme v úvahu lokalizaci a velikost litiázy, komplikující onemocnění a habitus pacienta (zejména monstrózní obezita modifikuje přístup k litiáze). V zásadě se snažíme metodikou ESWL–LARV odstranit konkrementy menšího objemu, kde je předpoklad dosažení jemné fragmentace a volné pasáže fragmentů močovými cestami. Endoskopické výkony mají nespornou výhodu přímé vizuální kontroly a ve zkušených rukou jsou zárukou bezpečného výkonu. URS používáme k odstranění ureterolitiázy a dobře přístupných konkrementů z kalichopánvičkového systému. PEK indikujeme u konkrementů lokalizovaných v hůře přístupných oblastech kalichopánvičkového systému a u konkrementů většího rozsahu, vč. odlitkových. Všechny metody lze kombinovat.
Po odstranění odesíláme konkrement na rozbor k zjištění příčiny onemocnění. K dalšímu vyšetření jsou indikováni jedinci s recidivující litiázou, s podezřením na metabolickou příčinu litiázy na základě rozboru konkrementu (Ca-oxalát monohydrát – whewellit či dihydrát weddellit, cystin, kalciumfosfát, urát apod.) a všeobecného biochemického vyšetření (hyperkalcemie, hyperurikosurie, hyperoxalurie), se závažnými komorbiditami (resekce střeva, enteritidy, revmatická onemocnění, stavy po úrazech s dlouhodobou imobilizací), s rizikovou rodinnou a sociální anamnézou (způsob fyzické aktivity a životosprávy) a mladí pacienti. Metabolické vyšetření indikujeme nejdříve za 8 týdnů po odchodu litiázy nebo ukončení všech intervenčních výkonů (tj. až po odstranění stentů nebo nefrostomie). U pacientů s recidivující urolitiázou bylo prokázáno, že metafylaxe je levnější než opakované litotrypse nebo endoskopické výkony. Podle výsledků metabolického vyšetření lze příčinu urolitiázy určit až v 97 % případů.
Vyšetření močového konkrementu buď přímo určuje typ poruchy (cystin), nebo upřesní směr dalšího biochemického vyšetření (kalciumoxalát, kalciumfosfát, urát). Analýza konkrementu je založena na chemických a fyzikálních metodách tak, aby byly vyšetřeny všechny složky konkrementu kvantitativně a kvalitativně. Z fyzikálních metod se rutinně používá mikroskopické vyšetření (polarizační a elektronové), které informuje o struktuře a původu krystalů. K další identifikaci složek konkrementu se nejvíce využívá infračervená spektrofotometrie, dále rentgenová difrakce a ev. krystalografické metody a termální analýza.
Profylaxe urolitiázy
Vyšetření kamenotvorných látek v moči a podrobná anamnéza patří k základním bodům profylaxe bezprostředně po objevení a rozboru konkrementu.
Hyperoxalurie (močové oxaláty > 40 mg/den): vedle primární hyperoxalurie může být hyperoxalurie sekundární způsobena nadměrným příjmem potravin obsahujících oxaláty (rebarbora, špenát, kakao, ořechy, pepř a čaj) nebo častěji např. u nemocných s IBD nadměrnou absorpcí oxalátů při některých střevních chorobách (např. po resekcích střeva, bakteriálních dysmikrobiích, chronické pankreatitidě a pankreatické insuficienci či biliárním postižení po ileojejunální chirurgické intervenci). Anamnéza a množství oxalátu v moči pomůže rozlišit mezi příčinami hyperoxalurie. Pacienti s postižením tenkého střeva mohou být léčeni kombinací nízkooxalátové, nízkotučné diety, zvýšeným přísunem kalcia či cholestyraminem.
Hypocitráturie (močové citráty < 350 mg/den): samotná či spolu s dalšími poruchami podporuje tvorbu konkrementů, protože citráty za fyziologických podmínek vážou kolem 50 % močového Ca jako solubilního kalcium citrátu. Perorální podání Na či K citrátu obvykle zvyšuje vylučování močového citrátu (např. K citrát 2–3 g/den).
Kalciové kameny: u přibližně 5 % nemocných, kteří mají kalciové kameny, je zjištěna primární hyperparatyreóza. Ostatní vzácnější příčiny kalciové litiázy jsou sarkoidóza, intoxikace vitaminem D, mnohočetný myelom, nádorové metastázy a primární hyperoxalurie.
Idiopatická hyperkalciurie, často na hereditárním podkladu, je přítomna u 20–40 % pacientů, u kterých se vytvořily Ca konkrementy. Představuje hlavní rizikový faktor pro tvorbu kalciových kamenů. U většiny nemocných s kontrastní urolitiázou jsou sérové hladiny Ca v mezích normy. V současné době rozlišujeme dvě formy idiopatické hyperkalciurie – renální formu, při níž je hyperkalciurie podmíněna sníženou tubulární resorpcí Ca, a absorpční formu, kdy jde o hyperkalciurii v důsledku zvýšené střevní resorpce Ca.
Při rozlišování těchto forem idiopatické hyperkalciurie pomáhá vyšetření vylučování Ca močí za podmínek tzv. bezkalciové diety (nemocný nesmí min. 3 dny přijímat potraviny obsahující větší množství vápníku (Ca) – především mléko a mléčné produkty). Za těchto podmínek klesá vylučování Ca močí k hodnotě 5 mmol/24 hod a nižším. U tzv. renální formy vylučování Ca močí k této hodnotě neklesne. U nemocných s absorpční formou idiopatické hyperkalciurie dochází k významnému snížení. Při běžné dietě vylučování Ca močí nepřevýší 7,5 mmol a u žen 6,25 mmol za 24 hod. Thiazidová diuretika snižují vylučování Ca a saturaci moči Ca oxalátem – výrazně klesá novotvorba konkrementů. Pacientům s urolitiázou je doporučováno zvýšit příjem tekutin na nejméně 2,5 l/den. Doplňuje se draslík v případech, kdy jeho sérová hladina klesá pod 3,5 mmol/l. V dietě se většinou snižuje příjem kalciových solí.
Hyperurikosurie je definována jako vylučování kyseliny močové > 4,5 mmol/den (750 mg/den ženy či 800 mg/den muži). Tvorba urátových konkrementů je vedle vylučovaného množství kyseliny močové významně ovlivněna hodnotou pH moči. Nízké pH moči podporuje tvorbu urátových konkrementů. Urátové krystaly tvoří „zárodečná jádra“, na nichž se mohou vychytávat krystaly Ca-oxalátu, a vést tak ke vzniku mikro - až makrolitiázy. U nemocných mohou být zjištěny čisté Ca konkrementy, neboť přítomnost urátových jader není zřejmá při běžném laboratorním vyšetření (hyperurikosurická kalciumoxalátová litiáza). Mohou vznikat i kameny smíšené (urát + kalciové soli). Z hlediska patogeneze hyperurikosurie hraje značnou roli zvýšený příjem purinů ve formě tmavého masa (především vnitřnosti, zvěřina), případně i některých ryb. Vedle časté zásadní změny v dietě podáváme alopurinol či účinnější febuxostat s cílem snížit produkci urátů. U menšího počtu nemocných není zjištěna žádná metabolická porucha. Tito lidé nejsou schopni tolerovat normální množství kamenotvorných látek v moči, aniž by nedocházelo ke krystalizaci. Thiazidová diuretika a zvýšený přívod tekutin snižují v těchto případech tvorbu konkrementů.
Kameny kyseliny močové se mohou objevit při snížení močového pH, při kterém nedisociované urátové soli krystalizují. K léčebným opatřením patří úprava močového pH na hodnotu mezi 6 a 6,5 pomocí perorální alkalizace (NaHCO3 a/či K-citrát), podávání alopurinolu (Milurit), redukovaný příjem purinů a zvýšený tekutin na 2–2,5 l/den.
Magnezium-amonium-fosfát (struvit): při nálezu pomýšlíme na infekci močových cest s mikrobiální flórou obsahující ureázu. Kameny jsou místem infekce a musí být léčeny jako jiné infekce v těle. Na rozdíl od ostatních konkrementů se tyto infekční kameny vyskytují především u žen. Nutná je pečlivá kontrola a léčba i menších infekcí vyvolaných močovinu rozkládajícími mikroby, stejně jako všech potenciálních metabolických příčin.
Vzácné cystinové konkrementy se diagnostikují při nálezu cystinurie.
Screenignové vyšetření u IBD nemocných
Jak bylo výše uvedeno, je výskyt urolitiázy u nemocných s IBD výrazně vyšší, než je tomu v běžné populaci. Je proto namístě aktivně pátrat po přítomnosti asymptomatické urolitiázy a také po predisponujících faktorech jejího vzniku, jako je hypersaturovaná moč kamenotvornými látkami nebo chybění některých blokátorů krystalizace (magnezium, citráty). Kteří pacienti by měli podstoupit pravidelná screeningová vyšetření spočívající v ultrasonografii ledvin a močových cest a metabolického vyšetření moči? Jde především o nemocné s CD postihující extenzivně tenké střevo, především distální ileum; o nemocné s CD, kteří se podrobili opakované resekci tenkého střeva; o nemocné s CD s cholereickými průjmy a/nebo malabsorpcí vitaminu B12; o nemocné s CD s komplikovaným průběhem choroby vedoucím ke stenóze ureteru nebo k píštělím do močových cest s opakovanými infekty močových cest. Vhodné je vyšetřit a dispenzarizovat pacienty s CD a UC, kteří se podrobili provedení kolektomie a mají vytvořenou ileostomii, u kterých vysoké odpady tekutin ze stomie mohou přispívat k vysoké koncentraci kamenotvorných látek v moči (oxaláty/uráty). Průkaz hypersaturované moči kamenotvornými látkami je efektivně eliminován jednoduchou léčbou, a minimalizuje tak závažné urologické komplikace u těchto pacientů v budoucnosti.
Autor děkuje doc. MUDr. E. Honsové, Ph.D., přednostce Pracoviště klinické a transplantační patologie Transplantcentra IKEM v Praze, za poskytnutí a zhodnocení bioptických nálezů.
The author thanks with great gratitude Assoc. Prof. E. Honsova, MD, PhD, Head of the Department for Clinical and Transplant Pathology, Transplant Center IKEM Prague, for the extension and evaluation of biopsy pictures.
Doručeno/Submitted: 20. 1. 2020
Přijato/Accepted: 30. 3. 2020
prof. MUDr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE I.V.F. a. s., Praha
Českomoravská 2510/19
190 00 Praha 9 – Libeň
Sources
1. Bortlík M. Vývoj léčby idiopatických střevních zánětů v posledních 20. letech. Gastroent Hepatol 2015; 69 (4): 341–350.
2. Magro F, Langner C, Driessen A et al. European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7 (10): 827–851. doi: 10.1016/j.crohns.2013.06.001.
3. Lukáš M et al. Pokroky v diagnostice a léčbě idiopatických střevních zánětů. Praha: Galen 2019.
4. Krebs CF, Paust HJ, Krohn S et al. Autoimmune renal disease is exacerbated by S1P-receptor-1-dependent intestinal TH17 cell migration to the kidney. Immunity 2016; 45 (5): 1078–1092. doi: 10.1016/j.immuni.2016.10.020.
5. Oikonomou K, Kapsoritakis A, Eleftheriadis T et al. Renal manifestations and complications of inflammatory bowel disease. Inflamm Bowel Dis 2011; 17 (4): 1034–1045. doi: 10.1002/ibd.21468.
6. Ridder RM, Kreth HW, Kiss E et al. Membranous nephropathy associated with familial chronic ulcerative colitis in a 12-year-old girl. Pediatr Nephrol 2005; 20 (9): 1349–1351. doi: 10.1007/s00467-005-1986-6.
7. Van Staa TP, Travis S, Leufkens HG et al. 5-aminosalicylic acids and the risk of renal disease: a large British epidemiologic study. Gastroenterology 2004; 126 (7): 1733–1739. doi: 10.1053/j.gastro.2004.03.016.
8. Riley SA, Lloyd DR, Mani V. Tests of renal function in patients with quiscent colitis: effect of drug treatment. Gut 1992; 33 (10): 1348–1352. doi: 10.1136/gut.33.10.1348.
9. Kreisel W, Wolf LM, Grotz et al. Renal tubular damage: an extraintestinal manifestation of chronic inflammatory bowel disease. Eur J Gastroenterol Hepatol 1996; 8 (5): 461–468.
10. Teplan V. Nefrologické minimum pro klinickou praxi. 3. přepracované a doplněné vyd. Praha: Maxdorf 2020.
11. Teplan V, Marečková O, Lukáš M. Onemocnění gastrointestinálního traktu a choroby ledvin. Gastroent Hepatol 2018; 72 (1): 50–57. doi: 10.14735/amgh201850.
12. Teplan V, Ševela K. Toxické a lékové poškození jater a ledvin. Gastroent Hepatol 2019; 73 (1): 66–74. doi: 10.14735/amgh201966.
13. Lukáš M, Bortlík M, Novotný A et al. Nefrotoxicita mesalazinu při dlouhodobé léčbě ulcerozní kolitidy a Crohnovy nemoci. Čes a Slov Gastroent 1999; 53 (5): 135–139.
14. Magalhães-Costa P, Matos L, Chagas C. Chronic tubulointerstitial nephritis induced by 5-aminosalicylate in an ulcerative colitis patient: a rare but serious adverse event. BMJ Case Rep 2015; bcr2014207928. doi: 10.1136/bcr-2014-207928.
15. World MJ, Stevens PE, Ashton M et al. Mesalasine-associated interstitial nephritis. Nephrol Dial Transpl 1996; 11 (4): 614–621. doi: 10.1093/oxfordjournals.ndt.a027349.
16. Calviño J, Romero R, Pintos E et al. Mesalasine-associated tubulo-interstitial nephritis in inflammatory bowel disease. Clin Nephrol 1998; 49 (4): 265–267.
17. Pohjonen J, Nurmi R, Metso M et al. Inflammatory bowel disease in patients undergoing renal biopsies. Clin Kidney J 2019; 12 (5): 645–651. doi: 10.1093/ckj/sfz004.
18. De Jong DJ, Tielen J, Habraken CM et al. 5-aminosalicylates and effect on renal function in patients with Crohn’s diseases. Inflamm Bowel Dis 2005; 11 (11): 972–976. doi: 10.1097/01.mib.0000185402.65288.19.
19. Mahmud N, McDonald GS, Kelleher D et al. Microalbuminuria correlates with intestinal histopathological grading in patients with inflammatory bowel disease. Gut 1996; 38 (1): 99–103. doi: 10.1136/gut.38.1.99.
20. Barbour VM, Williams PF. Nephrotic syndrome associated with sulphasalazine. BMJ 1990; 301 (6755): 818–822. doi: 10.1136/bmj.301.6755.818-b.
21. Mahmud N, O’Toole D, O’Hare N et al. Evaluation of renal function following treatment with 5-aminosalicylic acid derivatives in patients with ulcerative colitis. Aliment Phamacol Ther 2002; 16 (2): 207–215. doi: 10.1046/j.1365-2036.2002.01155.x.
22. Primas C, Novacek G, Schweiger K et al. Renal insufficiency in IBD – prevalence and possible pathogenetic aspects. J Crohns Colitis 2013; 7 (12): 630–634. doi: 10.1016/j.crohns.2013.05.001.
23. Oikonomou KA, Kapsoritakis AN, Stefanidis Iet al. Drug-induced nephrotoxicity in inflammatory bowel disease. Nephron Clin Pract 2011; 119 (2): 89–94. doi: 10.1159/000326682.
24. Hämling J, Raeder A, Helmchen U et al. 5-aminosalicylic acid-associated renal tubular acidosis with decreased renal function in Crohn’s disease. Digestion 1997; 58 (3): 304–307. doi: 10.1159/000201459.
25. Kiryluk K, Li Y, Scolari F et al. Discovery of new risk loci for IgA nephropathy implicates genes involved in immunity against intestinal pathogens. Nat Genet 2014; 46 (11): 1187–1196. doi: 10.1038/ng.3118.
26. Honkanen T, Mustonen J, Kainulainen H et al. Small bowel cyclooxygenase 2 (COX-2) expression in patients with IgA nephropathy. Kidney Int 2005; 67 (6): 2187–2195. doi: 10.1111/ j.1523-1755.2005.00324.x.
27. Ritz E. Gastrointestinal disease and the kidney. In: Davison AM, Cameron JS, Grunfeld JP et al (eds). Oxford Textbook of Clinical Nephrology. Oxford University Press 1998 : 2733–2735.
28. Ramos-Casals M, Brito-Zerón P, Muñoz S et al. Autoimmune diseases induced by TNF-targeted therapies: analysis of 233 cases. Medicine (Baltimore) 2007; 86 (4): 242–251. doi: 10.1097/MD.0b013e3181441a68.
29. Haake H, Köneke J, Amann K et al. Development of systemic lupus erythematosus with focal proliferative lupus nephritis during anti-TNF-alpha therapy for psoriatic arthritis. Med Klin (Munich) 2007; 102 (10): 852–857. doi: 10.1007/s00063-007-1104-6.
30. Saint Marcoux B, De Bandt M, CRI (Club Rhumatismes et Inflammation). Vasculitides induced by TNF alpha antagonists: a study in 39 patients in France. Joint Bone Spine 2006; 73 (6): 710–713. doi: 10.1016/j.jbspin.2006.02.010.
31. Teplan V, Honsová E, Lukáš M. Glomerulopatie u pacientů s idiopatickými střevními záněty. Gastroent Hepatol 2020; 74 (1): 62–67. doi: 10.14735/amgh202062.
32. Cuquerella JT, Bosca-Watts MM, Ausejo RA et al. Amyloidosis in inflammatory bowel disease: a systematic review of epidemiology, clinical features, and treatment. J Crohns Colitis 2016; 10 (10): 1245–1253. doi: 10.1093/ecco-jcc/jjw080.
33. Ryšavá R. Postižení gastroinstestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat. Gastroent Hepatol 2019; 73 (2): 154–162. doi: 10.14735/amgh2019154.
34. Teplan V, Lukáš M. Urolithiasis in patients with inflammatory bowel disease. Gastroent Hepatol 2015; 69 (6): 561–569. doi: 10.14735/ amgh2015561.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 3-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Vliv pandemie COVID-19 na endoskopickou praxi v České republice – dotazníková studie
- Syndrom odpojeného pankreatického vývodu – opomíjená komplikace akutní pankreatitidy
- Motorizovaná spirální enteroskopie – naše první zkušenosti
- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- Projekt „Endoskopická centra“v České republice
- Aktuální vědecké podklady pro dietu pro Crohnovu chorobu založenou na vyloučení konkrétních potravin (CDED)
- Budesonid MMX v léčbě ulcerózní kolitidy
- Neobvyklý případ dysfagie horního typu
- Renální onemocnění pacientů s idiopatickými střevními záněty
- Na památku doc. Jana Kotrlíka
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz: Ischemická kolitida na podkladě trombózy dolní mezenterické žíly
- Perioperační ezofagogastroduodenoskopie v prevenci a terapii anastomotických komplikací – přehledový článek
- Herpetická ezofagitida u imunokompetentního sedmiletého pacienta
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Neobvyklý případ dysfagie horního typu
- Motorizovaná spirální enteroskopie – naše první zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

