-
Medical journals
- Career
Aktuální vědecké podklady pro dietu pro Crohnovu chorobu založenou na vyloučení konkrétních potravin (CDED)
Authors: El-Lababidi N.
Authors‘ workplace: Centrum dětské gastroenterologie, hepatologie a výživy, Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze
Published in: Gastroent Hepatol 2020; 74(3): 240-245
Category: IBD: Review Article
doi: https://doi.org/10.14735/amgh2020240Overview
Dle doporučených postupů Evropské organizace pro Crohnovu chorobu a kolitidu (ECCO – European Crohn’s and Colitis Organization) a Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN – European Society for Pediatric Gastroenterology, Hepatology and Nutrition) je metodou volby v indukci remise Crohnovy choroby (CD – Crohn’s disease) v dětském věku exkluzivní enterální výživa (EEN – exclusive enteral nutrition). Hlavními limitacemi EEN jsou její monotónnost a chuťové vlastnosti. V západní dietě byly identifikovány faktory, které se mohou podílet na střevní dysbióze, dysregulaci imunitních mechanizmů a indukci zánětu ve střevní sliznici. Při odstranění těchto dietních faktorů by měla nastat remise CD. Na tomto principu je postavena dieta pro CD s vyloučením konkrétních potravin (CDED – Crohn’s Disease Exclusion Diet). Data ukazují, že CDED s parciální enterální výživou (PEN – partial enteral nutrition) je v 6. týdnu terapie stejně efektivní, ale lépe tolerovaná než EEN. Ve 12. týdnu léčby jsou indukce a udržení remise CD statisticky významně lepší při použití CDED s PEN. CDED je velice slibný koncept v indukci remise lehké až středně těžké luminální formy CD.
Klíčová slova:
Crohnova choroba – Crohn’s Disease Exclusion Diet (CDED) – adherence – střevní mikrobiota
Úvod
Crohnova choroba (CD – Crohn’s disease) je chronickým idiopatickým zánětlivým onemocněním zažívací trubice [1], jehož incidence v dětském věku globálně stoupá [2]. Etiologie a etiopatogeneze tohoto onemocnění nejsou dosud zcela objasněny. Předpokládá se souhra genetické predispozice, antigenů střevní mikrobioty, patologické imunitní reakce a faktorů životního prostředí [3]. Alterace střevní mikrobioty se považuje za klíčový moment ve spuštění patologické kaskády vedoucí k rozvoji CD [4]. Současně platné doporučené postupy Evropské organizace pro Crohnovu chorobu a kolitidu (ECCO) a Evropské společnosti pro pediatrickou gastroenterologii, hepatologii a výživu (ESPGHAN) doporučují jako metodu volby exkluzivní enterální výživu (EEN – exclusive enteral nutrition) v indukci remise CD u dětí s aktivní luminální chorobou [2]. Za použití EEN lze dosáhnout remise CD ve stejném procentu jako při použití kortikoidů, ale pokles dětského indexu aktivity Crohnovy choroby (PCDAI – Pediatric Crohn’s Disease Activity Index) a slizniční hojení jsou statisticky významně lepší za použití EEN [5,6]. Užívání EEN v klinické praxi naráží na řadu problémů, proto se dlouhodobě pátrá po dietních alternativách, které by byly stejně efektivní nebo efektivnější než EEN. První alternativní dietou s publikovanou randomizovanou kontrolovanou studií prokazující její potenciální efekt v indukci a udržení remise u pacientů s lehkou až středně těžkou luminální formou CD je tzv. dieta pro Crohnovu chorobu založená na vyloučení konkrétních potravin (CDED – Crohn’s Disease Exclusion Diet) [7].
Limitace exkluzivní enterální výživy v klinické praxi
Hlavním problémem EEN je špatná adherence pacientů. Dle různých zdrojů se compliance pacientů pohybuje mezi 50 a 91 %, nižší čísla se zdají být reálnější [8–11]. Z dotazníkového šetření vyplývá, že hlavními důvody nízké adherence jsou špatné chuťové vlastnosti a monotónnost diety [12]. Dětští pacienti a zejména jejich rodiče vnímají dietu na bázi běžné stravy lépe než EEN [10].
Mezi další problémy EEN v klinické praxi patří, že se jedná o krátkodobou intervenci (6–8 týdnů) bez jasné pokračovací terapeutické strategie [13]. Dodržování EEN je náročné pro vynechání jakéhokoli kontaktu se stravou po stejně dlouhou dobu [13]. EEN vede ke snížení diverzity střevní mikrobioty a množství volných mastných kyselin s krátkým řetězcem (SCFA – short chain fatty acid) a je velmi chudá na vlákninu [14,15].
Západní dieta, složky stravy a jejich vliv na Crohnovu chorobu
Západní dieta je charakteristická nízkým obsahem vlákniny [15] a vysokým obsahem tuků, živočišných bílkovin, polynenasycených mastných kyselin (PUFA – polyunsaturated fatty acids) a rafinovaných cukrů [15,16]. Jedním z diskutovaných etiopatogenetických mechanizmů, které by mohly vést k rozvoji CD, je rozvoj střevní dysbiózy s následným zvýšením střevní permeability a vznikem zánětu střeva nízkého stupně na podkladě dlouhodobého požívání diety západního stylu [16].
Dlouhodobý vysoký přísun vlákniny, zejména ovocné, se jeví jako významný protektivní faktor proti rozvoji CD [17]. Na druhou stranu může vést její dlouhodobý nedostatek k šíření bakterií degradujících střevní hlenovou vrstvu a podporovat rozvoj kolitidy [18]. Za použití myších modelů se zdá, že dlouhodobé podávání diety s vysokým obsahem tuků a cukrů by mohlo vést ke zvýšení střevní propustnosti se ztenčením hlenové vrstvy tlustého střeva a poklesem počtu pohárkových buněk [16] a ke zvýšenému osídlení střeva E. coli [15]. Izolovaný vysoký příjem tuků vedl na zvířecích modelech ke změnám v denzitě a distribuci mikrobioty v gastrointestinálním traktu, obzvlášť ve střevě [19]. Na myších modelech se jeví lepek jako dietní faktor, který by mohl vyvolávat chronický zánět tenkého střeva [20]. Emulzifikátory mohou měnit složení mikrobioty a usnadnit přesun bakterií přes střevní slizniční povrch [21,22]. Maltodextriny ve stravě mohou mít negativní dopad na střevní imunitní mechanizmy poškozením [23] a potlačením antibakteriální odpovědi [24], usnadněním přilnutí bakterií ke střevním epiteliím [23] a změnami ve složení mikrobioty [25]. Karagenany mohou zvýšit propustnost střevní stěny a vést ke ztrátě tight-junctions buněčných spojů [24].
Na podkladě těchto vědeckých poznatků by mohla vést dieta založená na zvýšeném příjmu vlákniny a s vysazením, resp. omezením identifikovaných potenciálních škodlivých složek k obnovení bariérových a imunitních funkcí střeva, snížení počtu patogenních bakterií a k úpravě složení mikrobioty, a tím k indukci a udržení remise CD. Dieta, která byla navržena s respektováním těchto požadavků, je CDED.
Crohn’s Disease Exclusion Diet
Jak napovídá název, Crohn’s Disease Exclusion Diet (CDED) je dieta založená na vyloučení konkrétních potravin z jídelníčku pacienta. Potraviny se dělí na povinné, povolené a zakázané. Seznam povolených složek se rozšiřuje s délkou trvání diety, zatímco seznam zakázaných potravin se zmenšuje (tab. 1). CDED se dělí na tři fáze, přičemž první dvě fáze trvají každá 6 týdnů a trvání 3. fáze se odvíjí od ochoty pacienta v dietě pokračovat. V 1. fázi pochází 50 % kalorií z parciální enterální výživy (PEN – partial enteral nutrition) (Modulen, Nestlé Health Science, Vevey, Švýcarsko) a 50 % ze stravy, zatímco ve druhé fázi tvoří PEN jen 25 % kalorického příjmu a zbytek pochází ze stravy [7]. Ve třetí fázi jsou 2 volné dny, kdy má pacient značnou volnost ve své dietě, ostatní dny jsou identické s druhou fází.
Table 1. Seznam povinných, povolených a zakázaných potravin v průběhu 1. a 2. fáze CDED.
Tab. 1. List of mandatory, allowed and disallowed foods during phases 1 and 2 of CDED.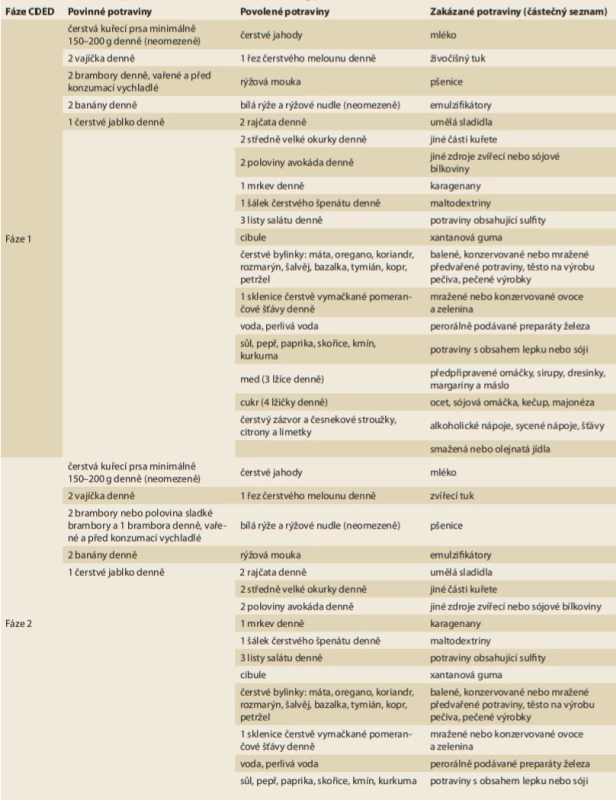
Tab. 1 – pokračování. Seznam povinných, povolených a zakázaných potravin v průběhu 1. a 2. fáze CDED.
Tab. 1 – continuing. List of mandatory, allowed and disallowed foods during phases 1 and 2 of CDED.
CDED – Crohn’s Disease Exclusion Diet. Převzato a graficky upraveno z [7]. Možný efekt CDED byl poprvé popsán v observační studii z roku 2014 [26], kdy CDED v kombinaci s PEN po dobu 6 týdnů vedla k indukci remise u 27 ze 40 (67,5 %) pacientů (21 dětských, 6 dospělých) a k částečné odpovědi u tří ze 40 probandů (1 dítě, 2 dospělí probandi) [26]. U těchto pacientů došlo mezi 0. a 6. týdnem terapie k statisticky významnému zlepšení Harvey-Bradshaw indexu, PCDAI, C-reaktivního proteinu (CRP) a sedimentace erytrocytů. Tento pozitivní efekt trval i ve 12. týdnu, kdy došlo k statisticky významnému zlepšení albuminu [26].
V roce 2017 byla publikována observační studie [27] ve které vedla CDED s PEN k opětovnému získání odpovědi na biologickou terapii u 13 z 21 (62 %) pacientů (6 dětských, 7 dospělých) po přechodné ztrátě odpovědi na ni.
Za nejvýznamnější se považuje randomizovaná kontrolovaná studie publikovaná v roce 2019, ve které se porovnávala účinnost EEN s účinností CDED s PEN [7]. Studie trvala 12 týdnů. Prvních 6 týdnů tvořila PEN v rameni CDED 50 % energetického příjmu a v rameni EEN 100 % příjmu. V dalších 6 týdnech tvořila PEN v obou ramenech 25 % energetického příjmu, v rameni EEN pocházela zbylá energie z volné diety. Počet probandů byl v obou ramenech studie porovnatelný (40 a 38). Nábor probandů probíhal v Izraeli (od září 2013) a následně i v Kanadě (od prosince 2016). Z ramene EEN odstoupili v průběhu prvních 48 hod studie čtyři probandi. Všichni probandi ve studii měli diagnostikovánu lehkou až středně těžkou luminální formu CD.
Primárním cílem studie bylo zhodnocení tolerance nutriční intervence na konci 6. týdne. Efekt EEN byl již v minulosti opakovaně prokázán, z tohoto důvodu by bylo porovnávání efektivity CDED proti placebu bezpředmětné a neetické. Problematická je však tolerance EEN, kdy je zapotřebí zavedení sondové výživy u 50–60 % pacientů. Zavádění sondy je často odmítáno jak ze strany rodičů, tak i lékařů. V designu studie byl příjem EEN zásadně ústy.
Sekundární cíle studie zahrnovaly odpověď na terapii definovanou jako pokles PCDAI o 12,5 bodů nebo dosažení remise. Remise v 6. týdnu byla definována jako PCDAI < 10 bodů nebo < 7,5 bodů při vynechání hodnocení výšky. Dalšími sekundárními cíli bylo hodnocení poklesu a/nebo normalizace zánětlivých ukazatelů v 6. týdnu, remise a normalizace CRP ve 12. týdnu a stupeň adherence.
Na konci 6. týdne studie byla remise srovnatelná v obou ramenech, ale primární cíl studie, tj. tolerance diety, byla statisticky významně lepší v rameni CDED s PEN (CDED s PEN 39/40, tj. 97,5 %, EEN 28/38, tj. 73,7 %; p = 0,002). Sekundárních cílů studie bylo dosaženo postupně mezi 6. a 12. týdnem. Na konci 12. týdne byla dosažená a udržená remise statisticky významně lepší v prospěch ramene s CDED s PEN (CDED s PEN 28/37, tj. 75,6 %, EEN 14/31, tj. 45,1 %; p = 0,001). Ke statisticky významnému poklesu fekálního kalprotektinu (FC – fecal calprotectin) došlo v 6. týdnu v obou ramenech (medián CDED s PEN poklesl z 3 126 μg/g na 1 744 μg/g; p = 0,002 a medián EEN z 2 647 μg/g na 1 021 μg/g; p = 0,011) a nebyl prokázán statisticky významný rozdíl v mediánu delty mezi oběma skupinami (CDED s PEN 1 473 μg/g a EEN 948 μg/g; p = 0,83). Po uvolnění diety po 6 týdnech EEN došlo k vzestupu FC, zatímco pokles v rameni CDED s PEN byl přítomen i ve 12. týdnu. CDED s PEN vedla na konci 12. týdne studie k návratu kvalitativního a kvantitativního složení střevní mikrobioty blíže ke stavu, který je asociován s remisí onemocnění, zatímco v rameni EEN byl ve 12. týdnu patrný sklon mikrobioty k návratu do výchozího stavu před zahájením terapie. Testováním střevní permeability bylo prokázáno, že v rameni CDED s PEN došlo k jejímu poklesu mezi 0. a 3. týdnem studie, zatímco v rameni EEN zůstala za stejné období stejná.
Tato studie [7] je první randomizovaná, kontrolovaná studie na světě, která prokázala, že CDED s PEN je lépe tolerována než EEN. Zatímco v 6. týdnu byl efekt obou nutričních intervencí porovnatelný, ve 12. týdnu byl staticky významně lepší efekt CDED s PEN.
Limitace studie zahrnovaly hodnocení FC ve dvou různých laboratořích s možnou chybou v průběhu analytického procesu a absence hodnocení slizničního hojení, jednoho z cílů při terapii CD [6]. Studie nezahrnovala hodnocení fáze 3, ke které nejsou v současné době dostupné výsledky hodnotící její efekt a dopad na pacienta.
Závěr
Prezentovaná data představují velice slibný koncept CDED s PEN v indukci a udržení remise lehké až středně těžké luminální formy CD. Dle dostupných dat by mohla CDED s PEN mít potenciál nahradit EEN jako metodu volby v indukci remise lehké až středně těžké luminální formy CD. Vzhledem k větší rozmanitosti a lepším chuťovým vlastnostem CDED s PEN by adherence pacientů s touto nutriční intervencí měla být lepší než v případě EEN. Proběhlé studie [7,26,27] využily Modulen jako jediný zdroj PEN a zatím nejsou k dispozici data, která by porovnávala účinnost CDED při použití Modulenu s jiným zdrojem PEN. Takové porovnávací studie by jistě přinesly velice zajímavé poznatky a mohly by vést k dalšímu rozšíření využití CDED s PEN v klinické praxi.
Doručeno/Submitted: 25. 3. 2020
Přijato/Accepted: 12. 4. 2020
MUDr. Nabil El-Lababidi
Centrum dětské gastroenterologie, hepatologie a výživy
Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze
Ke Karlovu 2
120 00 Praha 2
Sources
1. Feuerstein JD, Cheifetz AS. Crohn disease: epidemiology, diagnosis, and management. Mayo Clinic Proc 2017; 92 (7): 1088–1103. doi: 10.1016/j.mayocp.2017.04.010.
2. Ruemmele FM, Veres G, Kolho KL et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J Crohns Colitis 2014; 8 : 1179–1207. doi: 10.1016/j.crohns.2014.04.005.
3. Sartor R. Mechanisms of Disease: pathogenesis of Crohn’s disease and ulcerative colitis. Nat Rev Gastroenterol Hepatol 2006; 3 : 390–407.
4. Sommer F, Rühlemann MC, Bang C et al. Microbiomarkers in inflammatory bowel disease. Gut 2017; 67 (9): 734–1738. doi: 10.1136/gutjnl-2016-313678.
5. Yu Y, Chen KC, Chen J. Exclusive enteral nutrition versus corticosteroids for treatment of pediatric Crohn’s disease: a meta-analysis. World J Pediatr 2019; 15 (1): 26–36. doi: 10.1007/s12519-018-0204-0.
6. Miller T, Suskind DL. Exclusive enteral nutrition in pediatric inflammatory bowel disease. Curr Opin Pediatr 2018; 30 (5): 671–676. doi: 10.1097/MOP.0000000000000660.
7. Levine A, Wine E, Assa A et al. Crohn’s disease exclusion diet plus partial enteral nutrition induces sustained remission in a randomized controlled trial. Gastroenterology 2019; 157 (2): 440–450. doi: 10.1053/j.gastro.2019.04.021.
8. Wall CL, Gearry RB, Day AS. Treatment of active Crohn’s disease with exclusive and partial enteral nutrition: A pilot study in adults. Inflamm Intest Dis 2018; 2 (4): 219–227. doi: 10.1159/000489630.
9. Wall CL, Gearry RB, Day AS. New Zealand gastroenterologists’ perceptions, knowledge and experience of exclusive enteral nutrition to treat Crohn’s disease. N Z Med J 2017; 2130 (1464): 77–79.
10. Svolos V, Gerasimidis K, Buchanan E et al. Dietary treatment of Crohn’s disease: perception of families with children treated by exclusive enteral nutrition, a questionnaire survey. BMC Gastroenterol 2017; 217 : 14. doi: 10.1186/s12876-016-0564-7.
11. Shaikhkhalil AK, Boyle B, Smith J et al. Using quality improvement to increase utilization of enteral therapy in pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2018; 66 (6): 909–914. doi: 10.1097/MPG.0000000000001879.
12. Lowley M, Wu JW, Navas-López M et al. Global variation in use of enteral nutrition for pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2018; 67 (2): p e22.e29. doi: 10.1097/MPG.00000 00000001946.
13. Miele E, Shamir R, Aloi M et al. Nutrition in paediatric inflammatory bowel disease: a position paper on behalf of the Porto IBD Group of the ESPGHAN. J Pediatr Gastroenterol Nutr 2018; 66 (4): 687–708. doi: 10.1097/MPG.000000 0000001896.
14. Lee D, Albenberg L, Compher C et al. Diet in the pathogenesis and treatment of inflammatory bowel diseases. Gastroenterology 2015; 148 (6): 1087–106. doi: 10.1053/j.gastro.2015.01.007.
15. Agus A, Denizot J, Thévenot J et al. Western diet induces a shift in microbiota composition enhancing susceptibility to Adherent-Invasive E. coli infection and intestinal inflammation. Sci Rep 2016; 6 : 9032. doi: 10.1038/srep19032.
16. Martinez-Medina M, Denizot J, Dreux N et al. Western diet induces dysbiosis with increased E coli in CEABAC10 mice, alters host barrier function favouring AIEC colonisation. Gut 2014; 63 (1): 116–124. doi: 10.1136/gutjnl-2012-304119.
17. Ananthakrishnan AN, Khalil IH, Konijeti GG et al. A prospective study of long-term intake of dietary fiber and risk of Crohn’s disease and ulcerative colitis. Gastroenterology 2013; 145 (5): 970–977. doi: 10.1053/j.gastro.2013.07.050.
18. Desai MS, Seekatz AM, Koropatkin NM et al.A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell 2016; 167 (5): 1339–1353. doi: 10.1016/j.cell.2016.10.043.
19. Tomas J, Mulet C, Saffarian A et al. High-fat diet modifies PPAR - g pathway leading to disruption of microbial and physiological ecosystem in murine small intestine. Proc Natl Acad Sci USA 2016; 113 (40): E5934–E5943.
20. Wagner SJ, Schmidt A, Effenberger MJ et al. Semisynthetic diet ameliorates Crohn’s disease-like ileitis in TNFDARE/WT mice through antigen-independent mechanisms of gluten. Inflamm Bowel Dis 2013; 19 (6): 1285–1294.
21. Chassaing B, Koren O, Goodrich JK et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 2015; 519 (7541): 92–96. doi: 10.1038/nature14232.
22. Chassaing B, Van de Wiele T, De Bodt J et al.Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. Gut 2017; 66 (8): 1414–1427. doi: 10.1136/gutjnl-2016-313099.
23. Nickerson KP, Chanin R, McDonald C. Dysregulation of intestinal anti-microbial defense by the dietary additive, maltodextrin. Gut Microbes 2015; 6 (1): 78–83. doi: 10.1371/journal.pone.0101789.
24. Nickerson KP, Homer CR, Kessler SP et al. The dietary polysaccharide maltodextrin promotes Salmonella survival and mucosal colonization in mice. PLoS One 2014; 9 (7): e101789. doi: 10.1371/journal.pone.0101789.
25. Fahoum L, Moscovici A, David S et al. Digestive fate of dietary carrageenan: Evidence of interference with digestive proteolysis and disruption of gut epithelial function. Mol Nutr Food Res 2017; 161 (3). doi: 10.1002/mnfr.201600545.
26. Sigall-Boneh R, Pfeffer-Gik T, Segal I et al. Partial enteral nutrition with a Crohn’s disease exclusion diet is effective for induction of remission in children and young adults with Crohn’s disease. Inflamm Bowel Dis 2014; 20 : 1353–1360. doi: 10.1016/S1873-9946 (14) 50088-8.
27. Sigall-Boneh R, Sarbagili Shabat CS, Yanai H et al. Dietary therapy with the Crohn’s disease exclusion diet is a successful strategy for induction of remission in children and adults failing biological therapy. J Crohns Colitis 2017; 11 (10): 1205–1212. doi: 10.1093/ecco-jcc/jjx071.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 3-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Vliv pandemie COVID-19 na endoskopickou praxi v České republice – dotazníková studie
- Syndrom odpojeného pankreatického vývodu – opomíjená komplikace akutní pankreatitidy
- Motorizovaná spirální enteroskopie – naše první zkušenosti
- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- Projekt „Endoskopická centra“v České republice
- Aktuální vědecké podklady pro dietu pro Crohnovu chorobu založenou na vyloučení konkrétních potravin (CDED)
- Budesonid MMX v léčbě ulcerózní kolitidy
- Neobvyklý případ dysfagie horního typu
- Renální onemocnění pacientů s idiopatickými střevními záněty
- Na památku doc. Jana Kotrlíka
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz: Ischemická kolitida na podkladě trombózy dolní mezenterické žíly
- Perioperační ezofagogastroduodenoskopie v prevenci a terapii anastomotických komplikací – přehledový článek
- Herpetická ezofagitida u imunokompetentního sedmiletého pacienta
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Neobvyklý případ dysfagie horního typu
- Motorizovaná spirální enteroskopie – naše první zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

