-
Medical journals
- Career
Nutriční diety u gastroenterologických nemocných vyššího věku s chronickým onemocněním ledvin
Authors: V. Teplan 1 4; Marečková O. 5
Authors‘ workplace: Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE I. V. F. a. s., Praha 1; 1. LF UK, Praha 2; Subkatedra nefrologie, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 3; Katedra interních oborů a Interní klinika FN LF OU, Ostrava 4; Klinika nefrologie, Transplantcentrum, IKEM, Praha 5
Published in: Gastroent Hepatol 2019; 73(5): 423-437
Category:
doi: https://doi.org/10.14735/amgh2019423Overview
V posledních desetiletích se významně zvýšil počet nemocných ve vyšších a vysokých věkových kategoriích se závažným onemocněním ledvin, kteří mají také další onemocnění vč. postižení gastrointestinálního traktu (GIT). Přes rozvoj dialyzačních technologií a transplantačního programu přibývá nemocných, u kterých biologický věk s dalším orgánovým poškozením neumožňuje úspěšnou transplantaci ledviny, ale často ani dlouhodobou léčbu v dialyzačním programu. V posledním údobí se objevily studie o úspěšné dlouhodobé konzervativní léčbě s podáváním nutričních diet doplněných suplementy u nemocných nad 80 let. Tento léčebný postup však může být modifikován současným postižením GIT, a to vč. idiopatických střevních zánětů. V našich předchozích studiích u více než 3 000 nemocných bylo prokázáno, že starší nemocní mohou velmi dobře tolerovat modifikovanou nízkobílkovinnou dietu doplněnou suplementy. Při současném postižení GIT je však třeba v závislosti na dynamice onemocnění volit individuální postup, abychom předešli riziku skryté malnutrice.
Klíčová slova:
vyšší věk – onemocnění GIT – modifikovaná restriktivní dieta
Úvod
Celosvětově se prodlužuje věk populace. V letech 2010–2050 je předpoklad, že lidé ve věku 65 let a starší budou tvořit 7,7–16,2 % světové populace a v tzv. rozvinutých zemích to bude dokonce 15,9–26,1 %. Významný vzestup se očekává v především v populaci 80letých a starších, a to 1,6–4,4 % celosvětově, či dokonce 4,3–9,4 % v rozvinutých zemích. Tato generace bude heterogenní, řada seniorů bude trpět dalšími onemocněními ovlivňujícími metabolický stav organizmu, a tudíž vyžadujícími speciální nutriční péči. Může se jednat o doporučení k upravené dietě jako např. u nemocných s renální insuficiencí, gastrointestinálním onemocněním, diabetem či obezitou. Je přitom známo, že ve vyšším věku obecně klesá využitelnost živin z důvodů digesčních i metabolických. Není tedy obecně pravdou, že staří lidé mají jíst celkově méně. Jsou totiž náchylní k rozvoji „tiché“ malnutrice spojené s akcentací sarkopenie a psychické deteriorace. Zvláště výrazně se tyto malnutričně-dehydratační syndromy projeví při interkurentním onemocněním (s průjmem a zvracením), které pak vede k závažnému rozvratu minerálového a vodního metabolizmu spojeného se syndromem dehydratace s psychickou alterací. Dehydratace vede dále k anorexii a apatii s navazujícími terminálními komplikacemi ve smyslu oběhového selhání. Složení stravy seniorů musí být nutričně vyvážené, neboť senioři hůře metabolizují proteiny i tuky. Sacharidy jsou sice nejlépe metabolizované, ale pro často přítomnou hypofunkci pankreatu a diabetes mají svoje množstevní limity [1].
Pokud mají senioři vyšší body mass index, lze vždy předpokládat vyšší zastoupení viscerálního tuku. Obecně ve věku nad 75 let ubývá svalové hmoty a při zachování vyššího příjmu energie dojde ke zvětšení objemu tukové hmoty. Ta sice představuje energetické depo pro případ nouze, ale využitelnost těchto energetických zásob v akutních stavech také klesá. Více ohrožuje svého nositele aktivací adipocytokinů s proaterogenním účinkem, ale především akcentací inzulinové rezistence. Selektivní úbytek tukové hmoty je proto žádoucí, ale určitě nelze doporučit přísné redukční diety navozující katabolizmus. Úbytek musí být pozvolný a spojený s aktivací svalové hmoty pravidelným cvičením [2].
V poslední době také významně roste počet nemocných v preterminální fázi chronické renální insuficience, u kterých se stále více diskutuje, zda zahájit pravidelnou dialyzační léčbu, či ponechat nemocné na konzervativní léčbě při úrovni reziduální glomerulární filtrace kolem 10 ml/min (0,17 ml/s), což je u seniorů vysokých věkových skupin souměřitelné s až 2násobnou hodnotou u mladých jedinců [3]. Z hlediska mechanizmu účinku nízkobílkovinných diet je však otázkou, zda může úbytek proteinů v dietě ještě pozitivně ovlivnit hemodynamiku glomerulu – tedy zvýšený intraglomerulární tlak (při nefrosklerotickém poškození velkého množství glomerulů). Určitě však nelze doporučit nižší příjem proteinů než 0,6 g kvalitního proteinu/kg tělesné hmotnost (TH) /den, a to ještě za podmínky doplnění např. ketoanalogy esenciálních aminokyselin. Jinak příjem nesmí klesnout pod 0,8 g/kg TH/den. Uvedená doporučení však vycházejí z tzv. ideální TH, které byla stanovena pro mladší jedince. Jaká je optimální hmotnost člověka ve věku např. 80 let není známo (navíc se zcela mění výško-váhové poměry nezbytné pro výpočet). Výpočty glomerulární filtrace dle MDRD či CKD-EPI jsou u seniorů zatíženy značnou chybou danou i nestejným obsahem svalové hmoty u stejně kalendářně starých (ale biologicky odlišných) jedinců [4].
Vzájemné ovlivnění nemocí ledvin a gastrointestinálního traktu u seniorů
Gastrointestinální trakt (GIT) a ledviny jsou metabolicky vysoce aktivní orgány, které ve vzájemné souhře zajišťují řadu vitálních funkcí. Poškození jednoho se může projevit i onemocněním druhého orgánu. Současné postižení ledvin a GIT lze rozdělit do 4 skupin:
- onemocnění GIT a ledvin spolu nesouvisejí;
- základní choroba postihuje současně ledviny i GIT (např. diabetická nefropatie a gastroparéza či enteropatie);
- onemocnění GIT je spojeno s častým výskytem renálních komplikací (Crohnova choroba (CD – Crohn’s disease));
- onemocnění ledvin je spojeno s výskytem GIT komplikací [5].
Jednou z možností současného postižení ledvin a trávicího ústrojí je situace, kdy základní choroba poškozuje oba orgány. Patří sem diabetes mellitus (DM), kde jsou ledviny v různém stupni poškozeny diabetickou nefropatií a gastrointestinální obtíže mohou být způsobeny současným postižením GIT gastroparézou nebo enteropatií. Podobně postihují současně ledviny i GIT systémová onemocnění a některá vrozená onemocnění, především polycystická choroba s cystami v ledvinách, játrech, pankreatu a zvýšeným výskytem divertiklů GIT [6].
Další možností současného postižení ledvin a trávicího ústrojí je situace, kdy je základní gastroenterologické onemocnění provázeno často renálními komplikacemi. Příkladem jsou nespecifické střevní záněty, CD a ulcerózní proktokolitida. Zejména u CD se setkáváme s celým spektrem možných renálních komplikací: enterovezikální píštěle, obstrukce močových cest při zánětlivých změnách ústí ureterů do močového měchýře, močové kameny, následné recidivující infekce močových cest, pyelonefritida, intersticiální nefritida, glomerulonefritida (imunoglobulin (Ig) A nefropatie), renální amyloidóza.
Při vzniku GIT komplikací u nemocných s chronickým onemocněním ledvin hraje podstatnou roli stupeň snížení renální funkce a způsob léčby. Liší se podle toho, zda je nemocný léčen konzervativně, hemodialýzou nebo peritoneální dialýzou. Při konzervativní léčbě se gastroenterologické komplikace objevují především v pokročilých stadiích chronického selhání ledvin (CHSL) [7].
Gastrointestinální komplikace vznikající při chronickém onemocnění ledvin jsou značně ovlivněny sníženou imunitou a poruchami hemokoagulace s rizikem krvácení do GIT. Na snížené imunitě se podílí i porušená slizniční střevní epiteliální bariéra. Významnou roli hraje při stoupajícím věkovém průměru nemocných na dialýze i vliv toxicky působících látek, které nelze současnými dialyzačními metodami zcela odstranit (2-mikroglobulin hromadící se při dialyzační amyloidóze) [8].
Přestože je pokles výskytu vředové choroby gastroduodena, riziko krvácení z gastroduodenálních lézí zůstává u renálního selhání vysoké. Změny na sliznici gastroduodena jsou až u 80 % nemocných, kteří nemají anamnézu vředové choroby. Mezi nejčastější patří chronická gastritida, erozivní gastritida a duodenitida. Na jejich vzniku se podílí infekce Helicobacter pylori a používání nesteroidních antirevmatik. Hlavní komplikací je krvácení. Chronické drobné ztráty se projeví anémií rezistentní na erytropoetin.
Nejčastější gastroenterologické komplikace u seniorů s onemocněním ledvin
Postižení střev
Mezi nejčastější akutní i chronické stavy související s porušenou strukturální i funkční integritou intestinální epiteliální bariéry patří CHSL [9]. Intestinální mikroflóra není v posledním desetiletí chápána jen jako potenciální hrozba, ale spíše jako nezbytná součást střevní bariéry. Střevní mikroflóra má funkci ochrannou (vytěsnění patogenů, tvorba antimikrobiálních látek), strukturní (posílení těsných spojení, indukce tvorby IgA) a metabolickou (syntéza vitaminů K, B12, niacin, biotin, kyseliny listová). Za normálních okolností není možný transcelulární průnik bakterií přes mechanickou ochranu hlenové vrstvy. Střevní sliznici tvoří lamina propria a vrstva polarizovaných epiteliálních buněk spojených apikálním junkčním komplexem. Apikální junkční komplex sestává z tzv. těsných spojení (TJ – tight junctions) na luminární straně bariéry, na které naléhají adherenční apikální junkce. TJ jsou svými proteiny (klaudin, occludin) zakotvena do intracelulární aktinomyozinové intracelulární sítě. Některé typy klaudinu představují receptory pro bakteriální enterotoxiny – např. klaudin 3 a 4 pro enterotoxiny Clostridium perfringens [10]. Při CHSL dochází k porušení dynamické rovnováhy intestinální epiteliální bariéry, epiteliální buňky produkují prozánětlivé cytokiny a reaktivní formy kyslíku, což vede k otevření paracelulárních TJ a k aktivaci subepiteliálních imunitních buněk [11].
Příčinou postižení střev vznikajícího při chronickém onemocnění ledvin je porušená imunita, která znamená zvýšené riziko zánětlivých a infekčních střevních komplikací a poruchy hemokoagulace, které při ledvinném selhání spolu s opakovanou heparinizací nutnou při hemodialýze znamenají zvýšené riziko krvácení do dolních partií GIT i při nevelké střevní lézi, ať už je to zánět, slizniční eroze či vředy.
Některá onemocnění střev jsou vázána na dobu závažné chronické renální insuficience. Jsou to onemocnění, které vídáme i v běžné populaci ve vyšším věku. Souvisí s ischemickým poškozením střevní sliznice při změnách cév zásobujících příslušnou oblast. Vzhledem k tomu, že se věk nemocných s chronickým onemocněním ledvin stále zvyšuje, a to u nás i celosvětově, je pravděpodobné, že se na zvýšeném výskytu ischemických střevních lézí podílí oba faktory – věk nemocného i ledvinné selhání.
U nemocných s CHSL je popisován zvýšený výskyt vředových lézí kolon a pseudomembranózní kolitidy. Včasné zahájení pravidelné a účinné dialyzační léčby sníží riziko vzniku těžké vředové či pseudomembranózní kolitidy. Kolitidy však patří stále k nejčastějšímu postižení tenkého a tlustého střeva u nemocných s CHSL. Těžké formy kolitidy jsou vzácné, převládají formy mírné a středně těžké. I při dobře vedené hemodialýze jsou patologicko-anatomické střevní léze popisovány u více než poloviny nemocných.
Ulcerace solitární či mnohočetné jsou často lokalizovány v ileocekální oblasti a na začátku colon ascendens, v okrajích ulcerací byly často nalézány cytomegalovirové (CMV) inkluze.
Ve stejné lokalizaci se vyskytují často angiodysplazie. Mohou být příčinou krvácení při hemodialýze zejména u starších nemocných [12].
Některá onemocnění tenkého a tlustého střeva jsou u nemocných s CHSL častější než u běžné populace. Je to především divertikulóza tračníku, která se vyskytuje především ve spojení s polycystickou chorobou ledvin. Závažnou komplikací je divertikulitida, jejíž diagnóza je někdy obtížná, zvláště u seniorů vyšších věkových kategorií.
Výskyt ischemického postižení střev má v posledních desetiletích stoupající tendenci. Toto zjištění není nijak překvapivé, vezmeme-li v úvahu stoupající věk nemocných. Věk a CHSL tak představují rizikové faktory pro akcelerovaný rozvoj aterosklerózy a kardiovaskulárních komplikací, zvláště pak u diabetiků. Ischemická kolitida je dávána do souvislosti i se změnami TK a možnými hypotenzemi při hemodialýze, zejména při preexistující ateroskleróze. Nejcitlivější místo pro poškození cévního zásobení je lienální flexura a sigmoideum.
Střevní lymfom má při CHSL vyšší výskyt než v běžné populaci a může být příčinou obstrukce tlustého střeva. Je též popisována lokalizace v terminálním ileu. Častý výskyt je i po transplantaci ledviny.
U nemocných se selháním ledvin a především u pacientů na dlouhodobé dialyzační léčbě může vzniknout specifická forma amyloidózy způsobená depozity beta-2-mikroglobulinu ve střevě.
Všechny uvedené léze mohou být příčinou perforace a krvácení. Obě komplikace jsou při CHSL sice vzácné, mají však vysokou úmrtnost. Diagnóza je často obtížná a opožděná.
Divertikulární choroba
Výskyt
V naší běžné populaci se vyskytují divertikly u 30 % obyvatelstva ve věku 40–60 let, u lidí nad 70 let je výskyt nad 60 %. Výskyt v posledních desetiletích stoupá v Evropě i u nás [13]. Vysoký výskyt je u nemocných s polycystickou chorobou ledvin, kde se v mladších věkových kategoriích pod 50 let pohybuje kolem 40 %, ve věku nad 50 let je udáván výskyt až 80 % [14,15].
Etiologie
Etiologie není přesně známa, za důležitý rizikový faktor vzniku divertiklů se považuje nedostatek vlákniny ve stravě. Tuto teorii podporuje i skutečnost, že vláknina se úspěšně používá v léčbě nemoci.
Patogeneze
Kromě vrozených pravých divertiklů (mají všechny vrstvy stěny střeva) jsou ostatní divertikly nepravé, tvořené jen vychlípenou sliznicí, která je kryta serózou střeva a slabou pojivovou tkání. Obsah divertiklů se obtížně vyprazdňuje. Vznikají fekolity, které dráždí sliznici k zánětu. Patogeneticky se jedná v podstatě o divertikly pulzní, které vznikají prolabováním sliznice porušenou střevní stěnou během kontrakce. Jedna z posledních teorií patogeneze nemoci hovoří o zvýšeném ukládání elastinu do taenií střevní stěny [16]. Je též prokázána tvorba příčných vazeb v bílkovinné molekule kolagenu [17]. Molekuly elastinu se ukládají v uzavřené kontrahované formě, a tím udržují střevo zkrácené (tvoří se harmoniková deformace). Význam změněného kolagenu a elastinu u divertikulární choroby tlustého střeva vede k hypotéze, že defekt pojivové tkáně uplatňující se při vzniku extrarenálních projevů u polycystické choroby ledvin je též predisponujícím faktorem pro vznik divertiků v tlustém střevě u nemocných s polycystickou chorobou ledvin [15].
Rozlišujeme dva typy divertikulární choroby tlustého střeva: dynamicko-progresivní a adynamicko-regresivní [13]. Rozlišení je žádoucí pro další terapeutický postup, u regresivního typu nemá chirurgická léčba dobré funkční výsledky.
Klinický obraz
Nekomplikovaná divertikulóza nepůsobí větší obtíže. Dotazem zjišťujeme zácpu a meteorizmus, tedy příznaky střevní dyspepsie dolního typu. Někdy se vyskytuje tzv. hypersegmentační syndrom s kolikovitými bolestmi v levém hypogastriu, kde hmatáme stažené bolestivé sigmoideum jako tuhou trubici, ale bez peritoneálních příznaků, bez leukocytózy, teploty či zvýšené sedimentace. Na prostém snímku nacházíme někdy subileózní stav, koloskopii při akutních obtížích neprovádíme. V klidovém stadiu provádíme i irigografii, ovšem divertikly nemusí být zastiženy.
Komplikace
Divertikulitida – zánět jedné či více výchlipek – vytváří prakticky vždy drobný absces, který se většinou spontánně vyprázdní do střeva [18]. Může se ovšem propagovat směrem k seróze, vyvolat perikolitidu až parakolický absces, který při provalení do břišní dutiny vyvolá sterkorální peritonitidu s vysokou mortalitou (30–70 %). Následně mohou vznikat perzistující píštěle či stenózy, obtížně odlišitelné od karcinomu.
U nemocných se selháním funkce ledvin je nejčastější výskyt divertikulitidy u nemocných s polycystickou chorobou ledvin (typ dospělých), a to u 20 % nemocných.
Pokud vznikne u těchto nemocných divertikulitida po transplantaci ledviny, má těžký průběh, v 50 % komplikovaný perforací střeva [19].
Krvácení z divertiklu je buď chronické s drobnými krevními ztrátami, vedoucí k chronické anemizaci, nebo náhlé, masivní, s rozvojem hemoragického šoku [20]. Jde zpravidla o enteroragii světlé tekuté krve s koaguly, někdy je krev smíšena se stolicí. Příčinou mohou být i teleangiektázie, zvláště v pravé polovině tračníku. Průkaz je možný pomocí angiografie, někdy pomůže koloskopie zkušeným endoskopistou. Empirickou zkušeností je, že takové masivní krvácení často ustane po provedení irigografie.
Diagnostika
Irigografie zobrazí nepravidelný reliéf střeva při spazmech (zuby pily), predivertikulární stadium až typické divertikly různé velikosti, tvaru a uložení, prokáže i střevní stenózu, únik kontrastní látky do abscesu či píštěle. Pokud máme podezření na komplikace, doporučuje se provést vyšetření pomocí vodné kontrastní látky místo barya. Kontrastní látku používáme i pro zobrazení píštěle fistulografií. Ultrasonografie a CT jako neinvazivní metody se uplatňují při diagnostice zánětlivých komplikací. Sonografie je metodou první volby při diagnostice perikolických abscesů, umožní cílenou punkci pod sonografickou kontrolou. Koloskopie se uplatňuje především při diagnostice krvácení (divertikly, angiektazie) a spolu s biopsií pomáhá v diferenciální diagnostice. Odliší divertikl kolon od karcinomu, CD, ulcerózní kolitidy (UC – ulcerative colitis) či polypů. Při krvácení se uplatní i selektivní angiografie.
Léčba
Nekomplikovanou divertikulózu je možno léčit konzervativně. Základem je dietní léčba s dostatkem tekutin, vyloučením nadýmavých potravin, zvýšeným obsahem vlákniny ve formě zeleniny a doplňkem nevstřebatelné vlákniny, nejlépe ve formě pšeničných otrub v dávce stoupající postupně na 30 g/den. Pravidelné užívání vlákniny se doporučuje preventivně i u asymptomatické divertikulózy a dále po operacích pro komplikace divertikulární nemoci. Při divertikulitidě je vhodná jen tekutá dieta, spazmolytika, dle potřeby antibiotika celkově nebo v nálevech [21], event. lokálně i Priessnitzovy obklady. Při perikolitidě nemocného hospitalizujeme, podáváme parenterální výživu a antibiotika. Parakolický absces punktujeme pod sonografickou nebo CT kontrolou. Při krvácení dostává nemocný parenterální výživu, hemostyptika a krevní deriváty.
Elektivní chirurgická intervence znamená resekci postiženého úseku střeva, nejčastěji parciální resekci sestupného tračníku nebo esovité kličky. Při urgentní operaci je taktéž nezbytná resekce, ale primární anastomóza není vždy vhodná, a proto operační výkon končívá dočasnou kolostomií a zpravidla slepým uzávěrem rekta (Hartmannova operace). Později je realizován operační výkon s rekonstrukcí a obnovením střevní pasáže.
U bolestí špatně ovlivnitelných konzervativní léčbou či při recidivujících zánětlivých komplikacích lze provést kolomyotomii, která vede ke snížení intraluminálního tlaku.
Prognóza
U nekomplikované divertikulární nemoci tlustého střeva je prognóza dobrá. U divertikulitid komplikovaných je operační výkon nutný asi ve 20–30 % případů, mortalita je 10 %. U imunosuprimovaných nemocných po transplantaci ledviny je prognóza ještě závažnější, mortalita po operačních výkonech je udávána mezi 12 a 20 % [19,22,23]. Při perforaci colon je mortalita u nemocných po transplantaci ledviny udávána dokonce mezi 25 a 64 % [24].
Je však třeba zvážit, zda by preventivní koloskopie před plánovanou transplantací ledviny neměla být ordinována u nemocných s polycystickou chorobou, u kterých je výskyt divertikulární nemoci tlustého střeva 20–50 %, a to i v mladém věku (35 let), komplikující divertikulitida se vyskytuje u 20 % nemocných, a pokud vznikne u nemocných po transplantaci ledviny, je u poloviny nemocných nutný operační výkon [19].
Cytomegalovirová kolitida
Etiologie
Infekce CMV patří mezi nejčastější a nejzávažnější virové infekce u imunosuprimovaných nemocných po transplantaci ledviny. Častá je u imunodeficitních nemocných vč. seniorů s chronickou renální insuficiencí. CMV patří do skupiny herpetických virů.
Výskyt
Výskyt IgG protilátek proti CMV se pohybuje v běžné evropské populaci kolem 30 % u osob mladého věku, u jedinců nad 50 let je mezi 50 a 60 %. V tomto rozmezí se pohybuje i u dárců a příjemců ledviny. Rozlišujeme primární a sekundární CMV infekci. Primární CMV infekce zanechává protilátky IgG. U zdravého nositele virus zůstává latentní a jeho genom perzistuje v buňkách nositele bez jakýchkoli klinických projevů. Primární CMV infekce proběhne u 70–80 % příjemců ledviny, kteří byli séronegativní a kterým byla transplantována ledvina séropozitivního dárce. U většiny pacientů se to projeví klinickými příznaky. U příjemců ledviny, kteří byli před transplantací séropozitivní, se může latentní CMV infekce reaktivovat – potom hovoříme o sekundární CMV infekci nebo o CMV nemoci. Klinický obraz se neliší od primární CMV infekce. Některé práce hovoří o tom, že je možná i reinfekce novým CMV kmenem (superinfekce). Není známo, zda je reinfekce klinicky závažnější než reaktivace endogenní infekce.
Klinický obraz
V popředí jsou teploty, bolesti břicha, vodnaté průjmy, někdy s enteroragií. U nemocných po transplantaci ledviny se akutní projevy manifestují v prvních 4 měsících po operaci. Gastrointestinální komplikace jsou zde součástí CMV nemoci, současně bývá pneumonie, hepatitida, někdy je poškozen CMV infekcí i štěp, kde nejčastěji vzniká glomerulopatie. Závažnou komplikací je perforace střeva [25].
Diagnostika
Endoskopické vyšetření prokáže eroze až vředy, fokální erytém, pseudomembrány převážně v ileocekální krajině a v pravé polovině tračníku. Při histologickém vyšetření nacházíme charakteristické intranukleární a cytoplazmatické inkluze. Průkaz CMV je sérologický, histologický a izolací viru.
Z klinického hlediska má největší význam stanovení časného CMV antigenu. Jeho vyšetření trvá 24 hod a jeho citlivost je až 80 %. Dále se v diagnostice využívá sérokonverze protilátek IgM u původně séronegativního příjemce nebo 4× zvýšení protilátek IgG. Protilátky IgM se objevují do 1 týdne po objevení klinických příznaků, protilátky IgG mnohem později.
Terapie
Základem léčby je ganciclovir (např. Cymevene), který zabraňuje replikaci herpetických virů. Je vylučován ledvinami, proto musí být dávkování přizpůsobeno funkci ledvin. Léčbu zahajujeme intravenózně (i.v.), po několika týdnech navazuje dostatečně dlouhá léčba perorální. Nověji je používán valganciclovir (Valcyte) podávaný perorálně.
U imunosuprimovaných nemocných po transplantaci ledviny redukujeme imunosupresi, přístup musí být individuální. Při leukopenii omezujeme především azathioprin (nebo mykofenolát mofetyl), tacrolimus a kortikoidy ponecháváme většinou nezměněné. Při CMV infekci probíhající současně s rejekcí štěpu je možno léčit obojí – podat antirejekční náraz metylprednisolonu a zároveň léčit CMV infekci ganciclovirem.
Profylaxe CMV infekce u nemocných po transplantaci ledviny je doporučována zejména u CMV-séronegativních příjemců ledviny od CMV-séropozitivních dárců. U těchto nemocných je nejúčinnější pasivní profylaxe CMV Ig. Neselektované Ig jsou neúčinné. Také profylaktické podávání gancicloviru po dobu 2–4 týdnů po transplantaci chrání účinně před vznikem primární CMV infekce.
Prognóza
Prognóza je nejistá. CMV infekce má imunosupresivní efekt, který vede k manifestaci oportunních infekcí. V trávicím ústrojí je to např. infekce Clostridium difficile, která vyvolává pseudomembranózní kolitidu, nebo závažná tuberkulózní kolitida. Předpokládá se též, že CMV infekce má i efekt onkogenní. V trávicím ústrojí jsou dávány do souvislosti s CMV infekcí především lymfoproliferativní procesy.
Amyloidóza střev
Systémová amyloidóza
Amyloidóza střev se vyskytuje při systémovém onemocnění, které postihuje současně ledviny i celé trávicí ústrojí, především střeva. Je to samostatná choroba, která má vlastní etiologii, klinický obraz, prognózu i léčbu. Je zde zmíněna jen stručně, pro potřeby diferenciální diagnostiky u seniorů. Podrobně viz text dr. Ryšavé [26].
Postižení GIT při systémové amyloidóze se projeví bolestmi břicha, anorexií, hubnutím, nauzeou, zvracením, průjmy či naopak zácpou. V krvi prokazujeme sérový amyloid A (SAA), Je to protein akutní fáze, jeho koncentrace v séru je zvýšená v akutní fázi až 1 000×, ale po zklidnění a odstranění zánětlivého stimulu klesá rychle k normě. U lidí je poločas SAA přibližně 1 den. Hlavním zdrojem cirkulujícího SAA jsou játra. V plazmě je transportován ve spojení s lipoproteiny s vysokou hustotou. Cirkulující SAA je prekurzorem pro tkáňová depozita AA. SAA je štěpen působením elastáz na povrchu monocytů i enzymů uvolněných z aktivovaných polymorfonukleárů a Kupfferových buněk.
Dialyzační amyloidóza
Jiným typem je dialyzační amyloidóza, vyskytující se jako závažná komplikace dlouhotrvající hemodialýzy s depozicí beta-2-mikroglobulinu. Současný výskyt AA amyloidu a beta-2-mikroglobulinu u hemodialyzovaných nemocných je vzácný. Depozita beta-2-mikroglobulin-amyloidu jsou v trávicím ústrojí lokalizována v muscularis propria nebo ve stěně malých arterií. Proto je třeba provést při endoskopickém vyšetření hlubokou biop-sii. I tak je průkaz beta-2-mikroglobulin-amyloidu 4× častější při resekci části střeva než při biopsii, která nezachytí stěnu cév v submukóze a seróze [27].
Amyloidóza trávicího ústrojí se vyskytuje většinou po delším trvání pravidelné hemodialýzy – 12 let a více, jsou však popsány i případy vzniku za 6–8 let. Depozita amyloidu jsou lokalizována jednak ve svalové vrstvě (v muscularis mucosae) žaludku a střev, jednak ve stěně cév. Nejčastější manifestací onemocnění bylo krvácení do trávicího ústrojí a příznaky pseudoobstrukce [28]. Amyloidóza je diagnostikována buď biopsií sliznice, nebo nekropsií. Většina nemocných s dialyzační amyloidózou trávicího ústrojí (93 %) má současně postižené klouby, cysty v kostech nebo má projevy syndromu karpálního tunelu. U zbývajících 7 % není postižení kostí a kloubů prokazatelné, nemocní však mají amyloid ve stěně cév, což je predilekční místo pro systémovou amyloidózu.
Mechanizmus vzniku depozit amyloidu zůstává nejasný. Nemocní nemají – na rozdíl od pacientů s CD nebo UC – žádný specifický predisponující faktor pro gastrointestinální postižení.
Klinické projevy GIT amyloidózy: na počátku onemocnění mohou být zcela nenápadné, jindy se projevují bolestí, průjmy, poruchou resorpce, hubnutím. Nejzávažnější případy jsou provázeny krvácením do trávicího ústrojí, pseudoobstrukcí a vzácně se manifestují pod obrazem ischemické kolitidy. Krvácení se vyskytuje u 25 % nemocných. Bývá prudké, život ohrožující, vyžadující chirurgický výkon co nejdříve po zvládnutí hemoragického šoku.
Pseudomembranózní kolitida
Jedná se o závažnou bakteriální kolitidu, která má zvýšený výskyt u nemocných s CHSL.
Riziko zvyšuje věk. Významnou roli hraje v CHSL i poškozená střevní epiteliální bariéra.
U hemodialyzovaných nemocných je pseudomembranózní kolitida nejčastěji při jiné infekci léčené širokospektrými antibiotiky. Nejtěžší průběh má pseudomembranózní kolitida u imunosuprimovaných nemocných po transplantaci ledviny. Důležitá je prevence a intenzivní léčba [29].
Etiologie
Etiologické agens je C. difficile, tlusté střevo kolonizuje orálně-fekální cestou, rozhodujícím faktorem pro vznik onemocnění je antibiotická léčba alterující střevní mikroflóru. C. difficile uvolňuje toxin, který působí slizniční poškození a zánět.
Klinický obraz
Klinické příznaky se liší podle stupně poškození tlustého střeva. Prosté nosičství může být bez klinických příznaků. Těžká kolitida bez tvorby pseudomembrán se projevuje profuzními průjmy s příměsí krve, bolestmi břicha, teplotami, nauzeou, anorexií, dehydratací a leukocytózou (i nad 35 tis). Při pseudomembranózní kolitidě jsou všechny příznaky vystupňovány, při endoskopickém vyšetření nacházíme hyperemickou sliznici s adherujícími žlutými povlaky. Pseudomembranózní kolitida vede až k rozvoji toxického megacolon s perforací a následnou peritonitidou.
Diagnóza
Diagnóza je stanovena průkazem toxinu C. difficile ve stolici a koloskopií s histologickým vyšetřením.
Terapie
Základním opatřením je zvláště u seniorů hydratace, úprava vnitřního prostředí, zvážit vysazení léčby inhibitory protonové pumpy, přerušení dosavadní antibiotické léčby, podání metronidazolu (250 mg 4× denně) nebo vankomycinu (l g i.v.) a dále úprava dávky dle hladin a renální funkce. Při neúspěchu u těžkých forem je indikován fidaxomycin (Dificlir). Významnou složkou léčby jsou probiotika (Enterol, Mutaflor).
Ischemická kolitida
Etiologie
Hlavní roli hraje selhání krevního zásobení tlustého střeva způsobené poruchou tepenného přítoku, žilního odtoku nebo nedostatečnou cévní perfuzí.
Lokalizace
Nejčastější lokalizací je oblast slezinného ohbí tračníku, kde se spojují cévní pleteně z oblasti horní a dolní mezenterické arterie (Riolanovy arkády). Tato oblast je velmi citlivá na hypoperfuzi, protože zde není kolaterální řečiště, které by nahradilo snížený průtok. Druhou, relativně častou lokalizací je horní třetina rekta, kde se stýká řečiště dolní mezenterické arterie a systémové arteriální řečiště. Méně často je postižena ascendentní část tlustého střeva [12]. U nemocných s CHSL jsou popisovány těžké formy ischemické kolitidy lokalizované na pravé části tlustého střeva. V patogenezi ischemické kolitidy u hemodialyzovaných nemocných se uvažuje o opakovaných protrahovaných hypotenzích, které vyvolají vazokonstrikci vasa recta pravého tračníku. U většiny těchto nemocných se neprokáže cévní uzávěr.
Průběh
Ischemická kolitida může mít akutní nebo chronický průběh.
Akutní ischemická kolitida
Rozlišujeme lehkou a těžkou formu ischemické kolitidy:
- Lehká forma – tranzitorní ischemická kolitida je nejčastější formou ischemické kolitidy. Ischemie zde postihuje sliznici a podslizniční úsek, kde vznikají hemoragická ložiska, edém a povrchní vředové léze. Klinický obraz je zprvu nenápadný, postupně vzniká průjem s příměsí krve a hlenu. Bolesti jsou lokalizovány v levém podbřišku. Přínosem pro diagnózu je dvoukontrastní irigografie, která prokáže segmentární postižení a destrukci slizničního reliéfu tlustého střeva ve slezinném ohbí a sestupné části tlustého střeva. Endoskopické vyšetření prokáže křehkou, hyperemickou sliznici s povrchními ulceracemi, na rozdíl od UC je postižení vysloveně fokálního charakteru. Histologický nález není charakteristický a sám o sobě nestačí k diagnóze. V laboratorním nálezu není odezva v zánětlivých parametrech.
Léčba je konzervativní, zaměřená na úpravu vnitřního prostředí a odstranění vyvolávající příčiny (embolie, trombóza, hypotenze). Lokální nález na střevě lze ovlivnit lokálním či celkovým podáváním mesalazinu nebo kortikoidů. Léčba bolestí břicha a průjmů je symptomatická. Prognóza je příznivá. Diferenciálně diagnosticky je potřeba odlišit UC a infekčně podmíněné kolitidy.
- Těžká, fulminantní forma – samostatné postižení tlustého střeva touto formou je vzácné, častěji bývá součástí nekrózy celého tenkého a tlustého střeva při akutním uzávěru horní a dolní mezenterické arterie. Naproti tomu u hemodialyzovaných nemocných je těžká forma ischemické kolitidy lokalizována v 70–80 % na pravé straně tlustého střeva. Klinicky probíhá těžká forma pod obrazem akutního břicha a rozvíjejícího se šoku. Naději na přežití dává jen urgentní chirurgický výkon, mortalita je 50–90 %.
Chronická ischemická kolitida
Vyvolána je středně těžkou dlouhodobou ischemií, na rozdíl od akutní ischemické kolitidy postihuje vedle sliznice a submukózy také svalovou vrstvu. Klinický obraz, diagnostika a léčba jsou podobné jako u akutní ischemické kolitidy, navíc se vyskytují stenózy postiženého úseku, které vyžadují chirurgické řešení. Průběh je vleklý, neohrožuje nemocného na životě.
Angiodysplazie
Angiodysplazie jsou nejčastější cévní abnormalitou GIT u nemocných s CHSL, jejich výskyt dále vzrůstá s věkem. U nemocných s CHSL starších 65 let jsou angiodysplazie druhou nejčastější příčinou opakovaného krvácení různé intenzity do dolních partií GIT. Riziko krvácení z angiodysplazií vzrůstá u hemodialyzovaných nemocných.
Výskyt
Vaskulární angiodysplazie bez známek krvácení se nacházejí náhodně v běžné populaci asi u 25 % osob starších 60 let [5]. Jsou lokalizovány nejčastěji v céku ve vzestupném tračníku, méně často se nacházejí v tenkém střevě.
Patogeneze
Angiodysplazie představuje degenerativní cévní lézi. Předpokládá se, že jde o obstrukci submukózních žil během kontrakce a distenze céka, a to v místě, kde prostupují svalovinou. Následkem opakovaných epizod se žíly dilatují a deformují a zhoršená funkce prekapilárního sfinkteru vede k vytvoření arteriovenózní píštěle. Přednostní výskyt v pravé polovině tračníku se vysvětluje vyšším intraluminálním tlakem v této oblasti.
Diagnóza
Možnou diagnostickou metodou je mezenteriální angiografie, kde můžeme během krvácení identifikovat místo a podstatu lézí. Charakteristickým radiologickým nálezem je především časné plnění žíly a rozšířené, vinuté cévní ložiskové rozšíření. Angiografii lze použít též k terapeutickému zákroku, ale k tomuto účelu je již používána vzácně. Častěji k němu slouží koloskopie, a to jednak během krvácení, pokud je léze identifikovatelná, nebo po zástavě krvácení.
Léčba
Koloskopie nalézá dilatované a vinuté drobné cévy s abnormálními kličkami malých arterií.
Pro léčbu se při koloskopii používá laserová koagulace nebo injekční aplikace sklerotizačního roztoku. Jinou terapeutickou možností je intraarteriální aplikace vasopresinu a jeho analog, z nichž je u nás dostupný terlipresin (Remestyp). Zda se mají preventivně ošetřit náhodně nalezené angiodysplazie, je dosud předmětem diskuze. V některých případech je však k zastavení masivního či protrahovaného krvácení nutná chirurgická resekce postiženého úseku.
Specifické změny vodního a elektrolytového hospodářství u seniorů
Změny funkce ledvin ve stáří
V průběhu stárnutí, přesněji řečeno s přibývajícím věkem, dochází ke změnám v renálních funkcích. Tyto změny se všeobecně přisuzují důsledkům arteriosklerotických změn renálního cévního řečiště. Znalost změn renálních funkcí je důležitá pro interpretaci změn vnitřního prostředí u starších jedinců, a tím i pro adekvátní terapii těchto poruch [4].
Jak je dobře známo, udržování homeostázy vnitřního prostředí je v podstatě umožňováno tím, že díky četným regulačním mechanizmům a orgánovým funkcím jsou udržovány vztahy mezi:
- příjmem vody a elektrolytů (potravou) a jejich průnikem z trávicího ústrojí do mimobuněčné tekutiny;
- jejich vylučováním z organizmu, zvláště ledvinami;
- distribucí vody a elektrolytů do prostoru nitrobuněčného a mimobuněčného, což významně závisí na celkovém metabolickém stavu organizmu.
Změny renálních funkcí mohou narušovat vylučování vody a elektrolytů. Charakteristickým příkladem je snížená schopnost konzervovat vodu následkem poklesu maximální koncentrační schopnosti ledvin. Stejně významné je i snížení schopnosti vyloučit nadbytek vody s následným nebezpečím její retence a vzniku intoxikace vodou vzhledem ke snížení glomerulární filtrace a zřeďovací schopnosti ledvin k postupnému poklesu glomerulární filtrace (GF), což se zjišťuje při měření této funkce na podkladě clearance inulinu (Cin) stejně jako clearance endogenního kreatininu (CKr). Asi od 40 let věku nastává pozvolný pokles GF, která u jedinců ve věku 80–90 let dosahuje přibližně poloviční hodnoty proti jedincům mezi 20 a 30 lety. Tento pokles GF je zřejmě důsledkem poklesu průtoku plazmy a krve ledvinou.
Sníženou resorpcí osmoticky aktivních látek si lze vysvětlit, že starší jedinci nejsou schopni za podmínek zřeďovací zkoušky vytvořit moč o tak nízké osmolaritě jako jedinci mladší. Vedle neschopnosti ledvin starších jedinců vytvářet dostatečně hypotonickou moč je nutno přihlédnout k další důležité skutečnosti, že totiž nejsou schopni dostatečně rychle vyloučit podanou vodní nálož [30].
Vodní hospodářství
Obsah vody v organizmu závisí na věku člověka, pohlaví a TH. U osob s normální hmotností je relativně stálý. Do věku kolem 50 let činí u muže 60 % TH (tj. 600 ml/kg), u ženy 50 % TH. Po 50. roce věku obsah vody postupně klesá, u muže až na 52 %, u ženy na 46 %. Množství vody v aktivních tkáních (lean body mass) je u muže i ženy stejné. Úbytek celkové tělesné vody ve stáří se děje zejména na účet její intracelulární složky. Při výrazné obezitě může být relativní obsah vody v organizmu snížen až na 40 %, což vede k dalšímu poklesu rezervní kapacity pro extracelulární tekutinu, a tím i ke snížené schopnosti zajišťovat homeostázu vodního a elektrolytového hospodářství.
Staří lidé si však často neuvědomují nedostatek tekutin. Pocit žízně je u nich oslaben a hlavním příznakem nedostatku tekutin bývá nechutenství a apatie.
Mezi 30. a 70. rokem věku klesá hmotnost ledvin asi o 30 %, navíc se snižuje jejich funkce. Klesá glomerulární filtrace, ledviny mají sníženou koncentrační schopnost. Výsledkem je pokles osmolality moči až na 800 mmol/l. Vzhledem ke snížené kompenzační šíři funkce ledvin je k odstraňování produktů látkové přeměny nutno dodat denně navíc asi 500 ml tekutin [31].
Porušena je také termoregulace, klesá insenzibilní perspirace. Není-li příjem tekutin dostatečný, může dojít k vzestupu sérových hladin katabolitů vylučovaných ledvinami. Při nedostatku tekutin trvajícím do 12 hod (např. v předoperačním období) je organizmus ještě schopen zabránit volumové dekompenzaci. Dochází však k poklesu hmotnosti a k pouze mírnému snížení diurézy (porušená koncentrační schopnost). Trvá-li však odnětí tekutin dále (nebo při velkých ztrátách tekutin či krve), mohou se rozvinout známky ireverzibilní metabolické dekompenzace, která může přejít v selhání ledvin (prerenální formy) a v kóma.
Vzhledem ke snížené kompenzační schopnosti kardiovaskulárního aparátu dochází u starých lidí snadněji k jeho selhávání, které často rozpoznáme teprve v pozdním stadiu, a je proto hůře ovlivnitelné. Z hlediska vodního a elektrolytového hospodářství se selhávání projevuje retencí sodíku a vody s následnou hyperhydratací. Dojde-li k retenci v extracelulárním prostoru, je to hyperhydratace izoosmolární. Při neadekvátní léčbě dehydratačních stavů (např. roztokem 5% glukózy) se významně zvětší množství bezsolutové vody a může se naopak vyvinout hypoosmolární hyperhydratace.
Léčebná opatření je třeba řídit podle zjištěných hodnot iontového a vodního metabolizmu a jejich bilance. Je třeba varovat před schematickým použitím doporučovaných postupů pro dospělé pacienty mladšího věku, které by mohlo vést až k iatrogenním poškození nemocného.
Změny sodíku
Celkový obsah sodíku v organizmu se ve stáří nemění. Extracelulární prostor je relativně zvětšen (asi 25 % proti 27 % prostoru intracelulárního), podíl sodíku v extracelulární tekutině stoupá o 10–15 %. Poklesem obsahu bílkovinných složek skeletu a objemu intracelulární tekutiny dochází ke ztrátám sodíku. Někdy vídáme u starých lidí lehkou a ještě fyziologickou hyponatremii s hodnotami sérového sodíku 128–132 mmol/l.
U starých lidí často zajišťujeme hyponatremické syndromy a je třeba rozlišit, zda se jedná o nedostatek Na+ (depleční syndrom) nebo o změnu v jeho rozložení a zředění (diluční syndrom).
Nedostatek sodíku, resp. jeho nízká hladina v krvi, je většinou důsledkem zvýšeného vylučování vody a sodíku při dlouhodobém podávání saluretik. Klinicky se projevuje povšechnou únavností, slabostí a apatií až kómatem. Diagnózu potvrdí stanovení natremie a uvedené příznaky a dále frakcionované měření množství moči a exkrece sodíku, vyšetření celkových bílkovin a kreatininu v séru.
Hyponatremie při změně distribuce sodíku z extra-do interacelulárního prostoru vede ke zvýšení jeho koncentrace v buňkách. Lze ji pozorovat při srdeční insuficienci vyššího stupně, respirační insuficeienci a při stavech s nedostatkem kyslíku. Průkaz je po metodické stránce svízelný, protože bývá současně přítomna hyponatremie dilučního typu.
Diluční hyponatremie je projev převodnění – „intoxikace vodou“ – vzniklého v důsledku nadměrného příjmu tekutin nebo infuzí hypotonických roztoků, většinou při současné saluretické léčbě. Také při zvýšené sekreci adiuretického hormonu (např. při srdeční dekompenzaci) může dojít k diluční hyponatremii, jejímiž klinickými projevy jsou apatie, bolesti hlavy, nauzea a zvracení, které mohou až přejít v kóma, hypertenzi a bradykardii (při intrakraniální hypertenzi).
Snížený obsah sodíku v organizmu vede také k poklesu pufrační kapacity.
Při léčení postupujeme podle příčin hyponatremie. Substituční příjem sodíku závisí na základní poruše. Denní potřeba činí u zdravého člověka kolem 1 mmol/kg.
Změny draslíku a ostatních minerálů
Se stoupajícím věkem se snižuje celkové množství draslíku v organizmu. Při zvýšeném průniku sodíku do buněk vystupuje naopak draslík z buněk do extracelulárního prostoru, klesá také obsah draslíku v kostech. Sníženo je i směnitelné kalium (muži: 18–33 let 40 mmol K+/kg, 51–75 let 39,7 mmol K+/kg). U většiny geriatrických nemocných zjistíme hypokalemii > 3,5 mmol/l. Její příčinou je zejména dlouhodobé podávání diuretik, na druhém místě karence vyvolané nesprávným složením potravy (nedostatečný příjem mléka a mléčných výrobků, masa, ovoce a brambor). Normální denní spotřeba draslíku je přibližně 50–150 mmol (2–6 g). Po podání nadměrné dávky draslíku dochází u těchto nemocných relativně rychle k hyperkalemii, která je zaviněna sníženou funkcí ledvin, proto je nezbytné respektovat při doplňování kalia stav renálních funkcí a provádět substituci pozvolna.
Typickými projevy nedostatku draslíku u starých lidí jsou apatie, zácpa, edémy, zhoršení stávající ischemické choroby srdeční, klesá tolerance digitálisových přípravků, množí se poruchy rytmu.
Pokud jde o další elektrolyty, někdy se projevuje nedostatek hořčíku s rezultující kardiomyopatií, sekundárními kalcifikacemi a enzymatickými defekty, dále nedostatek vápníku vedoucí k osteoporóze, tetanickým křečím, poruchám vědomí a srdečního rytmu. Nedostatek fosfátu vyvolává apatii, enzymové defekty a arytmie; může dojít i ke karenci chloridů.
Starý člověk reaguje promptně i na nevelké změny vodního a elektrolytového hospodářství často netypickou symptomatologií (apatie, oběhové poruchy a dokonce bezvědomí).
Specifické změny látkové přeměny
U stárnoucího nemocného je nutno počítat s měnící se energetickou potřebou a změnami v intermediárním metabolizmu – nevyvážená výživa může být příčinou řady druhotných onemocnění, která negativně ovlivňují možnosti rehabilitace [32].
Příjem energie
S postupujícím věkem energetická potřeba klesá paralelně s hodnotami základního i námahového metabolizmu [2].
Celková potřeba energie je jen asi 2/3 v porovnání s mladým člověkem (25 let). Svalové tkáně ubývá ze 44 % celkové TH v mládí na 27 % ve věku nad 85 let. Antropometrie většinou zjišťuje ztluštění kožní řasy nad tricepsem a současně zmenšení obvodu paže (úbytek svaloviny). U starých lidí bývá omezena kapacita trávicích pochodů a resorpce, v důsledku metabolických poruch trpí nedostatkem bílkovin. Zvýšená TH může být zaviněna nesprávnou výživou (značný význam má také pokles tělesné aktivity). Se stoupající nadměrnou hmotností se zvyšuje výskyt některých dalších onemocnění, jako je DM, dna, hypertenze, ischemická choroba srdeční, poruchy periferní cirkulace i hyperlipidemie.
Hlavním účelem léčebné výživy je dosáhnout ideální TH a zajistit optimální složení diety s doporučeným poměrem jednotlivých živin. Přívod energie přizpůsobujeme poměrům hmotnosti pacienta s přihlédnutím k příslušným faktorům, které se ve vysokém věku mohou uplatňovat (tab. 1–3).
Table 1. Pokles základní energetické potřeby v průběhu stárnutí v kJ (kcal) na kg tělesné hmotnosti denně.
Tab. 1. Decrease in basic energy requirement during aging in kJ (kcal) per kg body weight per day.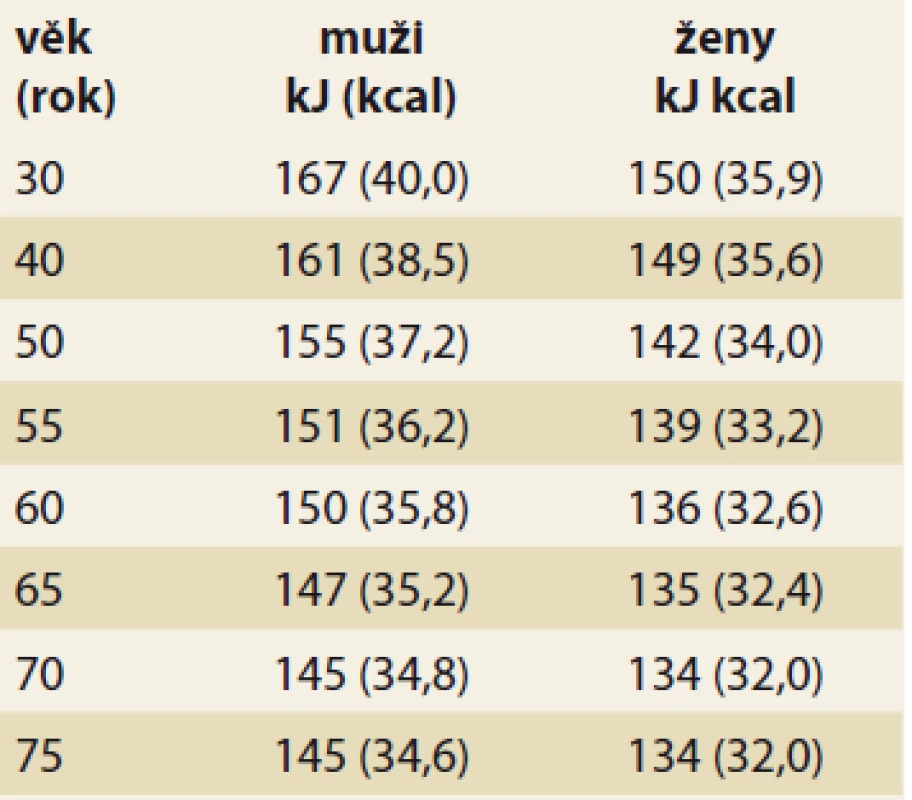
Table 2. Tělesná hmotnost v souboru nemocných ve věku 60-90 roků.
Tab. 2. Body weight in the group of patients aged 60-90 years.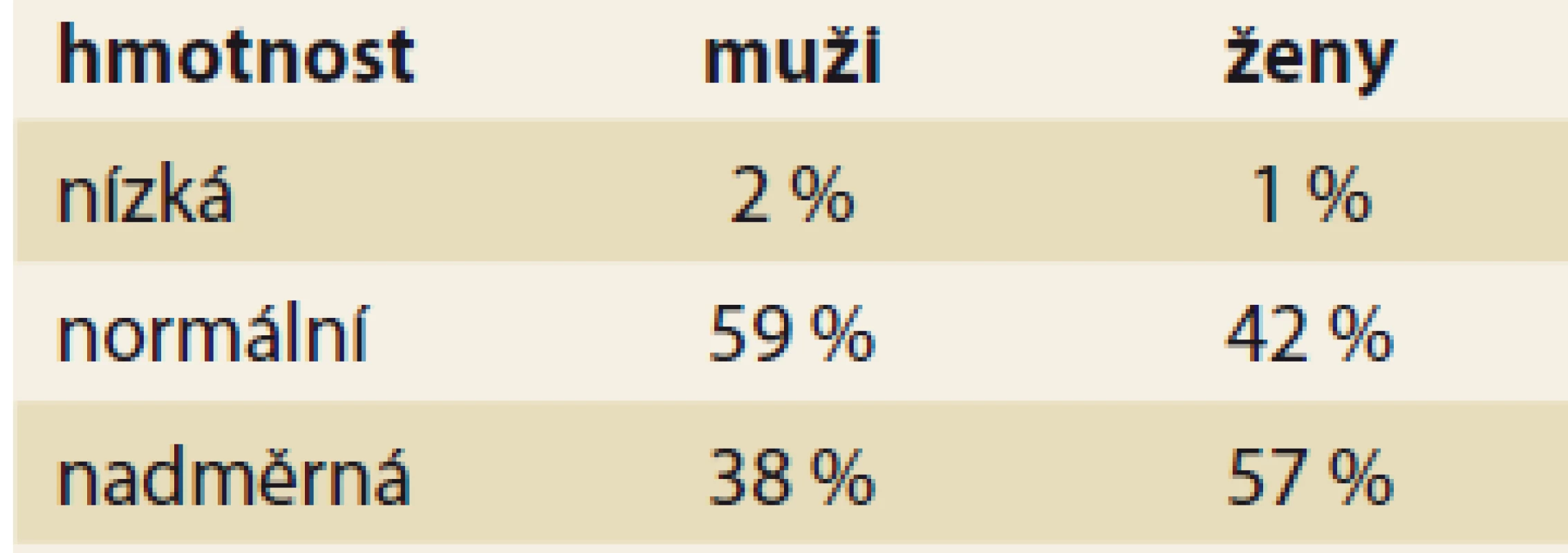
Table 3. Potřeba energie v porovnání s referenční 25letou osobou (zpráva FAO).
Tab. 3. Energy consumption compared to the reference 25-year-old (FAO report).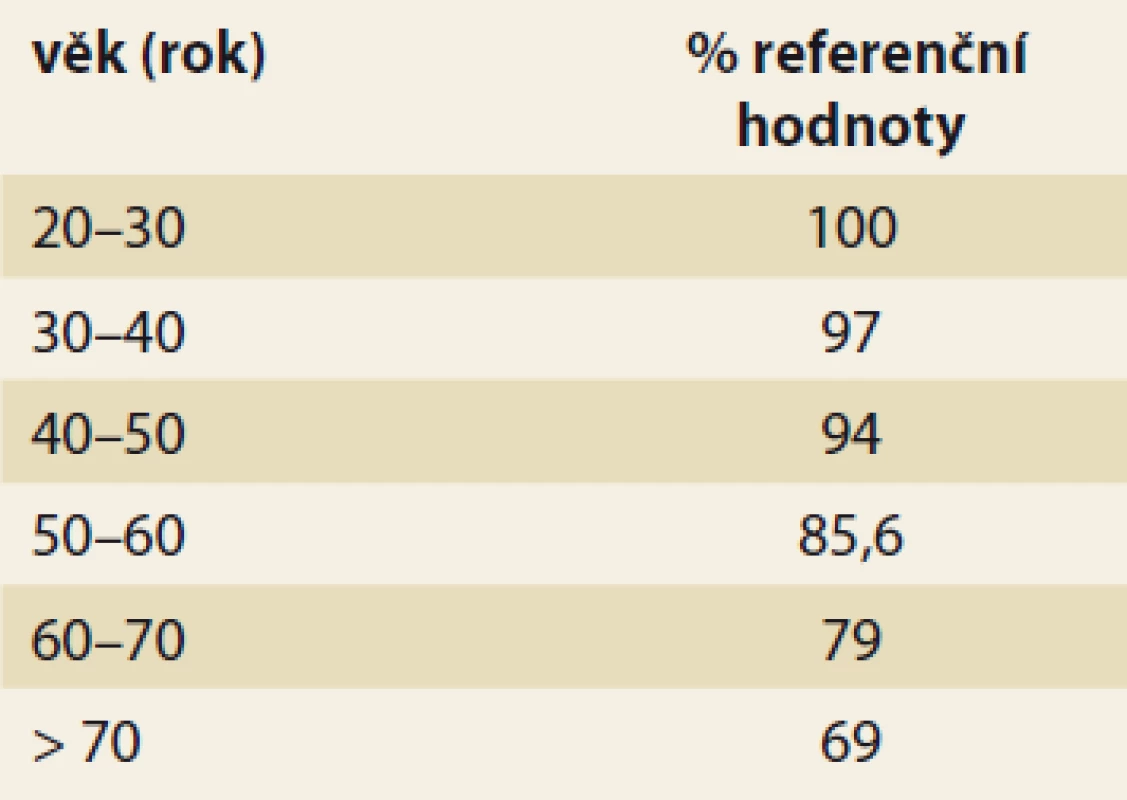
FAO – Food and Agriculture Organization Živiny
Metabolizmus ve stáří
Ve vyšším věku dochází k některým metabolickým změnám, ke kterým je nutno při léčbě přihlížet. Obvyklá strava starých osob bývá nevyvážená, mívá příliš vysoký obsah energie a nadbytek tuků, ale nedostatečný podíl bílkovin, který může vést k typickým příznakům malnutrice.
Jako projev stárnutí se významně uplatňují změny endokrinního systému a je důležité znát reakci jeho složek ve stresových situacích (traumata, operace a náhlá těžká onemocnění). Bývá zvýšena sekrece katecholaminů, především sekrece adrenalinu. Jinak probíhá hormonální odpověď podobně jako u mladých osob. Lze předpokládat dostatečnou adaptibilitu na stres. Trávení a resorpce jsou méně efektivní a mohou být příčinou různých gastrointestinálních poruch. Malabsorpce a rezultující malnutrice mohou být zaviněny chronickou gastritidou, stavem po resekci žaludku nebo chronickou pankreatitidou. Se zhoršeným trávením a resorpcí je třeba počítat i při výživě podávané sondou – dostatečným zdrojem výživy mohou být chemicky nebo nutričně definované diety. U některých metabolických onemocnění lze ve stáří použít enterální výživu jako léčebnou metodu (dna, hyperlipoproteinemie), protože výživné směsi většinou neobsahují puriny ani cholesterol.
Přívod bílkovin
Ve věku nad 50 let výrazně stoupají nároky na přívod bílkovin a zejména esenciálních aminokyselin. Pro seniora je optimální dodávat denně 1,2–1,5 g bílkovin (vzhledem ke snižující se funkci ledvin ve stáří je však nutná redukce při doporučování dávek bílkovin). Při indikovaném podávání je třeba sledovat koncentraci metabolických produktů degradace bílkovin v krvi) na kilogram TH, což odpovídá asi 30 % celkové dodávané energie. Toto množství je nutné k zajištění pozitivní dusíkové bilance, dostatečné odolnosti proti infekcím a hojení ran.
Karence bílkovin
Karence bílkovin je u starých lidí častá a jejími důvody jsou poruchy trávení, zhoršená schopnost žvýkaní při nedokonalé funkci chrupu, socioekonomické faktory (cena masa, příprava a nepravidelnost jídla). Nedostatek bílkovin vyvolává enzymové defekty, pokles plazmatických bílkovin, urychlení fyziologické senilní involuce, snižuje se duševní čilost, zhoršuje hojení ran a odolnost k infekčním chorobám klesá.
Potřeba esenciálních aminokyselin je u starých lidí značně zvýšena, u methioninu a lyzinu je to až 3násobek normální dávky. Zatím se pro finanční nákladnost v klinické praxi výrazněji neprosadily orgánově upravené směsi aminokyselin, které by tyto požadavky splňovaly, protože kinetika aminokyselin je velmi proměnlivá zejména pod vlivem traumat, sepse, selhávání jater nebo ledvin apod. Podáním standardních roztoků obsahujících aminokyseliny a glukozu uhradíme ve většině případů spotřebu energie a bílkovin (tab. 3). Jako doplněk je nutno podávat také elektrolyty, stopové prvky a vitaminy. Do periferní žíly lze podávat také běžné komerční výživné směsi.
Při enterální aplikaci výživných směsí je také nutno dbát na dostatečný přívod bílkovin a počítat s tím, že různé biologicky méně hodnotné bílkoviny rostlinného původu obsahují málo methioninu a lyzinu.
Při dně lze podáváním bezpurinových diet docílit zvýšeného vylučování kyseliny močové močí a pokles její krevní hladiny (téměř všechny průmyslově vyráběné přípravky pro podávání sondou jsou bez purinových látek).
Přívod tuků
Tuková složka zvyšuje energetickou hodnotu potravy starých osob, v krvi stoupá cholesterol a triacylglyceroly. I malé zvýšení cholesterolemie zvyšuje riziko vzniku degenerativních cévních změn. Vzhledem k nutnosti podávat energeticky bohaté směsi, omezit dávky tekutin a dodat esenciální mastné kyseliny ale nelze tuky při umělé výživě vyloučit. Je nutno omezit především živočišné tuky s nasycenými mastnými kyselinami o dlouhém řetězci, nezbytný je denní přívod kyseliny linolové v množství 7–8 g. Denní dávka tuku nemá překročit 1 g/kg/den, resp. 30 % dodávané energie. Limitujícími faktory jsou snížená vyčeřovací schopnost plazmy a sklon k hyperlipoproteinemiím. Při i.v. podávání tuků je nutno průběžně sledovat hladiny triacylglycerolů a glykemie jako ukazatele využití tuků a jejich tolerance. Je také nutno kontrolovat cholesterolemii. Pro enterální výživu jsou zvláště vhodné přípravky s vysokým obsahem esenciálních mastných kyselin. Ovlivnění cholesterolemie docílené podáváním bezcholesterolové enterální výživy nepřineslo jednoznačné úspěchy.
Přívod sacharidů
U nemocných starších 65 let je nutno počítat asi v 10 % s výskytem manifestního DM a asi s 3násobným počtem diabetiků latentních, což znamená, že téměř 1/3 populace starší 65 let trpí poruchou sacharidové tolerance. K příčinám patří relativní pokles hmotnosti pankreatu a vyšší podíl A buněk produkujících v Langerhansových ostrůvcích glukagon. Současné zmnožení vaziva v intersticiu zhoršuje kontakt krve s ostrůvky. Inzulinemie klesá, vedle toho dochází ve stáří k tzv. inzulinorezistenci periferních tkání přispívající též ke snížené toleranci sacharidů.
Poruchy sacharidové přeměny nutí ke značnému omezení oligosacharidů v potravě; větší dávky sacharidů vyžadují uvolnění vyššího množství inzulinu, což má mimo jiné za následek zvýšení lipogeneze a zbytečné zatížení již méně výkonného endokrinního pankreatu. Uvedené změny zjišťujeme zejména při postagresivním syndromu a kromě intolerance sacharidů vedou k nadbytečné tvorbě tuku.
Denní dávka sacharidů by neměla být vyšší než 400 g (nebo 6 g/kg/den). Podávání jiných oligosacharidů náhradou za glukózu může mít za následek zvýšenou produkci laktátu a urátů, proto i zde by měla být zachována určitá omezení, známá u jiných stavů. Při enterální aplikaci je vhodné snižovat dávku oligosacharidů, podáváme větší množství polysacharidů (degradační produkty škrobu). Snášenlivost laktózy bývá často snížena.
Přívod vitaminů
Podle dosavadních studií není potřeba vitaminů ve stáří podstatně změněna, ale málokdy je obvyklá strava obsahuje v dostatečném množství. Výsledky nasvědčují častému nedostatku kyseliny listové. Vitaminy v příslušném zastoupení podáváme podle směrnic doporučených dávek.
Nutriční postupy u nemocných vyššího věku s onemocněním ledvin
U starých lidí bývá omezena kapacita trávicích pochodů a resorpce. Zvýšená TH může být zaviněna nesprávnou výživou (značný význam má také pokles tělesné aktivity). Se stoupající nadměrnou hmotností se zvyšuje výskyt některých dalších onemocnění, jako je DM, dna, hypertenze, ischemická choroba srdeční, poruchy periferní cirkulace i hyperlipidemie. Hlavním účelem léčebné výživy je dosáhnout i u seniorů ideální TH pro danou věkovou skupinu a zajistit optimální složení diety s doporučeným poměrem živin [33]. Přívod energie by měl odpovídat poměrům hmotnosti pacienta s přihlédnutím k příslušným faktorům, které se ve vysokém věku mohou uplatňovat. Při špatné complianci lze užít u seniorů modifikovaného příjmu proteinů v dietě. Někteří autoři doporučují vložit do 7denního cyklu nízkobílkovinné diety 2 dny s vyšším obsahem bílkovin (B) (až 1 g/kg TH/den). Dle našich zkušeností, s ohledem na dlouhodobý metabolický stav nemocných a jídelní stereotyp, vkládáme většinou 1× týdně jídelní sestavu obsahující 0,8 g B/kg TH/den. V ostatních případech dáváme raději přednost nutričnímu suplementu či při špatné complianci a adherenci k dietě přechodu na volnější kontrolovanou dietu s obsahem 0,8 g B/kg TH/den s omezeným obsahem fosfátů. V současné době populární vegetariánská dieta se do určité míry blíží původní italské, resp. i bramboro-vaječné dietě německé. Na základě vegetariánské diety lze výhodně sestavit jídelní lístek pro všechny formy nízkobílkovinných diet. Pro nižší obsah esenciálních aminokyselin v některých vegetariánských pokrmech však musí být tyto diety suplementovány [34]. U diety přísně vegetariánské však nestačí samotný přísun rostlinné bílkoviny pokrýt základní potřebu esenciálních aminokyselin a tyto aminokyseliny musí být bezpodmínečně suplementovány. Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich keto-a hydroxyanalogy (KA). Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin [35]. Podávání bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich KA vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a methionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lyzin, treonin a tryptofan), neboť jejich aminace v organizmu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu. Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před více než 50 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných s chronickou renální insuficiencí dodnes zcela vyřešena. U nás dostupné přípravky mají ketoanaloga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v 1 tbl. přípravku Ketosteril nezanedbatelný přísun kalcia [36]. Na úspěšnosti nízkobílkovinných diet se nepochybně podílí dlouhodobě vyrovnaná metabolická bilance nemocných, účinná léčba hypertenze a pravidelné kontroly konané v této fázi onemocnění lékařem nejméně 1× měsíčně. Vedle základních laboratorních parametrů (kreatinin, urea, glomerulární filtrace, krevní obraz, sideremie (event. při léčbě rh-EPO feritin či saturace transferinu), sodík, draslík, vápník, fosfor, kyselina močová, Astrup, glykemie, cholesterol, triacylglyceroly, močový sediment, bakteriurie, proteinurie/24 hod) musíme pravidelně kontrolovat základní parametry nutrice, tj. albumin, transferin, event. aminogram (resp. Whiteheadův kvocient, tj. poměr neesenciálních aminokyselin gly + glu + ser + tau a esenciálních aminokyselin leu + ileu + val + met). K základním údajům patří subjektivní pocity nemocného a jeho celková prosperita měřená antropometricky. Vedle tzv. adherence k dietě, kterou můžeme zhodnotit anamnesticky či lépe formou dotazníku, hodnotíme při nízkobílkovinné dietě tzv. complianci podle odpadu urey a fosfátů do moči za 24 hod.
V souladu s historickou tezí Giordana lze predikovat – pokud organizmus dostává denně dostatečné množství esenciálních aminokyselin, stává se limitujícím faktorem pro udržení dusíkové rovnováhy dusík pocházející z neesenciálních aminokyselin. Za těchto podmínek může být využit ke stavbě bílkovin i dusík pocházející z močoviny. Utilizace dusíku urey u nemocných s chronickou renální insuficiencí může být relativně vysoká (30–40 %). Lepší využití aminokyselin při nedostatečném příjmu bílkovin je umožněno zvýšenou aktivitou proteosyntetických enzymů v játrech, snížením jejich oxidace a snížením aktivity enzymů ureového cyklu. Pro přepočet vyloučeného množství urey v moči na příjem bílkovin či aminokyselin je nutno vědět, že z 1 g bílkovin vzniká přibližně 5,5 mmol urey a 80 % vytvořené urey se vylučuje močí. K prakticky snadno dosažitelným indikátorům intenzity proteinového metabolizmu patří výpočet množství metabolizovaného (a za předpokladu vyrovnané metabolické bilance i přijatého) proteinu na podkladě množství urey vyloučené do moči v mmol za 24 hod – Uurea.V × 0,25 (za předpokladu, že se fekálně vylučuje u těchto nemocných kolem 0,031 g sodíku kg/den).
Spektrum aminokyselin v séru se při renální insuficienci zásadně mění. Snižují se koncentrace esenciálních aminokyselin (EAK) s výjimkou fenylalaninu. Koncentrace neesenciálních aminokyselin (NEAK) se většinou naopak zvyšuje. Snižuje se také poměr EAK: NEAK. Toto snížení je však výrazně ovlivňováno stavem nutrice. Vylučování aminokyselin do moči se při renální insuficienci podstatně nemění, což je způsobeno (při snížené glomerulární filtraci) zvýšenou frakční exkrecí aminokyselin. Koncentrace aminokyselin v séru závisí na jejich intracelulárním metabolizmu. Koncentrace volných aminokyselin je v intracelulární tekutině podstatně vyšší, než je v tekutině extracelulární. Tyto aminokyseliny pak mohou být transportovány do extracelulárního prostoru (např. při poklesu sérových hladin aminokyselin při ztrátách vyvolaných hemodialýzou). Snížené hladiny rozvětvených esenciálních aminokyselin jsou jedním z typických nálezů u nemocných s chronickou renální insuficiencí. Také hladina serinu může být významně snížena, neboť ledviny jsou hlavním místem jeho tvorby. Mohou být ovlivněny hladiny dalších hydroxyaminokyselin (glycin a threonin). Hladina alaninu a glutaminu bývá většinou normální a tyto aminokyseliny představují v postdigestční fázi hlavní zdroj dusíku pro ledviny a splanchnické orgány. Jejich hladina je výrazně ovlivňována dietou stejně jako stupněm vychytávání (metabolizace) v uvedených orgánech. Stejně tak se zvyšují hladiny některých aminokyselin ureového cyklu (především citrulinu, zatímco arginin zůstává většinou normální), aminokyselin obsahujích síru (cystinu, homocysteinu, event. cysteinu, zatímco hladina methioninu zůstává normální), prolinu, hydroxyprolinu a 3-metylhistidinu.
Pro malnutrici je typický pokles TH, tělesného tuku, svalové hmoty a intracelulární vody. Klesají hladiny albuminu, transferinu, cholinesterázy, komponent komplementového systému, především C3 složky. Stejně se snižují hladiny valinu, leucinu, izoleucinu, tryptofanu a tyrozinu, poměr celkových esenciálních aminokyselin k neesenciálním, valinu ke glycinu a tyrozinu k fenylalaninu, hladina glycinu je často zvýšena [37,38]. Tryptofan je jediná aminokyselina vázaná na bílkoviny séra a je mimořádně významná z hlediska zahájení proteosyntézy. Koncentrace tryptofanu v séru při chronické renální insuficienci bývá normální nebo lehce snížená. Mění se však poměr volného a vázaného tryptofanu. Koncentrace vázaného tryptofanu se snižuje, zvyšuje se koncentrace volného tryptofanu. Tryptofan je zdrojem indolových látek, jejichž koncentrace se při renální insuficienci zvyšuje. Porucha metabolizmu fenylalaninu a tyrozinu je známa již delší dobu. Uvádí se, že zvýšená hladina fenylalaninu, jeho zpomalená metabolizace a snížený poměr tyrozinu k fenylalaninu může být způsoben jak snížením hladiny ledvinné fenylalaninhydroxylázy, tak změnou intra-extracelulární distribuce. Je známou skutečností, že histidin je esenciální aminokyselinou pro nemocné s chronickou renální insuficiencí. Jeho plazmatické koncentrace bývají nízké buď pro sníženou syntézu jeho prekurzoru (kyselině imidasolpyrohroznové), nebo sníženou schopnost transaminovat tuto ketokyselinu (snížená aktivita transketolázy při chronické renální insuficienci).
Závažný příspěvek v hodnocení metabolického stavu nemocných s chronickou renální insuficiencí přinesly studie zabývající se intracelulární koncentrací aminokyselin, především ve svalové hmotě. Jak známo, kosterní svaly představují hlavní zásobní zdroj volných aminokyselin. Při chronické renální insuficienci se mění extra-intracelulární distribuce některých aminokyselin, takže plazmatické hladiny nejsou odpovídajícím odrazem hladin intracelulárních. Tato skutečnost se např. týká pro metabolizmus velice důležitých tzv. rozvětvených aminokyselin – leucinu, izoleucinu a valinu. Při snížené plazmatické hladině těchto tří aminokyselin byly popsány normální intracelulární koncentrace leucinu a izoleucinu (valin byl snížen) a tyto rozdíly přetrvávaly i při dlouhodobé nízkobílkovinné dietě doplněné esenciálními aminokyselinami. Selektivní deplece valinu (a to přes vysoký příjem) ukazovala, že tato aminokyselina byla zvýšeně katabolizována a při uvedené suplementaci esenciálních aminokyselin vznikl mezi valinem a leucinem s izoleucinem tzv. aminokyselinový antagonizmus. Podobně byla zjištěna výrazně snížená intracelulární hladina tyrozinu při relativně zvýšené hladině plazmatické. Threonin byl nalezen snížený jak v plazmě, tak ve svalu. Naproti tomu aminokyseliny ureového cyklu – citrulin, ornitin a arginin – byly nalezeny zvýšené jak ve svalu, tak v séru [39]. Je tedy zřejmé, že syntéza bílkovin v chronické renální insuficienci může být výrazně limitována intracelulárním obsahem aminokyselin, především pak nízkou koncentrací valinu, threoninu a tyrozinu a u neléčených též histidinu.
Použití esenciálních aminokyselin a jejich ketoanalog
Při chronické renální insuficienci byly opakovaně dokumentovány nálezy abnormálních hladin některých aminokyselin v plazmě a kosterním svalu. Bývají zjišťovány nízké koncentrace především esenciálních aminokyselin, zatímco hladina některých neesenciálních bývá zvýšena [40]. Typickým nálezem u dietologicky neléčených nemocných s chronickou renální insuficiencí jsou snížené plazmatické koncentrace treoninu, valinu, leucinu, izoleucinu, lyzinu, tryptofanu a tyrozinu. Hladina fenylalaninu se zpočátku nemění, později stoupá stejně jako poměr fenylalanin: tyrozin. Hladina histidinu je většinou snížena a vázne jeho využitelnost. Tento nález potvrzuje i snížená hladina karnosinu ve svalu (dipeptid složený z histidinu a -alaninu). Histidin představuje esenciální aminokyselinu pro nemocné s chronickou renální insuficiencí a vzhledem k váznoucí metabolizaci je semiesenciální i tyrozin, z neesenciálních aminokyselin je snížena plazmatická hladina serinu (snížená syntéza v ledvinné tkáni). Ostatní neesenciální aminokyseliny mají plazmatickou hladinu normální (glutamin, glycin, alanin) nebo zvýšenou (kyselina aspargová, kyselina glutamová, citrulin, ornitin, arginin). Ve svalu je zvýšena hladina především aminokyselin ureového cyklu. Jak vyplývá z uvedených údajů, je u nemocných s chronickou renální insuficiencí porušena distribuce především esenciálních aminokyselin extra-intracelulárního prostoru. Pouze z nálezu plazmatických hladin jednotlivých aminokyselin nelze přesně odvozovat jejich koncentraci v organizmu. Složení spektra aminokyselin neodpovídá nálezu u zdravých jedinců, a tedy nemocní s chronickou renální insuficiencí vyžadují doplnění aminokyselinami odpovídajícími jejich metabolickým poruchám.
Velmi významnou úlohu v metabolizmu aminokyselin a bílkovin hrají rozvětvené aminokyseliny (valin, leucin a izoleucin). Jejich nutriční důležitost byla objevena v 50. letech 20. století Rosem, který ukázal, že pro příznivou dusíkovou bilanci je nezbytné adekvátní množství rozvětvených aminokyselin. V 70. letech 20. stolení byl prokázán důležitý vliv těchto aminokyselin v regulaci proteinového, sacharidového a lipidového metabolizmu. Za fyziologických podmínek se metabolizuje největší množství rozvětvených aminokyselin extrahepatálně ve svalech (asi 55 %) a tento podíl se při metabolických dekompenzacích v organizmu zvyšuje.
Při metabolizaci aminokyselin je prvním krokem transaminace na odpovídající ketokyseliny. Tento pochod je reverzibilní, což má zásadní význam při užití ketoanalog esenciálních aminokyselin. Umožňuje tak příslušným ketokyselinám nahradit základní aminokyseliny v bílkovinných dietách. Konečným produktem oxidace leucinu a izoleucinu je acetyl CoA, který může sloužit jako základní zdroj pro syntézu mastných kyselin. Při neúplné oxidaci leucinu vzniká hydroxymetyl-glutaryl-CoA, základní prekurzor cholesterolu. Valin se metabolizuje na sukcinyl CoA – intermediální metabolit Krebsova cyklu, který má glykogenní účinek. Důležitý je zejména vztah alaninového a glutaminového metabolizmu k metabolizmu rozvětvených aminokyselin. Rozvětvené aminokyseliny jsou zdrojem -amino-dusíku pro syntézu glutaminu a alaninu. Alanin je přenašečem aminoskupin mezi kosterními svaly a játry, takže je možno říci, že rozvětvené aminokyseliny regulují sekundárně přenos -amino-dusíku mezi periferními a viscerálními tkáněmi. Glutamin je přenašečem aminoskupin mezi kosterními svaly a ledvinami. Alanin a glutamin jsou také klíčovými substráty pro glukoneogenezi. Všechny tři rozvětvené aminokyseliny mají regulační vliv na proteinový metabolizmus ve smyslu poklesu katabolizmu a tendenci k proteosyntéze. Největší protein šetřící účinek byl popsán u ketoanalogu leucinu. Vysoké koncentrace rozvětvených aminokyselin inhibují glukogenezi. Při chronické renální insuficienci zjišťujeme snížené plazmatické hladiny rozvětvených aminokyselin (hladina valinu < 150 µmol/l je důkazem těžké malnutrice). Naproti tomu intracelulární koncentrace leucinu i izoleucinu jsou normální, zatímco valinu je významně snížena. Tento poměr se nedá upravit ani při běžné suplementaci aminokyselin a je označován jako tzv. antagonizmus rozvětvených aminokyselin.
Použití esenciálních aminokyselin a jejich ketoanalog v klinické praxi je těsně spojeno se stanovením minimálního denního potřebného množství esenciálních aminokyselin u zdravých osob. Zjištěné hodnoty jsou uvedeny v tab. 4.
Table 4. Minimální denní množství esenciálních aminokyselin u zdravých osob.
Tab. 4. Minimum daily amount of essential amino acids in healthy persons.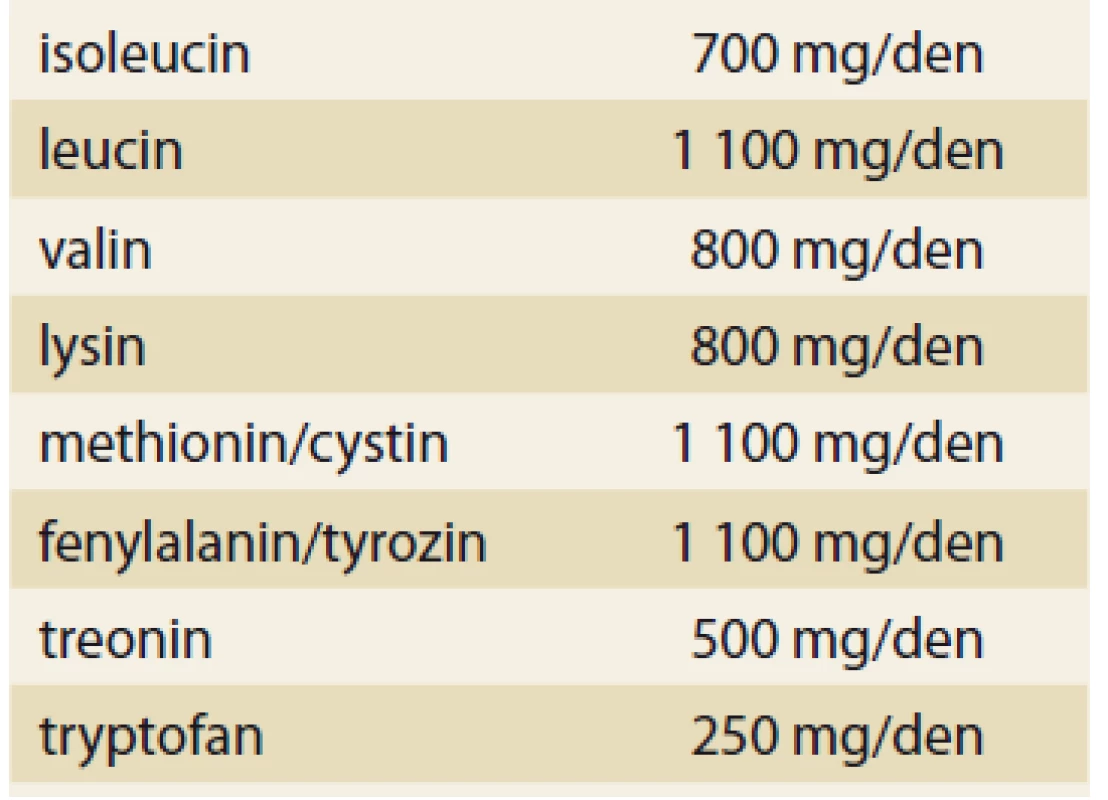
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich KA. Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin v jejich KA formě vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a methionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lyzin, treonin a tryptofan), neboť jejich aminace v organizmu byla metabolicky náročná a méně efektivní. Do sestavy aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu.
Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před 40 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných s chronickou renální insuficiencí dodnes zcela vyřešena [37,38].
Vedle ketoanalog lze podávat u nemocných s chronickou renální insuficiencí při nízkobílkovinné dietě též přípravky esenciálních aminokyselin. Podání samotných aminokyselin se však dlouhodobě příliš neosvědčilo, neboť stejného účinku lze dosáhnout při menších nákladech přidáním malého množství biologicky vysoce hodnotné bílkoviny či lépe oligopeptidů (navíc je příjem většího množství aminokyselin spojen s nebezpečím prohloubení metabolické acidózy). Podáváme je krátkodoběji (dnes výhradně parenterálně) především tam, kde je porušena metabolická aktivace ketoanalog (aminace) – u nemocných s jaterní lézí, v těžkém metabolickém stavu, u diabetiků apod.
Velikost dávky ketoanalog a esenciálních aminokyselin je závislá na bílkovinném složení diety, hmotnosti nemocného a jeho nutričním stavu. Při neselektivní nízkobílkovinné dietě obsahující 0,6 g bílkovin/kg/den se udává dávka 0,1–0,2 g aminokyselin/kg/den. Minimální dávka nezbytná k udržení dusíkové rovnováhy při naší dietě činila 4,8 g/den (přípravek Ketosteril). Celkový příjem bílkovin vč. aminokyselin nesmí dlouhodobě klesnout pod 0,7 g/kg TH/den.
Kontraindikace v podávání ketoanalog jsou hyperkalcemie, uremická gastrointestinální symptomatologie a těžká jaterní léze. Pro nedostatek klinických zkušeností se nedoporučuje podávat přípravek v těhotenství. Složení ketoanalog je uvedeno v tab. 5.
Table 5. Složení přípravku ketoanalog (Ketosteril Fresenius®).
Tab. 5. Composition of ketoanalog (Ketosteril Fresenius®).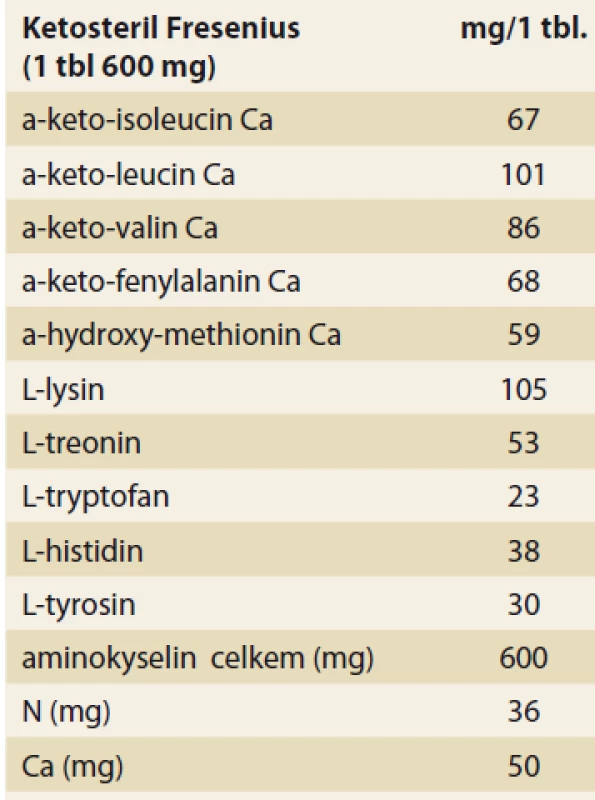
N – dusík, Ca – vápník Vzhledem k zvýšenému příjmu aminokyselin při nízkobílkovinných dietách byla také sledována otázka, zda zvýšená nálož aminokyselin touto cestou neovlivňuje nepříznivě hyperfiltraci v reziduálních nefronech. Experimentální studie ukázaly, že výhodné aminokyselinové složení těchto přípravků naopak hyperfiltraci snižuje [41]. Ketoanaloga významně ovlivňují také kalciofosfátový metabolizmus u nemocných s chronickou renální insuficiencí. Snižují hyperfosfatemii a hladinu parathormonu, zvyšují kalcemii, čímž příznivě ovlivňují projevy sekundární hyperparatyreózy. Tomuto mechanizmu se také přisuzuje významná role ve zpomalené progresi chronické renální insuficience.
Naše zkušenosti v dietoterapii u seniorů s gastrointestinálním onemocněním (reanalýza studie CEKAD)
V našich předchozích studiích u více než 3 000 nemocných s chronickým onemocněním ledvin (CKD – chronic kidney disease) bylo prokázáno, že starší nemocní mohou velmi dobře tolerovat nízkobílkovinnou dietu doplněnou ketoanalogy esenciálních aminokyselin, která pomáhá dlouhodobě stabilizovat metabolický stav nemocných. Navíc při většinou dobré complianci je riziko skryté malnutrice nízké [42].
V prospektivní, randomizované, dvojitě slepé, placebem kontrolované multicentrické studii CEKAD (Central European Keto Amino Acid Diet) bylo sledováno po dobu 3 let celkem 300 nemocných ve stadiu CKD 3–4, diabetiků a nediabetiků, z čehož 100 nemocných bylo z ČR. Průměrný věk souboru činil 62 ± 6 let. Z těchto pacientů ve věku nad 65 let mělo pouze 7 gastrointestinální onemocnění (1× CD, 2× UC, 4× divertikulární nemoc).
Následně byla provedena reanalýza dat s ohledem na věkové složení [43,44]. Soubor byl rozdělen na skupinu I (nemocní ve věku 65 let a starší) a skupinu II kontrolní (nemocní mladší než 65 let). Obě skupiny měly srovnatelnou vstupní úroveň GF 0,57–0,71 ± 0,32 ml/s. Při 3letém sledování jsme u skupiny I prokázali signifikantně vyšší pokles proteinurie a snížení TK ve srovnání s kontrolní skupinou II (p < 0,025). Bylo zachyceno i zpomalení progrese GF měřené CKr a úprava parametrů sacharidového a lipidového metabolizmu (p < 0,05). Gastrointestinální onemocnění bylo stabilní bez specifické léčby. Compliance nemocných byla dobrá a adherence k dietě přesahovala 80 % (p < 0,02).
U sledovaných seniorů bylo při standardní nutriční kontrole dlouhodobé podávání modifikované nízkobílkovinné diety s ketoanalogy esenciálních aminokyselin bezpečné a účinné, a představuje tak alternativní léčebný postup (ve srovnání s dialyzační léčbou) u nemocných vyšších věkových kategorií se současným stabilním onemocněním GIT.
Doručeno/Submitted: 22. 7. 2019
Přijato/Accepted: 17. 8. 2019
prof. MUDr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro střevní záněty
ISCARE I.V.F. a. s.
Jankovcova 1569/ 2c
170 00 Praha 7
Sources
1. Darmon P, Kaiser MJ, Bauer JM et al. Restrictive diets in the elderly: never say never again. Clin Nutr 2010; 29 (2): 170–174. doi: 10.1016/j.clnu.2009.11.002.
2. Teplan V. Metabolismus a ledviny. Praha: Grada Avicenum 2000 : 35–47.
3. Brunori G, Viola BF, Parrinello G et al. Efficacy and safety of very-low-protein diet when postponing dialysis in the elderly: a prospective randomized multicenter controlled study. Am J Kidney Dis 2007; 49 (5): 569–580. doi: 10.1053/j.ajkd.2007.02.278.
4. Teplan V. Funkční vyšetření ledvin u seniorů. In: Teplan V et al. Nefrologie vyššího věku. Praha: Mladá fronta, Aesculap 2015 : 263–277.
5. Marečková O. Gastroenterologické komplikace u seniorů s onemocněním ledvin. In: Teplan V et al. Nefrologie vyššího věku. Praha: Mladá fronta, Aesculap 2015 : 177–191.
6. Teplan V, Marečková O, Lukáš M. Onemocnění gastrointestinálního traktu a choroby ledvin. Gastroent Hepatol 2018; 72 (1): 50–57. doi: 10.14735/amgh201850.
7. Ritz E. Gastrointestinal disease and the kidney. In: Davison AM, Cameron JS, Grunfeld JP et al (eds). Oxford: Oxford University Press 1998 : 2733–2735.
8. Marečkova O. Poruchy gastrointestinálního traktu u chorob ledvin. In: Teplan V. Metabolismus a ledviny. Praha: Grada 2000 : 147–157.
9. Wang F, Jiang H, Shi K et al. Gut bacterial traslocation is associated with microinflammation in end-stage renal dinase patiens. Nephrology (Carlton) 2012; 17 (8): 733–738. doi: 10.1111/j.1440-1797.2012.01647.x.
10. Polak P, Jurankova J, Husa P. Struktura a funkce intestinální epiteliální bariéry. Gastroent Hepatol 2013; 67 (6): 494–497.
11. Vaziri ND, Goshtasbi N, Yuan J et al. Uremic plasma impairs barrier function and depletes the tight junction protein constituents of intestinal epithelium. Am J Nephrol 2012; 36 (5): 438–443. doi: 10.1159/000343886.
12. Marečková O, Teplan V, Schück O. Gastroenterologická problematika v nefrologii. Praha: Galen 2008.
13. Antoš F. Divertikulární choroba tlustého střeva. In: Mařatka Z (ed) et al. Gastroenterologie. Praha: Karolinum 1999 : 305–309.
14. Shaheen NJ, Hansen RA, Morgan DR et al. The burden of gastrointestinal and liver diseases. Am J Gastroenterol 2006; 101 (9): 2128–2130. doi: 10.1111/j.1572-0241.2006.00723.x.
15. Lederman ED, McCoy G, Conti DJ et al. Diverticulitis and polycystic kidney disease. Am Surg 2000; 66 (2): 200–203.
16. Whiteway J, Morson BC. Elastosis in diverticular disease of the sigmoid colon. Gut 1985; 26 (3): 258–266. doi: 10.1136/gut.26.3.258.
17. Wess L, Eastwood MA, Wess TJ et al. Cross linking of collagen is increased in colonic diverticulosis. Gut 1995; 37 (1): 91–94. doi: 10.1136/gut.37.1.91.
18. Shahedi K, Fuller G, Bolus R et al. Progression from incidental diverticulosis to acute divertikulitis. Gastroenterology 2012; 142 (5) (Suppl 1): S144. doi: 10.1016/S0016-5085 (12) 60 541-1.
19. Lederman ED, Conti DJ, Lempert N et al. Complicated diverticulitis following renal transplantation. Dis Colon Rektum 1998; 41 (5): 613–618. doi: 10.1007/bf02235270.
20. Ghassemi KA, Jensen DM. Lower GI bleeding: epidemiology and management. Curr Gastroenterol Rep 2013; 15 (7): 333. doi: 10.1007/s11894-013-0333-5.
21. Colecchia A, Vestito A, Pasqui F et al. Efficacy of long term cyclic administration of the poorly absorbed antibiotic Rifaximin in symptomatic, uncomplicated colonic diverticular disease. World J Gastroenterol 2007; 13 (2): 264–269. doi: 10.3748/wjg.v13.i2.264.
22. Stelzner M, Vlahakos DV, Milford EL et al. Colonic perforations after renal transplantation. J Am Coll Surg 1997; 184 (1): 63–69.
23. Benoit G, Moukarzel M, Verdelli G et al. Gastroiontestinal complications in renal transplantation. Transpl Int 1993; 6 (1): 45–49.
24. Matsuno T, Inagaki M, Oishi M et al. Ileocolonic complications after kidney transplantation. Transplant Proc 2000; 32 (7): 1880–1881. doi: 10.1016/s0041-1345 (00) 01474-3.
25. Toogood GJ, Gillespie PH, Gujral E. Cytomegalovirus infection and colonic perforation in renal transplant patients. Transpl Int 1996; 9 (3): 248–251.
26. Ryšavá R. Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat. Gastroent Hepatol 2019; 73 (2): 154–162. doi: 10.14735/amgh2019154.
27. Shimizu M, Manabe T, Matsumoto T et al. Beta 2 microglobulin haemodialysis related amyloidosis: distinctive gross features of gastrointestinal involvement. J Clin Pathol 1997; 50 (10): 873–875. doi: 10.1136/jcp.50.10.873.
28. Takahashi S, Morita T, Koda Y et al. Gastrointestinal involvement of dialysis-related amyloidosis. Clin Nephrol 1988; 30 (3): 168–161.
29. McCollum DL, Rodriguez JM. Detection, treatment, and prevention of Clostridium difficile infection. Clin Gastroenterol Hepatol 2012; 10 (6): 581–592. doi: 10.1016/j.cgh.2012.03.008.
30. Schück O. Examination of kidney function. Boston: Martinus Nijhoff Publishers l984 : 218–227.
31. Nádvorníková H. Koncentrační schopnost ledvin. Praha: Avicenum 1983.
32. El Nahas AM, Bello AK. Chronic kidney disease: the global challenge. Lancet 2005; 365 (9456): 331–340. doi: 10.1016/S0140-6736 (05) 17789-7.
33. Klahr S, Harris K. Adaptation of remnant nephrons. In: Giovannetti S (ed). Nutritional treatment of chronic renal failure. Dordrecht: Kluwer Academic Publishers Group 1989 : 21–28.
34. Piccoli GB, Attini R, Vasario E et al. Vegetarian supplemented low-protein diets. A safe option for pregnant CKD patiens: report of 12 pregnancies in 11 patients. Nephrol Dial Transplant 2011; 26 (1): 196–205. doi: 10.1093/ndt/gfq333.
35. Teplan V. Pharmacological features of a keto amino acids. Am J Nephrol 2005; 25 (Suppl 1): S13–S14.
36. Aparicio M, Bellizzi V, Chauveau P et al. Keto acid therapy in predialysis chronic kidney disease patiens: final consensus. J Ren Nutr 2012; 22 (Suppl 2): S1–S24. doi: 10.1053/j.jrn.2011.09.006.
37. Toigo G, Aparicio M, Attman PO et al. Expert Working Group report on nutrition in adult patients with renal insufficiency (part 1 of 2). Clin Nutr 2000; 19 (3): 197–207. doi. 10.1054/clnu.1999.0130.
38. Toigo G, Aparicio M, Attman PO et al. Expert Working Group report on nutrition in adult patients with renal insufficiency (part 2 of 2). Clin Nutr 2000; 19 (4): 281–291. doi: 10.1054/clnu.2000.0129.
39. Mitch WE. Beneficial responses to modified diets in treating patients with chronic kidney disease. Kidney Int 2005; (Suppl 94): 133–135. doi: 10.1111/j.1523-1755.2005.09430.x.
40. Misra M, Nolph K. Efficacy and safety of very-low-protein diet in the elderly: what are the options? Am J Kidney Disease 2008; 51 (3): 530–531. doi: 10.1053/j.ajkd.2007.11.034.
41. Teplan V. Effect of keto acids on asymmetric dimethylarginine, muscle, and fat tissue in chronic kidney disease and after kidney transplantation. J Ren Nutr 2009; 19 (Suppl 5): S27–S29. doi: 10.1053/j.jrn.2009.06.007.
42. Schober-Halstenberg HJ. Keto/Amino acids in the treatment of chronic kidney disease patients: 30 years experience in 3,000 patients. Am J Nephrol 2005; 25 (Suppl 1): S1–S27.
43. Teplan V, Schück O, Malý J et al. Konzervativní léčení chronické renální insuficience (CKD 4–5) u seniorů. Aktuality v nefrologii 2010; 16 (2): 59–66.
44. Teplan V. Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin. Vnitř Lék 2016; 62 (Suppl 6): S88–S95.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2019 Issue 5-
All articles in this issue
- Sekundární prevence kolorektálního karcinomu v České republice
- Gastrointestinální onkologie
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii
- Aktuální výsledky screeningu kolorektálního karcinomu v České republice a potenciální význam kolonické kapslové endoskopie
- Střevní příprava před koloskopií – existuje optimální příprava?
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Vliv současné léčby na populační data dlouhodobého přežívání nemocných s karcinomem pankreatu
- Divertikulární choroba tlustého střeva – nový pohled na klasifikaci a léčbu
- Mikrobiota v etiopatogenéze a liečbe symptomatickej divertikulovej choroby hrubého čreva
- Nutriční diety u gastroenterologických nemocných vyššího věku s chronickým onemocněním ledvin
- Díl V. – Příčiny úmrtí pacientů s idiopatickými střevními záněty a související časové trendy
- XXXIII. Hildebrandove bardejovské gastroenterologické dni
- Opustil nás profesor Meinhard Classen
- Výběr z mezinárodních časopisů
- Kvíz z klinické praxe
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: Gastrointestinální onkologie
- Asacol 1,6 g využívá nový technologický koncept OPTICORE™
- Papilárny adenokarcinóm žalúdka
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Střevní příprava před koloskopií – existuje optimální příprava?
- Divertikulární choroba tlustého střeva – nový pohled na klasifikaci a léčbu
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii
- Aktuální výsledky screeningu kolorektálního karcinomu v České republice a potenciální význam kolonické kapslové endoskopie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

