-
Medical journals
- Career
Vliv současné léčby na populační data dlouhodobého přežívání nemocných s karcinomem pankreatu
Authors: Ryska M.
Authors‘ workplace: Chirurgická klinika 2. LF UK a ÚVN – VFN Praha
Published in: Gastroent Hepatol 2019; 73(5): 409-412
Category: Gastrointestinal Oncology: Review Article
doi: https://doi.org/10.14735/amgh2019409Overview
Karcinom pankreatu představuje v České republice druhé nejčastější nádorové onemocnění zažívacího traktu a šesté nejčastější nádorové onemocnění vůbec. Pozdní stanovení diagnózy znamená, že ve stadiu onemocnění IV je diagnostikováno více než 70 % pacientů. Jedinou šancí na dlouhodobé přežívání pacientů je multimodální léčba, ve které hraje zásadní roli radikální resekce. Z populačních dat ČR v období 1995–2016 je zřejmé, že se podařilo výrazně zvýšit počet ošetřených nemocných v prvních dvou stadiích onemocnění: ve stadiu onemocnění I se zvýšilo procento 5letého přežití 3×, ve stadiu II 2×. Na straně druhé je možné konstatovat, že za posledních 20 let se celkové relativní přežití zvýšilo z 3,5 na 5,4 %, tj. o necelá 2 %.
Klíčová slova:
karcinom pankreatu – multimodální terapie – populační data
Karcinom pankreatu (PC – pancreatic cancer) vykazuje v hospodářsky rozvinutých zemích od roku 1950 narůstající incidenci a s tím i spojenou mortalitu. Ve více než 80 % se jedná o duktální adenokarcinom s výraznou stromální reakcí, o koloidní nebo medulární karcinom, ve významném procentu nediferencovaný, nebo o nádor s neuroendokrinní složkou. Méně než 20 % tak připadá na cystická neoplazmata, vzácné primární tumory a na sekundární metastatická postižení. U 90 % nemocných jde o karcinom sporadický, pouze v 10 % o familiární.
Jedinou šancí na dlouhodobé přežívání pacientů s PC je multimodální léčba, ve které hraje zásadní roli radikální resekce. Ta znamená odstranit postiženou část slinivky s provedením standardní lymfadenektomie [1,2]. Při lokalizaci v hlavě pankreatu provádíme proximální pankreatoduodenektomii, při lokalizaci v těle a v kaudě levostrannou pankreatektomii se splenektomií. Podmínkou radikality je průkaz negativních okrajů resekátu a absence pozitivních lymfatických uzlin N3. Totální pankreatektomie není v současné době považována u PC za standardní výkon a je racionální u cca 10−12 % resekovaných [3,4]. Odstranění jaterních metastáz není v rámci standardní terapie indikováno. Adjuvantní chemoterapie u radikálně resekovaných představuje signifikantní prodloužení života [5].
Cílem příspěvku je odpovědět na otázku, zda můžeme současným diagnosticko-terapeutickým přístupem výrazně pozitivně ovlivnit populační data vyjadřující velmi nepříznivý vývoj způsobený narůstající incidencí a pouze mírně snižující se relativní celkovou mortalitu.
Populační data České republiky
Je odhadováno, že v roce 2030 bude PC na druhé příčce příčin úmrtí na zhoubné onemocnění v USA. PC představuje v ČR po kolorektálním karcinomu druhé nejčastější nádorové onemocnění zažívacího traktu a šesté nejčastější nádorové onemocnění vůbec. S celkovou incidencí 10 nových případů na 100 tisíc obyvatel/rok (u věkových kategorií nad 60 let však s incidencí několikanásobně vyšší) je ČR na druhém místě ve světě, těsně za Japonskem. V absolutních číslech to pro ČR představuje cca 2 200 nových případů s ročním nárůstem > 1 % [6].
Současné celkové 1leté přežití u nemocných s PC je 28,3 % a 5leté přežití pacientů všech stadií PC v posledním desetiletí dosahuje pouze 7 %. Nízké přežití dělá z PC celosvětově čtvrtou nejčastější nádorovou příčinu úmrtí, kdy mortalita je téměř totožná s incidencí a roční počet úmrtí téměř dosahuje počet úmrtí na nádory s několikanásobně vyšší incidencí (např. prostata u mužů a kolorektální karcinom u žen).
Pozdní stanovení diagnózy potvrzuje zastoupení jednotlivých klinických stadií PC v ČR, kdy převažuje IV. stadium (v 70 %) s rostoucím meziročním trendem a malé počty pacientů v ostatních stadiích onemocnění bez významnějších změn [6].
Pokročilost onemocnění, tj. stadium, ve kterém je nádor zjištěn, patří mezi hlavní faktory ovlivňující přežití u nemocných s malignitou. Zatímco u I. stadia pozorujeme u většiny diagnóz přežití pacientů téměř srovnatelné s běžnou populací, u nejpokročilejších onemocnění ve IV. stadiu je naděje na delší přežití velmi malá. Pětileté relativní přežití u nemocných s PC ukazuje graf 1, přitom relativní přežití je poměr celkového přežití a tzv. očekávaného přežití vyjadřující mortalitu v obecné populaci odpovídající sledované skupině pacientů věkem a pohlavím. Cílem výpočtu je odfiltrovat mortalitu spojenou s dalšími diagnózami.
Graph 1. 5leté relativní přežití pacientů se zhoubnými novotvary v ČR podle stadií. Zdroj: Národní onkologický registr, ÚZIS ČR.
Graph 1. 5-year relative survival of patients with malignant neoplasms in the Czech Republic by stages. Source: National Cancer Registry, IHIS CR.
Uváděné hodnoty 5letého přežití jsou věkově standardizovány. Výsledky přežití podle stadií mohou být ovlivněny změnami v definici stadií mezi jednotlivými obdobími podle platných TNM klasifikací (TNM 4 1995–2000, TNM 5 2001–2004, TNM 6 2005–2010, TNM 7 od 2011). Z tab. 1 je zřejmé, že v I. a II. stadiu onemocnění PC má pacient šanci na 5leté přežití 36, resp. 13 %. Ve III. a IV. stadiu se šance blíží 0. Celkové relativní 5leté přežití u nemocných s PC nedosahuje 6 %.
Table 1. Kohortní analýza 5tiletého přežívání podle stádií onemocnění v uvedených obdobích s uvedením celkového přežívání.
Tab. 1. Cohort analysis of 5-year survival by disease stages in the indicated ‚ periods, indicating overall survival.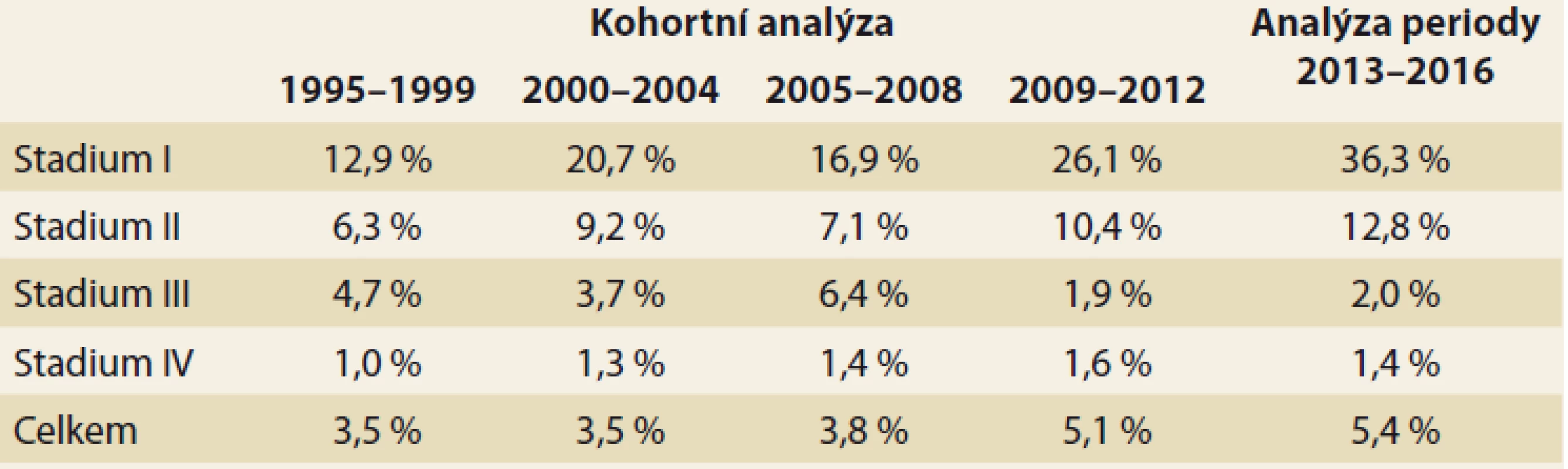
Srovnáme-li tyto údaje s přežíváním v jednotlivých stadiích u pacientů s jinými solidními tumory, je zřejmé, že žádná malignita neznamená tak tristní osud pacienta jako onemocnění karcinomem pankreatu.
V tab. 1 je ukázáno nejen přežití podle stadií v uvedených období od roku 1995, ale je zřejmý i trend zvyšujícího se přežití, a to jak podle stadií, tak i celkově. Z uvedených procent 5letého přežívání můžeme odvodit, že výrazně zvyšující se přežívání ve stadiu I a II od roku 1995 (12,9–36,3 %, resp. 6,3–12,8 %) díky narůstajícímu počtu indikací k resekci a jejímu provedení v důsledku zlepšení chirurgické techniky a perioperační péče k výraznému pozitivnímu posunu v celkovém přežití nedošlo (3,5–5,4 %).
Diskuze
PC se vyvíjí relativně pomalu v průběhu přibližně 10 let a my jej léčíme až v jeho terminální fázi. Onemocnění je třeba chápat jako systémové, nikoli pouze jako lokoregionální [7]. Nádor se navíc nešíří jen lymfatickými cévami, ale také perineurálně. Nehledě na skutečnost, že ačkoli známe rizikové faktory, symptomy, subtyp diabetu T3cDM provázející PC [8], nebyly doposud stanoveny vhodné markery onemocnění. Opakované a kombinované použití zobrazovacích vyšetření s vysokou rozlišovací schopností lze provádět pouze u vysoce rizikových skupin.
Proto rychlé určení stagingu zjištěného onemocnění je klíčové jak pro pacienta, tak pro stanovení optimální léčby v rámci multioborového týmu. Klíčové pro zhodnocení nálezu a resekability je CT dle standardního protokolu (max. 1mm řezy, 3 kontrastní fáze: parenchymatózní, arteriální, portální) bez použití orálně podané kontrastní látky. Zatímco vyslovení podezření či primární stanovení diagnózy se odehrává většinou mimo centrum, co nejpřesnější staging je úkolem tzv. high-volume center (H-V).
I tak medián přežití pacientů podstupujících resekční výkon s kurativním záměrem, doplněný adjuvantní chemoterapií, dosahuje 20−24 měsíců, 5leté přežívání 20 %, zatímco medián přežití lokálně pokročilého karcinomu pankreatu pouze 9−13 měsíců [9]. Porovnání mediánu přežívání u neresekovaných s radikálně resekovanými nemocnými proto jednoznačně hovoří ve prospěch radikálně resekovaných. Nepříznivým faktem zůstává, že resekabilních je pouze < 20 % nemocných. Nález hodnocený jako lokálně pokročilý bez vzdálených metastáz, ale primárně neresekabilní, očekávejme u 30 % pacientů. Více než 50 % tvoří pacienti s generalizovaným onemocněním [1].
Na problematiku léčby PC z hlediska dopadu na populační data a na cenu této léčby zásadně upozornil v roce 1987 Gudjonsson [10] s poukazem na jím uvedené 5leté kumulativní přežívání 3,4 %, kdy z celkového počtu 37 000 pacientů bylo resekováno 4 100 s 5letým přežitím u 154 pacientů. Stalo se tak 50 let po uznání radikální resekce hlavy pankreatu metodou podle Whippla [11], byť před ním provedli tuto operaci v jiných modifikacích Codivilla a Kausch na začátku 20. století. Ve své druhé práci stejný autor po dalších 30 letech přichází k podobnému závěru [12], a to vědomí, že klinické obory (chirurgie, anesteziologie a gastroenterologie) udělaly v posledních 30 letech krok dopředu a máme řadu uznávaných doporučených postupů [13].
Z populačních dat ČR v období 1995–2016 je jednoznačně zřejmé, že se podařilo výrazně zvýšit počet ošetřených nemocných v prvních dvou stadiích onemocnění: ve stadiu onemocnění I se zvýšilo procento 5letého přežití 3×, ve stadiu II 2×. Na straně druhé je možné konstatovat, že za posledních 20 let se celkové relativní přežití zvýšilo z 3,5 na 5,4 %, tj. o necelá 2 %.
Závěr
Příznivý vývoj v léčbě pacientů klasifikovaných v prvních dvou stadiích onemocnění za posledních 20 let málo ovlivnil šanci na dlouhodobé přežití u nemocných s nově diagnostikovaným karcinomem pankreatu v ČR. Tyto údaje korespondují s daty Gudjonssona, a to jak z roku 1987, tak i z roku 2016.
Jednoznačným závěrem z těchto zjištění je potřeba včasného záchytu onemocnění pro zajištění dobré prognózy a úspěšné léčby. Nadále zůstává pozdní diagnóza karcinomu pankreatu klíčovým problémem současnosti.
Autor nemůže při této příležitosti nezmínit, že omezené možnosti prevence a časné diagnostiky vedoucí k nálezu pokročilých stadií onemocnění při prvním kontaktu s lékařem, rekurence po radikálním resekčním výkonu, malá efektivita současné systémové protinádorové léčby a krátké přežívání (např. ve srovnání s kolorektálním karcinomem) často vedou u lékařské veřejnosti k přetrvávajícímu pocitu terapeutické beznaděje. Ta finálně vede nejen k podceňování současných terapeutických možností, ale mnohdy i ke špatné klinické praxi. Řada nemocných je dlouze vyšetřována, a tím je promarněna doba provedení resekčního výkonu [14]. Mnohdy nejsou respektovány poznatky týkající se kvality života v závislosti na zvolené léčebné metodě [15]. Z těchto důvodů nemalé procento nemocných z poskytované terapie v naší republice neprofituje. Část nemocných navíc krátký úsek zbývajícího života stráví ve zdravotnickém zařízení, ať již s komplikací málo efektivní léčby, či v marné naději na vyléčení. Neuspokojivé výsledky a ekonomická neefektivita takového postupu jsou zřejmé [16]. Na tomto místě je nutné zdůraznit, že se nejedná pouze o ČR, ale o problém celosvětový [17–19].
Poděkování prof. RNDr. L. Duškovi, Ph.D., řediteli Ústavu zdravotnických informací a statistiky ČR, za poskytnutí populačních dat.
Doručeno/Submitted: 9. 10. 2019
Přijato/Accepted: 14. 10. 2019
prof. MUDr. Miroslav Ryska, CSc.
Chirurgická klinika 2. LF UK, Praha
U vojenské nemocnice 1200
160 00 Praha 6
Sources
1. Hidalgo M. Pancreatic cancer. N Engl J Med 2010; 362 (17): 1605−1617. doi: 10.1056/NEJMra0901557.
2. Nimura Y, Nagino M, Takao S et al. Standard versus extended lymphadenectomy in radical pancreatoduodenectomy for ductal adenocarcinoma of the head of the pancreas. long-term results of a Japanese multicenter randomized controlled trial. J Hepatobiliary Pancreat Sci 2012; 19 (3): 230−241. doi: 10.1007/s00534-011-0466-6.
3. Büchler MW, Wagner M, Schmied BM et al. Changes in morbidity after pancreatic resection. toward the end of completion pancreatectomy. Arch Surg 2003; 138 (12): 1310−1314. doi: 10.1001/archsurg.138.12.1310.
4. Ryska M, Rudiš J. Total pancreatectomy for pancreatic malignancy – from history to the present day. Rozhl Chir 2016; 95 (10): 345−349.
5. Kagedan DJ, Raju RS, Dixon ME et al. The association of adjuvant therapy with survival at the population level following pancreatic adenocarcinoma resection. HPB 2016; 18 (4): 339–347. doi: 10.1016/j.hpb.2015.12.005.
6. Dušek L, Mužík L, Kubásek J et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: http: //www. svod.cz.
7. Yachida S, Jones S, Bozic I et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature 2010; 467 (7319): 1114−1117. doi: 10.1038/nature09515.
8. Cui Y, Andersen DK. Diabetes and pancreatic cancer. Endocr Relat Cancer 2012; 19 (5): F9−F26. doi: 10.1530/ERC-12-0105.
9. Seufferlein T, Bachet JB, Van Cutsem E et al. Pancreatic adenocarcinoma: ESMO–ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl 7): vii33–vii40. doi: 10.1093/annonc/mds224.
10. Gudjonsson B. Cancer of the pancreas. 50 years of surgery. Cancer 1987; 60 (9): 2284–2303. doi: 10.1002/1097-0142 (19871101) 60 : 9<2284:: aid-cncr2820600930>3.0.co; 2-v.
11. Whipple AO, Parsons WB, Mullins CR. Treatment of carcinoma of the ampulla of Vater. Ann Surg 1935; 102 (4): 763–776. doi: 10.1097/00000658-193510000-00023.
12. Gudjonsson B. Pancreatic cancer: 80 years of surgery – percentage and repetitions. HPB Surgery 2016. 6839687. doi: 10.1155/2016/6839 687.
13. Ducreux M, Cuhna AS, Caramella V et al. Cancer of the pancreas: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v56−v68. doi: 10.1093/annonc/mdv295.
14. Cooper M, Newman NA, Ibrahim AM et al. Unnecessary tests and procedures in patiens presenting with solid tumors of the pancreas. J Gastrointest Surg 2013; 17 (7): 1218−1223. doi: 10.1007/s11605-013-2213-6.
15. Ryska M, Dušek L, Pohnán R et al. Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu. Multicentrická prospektivní studie. Rozhl Chir 2012; 91 (4): 199−208.
16. Tittelbach-Helmrich D, Abegg L, Wellner U et al. Insurance costs in pancreatic surgery: does the pecuniary aspect indicate formation of centers? Chirurg 2011; 82 (2): 154–159. doi: 10.1007/s00104-010-1953-z.
17. Yeo TP. Demographics, epidemiology, and inheritance of pancreatic ductal adenocarcinoma. Semin Oncol 2015; 42 (1): 8−18. doi: 10.1053/j.seminoncol.2014.12.002.
18. Jemal A, Bray F, Center MM et al. Global cancer statistics. CA Cancer J Clin 2011; 61 (2): 69−90. doi: 10.3322/caac.20107.
19. Loveček M, Skalický P, Ryska M et al. Aktuální stav chirurgické léčby karcinomu pankreatu v České Republice. Rozhl Chir 2016; 95 (4): 151−155.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2019 Issue 5-
All articles in this issue
- Sekundární prevence kolorektálního karcinomu v České republice
- Gastrointestinální onkologie
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii
- Aktuální výsledky screeningu kolorektálního karcinomu v České republice a potenciální význam kolonické kapslové endoskopie
- Střevní příprava před koloskopií – existuje optimální příprava?
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Vliv současné léčby na populační data dlouhodobého přežívání nemocných s karcinomem pankreatu
- Divertikulární choroba tlustého střeva – nový pohled na klasifikaci a léčbu
- Mikrobiota v etiopatogenéze a liečbe symptomatickej divertikulovej choroby hrubého čreva
- Nutriční diety u gastroenterologických nemocných vyššího věku s chronickým onemocněním ledvin
- Díl V. – Příčiny úmrtí pacientů s idiopatickými střevními záněty a související časové trendy
- XXXIII. Hildebrandove bardejovské gastroenterologické dni
- Opustil nás profesor Meinhard Classen
- Výběr z mezinárodních časopisů
- Kvíz z klinické praxe
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: Gastrointestinální onkologie
- Asacol 1,6 g využívá nový technologický koncept OPTICORE™
- Papilárny adenokarcinóm žalúdka
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Střevní příprava před koloskopií – existuje optimální příprava?
- Divertikulární choroba tlustého střeva – nový pohled na klasifikaci a léčbu
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro kapslovou endoskopii
- Aktuální výsledky screeningu kolorektálního karcinomu v České republice a potenciální význam kolonické kapslové endoskopie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

