-
Medical journals
- Career
Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
Authors: Urbánek P. 1; Fraňková S. 2; Husa P. 3; Šperl J. 2; Plíšek S. 4; Rožnovský L. 5; Kümpel P. 6
Published in: Gastroent Hepatol 2019; 73(2): 101-125
Category: Hepatology: Best Practises
doi: https://doi.org/10.14735/amgh2019101Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy C (HCV) byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti (ČHS) ČLS JEP a Společnosti infekčního lékařství (SIL) ČLS JEP. Jsou založena především na doporučeních vydaných Evropskou asociací pro studium jater (EASL – European Association for the Study of the Liver) v dubnu 2018. Doporučení definují preferovaný přístup k řešení problematiky HCV infekce. V oblasti léčby chronické HCV infekce je vždy zmíněno několik variant postupu. Tato skutečnost je dána rychlým vývojem nových protivirových preparátů a jejich nerovnoměrným zaváděním do rutinní praxe v jednotlivých zemích. Preferovaný přístup k léčbě HCV infekce je vždy založen na těchto principech:
- Interferonové režimy nejsou k léčbě HCV infekce indikovány.
- Upřednostňovány jsou režimy:
- a) bez ribavirinu (RBV);
- b)pangenotypové (režimy s protivirovou účinností proti všem genotypům (GT) HCV);
- c)bez nutnosti testování rezistence na virostatika (RAS – resistance-associated substitutions).
- Je snaha o maximální zjednodušení léčby HCV infekce.
Přesné dodržování odborných doporučení je:
- a)podmínkou dosažení efektivní péče o nemocné s HCV;
- b)podmínkou snahy o dosažení kontroly HCV infekce v celostátním měřítku podle platných dokumentů Světové zdravotnické organizace (WHO – World Health Organisation).
Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
1. Úvod
Virem HCV je infikováno na světě přibližně 71 mil. lidí. HCV patří mezi nejdůležitější příčiny chronických jaterních onemocnění. Spontánní průběh onemocnění je velmi variabilní. Jaterní poškození se vyskytuje v celém možném spektru stupňů jaterní fibrózy a jaterní cirhózy, od minimálních histologických změn s minimální či žádnou jaterní fibrózou až po pokročilou jaterní cirhózu s portální hypertenzí a hepatocelulárním karcinomem (HCC – hepatocellular carcinoma).
2. Epidemiologie HCV
V ČR bylo v roce 2001 pomocí sérologického přehledu zjištěno, že prevalence protilátek anti-HCV v běžné populaci je 0,2 %. Séroprevalenční studie z roku 2015 prokázala anti-HCV reaktivitu u 1,67 % a sérovou virovou nukleovou kyselinu (HCV RNA) pozitivitu u 0,93 % vyšetřených osob. Podle novějších údajů a modelování založeného na známých klinických údajích je za reálnou považována prevalence HCV RNA pozitivity kolem 0,4–0,5 %.
Infekce HCV patří mezi krví přenosné infekce. Hlavními cestami šíření infekce jsou:
- injekční aplikace drog (po roce 1992);
- přenos krevními deriváty (před rokem 1992);
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos);
- iatrogenní přenos;
- tetování a piercing neprováděné za aseptických podmínek (zejména amatérsky);
- pravidelné dialyzační léčení (PDL);
- profesionální riziko expozice HCV;
- sexuální kontakt s osobou HCV pozitivní (častější mezi muži, kteří mají sex s muži (MSM) a při HCV/HIV koinfekci);
- rodinný kontakt s osobou HCV pozitivní;
- přenos orgánovým štěpem před rokem 1992.
Od zahájení rutinního testování krevních dárců na přítomnost infekce HCV (v roce 1992) je hlavní cestou šíření infekce rizikové chování především u nitrožilních uživatelů drog (sdílení injekčního instrumentária a parafernálií, jako jsou filtry, lžičky, kontejnery s vodou apod.). Do vysoce rizikové skupiny jsou řazeny i osoby s anamnézou nitrožilního užívání, které v daném okamžiku nepatří mezi aktivní nitrožilní uživatele (PWID – persons who inject drugs).
2.1. Prevence přenosu HCV
Základní metodou prevence přenosu HCV infekce je v současné době protivirová léčba. Protivirová léčba efektivně snižuje počet aktuálně infikovaných osob, a tím významně redukuje i riziko dalšího šíření HCV.
HCV pozitivní osoba musí být poučena, jak zabránit přenosu HCV na další osoby, zejména:
- HCV pozitivní osoba nesmí darovat krev, krevní deriváty, orgány, tkáně či sperma;
- HCV pozitivní osoba by si měla řádně ošetřit každou otevřenou ránu tak, aby nedošlo k jakékoli expozici jiné osoby infikovanou krví;
- HCV pozitivní osoba by měla být poučena, že riziko přenosu HCV sexuální cestou je malé a infekce sama o sobě není indikací k používání bariérové antikoncepce v dlouhodobém monogamním vztahu. Doporučení použití bariérové antikoncepce při náhodném sexu není tím dotčeno. Metody bezpečného sexu jsou dostatečnou prevencí přenosu;
- HCV pozitivní osoba by měla bránit i náhodnému použití svého zubního kartáčku, holicích potřeb apod. další osobou;
- HCV pozitivní osoby s adiktologickou poruchou by měly být zařazeny do programu kontrolované výměny injekčního instrumentária a všech dalších potřeb, pokud nejsou indikovány k odvykací léčbě. Protivirová léčba by u nich měla být zahájena po individuálním zvážení všech okolností, a to co nejdříve po stanovení diagnózy.
3. Přirozený průběh HCV infekce
Studie o přirozeném průběhu HCV infekce ukazují, že 55–85 % pacientů, kteří se infikují HCV, není schopno přirozeným způsobem virus eliminovat, a infekce u nich tudíž přejde do chronického stadia. U 5–20 % osob z tohoto počtu dojde během 20–25 let k rozvoji jaterní cirhózy. Osoby s jaterní cirhózou při chronické HCV infekci mají riziko rozvoje „end-stage-liver disease“ (cca 30 % během 10 let) a riziko vzniku HCC (1–2 % ročně). Faktory asociované s progresí jaterního postižení při chronické HCV infekci jsou:
- přenos infekce ve vyšším věku (riziko narůstá po 40.–45. roce věku);
- konzumace alkoholu ≥ 50 g denně;
- obezita a jaterní steatóza z jakéhokoli jiného důvodu (zejména při diabetes mellitus 2. typu);
- koinfekce HCV/HBV (hepatitis B virus) a koinfekce HCV/HIV;
- vyšší stupeň jaterního postižení nežli portální fibróza (METAVIR ≥ 2) v okamžiku stanovení diagnózy HCV infekce (pomocí některé metody neinvazivního určení stadia jaterní fibrózy).
Chronická HCV infekce je rovněž asociována s celou řadou tzv. extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinemie. Symptomatická smíšená kryoglobulinemie nebo jiná závažná forma extrahepatální manifestace HCV je jednoznačnou indikací k bezodkladnému zahájení protivirové léčby.
4. Laboratorní vyšetřovací metody
4.1. Sérologické detekční metody
Jedná se sérologickou detekci anti-HCV protilátek. Technicky se jedná o detekci protilátek metodou EIA či některých jejích variant. V současné době se používají metody 3. generace, které mají senzitivitu 97 % a specificitu až 99 %.
Protilátky jsou markerem expozice – kontaktu dané osoby s HCV. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organizmu. U osob se spontánní eliminací viru či u osob po úspěšné protivirové léčbě jakéhokoli typu přetrvává séroreaktivita anti-HCV dlouhodobě. Pouze u některých osob dochází v čase k poklesu jejich titru a následně k jejich vymizení. Anti-HCV jsou detekovatelné u naprosté většiny osob infikovaných HCV. Výjimečně se lze setkat s negativním anti-HCV nálezem u pacientů v časné fázi po expozici HCV (časná akutní HCV infekce) či u hluboce imunosuprimovaných osob.
4.2. Molekulárně genetické metody
Molekulárně genetické metody prokazují přítomnost HCV RNA v séru či tkáních infikovaného jedince. Největšího rozšíření v současné době dosáhla metoda polymerázové řetězové reakce v reálném čase (RT-PCR – real time polymerase chain reaction). Koncentrace HCV RNA v biologických tekutinách se udává v IU/ml.
Kvantitativní stanovení HCV RNA v krvi by standardně mělo být prováděno metodu s dolním limitem detekce ≤ 15 IU/ml. Protože řada laboratoří používá metody na stanovení HCV RNA, jejichž dolní limit detekce nedosahuje této hodnoty (je vyšší), je třeba, aby lékař zadávající vyšetření v souvislosti s hodnocením terapie dle těchto standardních postupů požadoval na laboratoři informaci, že citlivost jejich stanovení splňuje uvedený limit.
Součástí molekulárně genetického vyšetření by mělo být i stanovení GT a subtypu HCV. Genotypizace je důležitá z pohledu rozdílných léčebných postupů u jednotlivých GT HCV.
5. Screening HCV infekce
Velká část osob infikovaných HCV v tuto chvíli neví, že by mohla být infikována. Identifikace infikovaných osob je přitom jednou ze základních podmínek efektivní péče o toto onemocnění a je také jednou ze základních podmínek úspěšné snahy o dosažení kontroly HCV infekce v ČR, ale i v celosvětovém měřítku. Tato snaha má oporu jak v dokumentech WHO, tak i v dokumentech Evropské komise. V průběhu roku 2018 byla ze strany ČHS ČLS JEP a SIL ČLS JEP zahájena jednání s relevantními orgány v ČR tak, aby se dosažení kontroly HCV infekce stalo jednou z priorit zdravotní péče ČR. V současné době je kontrola HCV infekce uznanou prioritou ze strany Ministerstva zdravotnictví ČR.
V ČR nejsou k dispozici data, která by mohla odůvodnit uskutečnění populačního screeningu HCV infekce. Základním postupem screeningu HCV infekce je proto identifikace rizikových skupin, ve kterých lze očekávat kumulaci infikovaných osob. Rizikové skupiny jsou definovány především expozicí některému z rizikových faktorů přenosu HCV infekce. Efektivního screeningu lze dosáhnout pouze cestou plné informovanosti a především aktivního zapojení lékařů primární péče a specialistů, kteří se podílejí na péči o pacienty ve vysoce rizikových skupinách, do programů. Součástí snahy o efektivní screening HCV infekce musí ale také být snaha o větší informovanost veřejnosti tak, aby i laik byl schopen sám sebe identifikovat jako osobu v riziku přenosu HCV.
Screeningovým vyšetřením HCV infekce je vyšetření anti-HCV protilátek. Anti-HCV protilátky by měly být vyšetřeny u všech osob, u kterých je podezření, že byly někdy v průběhu života exponovány některému z rizikových faktorů přenosu HCV. Na základě znalostí o možnostech přenosu je doporučováno testování HCV infekce zejména u těchto skupin osob:
- osoby s anamnézou adiktologické poruchy (nejen nitrožilní uživatelé drog);
- osoby ve skupinách s vysokou prevalencí HCV infekce:
- příjemci krve a krevních derivátů či příjemci orgánových transplantátů před rokem 1992,
- HIV pozitivní osoby,
- hemofilici, zejména ti, kteří byli léčeni koagulačními faktory před rokem 1987,
- osoby s anamnézou hemodialýzy (i akutní a krátkodobé),
- osoby s nevysvětlitelnou elevací aminotransferáz,
- děti narozené HCV pozitivním matkám (testování je indikováno až po 18. měsíci věku);
- zdravotničtí pracovníci a další osoby s anamnézou poranění injekční jehlou (bez ohledu na sérologický stav event. zdroje) nebo osoby se slizniční expozicí krvi HCV pozitivní osoby;
- sexuální partneři HCV pozitivní osoby;
- osoby vystavené invazivním lékařským zákrokům, osoby s anamnézou komplikovaného chirurgického výkonu nebo osoby s anamnézou dlouhodobější hospitalizace (rizika iatrogenního přenosu).
Je-li vyšetřovaná osoba anti-HCV pozitivní, nelze očekávat vymizení anti-HCV protilátek ani po spontánní či léčbou navozené eliminaci viru, a proto není žádná indikace k opakování vyšetření anti-HCV kdykoli v budoucnosti. Sérologická pozitivita anti-HCV protilátek pouze indikuje expozici HCV v minulosti a nekoreluje se žádnou z charakteristik onemocnění (s pokročilostí jaterního postižení, s pravděpodobností dosažení vyléčení apod.). Každá anti-HCV pozitivní osoba musí být vyšetřena specialistou. Dalším krokem následujícím po pozitivním anti-HCV testování je stanovení sérové HCV RNA. Pouze viremické osoby jsou považovány za osoby infikované HCV.
Mezi doporučované a akceptované metody screeningu patří užití tzv. rychlých diagnostických testů (RDT). Jedná se o diagnostické soupravy (kity), které detekují anti-HCV nejen v plné krvi či plazmě, ale také v kapilární krvi odebrané z bříška prstu nebo v orální (krevikulární) tekutině. Vyráběny jsou v různé podobě, svým provedením a jednoduchostí použití připomínají známější gravitesty. Vyšetření pomocí RDT nevyžaduje žádné zpracování odebraného tekutiny (centrifugaci apod.). Vyšetření může být provedeno při pokojové teplotě a nevyžaduje ani žádné speciální školení personálu, který s RDT pracuje. V ČR bylo v poslední době uskutečněno několik projektů s užitím RDT u klientů adiktologických pracovišť a osob odsouzených k výkonu trestu odnětí svobody.
Z výše uvedených doporučení vyplývá, že identifikace HCV infikovaných osob je dvoustupňový proces: 1. stupeň = detekce anti-HCV, 2. stupeň = detekce sérové HCV RNA. Z dosavadních zkušeností a z charakteristik jednotlivých rizikových skupin vyplývá riziko, že řada pozitivně anti-HCV testovaných osob již nikdy nepokročí k druhému stupni – k testování HCV RNA. V poslední době proto byly vyvinuty i metody rychlého testování HCV RNA v kapce krve. Jejich rozšíření v současné době brání poměrně vysoká cena. Tyto metody mají většinou vyšší dolní limit detekce než běžně používané metody typu RT-PCR (kolem 1 000 IU/ml). V ČR s tímto typem testování nejsou dosud žádné zkušenosti.
6. Diagnostická kritéria
Diagnóza akutní i chronické HCV infekce je založena na pozitivní detekci HCV RNA v séru či plasmě vyšetřované osoby. K detekci HCV RNA jsou používány senzitivní kvalitativní či kombinované kvalitativní i kvantitativní molekulární detekční techniky. Za optimální jsou považovány metody s dolním limitem detekce ≤ 15 IU/ml.
6.1. Akutní HCV infekce
Akutní HCV infekce je diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu HCV infekce.
Spolehlivě lze stanovit diagnózu akutní HCV infekce pouze tehdy, je-li dokumentována nedávná sérokonverze na anti-HCV reaktivitu. Příčinou je skutečnost, že neexistuje sérologický marker akutní infekce HCV. O akutní HCV infekci lze také hovořit v případech, kdy jsou klinické příznaky v souladu s obrazem akutní hepatitidy. Jde především o tyto příznaky:
- sérová hladina alaninaminotransferázy (ALT) > 10× horní hranice normy;
- ikterus;
- nejsou známky chronického jaterního onemocnění nebo jiné možné příčiny akutní hepatitidy.
Pozitivním momentem může být i identifikace možného rizikového faktoru přenosu infekce HCV. Ve fázi akutní infekce je pozitivní sérová HCV RNA, nicméně během akutní fáze infekce byla popsána krátká období negativity sérové HCV RNA. Jedno negativní vyšetření sérové HCV RNA tedy diagnózu HCV infekce nevylučuje a také nemusí znamenat v konkrétním případě spontánní eliminaci viru. Stanovení HCV RNA je třeba opakovat. Vhodný interval mezi vyšetřeními HCV RNA k potvrzení eliminace viru je 12 a 24 týdnů od vzniku podezření.
Většina pacientů s akutní HCV infekcí je asymptomatická, pravděpodobnost přechodu do chronicity je vysoká (50–90 %). Ikterický průběh, ženské pohlaví, mladý věk a polymorfizmy genu IL28B jsou faktory asociované se spontánní eliminací HCV.
6.2. Chronická HCV infekce
Diagnóza chronické HCV infekce je založena na pozitivním průkazu sérové HCV RNA a anti-HCV protilátek v přítomnosti biochemických nebo histologických známek chronické hepatitidy (alternativou histologických změn je neinvazivní průkaz fibrózy jater). V případech akutní HCV infekce prakticky nedochází k eliminaci viru po více než 4–6 měsících od přenosu, proto může být pro definici chronické HCV infekce užit i tento časový parametr.
6.3. Reinfekce
Reinfekce se může objevit jak po spontánní eliminaci HCV, tak po úspěšné protivirové léčbě. Takřka výlučně nastává reinfekce u osob, které jsou ve vysokém riziku opakované expozice. Reinfekce je definována jako znovu vzniklá pozitivita sérové HCV RNA u osoby, která byla předtím klasifikována jako setrvalá virologická odpověď (SVR – sustained virologic response) SVR12 či SVR24 (viz dále). Diagnózu reinfekce podporuje průkaz jiného HCV genotypu než při první infekci nebo průkaz jiného, fylogeneticky vzdáleného řetězce HCV v případech infekce stejným HCV genotypem.
7. Cíle terapie chronické infekce HCV
Cílem terapie je vyléčení HCV infekce – trvalá eliminace viru. Eliminace viru znamená:
- snížení až vymizení rizika rozvoje jaterních i mimojaterních komplikací HCV infekce, vč. pokročilé jaterní fibrózy, cirhózy, dekompenzované cirhózy a HCC;
- zvýšení kvality života vyléčené osoby a zbavení původně infikované osoby řady zbytečných stigmat (odmítání zdravotní péče, odmítání ze strany zaměstnavatelů atd.);
- prevenci dalšího šíření HCV infekce.
Eliminací infekce se rozumí dosažení SVR, která je definována jako negativní sérová HCV RNA ve 12. (SVR12) nebo 24. týdnu (SVR24) po skončení protivirové léčby. SVR12 a SVR24 spolu korelují v 99 % případů. Podle dlouhodobých studií SVR v 99 % případů znamená trvalé vyléčení HCV infekce, tj. u osob se SVR nedochází k pozdním relapsům onemocnění. K posouzení SVR je nutno použít metodu detekce HCV RNA s dolním limitem detekce ≤ 15 IU/ml.
U osob se SVR dochází k významnému snížení jaterní morbidity i mortality. Pacienti s pokročilou jaterní fibrózou (METAVIR F3) jaterní cirhózou (METAVIR F4), u nichž bylo dosaženo SVR12/SVR24, mají významně snížené riziko dekompenzace cirhózy a rozvoje HCC. Minimální riziko rozvoje HCC však trvá, proto je u těchto osob indikována standardní surveillance HCC.
8. Vyšetření před zahájením protivirové léčby
Před zahájením protivirové léčby je nezbytné:
- odebrat podrobnou anamnézu protivirové léčby (zejména u osob již v minulosti léčených virostatiky);
- stanovit pokročilost jaterního onemocnění;
- vyšetřit vstupní virologické parametry, které mají vztah k volbě protivirové léčby.
Důvodem nutnosti stanovit stupeň pokročilosti jaterního onemocnění je především snaha identifikovat osoby s jaterní cirhózou či pokročilou (přemosťující) fibrózou. Vstupní stadium fibrózy definuje dlouhodobou prognózu onemocnění a také doporučení týkající se sledování po úspěšném skončení protivirové léčby (dosažení SVR).
I pacienti s trvale normální aktivitou ALT mohou mít významnou fibrózu, i u těchto osob je proto indikováno vyšetření pokročilosti postižení.
8.1. Jiné příčiny jaterního onemocnění
U každého pacienta s chronickou HCV infekcí by měla být provedena vyšetření, která umožňují odhalit jiná jaterní onemocnění nebo faktory ovlivňující vývoj HCV infekce. Jedná se zejména o:
- vyšetření sérologie HBV a HIV (HBsAg, anti-HBs, anti-HBc, anti-HIV1 a anti-HIV2);
- posouzení vlivu příjmu alkoholu;
- základní vyšetření jaterních autoimunitních onemocnění;
- vyšetření možného podílu genetických a metabolických jaterní onemocnění (hereditární hemochromatóza, diabetes, obezita);
- posouzení možné hepatotoxicity současně podávaných léků.
Osobám s HCV infekcí, které nejsou účinně chráněny proti HBV infekci či viru hepatitdy A (HAV), by měla být ve vhodný okamžik nabídnuta vakcinace. Ošetřující lékař by měl u každé HCV pozitivní osoby kvantifikovat příjem alkoholu. Každý pacient by měl být poučen o nebezpečí vyplývajících z jeho nadbytečného příjmu. Lékař specialista by měl také aktivně pátrat po možných mimojaterních projevech chronické HCV infekce. Samozřejmostí je maximální snaha o verifikaci či vyloučení významné komorbidity, zejména se jedná o onemocnění kardiovaskulárního aparátu, onemocnění ledvin, autoimunitní onemocnění, diabetes mellitus 2. typu a metabolická onemocnění jater.
8.2. Stanovení pokročilosti jaterního postižení
Před protivirovou léčbou by měl být stanoven stupeň pokročilosti jaterního postižení, tj. stupeň jaterní fibrózy (stage). Zvláštní důležitost má identifikace pacientů s jaterní cirhózou nebo přemosťující fibrózou, protože jejich dlouhodobá prognóza po skončení léčby je dána právě tímto výchozím stupněm postižení. Pacienti s jaterní cirhózou jsou i po úspěšné protivirové léčbě indikováni k doživotní dispenzarizaci a surveillance HCC. U pacientů s klinicky jasnou jaterní cirhózou není třeba verifikovat stupeň fibrózy. U pacientů s jaterní cirhózou by měla být provedena vyšetření směřující k průkazu či vyloučení přítomné portální hypertenze. Normální hladiny ALT nevylučují přítomnost významné jaterní fibrózy.
Referenční metodou pro stanovení pokročilosti onemocnění byla po mnoho let jaterní biopsie. Umožňuje hodnocení zánětlivé aktivity (grading) i stupně fibrózy (staging). V současné době již nelze na základě mnoha publikovaných výsledků a studií indikovat jaterní biopsii pouze za účelem posouzení fibrózy jater a je nutno indikovat pouze provedení neinvazivního stanovení stupně jaterní fibrózy. Nejširšího uplatnění na tomto poli dosáhly metody měření tuhosti jater, které mají v případech chronické HCV infekce akceptovatelnou výpovědní hodnotu. Jejich užití je u pacientů s chronickou HCV infekcí doporučováno i pro hodnocení rizika přítomnosti významné portální hypertenze.
Metody hodnocení jaterní tuhosti nalezly velkého rozšíření i v ČR. Je nicméně třeba určité zkušenosti při jejich použití, existuje řada faktorů, které mohou jejich výsledky ovlivnit (výsledek je většinou falešně nadhodnocen), např. obezita, vysoká sérová aktivita ALT, vyšetření po jídle.
Ke stanovení pokročilosti onemocnění lze užít i stanovení sérových koncentrací přímých biomarkerů jaterní fibrózy (jedná se většinou o látky spojené s metabolismem kolagenu, který je hlavní součástí extracelulární matrix). Pomocí stanovení těchto parametrů jsou poté počítána složitými (a někdy neveřejnými) algoritmy jednotlivá skóre, z nichž lze usuzovat na stupeň pokročilosti fibrózy. Tato vyšetření jsou však spolehlivá pouze v diskriminaci jaterní cirhóza vs. non-cirhóza. K hodnocení jednotlivých stadií jaterní fibrózy se nehodí. Tyto sérologické metody většího uplatnění v ČR dosud nenalezly. Odborné společnosti stále vedou jednání o stanovení úhrady pro součásti tzv. ELF test (Enhanced Liver Fibrosis Blood Test) jako v tuto chvíli jediného přímého sérologického skórovacího systému pro určení závažnosti jaterního postižení při chronické HCV infekci. Kombinace vyšetření tuhosti jater a krevních biomarkerů jaterní fibrózy zvyšuje přesnost hodnocení pokročilosti jaterního procesu.
V případech, kdy jsou dostupná vyšetření stadia jaterní fibrózy rozporná, případně u osob, kdy existuje podezření na spoluúčast jiných faktorů než HCV infekce při progresi jaterní fibrózy (HBV, metabolický syndrom, autoimunitní onemocnění, abúzus alkoholu atd.), je i nadále indikace k provedení jaterní biopsie.
8.3. Virologické parametry
8.3.1. Kvantifikace HCV RNA
Stanovení viremie (koncentrace HCV RNA v séru či v plné krvi, vyjádřeno jako IU/ml) je indikováno u osob s navazující protivirovou léčbou. Dolní detekční limit použité techniky by měl být ≤ 15 IU/ml.
8.3.2. Určení genotypu HCV
Stanovení GT a u GT1 i subtypu (1a či 1b) si stále ponechává svůj význam pro určení léčebného režimu a délky jeho trvání. Genotypizace a subtypizace u GT1 má být provedena pomocí techniky používající sekvence 5’ nepřekládané oblasti virového genomu společně s jednou sekvencí z kódující části genomu HCV (nejčastěji oblasti Core nebo NS5B).
8.3.3. Testování lékové rezistence
V současné době není dostupný žádný standardizovaný test pro testování rezistence HCV na existující virostatika. Testování rezistence proto spoléhá na nejrůznější „in-house“ varianty techniky populačního či hlubokého sekvenování. V ČR je testování dostupné pouze v několika laboratořích, vlastní provedení může být velmi složité (zejména u HCV GT jiných než 1 a 4) a spolehlivost těchto technik je rovněž velmi různorodá.
V současné době není systematické testování výskytu lékových rezistencí doporučováno. Je to především z těchto důvodů:
- techniky jsou obtížně dostupné, interpretace jejich výsledku není standardizována, není jednotná;
- jsou dostupné vysoce účinné lékové kombinace, a to i pro pacienty, u nichž jsou varianty HCV asociovány s rezistencí prokazatelnou před zahájením protivirové léčby.
Testování je možné doporučit u osob, u kterých došlo k selhání první protivirové léčby s použitím vysoce účinných kombinací přímo působících virostatik. Tyto osoby by měly být léčeny v centrech majících k testování přístup a zkušenost s jeho interpretací. I v těchto případech by měla být testována pouze oblast NS5A, cíl inhibitorů NS5A. Test by měl být založen na populačním sekvenování a výsledek by měl být reportován jako „RAS je přítomna“ či „RAS je nepřítomna“. Použít lze i hluboké sekvenování s cut-off limitem 15 % (protože bylo prokázáno, že pouze RAS, které jsou přítomny u více než 15 % sekvencí mají klinický význam). Použitý test by měl dále spolehlivě sekvenovat oblast kódující pořadí aminokyselin v pozicích NS5A 24–93. Testování přítomnosti RAS však není nutnou podmínkou pro zahájení léčby antivirovými léky (DAA – direct-acting antivirals) (tab. 1).
Table 1. Klinicky významné substituce oblasti NS5A asociované s rezistencí.
Tab. 1. Clinically significant NS5A substitutions associated with resistance to antivirals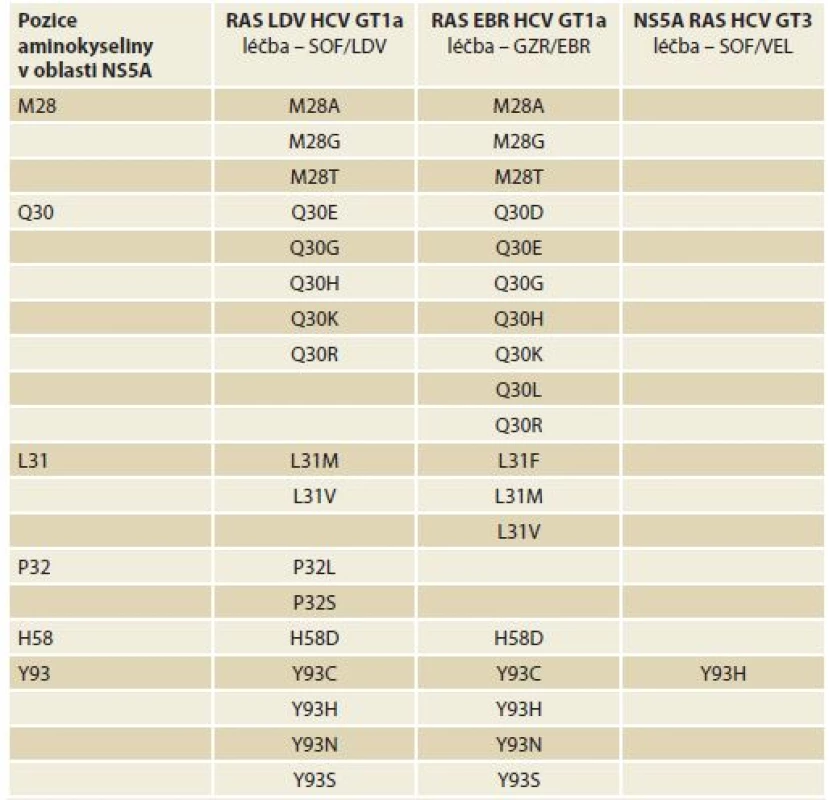
SOF – sofosbuvir, LDV – ledipasvir, VEL – velpatasvir, GZR – grazoprevir, EBR – elbasvir, GT – genotyp, HCV – virus hepatitidy C, RAS – rezistence na virostatika 9. Indikace zahájení terapie – kdo by měl být léčen?
Všichni pacienti s chronickou HCV infekcí, dosud protivirově neléčení, v minulosti léčení neúspěšně (tj. bez dosažení SVR), kteří léčeni chtějí být a nemají žádnou kontraindikaci léčby, jsou kandidáty protivirové terapie. Léčba by měla být bezodkladně poskytnuta pacientům s významnou fibrózou (METAVIR skóre F2 nebo F3) a s jaterní cirhózou (METAVIR F4), vč. dekompenzované cirhózy.
Další indikace k bezodkladnému zahájení léčby jsou:
- pacienti s projevy mimojaterního postižení (symptomatická kryoglobulinemie nebo HCV-asociovaná imunokomplexová nefropatie, HCV asociované non-Hodgkinské lymfomy aj.);
- pacienti s rekurencí HCV po transplantaci (Tx) jater;
- pacienti ve vysokém riziku rychlé progrese jaterní fibrózy při komorbiditách (zejména osoby po orgánových Tx, po Tx kostní dřeně, diabetici, osoby s HBV/HCV duální infekcí);
- osoby představující epidemiologické riziko – aktivní uživatelé drog, MSM, ženy plánující graviditu, pacienti v PDL. Osoby aktivně užívající drogy a MSM by měly být poučeny o možných rizicích reinfekce po úspěšné terapii a měly by souhlasit s účastí v preventivních programech různého typu.
Osoby s dekompenzovanou cirhózou a MELD skóre ≥ 18–20 bodů by měly nejdříve podstoupit Tx jater a teprve poté protivirovou léčbu, protože pravděpodobnost reparace jaterních funkcí a dlouhodobé přežití bez Tx je velmi nízká. Osobám s pokročilou jaterní cirhózou je věnována pozornost v kapitole 12.
Léčba není indikována u pacientů, jejichž přežití je limitováno přidruženým onemocněním.
10. Kontraindikace zahájení terapie chronické HCV infekce
Kontraindikací léčby s použitím DAA je velmi málo. Použití induktorů cytochromu P450 a P-glykoproteinu (P-gp), jako je karbamazepin a fenytoin, je kontraindikováno při léčbě jakýmkoli režimem DAA. Důvodem je významný pokles sérových koncentrací virostatik, která tak ztrácejí svou účinnost. Zvýšené riziko lékové toxicity je při podání režimů obsahujících NS3-4A inhibitory (paritaprevir/ritonavir, grazoprevir (GZR), glekaprevir (GLE), voxilaprevir (VOX)) u pacientů s dekompenzovanou jaterní cirhózou, Child-Pugh B nebo C. Opatrnosti je třeba při použití sofosbuviru (SOF) u osob s renální insuficiencí (eGFR – estimated glomerular filtration rate < 30 ml/min/1,73 m2). V této indikaci by měl být režim obsahující SOF použit, pouze pokud není bezpečnější alternativa. Nejdůležitější lékové interakce ukazují tab. 2 a 3.
Table 2. Lékové interakce mezi přímo působícími virostatiky a imunosupresivy.
Tab. 2. Drug interactions between directly acting virostatics and immunosuppressives.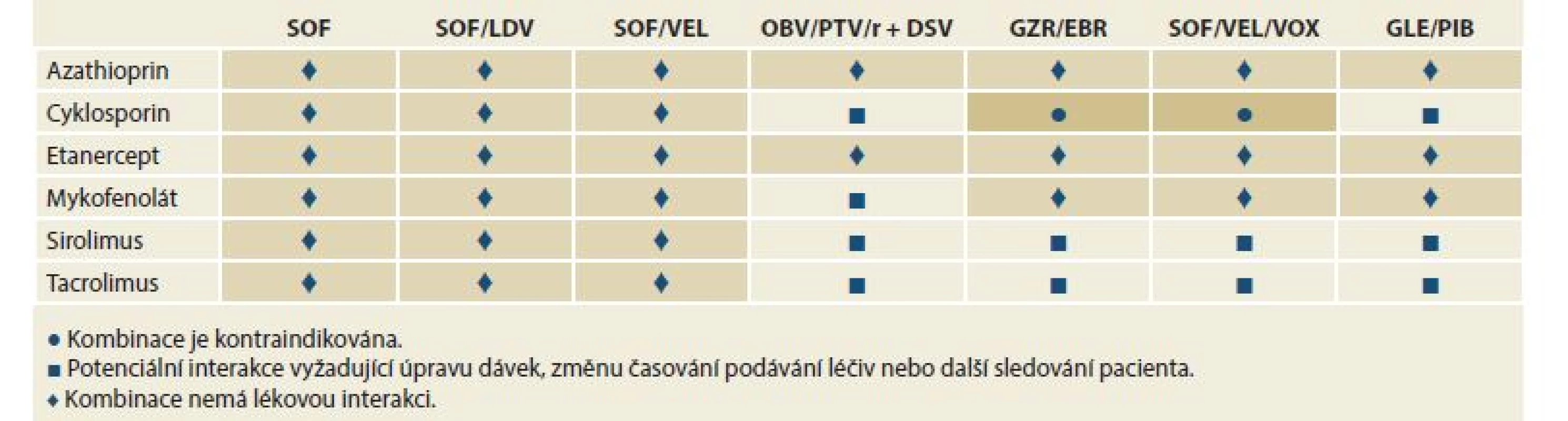
SOF – sofosbuvir, LDV – ledipasvir, VEL – velpatasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritomavir, DSV – dasabuvir, GZR – grazoprevir, EBR – elbasvir, VOX – voxilaprevir, GLE – glekaprevir, PIB – pibrentasvir Table 3. Lékové interakce mezi přímo působícími virostatiky a antiagregancii a antikoagulancii.
Tab. 3. Drug interactions between directly acting virostatic drugs, antiaggregants and anticoagulants.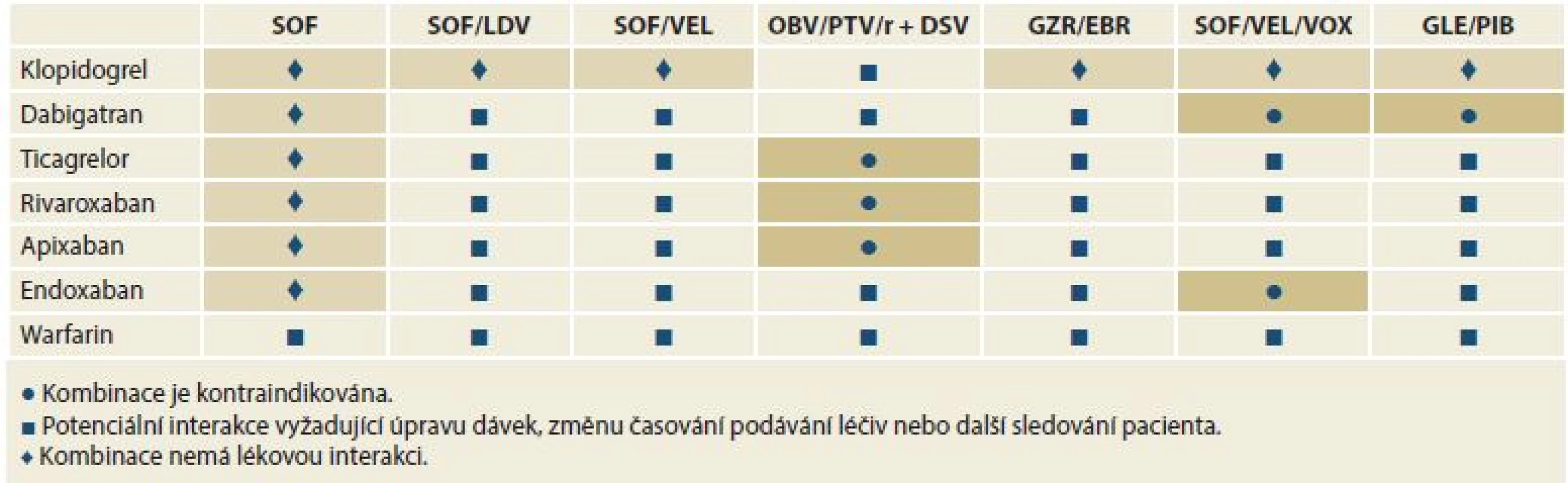
SOF – sofosbuvir, LDV – ledipasvir, VEL – velpatasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritomavir, DSV – dasabuvir, GZR – grazoprevir, EBR – elbasvir, VOX – voxilaprevir, GLE – glekaprevir, PIB – pibrentasvir 11. Dostupná protivirová léčiva
11.1. Sofosbuvir
Sofosbuvir (SOF), nukleotidový NS5B inhibitor, je syntetický inhibitor (analog uridinu) virové RNA dependentní RNA polymerázy (RdRp, produkt NS5B oblasti virové genomu). SOF je prodrug, který je intracelulárně trifosforylován, a následně je pomocí RdRp inkorporován do HCV RNA. Mechanizmem účinku je tzv. ukončení řetězce, kdy po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. SOF je účinný u všech hlavních nejrozšířenějších GT HCV (1–6), neinterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy.
SOF není metabolizován systémem cytochromu, potenciál lékových interakcí je tedy mnohem omezenější než u virostatik nižších generací. SOF je substrátem lékového transportéru P-gp a „breast cancer resistance protein“ (BCRP), jeho aktivní metabolit však nikoli. Potentní induktory P-gp ve střevě (rifampicin, karbamazepin a fenytoin) snižují plazmatickou hladinu SOF, snižuje se tedy i intracelulární přítomnost aktivního metabolitu a dochází ke snížení protivirové účinnosti SOF. Naopak inhibitory P-gp/BCRP zvyšují plazmatickou hladinu SOF, avšak nikoli aktivního metabolitu, takže SOF může být s inhibitory podáván současně. SOF v kombinaci s jinými DAA je kontraindikován u pacientů léčených amiodaronem pro riziko maligních arytmií. Nebezpečí prohloubení bradyarytmie při současném podávání amiodaronu se objevuje během několika hod až 2 týdnů po zahájení terapie SOF. Maligní arytmie byly popsány dokonce i v případech, kdy odstup od ukončení amiodaronu do zahájení léčby SOF byl několik měsíců. Z tohoto důvodu je doporučováno po vysazení amiodaronu vyčkat do zahájení podávání SOF min. 3 měsíce (pokud pacient již nemá implantován trvalý kardiostimulátor). Mechanizmus této lékové interakce není dosud znám. Potenciál závažných lékových interakcí u dalších baradykardizujících léků (např. β-blokátory) je nejistý.
V současné době nejsou dostupná data, která by umožnila definovat snížení dávkování SOF u pacientů s těžkou renální insuficiencí (eGFR < 30 ml/min/1,73 m2) nebo dokonce s konečným stadiem onemocnění ledvin. Přesto se objevují data o bezpečném užití SOF u pacientů s takto pokročilým onemocněním ledvin (eGFR < 30 ml/min/1,73 m2 nebo u pacientů v PDL).
SOF je vyráběn ve formě potahované tablety obsahující 400 mg účinné látky. Celková denní dávka je 400 mg, tj. 1 tbl denně. Dostupný lék Sovaldi® (Gilead Sciences, USA).
11.2. Fixní kombinace SOF a ledipasviru
Tato kombinace je dostupná ve formě 1 tablety obsahující 400 mg SOF a 90 mg ledipasviru (LDV). Celková denní dávka je 1 tbl denně. Dostupný lék Harvoni® (Gilead Sciences, USA).
Potenciál lékových interakcí závisí na interakcích každé součásti kombinace. SOF byl detailně probrán výše. LDV je NS5A inhibitorem a je transportován podobně jako SOF, tj. na jeho transportu se účastní P-gp a BCRP. Lékové interakce jsou proto velmi podobné. LDV je v nezměněné podobě vylučován žlučí, ledvinami je vyloučeno pouze 1 % celkového množství. Mezi rizikovou konkomitantní medikaci lze zařadit digitalis, dabigatran, aliskerin, amlodipin, buprenorfin, carvedilol a cyklosporin. Podání amiodaronu je striktně kontraindikováno (viz výše). Podání kombinace SOF/LDV není doporučováno současně s rosuvastatinem, interakce s ostatními statiny nelze jednozančně vyloučit. Plazmatické koncentrace LDV jsou snižovány při současném podání léků snižujících aciditu žaludku – antacida, H2-blokátory a inhibitory protonové pumpy (IPP). H2-blokátory lze podat současně s protivirovou kombinací nebo ve 12hodinovém odstupu v dávce ekvivalentní 40 mg famotidinu. IPP lze podat současně s protivirovou kombinací v dávce ekvivalentní 20 mg omeprazolu. SOF/LDV lze použít se všemi antiretrovirovými léky. Opatrnosti je třeba při současném podávání SOF/LDV a tenofovir disoproxil fumarátu při současném podání kombinací obsahujících farmakokinetické enhancery ritonavir a cobicistat. V těchto případech je třeba pečlivě monitorovat renální funkce.
V případě fixní kombinace SOF a LDV není třeba redukce dávky u pacientů s mírnou či středně závažnou renální insuficiencí. Bezpečnost podání nebyla dosud zkoumána u pacientů s poklesem eGFR < 30 ml/min/1,73m2 a u pacientů se selháním ledvin vyžadujícím hemodialýzu. Nicméně i v této indikaci se v poslední době objevují pozitivní bezpečnostní data. Pro pacienty s lehkou a středně těžkou renální insuficiencí není třeba redukovat běžnou doporučovanou dávku kombinace SOF/LDV, žádné doporučení k redukci nelze dát u pacientů s těžkou renální insuficiencí (eGFR < 30 ml/min/1,73 m2) nebo u pacientů v PDL. V těchto případech by měly být použity přednostně pangenotypové režimy, jejichž součásti nejsou eliminovány ledvinami.
11.3. Fixní kombinace SOF a velpatasviru
Fixní kombinace SOF a velpatasviru (VEL) je dostupná ve formě 1 tablety obsahující 400 mg SOF a 100 mg VEL. Dostupný lék Epclusa® (Gilead Sciences, USA). Doporučená dávka je 1 tbl denně s jídlem nebo nalačno.
VEL (NS5A inhibitor) je inhibitorem lékového transportéru P-gp a BCRP a transportních molekul v bazolaterální membráně hepatocytu OATP1B1 a OATP1B3. VEL je substrátem CYP2B6, CYP2C8 a CYP3A4 s pomalým metabolizmem. Po jedné dávce 100 mg VEL značeného izotopem 14C byla většina aktivity (> 98 %) v plazmě tvořena nezměněnou mateřskou látkou. Nezměněný VEL je také hlavní složkou přítomnou ve stolici. Hlavní cestou eliminace VEL je biliární exkrece. Biologický poločas VEL po jeho podání v rámci kombinace se SOF je přibližně 15 hod. U pacientů s jaterní cirhózou, a to ani dekompenzovanou, nedochází ke změnám farmakokinetických parametrů VEL. Klinicky nevýznamné změny farmakokinetiky byly prokázány u pacientů s těžkou renální insuficiencí (eGFR < 30 ml/min/1,73 m2).
Současné podávání kombinace SOF/VEL s léčivými přípravky, které jsou substráty výše zmíněných transportérů, může zvýšit expozici (a toxické účinky) takových léčivých přípravků. Nositelem většiny lékových interakcí je VEL, potenciál lékových interakcí SOF je minimální. Z praktického hlediska je třeba upozornit na tyto problematické lékové skupiny či léčiva:
- Současné podávání s IPP se nedoporučuje. Důvodem je skutečnost, že při vyšším pH klesá rozpustnost VEL, a tím jeho biologická dostupnost. Je-li současné podávání považováno za nezbytné, kombinaci SOF/VEL je třeba podávat s jídlem a užít ji 4 hod před podáním IPP v maximálních dávkách odpovídajících 20 mg omeprazolu.
- Současné podání kombinace SOF/VEL a amiodaronu či digoxinu vede ke zvýšení koncentrací a toxicity obou antiarytmik. Proto je třeba během současného podávání těchto léčiv pacienty velmi pečlivě monitorovat.
- Současné podávání kombinace SOF/VEL a dabigatranu zvyšuje riziko krvácivých příhod. Kombinovat SOF/VEL s dabigatranem je proto možné, pouze není-li jiná alternativa, a to ještě za bezprostředního sledování pacienta.
- Současné podání kombinace SOF/VEL a carbamazepinu, rifampicinu, fenobarbitalu a fenytoinu je považováno za kontraindikované.
Léčivé přípravky, které jsou středně silnými induktory střevního P-gp (např. oxcarbazepin, modafinil nebo efavirenz), mohou snižovat koncentraci SOF nebo VEL v plazmě a vést k poklesu terapeutického účinku jejich kombinace. Současné podávání takových léčivých přípravků s přípravkem Epclusa® se nedoporučuje. Současné podávání s léčivými přípravky, které inhibují P-gp nebo BCRP, může zvýšit plazmatické koncentrace SOF nebo VEL. Léčivé přípravky, které inhibují OATP, CYP2B6, CYP2C8 nebo CYP3A4, mohou zvyšovat plazmatické koncentrace VEL. Klinicky významné interakce léčivých přípravků s kombinací SOF/VEL zprostředkované inhibitory P-gp, BCRP, OATP nebo CYP450 se nepředpokládají. Nejdůležitější interakce kombinace SOF/VEL s některými běžně užívanými léčivy s obvyklou barevnou legendou ukazuje tab. 4.
Table 4. Lékové interakce mezi přímo působícími virostatiky a kardivaskulárními léčivy.
Tab. 4. Drug interactions between directly acting virostatics and cardivascular drugs.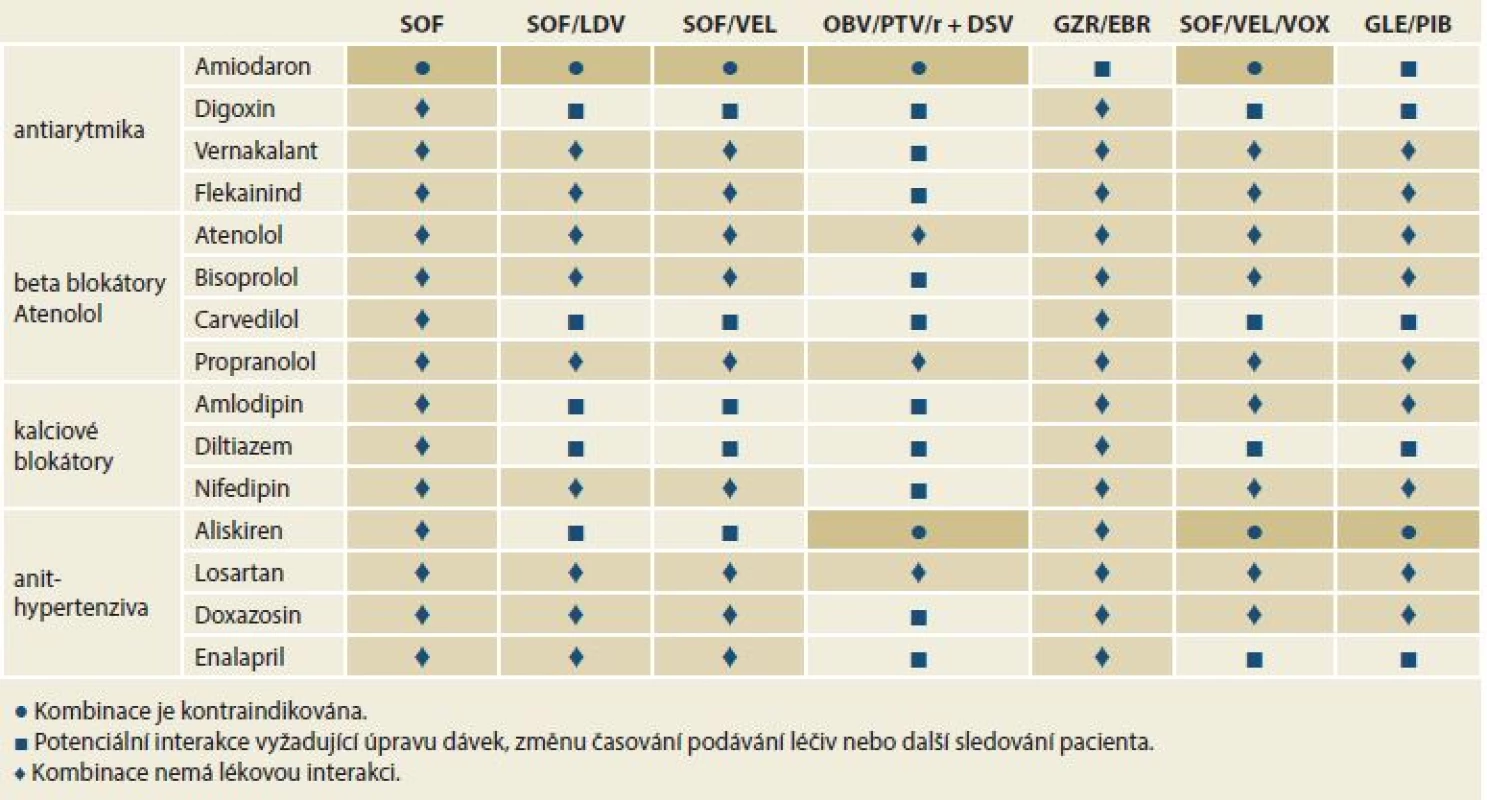
SOF – sofosbuvir, LDV – ledipasvir, VEL – velpatasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritomavir, DSV – dasabuvir, GZR – grazoprevir, EBR – elbasvir, VOX – voxilaprevir, GLE – glekaprevir, PIB – pibrentasvir U pacientů s HCV/HIV koinfekcí lze SOF/VEL kombinovat s většinou antiretrovirových (AR) léků. Výjimkou je efavirenz, etravirin a nevirapin. Tato léčiva snižují účinnost VEL.
U pacientů s HCV/HBV duální infekcí léčených tenofovirem dochází ke zvýšení sérových hladin tenofoviru, čímž se zvyšuje riziko jeho nefrotoxicity.
11.4. Fixní kombinace SOF, VEL a VOX
Fixní kombinace SOF/VEL/VOX je dostupná ve formě 1 tablety obsahující 400 mg SOF, 100 mg VEL a 100 mg VOX. Dostupný lék Vosevi® (Gilead Sciences, USA). Doporučená dávka je 1 tbl denně podávaná s jídlem.
VOX je in vitro metabolizován pomocí CYP3A4. Podobně jako VEL je také VOX inhibitorem transportérů P-gp, BCRP, OATP1B1 a OATP1B3. Hlavní cestou eliminace VOX je biliární exkrece. Poločas VOX podaného v dané kombinaci je přibližně 33 hod. U pacientů s jaterní cirhózou není indikace ke snížení dávky kombinace SOF/VEL/VOX. U pacientů se střední a těžkou jaterní dysfunkcí (jaterní cirhóza Child-Pugh B a C) byly prokázány významné změny farmakokinetiky. U pacientů s jaterní cirhózou Child-Pugh B proto kombinace SOF/VEL/VOX není doporučována, u pacientů s jaterní cirhózou Child-Pugh C je kombinace SOF/VEL/VOX kontraindikována.
Klinicky nevýznamné změny farmakokinetiky byly prokázány u pacientů s těžkou renální insuficiencí (eGFR < 30 ml/min/1,73 m2).
Protože VEL i VOX jsou inhibitory stejných transportérů (P-gp, BCRP, OATP1B1 a OATP1B3), může současné podání kombinace SOF/VEL/VOX a substrátů těchto transportérů vést k navýšení toxicity takové současné medikace. Do skupiny kontraindikovaných léčiv – substrátů transportérů pro současné podání s kombinací SOF/VEL/VOX – patří rosuvastatin, metotrexát, mitoxantron, imatinib, irinotecan, lapatinib, sulfasaolazin a topotecan. Inhibice P-gp vede ke kontraindikaci současného podání dabigatranu.
Současné podání kombinace SOF/VEL/ VOX a induktorů výše zmíněných transportérů je rovněž kontraindikováno pro významné snížení účinnosti protivirových léčiv. Tato kontraindikace se týká především rifampicinu, karbamazepinu, fenobarbitalu a fenytoinu. U žen užívajících současně s kombinací SOF/VEL/VOX hormonální kontraceptiva obsahující ethinylestradiol byla popsána elevace sérové aktivity ALT, a proto je tato kombinace rovněž považována za kontraindikovanou. Rozpustnost VOX klesá při zvyšujícím se pH, proto pro podání kombinace SOF/VEL/VOX platí pravidla týkající se podání IPP či H2-blokátorů, stejná jako byla uvedena u kombinace SOF/VEL. Kombinace SOF/VEL/VOX není doporučována u pacientů s HCV/HIV koinfekcí, kteří jsou léčení efavirenzem, etravirinem a nevirapinem a proteázovými inhibitory atazanavirem/ritonavirem a lopinavirem/ritonavirem. Data nejsou dostupná pro darunavir/ritonavir a darunavir/cobicistat a atazanavir/cobicistat.
Tyto kontraindikace i léčiva, jejichž současné podání s SOF/VEL/VOX podání je z různých důvodů rizikové, ukazují tab. 3 a 4.
11.5. Dasabuvir, ombitasvir, paritaprevir/ritonavir (kombinace 3D)
Dostupné léky: Exviera® (výrobce AbbVie, USA) potahovaná tableta obsahující dasabuvir 250 mg. Viekirax® (AbbVie, USA) obsahuje v potahované tabletě ombitasvir 12,5 mg, paritaprevir 75 mg a ritonavir 50 mg.
11.5.1. Dasabuvir
Dasabuvir (nenukleosiový NS5B inhibitor) je nenukleosidovým inhibitorem RdRp, produktu NS5B virového genomu. Není určen k podávání v monoterapii, striktně je třeba jej kombinovat s ombitasvirem/paritaprevirem/ritonavirem (viz dále). Kombinací dochází ke spojení tří přímo působících antivirotik s různými mechanizmy účinku a nepřekrývajícími se profily rezistence vůči cílovému HCV.
Dasabuvir je metabolizován systémem cytochromu, především pomocí CYP2C8 a CYP3A. Proto se při kombinaci dasabuviru s induktory těchto systémů očekává snížení jeho plazmatické koncentrace a snížení jeho protivirového účinku. Níže jsou uvedeny příklady induktorů, které jsou považovány z tohoto důvodu za kontraindikované k současnému podání s dasabuvirem. Naopak podání silných inhibitorů CYP2C8 může vést ke vzestupu plazmatické koncentrace dasabuviru a v důsledku toho ke zvýšení množství a závažnosti možných nežádoucích účinků.
11.5.2 Ombitasvir
Ombitasvir je inhibitorem NS5A proteázy, paritaprevir je inhibitorem NS3/4 proteázy viru. Ombitasvir i paritaprevir jsou metabolizovány přes složky cytochromu CYP3A. Další součást kombinace – ritonavir – není látkou s protivirovou účinností proti HCV. Je silným inhibitorem CYP3A. Jeho zařazení do 3D kombinace umožnilo snížení použité dávky paritapreviru. Při současném zachování optimální protivirové účinnosti paritapreviru tak došlo ke snížení počtu a závažnosti nežádoucích účinků.
Možné lékové interakce této protivirové kombinace s dalšími léčivy ukazují tab. 3 a 4. V ČR kombinace dasabuvir, ombitasvir, paritaprevir/ritonavir přestane být dostupná v průběhu roku 2019.
11.6. GZR a elbasvir
GZR (inhibitor NS3/4A proteázy) a elbasvir (EBR), inhibitor NS5A druhé generace, jsou dostupné ve fixní kombinaci v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Doporučené dávkování je 1 tbl denně s jídlem či nalačno. Dostupný lék® Zepatier (Merck, USA).
GZR i EBR jsou částečně metabolizovány CYP3A4, avšak metabolity nelze prokázat v plazmě. Eliminace metabolitů probíhá žlučí a stolicí. GZR je substrátem P-gp a OATP1B1, EBR je substrátem P-gp. V plazmě jsou obě látky vázány na bílkoviny a jejich poločas je 24 a 31 hod. Farmakokinetický profil obou látek je determinován funkční schopností jaterní tkáně, proto je kombinace GZR/EBR kontraindikována u pacientů s jaterní cirhózou funkční klasifikace Child-Pugh B a C. U pacientů s renální insuficiencí všech stupňů, vč. pacientů v PDL, není třeba redukovat dávku. Vzhledem k výše zmíněnému vztahu k CYP3A mohou induktory těchto proteinů (karbamazepin, bosentan, modafinil, fenytoin, efavirenz, etravirin atd.) snižovat jejich plazmatické hladiny, a proto je jejich současné podání považováno za kontraindikované. Podání inhibitorů CYP3A naopak zvyšuje jejich plazmatické hladiny, a proto jsou rovněž kontraindikovány cyklosporin a rifampicin. Při podání dalších farmak interferujících s CYP3A je třeba opatrnosti, jde např. o takrolimus, některé statiny či dabigatran. Podrobně ukazují možné lékové interakce této protivirové kombinace s dalšími léčivy tab. 3 a 4.
11.7. GLE a pibrentasvir
GLE a pibrentasvir (PIB) jsou dostupné jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Doporučená dávka je 3 tbl podávané 1× denně spolu s jídlem. Dostupný lék Maviret® (Abbvie, USA).
Hlavní cestou eliminace GLE i PIB je biliární exkrece, poločas GLE je 6 hod, PIB pak 23 hod.
Kombinace GLE/PIB je na základě analýzy farmakokinetiky kontraindikována u pacientů s jaterní cirhózou Child-Pugh B a C. Podání GLE/PIB je naopak bezpečné u pacientů se všemi stupni renální insuficience a také u pacientů v PDL. V těchto indikacích není třeba redukovat dávku kombinace GLE/PIB.
GLE i PIB jsou inhibitory P-gp, BCRP a OATP1B1 a OATP1B3. Současné podání substrátů těchto transportérů a GLE/PIB může tedy vést ke zvýšení toxicity těchto substrátů, např. dabigatran je z tohoto důvodu kontraindikován. Rosuvastatin je doporučováno rovněž nekombinovat nebo redukovat jeho denní dávku. Další statiny – atorvastatin a simvastatin (substráty OATP1B1/3) – jsou kontraindikovány.
Sérové koncentrace kombinace GLE/PIB mohou významně snižovat induktory P-gp a CYP3A. Do této skupiny léčiv patří rifampicin, carbamazepin, fenytoin. Při současném podání GLE/PIB a těchto léčiv dochází ke snížení protivirové účinnosti GLE/PIB. Vyjmenovaná léčiva jsou nejsilnějšími induktory P-gp a CYP3A, jejich současné podávání s GLE/PIB je považováno za kontraindikované. Podobný efekt ve smyslu snížení protivirové účinnosti nastává pravděpodobně u současně podávaných středně silných induktorů P-gp a CYP3A oxkarbazepinu a eslicarbazepinu. Současné podávání inhibitorů P-gp a BCRP zvyšuje sérové koncentrace GLE/PIB, podobný efekt má současné podání inhibitorů OATP1B1/3, jako je cyklosporin, darunavir a lopinavir.
Hormonální antikoncepce obsahující ethinylestradiol je kontraindikována pro riziko vzestupu sérové aktivity ALT, antikoncepce obsahující progesteron je akceptovatelná.
Podobně jako u dalších DAA klesá rozpustnost GLE/PIB při zvyšujícím se pH. Studovány byly sérové koncentrace GLE/PIB při současném podávání omeprazolu 40 mg. Maximální sérové koncentrace se snížily na 64 %. SPC kombinace GLE/PIB nedoporučuje měnit dávku protivirového léčiva při současném podávání IPP, nicméně vliv podání IPP ve vyšších dávkách než zmíněných 40 mg nebyl nikdy zkoumán.
U pacientů s HCV/HIV koinfekcí je podání GLE/PIB kontraindikováno při léčbě atazanavirem a není doporučována jeho kombinace s dalšími režimy obsahujícími HIV proteázové inhibitory. Podobně není doporučována kombinace GLE/PIB s non-nukleosidovými inhibitory reverzní transkriptázy efavirenzem, etravirinem a nevirapinem. Všechny ostatní antiretrovirové léky lze s GLE/PIB kombinovat.
12. Terapie HCV infekce
Od roku 2018 jsou jednoznačně doporučovány a preferovány (a to i ve znění těchto doporučených postupů) režimy spočívající v kombinaci perorálně podávaných přímo působících virostatik, režimy tzv. bezinterferonové a bezribavirinové a s preferencí pangenotypových režimů (režimy s vysokou účinností proti všem GT HCV). Tyto léčebné kombinace jsou vysoce účinné, bezpečné a výborně tolerované prakticky u všech existujících podskupin pacientů s HCV infekcí. Indikace a podání jednotlivých léčebných variant jsou závislé na GT HCV, případně i subtypu HCV a na stupni pokročilosti jaterního postižení. Indikace jsou stejné pro HCV monoinfikované pacienty i pro pacienty s HCV/HIV koinfekcí.
Bezinterferonové režimy vhodné pro jednotlivé genotypy HCV ukazuje tab. 5. Jednotlivé konkrétní možnosti léčby pro každý genotyp jsou rozebrány níže.
Table 5. Dostupné varianty bezinterferonových režimů pro jednotlivé genotypy HCV.
Tab. 5. IFN-free combination treatment regimens available for each HCV genotype.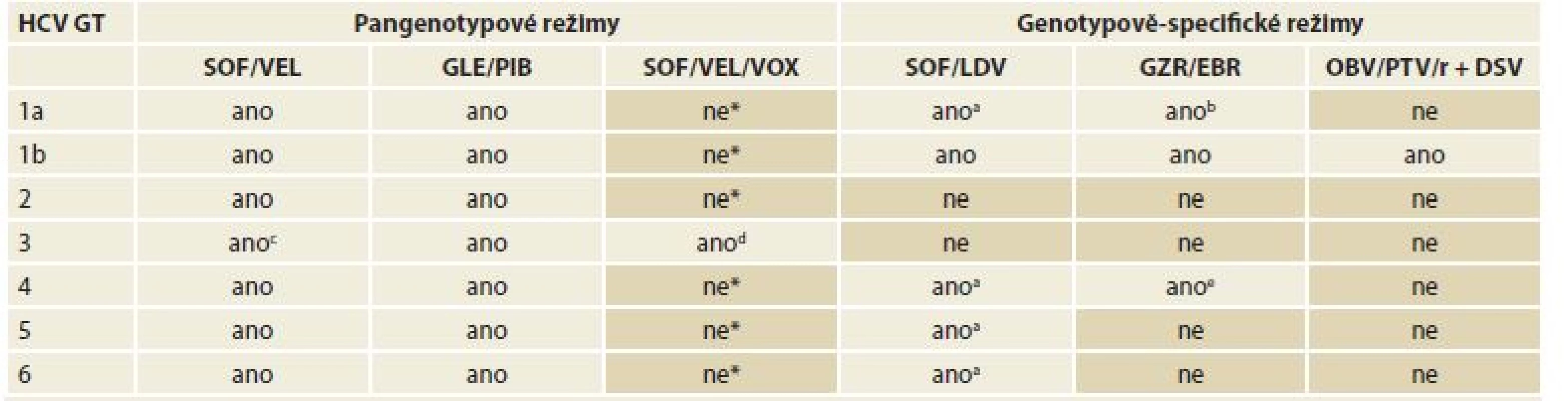
HCV – hepatitis C virus, GT – genotyp, SOF sofosbuvir, VEL velpatasvir, GLE glekaprevir, PIB pibrentasvir, VOX voxilaprevir, LDV ledipasvir, GZR grazoprevir, EBR elbasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritonavir, DSV – dasabuvir, RNA – ribonucleid acid
* V této indikace je kombinace SOF/VEL/VOX účinná, nicméně upřednostněno je podání dvojkombinačních režimů.
a Dosud neléčení pacienti bez cirhózy nebo s kompenzovanou (Child-Pugh A) jaterní cirhózou.
b Dosud neléčení i v minulosti léčení pacienti bez cirhózy nebo s kompenzovanou (Child-Pugh A) jaterní cirhózou a koncentrací HCV RNA ≤ 800 000 IU/ml
c Dosud neléčení i v minulosti léčení pacienti bez cirhózy.
d Dosud neléčení nebo v minulosti léčení pacienti s kompenzovanou (Child-Pugh A) jaterní cirhózou.
e Dosud neléčení pacienti bez cirhózy nebo s kompenzovanou (Child-Pugh A) jaterní cirhózou a koncentrací HCV RNA ≤ 800 000 IU/ml.
12.1. Genotyp HCV 1a
V roce 2018 jsou pro léčbu HCV GT1a dostupné čtyři léčebné možnosti, které jsou považovány za ekvivalentní, žádná není nadřazena jiné, pokud není toto specifikum výslovně zmíněno.
12.1.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Léčebně naivní a opakovaně léčení pacienti bez cirhózy nebo s kompenzovanou cirhózou Child-Pugh A by měli být léčeni fixní kombinací po dobu 12 týdnů.
Table 6. Doporučené režimy léčby chronické HCV infekce a koinfekce HCV/HIV u pacientů bez jaterní cirhózy, pacienty dosud neléčené (definované jako pacienty, kteří nikdy nebyli léčeni pro HCV infekci) a pacienty opakovaně léčené (definované jako pacienty, kteří byli dříve léčeni kombinací PEG-IFN + RBV, PEG-IFN + RBV + SOF nebo SOF + RBV).
Tab. 6. Treatment recommendation for chronic HCV infection and HCV/HIV co-infection in patients without hepatic cirrhosis, untreated patients (de? ned as never treated for HCV infection) and re-treated patients (defined as previously treated with PEG-IFN + RBV, PEG-IFN + RBV + SOF or SOF + RBV).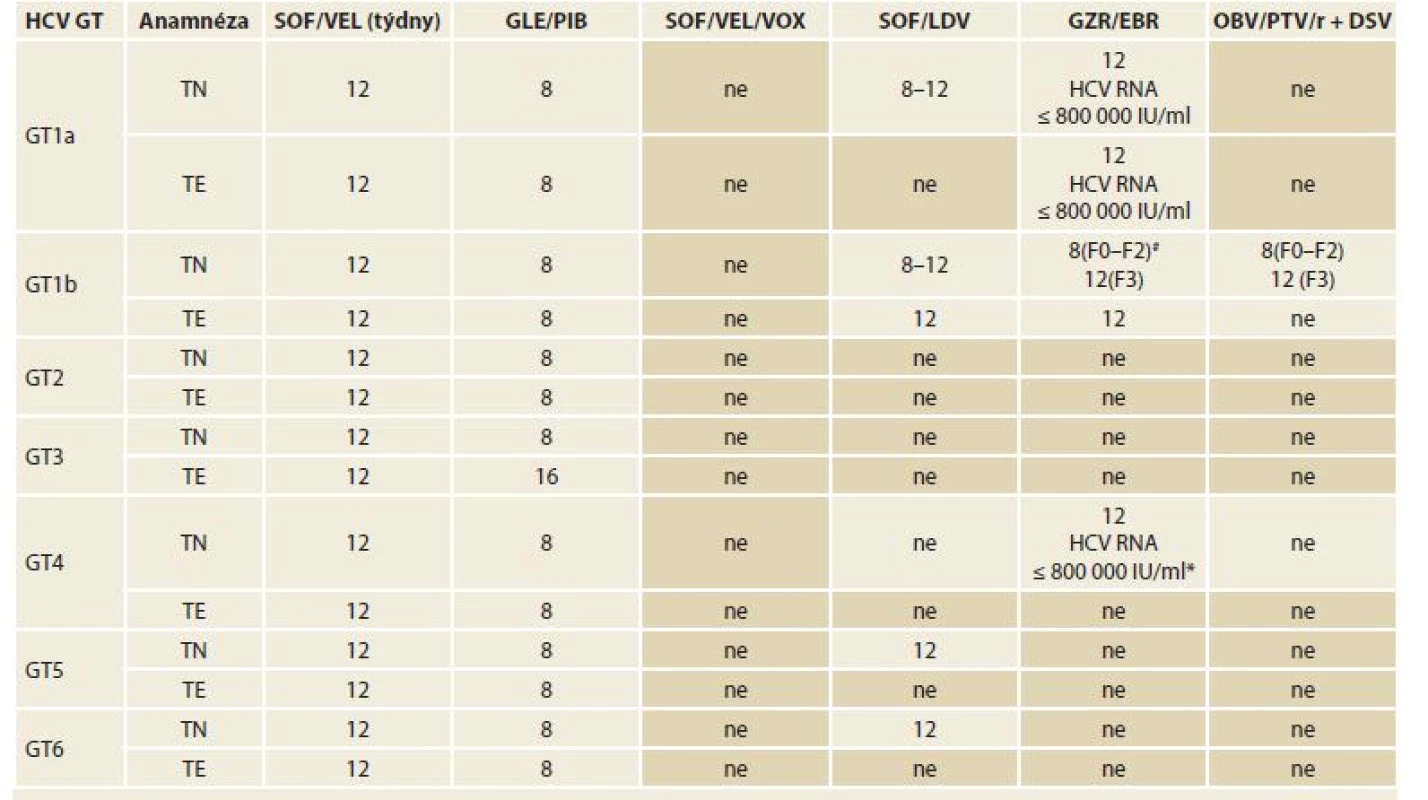
HCV – hepatitis C virus, GT – genotyp, TE – opakovaně léčení pacienti, TN – dosud neléčení pacienti, SOF – sofosbuvir, VEL – velpatasvir, GLE – glekaprevir, PIB – pibrentasvir, VOX – voxilaprevir, LDV – ledipasvir, GZR – grazoprevir, EBR – elbasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritomavir, DSV – dasabuvir, PEG-INF – pegylovaný interferon
* Režim v této indikaci nemá v ČR stanovenou úhradu z prostředků veřejného zdravotního pojištění.
# Režim v současnosti není součástí platného SPC, v ČR nelze doporučit jeho užití, nesplňuje podmínky úhrady z prostředků veřejného zdravotního pojištění. Podrobně viz kapitola 12.2.4.Table 7. Doporučené režimy léčby chronické HCV infekce a koinfekce HCV/HIV u pacientů s kompenzovanou jaterní cirhózou (Child-Pugh A), dosud neléčené (definované jako pacienty, kteří nikdy nebyli léčeni pro HCV infekci) a pacienty opakovaně léčené (definované jako pacienty, kteří byli dříve léčeni kombinací PEG-IFN + RBV, PEG-IFN + RBV + SOF nebo SOF + RBV).
Tab. 7. Treatment recommendations for chronic HCV infections and HCV/HIV co-infections in patients with compensated hepatic cirrhosis (Child-Pugh A), previously untreated (defined as patients never treated for HCV infection) and repeatedly treated patients (de? ned as those who have been previously treated with PEG-IFN + RBV, PEG-IFN + RBV + SOF or SOF + RBV).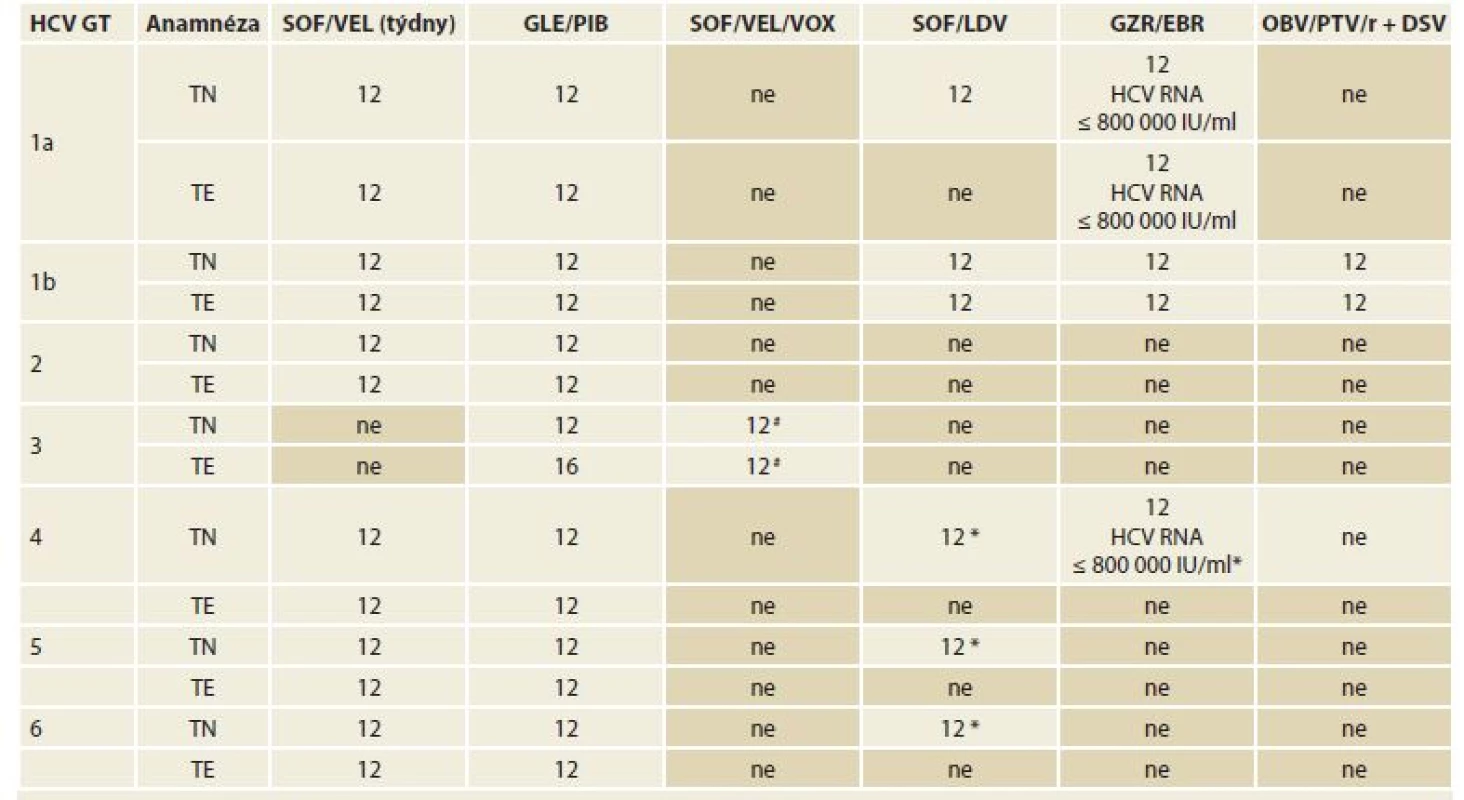
HCV – hepatitis C virus, GT – genotyp, TE – opakovaně léčení pacienti, TN – dosud neléčení pacienti, SOF – sofosbuvir, VEL – velpatasvir, GLE – glekaprevir, PIB – pibrentasvir, VOX – voxilaprevir, LDV – ledipasvir, GZR – grazoprevir, EBR – elbasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritomavir, DSV – dasabuvir, PEG-INF – pegylovaný interferon, RBV – ribavirin
* Režim v této indikaci nemá v ČR stanovenou úhradu z prostředků veřejného zdravotního pojištění.
# Režim v této indikaci nemá v ČR stanovenou úhradu z prostředků veřejného zdravotního pojištění, léčbě pacientů s jaterní cirhózou a HCV GT3 je věnována pozornost v kapitole 12.3.2.Toto doporučení se opírá o výsledky studie fáze III s názvem ASTRAL-1 u pacientů infikovaných GT HCV1, kteří byli léčeni kombinací SOF/VEL po dobu 12 týdnů bez RBV. Celkem 22 % pacientů mělo jaterní cirhózu, 66 % bylo dosud neléčených, 34 % bylo opakovaně léčených a z nich 44 % mělo anamnézu léčby DAA. SVR12 byla 98 %, u HCV GT1a byla SVR12 98 % a u HCV GT1b 99 %. Podobné výsledky byly dosaženy i v reálné praxi (RWD – real world data). HCV/HIV duální infekce byla studována ve studii ASTRAL-5. U léčebně naivních, opakovaně léčených cirhotiků a necirhotiků bylo dosaženo SVR12 v 95 a 92 %. Studie POLARIS-2 (trojkombinace SOF/VEL/VOX podávaná po dobu 8 týdnů) neprokázala non-inferioritu použité kombinace ve srovnání se SOF/VEL po dobu 12 týdnů. Studie zahrnovala přibližně 20 % osob s jaterní cirhózou a 25 % opakovaně léčených pacientů. SVR12 u pacientů s HCV GT1a byla 92 % po 8 týdnech SOF/VEL/VOX a 99 % po 12 týdnech SOF/VEL. Z tohoto důvodu není kombinace SOF/VEL/VOX u pacientů s HCV GT1a indikována.
12.1.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Léčebně naivní a opakovaně léčení pacienti infikovaní HCV GT1a bez cirhózy by měli být léčeni fixní kombinací GLE/PIB po dobu 8 týdnů.
Toto doporučení je založeno na výsledcích dvou studií fáze III u pacientů s HCV GT1a. Ve studii ENDURANCE-1 byla SVR12 98 % u dosud neléčených a opakovaně léčených pacientů bez jaterní cirhózy, kteří byli léčeni 8 týdnů. V rámci studie bylo léčeno i 13 pacientů s HCV/HIV duální infekcí. Studie EXPEDITION-1 zahrnovala dosud neléčené i opakovaně léčené pacienty infikované HCV GT1a s kompenzovanou jaterní cirhózou. SVR12 byla 98 % po léčbě GLE/PIB trvající 12 týdnů.
12.1.3. Genotypově specifický režim, varianta 1 – SOF/LDV
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení pacienti infikovaní HCV GT1a bez cirhózy nebo s kompenzovanou cirhózou (Child-Pugh A) by měli být léčeni kombinací SOF/LDV po dobu 12 týdnů.
- Dosud neléčení pacienti infikovaní HCV GT1a bez cirhózy a s výchozí HCV RNA < 6 mil. IU/ml mohou být léčeni kombinací SOF/LDV po dobu 8 týdnů.
- Kombinace SOF/LDV není doporučena pro léčbu opakovaně léčených pacientů infikovaných HCV GT1a.
Tato doporučení se opírají o tři studie fáze III (ION-1, ION-3 a ION-4), dále o post hoc analýzy všech dat studií fáze II a III a o publikované výsledky z RWD. Ve studii ION-1 (dosud neléčené osoby infikované HCV GT1a vč. 15 % osob s jaterní cirhózou) bylo dosaženo SVR12 v 98 % (141/144 případů) po 12týdenní léčbě SOF/LDV. Analýza pouze cirhotiků léčených v rámci studií fáze II a III prokázala SVR12 po 12 týdnech léčby SOF/LDV v 98 % (84/86 případů). Ve studii ION-4, která byla studií otevřenou u pacientů dosud neléčených i opakovaně léčených, cirhotiků i necirhotiků, kteří byli koinfikováni HIV (léčba tenofovir, emtricitabin, efavirenz, rilpivirin nebo raltegravir) byla SVR12 96 %. Ve studii ION-3 s dosud neléčenými pacienty bez jaterní cirhózy byla SVR12 93 % při léčbě SOF/LDV trvající 8 týdnů a 95 % při léčbě SOF/LDV trvající 12 týdnů. Stejné výsledky byly dosaženy v reálné praxi. Jedna ze studií tohoto typu prokázala, že zkrácení léčby na 8 týdnů nevede ke snížení SVR12 u pacientů s výchozí HCV RNA < 6 mil. IU/ml. Následná analýza všech publikovaných studií s pacienty dosud neléčenými infikovanými HCV HT1a a bez jaterní cirhózy (n = 566) splňujícími toto vstupní kritérium prokázala SVR12 v 98 %.
Kombinace SOF/LDV není doporučována pro opakovaně léčené pacienty infikované HCV GT1a, protože tento režim by vyžadoval současné podání RBV, což v roce 2018 není preferovaný režim.
12.1.4. Genotypově specifický režim, varianta 2 – grazorevir/EBR
Kombinace GZR/EBR je dostupná jako fixní kombinace v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Doporučené dávkování je 1 tbl denně. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT1a bez jaterní cirhózy nebo s kompenzovanou cirhózou (Child-Pugh A) s výchozí HCV RNA ≤ 800 000 IU/ml by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace GZR/EBR není indikována pro pacienty infikované HCV GT1a ve vstupní HCV RNA > 800 000 IU/ml.
Tato doporučení se opírají o tři studie fáze III a post hoc analýzy kumulovaných dat studií fáze II a III. V rámci studie C-EDGE-TN byli dosud neléčení pacienti infikovaní HCV GT1a léčeni kombinací GZR/EBR po dobu 12 týdnů. SVR12 byla 92 %. Kompenzovaná jaterní cirhóza nijak výsledek neovlivnila. Ve studii C-EDGE-COINFECTION byly léčeny do-sud protivirově neléčené osoby koinfikované HCV/HIV s cirhózou či bez ní po dobu 12 týdnů. SVR12 byla 99 % u osob s výchozí viremií ≤ 800 000 IU/ml. NS5A RAS existující před terapií neměly vliv na výslednou SVR. Ve studii C-EDGE-TE, která zahrnovala i cca 30 % pacientů s kompenzovanou cirhózou, byla SVR12 mezi pacienty s HCV GT1a 92 % při trvání léčby 12 týdnů. Při souhrnné post hoc analýze všech pacientů s HCV GT1a léčených 12 týdnů ve studiích fáze II a III byla SVR12 100 % (14/14) při výchozí HCV RNA ≤ 800 000 IU/ml.
U pacientů dosud neléčených i opakovaně léčených s HCV RNA > 800 000 IU/ml byla SVR12 negativně ovlivněna přítomností NS5A RAS. Vyšetření RAS není standardně doporučováno, a proto u pacientů s HCV RNA > 800 000 IU/ml není režim GZR/EBR doporučován.
12.2. Genotyp HCV 1b
V roce 2018 je pro léčbu HCV GT1b dostupných pět léčebných možností, které jsou považovány za ekvivalentní, žádná není nadřazena jiné, pokud není toto specifikum výslovně zmíněno.
12.2.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Léčebně naivní a opakovaně léčení pacienti bez cirhózy nebo s kompenzovanou cirhózou Child-Pugh A s HCV GT1b by měli být léčeni fixní kombinací SOF/VEL po dobu 12 týdnů.
Toto doporučení se opírá o výsledky studie fáze III s názvem ASTRAL-1 (HCV GT1, 22 % pacientů s jaterní cirhózou, 66 % dosud neléčených, 34 % opakovaně léčených a z těchto 44 % již v minulosti bylo léčených DAA), ve které byli pacienti léčeni kombinací SOF/VEL po dobu 12 týdnů. U osob infikovaných HCV GT1b byla SVR12 dosažena v 99 % případů. Ve studii ASTRAL-5, kde cílovou populací byli pacienti infikovaní HCV/HIV, byla dosažena SVR12 v 92 % případů ve skupině osob dosud neléčených i opakovaně léčených bez cirhózy nebo s kompenzovanou jaterní cirhózou. Tato data byla následně ověřena i daty z reálného života.
12.2.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Léčebně naivní a opakovaně léčení pacienti infikovaní HCV GT1b bez cirhózy by měli být léčeni fixní kombinací GLE/PIB po dobu 8 týdnů.
- Léčebně naivní a opakovaně léčení pacienti infikovaní HCV GT1b s kompenzovanou cirhózou by měli být léčeni fixní kombinací GLE/PIB po dobu 12 týdnů.
Toto doporučení je podloženo výsledky dvou studií fáze III u pacientů infikovaných genotypem HCV1b. Ve studii ENDURANCE-1 byla po 8 týdnech léčby SVR12 100 % u pacientů bez jaterní cirhózy, kteří dosud nebyli léčeni nebo byli léčeni opakovaně. Dosud neléčení i opakovaně léčení pacienti s jaterní cirhózou byli ve studii EXPEDITION-1 léčeni 12 týdnů. SVR12 v této skupině osob byla rovněž 100 %.
12.2.3. Genotypově specifický režim, varianta 1 – SOF/LDV
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení i opakovaně léčení pacienti infikovaní HCV GT1b bez cirhózy nebo s kompenzovanou cirhózou (Child-Pugh A) by měli být léčeni kombinací SOF/LDV po dobu 12 týdnů.
- Dosud neléčení pacienti infikovaní HCV GT1b a se vstupní HCV RNA < 6 mil. IU/ml bez cirhózy mohou být léčeni kombinací SOF/LDV po dobu 8 týdnů.
Toto doporučení se opírá o výsledky čtyř studií fáze III ION-1, ION-2, ION-3 a ION-4 a dále o post hoc analýzy všech dat studií fáze II a III. Ve studii ION-1 (dosud neléčené osoby infikované HCV GT1b vč. 15 % osob s jaterní cirhózou) bylo dosaženo SVR12 ve 100 % (141/144 případů) po 12týdenní léčbě SOF/LDV. Analýza pouze cirhotiků HCV GT1b léčených v rámci studií fáze II a III prokázala SVR12 po 12 týdnech léčby SOF/LDV v 97 % (72/74 případů) u dosud neléčených osob. U osob opakovaně léčených byla SVR12 96 % (124/129 případů). Ve studii ION-2, jejíž cílovou skupinou byli pacienti opakovaně léčení (po těchto režimech v minulosti: pegylovaný interferon (PEG/IFN) + RBV, PEG/IFN + RBV ± telaprevir nebo boceprevir) vč. 20 % s jaterní cirhózou byla SVR12 87 %. Ve studii ION-4, která byla studií otevřenou u pacientů dosud neléčených i opakovaně léčených, cirhotiků i necirhotiků, kteří byli koinfikováni HIV (léčba tenofovir, emtricitabin, efavirenz, rilpivirin nebo raltegravir), byla SVR12 96 % u pacientů infikovaných HCV GT1b. Ve studii ION-3 mezi dosud neléčenými pacienty HCV GT1b bez jaterní cirhózy byla SVR12 98 % při léčbě SOF/LDV trvající 8 týdnů. Stejné výsledky byly dosaženy v reálné praxi. Podle analýzy kumulovaných RWD SVR12 v této skupině HCV GT1b infikovaných osob přesáhla 99 % při léčbě trvající 8 týdnů.
12.2.4. Genotypově specifický režim, varianta 2 – GZR/EBR
Kombinace GZR/EBR je dostupná jako fixní kombinace v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Doporučené dávkování je 1 tbl denně. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT1b bez jaterní cirhózy nebo s kompenzovanou cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
Text standardů vydaných EASL v dubnu 2018 připouští ještě následující indikaci:
- Dosud neléčení pacienti infikovaní HCV GT1b a s jaterní fibrózou F0–F2 mohou být léčeni kombinací GZR/EBR po dobu 8 týdnů.
Tento postup doporučovaný panelem expertů EASL nelze v ČR doporučit. Režim k datu vydání těchto doporučených postupů není obsažen v platném znění SPC, proto nesplňuje podmínky pro úhradu z prostředků veřejného zdravotního pojištění. Při selhání režimu nelze hradit opakovanou léčbu.
Jedinou variantou léčby GZR/EBR použitelnou v ČR u dosud neléčených osob s HCV GT1b je režim GZR/EBR 12 týdnů pro všechny pacienty bez rozdílu stadia jaterní fibrózy.
Doporučení se opírají o tři studie fáze III a post hoc analýzy kumulovaných dat studií fáze II a III a o studii STREAGER se zkráceným režimem. V rámci studie C-EDGE-TN byli dosud neléčení pacienti infikovaní HCV GT1b léčeni kombinací GZR/EBR po dobu 12 týdnů. SVR12 byla 99 %. Ve studii C-CORAL byla SVR12 98 %. Ve studii C-EDGE-COINFECTION byly léčeny dosud protivirově neléčené osoby koinfikované HCV/HIV s cirhózou či bez ní po dobu 12 týdnů. SVR12 u HCV GT1b byla 95 %. Ve studii C-EDGE-TE, která zahrnovala i cca 30 % pacientů s kompenzovanou cirhózou, byla SVR12 mezi pacienty s HCV GT1b 100 % při trvání léčby 12 týdnů. Při souhrnné post hoc analýze všech pacientů s HCV GT1b léčených 12 týdnů ve studiích fáze II a III byla SVR12 97 %. Ve studii STREAGER, která zahrnovala pacienty s HCV GT1b, dosud neléčené a se stadiem jaterní fibrózy F0–F2, byla SVR12 po 8 týdnech léčby GZR/EBR 97 %.
12.2.5. Genotypově specifický režim, varianta 3 – dasabuvir, ombitasvir, paritaprevir/ritonavir (3D)
Tato léčebná kombinace se skládá z ombitasviru 12,5 mg, paritapreviru 75 mg a ritonaviru 50 mg v jedné tabletě (dávkování: 2 tbl 1× denně spolu s jídlem) a dasabuviru 250 mg (dávkování: 1 tbl 2× denně). Konkrétní použití této kombinace je následující (tab. 6 a 7).
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GH1b bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
- Naivní pacienti infikovaní HCV GT1b bez jaterní cirhózy s F0–F2 mohou být léčeni touto kombinací po dobu 8 týdnů bez RBV.
Uvedená doporučení jsou opřena o výsledky několika studií fáze III. Ve studii PEARL-III u pacientů dosud neléčených, bez jaterní cirhózy, infikovaných HCV GT1b byla SVR12 po terapii 3D trvající 12 týdnů 99 %. Ve studii MALACHITE-1 u pacientů dosud neléčených, bez jaterní cirhózy byla SVR12 98 %. Ve studii TURQUOISE-1, která studovala účinnost terapie 3D u pacientů dosud neléčených, bez jaterní cirhózy, s duální infekcí HCV/HIV, byla u pacientů s HCV GT1b SVR12 100 %. Studie GARET u dosud neléčených pacientů bez cirhózy (F0–F3) při léčbě trvající 8 týdnů dosáhla SVR12 v 97 % případů.
U opakovaně léčených pacientů (selhání PEG-IFN + RBV) bez cirhózy, kteří byli léčeni 12 týdnů ve studii PEARL-II, byla SVR12 100 %. Ve studii TOPAZ-1 u pacientů dosud neléčených a opakovaně léčených bez cirhózy byla SVR12 dosažená režimem 3D trvajícím 12 týdnů celkem 99 %. Kumulativní analýza pacientů infikovaných HCV GT1b ve všech studiích fáze III ukázala SVR12 99 %.
12.3. Genotyp HCV 3
12.3.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace u HCV GT3 je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT3 bez jaterní cirhózy by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace bez RBV není indikována jako postup 1. volby pro léčbu dosud neléčených a opakovaně léčených pacientů s kompenzovanou jaterní cirhózou (Child-Pugh A) vzhledem k suboptimálním výsledkům léčby.
Tato doporučení jsou založena na výsledcích studie fáze III ASTRAL-3. Cílovou skupinou byli pacienti infikovaní HCV GT3 (29 % s kompenzovanou cirhózou, 74 % dosud neléčených, 26 % opakovaně léčených), kteří byli léčeni kombinací SOF/VEL po dobu 12 týdnů. Ve skupině dosud neléčených osob byla SVR12 98 %. Nižší SVR12 bylo dosaženo ve skupině osob opakovaně léčených nebo majících jaterní cirhózu – celkem 90 %, dosud neléčené osoby s cirhózou 93 %, opakovaně léčené osoby bez cirhózy 91 %, opakovaně léčené osoby s jaterní cirhózou 89 %. Nízká SVR12 v poslední skupině pacientů je považována za důvod přidání 3. léku ke kombinaci SOF/VEL (viz dále). Ve studii ASTRAL-5 bylo SVR12 u pacientů s duální infekcí HCV/HIV 92 %.
12.3.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace u HCV GT3 je následující (tab. 6 a 7):
- Léčebně naivní pacienti s HCV GT3 bez jaterní fibrózy nebo se středně pokročilou fibrózou (METAVIR F0–F2) by měli být léčeni touto kombinací po dobu 8 týdnů.
- Léčebně naivní pacienti s HCV GT3 s pokročilou fibrózou, ale bez cirhózy (METAVIR F3), mohou být léčeni touto kombinací po dobu 8 týdnů.
- Opakovaně léčení pacienti s HCV GT3 bez jaterní cirhózy by měli být léčeni touto kombinací po dobu 16 týdnů.
- Léčebně naivní pacienti s HCV GT3 s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
- Opakovaně léčení pacienti s HCV GT3 s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 16 týdnů.
Tato doporučení se opírají o výsledky několika studií fáze III s názvem ENDURANCE-3, ve které byli cílovou skupinou pacienti dosud neléčení, bez jaterní cirhózy. Léčba trvala 8 týdnů a SVR12 byla 95 %. Celkem 17 % zařazených osob mělo jaterní fibrózu METAVIR F3, 83 % osob mělo jaterní fibrózu METAVIR F0–F2. Výsledek studie proto neumožňuje doporučit 8týdenní léčbu pro pacienty s fibrózou F ≥ 3. Studie na toto téma dále probíhají. Ve studii EXPEDITION-2 bylo dosaženo u pacientů s HCV/HIV duální infekcí bez jaterní cirhózy SVR12 100 % rovněž po 8týdenním režimu GLE/PIB. Studie SURVEYOR-2 analyzovala účinnost režimu trvajícího 12 nebo 16 týdnů u pacientů opakovaně léčených bez jaterní cirhózy. V rameni s trváním léčby 12 týdnů byla SVR12 91 %, v rameni se 16týdenní léčbou byla SVR12 95 %. U dosud neléčených osob s cirhózou byla SVR12 98 % při léčbě trvající 12 týdnů a 96 % při léčbě trvající 16 týdnů. Integrovaná analýza studií fází II a III prokázala u pacientů dosud neléčených bez jaterní cirhózy s HCV GT3 SVR12 95 %. Stejná integrovaná analýza u pacientů dosud neléčených s jaterní cirhózou léčených 12 týdnů prokázala SVR12 97 %. Integrovaná analýza dat studií fází II a III u pacientů dosud neléčených bez cirhózy léčených 12 týdnů prokázala SVR12 96 %, 90 % u opakovaně léčených bez jaterní cirhózy, 96 % u opakovaně léčených pacientů bez cirhózy při léčbě trvající 16 týdnů, 99 % u dosud neléčených s kompenzovanou cirhózou při léčbě trvající 12 týdnů a 94 % u pacientů opakovaně léčených s kompenzovanou cirhózou léčených 16 týdnů.
12.3.3. Pangenotypový režim, varianta 3 – SOF/VEL/VOX
Fixní kombinace SOF/VEL/VOX je dostupná ve formě jedné tablety obsahující 400 mg SOF, 100 mg VEL a 100 mg VOX. Dostupný lék Vosevi® (Gilead Sciences, USA). Doporučená dávka je 1 tbl denně podávána s jídlem. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení i opakovaně léčení pacienti s kompenzovanou cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
Tato doporučení jsou založena na výsledcích studií fáze III POLARIS-2 a POLARIS-3. Ve studii POLARIS-2 (75 % dosud neléčených osob, 25 % opakovaně léčených, 20 % s jaterní cirhózou) byla po 8týdenním režimu SVR12 99 %. Ve studii POLARIS-3 bylo 8týdenní léčbou dosaženo SVR12 96 % u dosud neléčených i opakovaně léčených pacientů s kompenzovanou jaterní cirhózou. Panel expertů EASL se dále shodl na formulaci, že HCV GT3 je nutno považovat za obtížněji léčitelný GT než jiné GT HCV, a proto při nedostatku dat s léčbou trvající 8 týdnů je třeba u pacientů s jaterní cirhózou za bezpečnější považovat léčbu trvající 12 týdnů. Toto doporučení se rozchází s platným zněním SPC léku Vosevi, kde je doporučena 8týdenní léčba i u pacientů s kompenzovanou jaterní cirhózou HCV GT3.
Rozpor mezi citovanými EASL doporučeními z roku 2018 a SPC Vosevi spolu s vyřazením kombinace SOF/VEL + RBV z léčby pacientů s kompenzovanou jaterní cirhózou u HCV GT3 vedl v průběhu roku 2018 ke komunikaci mezi držitelem registrace obou léků a EASL, která byla uzavřena až v listopadu 2018 zveřejněním dvou klíčových dokumentů týkajících se celé záležitosti. Závěr této diskuze sumarizuje tab. 8.
Table 8. Doporučované léčebné režimy v závislosti na dostupnosti léčebných variant a testování RAS.
Tab. 8. Treatment recommendations depending on the availability of treatment options and RAS testing.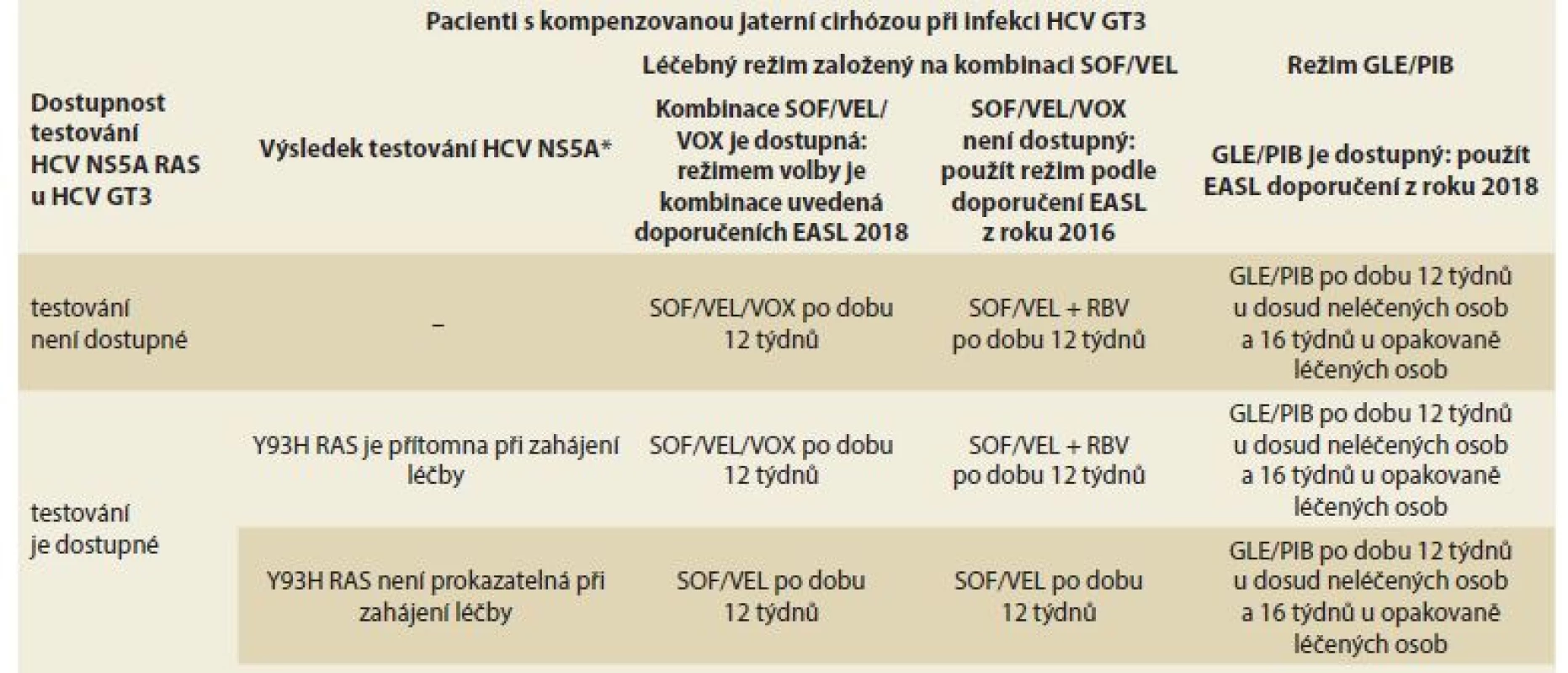
HCV – hepatitis C virus, GT – genotyp, RAS – resistance-associated substitutions, SOF– sofosbuvir, VEL – velpatasvir, VOX – voxilaprevir, GLE – glekaprevir, PIB – pibrentasvir, EASL – Evropská asociace pro studium jater, RBV – ribavirin, RAS – rezistence na virostatika
* Přítomnost NS5A RAS Y93H v okamžiku zahájení léčby je defi nována jako pozitivní výsledek při populačním testování nebo > 15 % při hlubokém sekvenování.V ČR je situace poněkud složitější a je třeba vycházet z platných podmínek úhrady kombinace SOF/VEL/VOX (Vosevi®) (www.sukl.cz): přípravek Vosevi® je hrazen k terapii dospělých pacientů s chronickou virovou hepatitidou C:
- GT HCV1, HCV2 nebo HCV3 bez cirhózy nebo s kompenzovanou cirhózou, kteří byli neúspěšně léčeni režimem s daklatasvirem, LDV, ombitasvirem nebo SOF (s výjimkou pacientů předléčených kombinací SOF a VEL). Maximální délka léčby je 12 týdnů.
- GT HCV3 bez cirhózy nebo s kompenzovanou cirhózou, kteří nebyli dříve léčeni nebo kteří byli neúspěšně léčeni kombinací pegylovaného interferonu alfa s RBV. Maximální délka léčby je 8 týdnů.
Z uvedeného tedy vyplývá, že pro dosud neléčené pacienty s jaterní cirhózou a HCV GT3 nelze naplnit doporučení EASL 2018 (doporučení k terapii 12 týdnů, úhrada v ČR pouze na 8 týdnů). V těchto případech je tedy v souladu s tab. 8 nutno postupovat podle doporučení EASL 2016 (ČHS A SIL ČLS JEP z roku 2017) a v této indikaci použití kombinaci SOF/VEL + RBV na dobu 12 týdnů.
12.4. Méně časté genotypy v České republice
12.4.1. Genotyp HCV2
12.4.1.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti s HCV GT2 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.1.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT2 bez jaterní cirhózy by měli být léčeni touto kombinací po dobu 8 týdnů.
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT2 s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.2. Genotyp HCV4
12.4.2.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti s HCV GT4 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.2.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT4 bez jaterní cirhózy by měli být léčeni touto kombinací po dobu 8 týdnů.
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT4 s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.2.3. Genotypově specifický režim, varianta 1 – SOF/LDV
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT4 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace není doporučována pro léčbu opakovaně léčených osob infikovaných HCV GT4.
12.4.2.4. Genotypově specifický režim, varianta 2 – GZR/EBR
Kombinace GZR/EBR je dostupná jako fixní kombinace v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Doporučené dávkování je 1 tbl denně. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení pacienti bez jaterní cirhózy nebo s kompenzovanou cirhózou (Child-Pugh A) a se vstupní HCV RNA ≤ 800 000 IU/ml by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace GZR/EBR není doporučována u dosud neléčených pacientů se vstupní HCV RNA > 800 000 IU/ml a u pacientů opakovaně léčených bez rozdílu viremie.
12.4.3. Genotyp HCV5
12.4.3.1. Pangenotypový režim, varianta 1 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT5 bez cirhózy by měli být léčeni touto kombinací po dobu 8 týdnů.
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT5 bez cirhózy by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.3.2. Pangenotypový režim, varianta 2 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacient s HCV GT5 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.3.3. Genotypově specifický režim, varianta 2 – SOF/LDV
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT 5 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace není doporučována pro léčbu opakovaně léčených osob infikovaných HCV GT5.
12.4.4. Genotyp HCV6
12.4.4.1. Pangenotypový režim, varianta 1 – SOF/VEL
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti s HCV GT4 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.4.2. Pangenotypový režim, varianta 2 – GLE/PIB
Kombinace GLE/PIB je dostupná jako fixní kombinace v jedné tabletě obsahující GLE 100 mg a PIB 40 mg. Standardní dávkování je 3 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT6 bez jaterní cirhózy by měli být léčeni touto kombinací po dobu 8 týdnů.
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT6 s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
12.4.4.3. Genotypově specifický režim, varianta 1 – SOF/LDV
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tbl denně. Konkrétní použití této kombinace je následující (tab. 6 a 7):
- Dosud neléčení a opakovaně léčení pacienti infikovaní HCV GT6 bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou (Child-Pugh A) by měli být léčeni touto kombinací po dobu 12 týdnů.
- Kombinace není doporučována pro léčbu opakovaně léčených osob infikovaných HCV GT6
12.5. Léčba pacientů s pokročilým jaterním onemocněním
12.5.1. Kompenzovaná jaterní cirhóza
Pacienti s kompenzovanou jaterní cirhózou představují skupinu osob, u kterých by měla být protivirová léčba zahájena co nejdříve. Všechny komplikace jaterní cirhózy, dekompenzace, rozvoj HCC, se v této skupině mohou objevit v krátkém časovém horizontu. Snížení incidence dekompenzace a HCC v případech úspěšné léčby bylo jednoznačně prokázáno. Tito pokročilí pacienti rovněž vyžadují zvláštní péči ve smyslu prevence a včasné léčby závažných nebo potenciálně závažných nežádoucích účinků léčby. Jde většinou o pacienty, kteří jsou ve srovnání s pacienty bez cirhózy starší, mají řadu souběžné medikace, a tudíž také léčbu HCV infekce hůře snášejí. Léčebné varianty pacientů s kompenzovanou jaterní cirhózou jsou podrobně rozebrány v kapitole 12.5.
12.5.2. Pacienti s dekompenzovanou cirhózou, bez HCC, indikovaní k Tx jater
Tx jater je volbou u pacientů s konečným stadiem jaterního onemocnění. Rekurence HCV infekce s reinfekcí štěpu po Tx je prakticky 100 %, životnost štěpu je také u pacientů s rekurentní HCV infekcí významně zkrácena. U pacientů čekajících na Tx jater je protivirová léčba jednoznačně indikována, protože v případech, kdy je HCV RNA nedetekovatelná alespoň 30 dní před vlastní Tx, nedochází k rekurenci infekce v jaterním štěpu.
Léčba HCV infekce před Tx jater má dva základní cíle:
- předejít reinfekci jaterního štěpu dosažením eradikace HCV;
- stabilizovat nebo zlepšit jaterní funkce.
Prevence rekurence HCV jednoznačně zjednoduší péči o pacienta po Tx. Zlepšení jaterní funkce pak umožní vyřazení některých pacientů z čekací listiny. U pacientů s jaterní cirhózou funkční klasifikace Child-Pugh B a C představují bezinterferonové režimy optimální léčebnou strategii díky absenci nežádoucích účinků a vysoké šanci na dosažení SVR. Léčba má být vedena v transplantačních centrech nebo v centrech, která mají s protivirovou léčbou dekompenzovaných cirhotiků zkušenost.
V současné době stále zůstává otevřena otázka, zda pacienti s dekompenzovanou cirhózou, kteří jsou zároveň kandidáty Tx jater, mají být léčeni před Tx nebo až časně po ní. Rozhodnutí je individuální a je ovlivněno zejména předpokládanou délkou doby v čekací listině v daném transplantačním centru a pokročilostí jaterní dysfunkce. Problémem zůstává načasování a délka protivirové léčby v čekací listině. U pacientů, kteří jsou z čekací listiny vyřazeni pro zlepšení jaterní funkce, musíme i po úspěšné léčbě počítat s rizikem další dekompenzace a vzniku HCC.
Léčba režimy obsahujícími proteázový inhibitor nemá být použita u pacientů s jaterní cirhózou funkční klasifikace Child-Pugh B a C pro vysoké riziko nežádoucích účinků spojené s vyššími koncentracemi léků v krvi. Stejně tak nemá být kombinace s proteázovým inhibitorem použita u pacientů s anamnézou dekompenzace jaterní cirhózy.
Pacienti s dekompenzovanou jaterní cirhózou zařazení v čekací listině k Tx jater mají být léčení kombinací SOF a NS5A inhibitoru, tedy LDV (GT1, GT4, GT5 a GT6) či VEL (všechny GT). Účinnost léčby je však u pacientů s dekompenzovanou cirhózou nižší než u pacientů s kompenzovanou cirhózou, riziko progrese jaterní dysfunkce a nežádoucích účinků v průběhu léčby je vyšší u pacientů s MELD skóre ≥ 15. Pacienti s dekompenzovanou cirhózou a MELD skóre ≥ 18–20 a též pacienti s refrakterními komplikacemi portální hypertenze mají být léčeni až po Tx jater, šance na zlepšení jaterní funkce a vyřazení z čekací listiny je v těchto případech minimální. Z důvodu častějšího výskytu nežádoucích účinků v průběhu léčby vyžadují tito nemocní časté klinické i laboratorní kontroly.
Pacienti s dekompenzovanou jaterní cirhózou (Child-Pugh B a C) s MELD skóre < 18–20, bez HCC, mají být léčeni kombinací SOF/LDV (GT1,GT4, GT5 a GT6) nebo kombinací SOF/VEL (všechny GT) spolu s RBV dle hmotnosti (1 000 mg u pacientů < 75 kg, 1 200 mg u pacientů ≥ 75 kg), doba léčby je 12 týdnů. Počáteční dávka RBV může být u těchto pacientů snížena na 600 mg denně a navýšena v průběhu léčby dle tolerance. Pacienti, kterým RBV nelze podat, mají být léčeni kombinací SOF/LDV (GT1, GT4, GT5 a GT6) nebo kombinací SOF/VEL (všechny GT) po dobu 24 týdnů.
Pacienti s dekompenzovanou jaterní cirhózou (Child-Pugh B a C) s MELD skóre ≥ 18–20 mají nejdříve podstoupit Tx jater a léčba má být podána následně. Léčba má být zahájena pouze ve zvláštních případech, je-li očekávaná doba v čekací listině delší než 6 měsíců.
12.5.3. Pacienti s HCC, bez cirhózy nebo s kompenzovanou cirhózou, indikovaní k Tx jater
U pacientů s HCC, kteří jsou kandidáty Tx jater, bez cirhózy nebo s kompenzovanou cirhózou, zůstává ideální načasování protivirové léčby nadále ne zcela vyřešeným problémem. Prioritou je, aby podání protivirové léčby neoddálilo Tx. Pacienti s HCC, kteří byli dříve léčeni různými kombinacemi DAA před Tx (SOF a LDV, ritonavirem potencovaný paritaprevir, ombitasvir a dasabuvir, s nebo bez RBV), měli nižší počty SVR ve srovnání s těmi, kteří byli léčeni až po Tx (71 vs. 91, resp. 94 %). Léčba po Tx se jeví jako finančně výhodnější. Indikace k léčbě a výběr antivirotika je shodný jako u pacientů, kteří nemají HCC, a záleží zejména na pokročilosti jaterního onemocnění. Pacienti s HCC, bez cirhózy či s kompenzovanou cirhózou (funkční klasifikace Child-Pugh A), mají být léčeni ve shodě s obecnými doporučeními.
12.5.4. Pacienti po Tx jater
Rekurence HCV infekce po Tx jater postihuje téměř všechny pacienty, kteří mají v době Tx detekovatelnou HCV RNA v krvi. Průběh infekce po Tx je akcelerován a přibližně u 1/3 pacientů se rozvine jaterní cirhóza během 5 let po Tx. V posledních letech se jasně prokázalo, že úspěšná protivirová léčba má velmi pozitivní vliv na přežití štěpu i pacienta. Všichni pacienti s potransplantační rekurencí HCV infekce jsou proto kandidáty protivirové léčby. Léčba má být zahájena urgentně u pacientů s fibrotizující cholestatickou hepatitidou a rovněž u pacientů s cirhózou štěpu a portální hypertenzí, neboť tito pacienti jsou nejvíce ohroženi ztrátou štěpu a úmrtím. Léčba po Tx má být zahájena časně, ideálně ihned po zvládnutí časných pooperačních komplikací, obvykle 3 měsíce od Tx. V průběhu protivirové léčby je třeba pečlivě monitorovat hladiny imunosupresiv.
Pacienti s rekurencí HCV po Tx jater s GT1, GT4, GT5 a GT6 bez cirhózy (fibróza F0–F3) nebo s kompenzovanou cirhózou štěpu mohou být léčeni fixní kombinací SOF/LDV po dobu 12 týdnů nebo kombinací SOF/VEL, doba léčby je 12 týdnů. Dávkování imunosupresiv není třeba upravovat, pravidelná monitorace jejich hladin je však doporučena.
Pacienti s rekurencí HCV po Tx jater s GT2 a GT3, bez cirhózy (fibróza F0–F3) a s kompenzovanou cirhózou štěpu mají být léčeni fixní kombinací SOF/VEL po dobu 12 týdnů. Dávkování imunosupresiv není třeba upravovat.
Pacienti s rekurencí HCV po Tx jater s GT HCV2 a HCV3 bez ohledu na stupeň fibrózy jaterního štěpu mají být léčeni fixní kombinací SOF/VEL, doba léčby je 12 týdnů. Dávkování imunosupresiv není třeba před léčbou upravovat.
Pacienti s rekurencí HCV po Tx jater infikovaní GT1–6, bez cirhózy (fibróza F0–F3) a s kompenzovanou cirhózou štěpu a eGFR < 30 ml/min/1,73 m2 mohou být léčeni fixní kombinací GLE/PIB, doba léčby je 12 týdnů. V průběhu léčby a po jejím ukončení má být pravidelně monitorována hladina imunosupresiv a upravena dle potřeby.
Pacienti s rekurencí HCV po Tx jater, s dekompenzovanou cirhózou štěpu (funkční klasifikace Child-Pugh B a C) mají být léčeni fixní kombinací SOF/LDV (GT1, GT4, GT5 a GT6) nebo fixní kombinací SOF/VEL (všechny GT). Doba léčby je 12 týdnů spolu s RBV dle hmotnosti (1 000 mg u pacientů < 75 kg, 1 200 mg u pacientů ≥ 75 kg). Počáteční dávka RBV může být u těchto pacientů snížena na 600 mg a upravena dle tolerance.
Dávka RBV má být upravena individuálně dle renálních funkcí, u pacientů s cirhózou štěpu má být zahájeno podávání RBV v dávce 600 mg denně a dávka upravena dle tolerance. Pacienti s kontraindikací podání RBV mají být léčeni fixní kombinací SOF/LDV nebo SOF/VEL po dobu 24 týdnů.
12.5.5. Léčba pacientů s dekompenzovanou cirhózou jater, kteří nejsou kandidáty Tx jater
U pacientů s dekompenzovanou jaterní cirhózou, funkční klasifikace Child-Pugh B a C, kteří nejsou kandidáty Tx jater, je cílem léčby zlepšení jaterní funkce a prodloužení přežití. V případě absence závažných komorbidit má proto být léčba zahájena bezodkladně. U těchto nemocných je kontraindikována léčba proteázovým inhibitorem. Pacienti mohou být léčeni fixní kombinací SOF/LDV (GT1, GT4, GT5, GT6) nebo fixní kombinací SOF/VEL (všechny GT) spolu s RBV dle hmotnosti pacienta (1 000 mg u pacientů < 75 kg, 1 200 mg u pacientů ≥ 75 kg). Dávka RBV může být snížena na 600 mg a upravena dle tolerance. Doba léčby v kombinaci s RBV je 12 týdnů, při kontraindikaci podání RBV má být léčba prodloužena na 24 týdnů. Vzhledem k vyššímu výskytu nežádoucích účinků u pacientů s dekompenzovanou cirhózou vyžadují tito nemocní častější laboratorní i klinické kontroly.
12.5.6. Léčba pacientů s hepatocelulárním karcinomem bez indikace k Tx jater
Protivirová léčba je indikována pouze u pacientů s malým HCC v případě, že lze u pacienta použít některou potenciálně kurativní metodu léčby (resekce, radiofrekvenční ablace, transarteriální chemoembolizace). V takovém případě se pravidla léčby této skupiny pacientů nijak neliší od pravidel probraných v předchozích kapitolách.
12.6. Léčba pacientů s komorbiditami
12.6.1. Koinfekce HCV/HBV
U naprosté většiny pacientů s koinfekcí HCV/HBV je hlavní příčinou jaterního onemocnění HCV, replikace HCV tlumí replikaci HBV, proto lze zpravidla v séru prokázat HCV RNA, zatímco sérová hladina HBV DNA je pod hranicí detekce. Z uvedeného vyplývá, že u těchto osob je zapotřebí stanovit replikační aktivitu obou virů, tj. stanovit sérové koncentrace HBV DNA i HCV RNA. Indikováno je i vyšetření sérologie HDV (hepatitis D virus, případně i HDV RNA). V případech kombinované infekce HCV/HBV + HDV lze postupovat stejně jako u monoinfekce HCV.
Pacienti, kteří současně splní kritéria k zahájení léčby HBV infekce dle platných doporučení, mají zahájit i léčbu HBV.
Pacienti, kteří jsou HBsAg pozitivní (s nízkou viremií, nesplňující kritéria k zahájení léčby), mají dostat při zahájení léčby HCV infekce profylaxi reaktivace HBV infekce nukleosidovými/nukleotidovými analogy. Anti-HBV profylaxe má být ukončena nejdříve 12 týdnů po ukončení léčby HCV infekce a pacient má být poté sledován v měsíčních intervalech (monitorace HBV DNA).
V případě izolované pozitivity anti-HBc má být monitorována aktivita ALT v měsíčních intervalech, protivirová léčba HBV infekce má být zahájena v případě opětovné pozitivity HBsAg a/nebo HBV DNA.
12.6.2. Osoby s extrahepatálními manifestacemi HCV infekce
Delší dobu je známa asociace HCV mnoha onemocnění autoimunitní povahy nebo povahy imunokomplexového orgánového postižení. Typickým zástupcem tohoto typu postižení je systémová vaskulitida s multiorgánovým postižením při smíšené kryoglobulinemii. Nepochybná je i asociace HCV infekce s B buněčným non-Hodgkinským lymfomem (B-NHL). U většiny těchto extrahepatálních manifestací je v tuto chvíli prokazatelný přínos bezinterferonových režimů a dosažení SVR. Podle některých prací se zdá, že dosažení SVR12 může u HCV asociovaných B-NHL vést k jejich regresi, pacienti s B-NHL mají být léčeni bezinterferonovým režimem bez RBV v kombinaci se specifickou chemoterapií. V úvahu je třeba vzít potenciální lékové interakce.
O ústupu a zlepšení klinických manifestací smíšené kryoglobulinemie se v současné době při dosažení SVR nepochybuje.
12.6.3. Pacienti s poruchou funkce ledvin a v pravidelném dialyzačním léčení
12.6.3.1. Diagnostika HCV infekce u pacientů s onemocněním ledvin
Vyšetření anti-HCV je indikováno při zahájení dispenzarizace pacienta v nefrologické ambulanci, zejména při stadiu CKD (chronic kidney disease) 3b a vyšším, dále pak při zahájení programu náhrady funkce ledvin (pravidelná hemodialýza, peritoneální dialýza, příprava k Tx ledviny). Vyšetření anti-HCV má být následně prováděno alespoň 1× ročně, při nově vzniklé elevaci ALT nad dvojnásobek normy ihned, pak s odstupem 4 týdnů. Anti-HCV pozitivní, HCV RNA negativní pacienti s CKD mají mít jako screeningové vyšetření testováno HCV RNA 1× ročně.
Při zjištění anti-HCV pozitivity má být testována HCV RNA. V případě, že je pozitivní, má být pacient odeslán do specializované hepatologické či infekční ambulance, má být kvantitativně stanovena HCV RNA a vyšetřen genotyp a subtyp viru, posouzena jaterní funkce (jaterní enzymy, bilirubin, albumin, protrombinový čas). Metodou volby je nyní neinvazivní vyšetření pokročilosti jaterní fibrózy metodou měření jaterní elasticity/tuhosti. Jaterní biopsie má být provedena pouze u vybraných případů k vyloučení jiné jaterní choroby, např. amyloidózy. Gastroskopie má být doplněna u pacientů s cirhózou s tuhostí jater nad 20 kPa k posouzení známek portální hypertenze.
Protivirová léčba má být zvážena u všech pacientů s CKD, s prokázanou HCV infekcí (akutní i chronickou). Interferonové režimy nejsou u pacientů v programu náhrady funkce ledvin doporučeny ani v případě, že ještě nemají pokročilou fibrózu jater. Léčebný režim určuje hepatolog/infektolog na základě následujících parametrů: GT HCV, stupeň fibrózy, přidružená medikace, perspektiva Tx ledviny. Praktický postup vyšetření anti-HCV pozitivního pacienta s CKD před zařazením do čekací listiny k Tx ledviny je uveden na schématu 1.
Schéma 1. Praktický postup před zařazením do čekací listiny k transplantaci ledviny u anti-HCV pozitivních pacientů. Scheme 1. Curent recommendations for approach to the anti-HCV positive patients just before being listed for kidney transplantation. 
HCV – hepatitis C virus, RNA – ribonukleová kyselina, Tx – transplantace HCV infekce je častější u pacientů s onemocněním ledvin, zejména pak u osob v PDL. K léčbě HCV mohou být zvažováni pacienti s CKD stadia 4 s významně omezenou funkcí ledvin (eGFR = 15–29 ml/min/1,73 m2) nebo pacienti s CKD stadia 5 (eGFR < 15 ml/min/1,73 m2 nebo v PDL), dále pak pacienti po Tx ledviny, pacienti s cirhózou jater a renálním selháním, pacienti po Tx jater a s poškozením ledvin vlivem toxicity kalcineurinových inhibitorů nebo pacienti se smíšenou kryoglobulinemií a HCV-asociovanou glomerulonefritidou. U některých pacientů může úspěšná protivirová léčba zlepšit funkci ledvin.
U pacientů v PDL je HCV infekce spojena s vyšší všeobecnou mortalitou i s jaterním onemocněním spojenou mortalitou, kardiovaskulární mortalita zůstává přesto vedoucí příčinou mortality pacientů v PDL. Základním kritériem pro zahájení protivirové léčby pacienta v PDL je perspektiva Tx ledviny, v úvahu je třeba brát rovněž hledisko epidemiologické. Léčba pacientů s významnou poruchou funkce ledvin a v PDL by měla být vedena na pracovišti majícím s touto skupinou nemocných zkušenosti.
V roce 2016 byla vydána společná doporučení ČHS ČLS JEP a České nefrologické společnosti pro diagnostiku a terapii HCV infekce.
12.6.3.2. Terapeutické možnosti
Pacienti s HCV infekcí a mírnou a středně těžkou poruchou funkce ledvin (eGFR > 30 ml/min/1,73 m2) mají být léčeni dle standardních doporučení. Dávky antivirotik se neupravují, má být preferován režim bez RBV. Pacienti s těžkou poruchou funkce ledvin (eGFR < 30 ml/min/1,73 m2) a pacienti v PDL mají být léčeni v centrech, která mají s léčbou zkušenost, ve spolupráci s ošetřujícím nefrologem.
SOF má být u pacientů s eGFR < 30 ml/min/1,73 m2 s velikou opatrností a pouze v případě, že není možná jiná léčebná alternativa. Pacienti s těžkou poruchou funkce ledvin (eGFR < 30 ml/min/1,73 m2) nebo v PDL, ať jsou či nejsou indikováni k Tx ledviny, mají být léčeni kombinací GLE/PIB (všechny GT) 8 nebo 12 týdnů, v souladu s obecnými doporučeními.
Pacienti s GT1a a k léčbě naivní pacienti s GT4 s těžkou poruchou funkce ledvin (eGFR < 30 ml/min/1,73 m2) nebo v PDL, s HCV RNA ≤ 800 000 IU/ml mohou být léčeni kombinací GZR/EBR po dobu 12 týdnů.
Pacienti s GT1b s těžkou poruchou funkce ledvin (eGFR < 30 ml/min/ /1,73 m2) nebo v PDL, s HCV RNA ≤ 800 000 IU/ml mohou být léčeni kombinací GZR/EBR po dobu 12 týdnů nebo kombinací ritonavirem potencovaného paritapreviru, ombitasviru a dasabuviru, doba léčby 12 týdnů. Rizika a užitek protivirové léčby HCV pro pacienta s chronickým selháním ledvin mají být vždy posouzeny individuálně, zejména s přihlédnutím k indikaci k Tx ledviny.
12.6.4. Léčba HCV infekce po orgánových Tx
HCV infekce je považována v řadě center za kontraindikaci orgánové Tx (ledviny, jater, plic, tenkého střeva, pankreatu). Pacienti mohou být léčeni před i po Tx orgánů s ohledem na jejich očekávané přežití. Před Tx ledviny, srdce, plic, pankreatu a tenkého střeva můžeme pacienty léčit dle platných obecných odporučení, s ohledem na lékové interakce u pacientů s významnou přidruženou medikací. Po Tx je možno zahájit léčbu kombinací SOF s LDV (GT1, GT4, GT5 a GT6) nebo kombinací SOF s VEL (všechny genotypy) dle obecných doporučení, doba léčby je 12 týdnů. Dávku imunosuprese není třeba upravovat.
U pacientů po orgánových Tx s eGFR < 30 ml/min/1,73 m2 je možno použít kombinaci GLE a PIB, doba léčby je 12 týdnů. Je doporučeno pravidelné monitorování hladiny imunosuprese v průběhu léčby a po jejím ukončení, event. úprava dávek podávaných imunosupresiv.
12.6.5. Hemofilici a pacienti s hemoglobinopatiemi
Léčba HCV infekce u pacientů s různými typy hemofilií se nijak neliší od pacientů HCV pozitivních bez hemofilie. U pacientů s hemoglobinopatiemi jsou kontraindikovány režimy obsahující RBV, jinak je výběr léčebného režimu shodný s obecnými doporučeními.
12.6.6. Děti a adolescenti
Přenos z matky na dítě je v této věkové skupině nejčastějším zdrojem infekce, nicméně nelze vyloučit ani například nozokomiální akvizici. Adolescenti jsou pak v riziku přenosu nitrožilní aplikací drog. Riziko přenosu na dítě je vyšší u HCV/HIV koinfikovaných žen. Všechny děti narozené HCV infikovaným ženám mají být testovány na přítomnosti HCV infekce v 18 měsících věku.
Adolescenti nad 12 let věku nebo vážící více než 35 kg s GT1, GT4, GT5 a GT6 mají být léčeni fixní kombinací SOF/LDV 12 týdnů. Adolescenti nad 12 let infikovaní GT2 a GT3 mohou být s opatrností léčeni režimy, které jsou schváleny k léčbě dospělých pacientů. U dětí mladších 12 let má být léčba odložena do doby, než budou k dispozici pangenotypové režimy DAA schválené k léčbě dětí.
12.6.7. Léčba osob užívajících drogy a na substituční léčbě
Osoby s anamnézou PWID zahrnují ty, kteří drogy injekčně aplikovali v minulosti, s jejich injekční aplikací skončili v nedávné době či stále drogy užívají. Některé z nich jsou na opioidní substituční terapii (OST) metadonem nebo buprenorfinem. V Evropě jsou 2/3 pacientů s HCV infekcí infikovány při nitrožilní aplikaci drog. Prevalence chronické HCV infekce činí u PWID v Evropě, stejně jako v ČR, přibližně 40 %. Doporučení pro testování HCV infekce v této populaci je založeno na vysoké prevalenci infekce a na faktu, že léčba této populace významně snižuje riziko přenosu a morbiditu i mortalitu s HCV infekcí spojenou. Medicínsky tedy není odůvodnitelné odmítnutí protivirové léčby uživatelům drog, rozhodující je motivace a ochota pacienta k léčbě. Ideální je léčba v rámci multidisciplinární spolupráce s terapeutickými komunitami a AT poradnami, které zabezpečují OST.
PWID by měli být dobrovolně a v pravidelných intervalech testováni pomocí vyšetření anti-HCV protilátek nebo HCV RNA. Všichni, u kterých je diagnostikována HCV infekce, by měli být léčeni, neboť léčba DAA je i v této skupině pacientů bezpečná a vysoce účinná. Před zahájením léčby by měl být pacient podrobně poučen o přenosu HCV, rizikových faktorech progrese fibrózy, léčbě, riziku reinfekce a strategiích minimalizace rizika reinfekce po úspěšné léčbě. Ve skupině pacientů užívajících OST není nutná úprava dávky metadonu ani buprenorfinu.
Po dosažení SVR má být pacient sledován k vyloučení možné reinfekce vyšetřením HCV RNA, ideálně 2× ročně v případě, že u něj trvá rizikové chování.
12.6.8. Pacienti s HCV/HIV koinfekcí
Infekce HIV negativně ovlivňuje průběh akutní i chronické HCV infekce. Proto je testování HCV standardní součástí vyšetřování pacientů s infekcí HIV. Jaterní choroby, zejména vzniklé v souvislosti s chronickou HCV infekcí, jsou významnou příčinou úmrtí mezi HIV pozitivními pacienty. Pravidla a varianty protivirové léčby chronické HCV infekce u HCV/HIV koinfikovaných osob se neliší od pacientů bez HIV koinfekce. Pozornost je třeba věnovat především lékovým interakcím mezi DAA a AR léky, před zahájením léčby infekce HCV je někdy nezbytné upravit AR terapii. Základní přehled možných terapeutických variant a lékových interakcí ukazuje tab. 9.
Table 9. Pehled základních možných interakcí terapeutických variant HIV a HCV infekce.
Tab. 9. Drug-drug interactions between HCV DAAs and HIV antiretrovirals.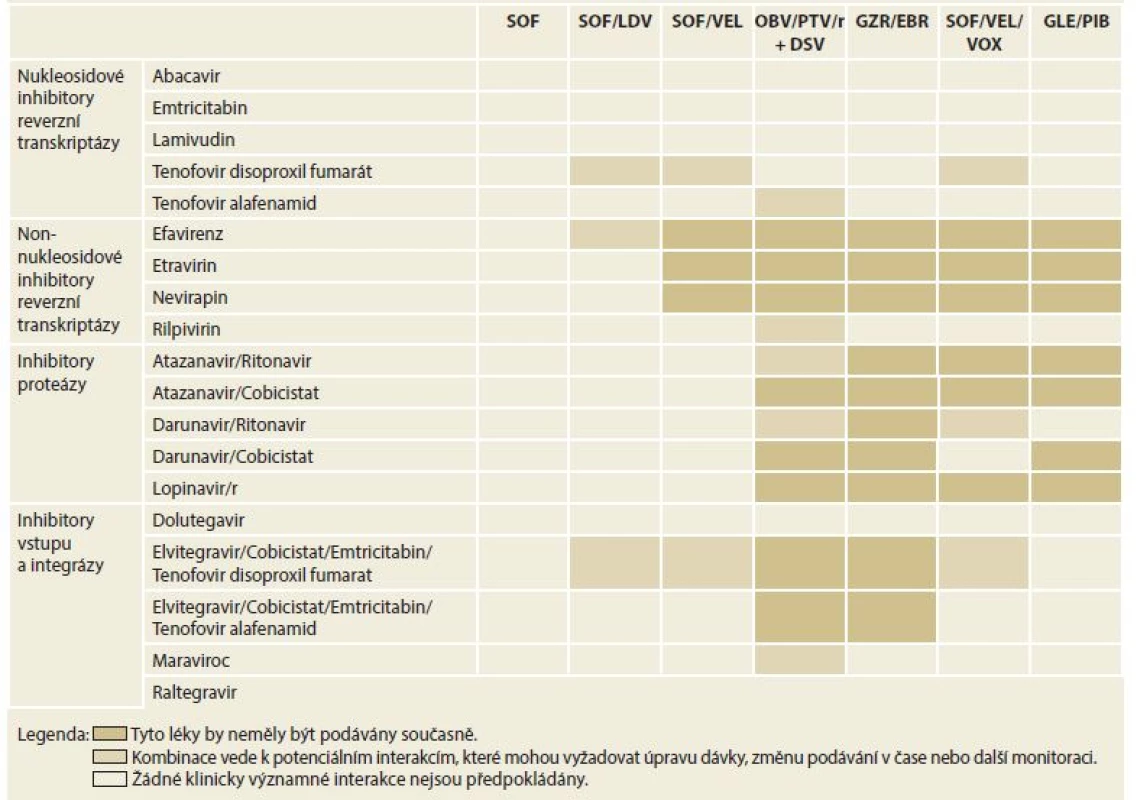
SOF – sofosbuvir, LDV – ledipasvir, VEL – velpatasvir, OBV – ombitasvir, PTV – paritaprevir, r – ritonavir, DSV – dasabuvir, GZR – grazoprevir, EBR – elbasvir, GLE glekaprevir, PIB pibrentasvir, VOX – voxilaprevir, HCV – hepatitis C virus 12.6.9. Léčba pacientů, u kterých selhala předchozí protivirová léčba
Léčba pacientů, u nichž selhala kombinace PEG/IFN + RBV, PEG/IFN + RBV a SOF nebo SOF s RBV, je popsána v obecných doporučeních.
12.6.10. Selhání léčby čistě perorálním režimem DAA
U pacientů, u nichž selhala jakákoli léčba DAA, by mělo být provedeno RAS za účelem výběru co nejúčinnějšího protivirového režimu na základě přítomnosti RAS. Léčba má být vedena v centru se zkušeností s opakovanou léčbou obtížně léčitelných pacientů, ve spolupráci s virologem.
Pacienti bez cirhózy nebo s kompenzovanou cirhózou, funkční klasifikace Child-Pugh A, u kterých selhala léčba DAA (režim s proteázovým inhibitorem a/nebo NS5A inhibitorem), mají být léčeni fixní kombinací SOF/VEL/VOX, doba léčby je 12 týdnů.
Pacienti bez cirhózy nebo s kompenzovanou cirhózou, funkční klasifikace Child-Pugh A, u kterých selhala léčba DAA (režim s proteázovým inhibitorem a/nebo NS5A inhibitorem) a kteří mají negativní prediktory odpovědi na léčbu, jako jsou pokročilé jaterní onemocnění, opakované selhání terapie, nepříznivý rezistenční profil v NS5A oblasti, mohou být léčeni kombinací SOF spolu s GLE/PIB, doba léčby je 12 týdnů.
Velmi obtížně léčitelní pacienti, pacienti s NS5A RAS a ti, kteří selhali 2× v léčbě obsahující proteázový a/nebo NS5A inhibitor, mohou být léčeni fixní kombinací SOF/VEL/VOX nebo kombinací SOF spolu s GLE/PIB. V obou případech je možno přidat RBV dle hmotnosti pacienta (1 000 mg u pacientů < 75 kg, 1 200 mg u pacientů ≥ 75 kg) a/nebo prodloužit délku léčby na 16 nebo 24 týdnů.
Pacienti s dekompenzovanou cirhózou, funkční klasifikace Child-Pugh B a C, u kterých selhala léčba DAA (režim s proteázovým inhibitorem a/nebo NS5A inhibitorem), nemohou být již léčeni proteázovým inhibitorem, a proto mají být léčeni fixní kombinací SOF/VEL s RBV dle hmotnosti pacienta (1 000 mg u pacientů < 75 kg, 1 200 mg u pacientů ≥ 75 kg). Doba léčby je 24 týdnů.
13. Léčba akutní HCV infekce
Průběh akutní HCV infekce je ve většině případů asymptomatický, ale k chronickému průběhu onemocnění dochází v 50–90 % případů. Symptomatický průběh, ženské pohlaví, nižší věk a GT IL28B CC jsou faktory asociované se spontánní eliminací viru. Žádný z těchto parametrů však nemá dostatečnou individuální prediktivní hodnotu. Pacienti s diagnostikovanou akutní hepatitidou C by měli být považováni za kandidáty protivirové léčby. Cílem protivirové léčby akutní HCV infekce je zabránění přechodu onemocnění do chronického stadia. Bezodkladné zahájení DAA terapie v případech akutní infekce brání přechodu do chronicity, zlepšuje klinický průběh akutního onemocnění a je vysoce nákladově efektivní. Ideální režim, jeho trvání ani ideální okamžik zahájení protivirové léčby nebyly dosud metodami medicíny založené na důkazech stanoveny. Dostupné jsou pouze malé, izolované kohortové studie. Na jejich základě je považována za minimální dobu vhodnou k trvání léčby s uspokojivou účinností doba 8 týdnů. Mohou být léčeni kombinací SOF/LDV (GT1, GT4, GT5 a GT6) či kombinací ombitasvir/paritaprevir/ritonavir + dasabuvir (tzv. 3D) u GT1b nebo kombinací GZR/EBR (GT1 a GT4). Stejně tak může být použit pangenotypový režim, GLE/PIB nebo SOF/VEL. Doba léčby je rovněž 8 týdnů.
Nadále platí, že není indikace k podání DAA jako postexpoziční profylaxe.
14. Monitorování léčby HCV infekce
14.1. Monitorování účinnosti léčby
Monitorování účinnosti léčby je založeno na opakovaném sledování sérových koncentrací HCV RNA. K tomuto účelu je třeba užívat metody o standardní citlivosti ≤ 15 IU/ml. Nutné je dbát na to, aby při sledování jednoho konkrétního pacienta byla využívána stejná metoda, ideálně stejná laboratoř. Pro účely monitorování účinnosti léčby a pro kvalifikované rozhodování o pokračování či naopak o ukončení protivirové léčby je třeba respektovat definované časové body, kdy je vyšetření HCV RNA indikováno. Časové body, kdy je vhodné vyšetření HCV RNA, se mohou u jednotlivých léčebných variant lišit.
Obecně jde především o tyto indikace:
- zahájení léčby;
- rozhodnutí o úspěchu léčby, tj. ve 12. a/nebo 24. týdnu po skončení léčby (SVR).
14.2. Monitorování bezpečnosti léčby HCV infekce
Dosud nebyly definovány vhodné intervaly klinických kontrol z pohledu monitorování možných nežádoucích účinků léčby. Tyto je třeba individualizovat s ohledem na dostupná data o výskytu možných vážnějších nežádoucích reakcí, které jsou však u bezinterferonových léčebných režimů velmi vzácné. Nežádoucí reakce byly prakticky u všech v současnosti preferovaných režimů příčinou ukončení léčby v < 1 % případů, výskyt všech nežádoucích účinků v registračních studiích jednotlivých režimu se významně nelišil od jejich výskytu v ramenech s podáváním placeba.
14.3. Monitorování lékových interakcí během léčby HCV infekce
Dostupné nové protivirové léky často přinášejí množství lékových interakcí. Proto je třeba před podáváním a během podávaní nových léčebných režimů opakovaně monitorovat současně podávanou medikaci. V nutných případech je nutné konkomitantní léčbu přerušit (pokud lze) nebo zvolit alternativu s menším rizikem interakcí.
15. Péče o pacienty s dosaženou SVR
Infekci HCV u pacientů bez jaterní cirhózy, kteří dosáhli SVR, je možno považovat v daném případě za vyléčenou a HCV RNA již dále nemusí být vyšetřována. Pacienti se SVR, u nichž ale byly před zahájením protivirové léčby přítomny ještě jiné možné příčiny jaterního onemocnění (diabetes mellitus 2. typu, zvýšený příjem alkoholu), by měli být dále sledováni v odborných poradnách. Interval sledování nebyl stanoven.
Pacienti s jaterní cirhózou a pacienti s přemosťující fibrózou (METAVIR F3) a jaterní cirhózou (METAVIR F4), kteří dosáhnou SVR, by měli být zařazeni do programů surveillance HCC a měla by být u nich monitorována možná progrese portální hypertenze. U této skupiny nemocných je proto indikována abdominální sonografie v intervalu 6 měsíců, a pokud byly přítomny jícnové varixy před zahájením léčby, je třeba provádět endoskopické vyšetření v intervalu 1 roku. Další faktory – diabetes mellitus 2. typu či anamnéza abúzu alkoholu – mohou tento navrhovaný postup modifikovat.
U osob s vysokým rizikem infekce, jako jsou např. intravenózní uživatelé drog či homosexuálové, je třeba uvažovat i o riziku reinfekce. Riziko reinfekce je nicméně malé, publikovaná data se pohybují v rozmezí 1–8 % ročně.
16. Sledování pacientů neléčených a pacientů s neúspěšnou léčbou
Pacienti neléčení a pacienti s prodělanou neúspěšnou terapií (tj. bez SVR) by měli být dále pravidelně sledováni. Základním pravidlem má být zdokumentování důvodu nepodání protivirové léčby v daném okamžiku a případně typu protivirové odpovědi a pravděpodobného důvodu selhání léčby (zejména při suspekci na špatnou adherenci k léčbě). Neléčení pacienti by měli podstoupit kompletní vyšetření každých 12–24 měsíců, v intervalu 2 let může být provedeno i neinvazivní měření stadia jaterní fibrózy. Pacienti s jaterní cirhózou by měli absolvovat program surveillance HCC, tj. abdominální ultrasonografii každých 6 měsíců.
17. Vakcinace proti ostatním virovým infekcím jater
Všichni pacienti s chronickou HCV infekcí by měli být očkováni proti HAV. Séronegativní pacienti (tj. HBsAg, anti-HBc total a anti-HBs negativní) by měli být očkováni i proti HBV.
Datum schválení výborem ČHS ČLS JEP: 18. 1. 2019
Datum schválení výborem SIL ČLS JEP: 25. 2. 2019
prof. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
Sources
1. European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol 2018; 69 (2): 461–511. doi: 10.1016/j. jhep.2018.03.026.
2. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control and Prevention. MMWR Recomm Rep 1998; 47 (RR-19): 1–39.
3. Castéra L, Sebastiani G, Le Bail B et al. Prospective comparison of two algorithms combining non-invasive methods for staging liver fibrosis in chronic hepatitis C. J Hepatol 2010; 52 (2): 191–198. doi: 10.1016/j.jhep.2009.11.008.
4. Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol 2017; 2 (3): 161–176. doi: 10.1016/S2468-1253 (16) 30181-9.
5. European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2016. J Hepatol 2017; 66 (1): 153–194. 10.1016/j.jhep.2016.09.001.
6. Zeuzem S, Foster GR, Wang S et al. Glecaprevir-pibrentasvir for 8 or 12 weeks in HCV genotype 1 or 3 infection. N Engl J Med 2018; 378 (4): 354–369. doi: 10.1056/NEJMoa1702417.
7. Forns X, Lee SS, Valdes J et al. Glecaprevir plus pibrentasvir for chronic hepatitis C virus genotype 1, 2, 4, 5, or 6 infection in adults with compensated cirrhosis (EXPEDITION-1): a single-arm, open-label, multicentre phase 3 trial. Lancet Infect Dis 2017; 17 (10): 1062–1068. doi: 10.1016/S1473-3099 (17) 30496-6.
8. Afdhal N, Zeuzem S, Kwo P et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med 2014; 370 : 1889–1898. doi: 10.1056/NEJMoa1402454.
9. Afdhal N, Reddy KR, Nelson DR et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med 2014; 370 (16): 1483–1493. doi: 10.1056/NEJMoa1316366.
10. Kowdley KV, Gordon SC, Reddy KR et al. Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without cirrhosis. N Engl J Med 2014; 370 (20): 1879–1888. doi: 10.1056/NEJMoa1402355.
11. Naggie S, Cooper C, Saag M et al. Ledipasvir and sofosbuvir for HCV in patients coinfected with HIV-1. N Engl J Med 2015; 373 (8): 705–713. doi: 10.1056/NEJMoa1501315.
12. Reddy KR, Bourlière M, Sulkowski M et al. Ledipasvir and sofosbuvir in patients with genotype 1 hepatitis C virus infection and compensated cirrhosis: an integrated safety and efficacy analysis. Hepatology 2015; 62 (1): 79–86. doi: 10.1002/hep.27826.
13. Wilson E, Kattakuzhy S, Kwo P et al. Real-world effectiveness of 8 vs 12 weeks of ledipasvir/sofosbuvir (LDV/SOF) in Blacks with HCV: a comparative analysis of clinical trials with real-world cohorts. Hepatology 2017; 66 : 608A. [online]. Available from: http: //www.natap.org/2017/AASLD/AASLD_133.htm.
14. Kowdley KV, Sundaram V, Jeon CY et al. Eight weeks of ledipasvir/sofosbuvir is effective for selected patients with genotype 1 hepatitis C virus infection. Hepatology 2017; 65 (4): 1094–1103. doi: 10.1002/hep.29005.
15. Buggisch P, Vermehren J, Mauss S et al. Real-world effectiveness of 8-week treatment with ledipasvir/sofosbuvir in chronic hepatitis C. J Hepatol 2018; 68 (4): 663–671. doi: 10.1016/j.jhep.2017.11.009.
16. Zeuzem S, Ghalib R, Reddy KR et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic hepatitis C virus genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med 2015; 163 (1): 1–13. doi: 10.7326/M15-0785.
17. Rockstroh JK, Nelson M, Katlama C et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE COINFECTION): a non-randomised, open-label trial. Lancet HIV 2015; 2 (8): e319–e327. doi: 10.1016/S2352-3018 (15) 00114-9.
18. Kwo P, Gane EJ, Peng CY et al. Effectiveness of elbasvir and grazoprevir combination, with or without ribavirin, for treatment-experienced patients with chronic hepatitis C infection. Gastroenterology 2017; 152 (1): 164–175, e164. doi: 10.1053/j.gastro.2016.09.045.
19. Wei LJ, Zhdanov K, Burnevich E et al. Efficacy and safety of elbasvir/grazoprevir in treatment-naive patients with chronic HCV GT1, GT4 and GT6 infection (C-CORAL): a Phase III randomized multinational clinical trial. J Hepatol 2017; 66 (1): S529. doi: 10.1016/S0168-8278 (17) 31460-5.
20. Zeuzem S, Serfaty L, Vierling J et al. The safety and efficacy of elbasvir and grazoprevir in participants with hepatitis C virus genotype 1b infection. J Gastroenterol 2018; 53 (5): 679–688. doi: 10.1007/s00535-018-1429-3.
21. Abergel A, Hezode C, Asselah T et al. High efficacy and safety of grazoprevir and elbasvir for 8 weeks in treatment-naive, non-severe fibrosis HCV GT1b-infected patients: interim results of the STREAGER study. J Hepatol 2018; 68 (Suppl 1): S110. doi: 10.1016/S0168-8278 (18) 30437-9.
22. Ferenci P, Bernstein D, Lalezari J et al. ABT-450/r-ombitasvir and dasabuvir with or without ribavirin for HCV. N Engl J Med 2014; 370 : 1983–1992. doi: 10.1056/NEJMoa1402338.
23. Dore GJ, Conway B, Luo Y et al. Efficacy and safety of ombitasvir/paritaprevir/r and dasabuvir compared to IFN-containing regimens in genotype 1 HCV patients: the MALACHITE-I/II trials. J Hepatol 2016; 64 (1): 19–28. doi: 10.1016/j.jhep.2015.08.015.
24. Wyles D, Saag M, Viani RM et al. TURQUOISE-I Part 1b: ombitasvir/paritaprevir/ritonavir and dasabuvir with ribavirin for hepatitis C virus infection in HIV-1 coinfected patients on darunavir. J Infect Dis 2017; 215 (4): 599–605. doi: 10.1093/infdis/jiw597.
25. Welzel TM, Asselah T, Dumas EO et al. Ombitasvir, paritaprevir, and ritonavir plus dasabuvir for 8 weeks in previously untreated patients with hepatitis C virus genotype 1b infection without cirrhosis (GARNET): a single-arm, open-label, Phase 3b trial. Lancet Gastroenterol Hepatol 2017; 2 (7): 494–500. doi: 10.1016/S2468-1253 (17) 30071-7.
26. Agarwal K, Gaeta BG, Lee SS et al. Long-term clinical outcomes in HCV genotype 1-infected patients receiving ombitasvir/paritaprevir/ritonavir and dasabuvir ± ribavirin: first interim safety and efficacy results from TOPAZ-I. Hepatology 2016; 64 : 427. [online]. Dostupné z: http: //www.natap.org/2016/AASLD/AASLD_54.htm.
27. Welzel TM, Isakov V, Trinh R et al. Efficacy and safety of ombitasvir, paritaprevir/ritonavir and dasabuvir without ribavirin in patients with HCV genotype 1b with or without compensated cirrhosis: pooled analysis across 5 clinical trials. J Hepatol 2016; 64 (2): S824. doi: https: //doi.org/10.1016/S0168-8278 (16) 01613-5.
28. Foster GR, Afdhal N, Roberts SK et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med 2015; 373 (27): 2608–2617. doi: 10.1056/NEJMoa1512612.
29. Lawitz E, Mangia A, Wyles D et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 368 (20): 1878–1887. doi: 10.1056/NEJMoa1214853.
30. Snopková S, Rozsypal H, Aster V et al. Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV. [online]. Dostupné z: https: //www.infekce.cz/ DoporART16.htm.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2019 Issue 2-
All articles in this issue
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
- Idiopatické střevní záněty a fertilita mužů
- Ektopický pankreas jako zdroj krvácení do horní etáže trávicího traktu
- Dieulafoy léze žaludku
- Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat
- Díl II. – Epidemiologie idiopatických střevních zánětů v české populaci: dostupné datové zdroje, prevalence léčených pacientů a celková mortalita
- Laparoskopická resekce jater pro alveolární echinokokózu
- Právoplatnosť slovenskej verzie dotazníka SIBDQ v kohorte pacientov s idiopatickými střevními záněty
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dieulafoy léze žaludku
- Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat
- Ektopický pankreas jako zdroj krvácení do horní etáže trávicího traktu
- Idiopatické střevní záněty a fertilita mužů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

