-
Medical journals
- Career
Imunoglobulin G4 asociovaná sklerozující cholangitida u pacienta s Crohnovou nemocí
Authors: J. Drahoš; P. Vyhnálek
Authors‘ workplace: Interní oddělení, Pardubická nemocnice, Nemocnice Pardubického kraje, a. s.
Published in: Gastroent Hepatol 2017; 71(1): 49-52
Category: Hepatology: Case Report
doi: https://doi.org/10.14735/amgh2016csgh.info14Overview
V našem sdělení prezentujeme případ 56letého pacienta roky léčeného pro Crohnovu nemoc a primární sklerozující cholangitidu (PSC). Histologický nález z jaterní biopsie, kterou jsme provedli ke zhodnocení pokročilosti jaterního postižení, nás upozornil na skutečnost, že se může jednat o imunoglobulin G4 asociovanou sklerozující cholangitidu (IASC). Na tuto nemoc jsme nepomýšleli, jelikož pacient neměl některé z rysů pro ni charakteristických. Netrpěl současně autoimunitní pankreatitidou, začátek jaterního onemocnění byl pozvolný – projevil se pouze pomalým nárůstem sérových koncentrací cholestatických enzymů. Začátek IASC je většinou náhlý s obstrukčním ikterem již na počátku onemocnění. IASC je většinou diagnostikována ve vyšším věku a její izolovaný výskyt bez autoimunitní pankreatitidy je popisován pouze u 2 % pacientů. Koincidence idiopatického střevního zánětu je pro IASC také netypická. Samotná vysoká sérová koncentrace imunoglobulinu G4 není ke stanovení diagnózy dostatečná, může být přítomna např. při cholangiocelulárním karcinomu či při PSC. Diagnostika IASC je založena na kombinaci histologických, zobrazovacích, biochemických a klinických nálezů, nicméně všeobecně akceptovaná diagnostická kritéria doposud neexistují. V našem případě byla rozhodující dobrá klinická i laboratorní odpověď na zahájení kortikoidní medikace, což je jedním ze základních rysů všech imunoglobulin G4 asociovaných onemocnění.
Klíčová slova:
imunoglobulin G – sklerozující cholangitida – Crohnova nemocÚvod
Imunoglobulin G4 (IgG4) asociovaná sklerozující cholangitida (IASC) patří do široké skupiny IgG4 asociovaných nemocí (IAN). Ve většině případů se vyskytuje ve spojení s autoimunitní pankreatitidou typu 1 [1 – 3]. Pro IASC jsou typické znaky charakterizující celou skupinu IAN – zvýšená plazmatická hladina IgG4, infiltrace postižené tkáně IgG4 pozitivními plazmatickými buňkami a dobrá odpověď na kortikoidní léčbu [3].
Popis případu
V naší gastroenterologické poradně byl pro ulcerózní kolitidu od roku 1991 sledován muž narozený v roce 1962. Při první kolonoskopii byly patrné chronické zánětlivé změny v celém rozsahu tlustého střeva, histologicky byla sliznice výrazně zánětlivě infiltrovaná, exulcerovaná, kryptové abscesy nalezeny nebyly. Po 1,5měsíční léčbě prednisonem byl dle tehdejších zvyklostí nasazen sulfasalazin. V dubnu 2003 bylo pro kolonoskopický nález zánětlivého postižení v oblasti colon ascendens, céka a terminálního ilea a odpovídající histologický nález onemocnění překlasifikováno na Crohnovu nemoc (CD – Crohn’s disease) a sulfasalazin byl nahrazen mesalazinem. Jednorázově v roce 2004 a poté stabilně od roku 2007 byla patrná elevace sérové koncentrace alkalické fosfatázy (ALP) a menší elevace γ-glutamyltransferázy (GGT), hodnoty bilirubinu byly v normě, pacient neměl pruritus. V březnu 2008 byla, pro vzestup hladin cholestatických enzymů a pro naše přesvědčení, že se jedná o primární sklerozující cholangitidu (PSC), zahájena léčba kyselinou ursodeoxycholovou (UDCA – ursodeoxycholic acid) v dávce 500 mg denně. O několik dní později jsme provedli endoskopickou retrográdní cholangiopankreatografii (ERCP). Žlučové cesty se ovšem nepovedlo nasondovat, ductus Wirsungi byl bez patologického nálezu. Laboratorně byl znatelný efekt medikamentozní léčby (pokles sérových koncentrací GGT i ALP). V červenci 2010 jsme pro opětovný nárůst sérové koncentrace ALP zopakovali ERCP s nálezem stenózy středního a distálního ductus choledochus s nerovným lumen, stenózy v odstupu pravého ductus hepaticus a doprovodnými stenózami intrahepatických žlučovodů (obr. 1). Při výkonu byla provedena balonová dilatace stenózy ductus choledochus (balon 10 × 30 mm). Pacient byl po provedené dilataci nadále bez obtíží, dávka UDCA byla navýšena na 750 mg denně. Dále pacient užíval dlouhodobě pouze mesalazin v dávce 3 g denně. Od roku 2013 pacienta začal trápit občasný pruritus, hodnoty bilirubinu byly nadále v normě. V dubnu 2015 jsme pro opětovný nárůst sérové koncentrace ALP a zintenzivnění potíží ve smyslu častějšího pruritu zopakovali ERCP s nálezem stenózy ductus choledochus, ductus hepaticus communis a difuzním stenotickým postižením intrahepatických žlučových cest s prestenotickými dilatacemi (obr. 2). Ductus Wirsungi nebyl vyšetřen. Dále jsme provedli jaterní biopsii, kdy byla histologicky prokázána výrazná periportální a septální fibróza s hyperplazií parenchymu, známkami chronické cholestázy a mírnými zánětlivými změnami v lobulech. Nález by podporoval diagnózu PSC, avšak pro četné plazmatické buňky ve vazivových septech bylo patologem doporučeno vyloučit IASC sérologicky (vykrájený punkční vzorek toto vyšetření bohužel neumožňoval). Hladina IgG4 byla 332,5 mg/ dl (fyziologické rozmezí hodnot naší laboratoře je 1 – 93 mg/ dl), proto jsme nasadili prednison v dávce 40 mg denně po dobu 1 měsíce a poté 20 mg denně na 6 měsíců. Již při první kontrole, tedy 1,5 měsíce od nasazení kortikoidní medikace, pacient udával odeznění pruritu. Hodnota GGT klesla, hodnota ALP je po mírném vzestupu při poslední kontrole stacionárně nízká (graf 1). V únoru 2016 byl pro pálení očí a pocení v souvislosti s užíváním prednisonu tento lék nahrazen budesonidem v dávce 9 mg denně pro jeho výrazný „first pass“ efekt a předpokládaný nižší výskyt systémových nežádoucích účinků. Pacient je nadále zcela bez potíží.
Image 1. ERCP – stenóza střední a distální části ductus choledochus s prestenotickou dilatací, stenóza v odstupu pravého ductus hepaticus, četné stenózy intrahepatických žlučovodů. Fig. 1. ERCP – stenosis of the middle and distal part of the common bile duct with pre-stenotic dilatation, stenosis of the right hepatic duct, numerous intrahepatic stenoses. 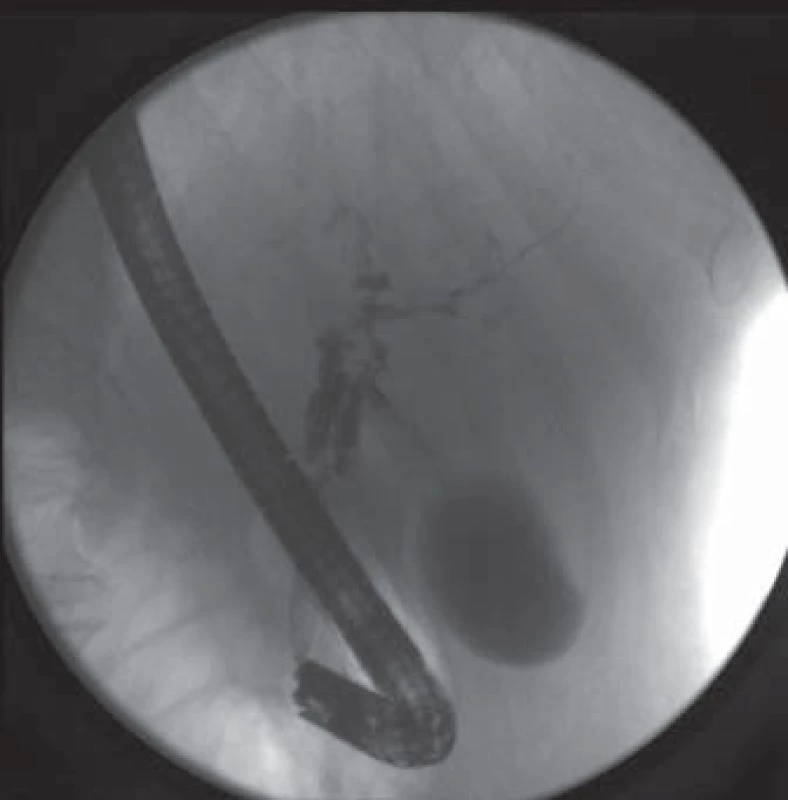
Image 2. ERCP – stenóza distálního ductus choledochus, ductus hepaticus communis, četné stenózy intrahepatických žlučovodů s prestenotickými dilatacemi. Fig.2. ERCP – stenosis of the common bile duct, common hepatic duct, multiple intrahepatic stenosis with corresponding pre-stenotic dilatations. 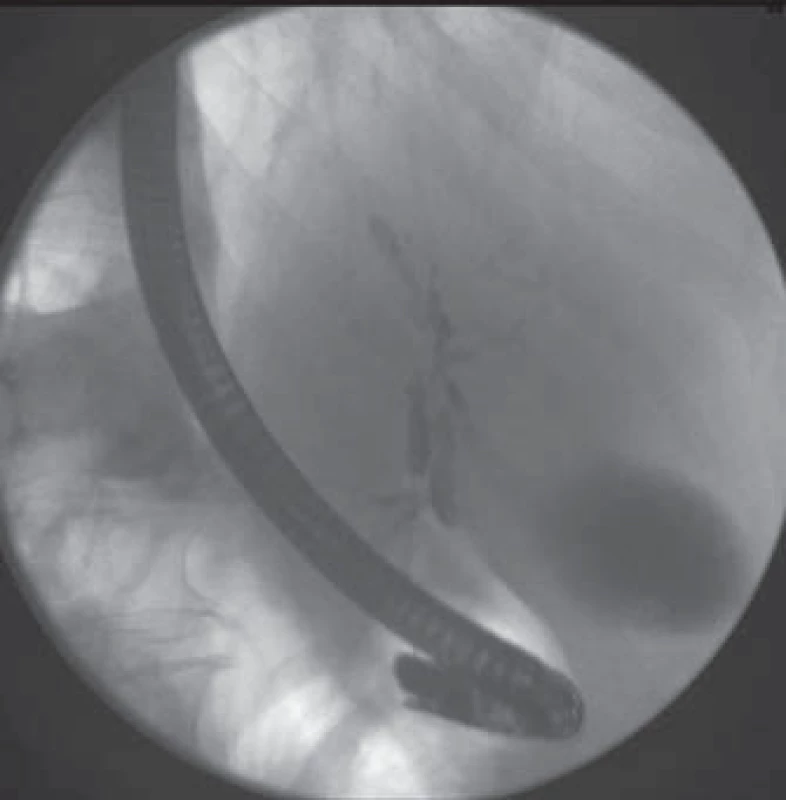
Graph 1. Vývoj GGT a ALP v letech 2003 - 2016; značkami jsou zleva doprava označeny následující události – nasazení UDCA, ERCP v roce 2010 s dilatací ductus choledochus, ERCP v roce 2015 a zahájení kortikoidní léčby. Graph 1. Development of GGT and ALP in the years 2003 - 2016; the signs indicate the following from left to right – deployment of ursodeoxycholic acid, ERCP in 2010 with bile duct dilatation, ERCP in 2015 and the initiation of corticosteroid therapy. 
Diskuze
Pacient byl 7 let léčen pro PSC UDCA. V roce 2008 byl proveden první a neúspěšný pokus o zobrazení žlučových cest – ERCP. Magnetická cholangiopankreatografie (MRCP) by byla pro pacienta méně riziková, avšak vzhledem k dobré dostupnosti ERCP na našem endoskopickém pracovišti je tato metoda u nás preferována. Léčba UDCA byla zahájena empiricky několik dní před výkonem, jelikož jsme jiné onemocnění při dlouhotrvajícím zvýšení cholestatických enzymů a současně přítomné CD nepředpokládali. Vzhledem k rychlému poklesu hladin GGT i ALP po nasazení UDCA a nepřítomnosti jakýchkoli obtíží jsme MRCP nedoplňovali. V roce 2010 byla již ERCP úspěšná, byla provedena dilatace stenózy distálního choledochu a navýšili jsme dávku UDCA na 750 mg denně. Elevace hladin ALP a GGT však přetrvávala, což jsme si vysvětlovali přítomností dalších intrahepaticky umístěných stenóz, terapeuticky neovlivnitelných. Eventuelní doplnění MRCP jsme proto nepovažovali za přínosné pro další léčbu našeho pacienta. V dubnu 2015 nás však překvapil nález četných plazmatických buněk v histologickém vzorku z jaterní biopsie a následně i vysoká hladina plazmatického IgG4. Proto jsme stáli před rozhodnutím, jak pacienta dále léčit.
IAN se 4x častěji vyskytuje u mužů než u žen a u > 90 % pacientů byla diagnostikována až po 50. roce věku [4]. IASC je třeba vždy odlišit od PSC a cholangiogenního karcinomu (CC). Vzhledem k dlouholetému sledování našeho pacienta a nepřítomnosti klinických potíží ve smyslu hubnutí, bolestí břicha či nechutenství jsme diagnózu CC nepředpokládali. K rozlišení IASC a PSC by nám pomohlo stanovení množství IgG4 pozitivních plazmatických buněk (IPPB) z bioptického vzorku, kdy diagnózu IASC podporuje průkaz > 10 IPPB na jedno zorné pole [5]. Toto vyšetření však z námi odebraného materiálu nebylo možné provést. Věk našeho pacienta a současná přítomnost idiopatického střevního zánětu by svědčily spíše pro PSC [6]. I výskyt samostatné IASC bez autoimunitní pankreatitidy je popisován pouze u 2 % pacientů [7], náš pacient však nebyl na přítomnost jiných IAN vyšetřen, jelikož neměl až na občasné svědění žádné subjektivní obtíže či laboratorní abnormality. Při diagnostice IAN je dále užíváno stanovení hladiny IgG4, kdy pro IAN svědčí hladina vyšší než 135 mg/ dl [1,4,7 – 9]. Jako hodnota, která výrazně podporuje diagnózu IAN, je pak udávána hladina vyšší než 270 mg/ dl, která má vyšší specificitu, avšak nižší senzitivitu [4,7,8]. Při podezření na izolovanou IASC není zvýšená sérová hladina IgG4 spolu s nálezy ze zobrazovacích vyšetření (v našem případě ERCP) dostačující [7]. Jsou popsány i případy pacientů s PCS, CC či jejich kombinací, kteří měli vysokou hodnotu plazmatického IgG4 [4,8,9]. Pacienta jsme již nechtěli zatěžovat dalším invazivním vyšetřením, a jelikož odpovídavost na kortikoidní medikaci je jednou ze známek IAN [7,10], zahájili jsme kortikoidní léčbu. Pro dobrou laboratorní i klinickou odpověď na nasazení prednisonu zatím neplánujeme kontrolní vyšetření žlučových cest (MRCP či ERCP). Poslední kolonoskopický nález z listopadu 2015 byl až na několik ojedinělých aft v sigmatu v normě. Vzhledem k malému počtu pacientů s CD a IASC a relativně mladému konceptu IAN není možné posoudit riziko rozvoje kolorektálního karcinomu oproti pacientům s CD a PSC.
Závěr
Diagnostika izolované IASC je i v současné době problematická, zvláště při současně se vyskytujícím idiopatickém střevním zánětu. Měla by se opírat o škálu vyšetření (histologický nález, zobrazovací vyšetření, hladina IgG4, průkaz postižení dalších orgánů). Dobrá reakce na kortikoidní léčbu je však jedním ze základních znaků IAN a může sloužit jako další diagnostické kritérium [7,10].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 22. 6. 2016
Přijato: 9. 8. 2016
MU Dr. Jan Drahoš
Interní oddělení, Pardubická nemocnice
Nemocnice Pardubického kraje, a. s.
Kyjevská 44
532 03 Pardubice
zahon@email.cz
Sources
1. Nakazawa T, Naitoh I, Hayashi K et al. Diagnosis of IgG4-related sclerosing cholangitis. World J Gastroenterol 2013; 19(43): 7661 – 7670. doi: 10.3748/ wjg.v19.i43.7661.
2. Dítě P, Novotný I, Lata J et al. Autoimunitní pankreatitida a IgG pozitivní sklerotizující cholangitida. Vnitr Lek 2011; 57(3): 254 – 257.
3. Hubers LM, Beuers U. How to diagnose immunoglobulin g4-associated cholangitis: the jack-of-all-trades in the biliary tract. Viszeralmedizin 2015; 31(3): 185 – 188. doi: 10.1159/ 000431028.
4. Inoue D, Yoshida K, Yoneda N et al. IgG4-related disease: dataset of 235 consecutive patients. Medicine 2015; 94(15): e680. doi: 10.1097/ MD.0000000000000680.
5. Deshpande V, Zen Y, Chan JK et al. Consensus statement on the pathology of IgG4-related disease. Mod Pathol 2012; 25(9):1181 – 1192. doi: 10.1038/ modpathol.2012.72.
6. Zen Y, Nakanuma Y. IgG4 Cholangiopathy. Int J Hepatol 2012; 2012 : 472376. doi: 10.1155/ 2012/ 472376.
7. Zen Y, Kawakami H, Kim JH. IgG4-related sclerosing cholangitis: all we need to know. J Gastroenterol 2016; 51(4): 295 – 312. doi: 10.1007/ s00535-016-1163-7.
8. Oseini AM, Chaiteerakij R, Shire AM et al. The utility of serum immunoglobulin G4 in distinguishing immunoglobulin G4--associated cholangitis from cholangiocarcinoma. Hepatology 2011; 54(3): 940 – 948. doi: 10.1002/ hep.24487.
9. Mendes FD, Jorgensen R, Keach J et al. Elevated serum IgG4 concentration in patients with primary sclerosing cholangitis. Am J Gastroenterol 2006; 101(9): 2070 – 2075.
10. Ohara H, Okazaki K, Tsubouchi H et al. Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012. J Hepato Biliary Pancreat Sci 2012; 19(5): 536 – 542. doi: 10.1007/ s00534-012-0521-y.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2017 Issue 1-
All articles in this issue
- Novinky v roce 2017
- Realista
- Czech Working Group for Paediatric Gastroenterology and Nutrition guidelines for diagnostics and treatment of inflammatory bowel diseases in children – 1stedition update
- Léčba vedolizumabem u pacientů s idiopatickými střevními záněty v České republice
- Možnosti miniinvazivní chirurgie u pacientů s Crohnovou nemocí a ulcerózní kolitidou
- Ustekinumab – nové biologikum v terapii Crohnovy nemoci
- Kožní problematika u pacientů s idiopatickými střevními záněty
- Imunoglobulin G4 asociovaná sklerozující cholangitida u pacienta s Crohnovou nemocí
- Receptorové mechanizmy aktivácie pažerákových nervov kyselinou
- Celiakie, která není celiakií?
- Mění se chirurgická léčba stenotického karcinomu rekta?
- Looking back at the XVth intensive IBD course for doctors and nurses
- 14th Training and Discussion Gastroenterology Days
- Výběr z mezinárodních časopisů
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Intraoperačná enteroskopia je bezpečná a je prínosom v určení rozsahu resekčného výkonu pri Crohnovej chorobe
-
Gastrointestinal infections
Herbert Tilg Lecture – Gastro Update Europe 2016, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožní problematika u pacientů s idiopatickými střevními záněty
- Celiakie, která není celiakií?
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Mění se chirurgická léčba stenotického karcinomu rekta?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

