-
Medical journals
- Career
Výsledky bezinterferonové léčby virové hepatitidy C v ČR v reálné praxi
Authors: P. Husa 1; L. Husová 2
Authors‘ workplace: Klinika infekčních chorob LF MU a FN Brno 1; Centrum kardiovaskulární a transplantační chirurgie Brno 2
Published in: Gastroent Hepatol 2016; 70(6): 500-507
Category: Hepatology
doi: https://doi.org/10.14735/amgh2016500Overview
Práce prezentuje první reálná data o úspěšnosti bezinterferonové léčby chronické hepatitidy C v ČR. Pacienti byli léčeni kombinovanou terapií paritaprevir/ ritonavir + ombitasvir + dasabuvir s ribavirinem nebo bez něj. Soubor tvořilo 109 pacientů, převážně mužů (62; 57 %). Převládajícím genotypem byl subtyp 1b (101 ze 109 pacientů; 93 %), infekce subtypem 1a byla přítomna u šesti (5 %) a genotypem 4 u dvou (2 %) nemocných. Byli léčeni jak pacienti dříve neléčení – naivní (43 ze 109; 39 %), tak již v minulosti neúspěšně léčení kombinací pegylovaného interferonu a ribavirinu (66 ze 109; 61 %). Setrvalé virologické odpovědi 12 týdnů po ukončení terapie (SVR12) bylo dosaženo u 107 pacientů (98,2 %). Pokud z analýzy vyloučíme dva pacienty, kteří nedosáhli SVR12 z jiného důvodu než virologického selhání léčby, byla úspěšnost léčby 100%.
Klíčová slova:
chronická hepatitida C – paritaprevir/ ritonavir – ombitasvir – dasabuvir – ribavirinÚvod
Infekce virem hepatitidy C (HCV) je celosvětově jednou z hlavních příčin chronického onemocnění jater. Dlouhodobý efekt infekce HCV je velmi variabilní, kolísá od minimálních histologických změn až po extenzivní fibrózu a cirhózu s hepatocelulárním karcinomem (HCC) nebo bez něj. Odhaduje se, že na světě žije okolo 180 mil. osob s chronickou infekcí HCV, ale většina z nich o této infekci neví. Péče o pacienty infikované HCV se za posledních 20 let významně zlepšila díky lepšímu porozumění patofyziologii onemocnění, zdokonalení diagnostiky, terapeutických a preventivních možností.
Primárním cílem léčby chronické hepatitidy C je vyléčení infekce, tedy dosažení setrvalé virologické odpovědi (SVR) definované jako nedetekovatelná nukleová kyselina viru (HCV RNA) v periferní krvi 12 nebo 24 týdnů po skončení antivirové léčby. Dosažení SVR je obecně spojeno s normalizací aktivity alaninaminotransferázy (ALT) a aspartátaminotransferázy, s ústupem nebo úplným vymizením jaterních nekroticko-zánětlivých změn a fibrózy. Pacienti s pokročilou jaterní fibrózou (F3 dle klasifikace METAVIR) nebo jaterní cirhózou (F4) zůstávají i po dosažení SVR v riziku vzniku závažných jaterních komplikací, i když fibróza většinou regreduje a nebezpečí vzniku jaterního selhání a portální hypertenze je sníženo. Podle výsledků recentních klinických studií je u úspěšně léčených osob riziko vzniku HCC signifikantně redukováno oproti neléčeným pacientům a těm, kteří nedosáhli SVR, ale není zcela eliminováno. Chronická infekce HCV je spojena s výskytem celé řady extrahepatálních manifestací (zejména se smíšenou kryoglobulinemií, řadou ledvinných chorob, non-Hodgkinovým B-buněčným lymfomem). Antivirová léčba s velkou pravděpodobností zlepší nejen jaterní onemocnění a sníží riziko progrese choroby do jaterní cirhózy nebo HCC, ale u významné části alespoň přechodně sníží intenzitu projevů základní choroby [1].
Léčba chronické hepatitidy C prodělává v posledních pěti letech zcela mimořádné změny. Do praxe se postupně zavádějí přímo působící antivirotika (DAA – direct acting antivirals), která se podávají především v bezinterferonových (interferon-free) režimech, nebo dokonce v bezribavirinových (ribavirin-free) režimech. Tyto režimy eliminují závažné nežádoucí účinky pegylovaného interferonu (PEG-IFN) α a ribavirinu (RBV), nemají prakticky kontraindikace a jejich účinnost se blíží 100 %.
Výrazné změny v možnostech léčby chronické hepatitidy C vedou k rychlým inovacím doporučených postupů. Evropská asociace pro studium jater (EASL – European Association for the Study of the Liver) vydala doporučení léčby hepatitidy C v dubnu 2014 [2] a během jednoho roku došlo k takovému vývoji léčebných možností, že v rámci 50. výročního zasedání EASL ve Vídni v dubnu 2015 byla představena doporučení nová [3]. Nejnovější verze doporučeného postupu EASL byla oficiálně představena 22. září 2016 na speciální konferenci EASL New perspectives in hepatitis C virus infection – the roadmap for cure konané v Paříži [1]. Americká asociace pro studium jater přestala svá doporučení vydávat v tištěné formě a zpřístupnila je pouze online na webových stránkách, kde jsou plynule doplňována o výsledky nových klinických hodnocení. Při každém stažení tohoto doporučeného postupu se k textu automaticky přiřadí datum, ve kterém daná verze platila a byla uživatelem získána [4]. Podle posledních evropských i amerických doporučení je nejlepší možností léčby hepatitidy C bezinterferonová terapie.
Současné možnosti bezinterferonové léčby v ČR představují kombinace sofosbuviru s jinými DAA s RBV nebo bez RBV a kombinace paritapreviru potencovaného ritonavirem + ombitasvir + dasabuvir s RBV nebo bez RBV [5]. Nové léky se stále vyvíjejí a postupně přicházejí i na český trh, v prvním čtvrtletí roku 2017 se očekává dostupnost nové fixní kombinace elbasviru s grazoprevirem a sofosbuviru s velpatasvirem, které mají rovněž mimořádně vysokou účinnost a bezpečnost.
Paritaprevir/ ritonavir, ombitasvir a dasabuvir
Léčebná kombinace paritaprevir/ ritonavir, ombitasvir a dasabuvir (Viekirax, Exviera) obsahuje v jedné tabletě paritaprevir (inhibitor NS3/ 4A proteázy) v dávce 75 mg, potencovaný 50 mg ritonaviru, a ombitasvir (inhibitor NS5A) v dávce 12,5 mg. Doporučenou dávkou jsou dvě tablety 1× denně s jídlem. Druhá tableta obsahuje dasabuvir (Exviera), nenukleosidový inhibitor NS5B polymerázy v dávce 250 mg. Užívá se 2× denně jedna tableta. Kombinace těchto léčiv, která se pro zjednodušení označuje jako 3D režim, blokuje všechny dosud známé úrovně replikace HCV. Ritonavir nepůsobí proti HCV, ovlivňuje farmakokinetiku a umožňuje podávání paritapreviru v nižší dávce pouze 1× denně. Tato kombinace je určena pro léčbu pacientů infikovaných genotypem 1, v případě infekce genotypem 4 se používá pouze paritaprevir/ ritonavir + ombitasvir, tedy bez dasabuviru. Oba léky byly v ČR registrovány 1. ledna 2015 a maximální cena a úhrada (vč. úhradových podmínek) byla stanovena od 15. ledna 2016 [6].
Z bezpečnostní analýzy dosud publikovaných klinických studií s 3D kombinací s/ bez RBV vyplynulo, že nejčastějšími nežádoucími účinky byly svědění kůže, únava, nauzea, astenie a nespavost. Příčinou největšího množství nežádoucích reakcí byl RBV, jehož dávku bylo nutno u 7 % pacientů během terapie snížit. Sama 3D kombinace vedla pouze ke svědění kůže. Podstatné je, že závažné nežádoucí účinky léčby se vyskytly u < 2,5 % léčených pacientů. Nežádoucí účinky vedly k předčasnému ukončení léčby v 1–2 % případů. Asymptomatické zvýšení aktivity ALT se obvykle objevilo během prvních čtyř týdnů léčby, vždy odeznělo bez terapeutické intervence a nikdy nebylo provázeno vzestupem sérové hladiny bilirubinu. Naopak přechodný vzestup nepřímého bilirubinu v séru byl pozorován u pacientů léčených 3D a RBV, příčinou byla inhibice bilirubinových transportérů QATP1B1 a QATP1B3 paritaprevirem a hemolýza vyvolaná RBV. Vyšší frekvence vzestupu hladin celkového bilirubinu byla zaznamenána u nemocných s jaterní cirhózou. Při současném užívání léků s estrogeny bylo riziko elevace aktivity ALT vyšší. Použité režimy (s/ bez RBV), podávané po dobu 12 nebo 24 týdnů, byly dobře tolerovány, výskyt nežádoucích reakcí byl velmi nízký [6].
Výsledky
V prezentovaném souboru bylo léčeno 109 pacientů 3D režimem s/ bez RBV. V ČR se na léčbě podílelo celkem devět center (Centrum kardiovaskulární a transplantační chirurgie Brno, FN Brno, FN Motol, FN Olomouc, FN Plzeň, IKEM Praha, Slezská nemocnice Opava, ÚVN Praha, VFN v Praze). U všech pacientů uplynulo v době hodnocení min. 12 týdnů od skončení léčby, a proto bylo možné posoudit dosažení SVR12. Soubor tvořilo 62 mužů (57 %) a 47 žen (43 %). Většina pacientů měla infekci subtypem 1b, a to 101 pacientů (93 %), zbytek byl infikován subtypem 1a (6 ze 109; 5 %) nebo genotypem 4 (2 ze 109; 2 %). Průměrný věk pacientů byl 56 let, u většiny pacientů byla pokročilá jaterní fibróza a vysoká viremie, podrobné charakteristiky souboru jsou uvedeny v tab. 1. Převažovali dříve léčení pacienti (66 ze 109; 61 %), a to jak pacienti relabující po ukončení léčby, tak pacienti, kteří na léčbu neodpověděli, respektive během léčby nedošlo k vymizení viremie (nuloví respondéři) nebo netolerující léčbu PEG-IFN a RBV (tab. 2). Po 8 i 12 týdnech léčby byla negativní viremie u 107 pacientů (98,2 %). Rovněž 12 týdnů po skončení léčby byla nedetekovatelná viremie u 107 pacientů (SVR12 – 98,2 %). U dvou pacientů došlo k předčasnému ukončení léčby v prvním měsíci bezinterferonové terapie z důvodu jiného než virologického selhání léčby, podle modifikované intent-to-treat analýzy (mITT) bylo dosaženo SVR12 ve 100 % případů (graf 1).
Table 1. Základní parametry celého souboru (n = 109). Tab. 1. Basic parameters of the entire group (n = 109). 
Table 2. Rozdělení pacientů podle předchozí léčby. Tab. 2. Categorisation of patients according to prior treatment. 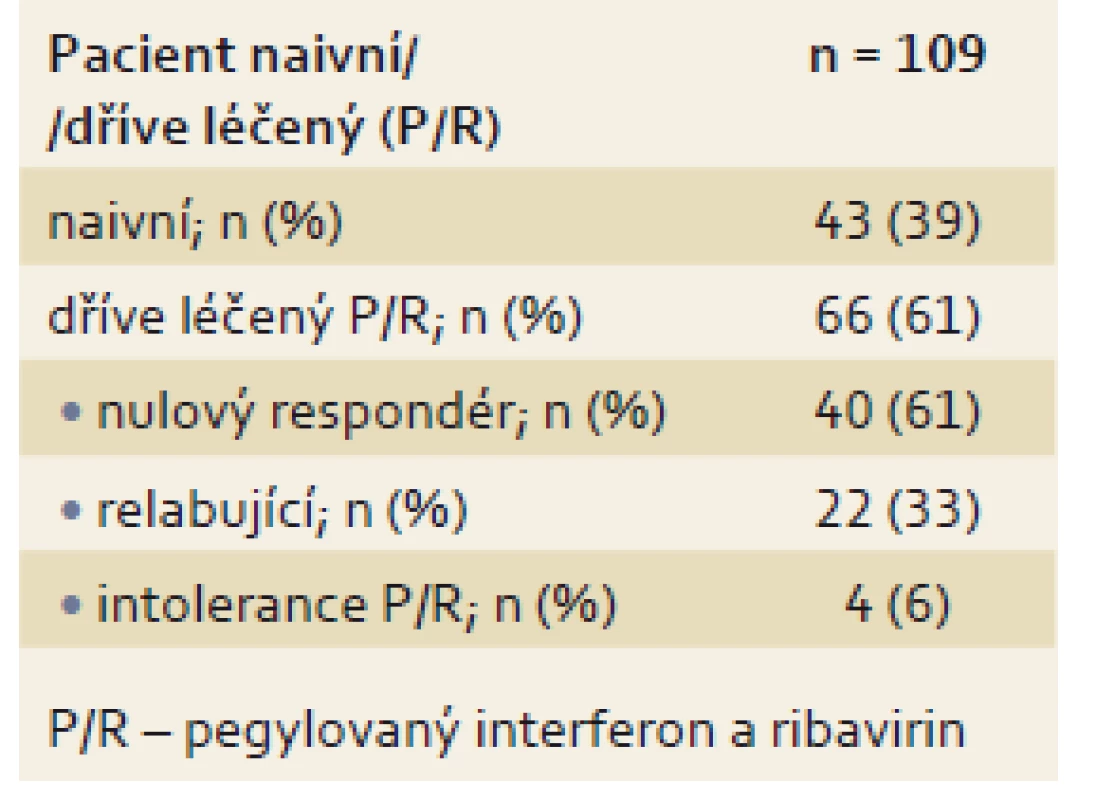
Graph 1. Účinnost 3D léčby. Graph 1. Efficacy of 3D treatment. 
U skupiny nulových respondérů na předchozí léčbou PEG-IFN a RBV vedlo podání 3D režimu k dosažení SVR12 u všech pacientů. Soubor tvořilo 40 nemocných, převažovali muži infikovaní subtypem 1b (tab. 3). U všech pacientů po osmi týdnech léčby byla negativní viremie. Celková účinnost léčby byla velmi vysoká, dosáhla 100 % (SVR12) (tab. 4, graf 2).
Table 3. Základní parametry nulových responderů (n = 40). Tab. 3. Basic parameters of zero responders (n =40). 
Table 4. Změny hladin HCV RNA během léčby u nulových respondérů. Tab. 4. Changes in HCV RNA levels during treatment in zero responders. 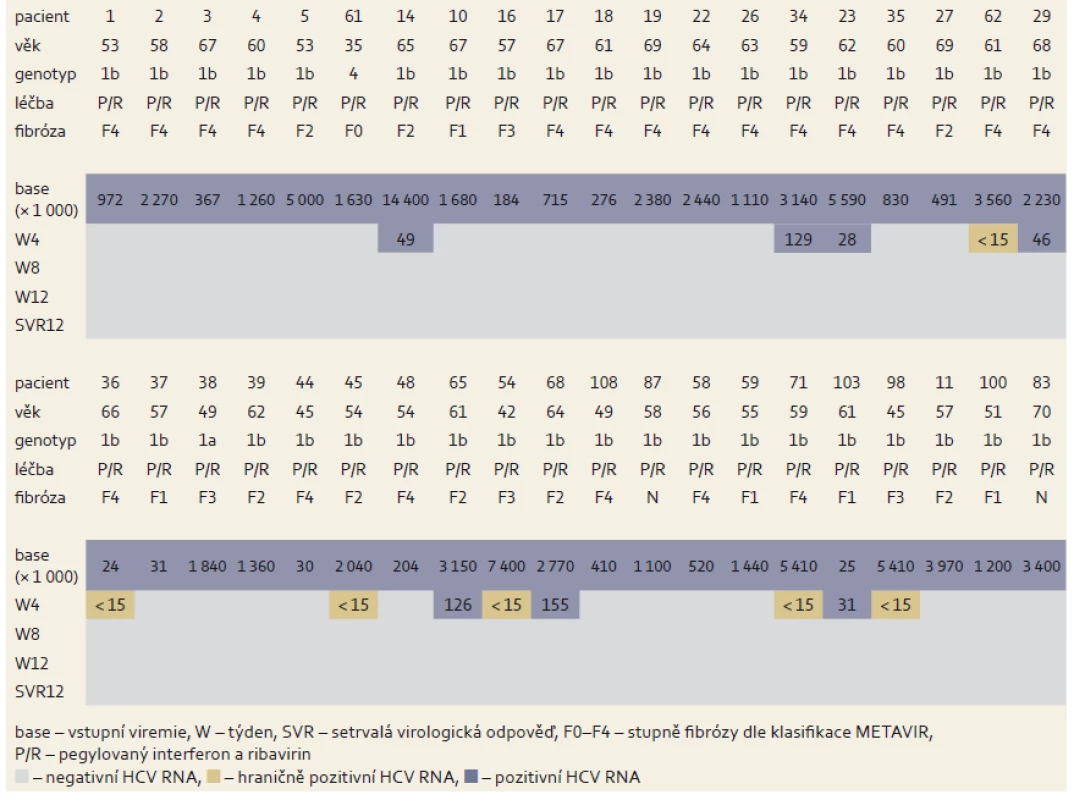
Graph 2. Účinnost 3D léčby u nulových respondérů. Graph 2. Efficacy of 3D treatment in zero responders. 
Další skupinu tvořili pacienti s jaterní cirhózou, u kterých je obecně účinnost a tolerance léčby založené na PEG-IFN velmi špatná. Bezinterferonovou léčbu velmi dobře tolerovali. Léčba jednoho pacienta byla předčasně ukončena po 10 dnech pro progredující ikterus a nově diagnostikovaný HCC. V souboru bylo léčeno 43 pacientů, převažovala infekce subtypem 1b. Podrobná charakteristika souboru je uvedena v tab. 5. Pravděpodobnost dosažení SVR12 byla velmi vysoká (97,7 %). Pokud se z analýzy vyřadí pacient, u kterého byla léčba přerušena z jiného než virologického selhání léčby, pak byla účinnost léčby 100% (mITT SVR12) (tab. 6, graf 3).
Table 5. Základní parametry pacientů s jaterní cirhózou (n = 43). Tab. 5. Basic parameters of patients with liver cirrhosis (n = 43). 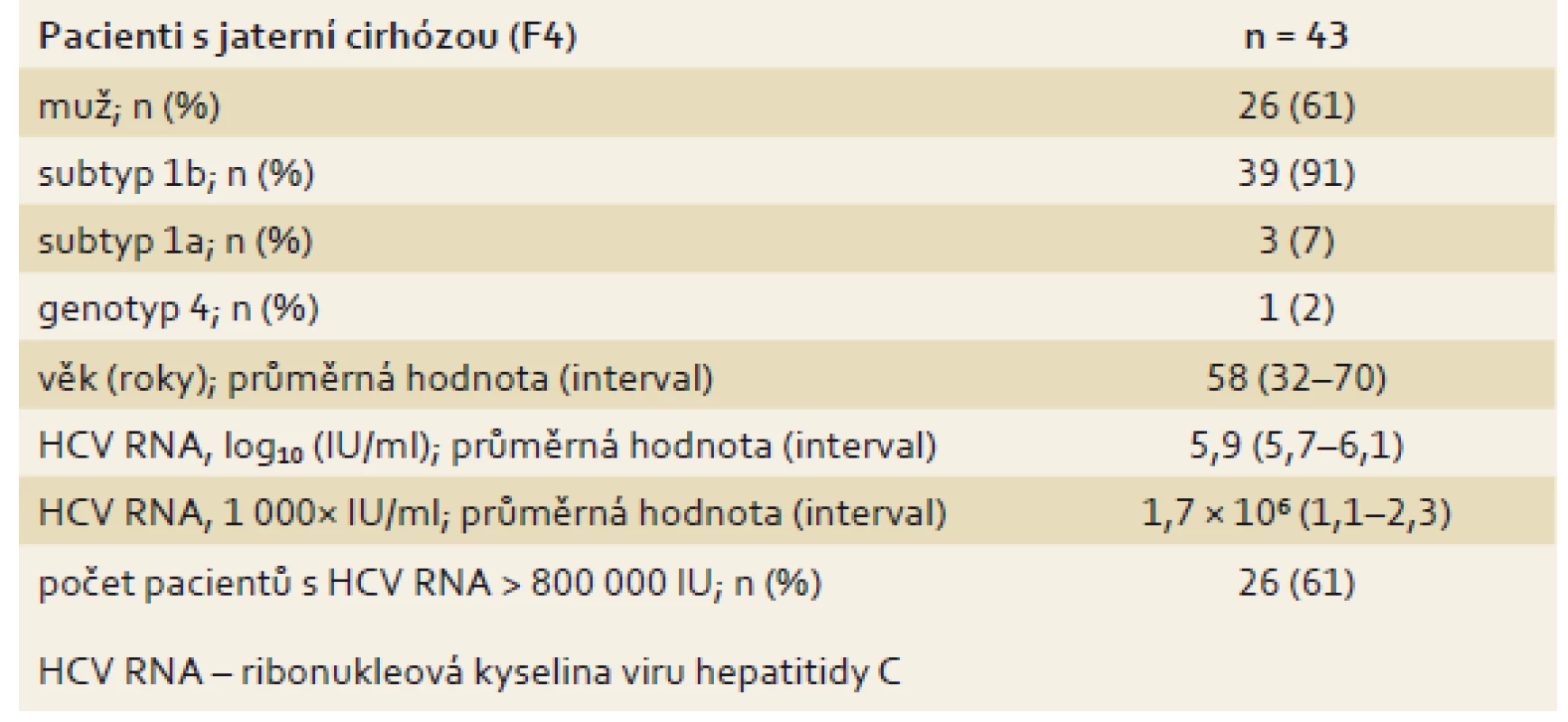
Table 6. Změny hladin HCV RNA během léčby u cirhotiků. Tab. 6. Changes in HCV RNA levels during treatment of cirrhotic patients. 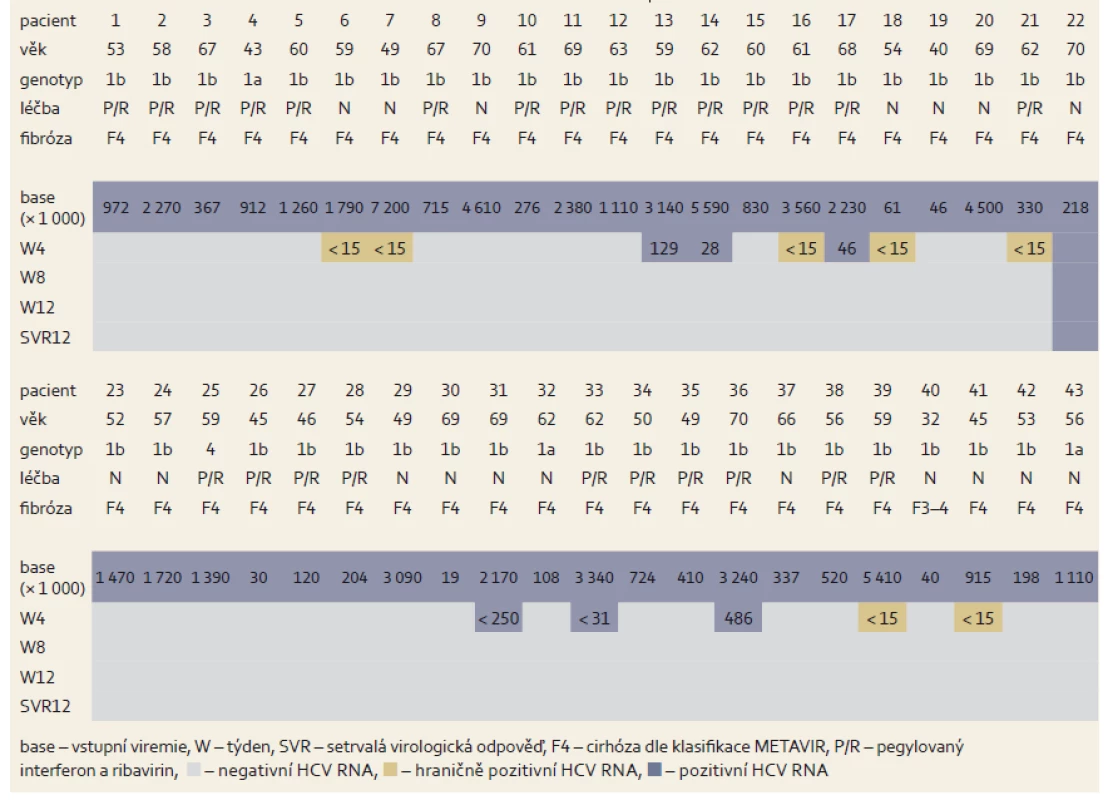
Graph 3. Účinnost 3D léčby u cirhotiků. Graph 3. Efficacy of 3D treatment in cirrhotic patients. 
Velmi zajímavou skupinu tvořili pacienti s rekurující virovou hepatitidoupo transplantaci jater. Virová hepatitida C je jednou z předních indikací k transplantaci jater ve většině transplantačních center. Problém spočívá v časné rekurenci infekce HCV po transplantaci, pokud se transplantuje viremický pacient s rychlým rozvojem jaterní cirhózy. V prezentované skupině bylo léčeno 23 pacientů s rekurující virovou hepatitidou C, převažovali muži (15 z 23; 65 %), všichni se subtypem 1b. Podrobná charakteristika souboru je uvedena v tab. 7. Léčba byla velmi dobře tolerována, bez závažných nežádoucích účinků. Jediným relativním problémem byla nutnost redukce imunosupresivní léčby při současné 3D terapii. U jednoho pacienta byla léčba přerušena po 23 dnech pro závažné biliární komplikace, které si vyžádaly reoperaci. Šlo o chirurgický problém, nikoli o nežádoucí účinek bezinterferonové léčby. Po osmi týdnech léčby byla u všech pacientů vyšetřených v tomto týdnu viremie negativní. SVR12 byla zaznamenána v 95,7 % případů, a pokud vyřadíme pacienta, u kterého nebyla dosažena SVR z jiného důvodu než virologického selhání léčby, tak byla účinnost léčby opět 100% (mITT SVR12) (tab. 8, graf 4).
Table 7. Základní parametry pacientů po transplantaci jater (n = 23). Tab.7. Basic parameters of liver transplant patients (n = 23). 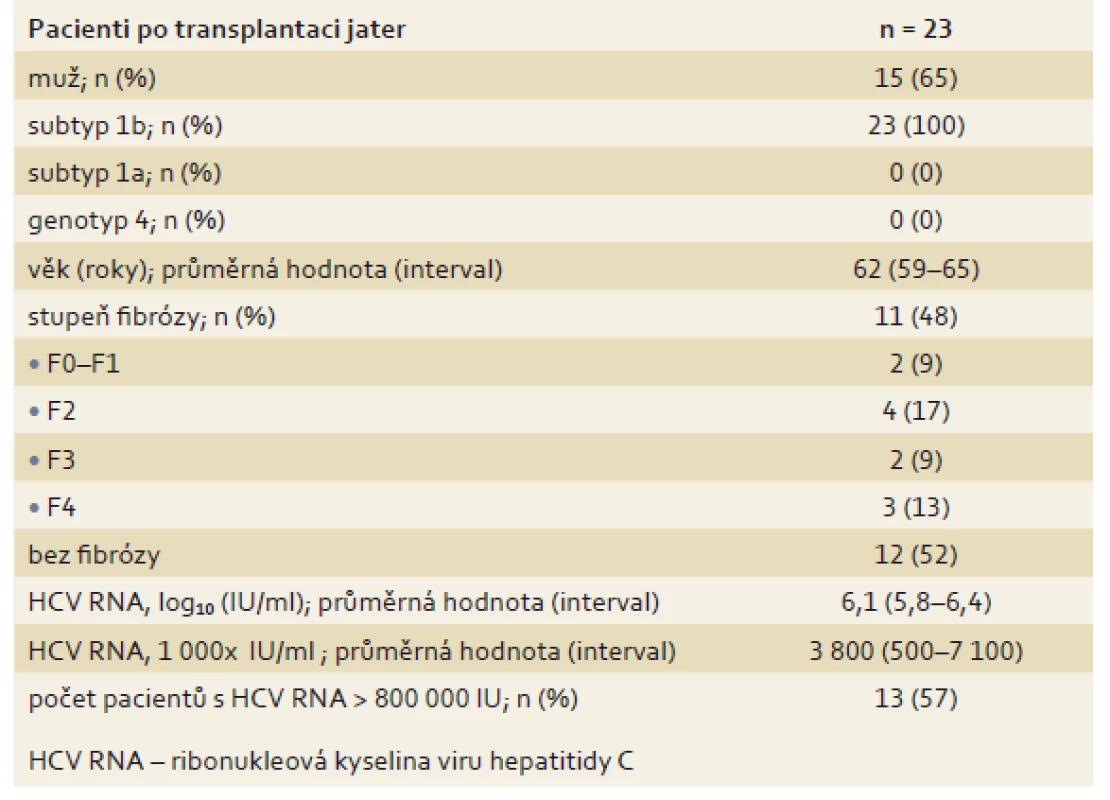
Table 8. Změny hladin HCV RNA během léčby u pacientů po transplantaci jater. Tab. 8. Changes in HCV RNA levels during treatment in patients after liver transplantation. 
Graph 4. Účinnost 3D léčby u pacientů po transplantaci jater. Graph 4. Efficacy of 3D treatment in patients after liver transplantation. 
Diskuze
Naše výsledky podporují výsledky klinických studií SAPHIRE I a II, PEARL II–IV, TURQUIOSE I–III o vysoké účinnosti 3D léčby v závislosti na pokročilosti jaterního procesu, daném genotypu a přidání RBV k 3D léčbě [7–13]. Ve studii SAPHIRE I bylo léčeno 12 týdnů 473 naivních (dosud antivirově neléčených) pacientů bez jaterní cirhózy 3D kombinací – SVR12 dosáhlo 95 % infikovaných subtypem 1a a 98 % se subtypem 1b [7]. Ve studii PEARL III bylo dosaženo SVR12 u 99 % pacientů léčených kombinací 3D ± RBV. Šlo opět o nemocné naivní, bez jaterní cirhózy a infikované subtypem 1b – přidání RBV neovlivnilo dosažený výsledek [8]. Výsledky studie TURQUISE I potvrdily účinnost a bezpečnost 3D léčby i u osob koinfikovaných HCV a virem lidského imunodeficitu (HIV). Jednalo se o pacienty naivní, bez jaterní cirhózy a po stránce infekce HIV stabilizované léčbou raltegravirem nebo atazanavirem. Dvanáct týdnů léčby 3D kombinací vedlo k dosažení SVR12 v 93 %, prodloužením délky léčby na 24 týdnů se úspěšnost léčby nezvýšila (91 %) [9]. Studie SAPHIRE II prokázala vynikající úspěšnost 3D léčby i u pacientů v minulosti neúspěšně léčených kombinací PEG-IFN a RBV – SVR 12 bylo dosaženo po 12 týdnech léčby u 96 % osob infikovaných subtypem 1a a 97 % se subtypem 1b [10]. Ve studii PEARL II byl zkoumán efekt přidání RBV k 3D kombinaci u pacientů infikovaných subtypem 1b. Význam přidání RBV se neprokázal – SVR12 ve 100 % případů bez RBV a v 97 % s RBV [11]. Výsledky studie TURQUISE II prokázaly srovnatelnou účinnost 3D kombinace s RBV u pacientů s jaterní cirhózou léčených 12 nebo 24 týdnů (92 vs. 96 %) [12]. Studie TURQUOISE III ukázala, že u kompenzovaných cirhotiků infikovaných subtopem 1b není nutné přidávat RBV – 12 týdnů 3D léčby vedlo k dosažení SVR12 ve 100 % [13].
Závěr
Bezinterferonová léčba je zcela revoluční změnou terapeutických možností chronické hepatitidy C. Po více než 20 letech mizí nutnost použití IFNa se všemi jeho nežádoucími účinky, kontraindikacemi i nutností injekční aplikace. Za absolutní minimum účinnosti se u bezinterferonové léčby bere dosažení SVR v 90 % případů. Většinou je však tohoto cíle dosaženo u ≥ 95 % léčených, v některých podskupinách pacientů je úspěšnost léčby 100%, a to po 12 týdnech léčby (v některých případech po osmi týdnech léčby) a s minimem nežádoucích účinků. Naše výsledky s bezinterferonovou 3D terapií zcela potvrzují dobrou snášenlivost i bezpečnost léčby a její vysokou až 100% účinnost.
Autoři děkují lékařům z FN Motol, FN Olomouc, FN Plzeň, IKEM Praha, Slezské nemocnice Opava, ÚVN Praha a VFN v Praze za poskytnutá data o pacientech a výsledcích jejich léčby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 11. 2016
Přijato: 20. 11. 2016
prof. MU Dr. Petr Husa, CSc.
Klinika infekčních chorob
LF MU a FN Brno
Jihlavská 20
625 00 Brno
husa.petr@fnbrno.cz
Sources
1. European Association for the Study of Liver. EASL recommendations on treatment of hepatitis C 2016. Summary. [online]. Available from: www.easl.eu/ medias/ cpg/ HCV2016/ Summary.pdf.
2. European Association for the Study of Liver. EASL recommendations on treatment of hepatitis C 2014. J Hepatol 2014; 61(2): 373–395. doi: 10.1016/ j.jhep. 2014.05.001
3. European Association for the Study of Liver. EASL recommendations on treatment of hepatitis C 2015. J Hepatol 2015; 63(1): 199–236. doi: 10.1016/ j.jhep.2015.03.025.
4. AASLD recommendation for testing, managing, and treating hepatitis C. [online]. Available from: www.hcvguidelines.org.
5. Urbánek P, Husa P, Šperl J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Klin Mikrobiol Infekc Lek 2015; 21(3): 83–98.
6. Urbánek P. Exviera, Viekirax. Gastroent Hepatol 2015; 69(1): 75–80. doi: 10.14735/ amgh201575.
7. Feld JJ, Kowdley KV, Coakley E et al. Treatment of HCV with ABT-450/ r-ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17): 1594–1603. doi: 10.1056/ NEJMoa1315722.
8. Ferenci P, Bernstein D, Lalezari J et al. ABT-450/ r, ombitasvir and dasabuvir with or without ribavirin for HCV. N Engl J Med 2014; 370(21): 1983–1992. doi: 10.1056/ NEJMoa1402338.
9. Wyles DL, Sulkowski MS, Eron JJ et al.TURQUOISE-I: 94% SVR12 in HCV/ HIV-1coinfected patients treated with ABT-450/ r/ ombitasvir, dasabuvir and ribavirin. Hepatology 2014; 60 (Suppl 1): 136A.
10. Zeuzem S, Jacobson IM, Baykal T et al.Retreatment of HCV with ABT-450/ r-ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17): 1604–1614. doi: 10.1056/ NEJMoa1401561.
11. Andreone P, Colombo MG, Enejosa JV et al. ABT-450, ritonavir, ombitasvir, and dasabuvir achieves 97% and 100% sustained virologic response with or without ribavirin in treatment experienced patients with HCV genotype 1b infection. Gastroenterology 2014; 147(2): 359–365. doi: 10.1053/ j.gastro.2014.04.045.
12. Poordad F, Hezode C, Trinh R et al. ABT--450/ r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med 2014; 370(21): 1973–1982. doi: 10.1056/ NEJMoa1402869.
13. Feld JJ, Moreno C, Trinh R et al. Sustained virological response of 100% in HCV genotype 1b patients with cirrhosis receiving ombitasvir/ paritaprevir/ r and dasabuvir for 12 weeks. J Hepatol 2016; 64(2): 301–307. doi: 10.1016/ j.jhep.2015.10.005.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2016 Issue 6-
All articles in this issue
- Dětská gastroenterologie a hepatologie
- Bariatrie
- Niektoré genetické determinanty celiakie, význam HLA typizácie v klinickej praxi a zastúpenie HLA-DQ haplotypov v súbore 306 detských pacientov
- Význam fekálního kalprotektinu v diagnostice a sledování dospělých a dětských pacientů s idiopatickými střevními záněty
- Současná bariatricko-metabolická chirurgie
- Endoskopický duodenojejunální bypass (EndoBarrier®) jako nový terapeutický přístup u obézních diabetiků 2. typu – efektivita a faktory predikující optimální efekt
- Výsledky bezinterferonové léčby virové hepatitidy C v ČR v reálné praxi
- Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v reálné klinické praxi
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii
- Vídeňské ozvěny
- 1st National Congress of Gastrointestinal Oncologywith international participation
- Výběr z mezinárodních časopisů
- Kombinace sofosbuviru a velpatasviru (Epclusa®)
- Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam fekálního kalprotektinu v diagnostice a sledování dospělých a dětských pacientů s idiopatickými střevními záněty
- Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v reálné klinické praxi
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii
- Endoskopický duodenojejunální bypass (EndoBarrier®) jako nový terapeutický přístup u obézních diabetiků 2. typu – efektivita a faktory predikující optimální efekt
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

