-
Medical journals
- Career
Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
Authors: T. Hlavatý; T. Koller; J. Tóth; M. Huorka
Authors‘ workplace: Gastroenterologické a hepatologické oddelenie, V. interná klinika LF UK a UN Bratislava
Published in: Gastroent Hepatol 2014; 68(5): 441-450
Category: Gastrointestinal Oncology: Review Article
doi: https://doi.org/10.14735/amgh2014441Overview
V posledných rokoch došlo ku významnému pokroku vo vývoji enterálnych stentov. Zlepšili sa vlastnosti stentov, techniky ich zavádzania a rozširujú sa indikácie. Paliatívne stentovanie inoperabilných malígnych stenóz pažeráka je dnes bežnou súčasťou liečby. Okrem malígnych indikácií sa rozširuje spektrum benígnych indikácií, ako sú liečba benígnych stenóz pažeráka, fistúl, anastomotických leakov, perforácií alebo krvácajúcich varixov. Výber optimálneho typu stentu a liečebného protokolu je i naďalej viac otázkou klinickej skúsenosti, nakoľko komparatívnych prospektívnych štúdií je málo. Novými sľubnými inováciami v oblasti stentov sú biodegradabilné steny alebo dvojvrstvové stenty. V blízkej budúcnosti je možné očakávať ďalší intenzívny vývoj nových stentov, techník zavádzania a klinických indikácií.
Kľúčové slová:
samoexpandibilný stent – stenóza – karcinóm pažeráka – paliatívna liečba – perforácia pažeráka – fistuly pažeráka – ezofageálne varixy
Enterálne stenty sú medicínske výrobky, ktoré sa používajú na obnovenie a udržanie priechodnosti lumenu tráviaceho traktu. V posledných rokoch zaznamenávame významný pokrok v oblasti vývoja nových stentov, úspešnosti a bezpečnosti ich klinického využitia v tradičných indikáciách stenóz tráviaceho traktu aj v oblasti nových „nestenózových” indikáciách [1–3].
Prvú rigidnú endoprotézu pažeráka zaviedol Sir Charter Symmonds v roku 1885 na preklenutie malígnej stenózy [4]. K väčšiemu rozšíreniu ezofageálnych protéz však došlo až po zavedení latexových stentov typu Celestine a Atkinson v 70. rokoch 20. storočia [5]. Prvé flexibilné expandibilné stenty sa začali používať v 90. rokoch minulého storočia a postupne nahradili rigidné ezofageálne protézy [6]. Prvé metalické stenty sa vyrábali z chirurgickej ocele, neskôr ich nahradili stenty z nitinolu.
Historicky prvou a stále najčastejšou indikáciou implantácie ezofageálnych stentov je dysfágia v dôsledku malígnej stenózy pažeráka. Spektrum indikácií na implantáciu ezofageálnych stentov sa však v poslednej dobe rozšírilo aj na liečbu fistúl, anastomotických leakov, perforácií, extramurálnu kompresiu pažeráka nádormi mediastina, pľúc a lymfatických uzlín, liečbu benígnych refraktérnych stenóz pažeráka a liečbu refraktérneho krvácania z varixov [2]. Prehľad súčasných indikácií a kontraindikácií implantácie ezofageálnych stentov je v tab. 1.
Table 1. Indikácie a kontraindikácie implantácie ezofageálnych stentov (SEMS/SEPS). Tab. 1. Indications and contraindications of esophageal stent implantation (SEMS/SEPS). 
Typy ezofageálnych stentov
Podľa toho, pre ktorú etáž tráviaceho traktu sú stenty určené, sa rozdeľujú na ezofageálne, duodenálne, kolonické a biliárne [7]. Stenty možno rozdeliť podľa materiálu na samoexpandibilné metalické stenty (SEMS), samoexpandibilné plastové stenty (SEPS) a biodegradabilné stenty (BDS). Najčastejšie používané metalické stenty sa vyrábajú z nitinolu (zmes niklu a titánu). Zriedkavejšie používané materiály sú chirurgická oceľ a elgiloy (zmes niklu, kobaltu a chrómu). Metalické stenty sa podľa spôsobu výroby delia na segmentované, pletené a vyrezávané. Najčastejšie sú pletené stenty, ktoré sa ďalej konštrukčne rozdeľujú na „tkané” (braided stents – pletenie v tvare X) a „štrikované” stenty (knitted stents – pletenie v tvare Z). Pre štrikované stenty je charakteristická vyššia radiálna expanzná sila a obmedzené skracovanie v pozdĺžnej osi po implantácii. Pre tkané stenty je naopak charakteristické skracovanie stentu a nižšia radiálna expanzná sila [8].
Stenty môžu byť povlečené, čiastočne povlečené a nepovlečené. Povlečenie stentov je najčastejšie zo silikónu, polyuretánu, polyetylénu a polytetrafluoroetylénu. Ponuka ezofageálnych metalických a plastových stentov je vo svete veľmi široká. Základné charakteristiky rôznych typov ezofageálnych stentov dostupných toho času v Slovenskej republike sú zosumarizované v tab. 2.
Table 2. Základné parametre ezofageálnych stentov dostupných v Slovenskej republike. Tab. 2. Parameters of SEMS commercially available in the Slovak republic. 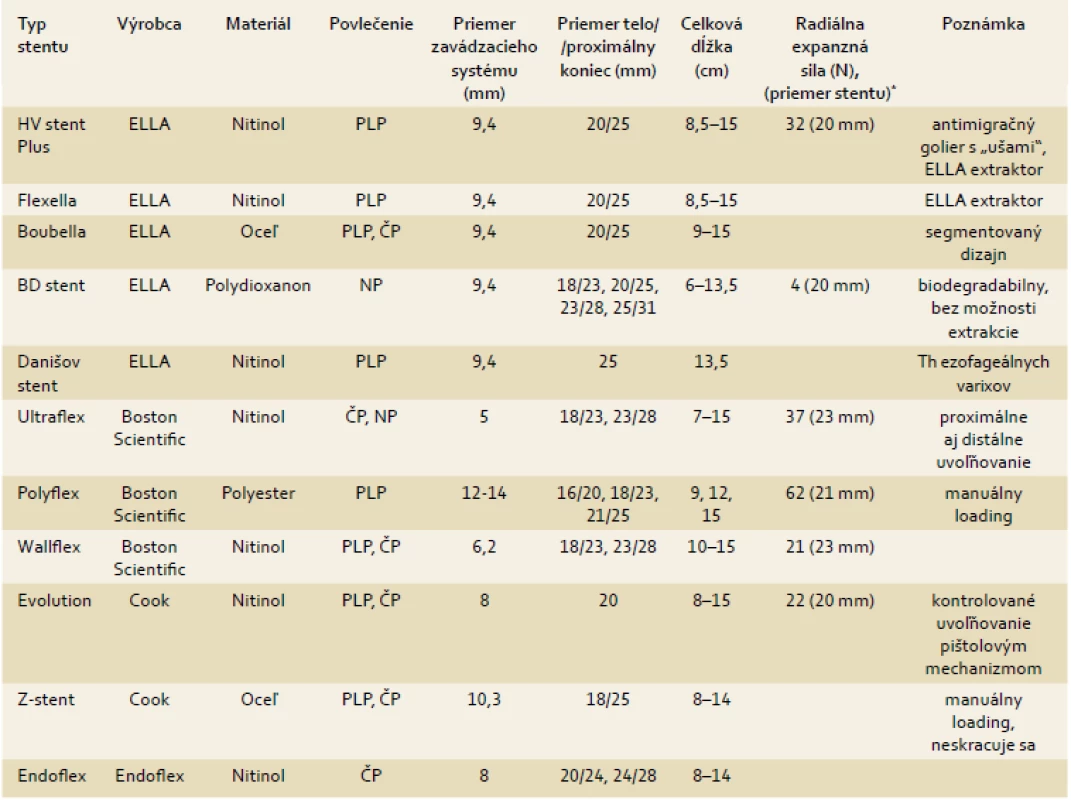
PLP – plne povlečený stent, ČP, čiastočne povlečený stent, NP – nepovlečený stent * spracované podľa Hirdes et al [8], radiálna sila meraná v strede stentu pri jeho expanzii na 15 mm v Newtnoch (N), v zátvorke uvedený priemer tela testovaného stentu V malígnych indikáciách sa uplatňujú hlavne povlečené metalické stenty, pri riziku migrácie aj čiastočne povlečené SEMS. V poslednej dobe sa portfólio ezofageálnych stentov rozšírilo o špeciálne konštruované stenty určené na vysoké proximálne stenózy pažeráka a špeciálne dizajnované stenty na gastroezofageálnu junkciu so širokým hrdlom zabraňujúcim prerastaniu. V benígnych indikáciách sa uplatňujú metalické aj plastové stenty a v poslednej dobe sú dostupné aj biodegradabilné stenty (BDS) [9]. Prvým komerčne dostupným BDS je ELLA-BD stent (Ella/CS, Česká republika) [10]. Je zložený z polydioxanonnových monofilamentov. Integrita a radiálna sila sa zväčša udržiavajú po dobu 6–8 týždňov, potom dochádza ku rozpúšťaniu stentu a po 12 týždňoch dochádza ku kompletnej dezintegrácii. Pri kyslom pH dochádza ku dezintegrácii rýchlejšie. Stent nie je RTG kontrastný. Pri jeho prípadnej migrácii je možné ho ponechať v žalúdku, kde sa spontánne rozloží.
Obzvlášť u stentov, ktoré preklenujú gastroezofageálnu junkciu, je častou komplikáciou reflux žalúdočného obsahu. Na riešenie tohto problému boli vyvinuté stenty s antirefluxnými chlopňami. Tieto chlopne sú zväčša niekoľko-centimetrovým predĺžením polyuretánového alebo silikónového povlečenia stentu za úroveň distálneho konca stentu (tzv ponožkový-windsock mechanizmus). Antirefluxný mechanizmus znižuje mieru refluxných komplikácií [11]. Väčšina výrobcov už v súčasnosti ponúka variácie ezofageálnych stentov s takouto antirefluxnou chlopňou.
Technika inzercie ezofageálnych stentov
Implantácia stentu zahŕňa tri základné kroky. Prvým je dôkladná predzákroková diagnostika charakteru a anatómie stenózy alebo inej lézie pomocou endoskopie, CT alebo ezofagografie. Táto zahŕňa popis lokalizácie lézie v pažeráku (v cm od zuboradia), jej dĺžku, šírku, ako aj popis patencie dýchacích ciest.
Druhým krokom je výber optimálneho stentu. Pri výbere veľkosti, materiálu a povlečenia stentu je nutné zohľadniť morfológiu lézie a predpokladanú dĺžku terapie. Stent by mal presahovať stenózu na každom okraji najmenej o 2 cm.
Tretím krokom je samotná implantácia stentu. Na začiatku výkonu je potrebné endoskopicky zaviesť vodiaci drôt. Pokiaľ je stenóza nepriechodná pre zavádzací systém stentu (5–9,4 mm), je nutné ju pred zavedením stentu dilatovať pomocou endoskopických balónkov alebo bužií na minimálnu šírku zavádzaného systému stentu. Následne sa označuje rádiokontrastnými značkami začiatok a koniec stenózy (lézie) najčastejšie nalepením kovových značiek na kožu pacienta. V literatúre sa uvádza aj označenie pomocou endoklipov alebo submukóznou injekciou iódovej rádiokontrastnej látky. Po zavedenom vodiči sa následne zavedie pod RTG kontrolou zavádzací systém stentu do správnej polohy. Okraje stentu by mali presahovať stenózu najmenej o 2 cm na každej strane, pričom treba rátať so skracovaním stentu pri jeho postupnej dilatácii.
Stent sa uvoľňuje najčastejšie od distálneho konca smerom proximálne. Až do označeného kritického bodu je možné väčšinu komerčne dostupných stentov spätne zasunúť a plne repozicionovať. Po uvoľnení stentu je repozícia možná v obmedzenej miere zachytením proximálneho golierika stentu klieštikmi alebo potkaním zubom. Repozícia povlečených stentov je vo všeobecnosti jednoduchšia ako nepovlečených. V priebehu 24–48 hod po implantácii dochádza ku postupnej expanzii stentu a jeho ďalšie repozicionovanie zväčša nie je možné.
Komplikácie implantácie ezofageálnych stentov
Komplikácie implantácie ezofageálnych stentov rozdeľujeme na včasné (do siedmich dní) a neskoré (viac ako sedem dní). Ich výskyt závisí od charakteru stenózy alebo lézie, od typu použitého stentu a pri malígnych stenózach aj od typu adjuvantnej liečby. Medzi včasné komplikácie patrí bolesť na hrudníku (12–14 %), krvácanie (3–8 %), včasná perforácia (< 1 %) a tracheálna kompresia s respiračnou insuficienciou (< 1 %) [4]. Medzi neskoré patrí distálna migrácia stentu (nepovlečené 0–6 % vs povlečené 25–32 %), obštrukcia stentu prerastaním alebo obrastaním tumorom alebo potravou (nepovlečené 17–36 % vs povlečené 0–5 %), refluxná ezofagitída a refluxná aspiračná bronchopneumónia (4 %, pri stentoch cez gastroezofageálnu junkciu až do 20 %), neskorá perforácia alebo vytvorenie fistuly (3 %) [4]. Pri nerešpektovaní kontraindikácie vo vzťahu ku hornému ezofageálnemu sfinkteru alebo proximálnej migrácii môže dôjsť aj ku pocitu cudzieho telesa v hrdle.
Z hľadiska dlhodobej úspešnosti liečby dysfágie sú limitujúce miera migrácie a miera obturácie stentu. Migrácia stentov je vyššia v prípade plne povlečených stentov, plastových stentov, stentov presahujúcich gastroezofageálnu junkciu a po neoadjuvantnej rádio - alebo chemoterapii [12–15].
Ak sa v období 3–6 týždňov po neoadjuvantnej chemo - alebo rádioterapii implantoval stent, okrem migrácie sa pozorovala aj vysoká miera (10–15 %) ďalších závažných komplikácií ako perforácia pažeráka, krvácanie, mediastinitída a tracheoezofageálna fistula [15–17]. Obzvlášť vysoká miera komplikácií bola v tejto klinickej situácii pozorovaná po implantácii BDS (89 %) [18].
Distálne migrované stenty sa u pacientov s malígnou obštrukciou pažeráka v súčasnosti odporúčajú ponechať in situ, nakoľko u ~ 90 % pacientov nespôsobujú ťažkosti, ich extrakcia môže spôsobiť perforáciu alebo krvácanie a doba prežívania pacientov s karcinómom pažeráka je nízka [19]. De Palma et al pozorovali, že z 13 migrovaných stentov deväť zostalo po dobu sledovania v žalúdku, tri odišli bez povšimnutia per vias naturales a jeden spôsobil mechanický ileus v hrubom čreve [19].
Ďalšou závažnou neskorou komplikáciou je obturácia stentov. Dochádza k nej pri malígnych aj benígnych léziách. Pri malígnych léziách dochádza k prerastaniu tumorom po mediáne 18 týždňov, pri benígnych ku hyperproliferácii granulačného tkaniva po mediáne 22 týždňov [13,20,21]. Klinicky signifikantná hyperplastická tkanivová reakcia sa môže objaviť už dva týždne po implantácii [20]. Obturáciu stentu je možné riešiť restentovaním, APC koaguláciou alebo balónkovou dilatáciou. Hirdes et al nedávno publikovali metódu zavedenia druhého stentu do obštruovaného stentu s prerasteným granulačným tkanivom [22]. Kompresiou prerastajúceho tkaniva došlo k jeho nekróze a oba stenty bolo možné bez komplikácií vybrať o 7–14 dní.
Ezofageálne stenty v liečbe malígnych stenóz pažeráka
Implantácia SEMS je účinnou liečbou malígnej stenózy pažeráka, je technicky jednoduchá, vedie ku rýchlej obnove príjmu potravy a signifikantne zvyšuje kvalitu života pacientov [23].
SEMS a paliatívna rádioterpia sú v súčasnosti najčastejšie používané metódy rekanalizácie lumenu pažeráka pri malígnej stenóze, pričom viaceré veľké randomizované štúdie preukázali ich porovnateľnú účinnosť [24,25]. K ústupu dysfágie dochádza rýchlejšie po implantácii SEMS, na druhej strane medián patencie lumenu je dlhší po rádioterapii. Pri restentovaní (výmena stentu alebo zavedenie stentu do stentu) sú však aj dlhodobé výsledky liečby dysfágie porovnateľné.
SEMS boli uvedené do klinickej praxe začiatkom 90. rokov. Prvú kontrolovanú štúdiu, ktorá porovnávala SEMS a dovtedy používané rigidné 16mm protézy pri paliácii malígnej dysfágie, publikovali Knyrim et al v roku 1993 [6]. Na kohorte 42 pacientov pozorovali rovnakú účinnosť oboch metód, avšak SEMS mali signifikantne nižšiu mieru komplikácií (33 vs 76 %), včítane závažných komplikácií ako perforácie, migrácia stentu a aspirácia (0 vs 43 %). Vývoj stentov v 90. rokoch prešiel zásadným konštrukčným vývojom. Pre vysokú mieru periimplantačnej mortality (~ 16 %) aj včasných komplikácií ako bolesť na hrudníku (~ 20 %) sa upustilo od ostrého zakončenia stentov [26]. Zistilo sa, že proximálny priemer stentu 30 mm (Flamingo Wallstent, Boston Scientific, USA) viedol pri rovnakej účinnosti takisto k častejším komplikáciám, predovšetkým k bolestiam na hrudníku [27,28]. Použitie 25mm stentov viedlo k nižšej miere migrácie (~ 8 %), ale takisto vyššej miere hrudného dyskomfortu a perforácií [29].
Vzhľadom na vysokú mieru (~ 30 %) prerastanie a obturácie nepovlečených stentov nádorovým tkanivom sa koncom 90. rokoch do klinickej praxe uviedli povlečené stenty. Prvé štúdie naznačovali rovnakú klinickú účinnosť a nižšiu mieru recidívy dysfágie pri nižšej miere prerastania [30].
Otázke porovnania nepovlečených a povlečených stentov sa venovalo medzičasom veľa štúdií. Yakoub et al publikovali hodnotenie 20 porovnávacích štúdií stentov v liečbe malígnej stenózy pažeráka na spolu 911 pacientoch [31]. Dvanásť štúdií porovnávalo plastové a metalické stenty a osem štúdií povlečené vs nepovlečené stenty. Nepovlečené stenty mali vyššiu mieru obliterácie prerastaním (~ 25 vs 2 %), naopak povlečené mali vyššiu mieru migrácie (~ 25 vs ~ 2 %).
Štúdie, ktoré porovnávali jednotlivé typy stentov, vo väčšine prípadov nezistili signifikantné rozdiely v klinickej účinnosti, prežívania ani miere komplikácií [4,23,27,32,33].
Výnimku tvorí nedávno publikovaná štúdia Van Heel et al, v ktorej sa porovnávali dva parciálne povlečené stenty Ultraflex (Boston Scientific) a Evolution (Cook) v randomizovanej multicentrickej štúdii STEMA na kohorte 80 pacientov [34]. Evolution stent bol rovnako účinný, mal však menej závažných komplikácií (3/39 vs 10/40; p = 0,04) a vyžadoval menej reintervencií (4/39 vs 15/40; p = 0,004).
Viaceré stenty boli nadizajnované špecificky s cieľom znížiť migráciu povlečených SEMS. Jedným z nich je dvojvrstvový stent Niti-S (Taewoong Medical, Južná Kórea). Stent má povlečenú vnútornú nitinolovú membránu, ktorá je prekrytá druhou vrstvou nepovlečeného nitinolového stentu. V randomizovanej kontrolovanej štúdii na 37 pacientoch s malígnou stenózou pažeráka sa porovnával povlečený SEMS a dvojvrstvový Niti-S stent [35]. Oba stenty dosahovali porovnateľnú klinickú účinnosť na paliáciu dysfágie. Miera komplikácií (migrácia, prerastanie) bola signifikantne nižšia v skupine liečenej dvojvrstvovým stentom (2/17, 12 %) vs povlečeným SEMS (11/19, 58 %; p = 0,006). Kumulatívna miera migrácie stentu na kohorte 101 pacientov s malígnou stenózou predstavovala spolu 8 % [13,35,36].
Druhým stentom s antimigračnými prvkami je SX-ELLA HV stent, ktorý má na proximálnom konci špeciálny antimigračný kruh. Uitdehaag et al pozorovali na kohorte 44 pacientov s malígnou stenózou pažeráka dobrú klinickú účinnosť [37]. Miera migrácie bola na úrovni 6/44 (13,5 %), prerastanie na úrovni 2/44 pacientov (5 %). Celková miera komplikácií však dosahovala 10/44 (23 %) pacientov, predovšetkým v dôsledku krvácavých komplikácií (8/44).
Asi najväčšie doterajšie skúsenosti s použitím SEMS v liečbe stenotizujúceho karcinómu pažeráka publikovali White et al [38]. V prospektívnej štúdii na kohorte 951 pacientov, ktorým implantovali 1 000 stentov v období rokov 1999–2008, bol možný dlhodobý follow-up u 334 pacientov. Medián prežívania dosiahol 250 dní. Dilatácia stenózy bola možná u 90 % pacientov. Včasné komplikácie sa vyskytli u 54/951 (6 %) pacientov (perforácia 34, krvácanie 7, silné bolesti 10, úmrtie 3) a neskoré u 62/334 (19 %) pacientov (obštrukcia 55, migrácia 3, tracheoezofageálna fistula 8). Mortalita asociovaná s výkonom predstavovala 3/951 (0,3 %) pacientov.
Špecifické porovnanie účinnosti a komplikácií SEMS a porovnania povlečených a nepovlečených stentov pri malígnych stenózach gastroezofageálnej junkcie skúmala štúdia Parka et al na kohorte 89 pacientov [39]. Celková miera úspešnosti bola 93 %, medián patencie stentu bol 190 dní a miera zlyhania stentov 33 %. Obdobne ako v proximálnejších lokalizáciách bola vyššia miera migrácie u povlečených stentov (20 vs 0 %) a vyššia miera prerastania pri nepovlečených stentoch (29 vs 18 %). Vyššia miera migrácie bola pozorovaná po chemoterapii (43 vs 10 %), naopak rádioterapia zvýšila dobu patencie stentu.
Ďalšou osobitnou kategóriou sú proximálne stenózy v oblasti cervikálneho pažeráka. Za kritickú hranicu pre implantáciu štandardného SEMS sa v súčasnosti považuje proximálny koniec lézie 2 cm distálne od horného ezofageálneho sfinktera. Dôvodom je takmer nulová tolerancia stentu pre bolesti a pocity globusu v hrdle [40]. Na trhu sú stenty so skráteným proximálnym golierom, ktoré výrobcovia uvádzajú ako vhodnejšie na proximálnu implantáciu. Nedávno boli tiež publikované práce na malých kohortách pacientov po laryngektómii alebo po rádioterapii, pri ktorých boli v proximálnom pažeráku s úspechom použité neskracujúce sa stenty s lumenom 10–16 mm [41,42].
Jediným dostupným ezofageálnym plastovým stentom je Polyflex (Boston Scientific, USA). Jeho nevýhodou je pomerne široký zavádzaný systém šírky 12–14 mm, ktorý komplikuje zavádzanie cez užšie stenózy a vyžaduje ich predzákrokovú dilatáciu. Viaceré randomizované štúdie a jedna veľká metaanalýza ukázali vyššiu mieru komplikácií po aplikácii plastových stentov (perforácie, migrácia) a tieto sa v liečbe malígnych stenóz pažeráka používajú zriedka [12,13,31,43].
Osobitnou otázkou je indikácia stentov u pacientov s operabilným karcinómom pažeráka, dysfágiou, malnutríciou a plánovanou neoadjuvantnou chemorádioterapiou (6–8 týždňov). U týchto pacientov zavedenie SEPS viedlo k rovnakým nutričným výsledkom (+ 4 kg) ako zavedenie chirurgickej jejunostómie [44] pri porovnateľnej miere technickej úspešnosti a nesignifikantne vyššej miere komplikácií (22 vs 4 %). Problémom sa zdá byť jednak vysoká miera (~ 15 %) závažných komplikácií ako perforácie, fistuly a krvácania [15] a jednak vysoká miera migrácie stentu (SEMS 2–40 %, SEPS 15–60 %) počas chemorádioterapie [23].
Ezofageálne stenty v liečbe externej kompresie pažeráka
Extramurálna kompresia pažeráka býva spôsobená tumormi pľúc alebo mediastinou, mediastinálnou lymfadenopatiou a zriedkavo benígnymi ochoreniami, ako sú aneuryzma aorty alebo sarkoidóza.
Vzhľadom na zvyčajne vyšší tlak sa pri stenóze v dôsledku extramurálnej kompresie v súčasnosti odporúčajú stenty s vysokou radiálnou silou, ako sú segmentované stenty alebo štrikované (knitted) stenty.
Technika implantácie je pri extramurálnej kompresii rovnaká. Osobitným rizikom (~ 8 %) v tejto indikácii je kompresia dýchacích ciest [45]. Predimplantačná stenóza trachey alebo hlavných bronchov je kontraindikáciou implantácie. Pri predimplantačnej diagnostike sa zvyčajne dajú využiť CT snímky hrudníka, ktoré má väčšina pacientov v tejto indikácii k dispozícii. Klinicky je možné patenciu dýchacích ciest overiť aj tak, že počas endoskopie sa v stenóze nafúkne 18–20 mm endoskopický balónik alebo sa zavedie 54 Fr bužia a sleduje sa prípadný stridor a/alebo dyspnoe. Riziko kompresie dýchacích ciest je možné úspešne eliminovať zavedením endobronchiálneho stentu pred zavedením ezofageálneho stentu [41,46,47].
Implantácie SEMS pre stenózy pažeráka v dôsledku extramurálnej kompresie bývajú menej uspokojivé ako pri intraluminálnej obštrukcii [48]. V nedávno publikovanej holandskej retrospektívnej štúdii na 50 pacientoch s extramurálnou obštrukciou pri nádoroch pľúc alebo metastázach karcinómu pažeráka do mediastina po ezofagektómii autori pozorovali krátku dobu prežívania (44 dní), 84% klinickú úspešnosť úľavy dysfágie, 10 % závažných komplikácií stentu (perforáca, krvácanie) a 18 % ľahkých komplikácií [45].
Ezofageálne stenty v liečbe benígnych stenóz pažeráka
Benígne stenózy pažeráka boli v minulosti najčastejšie dôsledkom refluxnej choroby pažeráka. Po zavedení inhibítorov protónovej pumpy do liečby sa ich výskyt znížil a v súčasnosti prevažujú anastomotické stenózy a korozívne stenózy po požití agresívnych látok.
Liečbou prvej voľby benígnych stenóz je dilatácia stenózy pomocou Savary-Gillardových bužií alebo endoskopických balónkov. Pri jej zlyhaní je indikovaná krátkodobá liečba samoexpandibilnými stentami. Táto je v súčasnosti považovaná za kontroverznú s otáznymi dlhodobými výsledkami. V malých klinických štúdiách boli použité SEMS, SEPS a najnovšie aj biodegradabilné stenty. Optimálna doba implantácie v tejto indikácii nie je jednoznačne určená. Zvyčajne sa stenty ponechávajú po dobu 8–12 týždňov.
Výsledky použitia plastových stentov sú kontroverzné. Na jednej strane sú práce, ktoré v indikácii benígnych ezofageálnych stenóz udávali vysokú (80–90%) mieru úspešnosti liečby [49,50], iné práce však pozorovali vysokú migráciu stentov a nízku dlhodobú úspešnosť po extrakcii stentu [51,52]. Holm et al vo svojej práci napríklad udávajú, že len 5/83 (6 %) pacientov s benígnymi stenózami a fistulami dosiahli dlhodobé zlepšenie aj po extrakcii stentu [51]. Navyše miera migrácie presahovala 70 %, a to obzvlášť v indikácii benígnej (82 %) a anastomotickej (75 %) stenózy.
Z metalických stentov sa používajú plne povlečené stenty. Canena et al porovnávali povlečený SEMS (pSEMS, 10 pacientov, 10 týždňov), SEPS (10 pacientov, 12 týždňov doby implantácie) a biodegradabilný stent (BDS, 10 pacientov, do rozpustenia stentu) na kohorte 30 pacientov s benígnou stenózou pažeráka [53]. Metalické plne povlečené stenty mali najvyššiu mieru úľavy od dysfágie (40 %) vs BDS (30 %) vs SEPS (10 %). Najnižšiu mieru migrácie naopak autori pozorovali v prípade BDS (20 %) vs SEMS (30 %) a SEPS (60 %). Celková miera úspešnosti korelovala v multivariátnej analýze navyše s kratšou dĺžkou stenózy. Zaujímavým pozorovaním výlučne v kohorte BDS bola výrazná tkanivová hyperplázia u 3/10 pacientov, ktorá viedla ku závažnému krvácaniu u jedného pacienta a restenóze u zvyšných dvoch pacientov.
Van Boeckel et al naopak v retrospektívnej štúdii na kohorte 38 pacientov s refraktérnou benígnou ezofageálnou stenózou nepozorovali rozdiel v miere klinickej úspešnosti SEPS a BDS (30 vs 33 %) [54]. Miera závažných komplikácií (perforácia, krvácanie, bolesť na hrudníku) bola nesignifikantne nižšia pri SEPS (10 % SEPS vs 22 % BDS).
Extrakcia stentov pri benígnych stenózach je pomerne bezpečná. V najväčšej doteraz publikovanej retrospektívnej štúdii bola miera závažných komplikácií (perforácia, impakcia stentu, fistula) na súbore 214 pacientov s 329 extrakciami stentov 7/329 (2 %) a celková miera komplikácií 35/329 (11 %) [55]. Komplikácie boli signifikatne častejšie u parciálne povlečených stentov (25 %) vs povlečené (4 %) a plastové (9 %). Miera komplikácií nebola ovplyvnená dĺžkou doby implantácie.
V poslednej dobe sa SEMS indikujú aj v liečbe achalázie, hoci ich presný význam zatiaľ nebol dostatočne stanovený [56]. V dlhodobej prospektívnej štúdii bol na mieru vyrobený SEMS s priemerom 30 mm implantovaný na dobu 4–5 dní 75 pacientom s achaláziou [57]. Klinická úspešnosť dosahovala 96 % po jednom roku a 83 % po desiatich rokoch sledovania. Autori nepozorovali žiadnu perforáciu, sledovali 5% migráciu stentu, 39% výskyt bolesti na hrudníku a 12% mieru krvácania. V prospektívnej randomizovanej štúdii bolo použitie SEMS s 30mm priemerom úspešnejšie ako pneumatická dilatácia a SEMS s priemermi 20 a 25 mm [58].
Ezofageálne stenty v liečbe ezofageálnych fistúl
Ezofagorespiračné fistuly môžu byť malígne alebo benígne. Malígne vznikajú ako komplikácia nádorov pažeráka alebo okolitých orgánov. Benígne sú zväčša iatrogénne ako komplikácia hrudnochirurgického alebo endoskopického zákroku.
V indikácii malígnej fistuly pažeráka sa používajú plne povlečené SEMS. Pri ich implantácii je dôležité zabezpečiť, aby proximálny koniec stentu aj po jeho skrátení spoľahlivo presahoval otvor fistuly. Takisto je dôležité, aby proximálny koniec stentu po expanzii dôkladne priliehal na stenu pažeráka a nedovoľoval pretekanie potravy do oblasti fistuly [41]. Po implantácii stentu a pred prvým požitím potravy je vhodné vykonať RTG pasáž pažeráka iódovou kontrastnou látkou, skontrolovať preklenutie fistuly stentom a vylúčiť jej plnenie kontrastnou látkou.
Klinická úspešnosť SEMS na uzatvorenie malígnej fistuly dosahuje podľa review klinických štúdií 70–100 % [2]. Miera komplikácií je obdobná ako v iných indikáciách a dosahuje 10–30 %. Pri zlyhaní liečby SEMS je možné zvýšiť úspešnosť liečby bronchoskopickým zavedením paralelného tracheálneho stentu [59].
Pri benígnych fistulách sa takisto používajú plne povlečné stenty z dôvodu ich ľahkej extrakcie. Počas výkonu vykonávajú niektorí endoskopisti abráziu výstelky fistulózneho traktu pomocou cytologickej kefky, čím sa očakáva rýchlejší uzáver fistuly. Do fistulózneho traktu je takisto možné aplikovať fibrínové lepidlo, ktoré urýchľuje proces obliterácie fistuly [60].
Optimálna dĺžka liečby a ponechanie stentu pri indikácii benígnej fistuly nie sú klinicky overené a odporúčania sa pohybujú od 4–6 týždňov pri čerstvých fistulách po 3–6 mesiacov pri chronických fistulách [41].
Pokiaľ dôjde ku migrácii povlečeného stentu, je možné implantovať parciálne povlečný stent. Pokiaľ by došlo k jeho fixácii granuláciou tkaniva a stent by nebolo možné na konci liečby extrahovať, je možné s úspechom použiť techniku implantácie druhého stentu do stentu a po ~ 6 týždňoch oba stenty extrahovať [22].
Celkovo sa úspešnosť liečby benígnych fistúl podľa rôznych štúdií pohybuje na úrovni 30–90 % [2]. V retrospektívnej štúdii na kohorte 54 pacientov s benígnymi indikáciami (postchirurgický anastomotický leak n = 29, fistula n = 15 a perforácia n = 10 pacientov), ktorým bolo implantovaných spolu 117 stentov, sa pozorovala 74% primárna úspešnosť (leak 73 %, fistula 73 %, perforácia 80 %) a 83% celková úspešnosť (leak 83 %, fistula 80 %, perforácia 90 %) implantácie stentu na uzatvorenie lézie [61]. Najčastejšou technickou komplikáciou bola migrácia stentov v 28 % prípadov, pričom nebol rozdiel medzi parciálne povlečenými a plne povlečenými stentami. Úspešnosť liečby pri léziách s veľkosťou do 15 mm bola signifikantne vyššia 34/39 (87 % vs lézie väčšie ako 15 mm 6/15 40 %; p = 0,003).
Pri zlyhaní liečby je možné indikovať operačné riešenie alebo použiť nedávno uvedené over-the-scope endoklipy (Ovesco) s veľkým diametrom [62,63].
Ezofageálne stenty v liečbe ruptúr pažeráka
Ruptúry pažeráka môžu vzniknúť iatrogénne ako komplikácia endoskopického vyšetrenia (najčastejšie dilatácie, extrakcie cudzích telies, ERCP), chirurgickej intervencie na pažeráku alebo zriedkavejšie spontánne pri intenzívnom zvracaní (Boerhaaveho syndróm) [64,65]. Perforácie stredného a distálneho pažeráka sú sprevádzané vysokou mortalitou najmä v dôsledku rozvoja mediastinitídy a sepsy [66]. Liečba anastomotických leakov sa posunula od chirurgických reintervencií ku konzervatívnemu postupu založenom na parenterálnej výžive, antibiotikách a drenáži [67,68].
V poslednej dobe sa s úspechom v tejto indikácii používajú aj povlečené SEMS alebo SEPS [69]. SEMS sa zvyčajne implantujú na dobu 6–8 týždňov (rozptyl v štúdiách je 3–18 týždňov) a následne sa extrahujú. Nedávna metaanalýza 25 štúdií na spolu 267 pacientov ukázala 85% úspešnosť implantácie SEMS na uzatvorenie perforácie pažeráka. Metaanlýza neukázala rozdiel medzi povlečenými a parciálne povlečenými stentami ani medzi metalickými a plastovými stentami [21]. Celková mortalita bola 11 %, zväčša v dôsledku septických komplikácií perforácie. Včasné komplikácie sa pozorovali u 3 % pacientov (krvácanie 2 %, perforácia 1 %). Neskoré komplikácie boli pozorované u 34 % pacientov, z toho migrácia u 29 % a obturácia v 5 %. Migrácia stentov bola najvyššia pri plne povlečených SEPS (31 %) vs pri plne povlečenených SEMS (26 %) a parciálne povlečených SEMS (12 %), p < 0,001. Na druhej strane obturácia granulujúcim tkanivom bola pozorovaná u 12 % parciálne povlečených SEMS vs 7 % plne povlečených SEMS a 3 % plne povlečených SEPS.
Na priame porovnanie SEMS a chirurgického riešenia perforácie pažeráka nie sú v súčasnosti k dispozícii spoľahlivé dáta. Mortalita pri SEMS v tejto indikácii je okolo 13 %, mortalita chirurgického riešenia v literatúre je 12–50 %. Implantácia SEMS sa podľa expertov odporúča pri perforácii menej ako 70 % cirkumferencie lumenu pažeráka [70].
V posledných rokoch vzrastá počet metabolických bariatrických chirurgických operácií pre morbídnu obezitu, pričom asi 2 % operácií sú komplikované insuficienciou anastomózy s následným leakom [71]. Väčšina leakov je v proximálnej tretine žalúdka a je asociovaná so signifikantnou mortalitou 6–15 % [72]. Viaceré firmy v poslednej dobe predstavili špeciálne 18–24 cm stenty s variabilným priemerom do 30 mm na liečbu leakov v anastomóze na žalúdku po bariatrickej chirurgii.
Ezofageálne stenty v liečbe ezofageálnych varixov
Špeciálne ezofageálne stenty (Danišov stent) sa v poslednej dobe začali s úspechom využívať aj v liečbe refraktérnych ezofageálnych varixov [77]. Danišov stent je povlečený nitinolový stent s atraumatickými okrajmi, špeciálnym antiperistaltickým pletením a s možnosťou extrakcie (ELLA, Česká republika). Na jeho distálnom konci je nafukovateľný balónik, ktorý umožňuje zavádzanie stentu do distálneho pažeráka „naslepo“ aj bez endoskopickej alebo skiaskopickej kontroly. Danišov stent je indikovaný na liečbu refraktérneho ezofageálneho krvácania, ako alternatíva ku balónkovej tamponáde alebo intrahepatickej portokaválnej spojke (TIPS). Stent sa ponecháva v pažeráku sedem dní a potom sa extrahuje.
Zehenter et al publikovali výsledky implantácie Danišovho stentu na kohorte 34 pacientov s refraktérnym variceálnym krvácaním [73]. Hemostáza sa dosiahla v 33/34 (97 %) prípadoch. Autori nepozorovali žiadne komplikácie v súvislosti s implantáciou alebo extrakciou stentov. Podobné výsledky s > 90% úspešnosťou na zástavu krvácania publikovali aj ďalšie dve menšie štúdie [74,75].
Česká hepatologická spoločnosť uvádza v nedávno publikovaných odporúčaniach pre liečbu krvácania pri portálnej hypertenzii Danišov stent ako alternatívu ku balónkovej tamponáde pri zlyhaní endoskopickej liečby [76].
Záver
V posledných rokoch došlo ku významnému pokroku vo vývoji ezofageálnych stentov. Zlepšili sa vlastnosti stentov, techniky ich zavádzania a rozširujú sa indikácie. Paliatívne stentovanie inoperabilných malígnych stenóz pažeráka je dnes bežnou súčasťou liečby. Okrem malígnych indikácií sa rozširuje spektrum benígnych indikácií, ako sú liečba refraktérnych benígnych stenóz pažeráka, fistúl, anastomotických leakov a perforácií alebo krvácajúcich varixov. V blízkej budúcnosti je možné očakávať ďalší intenzívny vývoj nových stentov, techník zavádzania a klinických indikácií. Medzi najväčšie výzvy patrí prevencia migrácie stentov a optimalizácia výberu stentu podľa charakteru lézie a konštrukčných vlastností stentu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 6. 2. 2014
Přijato: 18. 5. 2014
doc. MUDr. Tibor Hlavatý, PhD.
Gastroenterologické a hepatologické oddelenie
V. interná klinika LF UK a UN Bratislava
Ružinovská 6, 82606 Bratislava
tibor.hlavaty2@gmail.com
Sources
1. Kochar R, Shah N. Enteral stents: from esophagus to colon. Gastrointest Endosc 2013; 78(6): 913–918. doi: 10.1016/j.gie.2013.07.015.
2. Sharma P, Kozarek R. Role of esophageal stents in benign and malignant diseases. Am J Gastroenterol 2010; 105(2): 258–273. doi: 10.1038/ajg.2009.684.
3. Rejchrt S, Bures J, Brozík J et al. Use of bio-degradable stents for the treatment of refractory benign gastrointestinal stenoses. Acta Medica (Hradec Kralove) 2011; 54(4): 137–143.
4. Irani S, Kozarek R. Esophageal stents: past, present, and future. Tech Gastrointest Endosc 2010; 12(4): 178–190.
5. Palmer ED. Experiences with management of malignant esophagorespiratory fistula by peroral esophageal prosthesis. Gastrointest Endosc 1970; 17(1): 12–16.
6. Knyrim K, Wagner HJ, Bethge N et al. A controlled trial of an expansile metal stent for palliation of esophageal obstruction due to inoperable cancer. N Engl J Med 1993; 329(18): 1302–1307.
7. Žitňan Ľ, Májek J, Pekárek B et al. Stenty v liečbe zhubných nádorov kolorekta – prehľad a vlastné skúsenosti. Gastroent Hepatol 2013; 67(1): 49–53.
8. Hirdes MM, Vleggaar FP, de Beule M et al. In vitro evaluation of the radial and axial force of self-expanding esophageal stents. Endoscopy 2013; 45(12): 997–1005. doi: 10.1055/s-0033-1344985.
9. Tanaka T, Takahashi M, Nitta N et al. Newly developed biodegradable stents for benign gastrointestinal tract stenoses: a preliminary clinical trial. Digestion 2006; 74(3–4): 199–205.
10. Stivaros SM, Williams LR, Senger C et al. Woven polydioxanone biodegradable stents: a new treatment option for benign and malignant oesophageal strictures. Eur Radiol 2010; 20(5): 1069–1072. doi: 10.1007/s00330-009-1662-5.
11. Laasch HU, Marriott A, Wilbraham L et al. Effectiveness of open versus antireflux stents for palliation of distal esophageal carcinoma and prevention of symptomatic gastroesophageal reflux. Radiology 2002; 225(2): 359–365.
12. Conio M, Repici A, Battaglia G et al. A randomized prospective comparison of self-expandable plastic stents and partially covered self-expandable metal stents in the palliation of malignant esophageal dysphagia. Am J Gastroenterol 2007; 102(12): 2667–2677.
13. Verschuur EM, Repici A, Kuipers EJ et al. New design esophageal stents for the palliation of dysphagia from esophageal or gastric cardia cancer: a randomized trial. Am J Gastroenterol 2008; 103(2): 304–312.
14. Shim CS, Jung IS, Cheon YK et al. Management of malignant stricture of the esophagogastric junction with a newly designed self-expanding metal stent with an antireflux mechanism. Endoscopy 2005; 37(4): 335–339.
15. Langer FB, Schoppmann SF, Prager G et al. Temporary placement of self-expanding oesophageal stents as bridging for neo-adjuvant therapy. Ann Surg Oncol 2010; 17(2): 470–475. doi: 10.1245/s10434-009-0760-6.
16. Yakami M, Mitsumori M, Sai H et al. Development of severe complications caused by stent placement followed by definitive radiation therapy for T4 esophageal cancer. Int J Clin Oncol 2003; 8(6): 395–398.
17. Sabharwal T, Morales JP, Irani FG et al. Quality improvement guidelines for placement of esophageal stents. Cardiovasc Intervent Radiol 2005; 28(3): 284–288.
18. Hirdes MM, van Hooft JE, Wijrdeman HK et al. Combination of biodegradable stent placement and single-dose brachytherapy is associated with an unacceptably high complication rate in the treatment of dysphagia from esophageal cancer. Gastrointest Endosc 2012; 76(2): 267–274. doi: 10.1016/j.gie.2012.04.442.
19. De Palma GD, Iovino P, Catanzano C. Distally migrated esophageal self-expanding metal stents: wait and see or remove? Gastrointest Endosc 2001; 53(1): 96–98.
20. Mayoral W, Fleischer D, Salcedo J et al. Nonmalignant obstruction is a common problem with metal stents in the treatment of esophageal cancer. Gastrointest Endosc 2000; 51(5): 556–559.
21. Van Boeckel PG, Sijbring A, Vleggaar FP et al. Systematic review: temporary stent placement for benign rupture or anastomotic leak of the oesophagus. Aliment Pharmacol Ther 2011; 33(12): 1292–1301. doi: 10.1111/j.1365-2036.2011.04663.x.
22. Hirdes MM, Siersema PD, Houben MH et al. Stent-in-stent technique for removal of embedded esophageal self-expanding metal stents. Am J Gastroenterol 2011; 106(2): 286–293. doi: 10.1038/ajg.2010.394.
23. Conio M, De Ceglie A, Blanchi S et al. Esophageal strictures, tumors, and fistulae: stents for primary esophageal cancer. Tech Gastrointest Endosc 2010; 12 : 191–202.
24. Homs MY, Steyerberg EW, Eijkenboom WM et al. Single-dose brachytherapy versus metal stent placement for the palliation of dysphagia from oesophageal cancer: multicentre randomised trial. Lancet 2004; 364(9444): 1497–1504.
25. Bergquist H, Wenger U, Johnsson E et al. Stent insertion or endoluminal brachytherapy as palliation of patients with advanced cancer of the esophagus and gastroesophageal junction. Results of a randomized, controlled clinical trial. Dis Esophagus 2005; 18(3): 131–139.
26. Schmassmann A, Meyenberger C, Knuchel J et al. Self-expanding metal stents in malignant esophageal obstruction: a comparison between two stent types. Am J Gastroenterol 1997; 92(3): 400–406.
27. Siersema PD, Hop WC, van Blankenstein M et al. A comparison of 3 types of covered metal stents for the palliation of patients with dysphagia caused by esophagogastric carcinoma: a prospective, randomized study. Gastrointest Endosc 2001; 54(2): 145–153.
28. Sabharwal T, Hamady MS, Chui S et al. A randomised prospective comparison of the Flamingo Wallstent and Ultraflex stent for palliation of dysphagia associated with lower third oesophageal carcinoma. Gut 2003; 52(7): 922–926.
29. Kozarek RA, Raltz S, Marcon N et al. Use of the 25 mm flanged esophageal Z stent for malignant dysphagia: a prospective multicenter trial. Gastrointest Endosc 1997; 46(2): 156–160.
30. Vakil N, Morris AI, Marcon N et al. A prospective, randomized, controlled trial of covered expandable metal stents in the palliation of malignant esophageal obstruction at the gastroesophageal junction. Am J Gastroenterol 2001; 96(6): 1791–1796.
31. Yakoub D, Fahmy R, Athanasiou T et al. Evidence-based choice of esophageal stent for the palliative management of malignant dysphagia. World J Surg 2008; 32(9): 1996–2009. doi: 10.1007/s00268-008-9654-1.
32. Varadarajulu S, Banerjee S, Barth B et al. Enteral stents. Gastrointest Endosc 2011; 74(3): 455–464. doi: 10.1016/j.gie.2011.04.011.
33. Siddiqui AA, Sarkar A, Beltz S et al. Placement of fully covered self-expandable metal stents in patients with local-ly advanced esophageal cancer before neoadjuvant therapy. Gastrointest Endosc 2012; 76(1): 44–51. doi: 10.1016/j.gie.2012.02.036.
34. Van Heel NC, Haringsma J, Boot H et al. Comparison of 2 expandable stents for malignant esophageal disease: a randomized controlled trial. Gastrointest Endosc 2012; 76(1): 52–58. doi: 10.1016/j.gie.2012.02.050.
35. Kim ES, Jeon SW, Park SY et al. Comparison of double-layered and covered Niti-S stents for palliation of malignant dysphagia. J Gastroenterol Hepatol 2009; 24(1): 114–119. doi: 10.1111/j.1440-1746.2008.05674.x.
36. Verschuur EM, Homs MY, Steyerberg EW et al. A new esophageal stent design (Niti-S stent) for the prevention of migration: a prospective study in 42 patients. Gastrointest Endosc 2006; 63(1): 134–140.
37. Uitdehaag MJ, Siersema PD, Spaander MC et al. A new fully covered stent with antimigration properties for the palliation of malignant dysphagia: a prospective cohort study. Gastrointest Endosc 2010; 71(3): 600–605. doi: 10.1016/j.gie.2009.09.023.
38. White RE, Parker RK, Fitzwater JW et al. Stents as sole therapy for oesophageal cancer: a prospective analysis of outcomes after placement. Lancet Oncol 2009; 10(3): 240–246. doi: 10.1016/S1470-2045(09)70004-X.
39. Park JJ, Lee YC, Kim BK et al. Long-term clinical outcomes of self-expanding metal stents for treatment of malignant gastroesophageal junction obstructions and prognostic factors for stent patency: effects of anticancer treatments. Dig Liver Dis 2010; 42(6): 436–440. doi: 10.1016/j.dld.2009.07.020.
40. Choi EK, Song HY, Kim JW et al. Cover-ed metallic stent placement in the man-agement of cervical esophageal strictures. J Vasc Interv Radiol 2007; 18(7): 888–895.
41. Wong Kee Song LM, Baron TH. Stents for uncommon malignant and benign esophageal indications (extrinsic compression, esophagorespiratory fistulas, and proximal esophageal obstruction). Tech Gastrointest Endosc 2010; 12(4): 210–215.
42. Eleftheriadis E, Kotzampassi K. Endoprosthesis implantation at the pharyngo-esophageal level: problems, limitations and challenges. World J Gastroenterol 2006; 12(13): 2103–2108.
43. Adler DG, Fang J, Wong R et al. Placement of Polyflex stents in patients with locally advanced esophageal cancer is safe and improves dysphagia during neoadjuvant therapy. Gastrointest Endosc 2009; 70(4): 614–619. doi: 10.1016/j.gie.2009.01.026.
44. Siddiqui AA, Glynn C, Loren D et al. Self-expanding plastic esophageal stents versus jejunostomy tubes for the maintenance of nutrition during neoadjuvant chemoradiation therapy in patients with esophageal cancer: a retrospective study. Dis Esophagus 2009; 22(3): 216–222. doi: 10.1111/j.1442-2050.2008.00905.x.
45. Van Heel NC, Haringsma J, Spaander MC et al. Esophageal stents for the relief of malignant dysphagia due to extrinsic compression. Endoscopy 2010; 42(7): 536–540. doi: 10.1055/s-0029-1244123.
46. Tojo T, Iioka S, Kitamura S et al. Management of malignant tracheobronchial stenosis with metal stents and Dumon stents. Ann Thorac Surg 1996; 61(4): 1074–1078.
47. Thies J, Elfeldt RJ. Indications, technical implementation and results of endobronchial stent implantation. Langenbecks Arch Chir Suppl Kongressbd 1996; 113 : 547–549.
48. Bethge N, Sommer A, Vakil N. Palliation of malignant esophageal obstruction due to intrinsic and extrinsic lesions with expandable metal stents. Am J Gastroenterol 1998; 93(10): 1829–1832.
49. Evrard S, Le Moine O, Lazaraki G et al. Self-expanding plastic stents for benign esophageal lesions. Gastrointest Endosc 2004; 60(6): 894–900.
50. García-Cano J. Dilation of benign strictures in the esophagus and colon with the polyflex stent: a case series study. Dig Dis Sci 2008; 53(2): 341–346.
51. Holm AN, de la Mora Levy JG, Gostout CJ et al. Self-expanding plastic stents in treatment of benign esophageal conditions. Gastrointest Endosc 2008; 67(1): 20–25.
52. Triester SL, Fleischer DE, Sharma VK. Failure of self-expanding plastic stents in treatment of refractory benign esophageal strictures. Endoscopy 2006; 38(5): 533–537.
53. Canena JM, Liberato MJ, Rio-Tinto RA et al. A comparison of the temporary placement of 3 different self-expanding stents for the treatment of refractory benign esophageal strictures: a prospective multicentre study. BMC Gastroenterol 2012; 12 : 70.
54. Van Boeckel PG, Vleggaar FP, Siersema PD. A comparison of temporary self-expanding plastic and biodegradable stents for refractory benign esophageal strictures. Clin Gastroenterol Hepatol 2011; 9(8): 653–659. doi: 10.1016/j.cgh.2011.04.006.
55. Van Halsema EE, Wong Kee Song LM, Baron TH et al. Safety of endoscopic removal of self-expandable stents after treatment of benign esophageal diseases. Gastrointest Endosc 2013; 77(1): 18–28. doi: 10.1016/j.gie.2012.09.001.
56. Veseliny E, Jarčuška P, Zakuciová M et al. Liečba achalázie – súčasný prístup a vlastné skúsenosti. Gastroent Hepatol 2012; 66(2): 116–124.
57. Zhao JG, Li YD, Cheng YS et al. Long-term safety and outcome of a temporary self-expanding metallic stent for achalasia: a prospective study with a 13-year single-center experience. Eur Radiol 2009; 19(8): 1973–1980. doi: 10.1007/s00330-009-1373-y.
58. Li YD, Tang GY, Cheng YS et al. 13-year follow-up of a prospective comparison of the long-term clinical efficacy of temporary self-expanding metallic stents and pneumatic dilatation for the treatment of achalasia in 120 patients. Am J Roentgenol 2010; 195(6): 1429–1437. doi: 10.2214/AJR.10.4407.
59. Van den Bongard HJ, Boot H, Baas P et al. The role of parallel stent insertion in patients with esophagorespiratory fistulas. Gastrointest Endosc 2002; 55(1): 110–115.
60. Cellier C, Landi B, Faye A et al. Upper gastrointestinal tract fistulae: endoscopic obliteration with fibrin sealant. Gastrointest Endosc 1996; 44(6): 731–733.
61. El Hajj II, Imperiale TF, Rex DK et al. Treatment of esophageal leaks, fistulae, and perforations with temporary stents: evaluation of efficacy, adverse events, and factors associated with successful outcomes. Gastrointest Endosc 2014; 79(4): 589–598. doi: 10.1016/j.gie.2013.08.039.
62. Krajc T, Janík M, Lučeni M et al. Možnosti a výsledky chirurgického riešenia benígnej tracheoezofageálnej fistuly. Rozhl Chir 2010; 89(8): 478–489.
63. Von Renteln D, Denzer UW, Schach-schal G et al. Endoscopic closure of GI fistulae by using an over-the-scope clip (with videos). Gastrointest Endosc 2010; 72(6): 1289–1296. doi: 10.1016/j.gie.2010.07.033.
64. Siersema PD. Treatment of esophageal perforations and anastomotic leaks: the endoscopist is stepping into the arena. Gastrointest Endosc 2005; 61(7): 897–900.
65. Janík M, Haruštiak S, Krajč T et al. Synd-roma Boerhaave. Slov Chirurg 2004; 8 : 16–20.
66. Tilanus HW, Bossuyt P, Schattenkerk ME et al. Treatment of oesophageal perforation: a multivariate analysis. Br J Surg 1991; 78(5): 582–585.
67. Janík M, Haruštiak S, Benej R et al. Výsledky liečby akútnej mediastinitídy v našom súbore pacientov. Studia Pneumol Phtiseol 2002; 62 : 41–45.
68. Janík M, Krajč T, Benej R et al. Aktuálne trendy v liečbe akútnej mediastinitídy. Slov Chirurg 2008; 5 : 4–8.
69. Almadi MA, Aljebreen AM, Bamihriz F. Resolution of an esophageal leak and posterior gastric wall necrosis with esophageal self-expandable metal stents. World J Gastroenterol 2013; 19(40): 6931–6933. doi: 10.3748/wjg.v19.i40.6931.
70. Schubert D, Scheidbach H, Kuhn R et al. Endoscopic treatment of thoracic esophageal anastomotic leaks by using silicone-covered, self-expanding polyester stents. Gastrointest Endosc 2005; 61(7): 891–896.
71. Kumar N, Thompson CC. Endoscopic management of complications after gastrointestinal weight loss surgery. Clin Gastroenterol Hepatol 2013; 11(4): 343–353. doi: 10.1016/j.cgh.2012.10.043.
72. Aurora AR, Khaitan L, Saber AA. Sleeve gastrectomy and the risk of leak: a systematic analysis of 4,888 patients. Surg Endosc 2012; 26(6): 1509–1515. doi: 10.1007/s00464-011-2085-3.
73. Zehetner J, Shamiyeh A, Wayand W et al. Results of a new method to stop acute bleeding from esophageal varices: implantation of a self-expanding stent. Surg Endosc 2008; 22(10): 2149–2152. doi: 10.1007/s00464-008-0009-7.
74. Wright G, Lewis H, Hogan B et al. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center. Gastrointest Endosc 2010; 71(1): 71–78. doi: 10.1016/j.gie.2009.07.028.
75. Hubmann R, Bodlaj G, Czompo M et al. The use of self-expanding metal stents to treat acute esophageal variceal bleeding. Endoscopy 2006; 38(9): 896–901.
76. Bruha R, Drastich P, Fejfar T et al. Guidelines on the diagnosis and treatment of bleeding into the digestive tract caused by portal hypertension. Gastroent Hepatol 2011; 65(3): 141–142.
77. Fejfar T, Šafka V, Jirkovský V et al. Danišův jícnový stent v terapii varikózního krvácení. Gastroent Hepatol 2013; 67(2): 98–103.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2014 Issue 5-
All articles in this issue
- Cílený screening kolorektálního karcinomu u diabetiků 2. typu a osob s vysokým kardiovaskulárním rizikem – první průběžné výsledky multicentrické prospektivní studie
- Transanal endoscopic microsurgery for rectal cancer at the 3rd Surgical Clinic of the 1st Faculty of Medicine, Charles University and the University Hospital in Motol in 2008–2013
- Nové pohledy na zařazení farmakoterapie do algoritmu léčby jaterních metastáz kolorektálního karcinomu
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Péče o IBD pacienty – klinická praxe v gastroenterologických ambulancích sekundárního typu v ČR
- Hyaluronát sodný: nová cesta v léčbě ulcerózní kolitidy?
- Gastrointestinální onkologie – prevence, diagnostika i léčba
- Zpráva o činnosti výboru České gastroenterologické společnosti za uplynulé volební období
- Vedomostná úroveň na Slovensku o obezite ako rizikovom faktore zhubných nádorov tráviaceho traktu i ďalších orgánov
- Screening kolorektálního karcinomu v ČR po zavedení adresného zvaní – dosavadní výsledky dle dostupných dat
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

