-
Medical journals
- Career
Sérové protilátky proti zymogenovému glykoproteinu 2 (anti-GP2) u nemocných s idiopatickými střevními záněty
Authors: K. Malíčková 1; D. Ďuricová 2; M. Bortlík 2; Luděk Hrdlička 2; N. Machková 2; M. Lukáš 1,2
Authors‘ workplace: Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze 1; Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE a 1. LF UK v Praze 2
Published in: Gastroent Hepatol 2013; 67(1): 10-16
Category: IDB: Original Article
Overview
Účel studie:
Cílem práce je studium výskytu a významu sérových protilátek proti zymogenovému glykoproteinu 2 (anti-GP2) u nemocných s idiopatickými střevními záněty (Inflammatory Bowel Disease, IBD).Metody:
Vyšetřili jsme 81 nemocných s diagnózou IBD – 66 pacientů s Crohnovou nemocí (CN) a 15 pacientů s ulcerózní kolitidou (UC), kontrolní skupinu 20 nemocných s neléčenou celiakií a 50 zdravých dárců krve. Všichni vyšetření pacienti s IBD byli léčeni infliximabem. Testování anti-GP2 IgG/IgA bylo provedeno ve vzorcích z nultého (W0) a desátého (W10) týdne léčby.Výsledky:
Pozitivita anti-GP2 alespoň v jednom izotypu byla nalezena u 52 % nemocných s CN, ale jen u 13 % pacientů s UC (p = 0,007). V obou kontrolních skupinách byl výskyt anti-GP2 zanedbatelný. Pacienti s CN dosahovali ve srovnání s UC signifikantně vyšších koncentrací anti-GP2 (p = 0,001 pro anti-GP2 IgG a W0 a p < 0,001 pro anti-GP2 IgA a W0). V průběhu deseti týdnů biologické léčby nedošlo u nemocných s IBD k signifikantním změnám koncentrací sledovaných autoprotilátek. Nebyla prokázána souvislost výskytu anti-GP2 IgG ani IgA s pohlavím, věkem, místem a typem postižení ani s aktivitou zánětlivého onemocnění střev. Jediná signifikantní souvislost byla nalezena u anti-GP2 IgA s formou postižení CN, kdy strikturující a fistulující forma byla spojena s častějším výskytem a vyššími titry anti-GP2 IgA.Závěry:
Anti-GP2 se vyskytují přibližně u poloviny pacientů s CN. Výskyt anti-GP2 nekoreluje s místem, formou ani typem postižení zažívacího ústrojí, nesouvisí s aktivitou nemoci a koncentrace autoprotilátek se v průběhu biologické terapie IBD zásadně nemění.Klíčová slova:
idiopatické střevní záněty – autoprotilátky – zymogenový glykoprotein 2 – biologická léčba
Imunopatogenetické mechanizmy vzniku idiopatických střevních zánětů (Inflammatory Bowel Disease, IBD) dosud nebyly přesně popsány, není však pochyb o tom, že tato skupina chorob má u geneticky predisponovaných jedinců souvislost s poškozením střevní slizniční bariéry vyvolané luminálními mikrobiálními antigeny. Významnou klinickou charakteristikou IBD je tvorba protilátek proti řadě autoantigenů, přičemž autoprotilátky se za jistých okolností nejspíše přímo účastní některých zánětlivých kaskád vedoucích ke vzniku a rozvoji IBD [1].
Od 80. let minulého století je známo, že přibližně 30–40 % nemocných s Crohnovou nemocí (CN) tvoří protilátky proti acinárním zevně sekretorickým buňkám pankreatu (protilátky proti exokrinnímu pankreatu, PAB) (obr. 1). U nemocných s ulcerózní kolitidou (UC) nebo jiným non-IBD postižením zažívacího ústrojí je výskyt PAB velmi vzácný [2–4].
Image 1. Protilátky proti exokrinnímu pankreatu, PAB. Nepřímá imunofluorescence, substrát: opičí pankreas (Euroimmun, SRN ). Mikroskop: Olympus BX51, objektiv UPlan FI 40×. Kapkovité extracelulární (luminální) útvary a granulární cytoplazmatická fluorescence v acinárních buňkách. <sup>©</sup>Ing. Miroslav Hinďoš, ÚLBLD VFN a 1. LF UK. Fig. 1. Antibodies against exocrine pancreas, PAB. Indirect immunoflorescence; substrate mankye´s pancreas; (Euroimmun, Germany): Droplike (luminal) formation and granular cytoplasmatic florescence in the acinar cells. (Ing Miroslav Hinďoš, ÚLBLD VFN a 1. LF UK). 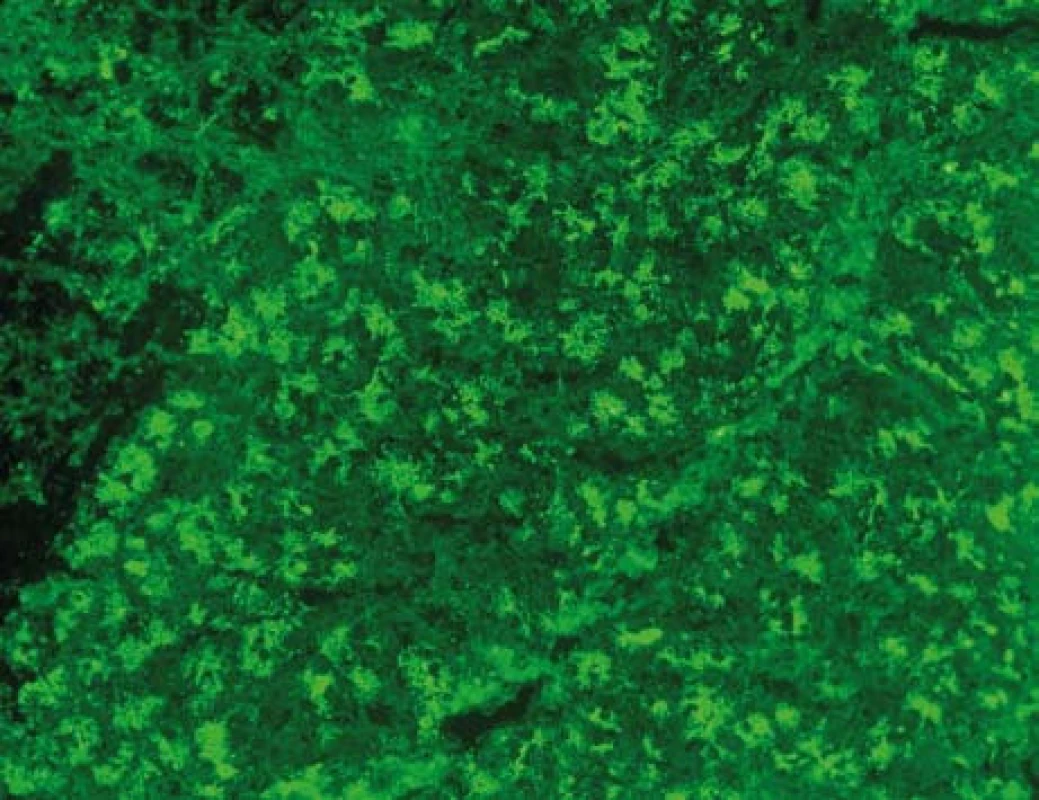
Hlavním cílovým antigenem PAB je pankreatický glykosylfosfoinositol (GPI) nazývaný též zymogenový glykoprotein 2 (GP2) [5]. Dříve se předpokládalo, že GP2 je exprimován výlučně na membránách pankreatických acinárních buněk [6]. Nedávné studie však prokázaly, že GP2 se hojně nachází na površích M-buněk, tj. epiteliálních buněk pokrývajících lymfocytární folikuly Peyerových plátů [7]. M-buňky patří k systému tzv. Follicle-Associated Epithelium (FAE) a ve slizničním epitelu zajišťují přenos luminálních antigenů k lymfocytům Peyerových plátů. M-buňky mají velké zastoupení v tenkém střevě (obzvlášť v ileu) a téměř chybějí ve sliznici tlustého střeva [8].
Jedna z hypotéz vysvětlujících chování GP2 proteinů na M-buňkách nemocných s IBD předpokládá indukci exprese GP2 následkem zánětlivých změn sliznice tenkého střeva [9]. Dosud však není známo, zda je tvorba autoprotilátek proti GP2 (anti-GP2) prostým epifenomenem tohoto slizničního zánětu anebo zda se anti-GP2 přímo účastní imunopatologických mechanizmů vzniku a rozvoje CN.
K dnešnímu dni bylo publikováno několik klinických studií zkoumajících úlohu anti-GP2 u pacientů s IBD. Studie se překvapivě shodují pouze v tom, že výskyt anti-GP2 je častější u nemocných s CN. Odlišné výsledky byly zaznamenány při hodnocení souvislostí pozitivity anti-GP2 s místem a formou postižení střeva jakož i pozitivity autoprotilátek s aktivitou IBD [5,9–13].
Cílem předkládané práce bylo ověření výskytu anti-GP2 u specifické skupiny nemocných s IBD, a to u pacientů indikovaných k biologické léčbě infliximabem, tedy u jedinců se středně či vysoce aktivní CN nebo UC, s fistulující a/nebo strikturující formou CN, s kortikodependentním průběhem CN/UC nebo s extraintestinálními projevy nemoci [14]. Zajímal nás výskyt a výše titrů sérových anti-GP2 IgG/IgA u nemocných s CN a jinými imunopatologickými nemocemi zažívacího ústrojí, vztah autoprotilátek k demografickým a klinickým charakteristikám IBD a vývoj koncentrací anti-GP2 IgG/IgA v průběhu biologické léčby.
Materiál a metodika
Pacienti
Vyšetřili jsme 81 nemocných s klinicky a biopticky verifikovanou diagnózou IBD. Základní demografické a klinické údaje o těchto pacientech uvádí tab. 1.
Table 1. Základní demografické a klinické údaje o vyšetřených pacientech s diagnózou IBD. Tab. 1. Basic demographic and clinical data concerning examined patients diagnosed with IBD. 
Léčba pacientů probíhala v letech 2010–2012 v Klinickém a výzkumném centru pro idiopatické střevní záněty ISCARE a 1. LF UK v Praze. Biologická terapie infliximabem se řídila doporučenými postupy Pracovní skupiny pro idiopatické střevní záněty České gastroenterologické společnosti JEP [15]. K laboratornímu vyšetření byly použity vzorky krve odebrané před podáním první dávky infliximabu (W0) a v desátém (W10) týdnu biologické léčby. Krev na vyšetření byla odebrána těsně před podáním biologického léčiva.
Kontrolní skupiny
Do studie byly zařazeny dvě kontrolní skupiny. První tvořili pacienti s biopticky verifikovanou celiakií před zahájením bezlepkové diety. Šlo o jedenáct mužů a devět žen s mediánem věku 28 let (věkové rozmezí 13–58 let). U všech byly prokázány pozitivní protilátky proti endomyziu v izotypu IgA a/nebo IgG (100 %) a s výjimkou jedné osoby též pozitivní protilátky proti tkáňové transglutamináze IgA a/nebo IgG (95 %).
Druhou kontrolní skupinu tvořilo 50 zdravých dárců krve, 35 mužů a 15 žen, s mediánem věku 35 let (rozmezí 21–48 let).
Laboratorní analýzy
Vzorky srážlivé krve byly centrifugovány rychlostí 1 000 g po dobu 10 min, séra byla rozpipetována do alikvot po 100 µl a zamražena na –75 °C v IBD bance. Před provedením analýz byly vzorky sér rozmraženy na ledu a následně vytemperovány na pokojovou teplotu.
Sérové protilátky proti GP2 byly detekovány metodou enzymové imunoanalýzy (ELISA) pomocí validovaných standardizovaných souprav Anti-GP2 IgG a Anti-GP2 IgA (Generic Assays, SRN). Koncentrace anti-GP2 je udávána v U/ml. Výrobcem je doporučeno refenční rozmezí normálních hodnot 0–15 U/ml. Anti-GP2 IgG/IgA byly vyšetřeny u pacientů s IBD i u obou kontrolních skupin.
U všech vyšetřených sér z IBD banky byl pro W0 znám výsledek vyšetření protilátek proti Saccharomyces cerevisiae (ASCA IgG a IgA) metodou ELISA a protilátek proti cytoplazmě neutrofilů (ANCA) metodou nepřímé imunofluorescence (NIF). Ve zkoumaných vzorcích sér pacientů s IBD z týdnů W0 a W10 byly navíc vyšetřeny antinukleární protilátky (ANAb) v izotypu IgG (NOVA Lite® ANA, INOVA, USA) a protilátky proti dvouvláknové DNA (anti-dsDNA) IgG (NOVA Lite® dsDNA Crithidia lucillae, INOVA, USA). V obou případech šlo o metodu NIF, výsledek je vydáván v kvalitativní formě, tj. negativní/slabě pozitivní/pozitivní.
Statistická analýza
Statistická analýza dat byla provedena pomocí softwaru STATISTICA CZ 10.0 (Statsoft, USA). Pro popis dat byla použita deskriptivní statistika, přičemž jako míry polohy spojitých proměnných jsou uváděny medián a interkvartilové rozmezí ({IQR}). S ohledem na charakter a rozsah souboru byly k analýzám použity neparametrické testy. Ke zhodnocení rozdílů hodnot mezi soubory byl použit Kruskal-Wallisův test a hladina významnosti p < 0,05. K analýze kvalitativních proměnných byl použit Pearsonův chí-kvadrát test a hladina významnosti p < 0,05.
Výsledky
1. Výskyt anti-GP2 IgG a/nebo IgA ve vyšetřovaných skupinách
Ve skupině pacientů s CN byl výskyt zvýšených až vysokých koncentrací anti-GP2 IgG/IgA signifikantně vyšší než u nemocných s diagnózou UC: anti-GP2 IgG byly pozitivní u 29 %, anti-GP2 IgA u 42 % a double-IgG/IgA u 12 % pacientů s CN. Pozitivita anti-GP2 alespoň v jednom izotypu byla nalezena u 52 % nemocných s CN, ale jen u 13 % pacientů s UC (p = 0,007). V kontrolní skupině pacientů s celiakií byla pouze u jednoho nemocného zaznamenána mírná elevace hladiny anti-GP2 IgA (5 %), v kontrolní skupině zdravých dárců krve vykázali dva jedinci slabou pozitivitu anti-GP2 IgG (4 %) (tab. 2, graf. 1).
Table 2. Výskyt anti-GP2 IgG a/nebo IgA ve vyšetřovaných skupinách. Tab. 2. Incidence of anti-GP2 IgG and/or IgA in examined cohorts. 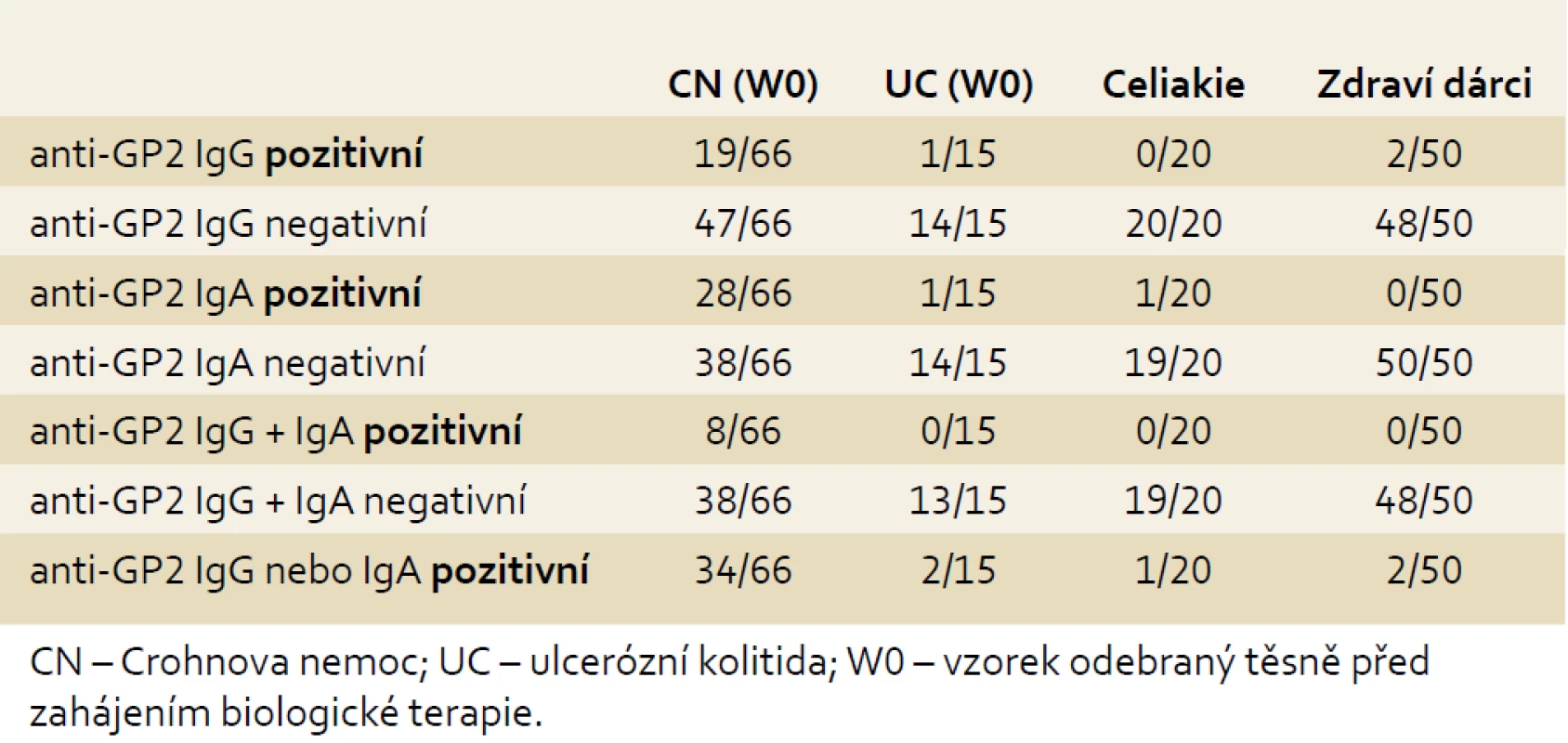
Graph 1. Anti-GP2 IgG a IgA v jednotlivých skupinách – podíl pozitivních nálezů. Graph 1. Anti-GP2 IgG and IgA in examined cohorts – proportion of positive findings. 
2. Absolutní hodnoty koncentrací anti-GP2 IgG a IgA ve sledovaných skupinách
Pacienti s CN dosahovali ve srovnání s UC signifikantně vyšších koncentrací anti-GP2 v obou izotypech (p = 0,001 pro anti-GP2 IgG a W0 a p < 0,001 pro anti-GP2 IgA a W0).
V průběhu deseti týdnů biologické léčby nedošlo u nemocných s IBD k signifikantním změnám koncentrací sledovaných autoprotilátek: u nemocných s CN p = 0,174 pro anti-GP2 IgG a p = 0,203 pro anti-GP2 IgA, u nemocných s UC p = 0,378 pro anti-GP2 IgG a p = 0,297 pro anti-GP2 IgA (tab. 3).
Table 3. Koncentrace anti-GP2 IgG a IgA ve vyšetřovaných skupinách. Tab. 3. Concentration of anti-GP2 IgG and IgA in examined cohorts. 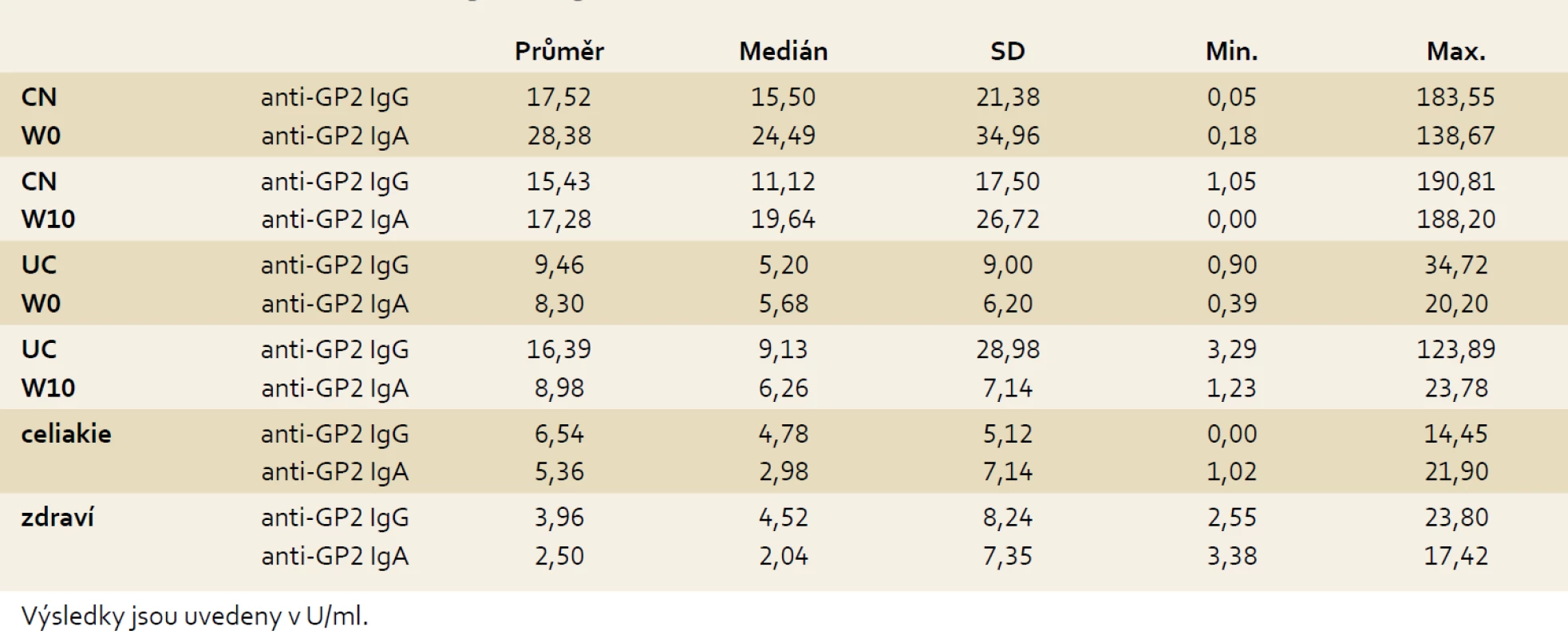
3. Senzitivita a specificita, pozitivní a negativní prediktivní hodnota vyšetření anti-GP2 IgG a IgA pro diagnózu CN
Z výše uvedených čísel vyplývá nízká senzivitita vyšetření anti-GP2 IgG i IgA pro diagnózu CN. Byla však nalezena významná specificita pro odlišení CN od diagnózy UC a vysoká pozitivní prediktivní hodnota (neboli pravděpodobnost, že případ je skutečně pozitivní, když ho test jako pozitivní vyhodnotil) (tab. 4).
Table 4. Senzitivita anti-GP2 IgG a IgA pro diagnózu CN , specificita ve vztahu CN k UC , pozitivní (PPV) a negativní (NPV) prediktivní hodnota. Tab. 4. Sensitivity of anti-GP2 IgG and IgA for CN diagnosis, specifity in relation to UC, positive (PPV) and negative (NPV) predictive values. 
4. Souvislost pozitivity anti-GP2 s vybranými klinickými a demografickými charakteristikami IBD
Nepodařilo se prokázat souvislost výskytu anti-GP2 IgG ani IgA s pohlavím, věkem, místem a typem postižení ani s aktivitou zánětlivého onemocnění střev. Jediná signifikantní souvislost byla nalezena u anti-GP2 IgA s formou postižení Crohnovou nemocí, kdy strikturující a fistulující forma CN (B2, 3, 2 + 3) byla spojena s častějším výskytem a vyššími titry anti-GP2 IgA (tab. 5).
Table 5. Vztah koncentrací anti-GP2 IgG/IgA k demografickým a klinickým charakteristikám souboru pacientů s IBD. Kruskal-Wallisův test shody mediánů. Tab. 5. Correlation of anti-GP2 IgG/IgA concentrations with demographic and clinical features of patients with IBD. Kruskal-Wallis test. 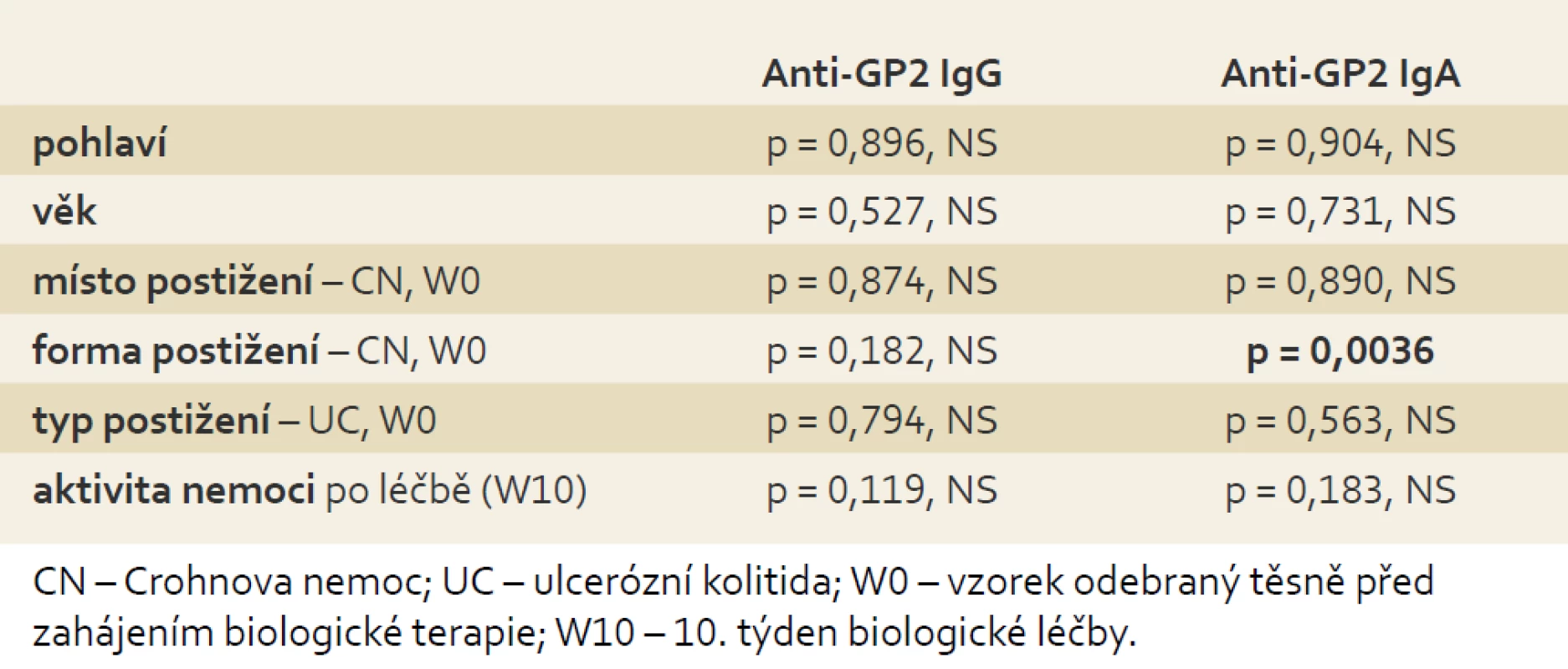
5. Anti-GP2 IgG a IgA a jiné autoprotilátky u nemocných s IBD
U 22 z celkového počtu 81 pacientů s IBD léčených infliximabem (27 %) byla ve vzorku z desátého týdne léčby (W10) nalezena pozitivita antinukleárních protilátek (ANAb), u 8 z těchto 22 ANAb-pozitivních vzorků byla prokázána též pozitivita anti-dsDNA protilátek (10 % z celkového počtu nemocných na biologické terapii). Souvislost výskytu anti-GP2 IgG či IgA s indukcí tvorby ANAb a anti-dsDNA se však neprokázala (p = 0,457 pro ANAb, p = 0,312 pro anti-dsDNA).
Anti-GP2 IgG/IgA tvořili jak ASCA-pozitivní, tak ASCA-negativní nemocní s CN (p = 0,572), obdobná čísla platí i pro ANCA-pozitivní a ANCA--negativní UC (p = 0,209).
Diskuze
Předložená práce je dle našich informací první studií výskytu anti-GP2 protilátek v populaci českých pacientů s IBD. Ve shodě s výsledky zahraničních výzkumů [9–13] potvrzuje výskyt anti-GP2 přibližně u poloviny pacientů s CN a zanedbatelný výskyt pozitivních nálezů u pacientů s UC a s jinými střevními imunopatologiemi, jakož i u zdravých jedinců. Na rozdíl od některých zahraničních studií však nepotvrzuje význam anti-GP2 jako biomarkeru pro místo, formu a typ postižení zažívacího ústrojí. Výsledky studie naznačují, že pozitivita anti-GP2 nesouvisí s aktivitou IBD a koncentrace autoprotilátek se v průběhu biologické terapie IBD zásadně nemění.
První informace o pankreatickém membránovém proteinu GP2 byly publikovány před více než 20 lety [16]. Krátce nato bylo zjištěno, že GP2 je jedním z autoantigenů, který je cílem autoprotilátek u nemocných s IBD [17], a protilátky proti exokrinnímu pankreatu se staly jedním z pomocných imunologických laboratorních vyšetření při diagnostice IBD.
Zájem o anti-GP2 byl opět probuzen díky výzkumu německých autorů v čele s Roggenbuckem. Důležitým milníkem při studiu významu GP2 a anti-GP2 v patofyziologii IBD bylo Roggenbuckovo zjištění, že GP2 je významně exprimován na M-buňkách sliznice tenkého střeva [5]. Jeho pracovní skupina dále prokázala, že výskyt sérových anti-GP2 detekovaných metodou enzymové imunoanalýzy přímo koreluje s nálezem protilátek proti exokrinnímu pankreatu prokazovaných metodou NIF [5] jakož i s výskytem ASCA (a to na hladině významnosti p = 0,03) [18]. Britští autoři publikovali před dvěma lety data o 30% senzitivitě a 95% specificitě vyšetření anti-GP2 pro diagnózu CN [9].
Poté se však objevily studie s poněkud odlišnými výstupy: Pavlidis et al vloni publikovali práci, ve které se jim nepodařilo prokázat významnou souvislost výskytu anti-GP2 s postižením pankreatu, na rozdíl od Roggenbucka nenašli ani korelaci mezi titry ASCA a anti-GP2 [10]. V této multicentrické studii výskytu anti-GP2 v populaci britských, řeckých a německých nemocných s IBD byly anti-GP2 signifikantně častěji přítomny u pacientů s extenzivním postižením CN a s postižením tenkého střeva (χ2 = 8,16; p < 0,01; OR 4,06) a signifikantně méně často u jedinců s penetrující formou CN (χ2 = 6,18; p = 0,02; OR 3,96).
Belgická studie Op De Beéck [13] sledovala anti-GP2 u 164 nemocných s CN, 118 nemocných s UC a u 75 jedinců s jiným non-IBD onemocněním střev. Kromě signifikantně častějšího výskytu anti-GP2 u CN ve srovnání s UC (p < 0,0003) nebyla nalezena korelace výskytu anti-GP2 s věkem, pohlavím, titry ASCA, místem ani formou postižení. U belgických pacientů se anti-GP2 častěji vyskytovaly pouze u pacientů s postižením horní části trávicího traktu (p = 0,042). Biologická léčba infliximabem či adalimumabem neměla signifikantní vliv na výskyt ani dynamiku změn titrů autoprotilátek.
Naše studie nevnáší do náhledu na klinický význam detekce anti-GP2 mnoho optimizmu. Námi zjištěná senzitivita vyšetření pro diagnózu CN 52 % je poněkud vyšší ve srovnání s výše zmíněnými studiemi (cca 30–40 %). Domníváme se, že důvodem je specifický výběr pacientů s IBD – všichni naši nemocní měli závažný průběh nemoci s komplikacemi a byli vyšetřováni v době těsně před zahájením biologické léčby, tj. v akutním stavu. Jedinou klinickou charakteristikou spjatou se zvýšeným výskytem anti-GP2 byla v našem souboru strikturující a fistulující forma CN. Výše zmíněná práce Op De Beéck [13] žádné rozdíly u jedinců s píštělemi a bez nich nenachází a Pavlidisova studie [10] uvádí u CN s píštělemi dokonce nižší výskyt anti-GP2. Tyto diskrepance lze vysvětlit pouze jediným způsobem: tvorba protilátek proti GP2 je indukována jiným, dosud neidentifikovaným mechanizmem či faktorem, který žádná z dosud provedených studií (včetně té naší) nezachytila a neprozkoumala.
Závěrem konstatujeme, že v současné době není vyšetření anti-GP2 IgG/IgA významným přínosem pro rutinní diagnostiku IBD ani pro sledování vývoje onemocnění či odpovídavosti na terapii. Indukce tvorby protilátek proti autoantigenům membrány M-buněk je však velmi zajímavým fenoménem a jeho možné konsekvence budou pro objasnění imunopatologických mechanizmů vzniku IBD nejspíše velmi překvapivé.
Práce byla podpořena grantem GAUK 69810 a Nadačním fondem IBD-Comfort.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 10. 1. 2013
Přijato: 19. 1. 2013
MUDr. Karin Malíčková
Klinická imunologie a alergologie – laboratoř
Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze
Karlovo nám. 32, 121 11 Praha 2
kmali@lf1.cuni.cz
Sources
1. Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. Lancet 2007; 369(9573): 1627–1640.
2. Stocker W, Otte M, Ulrich S et al. Autoimmunity to pancreatic juice in Crohn’s disease. Results of an autoantibody screening in patients with chronic inflammatory bowel disease. Scand J Gastroenterol 1987; 139 (Suppl): 41–52.
3. Klebl FH, Bataille F, Huy C et al. Association of antibodies to exocrine pancreas with subtypes of Crohn’s disease. Eur J Gastroenterol Hepatol 2005; 17(1): 73–77.
4. Desplat-J´ego S, Johanet C, Escande A et al. Update in Anti - Saccharomyces cerevisiae antibodies, anti-nuclear associated anti-neutrophil antibodies and antibodies to exocrine pancreas detected by indirect immunofluorescence as biomarkers in chronic inflammatory bowel diseases: results of a multicenter study. World J Gastroenterol 2007; 13(16): 2312–2318.
5. Roggenbuck D, Hausdorf G, Martinez-Gamboa L et al. Identification of GP2, the major zymogen granulemembrane glycoprotein, as the autoantigen of pancreatic antibodies in Crohn’s disease. Gut 2009; 58(12): 1620–1628.
6. Fukuoka SI, Freedman SD, Scheele GA. A single gene encodes membrane-bound and free forms of GP-2, the major glycoprotein in pancreatic secretory (zymogen) granule membranes. PNAS 1991; 88(7): 2898–2902.
7. Hase K, Kawano K, Nochi T et al. Uptake through glycoprotein 2 of FimH+ bacteria by M cells initiates mucosal immune response. Nature 2009; 462(7270): 226–230.
8. Kraehenbuhl JP, Neutra MR. Epithelial M cells: differentiation and function. Ann Rev Cell Dev Biol 2000; 16 : 301–332.
9. Bogdanos DP, Rigopoulou EI, Smyk DS et al. Diagnostic value, clinical utility and pathogenic significance of reactivity to the molecular targets of Crohn’s disease specific-pancreatic autoantibodies. Autoimm Rev 2011; 11(2): 143–148.
10. Pavlidis P, Romanidou O, Roggenbuck D et al. Ileal inflammation may trigger the development of GP2-specific pancreatic autoantibodies in patients with Crohn’s disease. Clin Dev Immunol 2012; 2012 : 640835.
11. Roggenbuck D, Humbel RL, Reinhold D et al. Glycoprotein 2 antibodies in inflammatory bowel disease – no association with disease phenotype? J Pediatr Gastroenterol Nutr 2012. [Epub ahead of print].
12. Bogdanos DP, Roggenbuck D, Reinhold D et al. Pancreatic-specific autoantibodies to glycoprotein 2 mirror disease location and behaviour in younger patients with Crohn’s disease. BMC Gastroenterol 2012, 6; 12 : 102.
13. Op De Beéck K, Vermeire S, Rutgeerts P et al. Antibodies to GP2, the major zymogen granule membrane glycoprotein, in inflammatory bowel diseases. Gut 2012; 61(1): 162–164
14. Zbořil V et al. Biologická terapie v léčbě idiopatických střevních zánětů. Praha: Mladá fronta 2012.
15. Lukáš M, Ďuricová D, Bortlík M et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů. Čes a Slov Gastroent a Hepatol 2008; 62(5): 285–291.
16. Rindler MJ, Hoops TC. The pancreatic membrane protein GP-2 localizes specifically to secretory granules and is shed into the pancreatic juice as a protein aggregate. Eur J Cell Biol 1990; 53(1): 154–163.
17. Bartoloni C, Guidi L, Pili R et al. Assay, isolation and characterization of circulating immune complexes from serum of gastrointestinal cancer, stage III and IV melanom and chronic inflammatory bowel disease patients. Oncology 1993; 50(1): 27–34.
18. Roggenbuck D, Reinhold D, Wex T et al. Autoantibodies to GP2, the major zymogen granule membrane glycoprotein, are new markers in Crohn’s disease. Clin Chim Acta 2011; 412(9–10): 718–724.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 1-
All articles in this issue
- Plány a představy redakční rady na rok 2013
- Za vším hledej peníze (... a nebo ženu)
- Sérové protilátky proti zymogenovému glykoproteinu 2 (anti-GP2) u nemocných s idiopatickými střevními záněty
- Hodnocení slizničního hojení v průběhu biologické léčby Crohnovy choroby tenkého střeva pomocí kapslové endoskopie: prospektivní observační studie
- Mesalazin u Crohnovy nemoci: obsolentní nebo neprávem opomíjená léčba?
- Současný pohled na léčbu perianálních píštělí u nemocných s Crohnovou chorobou
- Akutní krvácení do GIT a změny v lipidovém spektru – pilotní projekt
- Perforující gangrenózní cholecystitida
- Dysfunkce horní části trávicího traktu u kriticky nemocných: současný pohled a perspektiva
- 18FDG-PET/CT diagnostika adenokarcinomu pankreatu
- Stenty v liečbe zhubných nádorov kolorekta – prehľad a vlastné skúsenosti
- Metastáza maligního melanomu v bulbu duodena jako vzácná příčina obstrukce výtokového traktu žaludku
- Segmentálna portálna hypertenzia
- Gastrofórum – Pankreatofórum v januári 2013
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Segmentálna portálna hypertenzia
- Současný pohled na léčbu perianálních píštělí u nemocných s Crohnovou chorobou
- Perforující gangrenózní cholecystitida
- Dysfunkce horní části trávicího traktu u kriticky nemocných: současný pohled a perspektiva
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

