-
Medical journals
- Career
Graft vs host disease jako neobvyklá komplikace po transplantaci jater
Authors: L. Husová 1; V. Mejzlík 1; H. Jedličková 2; T. Ostřížek 1; M. Kuman 1; S. Štěpánková 1; V. Žampachová 3; P. Němec 1
Authors‘ workplace: Centrum kardiovaskulární a transplantační chirurgie, Brno 1; I. dermatovenerologická klinika LF MU a FN U sv. Anny v Brně 2; I. patologicko-anatomický ústav LF MU a FN u sv. Anny v Brně 3
Published in: Gastroent Hepatol 2012; 66(2): 109-115
Category: Hepatology: Case Report
Overview
V transplantačním centru v Brně bylo provedeno 417 ortotopických transplantací jater v období od 2. 2. 1983 do 1. 12. 2011. Graft vs host disease (GVHD) byla diagnostikována pouze v jednom případě (0,24 %). Autoři popisují případ 59leté ženy, u které byla transplantace jater provedena pro sekundární biliární cirhózu po iatrogenním poškození ductus choledochus při cholecystectomii. U pacientky se po transplantaci jater rozvinul kožní exantém provázený průjmy s následnou leukopenií a rozvojem septického šoku. Diagnóza GVHD byla ověřena kožní biopsií a podpořena stanovením přítomnosti podílu dárcovských buněk v periferní krvi příjemce (chimerizmus). V léčbě byly použity vysoké dávky glukokortikoidů, udržování co nejnižších účinných hladin tacrolimu, podání imunoglobulinů, anti-CD25 mAbs, symptomatická terapie (faktor stimulující granulocyty, antibiotika, antivirotika). I přes velmi komplikovaný průběh se pacientka subjektivně i objektivně zlepšila a příznaky GVHD postupně odezněly. Stav byl však provázen výraznou leukopenií s rozvojem septického stavu. Výše uvedená terapie vedla k postupné úpravě jak klinického stavu, tak laboratorních výsledků a možnosti propuštění po 77 dnech od transplantace. Po následujících 10 dnech však dochází k novému výskytu kožních projevů, které po navýšení glukokortikoidů a redukci dávky blokátorů kalcineurinu opět ustoupily. Tento stav již nebyl provázen leukopenií ani septickým stavem. Nemocná byla opětovně hospitalizována 252. den po transplantaci s rozvojem srdečního selhání s biopticky prokázanou virovou myokarditidou. Pacientka je nyní 10 měsíců po transplantaci jater bez klinických známek GVHD s dobrou funkcí jaterního štěpu.
Klíčová slova:
exantém – graft vs host disease – transplantace jaterGraft vs host disease (GVHD – reakce štěpu proti hostiteli) představuje jednu z hlavních komplikací po provedení alogenní transplantace krvetvorných buněk. GVHD provázející ortotopickou transplantaci jater (OLT) je však zcela nezvyklou komplikací, která je nesnadno diagnostikovatelná, velmi obtížně léčitelná a má vysokou mortalitu. Za vznik GVHD jsou odpovědny T-lymfocyty přítomné v transplantátu. GVHD se dělí na akutní, se vznikem do 100 dnů po transplantaci, a chronickou, která vzniká po více než 100 dnech od transplantace. Akutní forma GVHD (aGVHD) může přejít v chronickou. Obecně aGVHD může vést k poškození jater, kůže a trávicího traktu. Nejčastěji se projevuje průjmem, bolestmi břicha, nevolností, zvracením, hubnutím a horečkou. Chronická forma je charakterizována kožními projevy, keratokonjunktivitidou, vypadáváním vlasů, vzácně polymyozitidou či myokarditidou. Riziko vzniku GVHD souvisí s věkem pacienta. Pacienti starší 50 let mají nejvyšší riziko a pacienti mladší 20 let mají naopak minimální riziko vzniku GVHD. U věkové skupiny 20–50 let je toto riziko kolem 30 %. Poprvé byla aGVHD po OLT popsána v roce 1988 Burdickem u 51letého muže léčeného kombinací antithymocytárního globulinu (ATG) a vysokých dávek kortikosteroidů [1]. Incidence GVHD po OLT není zcela známá. Smith popsal výskyt GVHD u 13 pacientů z celkového počtu 1 082 (1,2 %) a Taylor u 7 pacientů z celkového počtu 453 (1,5 %) [2,3]. Další publikovaná retrospektivní analýza 1 815 pacientů po OLT udává vznik GVHD u pěti pacientů (0,28 %) [4]. United Network for Organ Sharing (UNOS) udává incidenci mnohem nižší, mezi lety 1995 a 2002 to bylo pouze 0,1 %. Z toho se lze domnívat, že mnohé příznaky GVHD jsou označeny jako alergická reakce na léky, infekce atd. [3]. Klinické projevy aGVHD po OLT obvykle vznikají mezi 1. a 8. týdnem po transplantaci. Jak u dětí, tak u dospělých se obvykle prezentují teplotou a kožní vyrážkou. Asi u 15 % publikovaných případů zůstávají přítomny jen kožní příznaky, ale většina probíhá jako multisystémové onemocnění postihující kůži, gastrointestinální trakt a krvetvorbu. Kožní projevy se vyskytují především na dlaních a ploskách nohy. V úvodu začínají jako makulopapulózní exantém s možnou progresí, při které dochází k tvorbě bul a deskvamaci epitelu. Postižení gastrointestinálního traktu se projevuje především průjmem s následným snížením absorbce v důsledku lymfocytární infiltrace sliznice a destrukce mukózy sliznice. U pacientů po transplantaci kostní dřeně je časté postižení biliárního epitelu s následným poškozením jaterní funkce. Po transplantaci jater k tomu nedochází, protože příjemcova játra byla odstraněna a imunokompetentní buňky dárce zodpovědné za vznik GVHD nevedou k postižení dárcovských jater. Častým projevem aGVHD jsou neutropenie a trombocytopenie, které vznikají po iniciálních projevech a vedou často k infekci či krvácivým projevům [3,4]. Léčba aGVHD po OLT je empirická, vycházející ze zkušeností s léčbou GVHD po transplantaci kostní dřeně a z kazuistických případů popisujících léčbu GVHD po OLT. Kortikosteroidy jsou první linií volby léčby aGVHD jak pro transplantaci kostní dřeně, tak OLT [3,5].
Popis případu
K transplantaci jater byla indikována 59letá žena se sekundární jaterní cirhózou po iatrogenním poranění ductus choledochus při cholecystectomii v květnu 2000. Následně byla provedena hepatikojejunoanastomóza, ve které byla v březnu 2003 diagnostikována stenóza vedoucí k cholestáze a dilataci intrahepatálních žlučových cest. Proto byla provedena papilosfinkteromie a extrakce tří kamenů z pahýlu choledochu cestou endoskopické retrográdní cholangiopankreatikografie (ERCP). Stav byl komplikován opakovanými cholangoitidami. V anamnéze je významná subtotální tyreoidektomie pro cysty (1997) s následnou substituční terapií. Od roku 2008 je nemocná léčena pro osteoporózu (vitamin D3, kalcium, bifosfonát). V dubnu 2008 byla pacientka zařazena na čekací listinu k OLT a rekonstrukci žlučových cest. Transplantace jater a choledochojejunoanastomóza Roux kličkou byla provedena v březnu 2011. V anhepatální fázi OLT byl podán basiliximab. Po transplantaci byla zavedena imunosupresivní terapie v kombinaci glukokortikoidy, tacrolimus a mycofenolát mofetil. Od 4. pooperačního dne došlo k rozvoji těžké periferní parézy s omezením dorzální i plantární flexe levé dolní končetiny a frustnímu oslabení levé horní končetiny pravděpodobně jako důsledek neurotoxicity tacrolimu, ale příčina lateralizace nebyla zcela jasná. Provedená výpočetní tomografie (CT) mozku i ultrazvuk magistrálních tepen neprokázaly patologický nález. Pro předpokládanou neurotoxicitu tacrolimu byla pacientka 21. den po transplantaci převedena z tacrolimu na cyklosporin v kombinaci se sirolimem. Magnetická rezonance (MRI) mozku neprokázala patologický nález, MRI krční páteře ukázala jen zcela minimální imprese na přední subarachnoidální prostor v segmentu C4–C5, který byl lehce redukován. Segment C4–C5 byl s incipientní osteochondrózou, s náznakem ventropozice těla C4 a drobnou protruzí meziobratlového disku. Po 10 dnech došlo k postupné úplné úpravě parézy levostranných končetin. Ve 14. potransplantačním dnu se objevil průjem. Stolice byla bakteriologicky negativní, rovněž toxin Clostridium difficile nebyl ve stolici prokázán. Provedená sigmoideoskopie byla bez slizničních změn, histologie bez průkazu GVHD a cytomegalovirové infekce. Při symptomatické terapii průjem po týdnu ustal. Patnáctý den od transplantace se objevil lichenoidní exantém lokalizovaný na břiše. Postupně se kožní postižení rozšířilo na celé tělo, s maximem postižení trupu, horních a dolních končetin. Původně drobnopapulózní exantém se rozvinul do generalizovaného multiformního exantému s erozemi dutiny ústní a epidermolýzou na dlaních, ploskách a v místech tlaku (obr. 1–4). Provedená kožní biopsie potvrdila diagnózu GVHD, grade II (nepravidelné úseky inflamatorní léze s lichenoidními rysy, hydropickou degenerací bazálních keratinocytů až naznačenou spongiózou, cytoidními tělísky, ojediněle i dyskeratózou, superficiálně úsekem hyperkeratózy i mírné parakeratózy. Ložiskové regresivní změny vaziva horní dermis, nepravidelný smíšený infiltrát s převahou neutrofilů a lymfocytů, přítomna ložisková exocytóza. Kapiláry s ložiskovou leukostázou, mírnou aktivací endotelií (obr. 5). U pacientky byla vyšetřena přítomnost dárcovských lymfocytů v periferní krvi, vzorek po transplantaci obsahoval 4 % alogenních buněk. Po zlepšení stavu bylo provedeno kontrolní vyšetření, kdy podíl dárcovských buněk poklesl na 0,1–0,2 %. Byla provedena změna imunosupresivní terapie (28. den po transplantaci), navýšeny dávky glukokortikoidů (methylprednisolon 125 mg/24 hod) a vysazen cyklosporin a sirolimus. I při této terapii se objevily subfebrilie, progredoval kožní nález s výsevem purpury na dolních končetinách a zhoršení projevů v dutině ústní. Exantém souvisle postihoval 90 % povrchu těla s erozemi na 10 % povrchu. V terapii byl přidán lidský imunoglobulin (25 g/24 hod po dobu 5 dnů) a navýšena glukokortikoidní terapie (methylprednisolon 500 mg/24 hod). Lokální ošetření kůže spočívalo v dezinfekčních obkladech, aplikaci lokálních kortikosteroidů III. a IV. třídy 2× denně a emolientií 2× denně. Eroze byly ošetřovány lokálními antibiotiky a neadhezivním krytím. Eroze v dutině ústní byly léčeny antiseptickými výplachy a antimykotiky.
Image 1. Generalizovaný multiformní exantému trupu. Fig. 1. Generalized multiform exanthem of the trunk. 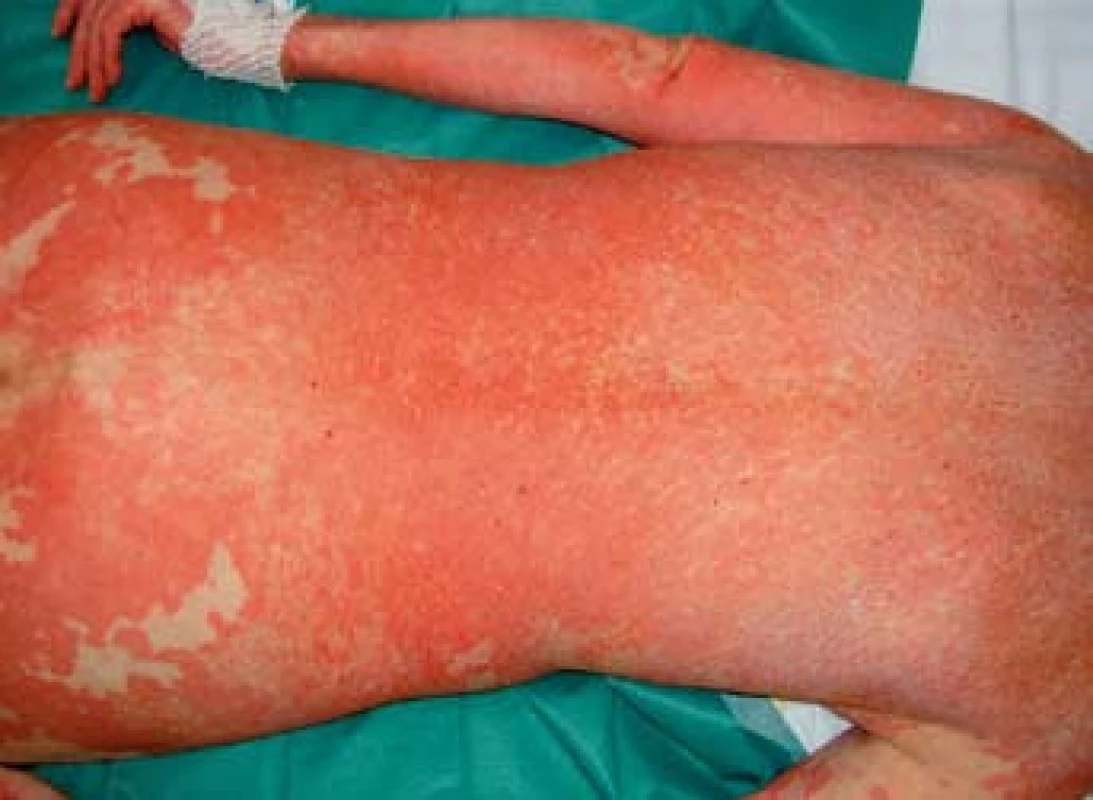
Image 2. Generalizovaný exantém na dolních končetinách. Fig. 2. Generalized exanthem in the lower limbs. 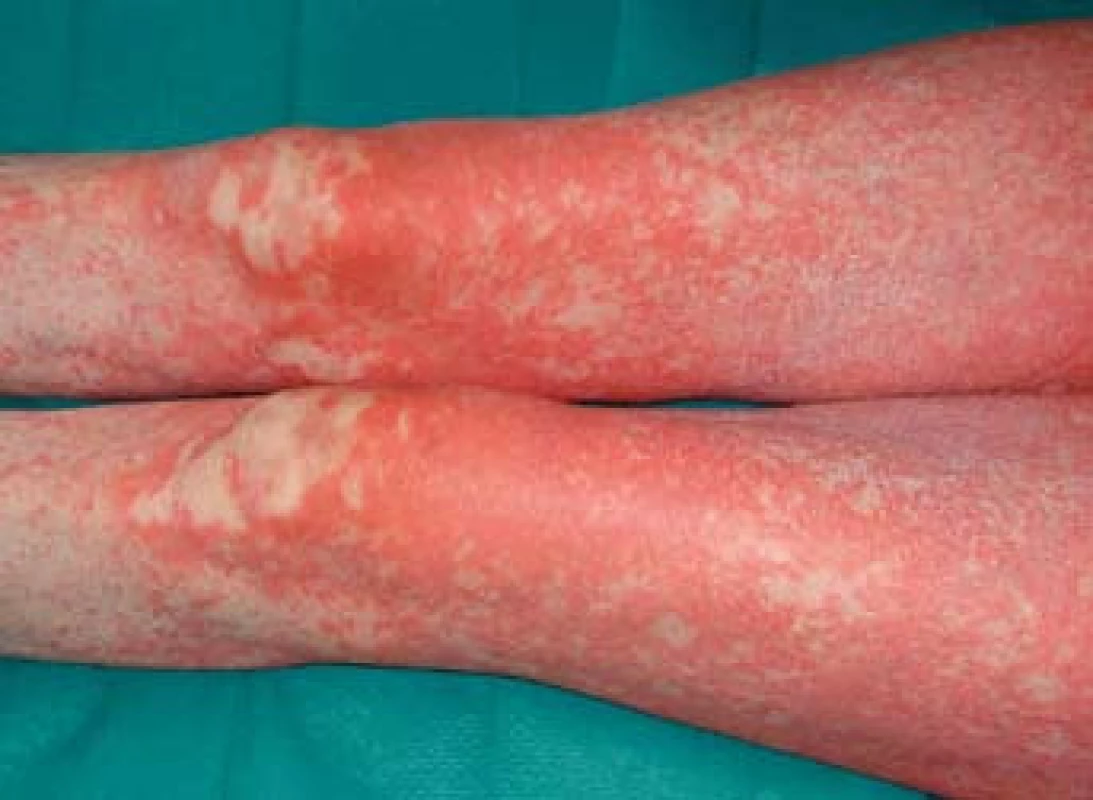
Image 3. Mokvající eroze na dlaních. Fig. 3. Peeling exanthem on the palms. 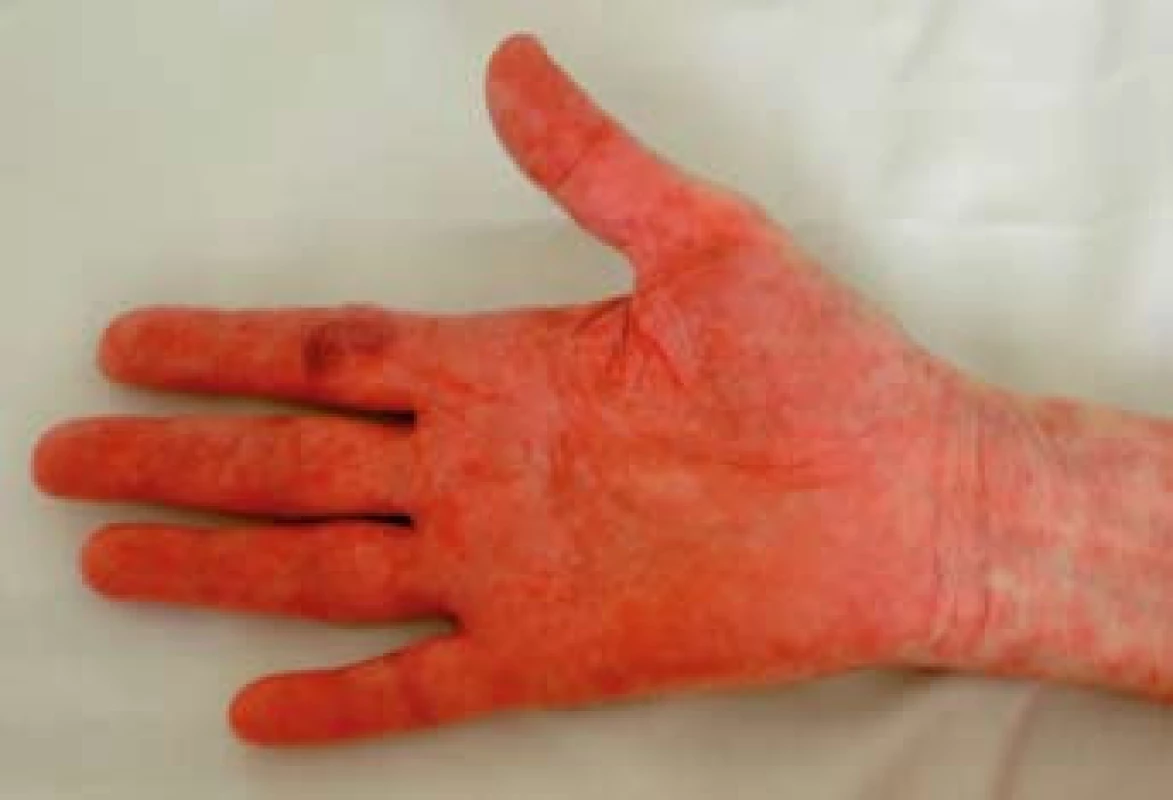
Image 4. Olupující se exantém na dlaních. Fig. 4. Peeling exanthem on the palms. 
Image 5. Inflamatorní lichenoidní léze s bazální spongiózou a disperzní apoptózou keratinocytů (označeny šipkou), dermální smíšený reaktivní infiltrát-bioptický vzorek kůže (HE, zvětšení 200×). Fig. 5. Inflammatory lichenoid lesions with basal spongiosis and dispersed apoptosis of keratinocytes (marked by arrow), dermal mixed reactive infiltrate – bioptic skin sample (HE, magnification of 200×). 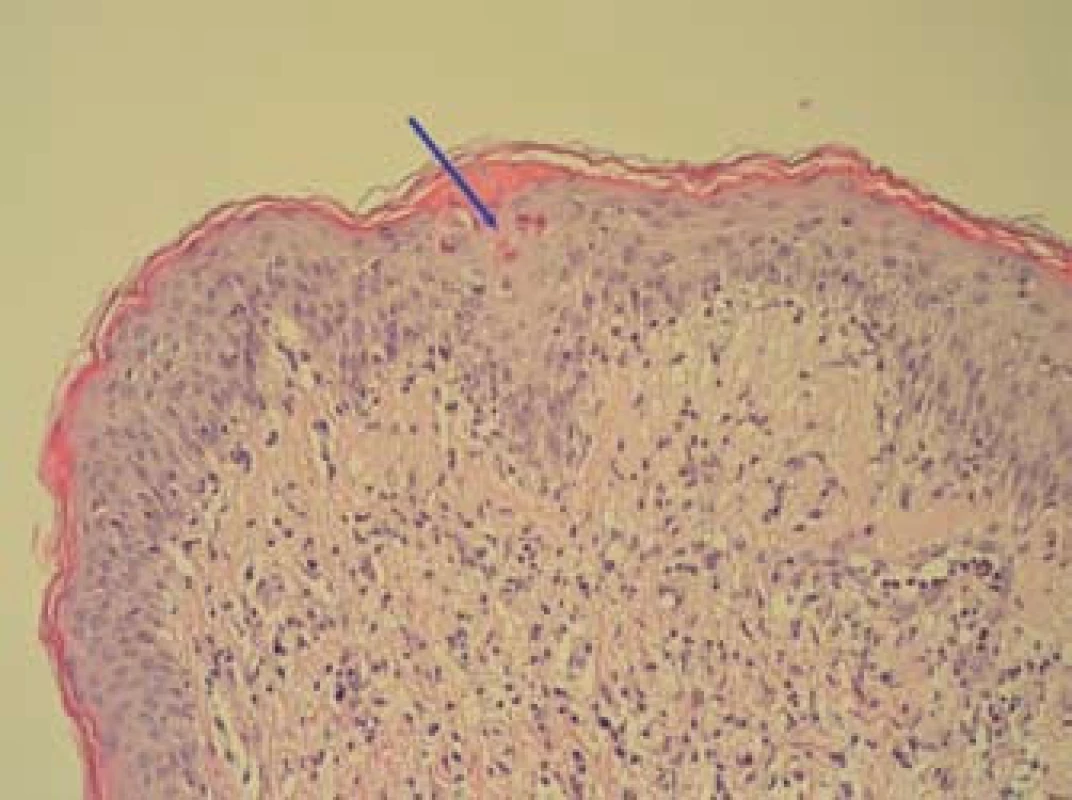
Od 41. dne po transplantaci došlo k mírnému vzestupu aktivity asparátaminotrasferázy (AST) 0,29…0,65 µkat/l, alaninaminotrasferázy (ALT) 0,29……0,65 µkat/l a gama-glutamyltransferázy (GGT) 0,58…0,7 µkat/l. Aktivita alkalické fosfatázy (ALP) byla normální 0,76…0,76 µkat/l, stejně jako sérová hladina bilirubinu 4,6…6,3 µmol/l. Byla prokázána aktivní cytomegalovirová infekce, a proto byla zahájena terapie ganciclovirem intravenózně (500 mg po 12 hod). V té době byl podán basiliximab (20 mg) ve snaze ovlivnit GVHD a faktor stimulující granulocyty se snahou o zvládnutí infekčních komplikací. Pro progredující vzestup aktivity AST (0,80 µkat/l), ALT (2,18 µkat/l), GGT (1,28 µkat/l), při suspektní akutní rejekci bylo opět přistoupeno k terapii tacrolimem v kombinaci s glukokortikoidy. Pro postupně progredující anémii a trombocytopenii (erytrocyty 3,67…3,36 × 1012/l, leukocyty 7,7……3,0 × 109/l, hemoglobin 107…90 g/l, hematokrit 0.31…0.29, trombocyty 297…23 × 109/l) byly redukovány dávky gancicloviru na polovinu. Od 46. dne od transplantace došlo k rozvoji febrilií (38–39 °C), hypotenzi s nutností podávání vazopresorů. Stav si vyžádal zavedení antibiotické a antimykotické terapie (meropenem, gentamicin, rifaximin, fluconazol). Poprvé se v laboratorním vyšetření objevil vzestup C-reaktivního proteinu (CRP) – 26,2 g/l. Stav přes intenzivní terapii nadále progredoval a respirační insuficience si vyžádala umělou plicní ventilaci. Opakovanými stěry na bakteriologické vyšetření byla na kůži identifikována Pseudomonas aeruginosa, Klebsiella spp., Klebsiella pneumonie, Staphylococcus koaguláza negativní, Candida albicans, z hemokultur byla vypěstována Klebsiella spp., Pseudomonas aeruginas, z centrálního venózního katétru Pseudomonas aeruginosa, Klebsiella pneumonie, ve výtěru z krku byla prokázána Candida albicans. Terapie antibiotiky pokračovala, byla prokázána dobrá citlivost na výše uvedená mikrobiální agens. Pro suspekci na pseudomembranózní kolitidu byla provedena výměna rifaximinu za metronidazol intravenózně v kombinaci s vankomycinem perorálně. Klostridiová kolitida však nebyla průkazem toxinu ve stolici potvrzena. Postupné zlepšení klinického stavu dovolilo odpojení z umělé ventilace, pacientka byla po šesti dnech extubována (52. den od transplantace). Pro anémii byla opakovaně podána deleukotizovaná erytrocytární masa a pro neutropenii rovněž opakovaně faktor stimulující granulocyty. Při konzervativní léčbě a lokální dermatologické terapii došlo k postupnému zlepšování kožního nálezu. Antibiotická terapie byla ponechána 14 dní a ganciclovir po dobu 2 měsíců. Do domácího ošetření byla nemocná propuštěna 77. potransplantační den. V terapii byla ponechána imunosuprese tacrolimem v kombinaci s glukokortikoidy. 87. potransplantační den však dochází k opětovnému výsevu exantému na obličeji a dolních končetinách, a proto byla pacientka opět přijata k hospitalizaci. Při přijetí byla pacientka afebrilní, astenického vzhledu 45 kg/164 cm. Na kůži byl patrný generalizovaný drobně morbiliformní exantém postihující trup i končetiny. Exantém vynechával lýtka a několik ostře ohraničených ploch na kolenou a přední straně hrudníku, v obličeji byla patrná fotosložka. Byl opětovně vyšetřen chimerizmus a došlo k nárůstu dárcovských buněk na 1 % z 0,1–0,2 %. Terapeuticky byly navýšeny glukokortikoidy a sníženy dávky tacrolimu. Při lokální terapii a minimální imunosupresi se postupně zlepšil kožní nález, stav již nebyl provázen leukopenií, trombocytopenií ani infekčními komplikacemi a pacientka byla 110. den po transplantaci znovu propuštěna do domácího ošetření. V době propuštění byla pacientka bez kožních výsevů s dobrou funkcí graftu a bez patologických laboratorních nálezů (bilirubin 6,4 µmol/l, AST 0,25 µkat/l, ALT 0,51 µkat/l, GGT 0,76 µkat/l, ALP 0,69 µkat/l, erytrocyty 4,06 × 1012/l, leukocyty 9,1 × 109/l, hemoglobin 125 g/l, hematokrit 0,38, trombocyty 201 × 109/l). Pro akutní srdeční selhání byla nemocná znovu přijata k hospitalizaci 252. den po transplantaci jater. Na echokardiografii srdce byla zjištěna nedilatovaná levá komora (LK), těžká globální hypokontraktilita, ejekční frakce levé komory 22 %, výrazně snížený srdeční výdej, těžká diastolická dysfunkce, mírná dilatace levé síně, normální pravostranné oddíly, stopa aortální regurgitace, sekundární mitrální regurgitace – středně významná, stopa trikuspidální regurgitace, bez známek plicní hypertenze, minimální perikardiální výpotek, pleurální výpotky oboustranně – více vlevo. Byla provedena biopsie myokardu s nálezem: rozvlákněné vzorky myokardu s fokální inflamatorní lézí, splňující kvantitativní kritéria pro bordeline myokarditidu dle Dallaské klasifikace. Nebyly zachyceny zcela jednoznačné akutní regresivní změny kardiomyocytů, vzhledem k fokálnímu charakteru léze je nebylo možné vyloučit. Etiologicky nelze z histologického obrazu rozlišit mezi GVHD či myokarditidou jiného původu (obr. 6,7). V bioptickém vzorku myokardu byl polymerázovou řetězovou reakcí (PCR) prokázán lidský herpetický virus 6 (HHV 6) – výše viremie byla 809 kopií/µg. Nemocná byla od přijetí léčena symptomaticky a po průkazu HHV 6 v biopsii myokardu byla zahájena léčba ganciclovirem (5 mg/kg po 12 hod intravenózně). Postupně došlo ke zlepšení objektivního nálezu i ústupu subjektivních obtíží pacientky. Po deseti měsících od transplantace jater je pacientka bez subjektivních potíží s dobrou funkcí jaterního štěpu a bez projevů GVHD. V echokardiografickém nálezu však trvá deprese funkce levé komory, ejekční frakce do 30 %, bez významné chlopenní vady, stále je přítomen perikardiální výpotek s maximem za pravou komorou do 6 mm.
Image 6. Bioptický vzorek myokardu (zvětšení 200×) s imunohistochemickým průkazem patologického (nadhraničního) infiltrátu LCA (Leukocyte Common Antigen) + leukocytů (označeny šipkou) v intersticiu. Fig. 6. Bioptic sample of the myocardium (magnification of 200×) with immunohistochemical manifestation of the pathological (above-limit) infiltrate LCA (Leukocyte Common Antigen) + of leukocytes (marked by arrow) in the interstitium. 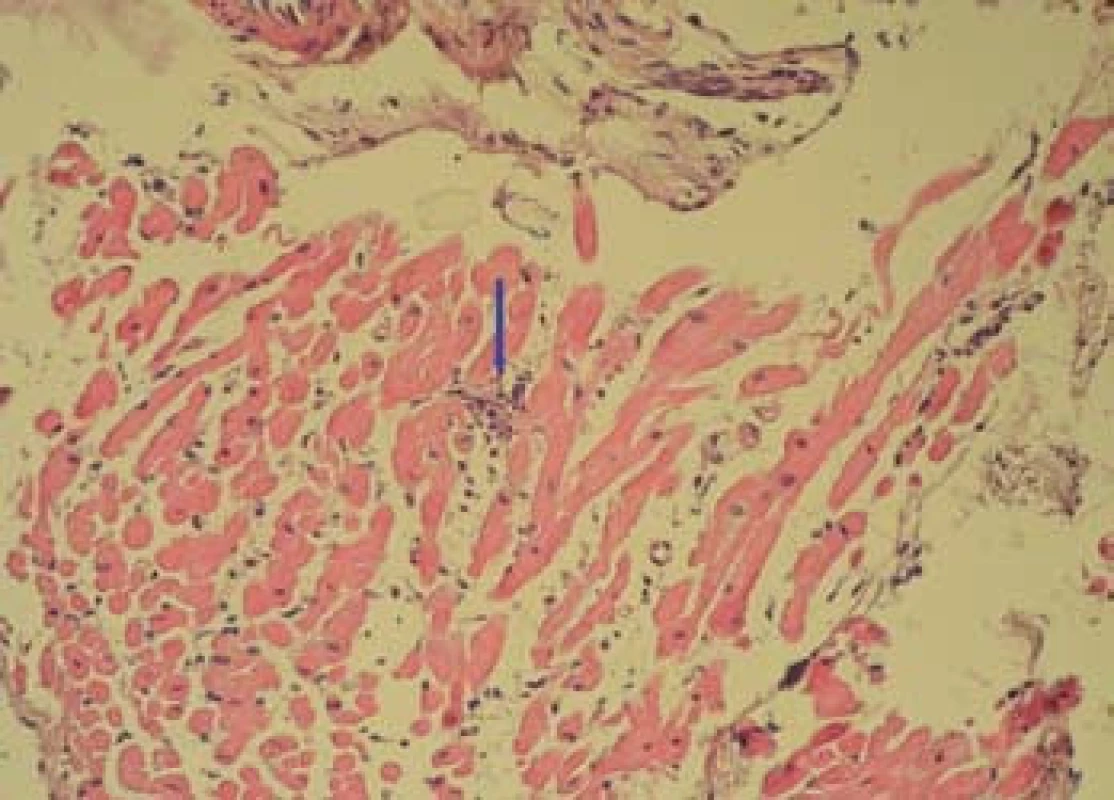
Image 7. Bioptický vzorek myokardu (HE, zvětšení 200×) s ložiskem intersticiální inflamatorní reakce, těsně navazující na kardiomyocyty (označeno šipkou). Fig. 7. Bioptic sample of the myocardium (magnification of 200×) with the nidus of interstitial inflammatory response, closely following cardiomyocytes (marked by arrow). 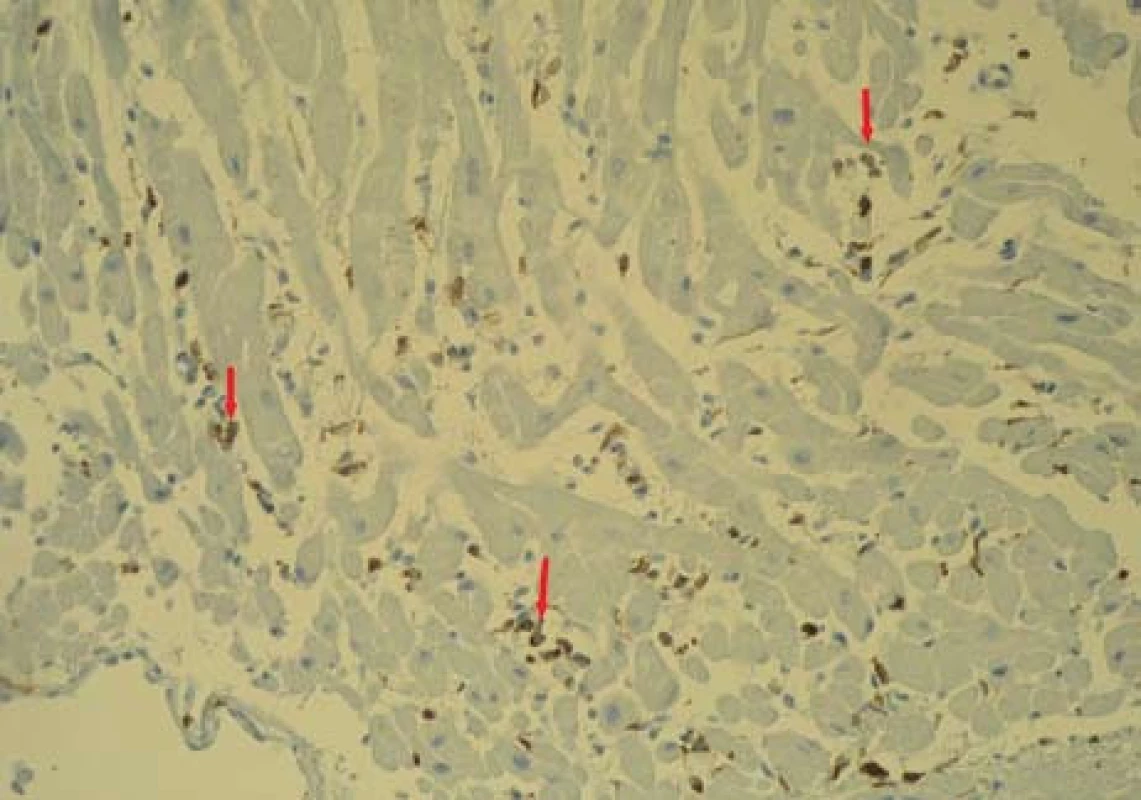
Diskuze
Úmrtnost na GVHD po OLT je velmi vysoká, dle publikovaných prací ze dvou větších center je přibližně 85 % [2,3]. Obecně lepší prognózu mají pacienti pouze s kožními projevy oproti pacientům s multisystémovými projevy GVHD. Ze 44 pacientů s multisystémovými projevy GVHD přežilo pouze 6 (14 %). Špatnou prognózu a vysokou úmrtnost (97 %) mají pacienti s febrilním stavem jako projevem GVHD [4]. Vysoká úmrtnost na GVHD po OLT je srovnatelná jako u pacientů s těžkým multisystémovým GVHD po alogenní transplantaci kostní dřeně [4,7]. Jediné dva rizikové faktory, které byly jasně určeny pro vznik GVHD po OLT, jsou HLA shoda mezi dárcem a příjemcem a věk příjemce [4]. Tato situace se odráží u živých dárců jater, kdy příjemce obdrží HLA homozygotní játra od jednoho z rodičů a je spojena s mimořádně vysokým rizikem vzniku aGVHD [7,8,11]. V retrospektivní analýze více než tisíce pacientů, kteří podstoupili OLT v jednom centru, Smith et al identifikovali HLA shodu za významný rizikový faktor u 12 pacientů, u kterých se vyvinul GVHD, a dospěli k závěru, že čím větší je neshoda HLA I. třídy, tím menší je pravděpodobnost vzniku GVHD [2]. I u naší nemocné byla identifikována HLA s dárcem (A 1, B 8, DRB 3). Koller et al retrospektivně zhodnotili 1 815 pacientů po transplantaci jater za předchozích 17 let. U pěti pacientů (0,28 %) byl histologicky diagnostikován GVHD. První příznaky vznikly mezi 20. a 60. dnem od transplantace. U čtyř pacientů jako první příznak vznikla kožní vyrážka a u jednoho pacienta bolesti kloubů. Všech pět pacientů zemřelo buď na nekontrolovatelné krvácení, nebo infekci [4]. Podle analýzy Smitha et al mají příjemci nad 65 let devětkrát vyšší riziko vzniku GVHD než mladší 65 let. Rovněž vyšší riziko vzniku GVHD je u dárců mladších 40 let [2]. Diagnostika GVHD je velmi obtížná a je omezena nedostatkem specifických a senzitivních vyšetření. Kožní biopsie s nálezem epidermální dyskeratózy, nekrózy epiteliálních buněk, velmi podporuje tuto diagnózu společně s klinickými příznaky. V diferenciální diagnóze je nutno uvažovat o vzácné, ale přece jen častěji se vyskytující toxické epidermální nekrolýze (TEN) vyvolané léky. Kvůli této možnosti byla zaměněna u naší pacientky antibiotika i další léky. Průběh onemocnění s recidivami exantému s klesající intenzitou pak ale jednoznačně korespondoval s GVHD. Pro diagnostiku je možné využít stanovení přítomnosti podílu dárcovských buněk v periferní krvi příjemce (chimerizmus). Chimerizmus je užitečná diagnostická pomůcka pro pacienty s příznaky GVHD. Ale je nutné si uvědomit, že chimerizmus se objeví přechodně u většiny pacientů v časném potransplantačním období. Dvě retrospektivní studie s 11 a 16 pacienty popisují přítomnost dárcovských lymfocytů v oběhu s vrcholem v prvním týdnu po transplantaci, kdy tvoří až 24 % lymfocytů periferní krve, a k poklesu dochází za 3–4 týdny po transplantaci [9,10]. Léčba aGVHD po OLT není známá, nicméně vodítkem k léčbě mohou být zkušenosti s léčbou aGVHD po transplantaci kostní dřeně. První linií léčby aGVHD po OLT jsou jednoznačně glukokortikoidy [3,12]. Podle zkušeností s léčbou aGVHD po transplantaci kostní dřeně vedou glukokortikoidy asi v polovině případů k dlouhodobé remisi [13–15]. Bohužel je však GVHD po OLT méně citlivý na kortikosteroidy než GVHD po transplantaci kostní dřeně [3]. Dalším lékem volby jsou protilátkové preparáty a antithymocytární globulin (ALG). Nejsou však dosud žádné důkazy, že tyto látky ovlivní průběh a přežití pacientů s aGVHD [1,12,16,17]. Další léčebnou metodou jsou monoklonální protilátky (mAbs) proti CD 25 (basiliximab, daclizumab), který se užívá v léčbě GVHD jak po transplantaci kostní dřeně, tak OLT [9,18,19–21]. Úspěšnost této léčby u GVHD po transplantaci kostní dřeně je popisována u kortikorezistentních pacientů ve 40–50 %, ale je zde vyšší riziko vzniku infekčních komplikací [19–21]. Nejasná role je v použití infliximabu, anti-TNF mAb, u léčby GVHD po OLT. Infliximab byl užit v léčbě GVHD po transplantaci kostní dřeně s rozporuplnými výsledky. U čtyř pacientů po transplantaci kostní dřeně s GVHD vedl k úplnému vymizení gastrointestinálních příznaků a výraznému zlepšení kožních a jaterních příznaků [22]. U dalších 11 pacientů, kdy byl v léčbě GVHD po transplantaci kostní dřeně podán infliximab, byly výsledky nepřesvědčivé – přežili pouze dva nemocní (18 %) [23]. V léčbě GVHD po OLT se doporučuje snížení nebo dokonce zrušení imunosupresivní terapie, a to proto, že může příjemci dovolit odmítnout dárcovské lymfocyty efektivněji. Snížení imunosuprese však může vést k odhojení štěpu. Dárcovské T-buňky mohou vést ke zhoršení GVHD [24]. V terapii je jistě důležitá prevence a léčba infekčních komplikací, neboť u většiny GVHD po OLT dochází ke vzniku pancytopenie. K diskuzi je rovněž užití růstových faktorů při neutropenii u GVHD k restituci neutrofilů [2]. V experimentu probíhají na zvířecích modelech studie s užitím antagonistů lipopolysacharidázy, interleukinu 12 v léčbě GVHD, ne však se zcela přesvědčivými výsledky [25,26].
Závěr
Graft vs host disease představuje jednu z hlavních komplikací po provedení alogenní transplantace krvetvorných buněk. GVHD provázející OLT je však zcela nezvyklá komplikace, která je provázena vysokou mortalitou, nesnadnou diagnostikou a velmi obtížným terapeutickým ovlivněním. Incidence není zcela známá a je udávána od 0,1–1,5 % (v našem souboru 1/417 = 0,24 %) [2–4]. Vzhledem k nesnadné diagnostice pravděpodobně bude incidence i po OLT vyšší, neboť část těchto nemocných uniká pod jinou diagnózou, např. alergický exantém, léková intolerance, infekce atd. Vzhledem k vysoké mortalitě (84–97 %) je nutné myslet na tuto diagnózu i u pacientů po orgánových transplantacích a úpravou terapie se snažit o ovlivnění průběhu onemocnění [2,3,7]. Potvrzení GVHD by mělo být okamžitě léčeno glukokortikoidy a ke zvážení je terapie anti-CD 25 mAbs společně s chemoprofylaxí [6]. Případ naší pacientky demonstruje velmi těžký a komplikovaný průběh aGVHD. V léčbě byly použity vysoké dávky glukokortikoidů, udržování co nejnižších hladin tacrolimu, podání imunoglobulinů, anti-CD 25 mAbs, symptomatická terapie (faktor stimulující granulocyty, antibiotika, antivirotika) a intenzivní lokální terapie. I přes velmi komplikovaný průběh se pacientka subjektivně i objektivně zlepšila a příznaky GVHD postupně odezněly. Pozdní komplikace srdečním selháním vedla k podezření na rozvoj chronického GVHD, které však vyloučil průkaz HHV 6 v biopsii myokardu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 2. 2012
Přijato: 6. 3. 2012
MUDr. Libuše Husová, Ph.D.
Centrum kardiovaskulární a transplantační chirurgie
Pekařská 53, 656 91 Brno
libuse.husova@cktch.cz
Sources
1. Burdick JF, Vogelsang GB, Smith WJ et al. Severe graft-versus-host disease in a liver-transplant recipient. N Engl J Med 1988; 318(11): 689–691.
2. Smith DM, Agura E, Netto G et al. Liver transplant-associated graft-versus-host disease. Transplantation 2003; 75(1): 118–126.
3. Taylor A, Sudhindran S, Key T et al. Monitoring systemic donor lymfocyte microchimerism to aid the differential diagnosis of graft versus host disease following liver transplantation. Transplantation 2004; 77(3): 441–446.
4. Kohler S, Pascher A, Junge G et al. Graft versus host disease after liver transplantation – a single center experience and review of literature. Transpl Int 2008; 21(5): 441–451.
5. Mayer J, Cetkovský P, Krejčí M. Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD). Transfuze hematol dnes 2007; 13(4): 192–199.
6. Taylor AL, Gibbs P, Bradley JA. Acute graft versus host disease following liver transplantation: The enemy within. Am J Transplant 2004; 4(4): 466–474.
7. Ratanatharathorn V, Ayash L, Lazarus HM et al. Chronic graft-versus-host disease: clinical manifestation and therapy. Bone Marrow Transplant 2001; 28(2): 121–129.
8. Whitington PF, Rubin CM, Alonso EM et al. Complete lymphoid chimerism and chronic graft-versus-host disease in an infant recipient of a hepatic allograft from an HLA-homozygous parenteral living donor. Transplantation 1996; 62(10): 1516–1519.
9. Jonsson JR, Hogan PG, Thomas R et al. Peripheral blood chimerism following human liver transplantation. Hematology 1997; 25(5): 1233–1236.
10. Schlitt HJ, Kanehiro H, Raddatz G et al. Persistance of donor lymphocytes in liver allograft recipients. Transplantation 1993; 56(4): 1001–1007.
11. Schmuth M, Vogel W, Weinlich G et al. Cutaneous lesions as the presenting sign of acute graft-versus-host disease following liver transplantation. Br J Dermatol 1999; 141(5): 901–904.
12. Jamienson NV, Joysey V, Friend PJ et al. Graft-versus-host disease in solid organ transplantation. Transpl Int 1991; 4(2): 67–71.
13. Vogelsang GB, Lee L, Bensen-Kennedy DN. Pathogenesis and treatment of graft-versus--host disease after bone marrow transplant. Ann Rev Med 2003; 54 : 29–52.
14. Hings IM, Filipovich AH, Miller WJ. Prednisolone therapy for acute graft-vs-host disease: short - vs. long-term treatment. A prospective randomised trial. Transplantation 1993; 56(3): 577–580.
15. Martin PJ, Schoch G, Fisher LA. Retrospective analysis of therapy for acute graft--vs-host disease: initial treatment. Blood 1990; 76(8): 1464–1472.
16. Dunn SP, Krueger LJ, Butani L et al. Late onset of severe graft-versus-host disease in a pediatric liver transplantation. Transpl Int 1998; 11: S383–S384.
17. Roberts JP, Ascher NL, Lake J et al. Graft vs. Host disease after liver transplantation in humus: a report of four cases. Hepatology 1991; 14(2): 274–281.
18. Sundhidran S, Taylor A, Delriviere L et al. Treatment of graft-versus-host disease after liver transplantation with basiliximab followed by bowel resection. Am J Transpant 2003; 3(8): 1024–1029.
19. Massenkeil G, Rackwitz S, Genvresse I et al. Basiliximab is well tolerated and effective in the treatment of steroid refractory acute graft-versus-host disease after alogenetic stem cell transplantation. Bone Marrow Transplant 2002; 30(12): 899–903.
20. Willenbacher W, Basara N, Blau IW et al. Treatment of steroid refractory acute and chronic graft-versus-host disease with daclizumab. Br J Haematol 2001; 112(3): 820–823.
21. Przepiorka D, Kernan NA, Ippoliti C et al. Daclizumab, a humanized anti-interleukin-2 receptor alpha chain antibody, for treatment of acute graft-versus-host disease. Blood 2000; 95(1): 83–89.
22. Kobbe G, Schneidr P, Rohr U et al. Treatment of severe steroid refractory acute graft-versus-host disease with infliximab, a chimeric human/mouse anti TNF alpha antibody. Bone Marrow Transplant 2001; 28(1): 47–49.
23. Jacobsohn DA, Hallick J, Anders V et al. Infliximab for steroid-refractory acute GVHD. A case series. Am J Hematol 2003; 74(2): 119–124.
24. Lehner F, Becker T, Sybrecht L et al. Successful outcome of acute graft-versus--host disease in a liver allograft recipient by withdrawal of immunosuppression. Transplantation 2002; 73(2): 307–310.
25. Cooke KR, Gerbitz A, Crawford JM et al. LPS antagonism reduces graft-versus-host disease and preserves graft-versus-leukemia activity after experimental bone marrow transplantation. J Clin Invest 2001; 107(12): 1581–1589.
26. Williamson E, Garside P, Bradley JA et al. Neutralizing IL-12 during induction of murine acute graft-versus-host disease polazizes the cytosine profile toward a Th2-type alloimmune response and confers long term protection from disease. J Immunol 1997; 159(3): 1208–1215.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2012 Issue 2-
All articles in this issue
- Dobré zprávy
- XVIst Hradec days of gastroenterology and hepatology
- Prof. Jiří Nevoral on the occasion of his 70th birthday
- 20 let členem výboru České gastroenterologické společnosti (ČGS)
- Esomeprazol – první inhibitor protonové pumpy „druhé“ generace
- Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu
- Histopatologická diagnóza hepatocelulárního karcinomu
- Rotorův syndrom podmiňuje porucha jaterního vychytávání konjugovaného bilirubinu
- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Graft vs host disease jako neobvyklá komplikace po transplantaci jater
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Analýza těkavých plynů ve vydechovaném vzduchu u nemocných s idiopatickými střevními záněty
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Mezinárodní konsenzus ke sledování aktivity nemoci u pacientů s Crohnovou chorobou: Výsledky projektu IBD AHEAD 2011
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Prof. Jiří Nevoral on the occasion of his 70th birthday
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

