-
Medical journals
- Career
Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
: S. Magnusková 1; H. Kollárová 1; V. Kamarád 2; K. Azeem 1
: Ústav preventivního lékařství, LF UP v Olomouci 1; Ústav histologie a embryologie, LF OU v Ostravě 2
: Gastroent Hepatol 2011; 65(5): 255-263
: Clinical and Experimental Gastroenterology: Review Article
Karcinom jícnu je osmým nejčastějším nádorovým onemocněním na světě. Za posledních 30 let došlo k významným změnám v epidemiologii dvou hlavních histologických typů rakoviny jícnu – spinocelulárního karcinomu a adenokarcinomu. Cílem tohoto článku je přehled obou typů karcinomu jícnu z hlediska epidemiologie a etiologie. Byl proveden výběr nejnovějších poznatků týkajících se etiologie a rizikových faktorů jícnu z databází PubMed, Web of Science a vybrané odborné české a zahraniční literatury. Zdroji epidemiologických údajů, jako jsou incidence, úmrtnost a doba přežití, byly databáze GLOBOCAN 2008 a webový portál epidemiologie zhoubných nádorů SVOD. Nejvyšší incidence spinocelulárního karcinomu jícnu je v rozvojových zemích. Zatímco incidence a prevalence spinocelulárního karcinomu jícnu zůstává přibližně stejná, dochází k výraznému nárůstu adenokarcinomu jícnu ve vyspělých zemích. Etiologie karcinomu jícnu je multifaktoriální. Nadměrná konzumace alkoholu spolu s kouřením jsou hlavními rizikovými faktory spinocelulárního karcinomu jícnu. Atrofie žaludeční sliznice, konzumace horkých potravin nebo nakládané zeleniny a nízká socioekonomická úroveň rovněž zvyšují riziko výskytu spinocelulárního karcinomu jícnu. Mužské pohlaví, bílá rasa, refluxní choroba jícnu, Barrettův jícen a obezita jsou naproti tomu rizikovými faktory pro adenokarcinom jícnu. Naopak dostatečný příjem ovoce a zeleniny a užívání nesteroidních protizánětlivých léků a aspirinu byly potvrzeny jako protektivní faktory pro oba histologické typy. Vzhledem k tomu, že incidence karcinomu jícnu v ČR stoupá, je znalost rizikových, ale i protektivních faktorů významná pro možnost uplatnění preventivních opatření. Změna stravovacích návyků, omezení alkoholu a kouření by mohly významně snížit výskyt i úmrtnost na spinocelulární karcinom jícnu. Pozornost je třeba věnovat refluxní chorobě jícnu, achalázii jícnu a prekanceróze adenokarcinomu jícnu, Barrettově jícnu. Změna životního stylu včetně redukce hmotnosti je další způsob, který by mohl snížit výskyt adenokarcinomu jícnu. Významnou roli hraje také edukace, a to zejména výchova k nekuřáctví, nebo u pacientů s refluxní chorobou antirefluxní léčba.
Klíčová slova:
adenokarcinom jícnu – Barrettův jícen – epidemiologie – etiologie – spinocelulární karcinom jícnuKarcinom jícnu je zhoubné nádorové onemocnění vyššího věku, které se vyznačuje rychlým průběhem a vysokou letalitou. Jeho největší výskyt je mezi 50. a 70. rokem života [1,2]. Rozlišujeme dva hlavní histologické typy: spinocelulární karcinom (zejména proximální 2/3 jícnu) a adenokarcinom (distální část jícnu a gastroezofageální junkce).
Spinocelulární karcinom jícnu je v mnoha případech pokládán za nádor indukovaný ve sliznici chronickou expozicí dráždivým látkám, kouřením, konzumací horkých nápojů a alkoholu, zejména koncentrovaného. Prekurzorem spinocelulárního karcinomu je epiteliální dysplazie, která přechází v karcinom in situ a následně pak v invazivní karcinom, který se projevuje jako rychle rostoucí, ulcerující nebo infiltrující léze epitelu jícnu [3].
Reflux gastroduodenálního obsahu do jícnu, jež vede k chronickému poškození sliznice jícnu, je považován za nejsilnější rizikový faktor pro adenokarcinom jícnu. Nejvíce jsou postiženy distální partie jícnu. Vrstevnatý dlaždicový epitel jícnu je nahrazen cylindrickým epitelem s pohárkovými buňkami. Dochází k intestinální metaplazii a vzniká Barrettův jícen, který je v současné době považován za prekancerózu. Jde o získaný stav, který je výsledkem dlouhodobého poškozování jícnové sliznice. Patogenní mechanizmus je doposud předmětem výzkumu. Za důležité faktory pro vznik Barrettova jícnu jsou považovány: časté a dlouhotrvající období kyselého refluxu, kouření, nadměrné požívání alkoholu, abnormální tvorba žaludeční kyseliny, snížený tlak dolního jícnového svěrače a porucha motility. V Barrettově jícnu mohou vznikat dysplazie a karcinom [3].
Cílem tohoto článku je přehled obou typů karcinomu jícnu z hlediska epidemiologie a etiologie.
Epidemiologie karcinomu jícnu ve světě
Karcinom jícnu je osmým nejčastějším nádorovým onemocnění na světě a šestou nejčastější příčínou úmrtí na nádorová onemocnění. V roce 2008 byla incidence tohoto onemocnění 481 645 osob, z toho bylo 326 245 mužů a 155 400 žen. Poměr mezi počtem mužů a žen je udáván 2–4 : 1. Úmrtnost celosvětově představovala ve stejném roce 406 533 úmrtí na toto onemocnění, z toho 276 007 u mužů a 130 526 u žen [1].
Incidence karcinomu jícnu se vyznačuje poměrně významnou geografickou variabilitou. Nejvyšší incidence a zároveň úmrtnost u obou pohlaví je ve východní a jižní Africe a východní Asii. Téměř polovina všech případů karcinomu jícnu se vyskytla v Číně. Oblast s vysokou incidencí i mortalitou, tzv. středoasijský pás karcinomu jícnu, se táhne od Kazachstánu, Uzbekistánu, Turkmenistánu až po severovýchodní Írán, severní Afghánistán, Čínu a Mongolsko. Ačkoli incidence podle histologického typu není často dostupná, jedná se v těchto státech téměř vždy o spinocelulární karcinom jícnu [1].
V evropských státech byl v roce 2008 nejvyšší výskyt u mužů ve Velké Británii se standardizovanou incidencí na 100 000 obyvatel 9,5, v Nizozemsku 9,3 a Irsku 8,4. U žen byla standardizovaná incidence na 100 000 obyvatel nejvyšší shodně ve Velké Británii a Nizozemsku 3,6 a Irsku 2,7 [1].
Jak je patrné z tab. 1, v méně rozvinutých zemích je stále incidence a mortalita mnohonásobně vyšší než ve vyspělých státech [1].
1. Srovnání počtu nových případů a počtu úmrtí na karcinom jícnu celosvětově za rok 2008 [1]. Tab. 1. Comparison of number of new cases and number of deaths from carcinoma of the oesophagus worldwide in 2008 [1]. ![Srovnání počtu nových případů a počtu úmrtí na karcinom jícnu celosvětově za rok 2008 [1].
Tab. 1. Comparison of number of new cases and number of deaths from carcinoma of the oesophagus worldwide in 2008 [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0f63f54c55a5ac34140174ff80a28545.jpg)
Spinocelulární karcinom představoval v minulosti 90 % všech nádorů jícnu. I když se celková incidence spinocelulárního karcinomu snížila, v rozvojových zemích zůstává dominantním typem rakoviny jícnu. Jeho incidence je nejvyšší mezi Afričany, Američany černé pleti a Asijci [4]. V posledních třech dekádách došlo k významnému vzestupu incidence adenokarcinomu jícnu, který v současnosti tvoří 60 % všech nádorů jícnu v západních zemích. Tento typ převažuje u mužů bílé pleti. Nárůst adenokarcinomu jícnu je spojován s rostoucím počtem obézních osob v západních zemích.
1. Země s nejvyšší standardizovanou incidencí zhoubného nádoru jícnu (počet případů/100 000 osob). Fig. 1. Countries with the highest standardised incidence of carcinoma of the oesophagus (number of cases/100,000 persons). 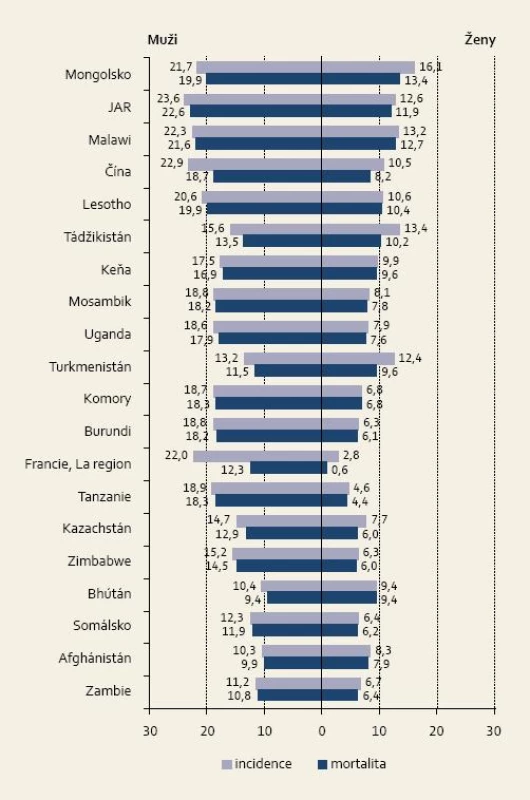
Epidemiologie karcinomu jícnu v ČR
Zhoubné nádory jícnu představují 0,7 % všech malignit v ČR a jsou odpovědné za 1,4 % všech úmrtí na nádorová onemocnění. Současné údaje hovoří o meziročním nárůstu incidence karcinomu jícnu o 6,6 % [5]. V roce 2008 bylo toto onemocnění nově diagnostikováno u 513 osob, z toho bylo 411 mužů a 102 žen. Ve stejném roce zemřelo na toto onemocnění 448 osob, 368 mužů a 80 žen. Standardizovaná incidence zhoubného nádoru jícnu u mužů představovala 5,1/100 000 a u žen 0,9/100 000. Standardizovaná úmrtnost u mužů je u nás 4,4/100 000, u žen 0,8/100 000. Relativní incidence plynule narůstá s věkem u mužů od 35 let, u žen od 45 let [6].
Geografické rozložení případů karcinomu jícnu není rovnoměrné. Nejvyšší incidence se nachází v Moravsko-slezském 2,8/100 000, Zlínském 2,7/100 000 a Libereckém kraji 2,6/100 000. Zvýšená incidence je také shodně v Jihomoravském a Karlovarském kraji 2,4/100 000 a Olomouckém kraji 2,3/100 000. Nejnižší incidence se naopak nachází v kraji Vysočina 1,9/100 000 a Praze 1,7/100 000 [7].
Při posouzení časového vývoje hrubé incidence a mortality je patrný vzestupný trend. V roce 1977 byla hrubá incidence u mužů 3,13/100 000 a u žen 0,4/100 000, o 30 let později 8,2/100 000 u mužů a 1,81/100 000 u žen. Hrubá mortalita byla v roce 1977 1,98/100 000 u mužů a 0,21/100 000 u žen, v roce 2007 5,98/100 000 u mužů a 1,19/100 000 u žen. Nejvyšší incidence a rovněž i mortalita u nás je ve věku 75 let a více [7]. Karcinom jícnu je závažné fatální onemocnění, jehož úmrtnost je přibližně 90 % roční incidence. Horší prognózu má jen karcinom jater, pleury a slinivky břišní [2].
Špatná prognóza pacientů je dána pozdní diagnostikou karcinomu jícnu. Karcinom jícnu se zpravidla manifestuje dysfagií až v době, když je již karcinom jícnu v pokročilém stadiu. Bereme-li v úvahu pacienty se všemi stadii choroby, pak pětileté přežití je asi 15 %, přičemž většina pacientů umírá již během prvního roku. Největší šance na vyléčení existuje tehdy, kdy je karcinom lokalizován pouze ve sliznici jícnu, pak je pětileté přežití asi u 80 % pacientů. Pokud karcinom prorůstá pod sliznici, je pětileté přežití menší než 50 %. U pacientů s pokročilým karcinomem jícnu pronikající do muscularis propria je pětileté přežití jen 20 %, a pokud karcinom pronikajícím ještě hlouběji, pak pět let přežívá jen 7 % pacientů. U inoperabilních pacientů s metastázami je pětileté přežití menší než 3 % [8].
Rizikové faktory spinocelulárního karcinomu jícnu
Kouření tabáku
Kouření cigaret má mnohem větší vliv na vznik spinocelulárního karcinomu, než je tomu u adenokarcinomu. Hashibe et al uvádí, že riziko spinocelulárního karcinomu je u kuřáků ve střední a východní Evropě v průměru sedmkrát vyšší. V této studii se kouření zdálo být nejdůležitějším rizikovým faktorem pro rozvoj spinocelulárního karcinomu ve střední a dolní části jícnu [9]. Rovněž bylo potvrzeno, že kouření dýmky či doutníků představuje stejné riziko jako kouření cigaret [10]. Po 5–10 letech od zanechání kouření se riziko karcinomu jícnu poměrně rychle snižuje [11,12].
Mezinárodní agentura pro výzkum rakoviny IARC (International Agency for Research on Cancer) potvrdila žvýkání betelu, který je rozšířený hlavně v asijských zemích, jako rizikový faktor pro vznik spinocelulárního karcinomu. Sousto pro žvýkání obsahuje kus ořechu arekového z palmy arekové, pinangu v určitém stadiu zralosti a trochu páleného vápna. Obě složky se zabalují do srdčitého listu pepře betelového. Je prokázáno, že žvýkání betelu je lehce návykové, navozuje dobrou náladu a tiší hlad a žízeň [13]. Studie, která byla prováděna v oblasti s vysokou incidencí v provinci Golestan v Íránu, prokázala, že užívání opia představuje dvojnásobně vyšší riziko vzniku nádoru jícnu [14].
Alkohol
IARC potvrdila konzumaci alkoholu jako rizikový faktor pro vznik karcinomu jícnu [15]. Riziko vzniku karcinomu vzrůstá se zvyšující se denní spotřebou alkoholu. Konzumace nadměrného množství alkoholu (více než 39 g alkoholu za den) vedlo k 3–5násobnému zvýšení rizika [16,17]. Ukázalo se, že celkové množství alkoholu obsaženého v nápoji je důležitější než typ nápoje. U osob konzumující 200–250 g čistého alkoholu denně bylo riziko dokonce dvacetkrát vyšší než u abstinentů [18]. Abstinence riziko spinocelulárního karcinomu snížila, ačkoli významný pokles rizika byl pozorován až po 10 a více letech od ukončení konzumace alkoholu [19,20]. Relativní riziko se mnohonásobně zvyšuje při společné konzumaci alkoholu a cigaret, jelikož se oba tyto faktory navzájem umocňují [11,21,22].
Horké jídlo a nápoje
Předpokládá se, že konzumace horkých potravin zvyšuje riziko karcinomu jícnu. Získané důkazy jsou nejednoznačné hlavně kvůli obtížnosti sledování a měření teploty potravin [23].
Maté (výtažek z rostliny cesmíny paraguayské) je nápoj, který se konzumuje horký ve velkém množství (1–2 l//den) v oblastech Jižní Ameriky [24]. V roce 1991 IARC označila vztah mezi konzumací horkého maté a kancerogenitou jícnu jako pravděpodobný (skupina 2A) [25,26]. Relativní riziko rakoviny jícnu při konzumaci více než jednoho litru horkého maté denně je asi 2,95. Při kumulativní konzumaci maté, alkoholu a tabáku je riziko vzniku karcinomu jícnu až sedminásobné [27]. Opakované teplotní poškození sliznice způsobené vysokou teplotou nápoje a vliv polycyklických aromatických uhlovodíků (PAU) obsažených v maté se mohou uplatnit při vzniku tohoto karcinomu [28].
Nakládaná zelenina
Konzumace nakládané zeleniny v některých oblastech Číny je považována za příčinu spinocelulárního karcinomu jícnu [29]. IARC zařadila konzumaci tradiční asijské nakládané zeleniny za možnou příčinu kancerogenity, skupina 2B [25,30]. Plísně a kvasinky obsažené v nakládané zelenině mohou uvolňovat potenciálně karcinogenní látky, jako jsou N-nitrosaminy a Roussin. Metaanalýza studií případů a kontrol a kohortových studií ukázala až dvojnásobně vyšší riziko karcinomu spojené s konzumací nakládané zeleniny [31]. Ne všechny studie ale tuto souvislost potvrdily [32].
Atrofie žaludeční sliznice
Islami et al ve své metaanalýze z roku 2010 uvádí až dvojnásobné zvýšení rizika spinocelulárního karcinomu u pacientů s atrofií žaludeční sliznice [33]. Je možné, ale ne jisté, že vztah mezi gastrickou atrofií a spinocelulárním karcinomem je kauzální (infekce H. pylori může indukovat vznik atrofické gastritidy). Infekce Cag A pozitivním H. pylori může zvýšit riziko spinocelulárního karcinomu (na rozdíl od protektivního vlivu H. pylori u adenokarcinomu jícnu) [34].
Vliv profese
U osob pracujících s nitrosaminy, křemenem, černým uhlím, kyselinou sírovou a tetrachlorethylenem bylo zjištěno zvýšené riziko spinocelulárního karcinomu [35–37].
Radioterapie
Karcinom jícnu patří mezi vzácné sekundární malignity objevující se po expozici ionizačnímu záření [38]. Nádory způsobené ozářením představují méně než 1 % všech karcinomů jícnu [39]. Je zde ale mnoho nejasností ohledně vlivu rentgenového záření na vývoj sekundární malignity. Rizikové faktory, jako jsou kouření, alkohol a chronické zánětlivé onemocnění, budou mít pravděpodobně mnohem větší vliv než samotná radioterapie [40].
Spinocelulární karcinom v ORL oblasti
Některé studie popsaly vztah mezi předešlým spinocelulárním karcinomem v ORL oblasti a častějším vznikem spinocelulárního karcinomu jícnu. Pravděpodobně se tak děje v souvislosti s působením stejných rizikových faktorů (kouření a alkohol). Studie však neprokázaly, zda riziko endoskopického screeningu převáží výhody včasného stanovení spinocelulárního karcinomu jícnu. V současné době neexistuje doporučení k rutinnímu endoskopickému screeningu k identifikaci synchronního spinocelulárního karcinomu jícnu po předešlém spinocelulárním karcinomu v ORL oblasti, ale jednotlivá endoskopie může být u těchto osob indikovaná [41].
Genetické predispozice
Jediným dosud známým hereditárním syndromem asociovaným s karcinomem jícnu je tylóza, autozomálně dominantní onemocnění vyznačující se hyperkeratózou dlaní a chodidel, kde se zhoubný nádor jícnu vyskytuje u 40 % postižených. Také u žen s Plummer-Vinsonovým syndromem charakterizovaným sideropenickou anémií, glositidou a esofagitidou se nádory jícnu vyskytují až v 10 % případů [42].
Rizikové faktory adenokarcinomu jícnu
Barrettův jícen, gastroezofageální reflux
Barrettův jícen jako komplikace refluxní choroby jícnu bývá označován za prekancerózu jícnu s výskytem 0,4–0,5 % pacientů/rok [43]. Barrettův jícen je definován jako náhrada čili metaplazie dlaždicovitého epitelu sliznice jícnu epitelem cylindrickým, který má alespoň v některých úsecích intestinální charakter. Je to získaný stav, ke kterému dochází při dlouhodobém poškozování sliznice jícnu [44].
Ve švédské studii Lagergren et al prokázali závislost vzniku adenokarcinomu na frekvenci a stupni závažnosti refluxní choroby jícnu. Čím závažnější, častější a déle přetrvávající symptomy refluxu byly přítomny, tím bylo vyšší riziko adenokarcinomu [45]. Dosud však není známo, u kterých nemocných s refluxní chorobou se vyvine Barrettův jícen a u kterých z nich dojde až ke vzniku adenokarcinomu, protože 40 % pacientů s adenokarcinomem nemá žádnou refluxní symptomatologii [45,46].
Barrettův jícen jako rizikový faktor lze ovlivnit v zásadě třemi způsoby: léčbou refluxní choroby jícnu, endoskopickou dispenzarizací a včasným odhalením dysplazie a léčbou dysplazie. Další možností je chemoprevence [47].
Tělesná hmotnost
Nárůst obezity v západních zemích doprovází zvýšená incidence adenokarcinomu jícnu. Dvě metaanalýzy potvrdily vztah mezi nadváhou (BMI 25–30 kg/m2), obezitou (BMI > 30 kg/m2) a adenokarcinomem jícnu [48,49]. Bylo zjištěno, že riziko je u těchto osob 2–3násobné a s rostoucím BMI se riziko dále zvyšuje [49]. Obezita zvyšuje riziko refluxní choroby jícnu, a nepřímo tedy riziko Barrettova jícnu [50].
Význam má zejména typ obezity, přičemž bylo prokázáno, že centrální typ obezity (typ jablka) představuje v rozvoji metaplazie a následně adenokarcinomu jícnu mnohem větší nebezpečí než hodnota BMI. Tato skutečnost může vysvětlit, proč u mužů dochází k častějšímu výskytu tohoto karcinomu. Viscerální tuk je více metabolicky aktivní než tuk podkožní, aktivita polypeptidů tukové tkáně, jako je leptin, ghrelin a adiponektin, může také přispívat k patofyziologii adenokarcinomu jícnu [34].
Infekce Helicobacter pylori
Vztah infekce Helicobacter pylori a atrofie žaludeční sliznice byl dlouhodobě předmětem zkoumání. Infekce Helicobacter pylori, zejména Cag-A pozitivní, se ukázala být protektivním faktorem pro vznik adenokarcinomu jícnu, ale zároveň i rizikovým faktorem pro spinocelulární karcinom jícnu [34]. Možné vysvětlení protektivního účinku tím, že infekce vede ke snížení sekrece žaludeční kyseliny, a tak dochází ke snížení intenzity refluxu z žaludku do jícnu [51], bylo později zpochybněno ve studii Ye et al, která vyloučila mechanizmus navození atrofie a snížení kyselé sekrece infekcí Helicobacter pylori [34].
Názory na eradikaci Helicobacter pylori nejsou u refluxní choroby jícnu jednotné. Eradikace se doporučuje při současné vředové chorobě. V ostatních případech refluxní choroby jícnu se spíše doporučuje neeradikovat [52].
Whitemann et al ve studii případů a kontrol zjistili, že vzájemný inverzní vztah mezi infekcí Helicobacter pylori a adenokarcinomem jícnu je nezávislý na genetických faktorech a faktorech životního prostředí [53]. Statisticky významný vzájemný inverzní vztah byl pozorován i u Barrettova jícnu [54].
Rovněž Helicobacter pylori může snížit produkci ghrelinu, hormonu zvyšujícího chuť k jídlu, který je produkován buňkami sliznice žaludku. Díky tomu dochází k menšímu nárůstu obezity, která je rizikovým faktorem pro vznik adenokarcinomu jícnu [55].
Hiátová hernie
Při hiátové hernii dochází ke zkrácení délky a tlaku dolního jícnového svěrače a k poškození vlivu bráničních snopců. Snižuje se jícnová peristaltika, zvyšuje se průměr lumen v oblasti gastroezofageální junkce, vak kýly účinkuje jako rezervoár refluxátu a zvyšuje se styk jícnové sliznice s kyselým obsahem. Hiátová hernie je faktorem, který ezofagitidu zhoršuje tím, že prodlužuje čas styku s refluxátem, zvětšuje objem refluxátu a umožňuje proniknutí refluxátu do orálnějších partií jícnu [56]. Hiátová hernie může přispívat ke 2–6násobnému riziku adenokarcinomu jícnu [57].
Kouření tabáku
Ačkoli je u kuřáků zvýšení rizika vzniku adenokarcinomu jícnu méně významné než u spinocelulárního karcinomu jícnu, řada studií potvrdila dvojnásobně zvýšené riziko pro adenokarcinom jícnu [17,21,58–60]. Bylo potvrzeno, že riziko narůstá s délkou a intenzitou kouření [60]. Na rozdíl od spinocelulárního karcinomu jícnu se riziko snižuje asi až po 30 letech od zanechání kouření [12].
Vliv profese
Ačkoli byl prokázán vztah mezi výkonem profese a adenokarcinomem jícnu (např. u stavebních dělníků vystavených azbestu nebo cementovému prachu nebo u zdravotnických pracovníků), souvislost profesního rizika s adenokarcinomem jícnu je velmi malá [61–63].
Společné rizikové faktory pro spinocelulární karcinom a adenokarcinom jícnu
Nedostatečný příjem ovoce a zeleniny
Nedostatečný příjem ovoce a zeleniny je obecně spojován s vyšším rizikem karcinomu jícnu. Kohortové studie prokázaly, že pravidelný příjem ovoce a zeleniny vedl ke snížení rizika karcinomu jícnu [64,65]. Světový fond pro výzkum rakoviny a Americký institut pro výzkum rakoviny WCRF-AICR (The World Cancer Research Fund / American Institute for Cancer Research Joint Committee) [66] stejně jako COMA (The Committee on Medical Aspects of Food and Nutrition Policy) [67] došly k závěru, že příjem ovoce a zeleniny má přesvědčivý protektivní vliv na vznik karcinomu jícnu. Sapkota et al zjistili inverzní asociaci mezi konzumací rajčat a špenátu a karcinomu jícnu ve studii, která probíhala ve střední a východní Evropě [68].
Metaanalýza publikované literatury prokázala, že i další druhy zeleniny, jako například brukvovitá zelenina (brokolice, květák, kapusta) mají výraznější ochranný vliv na vznik karcinomu jícnu. Podle této metaanalýzy má ovoce větší protektivní účinek než zelenina [69].
Také u Barrettova jícnu má konzumace ovoce a zeleniny protektivní charakter. Ve studii případů a kontrol byl příjem ovoce (2,5 porce na 2 000 kcal/den) a zeleniny (4,6 porce na 2 000 kcal/den) spojen s největším snížením rizika Barrettova jícnu [70].
Achalázie jícnu
Achalázie jícnu je primární porucha motility jícnu charakterizovaná zvýšeným tlakem dolního jícnového svěrače se špatnou relaxací a narušením peristaltiky v jícnu. Městnání a fermentace potravy v jícnu pak může vést k zánětu a vyššímu riziku vzniku nádoru jícnu [71]. Desetinásobně zvýšené riziko pro oba histologické typy u pacientů s achalázií popisují ve švédské kohortové studii Zendehdel et al [72]. Achalázie byla tradičně považována za rizikový faktor pro spinocelulární karcinom jícnu a případy adenokarcinomu byly považovány za vzácné a přičítaly se iatrogennímu refluxu po myotomii. Zendehdel et al na základě své studie upozorňují na fakt, že riziko vzniku adenokarcinomu je významně zvýšené, ale zároveň nenašel důkaz, že by myotomie toto riziko ovlivňovala.
Aspirin/nesteroidní protizánětlivé léky
Řada epidemiologických studií nalezla inverzní asociaci mezi užíváním aspirinu a jiných nesteroidních protizánětlivých léků a rizikem vzniku karcinomu jícnu. Snížené riziko se vyskytuje u obou histologických typů karcinomu jícnu. Častější užívání těchto léků celkově snižuje riziko onemocnění, celkové snížení rizika je asi 40 % [73].
Výsledky, které v roce 2010 zveřejnil časopis Lancet, ukázaly, že dlouhodobě podávané nízké dávky kyseliny acetylsalicylové (75 mg denně) snižují úmrtnost způsobenou rakovinou tlustého střeva o více než třetinu. Hlavní přínos terapie byl patrný po uplynutí následného pětiletého sledování (mortalita klesla o 34 % u všech druhů nádorů a v případě nádorů trávicího traktu o 54 %). Snížení mortality po 20 letech terapie dosáhlo 40 % v případě kolorektálního karcinom a 60 % v případě karcinomu jícnu [74].
Lidský papilomavirus (HPV virus)
Výsledky z jednotlivých studií jsou velmi rozporuplné. Zatímco některé studie našly velmi silný vztah (relativní riziko 5 a vyšší) [75,76] mezi lidským papilomavirem, zejména HPV 16 nebo HPV 18, a karcinomem jícnu, jiné potvrdily střední riziko (relativní riziko 2–5) [77] a další nenašly žádný vztah nebo dokonce inverzní asociaci [78]. Na základě těchto rozporuplných výsledků vydala IARC stanovisko, že neexistuje dostatek podložených informací o karcinogenním působení lidského papilomaviru na jícen [79].
Socioekonomický status
Lidé, u kterých byl diagnostikován spinocelulární karcinom jícnu, mají průměrný věk o deset let nižší než pacienti s adenokarcinomem. Žijí v oblastech s nízkou socioekonomickou úrovní, kde vedle nedostatečné výživy často nadužívají ve velké míře alkohol a tabák, což často vede ke zhoršení jaterních funkcí až k jaterní cirhóze.
Adenokarcinom jícnu, který je naopak převažujícím typem v západních zemích s vysokou socioekonomickou úrovní, je spojen s vysokým BMI a s kardiovaskulárními rizikovými faktory [80].
Hlavní rizikové a protektivní faktory jsou shrnuty v tab. 2. Mnoho rizikových faktorů se objevuje jen u jednoho histologického typu, ale kouření tabáku a nadměrná konzumace alkoholu jsou rizikové faktory u obou [4].
2. Souhrn rizikových a protektivních faktorů podle histologického typu [81,82]. Tab. 2. Summary or risk and protective factors according to histological type [81,82]. ![Souhrn rizikových a protektivních faktorů podle histologického typu [81,82].
Tab. 2. Summary or risk and protective factors according to histological type [81,82].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d85e9350c37345e138f5bf268e0ab6ff.jpg)
Rizikový faktor: +++ přesvědčivé zvýšení rizika , ++ pravděpodobné zvýšení rizika, + omezené/nepotvrzené zvýšení rizika, 0 nemá vliv Protektivní faktor: −−− přesvědčivé snížení rizika, −− pravděpodobné snížení rizika, − omezené/nepotvrzené snížení rizika, 0 nemá vliv Závěr
V současné době není pochyb o tom, že spinocelulární karcinom a adenokarcinom jícnu jsou dvě různá onemocnění s odlišnou epidemiologií a etiologií. Výživové rizikové faktory a faktory životního prostředí se výrazněji podílejí na etiologii spinocelulárního karcinomu jícnu, zatímco endogenní faktory zejména gastroezofageální reflux a následná maladaptace v podobě intestinální metaplazie hrají důležitou roli v patogenezi adenokarcinomu jícnu.
V etiologii spinocelulárního karcinomu jícnu se více uplatňují některé toxické exogenní faktory, jako například kouření, nadměrná konzumace alkoholu, traumatizace sliznice a jiné, které nejsou tak významné pro vznik adenokarcinomu jícnu. V horní části trávicího traktu se neoplastické léze vyvíjejí na pozadí chronického zánětu sliznice nebo podslizničního vaziva a opakované expozice škodlivinám tento proces urychlují. Na rozdíl od spinocelulárního karcinomu jícnu není konzumace alkoholických nápojů rizikovým faktorem pro adenokarcinom jícnu a kouření riziko zvyšuje jen mírně [17,21,60,83].
Povrch distálního jícnu a žaludeční kardie je při gastroezofageálním refluxu vystaven působení agresivního žaludečního obsahu, což může vést ke vzniku intestinální metaplazie – Barrettova jícnu a následně ke vzniku adenokarcinomu jícnu. Vysoké BMI je rovněž spojováno s rostoucí incidencí prekanceróz v této oblasti jícnu. Na rozdíl od adenokarcinomu jícnu, kde je obezita považována za faktor zvyšující riziko vzniku tohoto karcinomu, je u spinocelulárního karcinomu zjišťována inverzní asociace k obezitě, a tedy nižší hodnoty BMI [80].
Profesionální expozice se u karcinomu jícnu uplatňuje spíše okrajově a je třeba zvažovat vliv bias a jiných ovlivňujících faktorů, zejména kouření a nadměrné konzumace alkoholu, které případný vliv těchto faktorů mohou ještě potencovat. I závěry epidemiologických studií jsou nejednoznačné a upozorňují, že možnou slabou souvislost překrývají významnější faktory, kterými jsou kouření a požívání alkoholu [61–63].
Vzhledem k tomu, že incidence karcinomu jícnu v České republice stoupá, je znalost rizikových, ale i protektivních faktorů významná pro možnost uplatnění preventivních opatření. Změna stravovacích návyků, omezení alkoholu a kouření by mohly významně snížit výskyt i úmrtnost na spinocelulární karcinom jícnu. Pozornost je třeba věnovat refluxní chorobě jícnu, achalázii jícnu a prekanceróze adenokarcinomu jícnu, Barrettově jícnu. Změna životního stylu včetně redukce hmotnosti je další způsob, který by mohl snížit výskyt adenokarcinomu jícnu. Významnou roli hraje také edukace, a to zejména výchova k nekuřáctví, nebo u pacientů s refluxní chorobou antirefluxní léčba.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Na tomto místě bych chtěla poděkovat Mgr. et MUDr. Karlu Šlaisovi, Ph.D., za podnětné rady a čas při psaní článku.
Doručeno/Submitted: 7. 3. 2011
Přijato/Accepted: 12. 5. 2011
Mgr. Silvie Magnusková
Ústav preventivního lékařství LF UP v Olomouci
Hněvotínská 3, 775 15 Olomouc
silvikm@centrum.cz
Sources
1. Ferlay J, Shin HR, Bray F et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010; 127(12): 2893–2917.
2. Coleman MP, Gatta G, Verdecchia A et al. EUROCARE-3 summary: cancer survival in Europe at the end of the 20th century. Ann Oncol 2003; 14 (Suppl 5): 128–149.
3. Lambert R, Hainaut P. Epidemiology of oesophagogastric cancer. Baillieres Best Pract Res Clin Gastroenterol 2007; 21(6): 921–945.
4. Hongo M, Nagasaki Y, Shoji T. Epidemiology of esophageal cancer: Orient to Occident. Effects of chronology, geography and ethnicity. J Gastroenterol Hepatol 2009; 24(5): 729–735.
5. Dušek L et al. Epidemiology of malignant tumours of the oesophagus (C15). In: Czech cancer care in numbers 2008–2009. Praha: Grada 2010 : 112.
6. Klener P. Karcinom jícnu. In: Klinická onkologie. Praha: Karolinum-Galén 2002: 397–398.
7. Dušek L et al. Český národní webový portál epidemiologie nádorů (online). Masarykova Univerzita 2005 [cited 2011 26.04.]; Available from: http://www.svod.cz.
8. Polednak AP. Trends in survival for both histologic types of esophageal cancer in US surveillance, epidemiology and end results areas. Int J Cancer 2003; 105(1): 98–100.
9. Hashibe M, Boffetta P, Janout V et al. Esophageal cancer in Central and Eastern Europe: tobacco and alcohol. Int J Cancer 2007 : 120(7): 1518–1522.
10. Koop CE, Luoto J. „The Health Consequences of Smoking: Cancer,“ overview of a report of the Surgeon General. Public Health Rep 1982; 97(4): 318–324.
11. Lee CH, Lee JM, Wu DC et al. Independent and combined effects of alcohol intake, tobacco smoking and betel quid chewing on the risk of esophageal cancer in Taiwan. Int J Cancer 2005; 113(3): 475–482.
12. Jankowski JA, Wright NA, Meltzer SJ et al. Molecular evolution of the metaplasia-dysplasia-adenocarcinoma sequence in the esophagus. Am J Pathol 1999; 154(4): 965–973.
13. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. Betel-quid and areca-nut chewing and some areca-nut derived nitrosamines. IARC Monogr Eval Carcinog Risks Hum 2004; 85 : 1–334.
14. Nasrollahzadeh D, Kamangar F, Aghcheli K et al. Opium, tobacco, and alcohol use in relation to oesophageal squamous cell carcinoma in a high-risk area of Iran. Br J Cancer 2008; 98(11): 1857–1863.
15. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. IARC Alcoholic Beverage Consumption and Ethyl Carbamate (Urethane). IARC Monogr Eval Carcinog Risks Hum 2007; 96.
16. Brown LM, Hoover R, Silverman D et al. Excess incidence of squamous cell esophageal cancer among US Black men: role of social class and other risk factors. Am J Epidemiol 2001; 153(2): 114–122.
17. Freedman ND, Abnet CC, Leitzmann MF et al. A prospective study of tobacco, alcohol, and the risk of oesophageal and gastric cancer subtypes. Am J Epidemiol 2007; 165(12): 1424–1433.
18. Bosetti C, La Vecchia C, Negri E et al. Wine and other types of alcoholic beverages and the risk of esophageal cancer. Eur J Clin Nutr 2000; 54(12): 918–920.
19. Castellsague X, Munoz N, De Stefani E et al. Independent and joint effects of tobacco smoking and alcohol drinking on the risk of esophageal cancer in men and women. Int J Cancer 1999; 82(5): 657–664.
20. Bosetti C, Franceschi S, Levi F et al. Smoking and drinking cessation and the risk of oesophageal cancer. Br J Cancer 2000; 83(5): 689–691.
21. Wu AH, Wan P, Bernstein L. A multiethnic population-based study of smoking, alcohol and body size and risk of adenocarcinomas of the stomach and esophagus (United States). Cancer Causes Control 2001; 12(8): 721–732.
22. Kollarova H, Machova L, Horakova D et al. Risk of oesophageal cancer. Ces a Slov Gastroent a Hepatol 2008; 62(2): 79–83.
23. De Jong UW, Day NE, Mounier-Kuhn PL et al. The relationship between the ingestion of hot coffee and intraoesophageal temperature. Gut 1972; 13(1): 24–30.
24. Castellsague X, Munoz N, De Stefani E et al. Influence of mate drinking, hot beverages and diet on esophageal cancer risk in South America. Int J Cancer 2000; 88(4): 658–664.
25. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. Overall Evaluations of carcinogenicity: An updating of IARC Monographs Volumes 1 to 42, Supplement 7. IARC Monogr Eval Carcinog Risks Hum; 1987.
26. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. Coffee, tea, mate, methylxanthines and methylglyoxal. IARC Monogr Eval Carcinog Risks Hum 1991; 51 : 1–513.
27. Sewram V, De Stefani E, Brennan P et al. Mate consumption and the risk of squamous cell esophageal cancer in Uruguay. Cancer Epidemiol Biomarkers Prev 2003; 12(6): 508–513.
28. Kamangar F, Schantz MM, Abnet CC et al. High levels of carcinogenic polycyclic aromatic hydrocarbons in mate drinks. Cancer Epidemiol Biomarkers Prev 2008; 17(5): 1262–1268.
29. Yang CS. Research on esophageal cancer in China: a review. Cancer Res 1980; 40(8 Pt 1): 2633–2644.
30. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans Pickled vegetables. IARC Monogr Eval Carcinog Risks Hum 1993; 56 : 83–113.
31. Islami F, Ren JS, Taylor PR et al. Pickled vegetables and the risk of oesophageal cancer: a meta-analysis. Br J Cancer 2009; 101(9): 1641–1647.
32. Tran GD, Sun XD, Abnet CC et al. Prospective study of risk factors for esophageal and gastric cancers in the Linxian general population trial cohort in China. Int J Cancer 2005; 113(3): 456–463.
33. Islami F, Sheikhattari P, Ren JS et al. Gastric atrophy and risk of oesophageal cancer and gastric cardia adenocarcinoma – a systematic review and meta-analysis. Ann Oncol 2011; 22(4): 754–760.
34. Ye W, Held M, Lagergren J et al. Helicobacter pylori infection and gastric atrophy: risk of adenocarcinoma and squamous-cell carcinoma of the esophagus and adenocarcinoma of the gastric cardia. J Natl Cancer Inst 2004; 96(5): 388–396.
35. Ruder AM, Ward EM, Brown DP. Mortality in dry-cleaning workers: an update. Am J Ind Med 2001; 39(2): 121–132.
36. Parent ME, Siemiatycki J, Fritschi L. Workplace exposures and oesophageal cancer. Occup Environ Med 2000; 57(5): 325–334.
37. Straif K, Weiland SK, Bungers M et al. Exposure to high concentrations of nitrosamines and cancer mortality among a cohort of rubber workers. Occup Environ Med 2000; 57(3): 180–187.
38. Micke O, Schafer U, Glashorster M et al. Radiation-induced esophageal carcinoma 30 years after mediastinal irradiation: case report and review of the literature. Jpn J Clin Oncol 1999; 29(3): 164–170.
39. Marchese MJ, Liskow A, Chang CH. Radiation therapy associated cancer of the esophagus. N Y State J Med 1986; 86(3): 152–153.
40. Kirova YM, Asselain B, Fourquet A. Can we consider always an esophageal carcinoma as radiation associated cancer after irradiation for breast cancer? Am J Clin Oncol 2009; 32(2): 197–199.
41. Hirota WK, Zuckerman MJ, Adler DG et al. ASGE guideline: the role of endoscopy in the surveillance of premalignant conditions of the upper GI tract. Gastrointest Endosc 2006; 63(4): 570–580.
42. Lukanich JM. Section I: epidemiological review. Semin Thorac Cardiovasc Surg 2003; 15(2): 158–166.
43. Thomas T, Abrams KR, De Caestecker JS et al. Meta analysis: Cancer risk in Barrett‘s oesophagus. Aliment Pharmacol Ther 2007; 26(11–12): 1465–1477.
44. Lukáš K. Barrettův jícen z pohledu gastroenterologa. Novinky z gastroenterologie 2000; 1 : 3–6.
45. Lagergren J, Bergstrom R, Lindgren A et al. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 1999; 340(11): 825–831.
46. Chak A, Faulx A, Eng C et al. Gastroesophageal reflux symptoms in patients with adenocarcinoma of the esophagus or cardia. Cancer 2006; 107(9): 2160–2166.
47. Spechler SJ, Fitzgerald RC, Prasad GA et al. History, molecular mechanisms, and endoscopic treatment of Barrett‘s esophagus. Gastroenterology 2010; 138(3): 854–869.
48. Hampel H, Abraham NS, El-Serag HB. Meta-analysis: obesity and the risk for gastroesophageal reflux disease and its complications. Ann Intern Med 2005; 143(3): 199–211.
49. Kubo A, Corley DA. Body mass index and adenocarcinomas of the esophagus or gastric cardia: a systematic review and meta-analysis. Cancer Epidemiol Biomarkers Prev 2006; 15(5): 872–878.
50. Cook MB, Greenwood DC, Hardie LJ et al. A systematic review and meta-analysis of the risk of increasing adiposity on Barrett‘s esophagus. Am J Gastroenterol 2008; 103(2): 292–300.
51. Chow WH, Blaser MJ, Blot WJ et al. An inverse relation between cagA+ strains of Helicobacter pylori infection and risk of esophageal and gastric cardia adenocarcinoma. Cancer Res 1998; 58(4): 588–590.
52. Lukáš K. Vztah infekce Helicobacter pylori a refluxní choroby jícnu. Interní medicína pro praxi 2006; 2 : 76–78.
53. Whiteman DC, Parmar P, Fahey P et al. Association of Helicobacter pylori infection with reduced risk for esophageal cancer is independent of environmental and genetic modifiers. Gastroenterology 2010; 139(1): 73–83.
54. Rokkas T, Pistiolas D, Sechopoulos P et al. Relationship between Helicobacter pylori infection and esophageal neoplasia: a meta-analysis. Clin Gastroenterol Hepatol 2007; 5(12): 1413–1417.
55. Whiteman DC, Sadeghi S, Pandeya N et al. Combined effects of obesity, acid reflux and smoking on the risk of adenocarcinomas of the oesophagus. Gut 2008; 57(2): 173–180.
56. Lukáš K. Je hiátová hernie synonynem pro refluxní chorobu jícnu? Čes a Slov Gastroent a Hepatol 2004; 58(3): 110–115.
57. Kamangar F, Chow WH, Abnet CC et al. Environmental causes of esophageal cancer. Gastroenterol Clin North Am 2009; 38(1): 27–57.
58. Veugelers PJ, Porter GA, Guernsey DL et al. Obesity and lifestyle risk factors for gastroesophageal reflux disease, Barrett esophagus and esophageal adenocarcinoma. Dis Esophagus 2006; 19(5): 321–328.
59. Chen Z, Yang G, Zhou M et al. Body mass index and mortality from ischaemic heart disease in a lean population: 10 year prospective study of 220,000 adult men. Int J Epidemiol 2006; 35(1): 141–150.
60. Gammon MD, Schoenberg JB, Ahsan H et al. Tobacco, alcohol, and socioeconomic status and adenocarcinomas of the esophagus and gastric cardia. J Natl Cancer Inst 1997; 89(17): 1277–1284.
61. Jansson C, Johansson AL, Bergdahl IA et al. Occupational exposures and risk of esophageal and gastric cardia cancers among male Swedish construction workers. Cancer Causes Control 2005; 16(6): 755–764.
62. Engel LS, Vaughan TL, Gammon MD et al. Occupation and risk of esophageal and gastric cardia adenocarcinoma. Am J Ind Med 2002; 42(1): 11–22.
63. Jansson C, Jeding K, and Lagergren J. Job strain and risk of esophageal and cardia cancers. Cancer Epidemiol 2009; 33(6): 473–475.
64. Guo W, Blot WJ, Li JY et al. A nested case-control study of oesophageal and stomach cancers in the Linxian nutrition intervention trial. Int J Epidemiol 1994; 23(3): 444–450.
65. Gonzalez CA, Pera G, Agudo A et al. Fruit and vegetable intake and the risk of stomach and oesophagus adenocarcinoma in the European Prospective Investigation into Cancer and Nutrition (EPIC-EURGAST). Int J Cancer 2006; 118(10): 2559–2566.
66. Glade MJ. Food, nutrition, and the prevention of cancer: a global perspective. American Institute for Cancer Research//World Cancer Research Fund, American Institute for Cancer Research, 1997. Nutrition 1999; 15(6): 523–526.
67. Nutritional aspects of the development of cancer. Report of the Working Group on Diet and Cancer of the Committee on Medical Aspects of Food and Nutrition Policy. Rep Health Soc Subj (Lond) 1998; 48:i-xiv: 1–274.
68. Sapkota A, Hsu CC, Zaridze D et al. Dietary risk factors for squamous cell carcinoma of the upper aerodigestive tract in central and eastern Europe. Cancer Causes Control 2008; 19(10): 1161–1170.
69. Riboli E, Norat T. Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. Am J Clin Nutr 2003; 78 (3 Suppl): 559S–569S.
70. Thompson OM, Beresford SA, Kirk EA et al. Vegetable and fruit intakes and risk of Barrett‘s esophagus in men and women. Am J Clin Nutr 2009; 89(3): 890–896.
71. Leeuwenburgh I, Haringsma J, Van Dekken H et al. Long-term risk of oesophagitis, Barrett‘s oesophagus and oesophageal cancer in achalasia patients. Scand J Gastroenterol Suppl 2006; (243): 7–10.
72. Zendehdel K, Nyren O, Edberg A et al. Risk of esophageal adenocarcinoma in achalasia patients, a retrospective cohort study in sweden. Am J Gastroenterol 2011; 106(1): 57–61.
73. Corley DA, Kerlikowske K, Verma R et al. Protective association of aspirin/NSAIDs and esophageal cancer: a systematic review and meta-analysis. Gastroenterology 2003; 124(1): 47–56.
74. Rothwell PM, Wilson M, Elwin CE et al. Long-term effect of aspirin on colorectal cancer incidence and mortality: 20-year follow-up of five randomised trials. Lancet 2010; 376(9754): 1741–1750.
75. Dillner J, Knekt P, Schiller JT et al. Prospective seroepidemiological evidence that human papillomavirus type 16 infection is a risk factor for oesophageal squamous cell carcinoma. Bmj 1995; 311(7016): 1346.
76. Bjorge T, Hakulinen T, Engeland A et al. A prospective, seroepidemiological study of the role of human papillomavirus in esophageal cancer in Norway. Cancer Res 1997; 57(18): 3989–3992.
77. Han C, Qiao G, Hubbert NL et al. Serologic association between human papillomavirus type 16 infection and esophageal cancer in Shaanxi Province, China. J Natl Cancer Inst 1996; 88(20): 1467–1471.
78. Kamangar F, Qiao YL, Schiller JT et al. Human papillomavirus serology and the risk of esophageal and gastric cancers: results from a cohort in a high-risk region in China. Int J Cancer 2006; 119(3): 579–584.
79. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. Human papillomaviruses. IARC Monogr Eval Carcinog Risks Hum 2007; 90 : 1–636.
80. Smith M, Zhou M, Whitlock G et al. Esophageal cancer and body mass index: results from a prospective study of 220,000 men in China and a meta-analysis of published studies. Int J Cancer 2008; 122(7): 1604–1610.
81. Brown LM, Devesa SS. Epidemiology and risk of esophageal cancer: clinical. In: Jobe BA, Thomas C, Hunter JG. Esophageal Cancer: Principles and Practice. New York: Demos Medical Publishing 2009 : 103–113.
82. Zavoral M. Epidemiologie, screening, současná diagnostika a staging karcinomu jícnu. Bulletin HPB chirurgie 2008; 16(1–2): 9–10.
83. de Jonge PJ, Steyerberg EW, Kuipers EJ et al. Risk factors for the development of esophageal adenocarcinoma in Barrett‘s esophagus. Am J Gastroenterol 2006; 101(7): 1421–1429.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2011 Issue 5-
All articles in this issue
- Natural Orifice Transluminal Endoscopic Surgery (NOTES) – current status and our own experience
- Eosinophilic esophagitis
- Radiofrequency ablation in the GI tract – the “state of the art” in the Czech Republic and worldwide
- Prognostic factors and timing of endoscopy in acute non-variceal upper gastrointestinal bleeding
- Spontaneous retroperitoneal perforation of the ascending colon and portal vein thrombosis in a patient with ulcerative colitis
- Obituary for the prof. MUDr. Dagmar Hauftová, CSc.(2. 6. 1927–18. 7. 2011)
- A global problem with funding of health care system
- Biologic therapy on IBD 2011
- This country is not recommended for doctors
- The Society for Gastrointestinal Oncology would like to invite you to the 1st national congress on colorectal carcinoma
- Shall our path be without any vision?
- Welcome on board
- No benefit of autofluorescence in a diagnosis of low grade intraepitelial neoplasia in patients with Barrett´s oesophagus
- Two faces of oesophageal cancer – epidemiology and etiology
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eosinophilic esophagitis
- Two faces of oesophageal cancer – epidemiology and etiology
- Radiofrequency ablation in the GI tract – the “state of the art” in the Czech Republic and worldwide
- Prognostic factors and timing of endoscopy in acute non-variceal upper gastrointestinal bleeding
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

