-
Medical journals
- Career
Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí
: M. Lukáš 1,2; M. Bortlík 1,3
: Klinické a výzkumné centrum pro střevní záněty ISCARE Lighthouse a 1. LF UK Praha 1; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN Praha 2; Interní klinika 1. LF UK a ÚVN Praha 3
: Gastroent Hepatol 2011; 65(2): 56-64
: IBD: Review Article
Ačkoli prvotní příčina vzniku ulcerózní kolitidy (UC) zůstává navzdory více než stoleté historii této klinické jednotky neznámá, základní i klinický výzkum přináší množství nových poznatků o etiopatogenezi UC. Je zřejmé, že pro vznik UC je nezbytná vzájemná interakce vnitřních a zevních faktorů, které se v různé míře uplatňují u konkrétních jedinců. Mezi vnitřními faktory zaujímají klíčové postavení mikrobiální flóra střeva, buňky střevního epitelu a aktivita slizničního, resp. střevního imunitního systému. Odchylky ve složení a množství střevních mikroorganizmů u pacientů s UC oproti běžné populaci jsou označovány termínem dysbióza. Přestože metoda celogenomových asociačních studií významně navýšila počet identifikovaných genových lokusů souvisejících s UC, nemá genetické testování v současnosti pro klinickou praxi význam. Některé faktory zevního prostředí mohou souviset se vznikem UC, jiné zvyšují riziko relapsu u nemocných v remisi střevního zánětu. Do první skupiny patří některé nutrienty (nasycené mastné kyseliny), kouření a prodělaná apendektomie. Riziko relapsu zvyšuje psychický stres, některá farmaka (např. nesteroidní antirevmatika) a interkurentní infekce, především respirační. UC vzniká podle současných představ v důsledku změněné reaktivity imunitního systému střeva na komenzální mikrobiální střevní flóru u geneticky predisponovaných jedinců. Tzv. hygienická hypotéza patogeneze UC vysvětluje rozvoj zánětu střeva nedostatkem orální imunotolerance v důsledku omezené antigenní stimulace v časném postnatálním období. Podle Mařatkovy dvousložkové teorie vzniku UC navazuje na primární imunopatologický děj sekundární superinfekce ve sliznici střeva.
Klíčová slova:
ulcerózní kolitida – etiologie – patogeneze – střevní mikroflóraVěnováno památce prof. MUDr. Zdeňka Mařatky, DrSc.
Charakteristické rysy ulcerózní kolitidy
Klinické aspekty nemoci
Ulcerózní kolitida (UC) je společně s Crohnovou chorobou (CN) řazena do skupiny onemocnění, které označujeme souhrnným termínem idiopatické střevní záněty (IBD). Jedná se o chronické záněty, které vznikají z dosud nepoznané příčiny a mají jen částečně prozkoumanou patogenezi. Pro UC je charakteristické, že vždy postihuje sliznici rekta a šíří se směrem orálním, a to v různém rozsahu. Podle lokalizace zánětu na tlustém střevě se choroba rozlišuje do tří skupin: a) na proktitidu a distální (ohraničený) typ (E1 podle Montrealské klasifikace); b) levostranný typ (E2); a c) extenzivní nebo difuzní postižení tlustého střeva (E3). Aktivita nemoci je dána stupněm závažnosti klinických obtíží (tenesmy, krvácení, průjmy a celkové projevy), laboratorním a endoskopickým nálezem. Je rovněž členěna do tří skupin na aktivitou mírnou, střední a vysokou. Fulminantní ataka UC je v některých zemích samostatnou kategorií (USA), v jiných oblastech spadá do skupiny pacientů s vysokou aktivitou (EU). Závažnost (tíže nemoci) je dána především tím, jakým způsobem choroba omezuje život svého nositele a obvykle je založena na zhodnocení kvality života, schopnosti pracovat, založit rodinu a starat se o ni a pochopitelně také nutnosti chirurgické léčby a podávání dlouhodobé a potenciálně toxické medikamentózní terapie.
Charakteristickým, a do značné míry stereotypním klinickým symptomem UC je rektální syndrom tvořený opakovanými tenesmy s evakuací hlenu a krve. Průjmy se dostavují u nemocných s UC až při rozsáhlejším postižením tlustého střeva. Naopak, u pacientů s tzv. distálním (ohraničeným) tvarem nemoci jsou v popředí klinických obtíží tenesmy a zácpovitá stolice. U některých pacientů (10–20 %) jsou pozorovány vzdálené mimostřední projevy střevního zánětu. Tyto extraintestinální komplikace představují postižení kloubů (enteropatická artritida I. a II. typu), axiálního skeletu (sakroileitida); změny kožní (pyoderma gangrenózum) nebo oční projevy (episkleritidy a iridocyklitidy). Nejzávažnější mimostřevní komplikací je primární sklerózující cholangitida, která je detekována přibližně u 3–5 % nemocných s UC, většinou mužského pohlaví. Je ovšem otázkou, do jaké míry jde skutečně o mimostřevní projev UC a zda se nejedná spíše o samostatnou podskupinu nemocných, odlišnou od typické UC.
Incidence UC se pohybuje v širokém rozsahu 0,5 –24,5 na 100 000 obyvatel. Jsou důkazy pro to, že v ČR je výskyt nemoci podobný jako v západní Evropě, tedy kolem 6–12 případů/100 000 obyvatel [1,2]. Současná prevalence UC v západní Evropě je odhadována na 150–250/100 000 obyvatel. Podobně jako v případě CN má incidence i prevalence UC vztah k ekonomické situaci země. Nejnižší je v rozvojových zemích a nejvyšší v severní Americe, v západní a střední Evropě a Skandinávii. V zemích bývalého sovětského bloku, v jižní Evropě a v Asii incidence UC v posledních dvaceti letech stále vzrůstá, na rozdíl od západní Evropy a Skandinávie, kde je v posledních desetiletích stabilní.
Morfologie
Patologicko-anatomickým podkladem UC je chronický hemorhagický zánět sliznice tlustého střeva, který je histologicky charakterizován přítomností chronické „kulatobuněčné“ lymfoplazmocelulární infiltrace, jež je lokalizována především v bazálních vrstvách sliznice a také strukturálními změnami Lieberkűhnských krypt, které ztrácejí fyziologické, paralelní uspořádání a jsou deformované, větvené a chaoticky uspořádané. Následkem zánětu se v kryptách projevuje výrazný úbytek pohárkových buněk. V akutních fázích zánětu je přítomna polymorfonukleární infiltrace sliznice s pronikáním leukocytů do epitelu krypt (kryptitida) nebo kumulace zánětlivého infiltrátu v lumen krypt (kryptové abscesy). Přítomnost vředovitých defektů ve sliznici je, na rozdíl od CN, méně častá, většinou jde o povrchní eroze. Hluboké vředy zasahující až do svaloviny tlustého střeva jsou zcela výjimečné a můžeme se s nimi setkat pouze u nemocných s tzv. fulminantním průběhem UC. Destrukce krypt a chronický zánětlivý infiltrát jsou základními znaky odlišujícími UC od infekčně podmíněných zánětů tlustého střeva. Jde o následné změny vznikající při trvání zánětu déle než 6–8 týdnů. Difuzní zánětlivé změny sliznice, kumulace plazmocytů v bazální vrstvě sliznice, kryptové abscesy a nepřítomnost aktivovaných histiocytů a (mikro)granulomů odlišují histologicky UC od CN.
Ačkoli první zmínky o této nemoci pochází patrně již z roku 1859 od britského patologa Samuela Wilkse, tajemství jejího vzniku nebylo do současné doby odhaleno [3]. Zavedení nových technologií, včetně molekulární biologie do základního a aplikovaného výzkumu v posledních dvaceti letech přineslo i na tomto poli významné pokroky.
Etiologie
Mikrobiální střevní flóra
Podobnost UC s infekčně podmíněnými záněty tlustého střeva byla důvodem dlouhodobé snahy identifikovat mikroorganizmus, který je za vznik chronického střevního zánětu odpovědný. Až dosud však byly všechny tyto pokusy neúspěšné a vztah mezi přítomností určitého mikrobu a vznikem UC nebyl nikdy potvrzen. Infekční etiologie je proto v současné době přijímána velmi kriticky. Hlavní argumenty proti nepoznané infekční příčině UC jsou shrnuty v tab. 1.
1. Argumenty proti infekční etiologii UC. Tab. 1. Arguments against the infectious aetiology of UC. 
Současně je ovšem prokázáno, že přítomnost střevních mikrobů je důležitým předpokladem pro vznik IBD. Experimentální studie na bezmikrobních myších přinesly v minulých letech nezvratné důkazy o tom, že bez přítomnosti nepatogenní, komenzální střevní flóry nedochází ke vzniku chronického zánětu střeva ani u geneticky modifikovaných (tzv. knock-outovaných) myší a že různé bakteriální kmeny mají u těchto zvířat odlišnou schopnost vyvolat chronický zánět střeva.
V posledním desetiletí jsme získali nové poznatky a důkazy pro to, že abnormální reakce slizničního imunitního systému proti běžné střevní mikrobiální flóře je klíčovým momentem při indukci a udržování chronického průběhu střevního zánětu. Technikami molekulární biologie bylo zjištěno, že ve střevním lumen je přítomno až 1 000 různých mikrobiálních druhů. Počet bakteriálních kmenů a celkové množství mikrobů se v trávicím ústrojí aborálním směrem rapidně zvyšuje, v tlustém střevě převažují gramnegativní, anaerobní bakterie. Bakteriální populace má v tračníku denzitu 1012 na gram luminálního obsahu. Ačkoli standardně lze kultivovat pouze kolem 30 % bakteriálních druhů, nové techniky detekce mikrobů, jako je analýza bakteriální 16S-ribozomální RNA, polymerázová řetězová reakce, hybridizace in situ, flow-cytometrie a DNA microarray nebo DNA „chipová“ analýza významně zvýšily schopnost identifikace mikroorganizmů osídlujících trávicí ústrojí. U dospělých osob je bakteriální složení relativně stabilní a specifické pro každého jedince, pouze s malou fluktuací bakteriálních kmenů do 20 % [4,5].
Bakteriální osídlení trávicího ústrojí má zásadní význam při vývoji slizniční imunity tím, že mikrobiální antigeny stimulují imunokompetentní buňky (lymfocyty regulační i efektorové subpopulace, dendritické buňky) k expanzi určitých klonů tak, aby byla zajištěna rovnováha a probíhala dostatečně efektivní apoptóza lymfocytů. Bylo zjištěno, že grampozitivní bakterie preferenčně stimulují tvorbu interleukinu IL-12, kdežto gramnegativní organizmy indukují tvorbu IL-4. Důležitým objevem je, že gramnegativní bakterie a lipopolysacharid z nich uvolněný se významně spolupodílejí na navození fenoménu orální imunitní tolerance.
V posledních letech řada autorů potvrdila existenci tzv. dysbiózy u nemocných s IBD [6]. Tímto termínem jsou označovány změny ve složení střevní mikroflóry oproti zdravým jedincům. Je patrno především snížené množství mikrobů kmene Firmicutes, mezi něž patří například Lactobacilly a Clostridia. Ve střevním obsahu i bioptických vzorcích byla pozorována rovněž redukce Bifidobacterií. Naproti tomu stoupá podíl Proteobacterií (včetně různých kmenů E. coli) a Actinobacterií. Je zajímavé, že většina prací neprokazuje podstatné rozdíly v zastoupení výše uvedených mikrobiálních kmenů mezi nemocnými s UC a CN [7].
Osídlení střevní sliznice je determinováno především imunitním systémem hostitele a je pro každého jedince unikátní, nicméně se zdá, že od rané fáze života zůstává stabilní. Určité změny ve složení a poměru jednotlivých bakteriálních kmenů jsou také zaznamenávány u zdravých příbuzných pacientů s IBD. Nevyřešenou a možná klíčovou otázkou je, zda střevní dysbióza je příčinou vzniku UC, nebo spíše důsledkem chronicky probíhajícího zánětu. Význam bakteriální střevní flóry pro vznik UC může být shrnut do několika bodů, které jsou uvedeny v tab. 2. V tab. 3 jsou pak zmíněny hlavní faktory zevního prostředí, které mají významný vliv na bakteriální složení hostitele.
2. Význam mikrobiální střevní flóry v etiologii UC. Tab. 2. Role of intestinal microbionta in aetiology of UC. 
3. Faktory, které modifikují složení střevní mikroflóry a přispívají ke vzniku dysbiózy. Tab. 3. Factors modifying the intestinal bacterial profile and contributing to dysbiosis. 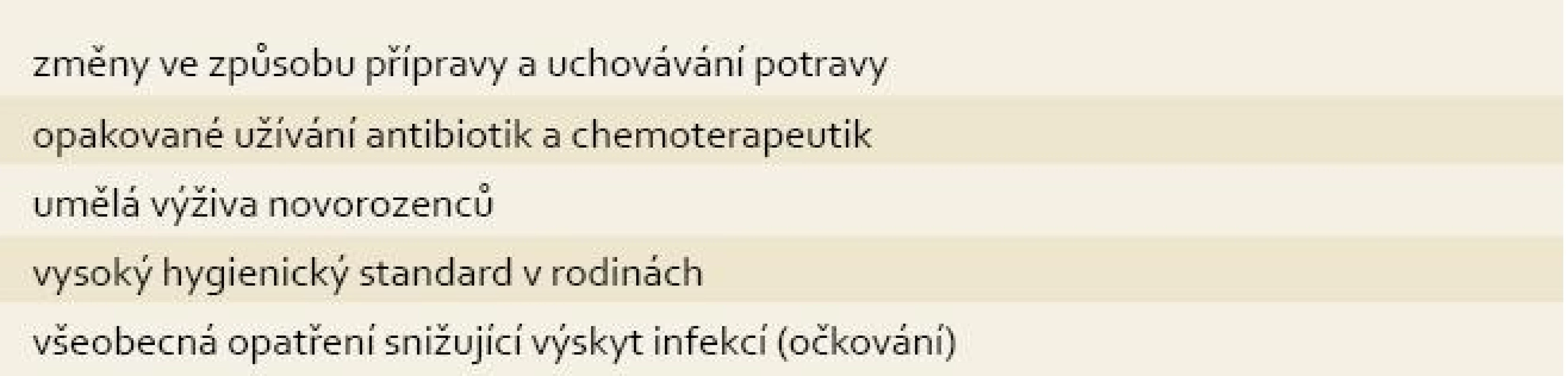
Z patogenetického hlediska se změny ve složení střevní mikroflóry uplatňují především dvěma způsoby: prvním je snížená tvorba mastných kyselin s krátkým řetězcem, především kyseliny máselné, hlavního nutrientu epiteliálních buněk tlustého střeva. Jejím nejdůležitějším producentem jsou Clostridia skupiny IV a XIVa vyskytující se u nemocných s UC ve sníženém množství. Butyrát je navíc významným inhibitorem exprese prozánětlivých cytokinů ve sliznici tračníku, tento mechanizmus rovněž přispívá k rozvoji a udržení zánětu střeva při jeho nedostatku. Druhým mechanizmem prozánětlivého efektu střevní dysbiózy je zvýšené množství kmenů označovaných zkratkou SRB (sulphate-reducing bacteria). Tyto kmeny produkují pro kolonocyty toxický sirovodík, který snižuje utilizaci butyrátu a blokuje fagocytózu patogenních mikrobů. Zvýšené množství tzv. SRB kmenů bylo zjištěno ve střevě pacientů s aktivní UC oproti zdravým kontrolám nebo pacientům v remisi UC [8].
Zvýšená invaze bakterií do sliznice u pacientů s UC (zvláště však s CN) koreluje se zvýšenými titry imunoglobulinů tvořených proti určitým bakteriálním antigenům. Některé z nich se v současné době využívají v klinické medicíně. Například k rozlišení mezi UC a CN lze využít stanovení anti-I2 protilátek (Peptostreptococcus anaerobius) nebo antiporinové protilátky namířené proti membránovému antigenu Escherichie coli (anti-OmpC). Byly zjištěny významné rozdíly v množství bakterií, které penetrovaly slizniční bariérou do střevní sliznice mezi pacienty s UC a zdravými jedinci. V případě UC je množství bakterií detekovatelných ve sliznici tlustého střeva významně vyšší proti zdravým kontrolám.
V některých případech lze využít příznivých vlastností střevních mikrobů i k terapeutickým účelům. Probiotické bakteriální kmeny (např. Escherichia coli kmen Nissle 1917) snižují tvorbu prozánětlivých působků, zvyšuji tvorbu defenzinů a indukují apoptózu aktivovaných lymfocytů. Podobným mechanizmem se uplatňuje probiotická směs VSL# 3, která obsahuje 1 kmen Streptococcus thermophillus, 3 kmeny Bifidobacterií a 4 kmeny Lactobacilů. Uvedená probiotika jsou používána v udržovací léčbě UC, resp. k profylaxi pouchitidy u nemocných s ileopouch--anální anastomozou.
Epiteliální buňky a slizniční imunita
V posledních letech byly popsány různé odchylky epiteliálních buněk (kolonocytů) u nemocných s UC. Distribuce zánětlivých změn v tlustém střevě u nemocných s UC (především rektum a distální část tračníku) představuje pro výzkumníky silný podnět zabývat se změnami ve struktuře a metabolizmu kolonocytů. Novým přístupem je monitorování interakce mezi epiteliálními buňkami a komenzální, nepatogenní mikrobiální střevní floróu. Kolonocyty, které pokrývají slizniční povrch tlustého střeva, jsou v živé, velmi komplikované a trvalé komunikaci s mikrobiální flórou. Výsledkem této interakce je (za fyziologických podmínek) imunitní tolerance na komenzální osídlení povrchu sliznice a naopak okamžité spuštění zánětlivé reakce při detekci patogenních mikrobů. Vzájemná interakce mezi kolonocyty a mikroby je zprostředkována řadou mechanizmů, jen zčásti objasněných. Mezi nejdůležitější patří systém tzv. „toll-like“ receptorů (TLR), které jsou exprimovány na povrchu epiteliální membrány a dále systém intracytosolických signálních proteinů (receptorů). Bakteriální ligandy (části bunečné membrány, DNA, organel) patogenních mikrobů se váží na příslušné receptory kolonocytů a indukují řetězovou reakci, která je zaměřena na syntézu a následné uvolnění celé plejády molekul, zahrnující cytokiny, eikosanoidy a antimikrobiální peptidy a vede k blokádě vstupu patogenního mikororganizmu do vnitřního prostředí hostitele. Existuje hypotéza, že porucha v rozpoznávání molekulárních znaků patogenní a fyziologické mikrobiální střevní flóry je odpovědná za vznik chronického zánětu sliznice tlustého střeva. Na povrchu kolonocytů jsou exprimovány různé typy TLR. Bylo identifikováno více než 10 savčích TLR receptorů, které jsou určeny k identifikaci různých bakteriálních struktur. Pro některé z nich (TLR 4 a 9) byly detekovány genové polymorfizmy, které se zvýšeně vyskytují u nemocných s UC, a mohou tedy přispívat ke vzniku choroby [9].
Antimikrobiální peptidy jsou malé, pozitivně nabité polypeptidy, které obsahují méně než 100 aminokyselin, avšak zaujímají klíčové místo při udržení sterilního prostředí sliznice. Jsou syntetizovány a vylučovány na povrch sliznic, kůže a do různých tělesných tekutin a vyskytují se ubikviterně u všech živých organizmů. Některé z nich se uplatňují především intracytosolicky. Dvě skupiny těchto peptidů – cathelicidiny a defenziny – mají významné antimikrobiální vlastnosti a zároveň velmi intenzivně komunikují s imunitním systémem hostitele. Ovlivňují řadu dalších komponent přirozeného imunitního systému, jako je chemotaxe neutrofilních leukocytů a aktivizace mastocytů. Defenziny jsou heterogenní peptidy, které jsou produkovány především Panethovými buňkami (α-defenziny) a kolonocyty (β-defenziny). Narozdíl od CN (terminálního ilea), jež je charakterizována sníženou expresí α-defenzinů (HD-5 a 6) , u nemocných s UC byla pozorována zvýšená produkce β-defenzinů 2, 3 a 4. Jedná se pravděpodobně o následek zvýšeného množství prozánětlivých cytokinů, a tedy jev nejspíše sekundární [10]. Problém spočívá v tom, že navzdory zvýšené produkci β-defenzinů ve sliznici tlustého střeva je jejich funkčnost snížena, protože chybí dostatečné množství kvalitního hlenu. Ten představuje kostru, na níž se antibakteriální peptidy drží. I když je tedy tvorba β-defenzinů kompenzatorně zvýšena, není tento mechanizmus v udržení neprostupnosti sliznice vůči bakteriím efektivní. U nemocných s CN postihující terminální ileum jsou aktivita a množství α-defenzinů výrazně sníženy, a proto je také bakteriální invaze do sliznice dramaticky vyšší, než je tomu u nemocných s UC. Tab. 4 shrnuje zásadní odchylky v metabolizmu a struktuře epiteliálních buněk u UC.
4. Abnormality epiteliálních buněk u UC. Tab. 4. Abnormalities of epithelial cells in UC. 
5. Argumenty pro vliv dědičnosti na vznik UC. Tab. 5. Arguments supporting a genetic basis in UC. 
Těsný kontakt mezi epiteliálními buňkami a imunitním systémem je odpovědný za nastolení a udržení homeostázy (klidového stavu) na slizničním povrchu, a to především díky komponentám přirozeného imunitního systému. Jak bylo již vysvětleno výše, komunikace jednotlivých složek angažovaných v patogenezi UC se odehrává hlavně přes TLR a intracelulární receptory. Patogenní bakterie stimulují tvorbu prozánětlivých cytokinů (TNF-α a interferon - α). V případě osídlení sliznice zdravých osob nepatogenními bakteriemi je stimulována tvorba regulačních cytokinů (TGF-β nebo IL-10). Epiteliální buňky mají důležitou úlohu nejen při formování přirozeného imunitního systému, ale také se podílejí na reakci získané protilátkové a buněčné slizniční imunity. Hlavním místem, kde se získaná imunitní reakce odehrává, jsou Payerovy pláty a lymfatické folikuly. Specializované dendritické buňky přenášejí bakteriální antigeny do lymfatické tkáně, kde je po jejich rozpoznání spuštěna klonální expanze T a B lymfocytů. Naivní T lymfocyty poté podléhají diferenciaci do Th1, Th2 nebo T regulačních (Th3,Tr1 nebo CD25+ CD4+) klonů. Uvedené buněčné subpopulace T lymfocytů mají zcela odlišné efektorové funkce. Zatímco Th1 odpověď, typická pro CN, je charakteristická zvýšenou produkcí interleukinů 12 (IL-12), 23 (IL-23), 27 (IL-27) a interferonu-γ (IFN-γ), v patogenezi UC se více uplatňuje aktivace Th2 lymfocytů a nadprodukce interleukinu 5 (IL-5) a transformujícího růstového faktoru β (TGF-β). Etiopatogeneze obou zánětů je však podstatně složitější proces a uvedené schéma zdůrazňující Th1 nebo Th2 diferenciaci je velkým zjednodušením celé problematiky.
Dědičnost
V současné době existuje řada důkazů dosvědčujících, že genetické vlohy pro vznik choroby (UC nebo CN) jsou nezbytným předpokladem k tomu, aby u stigmatizovaného jedince došlo ke klinickým projevům IBD. Obě nemoci mají komplexní genetické pozadí s tím, že se zde uplatňuje velké množství genů, které navíc vykazují značnou heterogenitu. V současnosti je známo více než 60 genových lokusů asociovaných s IBD, z toho přibližně třetina má vztah výhradně k ulcerózní kolitidě. Genetický vliv na vznik choroby je ovšem daleko silněji vyjádřen u CN než u UC. Získané geny, které svému nositeli „poskytují“ vhodný terén, se navíc vzájemně ovlivňují mezi sebou a jejich penetrace je modifikována působením zevních faktorů.
V posledních 15 letech byla provedena řada studií, které monitorovaly genové polymorfizmy u pacientů s určitými fenotypickými projevy IBD (tzv. „linkage studie“). Zásadním přínosem pro studium genetické podstaty IBD bylo zavedení nové techniky testování genomu – tzv. celogenomových asociačních studií (Genom-Wide Association, GWA). Výsledkem těchto snah je odhalení velkého množství kandidátních genových polymorfizmů, které by mohly predikovat riziko vzniku nemoci, klinický průběh a odpovídavost na léčbu. Několik rozsáhlých a na sobě nezávislých studií ukázalo, že NOD2/CARD 15 polymorfizmus není asociován s fenotypovými projevy UC, ale vyskytuje se výhradně u 30 % nemocných trpících CN, především v oblasti ileocékální, a to v bělošské populaci Evropy a Severní Ameriky [11].
Některé experimentální studie ukázaly, že polymorfizmus genu MDR-1 (multidrug resistence gene 1) je spojen se vznikem kolitidy u hlodavců. Další klinické výzkumy naznačily, že polymorfizmus tohoto genu (C3435T a G2677T/C) se častěji vyskytuje u nemocných postižených UC. Gen MDR-1 kóduje tvorbu tzv. P-glykoproteinu, který je odpovědný za přenos xenobiotik, a tedy i léčiv přes buněčnou membránu. Polymorfizmus tohoto genu může být odpovědný za tvorbu defektního P-glykoproteinu, který není schopen vykonávat svou základní funkci. Důsledkem tohoto stavu může být snížená schopnost buněk bránit se invazi bakterií a nitrobuněčné koncentraci některých léčiv (například kortikosteroidů). Bohužel jiné studie („case-control studie“) tyto velmi zajímavé výsledky nepotvrdily. V poslední době byla pozornost zaměřena také na kandidátní geny označené jako IBD 3 a IBD 6. IBD 3 je lokalizován na krátkém raménku 6 chromozomu (6p), kde je lokalizován celý komplex genů zúčastněných v řízení histokompatibility (tzv. HLA region). Ukazuje se, že HLA geny jsou velmi odlišné v závislosti na etnických skupinách vyšetřených probandů. V japonské populaci byl potvrzen rizikový gen pro vznik UC HLA-DRB1*1502, kdežto studie pocházející z Evropy (Oxford) prokázaly výskyt DRB1 *0103 jako prediktor rizika vzniku UC. Lokus IBD 6 zahrnuje geny kódující membránový protein označovaný jako integrin. Tato struktura je významná pro prostup leukocytů z krevního pólu do tkáně a také pro buňkami zprostředkovanou imunitu. Je pozorována asociace také mezi výskytem polymorfizmu genu pro jaderný faktor κB (NF-κB) a UC. Asociační studie zaměřené na polymorfizmy v oblasti promotorové části genu NF-κB1 na chromozomu 4q, který je součástí různých regulačních mechanizmů zahrnujících přirozenou i specifickou imunitu, růst buněk, apoptózu a buněčnou diferenciaci byly prováděny také u nemocných s UC. Autoři nalezli zvýšenou četnost 94ATTG delece NF-κB1 promotoru v bělošské populaci holandských pacientů s UC v porovnání s kontrolami. Homozygotní pacienti s -94ATTG delecí měli dřívější začátek nemoci než pacienti s UC bez tohoto znaku. Přesný mechanizmus, jakým se podílí mutace genu NFκB1 na časnější manifestaci UC, není znám. Spekuluje se o tom, že nedokonalá reaktivita přirozeného imunitního systému k bakteriálním antigenům (díky polymorfizmu genu NFκB1) je odpovědná za nízkou transkripci proteinů, které se podílejí na obraně před bakteriální infekcí, a důsledkem je pak zvýšená invaze bakterií do sliznice a spuštění chronické a nekontrolované zánětlivé reakce. Velmi intenzivně byly studovány geny kódující expresi „toll--like receptorů“ (TLR-4 a TLR-9) na povrchu lymfocytů, rovněž však s rozporuplnými výsledky [12–14].
Přes všechny nové poznatky přicházející z genetických studiích se ukazuje, že dosud známé genetické vlivy jsou sice podstatné pro vznik a chronický průběh nemoci, nemají však rozhodující roli. Výsledky genetických studií ukazují na to, že v případě IBD se jedná o komplexní, polygenní dědičnost s neúplnou a velmi rozdílnou penetrací. Další základní výzkum je nutný pro lepší pochopení všech mechanizmů, které se podílejí na vzniku a chronickém průběhu nemoci. Genetické testování je u UC i CN v současné době zatím nepoužitelné pro klinickou praxi.
Zevní faktory
Psychický stres
UC byla od 30. let minulého století považována za tzv. psychosomatické onemocnění. Velký důraz na tuto teorii byl kladen při renezanci psychosomatického učení v 50. letech 20. století. Psychoneuroimunologické studie skutečně přinesly důkazy pro to, že „behaviorální faktory“ (emoce, psychický stres) mohou velmi významně ovlivňovat imunitní systém jednotlivce v úrovni systémové odpovědi i lokální (slizniční) imunitní reakce. Nemocní s UC, kteří jsou v remisi, mají významně vyšší riziko exacerbace choroby, jsou-li vystaveni psychickému stresu nebo pokud se u nich vyskytne exogenní nebo endogenní depresivní porucha. Tyto výzkumné závěry jsou podpořeny také letitou klinickou zkušeností, která potvrzuje, že emocionálně nepříznivé (negativní) životní události, jako je ztráta blízkého člověka, rozvod, ztráta zaměstnání se mohou uplatnit jako moment provokující vzplanutí střevního zánětu. Ačkoli klinická zkušenost ukazuje, že terapeutické manipulace, které vedou ke snížení psychického stresu a snížení depresivních a úzkostných poruch, mohou příznivě ovlivnit průběh UC, klinická studie tento závěr nepotvrdila [15,16]. Je však zřejmé, že dobře designovanou a prospektivní klinickou studii, která by jednoznačně hodnotila vliv psychického stresu a psychických poruch na průběh UC, lze provést jen velmi obtížně.
Kouření a hormonální antikoncepce
UC postihuje zvláště nekuřáky a bývalé kuřáky. Kouření zlepšuje průběh UC a snižuje potřebu podávat orální kortikosteroidy či provedení kolektomie v porovnání s pacienty nekuřáky nebo bývalými kuřáky. Metaanalýza zahrnující několik velkých studií pacientů s UC ukázala, že kouření snižuje riziko nutnosti kolektomie o více než 40 % v porovnání s nekuřáky. Předpokládaný mechanizmus příznivého účinku kouření na průběh UC odkazuje na tvorbu a složení střevního hlenu, snížení tvorby prozánětlivých cytokinů, snížení napětí hladké svaloviny střeva a modifikaci permeability střevní sliznice pro různé makromolekuly. Vliv nikotinu a tabáku byl experimentálně studován v celkové i lokální aplikaci s rozdílnými a nekonzistentními výsledky. Zajímavé je, že vliv kouření je na obě nemoci (UC a CN) diametrálně odlišný, avšak prakticky shodný ve všech provedených studiích.
Vliv hormonální antikoncepce na průběhu UC se zdá být nevýznamný. Jsou k dispozici jen nekonzistentní data, některá z nich ukazují že používání perorálních kontraceptiv může zvyšovat riziko relapsu UC. Metaanalýza ukázala pouze nepatrné a klinicky zřejmě nevýznamné zvýšení rizika.
Dieta
Některé práce z poslední doby tvrdí, že nadměrná konzumace živočišných produktů a snížený příjem dietní vlákniny mohou být odpovědné za zvýšený výskyt obou chorob. Nejsilnější důkaz pro to, že živočišné produkty, zvláště tmavé maso, jsou nevhodné pro nemocné s UC, je velké množství sirných sloučenin v těchto surovinách. Sirné sloučeniny jsou substrátem pro tvorbu těkavých látek ze skupiny merkaptanů, které vykazují výrazný toxický vliv na epiteliální buňky tlustého střeva, mohou přímo alterovat funkci některých signálních proteinů a zvyšovat antigenicitu jiných sloučenin [17]. Tuto představu významně podporuje vzestup výskytu těchto onemocnění ve 2. polovině minulého století. Podle jedné z teorií mohou být za zvýšené riziko vzniku UC zodpovědné nasycené mastné kyseliny obsažené ve zvýšené míře v současné dietě západního typu. Tyto látky, kromě jiného, fungují jako agonisté TLR2 a TLR4, a mohou tak spustit zánětlivou reakci vedoucí k poškození střeva. Naopak, nenasycené mastné kyseliny s krátkým řetězcem blokují aktivaci signální cesty zprostředkované receptory ze skupiny TLR, a mohou tak riziko zánětu snížit. V klinické praxi ovšem stále platí, že vliv diety na průběh nemoci, výsledek léčby a snížení rizika chirurgického řešení však nebyl potvrzen.
Apendektomie
Osoby, které se podrobily apendektomii před 20. rokem života, mají menší pravděpodobnost vzniku UC v dospělosti. Negativní korelace mezi apendektomií a UC byla podpořena metaanlýzou zahrnující celkem 13 „case-control“ studií. Celkové „odds ratio“ 0,31 (95% CI: 0,25–0,38) potvrzuje, že provedení apendektomie v dětském nebo adolescentním věku poskytuje snížení rizika vzniku UC v dospělosti o 70 %. Jaký je mechanizmus profylaktického efektu apendektomie, opět nevíme. Někteří spekulují, že odstranění apendixu, ve kterém je velké množství lymfatické tkáně, může změnit poměr mezi regulačními a efektorovými subpopulacemi T lymfocytů. Tento koncept se zdá být podpořen také daty přicházejícími z experimentů na hlodavcích, u kterých po resekci céka dochází k vyvolání experimentální kolitidy ve významně nižším procentu něž u zdravých zvířat. Klinická pozorování ukazují, že nemocní s UC jsou méně náchylní ke vzniku akutní apendicitidy v porovnání se zdravými osobami. Provedení apendektomie u nemocných s chronickým, medikamentózně refrakterním průběhem proktitidy se však neukázalo být příliš efektivní.
Patogeneze
V současné době je všeobecně akceptována představa, že UC a CN vznikají v důsledku změněné reaktivity imunitního systému střeva na komenzální mikrobiální střevní flóru u geneticky predisponovaných jedinců. Ztráta imunitní tolerance hostitele vůči mikrobiálním agens vede ke vzniku chronické a nekotrolovatelné zánětlivé reakce. Slizniční rovnováha (hemostáza) mezi mohutným imunitním systém střeva a obrovským potenciálem luminálních mikrobiálních a potravinových antigenů je determinována genetickou výbavou hostitele.
Mařatkova dvousložková patogenetická hypotéza
Podrobné studie, které byly zaměřeny na periodický průběh nemoci, byly prováděny již od roku 1948. Do roku 1984 Mařatka analyzoval celkem 959 případů UC, které pozoroval společně s 303 pacienty s CN [18–20]. Jednalo se o českou populaci a diagnóza obou onemocnění byla u většiny pacientů provedena na základě klinického průběhu nemoci, irigografického vyšetření a rigidní rektoskopie. U každého pacienta byla vyloučena infekce. Na základě laboratorních a klinických studií provedených na těchto souborech nemocných byla již v roce 1948 Mařatkou postulována tzv. dvousložková hypotéza vzniku UC V pozdějších letech byla tato teorie dále rozpracována [21].
Základem dvousložkové hypotézy je představa, že neznámá primární složka vede ke vzniku hemorrhagického a katarálního zánětu sliznice tlustého střeva – vlastní UC. Tato primární příčina nemá jasný původ, předpokládá se vzájemná interakce genetické vlohy a abnormální imunitní reaktivity tak, jak bylo kdysi dokladováno přítomností protilátek proti kolonocytům. UC (podle Mařatky správněji idiopatická proktokolitida) je sama o sobě relativně mírné onemocnění, avšak s typickým periodickým průběhem. Sekundární komponentou UC jsou superponované změny na výše popsané primární odchylky, které jsou vyvolány nespecifickou infekční příčinou střevními mikroorganizmy. Tento druhý „zásah“ je pak odpovědný za vznik těžce probíhající a extenzivní formy UC s lokálními a systémovými změnami a dlouhodobými následky. Tyto druhotné změny potlačují charakteristický morfologický vzhled (katarální zánět) a také periodický průběh zánětu, rovněž histologické změny jsou u těchto forem nemoci diametrálně odlišné od jejich časných fází.
Potenciálním nedostatkem této hypotézy je klinická zkušenost, že pacienti s těžkou formou UC dlouhodobě neprofitují z antibiotické terapie. Tato hypotéza rovněž nedokáže vysvětlit ostrý předěl mezi zdravou a zánětlivou změnou sliznice, která je pro pacienty s UC tak typická. Mařatka preferoval termín idiopatická proktokolitida, který sice z terminologického hlediska správněji vystihuje podstatu a charakter nemoci, je však neznámým pojmem především v anglosaské literatuře. I z tohoto důvodu považujeme označení UC za vhodnější.
Hygienická hypotéza
Výskyt UC v ekonomicky vyspělých zemích Evropy a Severní Ameriky je rozhodujícím argumentem pro tzv. hygienickou hypotézu. Tato představa je založena na tom, že současné děti v ekonomicky vyspělých zemích od útlého dětství žijí v extrémně čistém prostředí, které má negativní dopad na formování jejich imunitního systému a predisponuje ke vzniku imunitně podmíněných onemocnění. Důležitou úlohu pro formování a maturaci střevního imunitního systému měli před desítkami či stovkami let červi, kteří pravidelně osídlovali trávicí trakt malých dětí. V současné době máme důkazy, že právě červi příznivě ovlivňují imunitní systém střeva a brání překotné až excesivní imunitní reakci na antigeny přicházející z lumen střeva. Hypotéza, která je v anglosaském písemnictví parafrázovaná názvem „old friends hypothesis“ vlastně dotváří výše uvedené. Je založena na předpokladu, že změny spektra a četnosti výskytu infekčních onemocnění vedly k dramaticky vyšší incidenci střevních zánětů a také ostatních imunitně zprostředkovaných chorob. Mnohočetné receptory na povrchu buněk zúčastněných v systému přirozené imunity jsou schopné rozpoznat nejrůznější „staré přítele“, jako jsou laktobacily, některé červy, saprofyticky rostoucí mykobakteria a jiné mikroorganizmy bez toho, aby indukovaly další reakce ze strany imunitního systému. Je to důsledkem skutečnosti, že mikroorganizmy provázely člověka v jeho fylogenetickém vývoji po tisíce let. Antigeny těchto mikrobů jsou důležité ke stimulaci dendritických buněk a vedou k jejich maturaci. Nezralé dendritické buňky mohou aktivovat a nadměrně stimulovat jiné regulační buňky, které pak nesou odpovědnost za porušení rovnováhy mezi Th1 a Th2 subpopulacemi lymfocytů a regulačními efektovými T lymfocyty. Za fyziologických podmínek se imunokopetentní buňky mohutného lymfatického systému střeva nezúčastní žádné reakce na přicházející antigeny díky tomu, že jsou vyzrálé a připravené zkušeností se „starými přáteli“ (bohatou mikrobiální střevní flórou). Za patologického stavu se vyvíjí abnormální reakce, při které imunokompetentní buňky, neznalé a nevystavené vlivu mikrobiální střevní flóry v časné fázi života, indukují trvalou zánětlivou reakci ve sliznici střeva. Přechod od imunitní tolerance k agresivní imunoreaktivitě je vyvolán nadměrnou a neadekvátní stimulací systému přirozené a následnou stimulací získané (adaptivní) imunity. Tyto představy jsou důležité pro posouzení významu střevní flóry za patologického stavu (dysbióza) i pro nové možnosti léčby [22,23].
Závěr
Navzdory enormnímu úsilí a také nezpochybnitelnému pokroku ve 2. polovině minulého století a v prvním desetiletí nového milénia zůstává zkoumání etiologie a patogeneze UC nezodpovězena. Hlavní nevyřešené problémy zahrnují také další otázky: proč je UC onemocněním pouze sliznice a proč má tak variabilní klinické projevy co do lokalizace, rozsahu, aktivity a průběhu? Jaké jsou příčiny relapsů UC? Jedná se skutečně o jednu chorobnou jednotku, nebo různé vyvolávající faktory navozují stereotypní změny na sliznici střeva, podobný morfologický nález a obtížně rozlišitelné klinické projevy?
V současné době se zdá nepravděpodobné, že jediný klinický přístup k léčbě těchto pacientů bude všeobecně a u každého pacienta úspěšný a také proveditelný. Naděje do budoucnosti spočívá v přísné individualizaci léčby, která bude zaměřena na dominantní antigen, na korekci zjistitelného genetického defektu, na snížení propustnosti slizniční bariéry, na eliminaci luminálních antigenů v průběhu manipulace s bakteriální střevní flórou nebo na aplikaci cílených molekul blokující to zásadní místo vedoucí k rozvoji a amplifikaci zánětu. Je slibný předpoklad, že nové léčebné postupy budou mít v budoucnosti významně vyšší terapeutickou efektivitu než je tomu dnes.
Addendum
V roce 2006 jsme společně s profesorem Mařatkou publikovali v britském časopise The Postgraduate Medical Journal přehledný článek, který se týkal nových poznatků o etiologii a patogenezi UC. Byla to poslední publikace, na které jsme měli tu čest se s legendárním gastroenterologem podílet. Od té doby jsem se s panem profesorem ještě mnohokrát sešel, a to u příležitosti domácích nebo zahraničních odborných sympozií. V prosinci 2009 tomu bylo naposledy v průběhu Národního kongresu České gastroenterologické společnosti v Praze. Tehdy mi profesor Mařatka trochu vyčinil, proč jsem ještě zmíněné review, které bylo publikováno v zahraničí, nepřeložil, nedoplnil a nezveřejnil v českém písemnictví. Tehdy jsem panu profesorovi slíbil, že to určitě udělám, ale stále na to nebylo dostatek času. Vracím se k tomuto slibu se zpožděním až v roce 2011. Zveřejněním a doplněním původně anglické verze článku jsme učinili v době, kdy vzpomínáme prvního výročí úmrtí (25. března 2010) zakladatele české gastroenterologie a uznávaného světového odborníka na střevní záněty, který je v mezinárodním písemnictví navždy zapsán jako tvůrce originální hypotézy vzniku ulcerózní kolitidy. I když je tato představa stará bezmála 65 let, je stále vysoce aktuální a nic neztratila na zajímavosti, logice a dokládá neuvěřitelné syntetické a pozorovací schopnosti stejně jako tvůrčího ducha muže, který ji kdysi ve druhé polovině čtyřicátých let minulého století vytvořil a celý život zdokonaloval.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrum pro střevní záněty
ISCARE Lighthouse a 1. LF UK, Praha
Jankovcova 1569/2c, 170 00 Praha 7
milan.lukas@email.cz
Sources
1. Lakatos L, Lakatos LP. Is the incidence and prevalence of inflammatory bowel diseases increasing in Eastern Europe? World J Gastroenterol 2006; 12(38): 6102–6108.
2. Burisch J, Cukovic-Cavka S, Kaimakliotis I et al. Construction and validation of a web-based epidemiological database for inflammatory bowel diseases in Europe An EpiCom study. Journal Crohn´s Colitis 2011; doi:10.1016/j.crohns.2011.02.016
3. Wilks S. The morbid appearance of the intestine of Miss Banks. Med Times Gazette 1859; 2 : 264–269.
4. Swidsinski A, Ladhoff A, Pernthaler A et al. Mucosal flora in inflammatory bowel disease. Gastroenterology 2003; 124(Suppl 1): S1370.
5. Marteau P, Lepage P, Mangin I et al. Review article: gut flora and inflammatory bowel disease. Aliment Pharmacol Ther 2004; 20(Suppl 4): S18–S23.
6. Tamboli CP, Neut C, Desreumax P et al. Dysbiosis in inflammatory bowel disease. Gut 2004; 53(1): 531–534.
7. Fava F, Danese S. Intestinal microbiota in IBD: Friend of foe? World J Gastroenterol 2011; 17(5): 557–566.
8. Pitcher MC, Beatty ER, Cummings JH. The contribution of sulphate reducing bacteria and 5-ASA to faecal sulphide in patients with ulcerative colitis. Gut 2000; 46(1): 64–72.
9. Cairo E. Toll-like receptors in inflammatory bowel diseases. Inflamm Bowel Dis2010; 16(9): 1583–1597.
10. Wekhmap J, Stange E. Paneht´s disease. Journal Crohn´s Colitis 2010; 4(5): 523–531.
11. Vermeire S, Rutgeerts P, Van Steen K et al. Genome wide scan in a Flemish inflammatory bowel disease population: support for the IBD4 locus, population heterogeneity, and epistatis. Gut 2004; 53(7): 980–986.
12. Borm MEA, Van Bodegraven AA, Mulder CJJ et al. A NFKB1 promoter polymorphism is involved in susceptibility to ulcerative colitis. Int J Immunogenet 2005; 32(6): 401–405.
13. Franchimont D, Vermeire S, El Housni H et al. Deficient host-bacteria interactions in inflammatory bowel disease? The toll-like receptors (TLR)-4 Asp299gly polymorphism is associated with Crohn‘s disease and ulcerative colitis. Gut 2004; 53(7): 987–992.
14. Thompson AI, Lees CW, Genetics of UC. Inflammm Bowel Dis 2011; 17(3): 831–848.
15. Mittermaier C, Dejaco C, Waldhoer T et al. Impact of depressive mood on relapse in patients with inflammatory bowel disease: a prospective 18-month follow-up study. Psychosom Med 2004; 66(1): 79–84.
16. Bitton A, Sewitch MJ, Peppercorn MA et al. Psychosocial determinants of relapse in ulcerative colitis: a longitudinal study. Am J Gastroentrol 2003; 98(10): 2203–2208.
17. Tilg H, Kaser A. Diet and relapsing ulcerative colitis: take off the meat? Gut 2004; 53(10): 1399–1401.
18. Maratka Z, Wagner V. The treatment of non-specific ulcerative colitis by autogenous vaccine. Correlated bacteriological and immunological studies. Gastroenterology 1948. 1134–1149.
19. Maratka Z, Spellberg MA. Observations on the clinical course of nonspecific ulcerative colitis. Gastroenterology 1949. 1279–86.
20. Maratka Z, Nedbal J, Kocianova J et al. Incidence of colorectal cancer in proctocolitis: a retrospective study of 959 cases over 40 years. Gut 1985; 26(1): 43–49.
21. Maratka Z. Colitis ulcerosa. Praha: Unie 1948.
22. Maratka Z. Pathogenesis and aetiology of inflammatory bowel disease. In: DeDombal FT, Myren J, Bouchier IAD, Watkinson G, eds. Inflammatory bowel disease. Oxford: Oxford University Press, 1986 (1st ed.), 1993 (2nd ed.).
23. Maratka Z. The role of intestinal bacteria in the pathogenesis of inflammatory bowel diseases. A two-component hypothesis. Folia Gastroenterol Hepatol 2003; 1 : 6–11.
24. Rogler G. Update in inflammatory bowel disease pathogenesis. Curr Opin Gastroenterol 20(4): 311–317.
25. Rook GAW, Brunet LR. Chronic inflammatory disorders, the gut and “Old Friends” hypothesis. In: Colombel JF, Scholmerich J, Vucelic B, eds. Inflammatory bowel disease: translation from basic research to clinical practice. Falk Symposium Vol 140. Berlin: Springer, 2005 : 43–58.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2011 Issue 2-
All articles in this issue
- What prof. Mařatka wrote also about
- The jubilee year
- Aetiology and pathogenesis of ulcerative colitis. Still more questions than clear answers
- Recommended procedure for small bowel examination in patients with Crohn’s disease
- Influence of albuminemia on the pharmacokinetics of infliximab in patients with inflammatory bowel diseases
- Biological treatment of patient with ulcerative colitis during pregnancy
- 10th anniversary of founding of the ECCO and 6th ECCO congress in Dublin
- Endoscopic submucosal dissection in the treatment of recurrent high-grade neoplasia of the rectum
- Obtaining biopsies during endoscopic investigation of the gastrointestinal tract for selected inflammatory disorders
- Quantitative testing in colorectal cancer screening – a view of the near future
- Gastrointestinal manifestation of Henoch-Schönlein purpura mimicking acute pancreatitis
- Highlights of the 15th Hradec days of gastroenterology and hepatology
- Interview with prof. dr. Petr Dítě, DrSc., the president of EAGE (European Association for Gastroenterology and Endoscopy) and the director of 7th course EAGE for young gastroenterologists
- Ostrava live endoscopy March 18th 2011
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obtaining biopsies during endoscopic investigation of the gastrointestinal tract for selected inflammatory disorders
- Recommended procedure for small bowel examination in patients with Crohn’s disease
- Quantitative testing in colorectal cancer screening – a view of the near future
- Aetiology and pathogenesis of ulcerative colitis. Still more questions than clear answers
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

