-
Medical journals
- Career
Racionalizácia predošlej liečby viacerými podaniami inzulínu prechodom na fixnú kombináciu bazálneho inzulínu degludek a agonistu GLP1-receptorov liraglutid (IDegLira): výsledky štúdie SIMPLIFY po 14 týždňoch
Authors: Emil Martinka 1; Rid Dravecká 2; Ivan Tkáč 3
Authors‘ workplace: Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa 1; I. interná klinika LF UPJŠ a UNLP Košice 2; Excelentný tím pre výskum aterosklerózy (EXTASY), IV. interná klinika LF UPJŠ a UN LP Košice 3
Published in: Forum Diab 2022; 11(Supplementum 1): 6-14
Category:
Overview
Charakeristiky a cieľ štúdie: Nerandomizovaná, otvorená, multicentrická, prospektívna štúdia s jedným ramenom, v podmienkach reálnej klinickej praxe (RWE – Real World Evidence), s cieľom vyhodnotiť, či prechod z liečby v schéme bazálny inzulín + prandiálne bolusy inzulínu (IIT – intenzifikovaná inzulínová terapia) na liečbu fixnou kombináciou bazálneho analógu inzulínu degludek a agonistu GLP1-receptorov liraglutidu (IDegLira) u pacientov s diabetes mellitus 2. typu (DM2T) je vo vzťahu ku glykemickej kompenzácii, telesnej hmotnosti, krvnému tlaku a hladinám krvných tukov aspoň tak efektívna ako predošlá liečba IIT. Analýza výsledkov po prvých 14 týždňoch. Súbory a metódy: Do štúdie bolo zaradených 147 pacientov s DM2T v trvaní > 5 rokov, na liečbe IIT > 12 mesiacov, s HbA1c > 7 %, so zachovanou sekréciou inzulínu a celodennou dávkou inzulínu (CDDI) < 0,7 IU/kg telesnej hmotnosti, resp. < 70 IU/deň. Pri pôvodnej liečbe IIT a následne po 14 týždňoch liečby po prechode na IDegLira boli porovnávané parametre glykemickej kompenzácie (HbA1c, glykémie v glykemických profiloch). V podskupine 31 pacientov bolo vykonané kontinuálne monitorovanie glukózy v intersticiálnej tekutine (CGM – Continuous Glucose Monitoring) a bol vyhodnotený aj podiel dňa, ktorý pacient strávil v príslušnom rozmedzí koncentrácie glukózy podľa medzinárodného konsenzu pre Time in Range (International Consensus on Time in Range). Z ďalších ukazovateľov bola meraná telesná hmotnosť (TH) a index telesnej hmotnosti (BMI – Body Mass Index), krvný tlak a hladiny krvných tukov, výskyt hypoglykémií a dávky inzulínu. Z IIT na IDegLira boli pacienti prevedení v rámci jedného sedenia s iniciálnou dávkou IDegLira do 16 DJ s následnou titráciou ± 2–4 DJ/3 dni. Výsledky: Analýza výsledkov po prvých 14 týždňoch liečby ukázala, že prechod z IIT na fixnú kombináciu IDegLira sa združoval so signifikantným zlepšením klasických parametrov glykemickej kompenzácie (HbA1c, glykémie v glykemických profiloch) a aj nárastom času dňa, ktorý pacient strávil v cieľovom rozmedzí koncentrácie glukózy 3,9–10,0 mmol/l (TIR – Time In Range) a poklesom času dňa nad týmto cieľovým rozmedzím (TAR – Time Above Range), ktoré však nenabudli štatistický význam. Združoval sa tiež so signifikantným poklesom telesnej hmotnosti, BMI, systolického krvného tlaku, krvných tukov (triglyceridy, celkový cholesterol a LDL-cholesterol), signifikantnou redukciou počtu hypoglykémií ako aj podielu pacientov s hypoglykémiou podľa selfmonitoringu a signifikantným poklesom podielu času dňa, ktorý pacient strávil pod cieľovým rozmedzím (TBR – Time Below Rang) v CGM a signifikantným poklesom dávok inzulínu. Záver: Prechod z IIT na IDegLira u pacientov s DM2T s HbA1c > 7 %, CDDI < 70 IU a zachovanou sekréciou inzulínu je efektívny, bezpečný a pre pacienta menej náročný spôsob liečby, benefit ktorého sa prejavuje už po 14 týždňoch liečby.
Klíčová slova:
diabetes mellitus 2. typu – IDegLira – CGM – intenzifikovaná liečba inzulínom – simplifikácia liečby
Úvod
Intenzívna liečba inzulínom (IIT Intensive Insulin Therapy) v 4–5 denných podaniach je zvyčajne poslednou možnosťou liečby pacienta s diabetes mellitus 2. typu (DM2T), ku ktorej sa donedávna pristupovalo po zlyhaní liečby perorálnymi antidiabetikami (PAD) alebo bazálnym, resp. bifazickým inzulínom. IIT je však pre pacienta pomerne náročný spôsob liečby, keď okrem viacerých injekčných podaní, zvýšených nárokov na frekvenciu selfmonitoringu glykémií a náročné zladenie so stravovaním a fyzickou aktivitou sa združuje aj s najvyšším rizikom hypoglykémie a prírastku na hmotnosti, čo môže viesť k horšej adherencii pacienta k liečbe. Tieto pomerne časté situácie limitujú dosiahnutie optimálnej glykemickej kontroly a zvyšujú morbiditno-mortalitné riziko, ktoré je u týchto pacientov zvyčajne veľmi vysoké.
Hoci logickou a najčastejšou indikáciou pre substitučnú liečbu inzulínom by aj u DM2T mal byť najmä nedostatok vlastnej sekrécie inzulínu, IIT sa mnohokrát začínala predčasne, ako riešenie z núdze alebo nedostatku iných terapeutických možností, v čom sa však v súčasnosti situácia zásadne zmenila zaradením novších skupín antidiabetík, ako sú agonisty GLP1-receptorov (GLP1-RA) a inhibítory sodíkovo-glukózového kotransportéru 2 (SGLT2i). Obe skupiny sa stali preferovaným výberom nielen v úvode liečby DM2T, ale GLP1-RA sú preferovanou voľbou aj pri intenzifikácii predošlej liečby bazálnym inzulínom [1]. Kým intenzifikácia predchádzajúcej liečby bazálnym inzulínom pridaním GLP1-RA sa stala odporúčaným štandardom [2], zmene liečby z IIT na kombináciu bazálneho inzulínu a GLP1-RA sa zatiaľ venovalo menej štúdií, hoci s veľmi povzbudivými výsledkami.
Väčšina pacientov, ktorí už sú liečení komplexnými inzulínovými režimami, má zachovanú vlastnú sekréciu inzulínu, ktorá je normálna alebo zvýšená [3], a potreba kompletnej substitučnej liečby inzulínom formou IIT je preto otázna. Naviac, liečba inzulínom môže v dôsledku viacerých už spomenutých nežiadúcich efektov viesť k rôznym klinickým komplikáciám. Napokon, z klinickej praxe je známa aj pomerne častá situácia, keď od určitého momentu (dávky) sa ďalšia up-titrácia inzulínu už stáva neefektívna, a navyše vedie k preinzulínovaniu a indukcii sekundárnej inzulínovej rezistencie. To celú situáciu ďalej komplikuje.
U mnohých pacientov už liečených IIT je preto vhodné potrebu a vhodnosť kompletnej substitučnej liečby inzulínom prehodnotiť. Jedným z možných efektívnych riešení je prechod na kombináciu bazálneho inzulínu a GLP1-RA [4]. Takáto liečba totiž využíva efekt dvoch účinných látok, ktoré sa navzájom vhodne dopĺňajú. Bazálny inzulín okrem iného prispieva k supresii hepatálnej produkcie glukózy, podporuje vychytávanie glukózy kostrovým svalom a šetrí (odľahčuje) vlastnú sekréciu inzulínu pankreasom. GLP1-RA poskytujú komplexný metabolický efekt. Stimulujú prirodzenú od koncentrácie glukózy závislú sekréciu inzulínu, a teda aj fyziologickú cestu účinku inzulínu ako i supresiu glukagónu, čím prispievajú k potlačeniu hepatálnej produkcie glukózy a vychytávaniu glukózy kostrovým svalom. Navodzujú pocit sýtosti a spomaľujú vyprázdňovanie žalúdka, čím uľahčujú spracovanie glukózy v postprandiálnom období. Preukazujú tiež priaznivý efekt na telesnú hmotnosť, endokrinnú dysfunkciu tukového tkaniva, chronický subklinický zápal a viaceré mechanizmy zúčastnené v rozvoji aterosklerózy (priaznivý efekt na hladiny krvných tukov, krvný tlak, funkcie endotelu a ďalšie), ktorej progresiu tak spomaľujú a majú aj potvrdený kardio-cerebro-nefroprotektívny efekt, čím prispievajú k redukcii morbidity a mortality [5–7]. Fixná, titrovateľná kombinácia oboch látok okrem toho zjednodušuje spôsob liečby redukciou počtu podaní, redukciou dávky inzulínu ako aj elimináciou nežiaducich účinkov, ako je prírastok na hmotnosti a riziko hypoglykémie pri liečbe IIT. Nezanedbateľnou výhodou liečby fixnou kombináciou oproti inzulínu v režime IIT je tiež menšia náročnosť na frekvenciu selfmonitoringu glykémií a voľnejšie zladenie so stravovaním a fyzickou aktivitou. Takýmto prípravkom je aj fixná kombinácia bazálneho analógu inzulínu degludek a GLP1-RA liraglutidu (IDegLira). Podľa viacerých autorov, vrátane slovenskej analýzy, je liečba IDegLira vs IIT aj cost-benefit efektívna [8].
Cieľom prezentovanej štúdie bolo vyhodnotiť, či prechod z IIT na IDegLira u pacientov s DM2T so zachovanou sekréciou inzulínu je pre kontrolu glykémie, krvných tukov, telesnej hmotnosti, krvného tlaku, výskytu hypoglykémií a variability glykémií aspoň tak efektívny a bezpečný ako predchádzajúca liečba inzulínom.
Pacienti a metódy
Ide o nerandomizovanú, otvorenú, multicentrickú, prospektívnu štúdiu s jedným ramenom, v podmienkach bežnej klinickej praxe s cieľom vyhodnotiť, či prechod z IIT na liečbu fixnou kombináciou IDegLira u pacientov s DM2T so zachovanou tvorbou inzulínu je pre kontrolu glykémie, krvných tukov, telesnej hmotnosti, krvného tlaku, výskytu hypoglykémií a variability glykémií aspoň tak efektívny a bezpečný ako predchádzajúca liečba IIT.
Do štúdie bolo zaradených 147 pacientov, ktorí spĺňali zaraďovacie a vylučovacie kritériá.
Zaraďovacie kritériá
Každý zaradený pacient podpísal informovaný súhlas podľa zásad správnej klinickej praxe (GCP – Good Clinical Practice). Zaradení boli pacienti s diabetes mellitus 2. typu (DM2T) vo veku > 18 < 80 rokov, v trvaní diabetu minimálne 60 mesiacov (5 rokov), ktorí boli v čase zaradenia liečení inzulínom v režime bazálny inzulín + prandiálne bolusy (IIT) v trvaní aspoň 12 mesiacov (1 rok) pred zaradením. Ďalšími podmienkami pre zaradenie bola neuspokojivá glykemická kompenzácia charakterizovaná HbA1c > 7,0 % podľa štandardu DCCT, celodenná dávka inzulínu (CDDI) < 0,7 IU/kg telesnej hmotnosti (TH), nie však viac ako 70 IU/deň, hladina C-peptidu v sére > 0,3 nmol/l (pri norme 0,27–1,27 nmol/l alebo ekvivalent pri inom vyjadrení normy), BMI > 25 kg/m2, schopnosť a ochota pacienta vykonávať pravidelný selfmonitoring glykémií (SMBG – Self-Monitoring of Blood Glucose) glukomerom z kapilárnej krvi.
U časti pacientov (n = 31) sa realizoval aj kontinuálny monitoring koncentrácie glukózy v intersticiálnej tekutine (CGM – Continuous Glucose Monitoring) za účelom hodnotenia podielov času dňa strávených pacientom v príslušných koncentráciách glukózy podľa medzinárodného konsenzu Time In Range (TIR) [13], výskytu hypoglykémií a variability glykémií. V tejto podskupine bola podmienkou aj schopnosť a ochota pacienta vykonávať CGM.
Vylučovacie kritériá
Do štúdie neboli zaraďovaní pacienti, ktorí na liečbe IIT mali HbA1c < 7 %, ktorú pacient dobre zvládal, bez nežiaducich prejavov liečby inzulínom. Ďalšími vylučovacími kritériami bola kontraindikácia/intolerancia inzulínu degludek alebo GLP1-RA, alebo kontraindikácia/intolerancia prípravku IDegLira podľa SPC. Do štúdie neboli zaradení ani pacienti s nízkou hladinou C-peptidu (< 0,3 nmol/l), s podozrením na DM1T (vrátane formy LADA), s prejavmi katabolizmu, s BMI < 25 kg/m2, s významnou necielenou stratou hmotnosti, s eGF < 15 ml/min/1,73 m2 a celkovým zlým klinickým stavom pacienta limitujúcim účasť v štúdii.
Sledované výsledky
Primárny ukazovateľ
Zmena HbA1c a telesnej hmotnosti oproti východiskovej hodnote po 14 týždňoch liečby IDegLira, v skupine využívajúcej CGM aj zmena v parametroch TIR, variabilita glykémií a počet hypoglykémií po 14 týždňoch oproti východiskovej situácii.
Sekundárne ukazovatele
Zmena CDDI (celková denná dávka inzulínu), glykémií v 7-bodovom glykemickom profile, krvného tlaku a krvných tukov po 14 týždňoch zmenenej liečby v porovnaní s hodnotami na pôvodnej liečbe. Ďalšími hodnotenými parametrami bol výskyt symptomatických potvrdených hypoglykémií < 3,9 mmol/l) a závažných hypoglykémií a podiel pacientov s aspoň jednou epizódou hypoglykémie za posledný mesiac. Hypoglykémie boli vyhodnocované jednak na základe údajov/záznamov pacienta, jednak na základe monitorovania CGM počas 2 týždňov. Zaznamenávané a vyhodnocované boli tiež akékoľvek nežiaduce udalosti a dôvody v prípade predčasného ukončenia štúdie.
U pacientov, u ktorých sa realizoval CGM, bol použitý systém Abbot FreeStyle Libre Pro iQ. Zvolená bola zaslepená verzia CGM s monitorovaním a nahrávaním počas 14 dní. Zaslepená forma CGM eliminovala cielené zásahy pacienta do liečby. Výsledky sledovaných parametrov boli vyhodnotené v čase zaradenia na pôvodnej liečbe IIT a po 14 týždňoch od zmeny liečby na IDegLira.
Priebeh štúdie
Pacient, ktorý podľa hodnôt klinických a laboratórnych parametrov z obdobia do 3 mesiacov pred plánovaným skríningom spĺňal zaraďovacie a vyraďovacie kritériá a prejavil predbežný záujem o účasť v štúdii, bol pozvaný na návštevu (Visit) V-1, náplňou ktorej bolo získanie informovaného súhlasu podľa zásad GCP po predošlom vysvetlení všetkých aspektov štúdie. Návšteva V-1 mohla byť spojená s V0 (skríning), alebo sa V0 (podľa okolností) zrealizovala najneskôr do 2 týždňov od V-1. Počas V0 bol u pacienta zrealizovaný odber vyhodnocovaných klinických a laboratórnych parametrov za účelom overenia zaraďovacích a vyraďovacích kritérií. Pacientovi bol súčasne vydaný dotazník kvality života (QoL – Quality of Life). V podskupine pacientov, v ktorej sa realizoval CGM, bol počas V0 pacient edukovaný o princípe CGM a tento mu bol napojený (na pôvodnej liečbe inzulínom v režime IIT). Po 14 dňoch od V0 sa pacient zúčastnil návštevy V1. Na tejto návšteve pacient odovzdal vyplnený dotazník QoL a bol prestavený z IIT na liečbu IDegLira (v jednom sedení) s poskytnutím edukácie o potrebe a spôsobe aktívnej titrácie IDegLira. Ak bol pacient zaradený v podskupine, v ktorej sa realizoval CGM, bol mu ešte pred zmenou liečby zložený CGM, ktorého záznam bol nahratý do systému LibreView. „Jedno sedenie“ bolo definované ako ukončenie IIT podaním poslednej dávky inzulínu večer pred V1 a začatie liečby IDegLira s prvým podaním ráno v deň V1. Ako iniciálna dávka IDegLira sa použilo 50 % predošlej CDDI, ktorá však nemala prekročiť maximálnu iniciálnu dávku uvedenú v SPC pre IDegLira 16 DJ. Titrácia dávky IDegLira prebiehala v spolupráci s pacientom samotným a teda titrovať mohol aj samotný pacient. Podmienkou bola edukácia. Titrácia dávky IDegLira sa riadila podľa SMBG s ohľadom na eventuálne prejavy nežiaducich účinkov (napr. nauzea, hypoglykémia). Titrácia vychádzala z hodnôt glykémie ráno nalačno, s ohľadom na glykémiu po raňajkách a pred spaním. Ak pacient po úvodnom podaní 16 DJ (alebo nižšej) nemal žiadne nežiaduce účinky (NÚ) a ešte neboli naplnené cieľové hodnoty glykemickej kontroly, dávka sa titrovala ± 2–4 DJ 1-krát za 3 dni. Ak boli paralelne používané perorálne antidiabetiká (PAD), odporúčalo sa ukončiť liečbu inhibítormi dipeptidylpeptidázy 4 (DPP4i), avšak ponechať liečbu metformínom a SGLT2i. Thiazolidíndióny (TZD) a sulfonylureu (SU) bolo možné ponechať podľa klinickej úvahy lekára. Po V1 bol pacient v priebehu 1. a 2. týždňa liečby IDegLira opakovane kontaktovaný telefonicky, a to vždy na 4. a 7. deň týždňa za účelom overenia titrácie a zisťovania efektivity a znášanlivosti liečby a prípadných nežiaducich účinkov. Ak bol pacient zaradený v podskupine, v ktorej sa realizoval CGM, zúčastnil sa po t. j. 12 týždňoch liečby IDegLira od V1 návštevy V2, na ktorej mu bol napojený CGM (na liečbe IDegLira). Pacienti, ktorí neboli zaradení v podskupine so CGM, sa V2 nezúčastnili. Všetci pacienti sa však po 14 týždňoch liečby IDegLira (od V1) zúčastnili návštevy V3. Na tejto návšteve boli získané vyhodnocované klinické a laboratórne parametre a pacient odovzdal vyplnený dotazník QoL. V podskupine pacientov, v ktorej sa realizoval CGM, bol tento zložený a záznam bol nahratý do systému LibreView.
Štatistické metódy
Pre štatistické vyhodnotenie výsledkov boli použité: párový a nepárový Studentov t-test na porovnanie kontinuálnych premenných a χ2-test na porovnanie početností.
Výsledky
V tejto predbežnej analýze prezentujeme parciálne výsledky po 14 týždňoch od zmeny liečby z IIT na IDegLira na súbore 147 pacientov.
Hodnotené klinické laboratórne parametre sú uvedené v tab. 1–3. Súbor pacientov tvorilo 44,4 % mužov a 55,6 % žien, s priemerným vekom 66,9 ± 8,3 rokov, s priemerným trvaním DM2T 16,0 ± 8,1 rokov, v prevahe obéznych s BMI 34,4 ± 5,3 kg/m2, so zachovanou tvorbou inzulínu (C-peptid 0,76 ± 0,42 nmol/l). Známe prítomné kardiovaskulárne ochorenie (KVO) malo 41,8 % pacientov. Liečenú artériovú hypertenziu malo 91,2 % pacientov, liečenú dyslipidémiu 78,2 % pacientov a 14,5 % pacientov boli fajčiari. Išlo teda o vysokorizikovú skupinu pacientov s neuspokojivou glykemickou kontrolou s HbA1c 8,57 ± 0,93 % s priemernou CDDI 55,6 ± 14,3 IU. Hodnoty jednotlivých sledovaných klinických a laboratórnych parametrov a ich zmenu po 14 týždňoch po prechode z IIT na IDegLira zobrazujú tab. 1–3 a grafy 1–8.
Table 1. Klinické a laboratórne parametre 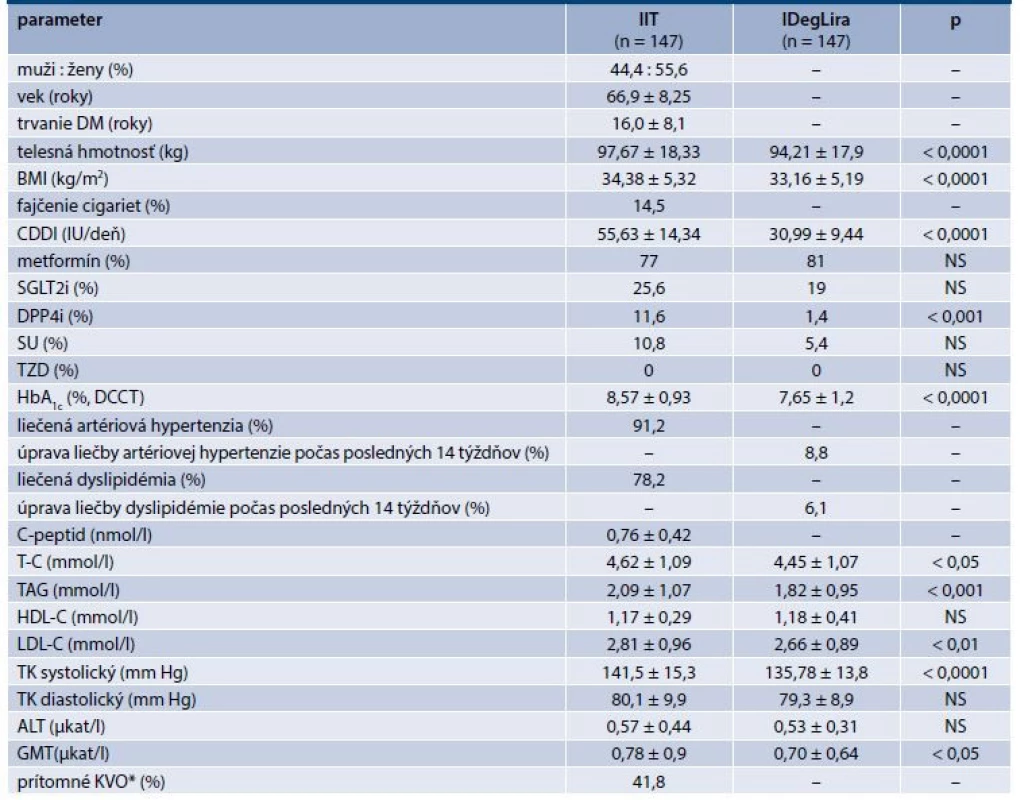
* potvrdená symptomatická koronárna choroba srdca, potvrdená asymptomatická ischémia srdca, chronické srdcové zlyhávanie NYHA II – III)
CDDI – celková denná dávka inzulínu DPP4i – inhibítor dipeptidylpeptidázy 4 GMT –glutamyltransferáza HDL-C – HDL-cholesterol KVO – kardiovaskulárne ochorenie LDL-C – LDL-cholesterol NS – nesignifikantné SGLT2i – inhibítor sodíkovo-glukózového kotransportéru 2 SU – sulfonylurea TAG – triacylglycerol TK – tlak krvi TZD – thiazolidíndióny T-C celkový (total) cholesterolTable 2. Efekt liečby na glykémie v glykemickom profile 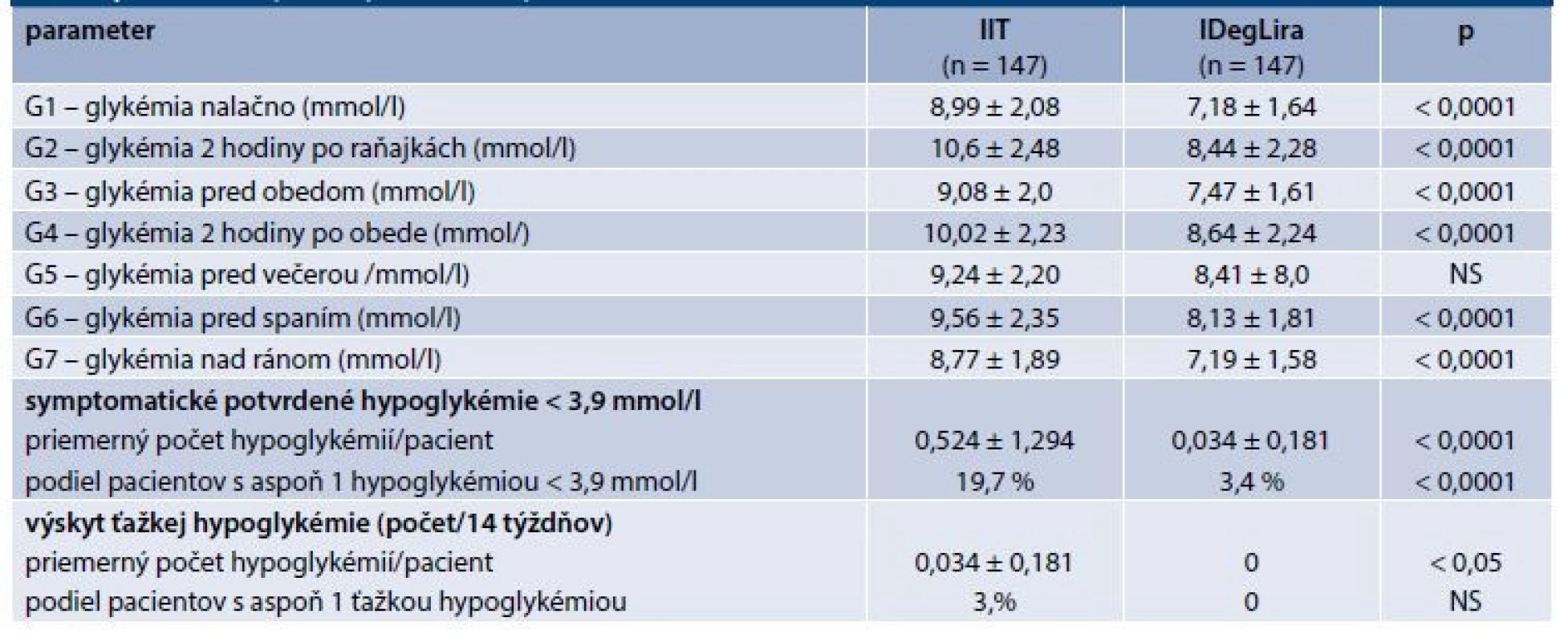
Table 3. Predčasné ukončenie liečby IDegLira a účasti v štúdii, nežiadúce účinky 
Nežiaduce účinky a predčasné ukončenie liečby IDegLira
U 2 pacientov bola liečba IDegLira počas prvých 14 týždňov štúdie ukončená a u pacienta sa následne pokračovalo v IIT. Dôvodom bolo zhoršenie glykemickej kontroly. Nežiaduce účinky liečby IDegLira počas prvých 14 týždňov liečby neboli uvedené v zázname žiadneho z pacientov (tab. 3).
Diskusia
Filozofia prechodu z IIT na IDegLira vychádza z niekoľkých aspektov. Liečba inzulínom v schéme IIT sa často začínala predčasne, ako riešenie z núdze a nedostatku iných terapeutických prostriedkov, v čom sa však v posledných rokoch situácia zásadne zmenila. Väčšina pacientov, ktorí už sú liečení komplexnými inzulínovými režimami, má zachovanú vlastnú normálnu až zvýšenú sekréciu inzulínu a reálna nutnosť substitučnej liečby inzulínom je preto otázna. Okrem toho, liečba inzulínom môže v dôsledku viacerých nežiaducich účinkov (prírastok na hmotnosti, hypoglykémia, indukcia inzulínovej rezistencie, hyperinzulinémia, retencia tekutín), viesť k vzniku komplikujúcich situácií. Navyše, realizácia IIT je pre pacienta pomerne náročná.
Ako ukázali predbežné výsledky našej štúdie, ale aj štúdie iných autorov [9–11], u mnohých pacientov je možné tieto problémy efektívne riešiť racionalizáciou (simplifikáciou) liečby, t.j. prechodom zo 4 až 5 podaní inzulínu denne na fixnú kombináciu bazálneho analógu inzulínu a GLP1-RA, ako je napríklad IDegLira, v jednom dennom podaní. Výsledky štúdie ukázali, že u pacientov s DM2T, s HbA1c > 7 %, so zachovanou tvorbou inzulínu a CDDI < 70 IU viedol prechod z IIT na IDegLira k signifikantnému zlepšeniu glykemickej kompenzácie, poklesu telesnej hmotnosti, BMI, ako aj k poklesu systolického krvného tlaku, triglyceridov, celkového a LDL-cholesterolu, GMT (tab. 1–2, graf 1–6). Okrem toho, po prechode z IIT na IDegLira sa signifikantne znížili aj celodenné dávky inzulínu (tab. 1, graf 7). Liečba tiež viedla k pozitívnemu hodnoteniu zo strany pacientov.
Zlepšenie glykemickej kompenzácie charakterizoval signifikantný pokles HbA1c približne o 0,9 %, ako aj všetkých glykémií v glykemickom profile s výnimkou glykémie pred večerou, ktorej pokles nedosiahol štatisticky význam (graf 1–2). V podskupine pacientov (n = 31), u ktorých sa realizoval CGM monitoring došlo po 14 týždňoch zmeny liečby z IIT na IDegLira v súlade s úpravou HbA1c a glykémií v glykemickom profile v celom súbore aj k vzostupu TIR (t.j. podielu času dňa stráveného v rozmedzí 3,9–10,0 mmol/l) zo 63,7 % na 68,7 % a poklesu TAR (t.j. podielu času dňa stráveného v glykémiách > 10 mmol/) z 33,4 % na 30,7 %. Rozdiel v týchto ukazovateľoch nedosiahol štatistický význam. Avšak aj v tejto podskupine pacientov došlo k signifikantnému poklesu HbA1c z 8,5 % na 7,9 % (p < 0,01), graf 3. V rámci celého súboru pacientov HbA1c poklesol u 86,4 % pacientov, nezmenil sa u 2 % a stúpol (zhoršil sa) u 11,6 % pacientov. U 12,2 % bol zaznamenaný pokles HbA1c o > 2 % a u 5,4 % pacientov až o > 3 %. Naopak, zhoršenie o > 2 % bolo zaznamenané u 2 pacientov (1,4 %). Medzi pacientmi, u ktorých došlo k poklesu vs vzostupu HbA1c, sme nezistili štatisticky významný rozdiel v žiadnom zo sledovaných parametrov.
Graph 1. HbA1c pri IIT a po prechode na IDegLira 
Graph 2. Glykémie v glykemickom profile pri IIT a po prechode na IDegLira 
Po prechode z IIT na IDegLira podľa záznamov pacienta významne poklesol aj výskyt počtu potvrdených symptomatických, resp. ťažkých hypoglykémií a podiel pacientov s aspoň jednou takouto hypoglykémiou za sledované obdobie (graf 7.2). V podskupine pacientov, u ktorých bol realizovaný CGM, bol štatisticky významný aj pokles v TBR (Time Below Range), t.j. v podiele času dňa stráveného v glykémiách < 3,9 mmol/l, ktorý klesol z 2,8 % na 0,7 % (p < 0,05 %), graf 3. Klesol aj počet jednotlivých hypoglykémií na pacienta a variabilita glykémií. Rozdiel v týchto ukazovateľoch však nedosiahol štatistický význam (graf 3).
Graph 3. TIR, TBR, TAR (graf 3.1), počet hypoglykémií a variabilita (graf 3.2) glykémií podľa monitorovania CGM pri IIT a po prechode na IDegLira (n = 31) 
Telesná hmotnosť poklesla v priemere o 3,5 kg a BMI o 1,22 kg/m2. TH poklesla u 84,3 % pacientov (o 1 až 22 kg), nezmenila sa u 12,9 % pacientov a vzrástla u 4 pacientov (2,7 %) v rozsahu 1–3 kg. Pokles systolického tlaku krvi a krvných tukov zobrazuje tab. 1 a graf 4–6.
Graph 4. Telesná hmotnosť pri IIT a po prechode na IDegLira 
Graph 5. Krvný tlak pri IIT a po prechode na IDegLira 
Graph 6. Krvné tuky pri IIT a po prechode na IDegLira 
Graph 7. Celodenná dávka inzulínu (graf 7.1) a výskyt hypoglykémie (graf 7.2) pri IIT a po prechode na IDegLira 
Najčastejším dôvodom pre zmenu liečby (u jedného pacienta mohli byť aj viaceré) bol prírastok na hmotnosti pri predošlej liečbe IIT (67 %), pre pacienta náročné zladenie inzulínovej terapie s diétnym režimom alebo fyzickou aktivitou (48 %) a zásadný (negatívny) vplyv na kvalitu života pacienta (45 %), prítomné aterosklerotické KVO alebo vysoké/veľmi vysoké KV-riziko (32 %), strata efektivity liečby napriek zvyšovaniu dávok inzulínu (32 %). Často alebo paralelne uvádzanými dôvodmi bola tiež nonadherencia k liečbe inzulínom z dôvodu náročnosti liečby z dôvodu zamestnania, alebo bežných denných aktivít (29 %), zabúdanie podania inzulínu alebo chyby aplikácie inzulínu (26 %). Ďalšími dôvodmi boli hypoglykémie (25 %) a nežiaduce prejavy hyperinzulinémie (retencia tekutín, sekundárne indukovaná inzulínová rezistencia, 12 %), či iné dôvody (graf 8).
Graph 8. Najčastejšie príčiny prechodu z IIT na IDegLira (uvedené mohli byť aj viaceré príčiny súčasne) 
1 nonadherencia k liečbe inzulínom z dôvodu náročnosti liečby, z dôvodu zamestnania, alebo bežných denných aktivít 2 zabúdanie podania inzulínu alebo chyby aplikácie 3 pre pacienta náročné zladenie inzulínoterapie s diétnym režimom alebo fyzickou aktivitou 4 hypoglykémie 5 prírastok na hmotnosti 6 nežiaduce prejavy hyperinzulinémie (retencia tekutín, sekundárna inzulínová rezistencia) 7 prítomné ASKVO alebo vysoké/veľmi vysoké KV-riziko 8 strata efektivity liečby napriek zvyšovaniu dávok inzulínu 9 zásadný vplyv na kvalitu života pacienta 10 iný dôvod Deintenzifikáciu sa odporúčalo urobiť v jednom sedení, t.j. ukončením IIT večer pred prechodom na liečbu IDegLira v odporúčanej iniciálnej dávke v súlade s SPC 16 DJ s následnou titráciou podľa glykémií v glykemickom profile ± 2–4 DJ/3 dni. Skutočná priemerná iniciálna dávka bola 17,7 ± 4,6 DJ, pričom u 13 % pacientov bola > 20 DJ (bez zaznamenaných nežiaducich účinkov). Po 14 týždňoch liečby narástla dávka IDegLira (a teda aj inzulínu) na 31,0 ± 9,4 DJ/deň. V porovnaní s CDDI na pôvodnej liečbe IIT (55,6 ± 14,3 IU/deň) tak došlo k signifikantnému poklesu dávky inzulínu v priemere o 24,6 IU/deň. Okrem redukcie dávok inzulínu došlo aj k redukcii používania väčšiny PAD. Využívanie sulfonylurey kleslo z 10,8 % na 5,4 %, DPP4i z 11,6 % na 1,4 %, SGLT2i z 25,6 % na 19 %. V prípade metformínu došlo k miernemu nárastu používania zo 77 % na 81 %. Iné antidiabetiká neboli používané. Úpravu v parametroch glykemickej kontroly teda nemožno vysvetľovať úpravou sprievodnej antidiabetickej liečby. Podobne pokiaľ išlo o liečbu krvného tlaku, bola táto počas sledovaného obdobia upravovaná len u 8,8 % pacientov a liečba dyslipidémie len u 6,1 % pacientov, čo samostatne a dostatočne nevysvetľuje signifikantný pokles systolického TK a krvných tukov (tab. 1).
Hoci sa IDegLira môže podávať kedykoľvek počas dňa, najčastejšou a tiež protokolom štúdie odporúčanou voľbou bolo podanie ráno pre raňajkami. Dôvodom preferencie ranného podania je skutočnosť, že najvyššia glykemická odozva je u väčšiny pacientov po raňajkách a ranné podanie IDegLira najlepšie využíva efekt liraglutidu na kontrolu postprandiálnej glykémie po raňajkách. Takto bol IDegLira podávaný u 85 % pacientov. U 10 % pacientov bol IDegLira podávaný pred večerou, a to zrejme u pacientov, u ktorých dominovala glykemická odozva po večeri. U 5 % pacientov bol IDegLira podávaný pred spaním a pravdepodobne súvisel s dominanciou glykémie ráno nalačno.
Počas prvých 14 týždňov nebol zaznamenaný žiaden nežiaduci účinok liečby IDegLira (vrátane nauzey ani iných gastrointestinálnych ťažkostí), pre ktorý by bola účasť pacienta v štúdii predčasne ukončená. U 2 pacientov bola účasť ukončená pre zhoršenú glykemickú kontrolu rozhodnutím ošetrujúceho lekára a u pacientov sa následne pokračovalo v IIT.
Výsledky našej štúdie sú v súlade s podobnými štúdiami iných autorov [9–12]. V post-hoc analýze štúdie DUAL II Japan [9], čo bola randomizovaná kontrolovaná štúdia (RCT – Randomized Controlled Trial) treat-to-target štúdia v trvaní 26 týždňov, bola predmetom hodnotenia efektivita a bezpečnosť liečby IDegLira u 39 pacientov s DM2T, ktorí prešli z režimu s bifázickým inzulínom na IDegLira vs bazálny inzulín degludek. Prechod na IDegLira viedol k zlepšeniu glykemickej kontroly, a to tak glykémie nalačno, ako aj postprandiálnych glykémií a poklesu HbA1c aj TH. Nižší bol tiež výskyt ťažkej alebo potvrdenej hypoglykémie a nižšie boli aj dávky inzulínu.
Prechod z viacerých podaní inzulínu u DM2T s relatívne dobrou glykemickou kontrolou (HbA1c < 7,5 %) a nízkou CDDI (< 0,6 IU/kg TH) počas priemerného času sledovania 3 mesiace bol hodnotený aj v nerandomizovanej maďarskej štúdii, do ktorej bolo zaradených 62 pacientov. Priemerná hodnota HbA1c v tejto štúdii poklesla o 0,3 % a signifikantne sa znížila aj telesná hmotnosť o 3,1 kg a BMI. Priemerná dávka IDegLira na konci sledovania predstavovala cca 21 DJ a potreba inzulínu klesla z 0,47 IU/kg TH na 0,23 IU/kg TH. Podiel pacientov, u ktorých sa vyskytla aspoň jedna dokumentovaná alebo potvrdená hypoglykémia, klesol zo 45 % na 9,7 % [10].
Medzinárodná multicentrická, retrospektívna, neintervenčná RWE štúdia EXTRA z bežnej klinickej praxe vyhodnocovala medicínske záznamy pacientov, ktorí boli prevedení na IDegLira z viacerých predošlých terapeutických režimov vrátane režimu s viacerými podaniami inzulínu. V tejto skupine po 6 mesiacoch liečby hodnota HbA1c klesla o 0,7 % a TH klesla o 2,4 kg. Priemerná iniciálna dávka v skupine pacientov na viacerých denných podaniach inzulínu predstavovala 21,2 IU a v priebehu 6 mesiacov vzrástla o 8,5 IU, pričom z celkového počtu 1 753 pacientov v tejto skupine 10 % presahovalo dávku 50 IU. Prechod na liečbu IDegLira viedol k redukcii dávok iných farmák a dávky inzulínu zo 65,7 IU na 45 IU. Celkový výskyt hypoglykémií bol nízky a bol po 6 mesiacoch liečby IDegLira nižší (0,28 vs 0,06 príhody na pacienta a rok) oproti výskytu na pôvodnej liečbe [11]. Napokon, v RWE-štúdii talianskych autorov [12] sa liečba pomocou IDegLira ukázala ako efektívnejšia než predošlá liečba IIT s výsledkami podobnými našej štúdii, keď HbA1c klesol z 8,4 % na 7,4 %, glykémia nalačno z 8,8 mmol/l na 6,9 mmol/l, TH z 94,1 na 93 kg a poklesla aj priemerná dávka inzulínu zo 42 IU/deň na 22 IU/deň.
V porovnaní s vyššie uvedenými štúdiami je silnou stránkou našej štúdie to, že nešlo o retrospektívnu analýzu na rozdiel od dvoch RWE štúdií [11,12]. Na rozdiel od japonskej štúdie, ktorá sledovala retrospektívne prechod z liečby premixovaným inzulínom [9], v našej štúdii sme sledovali prechod z IIT na kombináciu IDegLira. Maďarská štúdia mala podobný prospektívny dizajn s jedným ramenom, ale podstatne nižší počet zaradených pacientov [10]. Slabou stránkou ako tejto aj ďalších citovaných štúdií je, že žiadna z nich nemala randomizovaný dizajn porovnávajúci pokračovanie IIT so zmenou na fixnú kombináciu IDegLira.
V súhrne možno na základe predbežnej analýzy výsledkov štúdie SIMPLIFY konštatovať, že prechod z liečby viacerými podaniami inzulínu za deň (IIT) na fixnú kombináciu bazálneho inzulínu degludek a liraglutidu (IDegLira) je efektívny, bezpečný a pre pacienta menej náročný spôsob liečby. Prechod z IIT na IDegLira nielenže neviedol k zhoršeniu glykemickej kompenzácie, ale sa združoval so signifikantným zlepšením klasických parametrov glykemickej kompenzácie, ako sú HbA1c a glykémie v glykemických profiloch. V parametroch TIR sa zmena liečby združovala s nesignifikantným zlepšením glykemickej kompenzácie, výsledky však boli dostupné iba od 31 pacientov. Prechod z IIT na IDegLira sa tiež združoval so signifikantným poklesom telesnej hmotnosti, BMI, celodennej dávky inzulínu, systolického krvného tlaku, krvných tukov, počtu hypoglykémií a podielu pacientov s hypoglykémiou a dávok inzulínu.
Doručené do redakcie 30. 3. 2022
doc. MUDr. Emil Martinka, PhD.
www.nedu.sk
Sources
- Martinka E, Mokáň M, Tkáč I et al. Interdisciplinárne odporúčania pre diagnostiku a liečbu diabetes mellitus , jeho komplikácií a najvýznamnejšéch sprievodných ochorení – 2021. Forum Diabetologicum 2021; 10(Suppl 2).
- Davies MJ, D‘Alessio DA, Fradkin J et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018;61 (12): 2461–2498. Dostupné z DOI: <http://doi: 10.1007/s00125–018–4729–5. Erratum in: Diabetologia. 2019; 62(5): 873. PMID: 30288571>.
- Uzunlulu M, Oguz et al. C-peptide concentrations in patients with type 2 diabetes treated with insulin. Diabetes Metab Syndr 2019; 13(6): 3099–3104. Dostupné z DOI: <http://doi: 10.1016/j.dsx.2019.11.010>.
- Haluzík M, Flekač M, Lengyel C et al. Expert Opinion on the Therapeutic Use of the Fixed-Ratio Combination of Insulin Glargine 100 U/mL and Lixisenatide: a Central/Eastern European Perspective. Diabetes Ther 2020; 11(4): 1029–1043. Dostupné z DOI: <http://doi: 10.1007/s13300–020–00777–2>.
- Nauck MA, Meier JJ. Pharmacotherapy: GLP-1 analogues and insulin: sound the wedding bells? Nat Rev Endocrinol 2011; 7(4): 193–195. Dostupné z DOI: <http://doi: 10.1038/nrendo.2011.30>.
- Iorga RA, Bacalbasa N, Carsote M et al. Metabolic and cardiovascular benefits of GLP-1 agonists, besides the hypoglycemic effect (Review). Exp Ther Med 2020; 20(3): 2396–2400. Dostupné z DOI: <http://doi: 10.3892/etm.2020.8714>.
- Marso SP, Daniels GH, Brown-Frandsen K et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375 : 311–322. Dostupné z DOI: <http://doi: 10.1056/NEJMoa1603827>.
- Psota M, Psenkova MB, Racekova N et al. Cost-effectiveness analysis of IDegLira versus basal-bolus insulin for patients with type 2 diabetes in the Slovak health system. Clinicoecon Outcomes Res 2017; 9 : 749–762. Dostupné z DOI: <http://doi: 10.2147/CEOR.S143127>.
- Watada H, Ross Agner BF, Doshi A et al. IDegLira Improves Glycemic Control in Japanese Patients with Uncontrolled Type 2 Diabetes on Premixed Insulin Therapy. Diabetes Ther 2020; 11(1): 331–339. Dostupné z DOI: <http://doi: 10.1007/s13300–019–00730-y>.
- Taybani Z, Bótyik B, Katkó M et al. Simplifying Complex Insulin Regimens While Preserving Good Glycemic Control in Type 2 Diabetes. Diabetes Ther 2019; 10 : 1869–1878. Dostupné z DOI: <http://doi.org/10.1007/s13300–019–0673–8>.
- Price H, Blüher M, Prager R et al. [EXTRA study group]. Use and effectiveness of a fixed-ratio combination of insulin degludec/liraglutide (IDegLira) in a real-world population with type 2 diabetes: Results from a European, multicentre, retrospective chart review study. Diabetes Obes Metab 2018; 20(4): 954–962.
- Persano M, Nollino L, Sambataro M et al. Real-word study on the effectiveness and safety of basal insulin IDegLira in type 2 diabetic patients previously treated with multi-injective insulin therapy. European Review for Medical and Pharmacological Sciences 2021; 25 : 923–931.
- Battelino T, Danne T, Bergenstal RM et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care 2019; 42(8):1593-1603. Dostupné z DOI: <http://doi: 10.2337/dci19-0028>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2022 Issue Supplementum 1-
All articles in this issue
- Projekt SIMPLIFY: Prechod na liečbu fixnou kombináciou inzulínu degludek a agonistu GLP1-receptorov liraglutid (IDegLira) po predchádzajúcej intenzifikovanej liečbe inzulínom (IIT)
- Rationalisation of previous multiple insulin treatment by switching to a fixed combination of basal insulin degludec and the GLP1-receptor agonist liraglutide (IDegLira): results of the SIMPLIFY study after 14 weeks
- Simplification of previous multiple insulin treatment by switching to a fixed combination of basal insulin degludec and GLP1-receptor agonist liraglutide: SIMPLIFY study Evaluation of the early outcome questionnaires
- Projekt SIMPLIFY: Prechod na liečbu fixnou kombináciou inzulínu degludek a agonistu GLP1-receptorov liraglutid (IDegLira) po predchádzajúcej intenzifikovanej liečbe inzulínom (IIT)
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Projekt SIMPLIFY: Prechod na liečbu fixnou kombináciou inzulínu degludek a agonistu GLP1-receptorov liraglutid (IDegLira) po predchádzajúcej intenzifikovanej liečbe inzulínom (IIT)
- Rationalisation of previous multiple insulin treatment by switching to a fixed combination of basal insulin degludec and the GLP1-receptor agonist liraglutide (IDegLira): results of the SIMPLIFY study after 14 weeks
- Projekt SIMPLIFY: Prechod na liečbu fixnou kombináciou inzulínu degludek a agonistu GLP1-receptorov liraglutid (IDegLira) po predchádzajúcej intenzifikovanej liečbe inzulínom (IIT)
- Simplification of previous multiple insulin treatment by switching to a fixed combination of basal insulin degludec and GLP1-receptor agonist liraglutide: SIMPLIFY study Evaluation of the early outcome questionnaires
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

