-
Medical journals
- Career
Pohľad na kardiorenálny syndróm
: Ján Murín; Miroslav Pernický; Marta Filková
: I. interná klinika LF UK a UN, Bratislava, Nemocnica Staré Mesto, prednostka doc. MUDr. Soňa Kiňová, PhD.
: Forum Diab 2015; 4(3): 177-180
: Main Theme: Review
Kardiorenálny syndróm definovali prvýkrát v roku 2004 v USA pracovníci NHLBI (National Heart, Lung and Blood Institute) nasledovne: je to stav organizmu pacienta so srdcovým zlyhávaním (SZ), u ktorého je liečba SZ vo svojej intenzite obmedzovaná zhoršením obličkových funkcií [1]. Výskyt SZ má dnes epidemický rozmer a predstavuje asi 2 % populácie v Európe, u osôb ≥ 65 rokov je to asi 10 %, v ďalších rokoch ich podiel ešte exponenciálne stúpa (asi 20 % u osôb ≥ 80–85 rokov) [2,3]. Renálna funkčná porucha (dysfunkcia či insuficiencia) je u osôb so SZ veľmi častá, sčasti tiež súvisí s narastaním priemernej dĺžky prežívania občanov [4]. U akútneho SZ je výskyt renálnej insuficiencie asi 30–35 % a u chronického SZ dvakrát viac, asi 60–70 % [3,4]. Vzájomný výskyt srdcového a renálneho zlyhávania významne zhoršuje prognózu chorých, teda jeho morbiditu, mortalitu a rehospitalizácie, i kvalitu života [4,5]. U chorých s chronickým SZ býva renálna insuficiencia (RI) častejšie ako osôb s kardiovaskulárnym ochorením, ale bez srdcového zlyhávania [4]. Výskyt SZ koreluje s poklesom glomerulárnej filtrácie chorých. RI je silným a nezávislým rizikovým faktorom mortality u chorých so SZ [5,6,7]. V období X–XII/2008 sme analyzovali príjmy pacientov v pohotovostných službách na naše pracovisko: vyšetrených bolo 1052 chorých, 302 bolo prijatých, najviac prijatých (45 osôb) bolo pre akútne SZ. 18 osôb (40 % medzi osobami prijatými pre akútne SZ) malo diabetes. Prítomnosť chronickej renálnej insuficiencie mali všetci diabetici (priemerný vek 77 rokov) a 75 % nediabetikov (priemerný vek 80 rokov). Pacienti s diabetom boli ťažšie chorí ako nediabetici. Výskyt renálnej insuficiencie/zlyhania je u osôb so SZ, hlavne chronickým, častý. Lepšou KV-liečbou a predlžovaním veku bude v budúcnosti výskyt RI iste stúpať. Poznanie patofyziológie syndrómu je dôležité, aby sme zlepšili prevenciu i liečbu tohto zložitého ochorenia.
Kľúčové slová:
diabetes – liečba – prognóza – renálna insuficiencia – srdcové zlyhávanieÚvod
Kardiorenálny syndróm definovali prvýkrát v roku 2004 v USA pracovníci NHLBI (National Heart, Lung and Blood Institute) nasledovne: je to stav organizmu pacienta so srdcovým zlyhávaním (SZ), u ktorého je liečba SZ vo svojej intenzite obmedzovaná zhoršením obličkových funkcií. Následne skupina expertov z Talianska v roku 2008 vytvorila patofyziologickú definíciu tohoto syndrómu[1]. Táto definícia zohľadňuje vzájomný a obojstranný vplyv „interakcií zlyhávania srdca i obličiek“, pri ktorých dysfunkcia jedného z orgánov vyvoláva dysfunkciu druhého orgánu – hlavne prostredníctvom podobných hemodynamických, neurohormonálnych, imunologických aj biochemických zmien [1].
Epidemiológia syndrómu
Výskyt SZ má dnes epidemický rozmer a predstavuje asi 2 % populácie v Európe, u osôb ≥ 65 rokov je to asi 10 %, v ďalších rokoch ich podiel ešte exponenciálne stúpa (asi 20 % u osôb ≥ 80–85 rokov). Sú dve hlavné príčiny epidemického výskytu SZ – predlžovanie veku občanov vo vyspelých krajinách a dnes lepšia liečba väčšiny kardiovaskulárnych ochorení, na ktoré v minulosti mnohí chorí zomierali (infarkt myokardu, cievne mozgové príhody, revaskularizačné operácie, operácie chlopní a pod), ale dnes oveľa menej [2,3].
Renálna funkčná porucha (dysfunkcia či insuficiencia) je u osôb so SZ veľmi častá, sčasti tiež súvisí s narastaním priemernej dĺžky prežívania občanov. U akútneho SZ je výskyt renálnej insuficiencie asi 30–35 % a u chronického SZ dvakrát viac, asi 60–70 %. Vzájomný výskyt SZ a renálneho zlyhávania významne zhoršuje prognózu chorých, teda jeho morbiditu, mortalitu a rehospitalizácie, i kvalitu života [4,5].
Prognostický vplyv renálnej insuficiencie u SZ
U chorých s chronickým SZ býva renálna insuficiencia (RI) častejšie ako u KV chorých, ale bez srdcového zlyhávania [4]. Výskyt SZ koreluje s poklesom glomerulárnej filtrácie chorých. RI je silným a nezávislým rizikovým faktorom mortality u chorých so SZ [5,6,7]. Hillege et al analyzovali dlhodobo súbor asi 1 900 pacientov s kardiorenálnym syndrómom (osoby v NYHA triedach III a IV, so systolickým SZ a s ejekčnou frakciou ≤ 35 %, u ktorých vstupná priemerná glomerulárna filtrácia, kalkulovaná podľa Cockroft-Gaulta, bola 63 ml/min): hlavným prediktorom mortality bola u chorých vstupná glomerulárna filtrácia, až potom nasledovala hodnota NYHA triedy a úspešné pre prognózu chorých bolo podávanie ACE-inhibítorov. Chorí s najnižšou glomerulárnou filtráciou (eGF – kvartil s eGF < 44 ml/min) mali trojnásobne vyššie riziko mortality ako osoby v „najlepšom kvartile eGF“ (> 76 ml/min.), teda relatívne riziko tu bolo RR -2,85 (štatisticky významné) [5]. Aj ejekčná frakcia ľavej komory nebola štatisticky významná ako prognostický ukazovateľ. To poukazuje na väčšiu prognostickú výpoveď eGF, než je funkcia ľavej komory (ejekčná frakcia) [5].
U chorých v terminálnej fáze renálneho zlyhávania je KV mortalita dominantná a dosahuje ≥ 50 % prípadov. U chronickej renálnej insuficiencie je vaskulárne úmrtie asi 15 až 20-násobne vyššie než u rovesníkov bez renálneho zlyhávania. A mnohí chorí s renálnou insuficienciou trpia aj SZ súčasne [8]. Asi 75 % chorých s terminálnym renálnym zlyhávaním má hypertrofiu myokardu (často veľmi veľkú) a asi 40 % z nich trpí klinickou formou ischemickej choroby srdca [6,8,9].
Patofyziologické mechanizmy u kardiorenálneho syndrómu
Za hlavný faktor zhoršovania renálnych funkcií sa tradične uvádza nedostatočný prietok obličkou pri zníženom srdcovom minútovom výdaji (SZ). Asi sa tu uplatňuje aktivácia systému renín-angiotenzín-aldosterón (RAAS), a to uvoľnením renínu v obličke, ak je táto ischemizovaná. Ale mnohé klinické sledovania preukázali, že zvýšenie srdcového výdaja nevedie vždy k zlepšeniu renálnych funkcií [10,11].
A tak sa hľadali i alternatívne patofyziologické mechanizmy syndrómu, vysvetľujúce zlú prognózu chorých. U ťažších foriem SZ býva výrazne zvýšený centrálny žilný tlak. Isté práce preukázali, že nárast výšky centrálneho žilného tlaku asociuje s progresívnym poklesom obličkových funkcií u SZ. Vtedy klesá postupne diuréza. U asi 50 % chorých nachádzame vzostup centrálneho žilného tlaku, ak ide o pacientov s akútnou dekompenzáciou chronického SZ (s ejekčnou frakciou < 20 %), teda ak ide o ťažké systolické SZ [12,13].
Aj hyperaktivácia sympatického nerového systému je u tohto syndrómu významná: pre pokles renálneho prietoku v dôsledku vazokonstrikcie, pre uvoľňovanie katecholamínov do cirkulácie, pre zhoršené vylučovanie katecholamínov močom (pri renálnej insuficiencii). Isté práce preukázali, že „renálny obrat noradrenalínu!“ je silným rizikovým faktorom mortality u osôb s pokročilým chronickým SZ (čakajúcich na transplantáciu srdca) [14].
Problematika vzťahu aktivácie RAAS k mortalite i morbidite u SZ, ale i u renálneho zlyhávania (a tiež u oboch zlyhávaní spoločne) je preštudovaná a dobre známa. Inhibícia RAAS (ACE inhibítory, aldosterónové inihibítory) sú tu priaznivé: znižujú tonus sympatiku, zlepšujú endotelovú funkciu, bránia (spomaľujú) vývoju myokardiálnej fibrózy. Spomínané priaznivé efekty boli overené vo viacerých klinických štúdiách [15].
Zdá sa, že aj nárast oxidatívneho stresu má u kardio-renálneho syndrómu významné postavenie [16].
Aj anémia patrí k rizikovým faktorom tohto syndrómu. Anémia u chronického SZ zvyšuje mortalitu, predlžuje dobu hospitalizácií a zvyšuje riziko rehospitalizácií. Zdá sa, že podobne je to aj u RI, hoci tu môže byť aj len prejavom ochorenia obličky. U chorých s kardiorenálnym syndrómom býva anémia spojená s nedostatočnou produkciou erytropoietínu, no a erytropoietín – zdá sa – bráni apoptóze buniek renálneho parenchýmu, znižuje oxidatívny stres a asi má aj kardioprotektívne pôsobenie.
Iné faktory:
- úloha systému arginín-vazopresín (reguluje homeostázu vody a soli) nie je vyjasnená; antagonisty receptora (V1) pre vazopresín vedia zvýšiť diurézu a korigovať hyponátriémiu, ale štúdie nepreukázali benefit na KV-príhody
- adenozín nie je dostatočne prebádaný u kardiorenálneho syndrómu; antagonisty receptora adenozínu (A1) viedli k zvýšeniu glomerulárnej filtrácie (asi o 30 %), ale nebol opäť benefit na klinické príhody
- veľký výskum je v oblasti liečiv, ktoré stimulujú cGMP (zlepšuje to diurézu), ale tu nemáme ešte jasné klinické výstupy [18,19]
Naše skúsenosti s kardiorenálnym syndrómom
V období X–XII/2008 sme analyzovali príjmy pacientov v pohotovostných službách na naše pracovisko:
- vyšetrených bolo 1 052 chorých
- 302 bolo prijatých
- najviac prijatých (45 osôb) bolo pre akútne SZ; 18 osôb (40 % medzi osobami prijatými pre akútne SZ) malo diabetes
- komorbidity (ne/kardiovaskulárne) u prijatých s akútnym SZ uvádzajú tab. 1,2
- klasifikáciu renálnej insuficiencie (podľa KDOQI) u týchto chorých uvádza tab. 3.
Prítomnosť chronickej renálnej insuficiencie mali všetci diabetici (priemerný vek 77 rokov) a 75 % nediabetikov (priemerný vek 80 rokov), pričom asi 60 % diabetikov a temer polovica nediabetikov trpela aj anémiou (hemoglobín < 130 g/l u mužov a < 120 g/l u žien). U diabetikov boli vyššie štádiá renálnej insuficiencie podľa klasifikácie KDOQI: III. štádium (44 % vs 15 % u nediabetikov) a IV. štádium (11 % vs 4 %).
Pacienti s diabetom boli ťažšie chorí ako nediabetici a ukazujú to tab. 1, 2 a 3, ktoré ukazujú, že hlavne frekvencia výskytu ale i intenzita kardiorenálneho syndrómu poukazujú, ako ťažko chorí s akútnym SZ sú u nás diabetici [2,3].
1. Kardiovaskulárne komorbidity 
2. Nekardiovaskulárne komorbidity 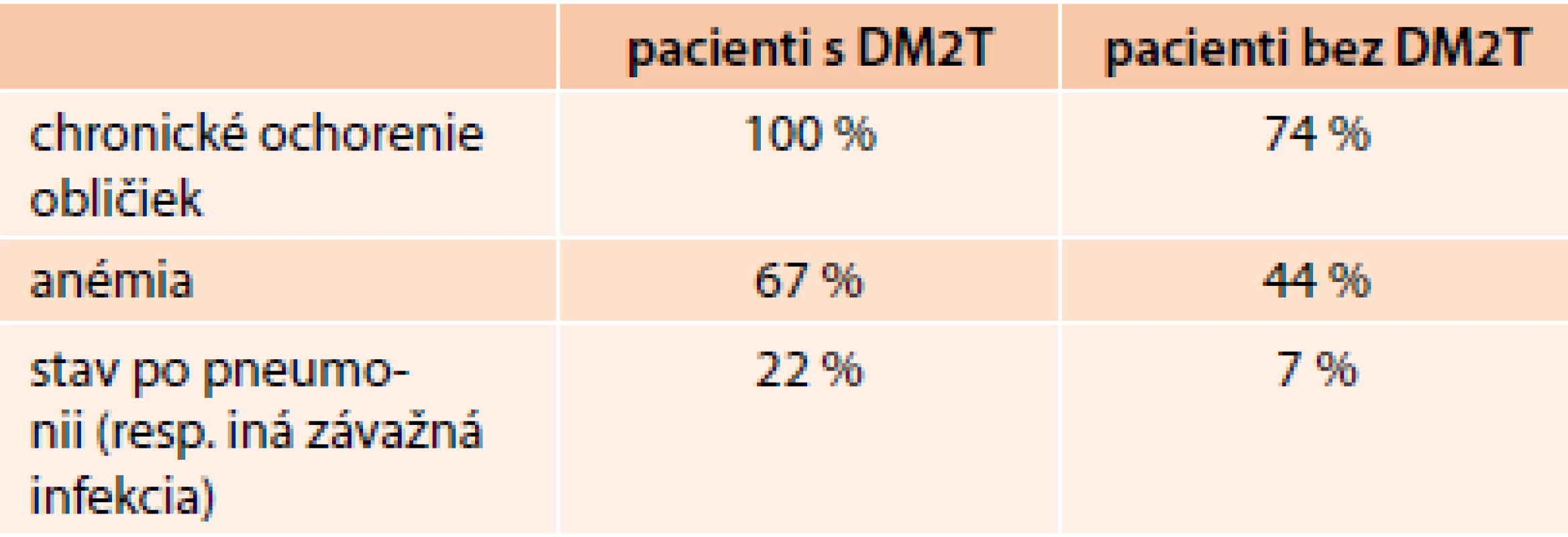
3. Klasifikácia chronického ochorenia obličiek 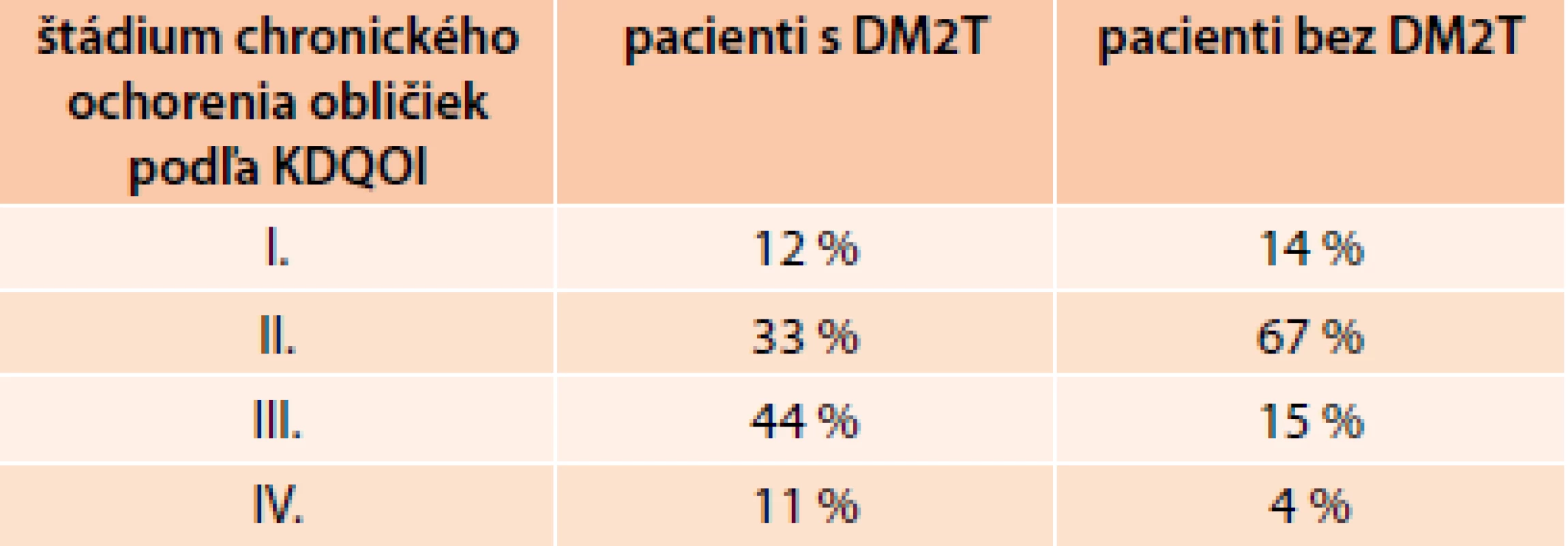
Čo na záver?
Výskyt renálnej insuficiencie/zlyhania je u osôb so SZ, hlavne chronickým, častý. A tak i výskyt kardiorenálneho syndrómu je častý, len ho takto treba v diagnózach aj písať, t. j. kategorizovať. Lepšou KV-liečbou a predlžovaním veku bude v budúcnosti iste stúpať. Poznanie patofyziológie syndrómu je dôležité, aby sme zlepšili prevenciu i liečbu tohto zložitého ochorenia.
prof. MUDr. Ján Murín, CSc.
jan.murin@gmail.com
I. interná klinika, LFUK a UN Bratislava
www.unb.sk
Doručené do redakcie 24. 8. 2015
Prijaté po recenzii 2. 10. 2015
Sources
1. Ronco C, House AA, Haapi M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong. Intensive Care Med 2008; 34(5): 957–962.
2. Pernický M, Murín J. Pacienti v ústavnej pohotovostnej službe na internej klinike. Vnit Lek 2010; 56(5): 47.
3. Pernický M, Murín J. Pacienti v pohotovostnej službe na internej klinike. Cardiology Lett 2010; 19(4): 287–292.
4. Pernický M, Karabová M, Murín J. Diabetes in acute heart failure and acute coronary syndrome – insight from a routine clinical practice in an Internal department with high volume of patients. Cardiology Lett 2012; 21(Suppl 1): S55
5. Pernický M, Karabová M, Murín J. Diabetes in acute heart failure and acute coronary syndrome. Eur J Heart Fail Supplements 2012; 14(Suppl A): S69.
6. Mc Alister FA, Ezekowitz J, Tonelli M et al. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study. Circulation 2004; 109(8): 1004–1009.
7. Hillege HL, Girbes AR, de Kam PJ et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation 2000; 102(2): 203–210.
8. Sarnak MJ. Cardiovascular complications in chronic kidney disease. Am J Kidney Dis 2003; 41 (Suppl 5): 11–17.
9. Henry RM, Kostense PJ, Bos G et al. Mild renal insufficiency is associated with increased cardiovascular mortality: The Hoorn Study. Kidney Int 2002; 62(4): 1402–1407.
10. Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol 1998; 9(12 Suppl): S16-S23.
11. Fried LF, Shlipak MG, Crump C et al. Renal insufficiency as a predictor of cardiovascular outcomes and mortality in elderly individuals. J Am Coll Cardiol 2003; 41(8): 1364–1372.
12. Weinfeld MS, Chertow GM, Stevenson LW. Aggravated renal dysfunction during intensive therapy for advanced chronic heart failure. Am Heart J 1999; 138(2 Pt 1): 285–290.
13. Nohria A, Hasselblad V, Stebbins A et al. Cardiorenal interactions: insights frome the ESCAPE trial. J Am Coll Cardiol 2008; (3)51 : 300–306.
14. Mullens W, Abrahams T, Skouri HN et al. Elevated intra-abdominal pressure in acute decomensated heart failure. J Am Coll Cardiol 2008; 51(3): 300–306.
15. Mullens W, Abrahams Z, Francis GS et al. Importance of venous congestion for worsening renal function in advaced decompensated heart failure. J Am Coll Cardiol 2009; 53(7):589–596.
16. Petersson M, Friberg P, Eisenhofer G et al. Long-term outcome in relation to renal sympathetic aktivity in patients with chronic heart failure. Eur Heart J 2005; 26(9): 906–913.
17. Remuzzi G, Perico N, Mancia M et al. The role of the renin-angiotensin-aldosteron system in the progression of chronic kidney disease. Kidney Int Suppl 2005; (99): S57-S65.
18. Tojo A, Onozato ML, Kobayashi N et al. Angiotensin II and oxidative stress in Dahl-sensitive rat with heart failure. Hypertension 2002; 40(6): 834–839.
19. Jie KE, Verhaar MC, Cramer MJ et al. Erythropoetin and the cardiorenal syndrome: cellular mechanisms on the cardiorenal conectors. Am J Physiol Renal Physiol 2006; 291(5): F932-F944.
20. Kostam MA, Gheorghiade M, Burnett JC Jr et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007; 297(12): 1319–1331.
21. Funaya H., Kitakaze M, Node K et al. Plasma adenosine levels increase in patients with chronic heart failure. Circulation 1997; 95(6): 1363–1365.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2015 Issue 3-
All articles in this issue
- Patients with diabetes as viewed by clinical nephrologist
- Early screening and treatment slow the progression of diabetic nephropathy
- Possibilities of using DPP4 inhibitors and SGLT2 inhibitors in patients with type 2 diabetes mellitus with impaired renal function
- A view on the cardiorenal syndrome
- The most frequent infectious complications in diabetic patients and their treatment
- Risk factors of the origin and progression of diabetic retinopathy
- Obesity – Key risk factor for diabetes mellitus after kidney transplantation
- Difficulty of hypertension control in diabetic nephropathy
- Incidence of diabetic nephropathy in a population of patients with diabetes mellitus in Slovakia: results of the NEFRITI investigation
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A view on the cardiorenal syndrome
- The most frequent infectious complications in diabetic patients and their treatment
- Incidence of diabetic nephropathy in a population of patients with diabetes mellitus in Slovakia: results of the NEFRITI investigation
- Early screening and treatment slow the progression of diabetic nephropathy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

