-
Medical journals
- Career
Analýza epidemiologických a molekulárních dat surveillance invazivního meningokokového onemocnění v České republice za období 1993–2020
Authors: P. Křížová 1; M. Honskus 1,2; Z. Okonji 1; M. Musílek 1; J. Kozáková 1
Authors‘ workplace: Národní referenční laboratoř pro meningokokové nákazy, Centrum epidemiologie a mikrobiologie, Státní zdravotní ústav, Praha 1; 3. lékařská fakulta Univerzity Karlovy, Praha 2
Published in: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 3, s. 148-160
Category: Original Papers
Overview
Cíl: V této studii prezentujeme analýzy epidemiologických a molekulárních dat surveillance invazivního meningokokového onemocnění (IMO) v České republice (ČR) za období 1993–2020, které je pro možnost porovnání trendů rozděleno do čtyř sedmiletých období: 1993–1999, 2000–2006, 2007–2013 a 2014–2020.
Materiál a metody: Data surveillance IMO vznikají propojením dat Národní referenční laboratoře pro meningokokové nákazy s epidemiologickými daty rutinně hlášenými do informačních systémů infekčních nemocí s vyloučením duplicit. Metodou sekvenace celého genomu (WGS) byly analyzovány vybrané izoláty z IMO. V této studii jsou analyzována WGS data 323 izolátů, které způsobily IMO v ČR mezi roky 1993–2020.
Výsledky: Za celé sledované období 1993–2020 bylo v programu surveillance IMO zjištěno 2 674 onemocnění, z nichž 272 skončilo úmrtím na IMO. V prvním sedmiletém období byla zjištěna nejvyšší nemocnost 2,2/100 000 obyvatel v roce 1995, ve třetím období byl zaznamenán pozvolný pokles nemocnosti z 0,8 na 0,6/100 000 obyvatel a v posledním období tento pokles pokračoval až do roku 2020 na nejnižší hodnotu 0,2/100 000. Ve všech čtyřech sledovaných obdobích byla nejvyšší nemocnost ve věkové skupině 0–11 měsíců, na druhém místě byla věková skupina 1–4 roky a na třetím místě věková skupina 15–19 roků. Nejvíce onemocnění způsobily meningokoky séroskupiny B (43,6 %), následované séroskupinou C (34,9 %), séroskupinou Y (1,8 %) a séroskupinou W (1,5 %). Séroskupina X byla zjištěna pouze u tří onemocnění. Celková smrtnost IMO za celé sledované období byla 10,2 % a ve srovnávaných obdobích neklesala. Z hlediska séroskupin za celé sledované období způsobily nejvyšší smrtnost meningokoky séroskupiny Y (14,6 %), následované séroskupinou W (12,5 %), séroskupinou C (12,0 %) a séroskupinou B (8,1 %). Z hlediska věkových skupin za celé sledované období byla nejvyšší smrtnost zjištěna ve věkové skupině 65 a více roků (24,7 %).
Data WGS 323 izolátů z IMO z let 1993–2020 ukázala nejpočetnější zastoupení osmi klonálních komplexů: cc11, cc44/41, cc32, cc267, cc23, cc18, cc35 a cc865. Izoláty séroskupiny C, cc11 z posledního sledovaného období, tvoří dvě vzájemně geneticky odlišné populace s odlišnými fenotypy, které jsou geneticky vzdálené od linie izolátů cc11 z prvních dvou období. Ve studovaném souboru byla zastoupena unikátní česká subpopulace izolátů séroskupiny W (ST-3342, cc865), zachycená pouze v posledních dvou sledovaných obdobích (2007–2020), jejíž pozice na fylogenetické síti podporuje teorii, že tato subpopulace séroskupiny W vznikla na území ČR z izolátů séroskupiny B mechanismem změny séroskupiny („capsule switching“). Klonální komplexy cc41/44, cc32, cc267, cc18 a cc35 jsou v převážné většině tvořeny izoláty séroskupiny B, zatímco cc23 je tvořen výhradně izoláty séroskupiny Y.
Závěry: Analýza dat surveillance za 28leté období potvrzuje, že současné nastavení vakcinační strategie v ČR, tj. očkování malých dětí a adolescentů kombinací vakcíny MenB a konjugované tetravakcíny A, C, W, Y, nejlépe odpovídá dlouhodobé epidemiologické situaci IMO v ČR.
Klíčová slova:
surveillance – Neisseria meningitidis – smrtnost – sekvenace celého genomu (WGS) – invazivní meningokokové onemocnění – séroskupina
ÚVOD
Invazivní meningokokové onemocnění (IMO) patří i v době významných pokroků moderní medicíny mezi infekční onemocnění s vysokou smrtností a vysokým výskytem závažných celoživotních následků u přeživších. Ve světě je zaznamenáno ročně více než milion případů IMO s průměrnou smrtností 10–20 %, která však může dosáhnout až 40 % u onemocnění vyvolaných hypervirulentními klony meningokoka [1–3]. Nebezpečnost tohoto onemocnění spočívá kromě jiného i v rychlosti rozvoje závažného klinického stavu, kdy během několika hodin z plného zdraví může být pacient ohrožen na životě [4].
Vzhledem k vysoké smrtnosti IMO a vysokému procentu celoživotních následků je důležité proti tomuto onemocnění očkovat. Podkladem pro vakcinační strategii v každé zemi mají být validní epidemiologická data. V České republice (ČR) jsou k dispozici hlášená data nemocnosti od roku 1943, zpočátku však tato data zahrnovala pouze jeden z klinických projevů IMO – meningitidu. V roce 1993, kdy Národní referenční laboratoř pro meningokokové nákazy (NRL) zjistila v ČR výskyt nového hypervirulentního klonu meningokoka (Neisseria meningitidis C, klonální komplex cc11), který způsobil skokové zvýšení nemocnosti a smrtnosti IMO, byl zahájen program surveillance IMO ve spolupráci NRL s mikrobiology, epidemiology, biostatistiky a infektology celé republiky. Data surveillance IMO zahrnující i molekulární charakteristiku meningokoků jsou mezinárodně srovnatelná a pravidelně hlášena do mezinárodních databází.
K očkování proti IMO jsou Evropskou lékovou agenturou registrovány a v ČR dostupné tři konjugované tetravalentní vakcíny obsahující antigeny séroskupin meningokoka A, C, W a Y: vakcína MenACWY-TT (Nimenrix), vakcína MenACWY-CRM (Menveo), vakcína MenACWY-TT (MenQuadfi) a dvě rekombinantní vakcíny obsahující antigeny meningokoka séroskupiny B (MenB vakcíny): vakcína MenB-4C (Bexsero) a vakcína MenB-FHbp (Trumenba). Cílem očkování proti IMO je zajistit co nejčasnější, nejkomplexnější a nejdelší protektivní imunitu očkované osoby. K zajištění co nejkomplexnější imunity proti IMO je doporučena kombinace konjugované tetravakcíny A, C, W, Y a MenB vakcíny.
Strategie zavádění očkování proti IMO je v jednotlivých zemích různá. Česká vakcinologická společnost České lékařské společnosti Jana Evangelisty Purkyně (ČVS ČLS JEP) ve spolupráci s NRL připravuje a aktualizuje doporučení pro očkování proti IMO a předkládá podklady k úpravě legislativy o očkování proti tomuto onemocnění. Od 1. 6. 2020 je platné aktualizované doporučení pro očkování proti IMO s detailními informacemi pro očkování kojenců a malých dětí, adolescentů a mladých dospělých a rizikových skupin. Toto doporučení je dostupné na webových stránkách ČVS [5] a na webových stránkách NRL [6].
Od 1. 1. 2018 je podle zákona č. 48/1997, o veřejném zdravotním pojištění, § 30 hrazeno očkování proti IMO u pojištěnců s vybranými zdravotními indikacemi. Od 1. 5. 2020 bylo novelou zákona mezi hrazená očkování zařazeno očkování malých dětí MenB vakcínou a konjugovanou tetravakcínou A, C, W, Y. Od 1. 1. 2022 vstoupila v platnost další novela zákona, která rozšířila úhradu očkování i pro adolescenty, je-li očkování zahájeno od dovršení čtrnáctého do dovršení patnáctého roku věku. Rovněž byly zpřesněny zdravotní indikace očkování proti IMO u osob s poruchami imunity.
V této studii prezentujeme analýzy epidemiologických a molekulárních dat surveillance IMO v ČR za období 1993–2020, které je pro možnost porovnání trendů rozděleno do čtyř sedmiletých období: 1993–1999, 2000–2006, 2007–20013 a 2014–2020.
MATERIÁL A METODY
Surveillance invazivního meningokokového onemocnění
Data surveillance IMO vznikají propojením dat NRL s epidemiologickými daty rutinně hlášenými do informačních systémů infekčních nemocí s vyloučením duplicit. Případy IMO jsou v databázi surveillance zařazovány do jednotlivých roků podle data počátku onemocnění. Definice případu IMO je v souladu s evropskou i českou legislativou [7, 8]. Do analýzy incidence IMO za období 1993–2020 je zahrnuta populace celé ČR, počty obyvatel ke konci každého kalendářního roku byly získány z údajů Českého statistického úřadu [9]. Analýzy dat surveillance IMO v České republice jsou každoročně publikovány ve Zprávách Centra epidemiologie a mikrobiologie SZÚ Praha a tyto články jsou dostupné na webu NRL [10].
Charakterizace izolátů N. meningitidis
NRL provádí konfirmaci, určení séroskupiny a určení sekvenačního typu (sequence type, ST) se zařazením do klonálního komplexu (clonal complex, cc) u všech doručených izolátů N. meningitidis z IMO. Séroskupiny jsou určovány klasickými sérologickými metodami a ověřeny molekulární metodou polymerázové řetězové reakce v reálném čase (RT-PCR). Metodou multilokusové sekvenační typizace (MLST) jsou určeny ST, které jsou přiřazeny do cc na základě dat dostupných v mezinárodní databázi PubMLST [11]. Metodou sekvenace celého genomu (WGS) byly analyzovány vybrané izoláty z IMO [12]. Součástí této studie je WGS analýza 323 izolátů z IMO v České republice z let 1993–2020. Izoláty byly porovnány na úrovni rozlišení 1 605 lokusů (core genome MLST) v programu Genome Comparator, který je součástí PubMLST databáze. „Distance matrix“, které jsou založené na přítomnosti a genetické variabilitě všech definovaných lokusů napříč srovnávanými izoláty, byly vygenerovány automaticky a na jejich základě byly sestaveny fylogenetické sítě programem SplitsTree4, který využívá algoritmus NeighborNet. Editace a úprava fylogenetických sítí proběhla v grafickém editoru Inkscape.
VÝSLEDKY
Epidemiologická data surveillance IMO
V prvním sedmiletém období surveillance IMO (1993 až 1999) byla zjištěna nejvyšší nemocnost 2,2/100 000 obyvatel v roce 1995, ve druhém období (2000 až 2006) hodnoty nemocnosti kolísaly v rozmezí 0,7 až 1,2/100 000. Ve třetím období (2007–2013) byl zaznamenán pozvolný pokles nemocnosti z 0,8 na 0,6/100 000 obyvatel a v posledním období (2014–2020) tento pokles pokračoval až do roku 2020 na nejnižší hodnotu 0,2/100 000 (s výjimkou mírného vzestupu v roce 2017) – obr. 1. Ve všech čtyřech sledovaných obdobích byla nejvyšší nemocnost ve věkové skupině 0–11 měsíců, na druhém místě byla věková skupina 1–4 roky a na třetím místě věková skupina 15–19 roků – obr. 2. V těchto třech věkových skupinách byl také zaznamenán největší pokles nemocnosti v průběhu sledovaných období.
Image 1. Celková nemocnost IMO, ČR, 1993–2020, surveillance data
Figure 1. Overall incidence of IMD, CR, 1993–2020, surveillance data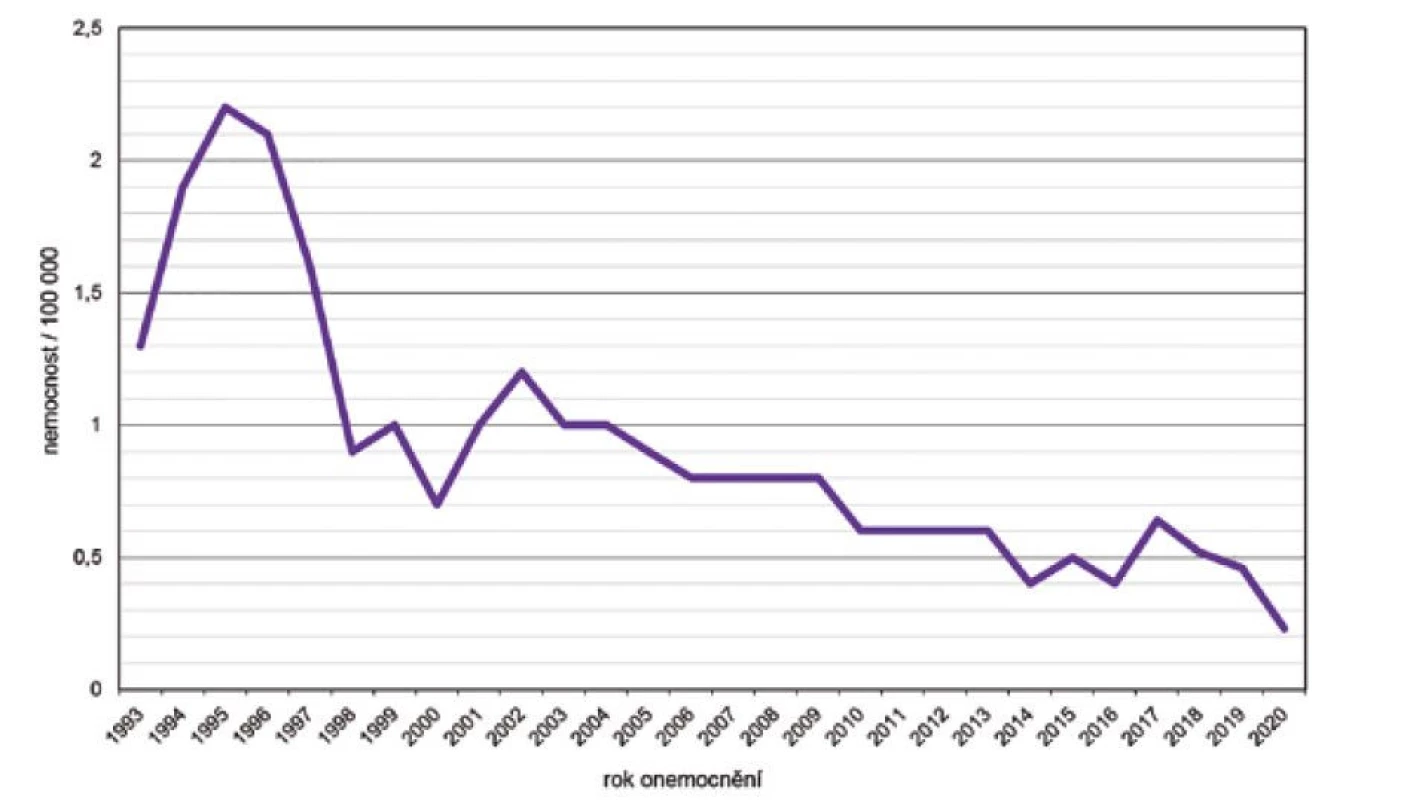
Image 2. Věkově specifická nemocnost IMO, ČR, 1993–2020, surveillance data
Figure 2. Age-specific incidence of IMD, CR, 1993–2020, surveillance data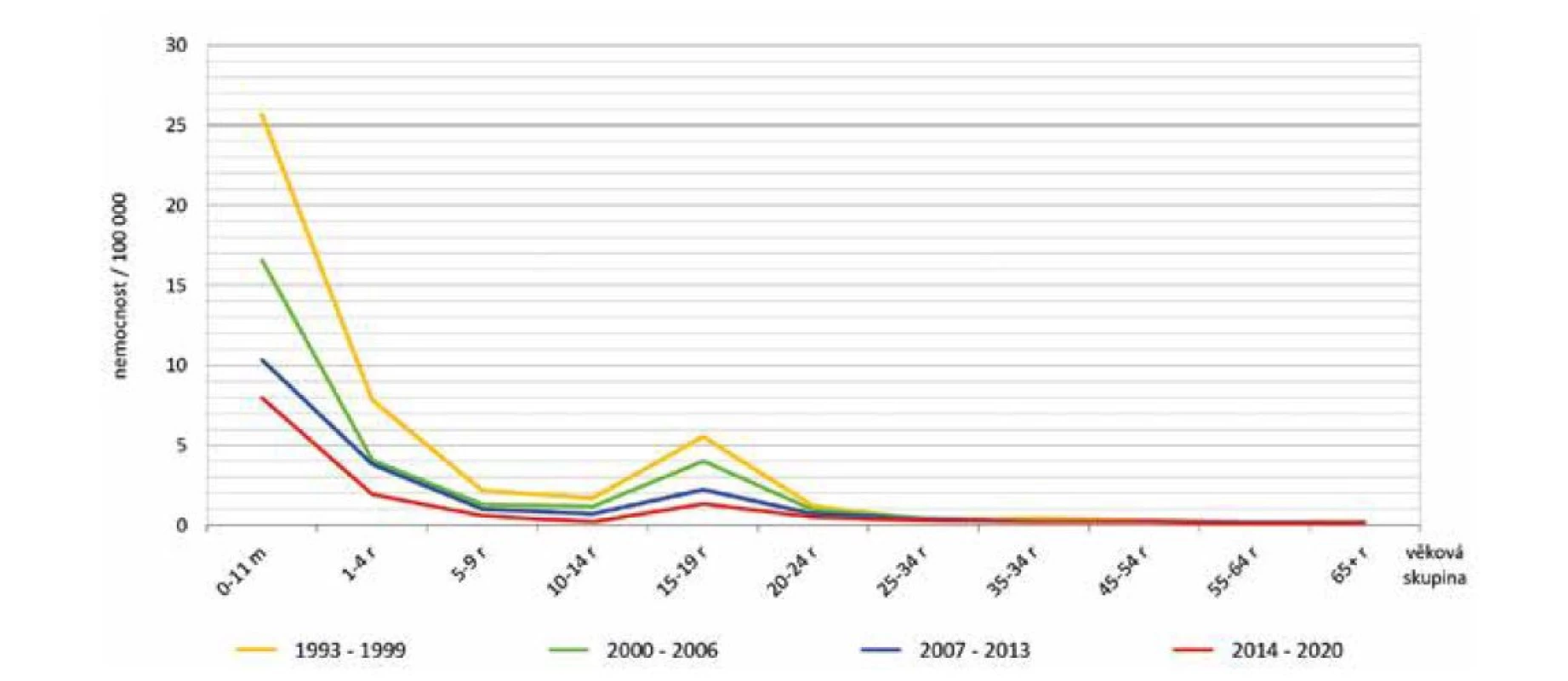
Za celé sledované období 1993–2020 bylo v programu surveillance IMO zjištěno 2 674 onemocnění. Nejvíce onemocnění způsobila séroskupina B (1165 onemocnění = 43,6 %), následovaná séroskupinou C (934 onemocnění = 34,9 %) – obr. 3. Séroskupiny W a Y byly určeny jako původci IMO u méně než 2 % případů: séroskupina W (40 onemocnění = 1,5 %), séroskupina Y (48 onemocnění = 1,8 %). Séroskupina X byla zjištěna pouze u tří onemocnění. U 464 onemocnění (17,4 %) nebyla séroskupina zjištěna (N. meningitidis ND).
Image 3. IMO dle séroskupin, ČR, 1993–2020, surveillance data
Figure 3. IMD cases by serogroup, CR, 1993–2020, surveillance data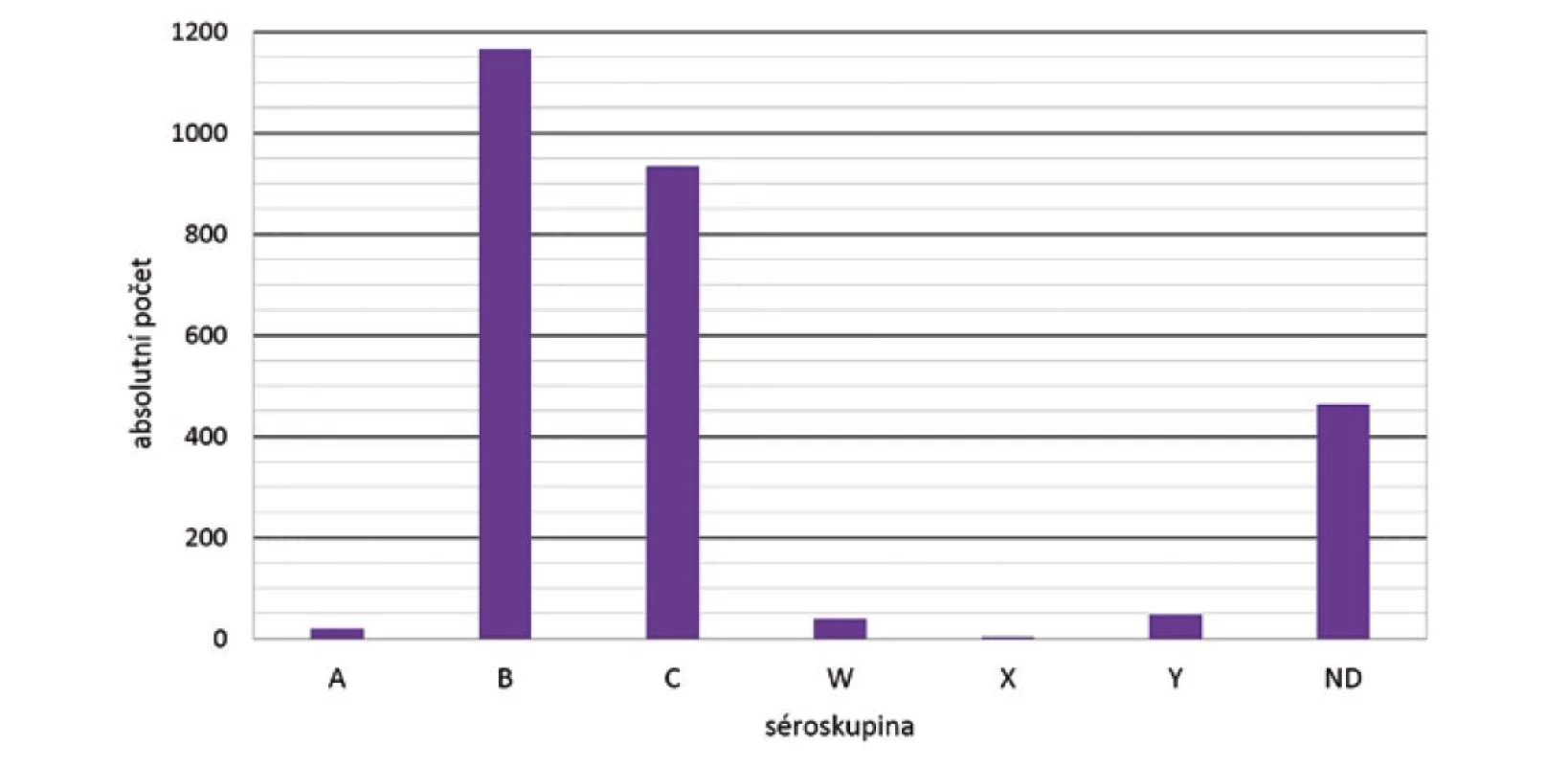
Nejvyšší absolutní počet onemocnění byl za celé sledované období zjištěn ve věkové skupině 15–19 roků (645), kde nejvyšší zastoupení měly meningokoky séroskupiny C (303) následované séroskupinou B (199) – obr. 4. Na druhém místě v počtu onemocnění byla věková skupina 1–4 roky (529), kde nejvyšší zastoupení měly meningokoky séroskupiny B (241) následované séroskupinou C (174). Na třetím místě byla věková skupina 0–11 měsíců (433), kde nejvyšší zastoupení měly meningokoky séroskupiny B (286) následované séroskupinou C (72).
Image 4. IMO dle séroskupin a věkových skupin, ČR, 1993–2020, surveillance data
Figure 4. IMD cases by serogroup and age group, CR, 1993–2020, surveillance data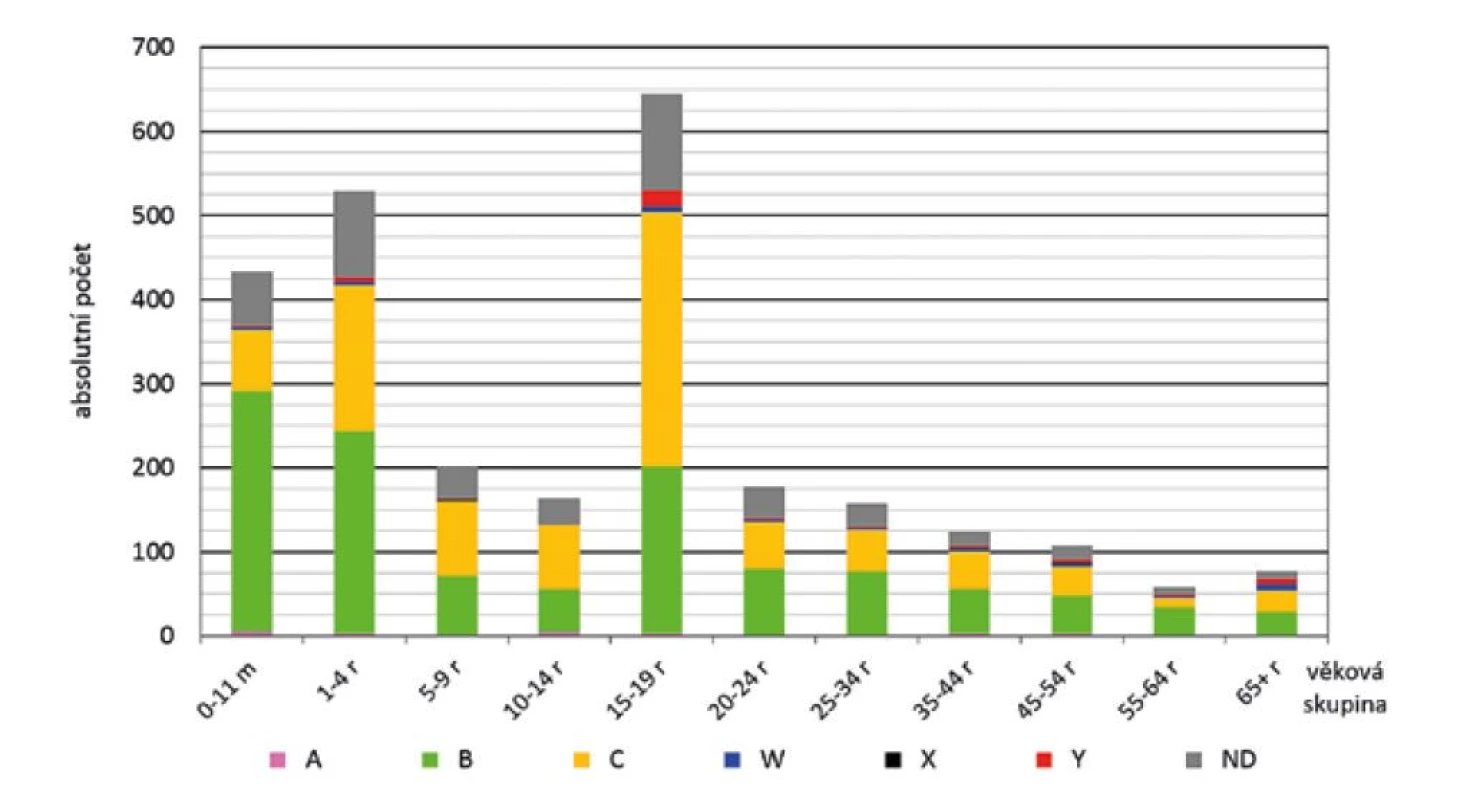
Největší pokles počtu IMO byl zaznamenán u séroskupiny C v prvních třech obdobích (568, 199 a 61 onemocnění). V posledním období došlo ale u séroskupiny C k opětovnému vzestupu (106 onemocnění) – obr. 5. U séroskupiny B byl ve druhém a třetím období zaznamenán mírný vzestup (351 a 349 onemocnění) oproti prvnímu období. V posledním sledovaném období došlo k výraznému poklesu (164 onemocnění), přesto však byla séroskupina B v tomto období nejčetnější ve srovnání s ostatními séroskupinami. Séroskupina W byla zjištěna ve všech čtyřech obdobích, se stoupajícím trendem (2, 11, 6 a 21 onemocnění). Séroskupina Y byla zjištěna v celém sledovaném období, s vyšší frekvencí ve druhém a třetím období (8, 14, 16 a 10 onemocnění). Séroskupina A byla zjištěna v nízké a klesající frekvenci (11, 7, 1 a 1 onemocnění). Séroskupina X byla zaznamenána pouze v posledních dvou obdobích (2 a 1 onemocnění). V průběhu celého období byl zaznamenán výrazný pokles onemocnění, u kterých nebyla séroskupina zjištěna (254, 105, 77 a 28 onemocnění).
Image 5. IMO dle séroskupin a sledovaných čtyř období, ČR, 1993–2020, surveillance data
Figure 5. IMD cases by serogroup and study period, CR, 1993–2020, surveillance data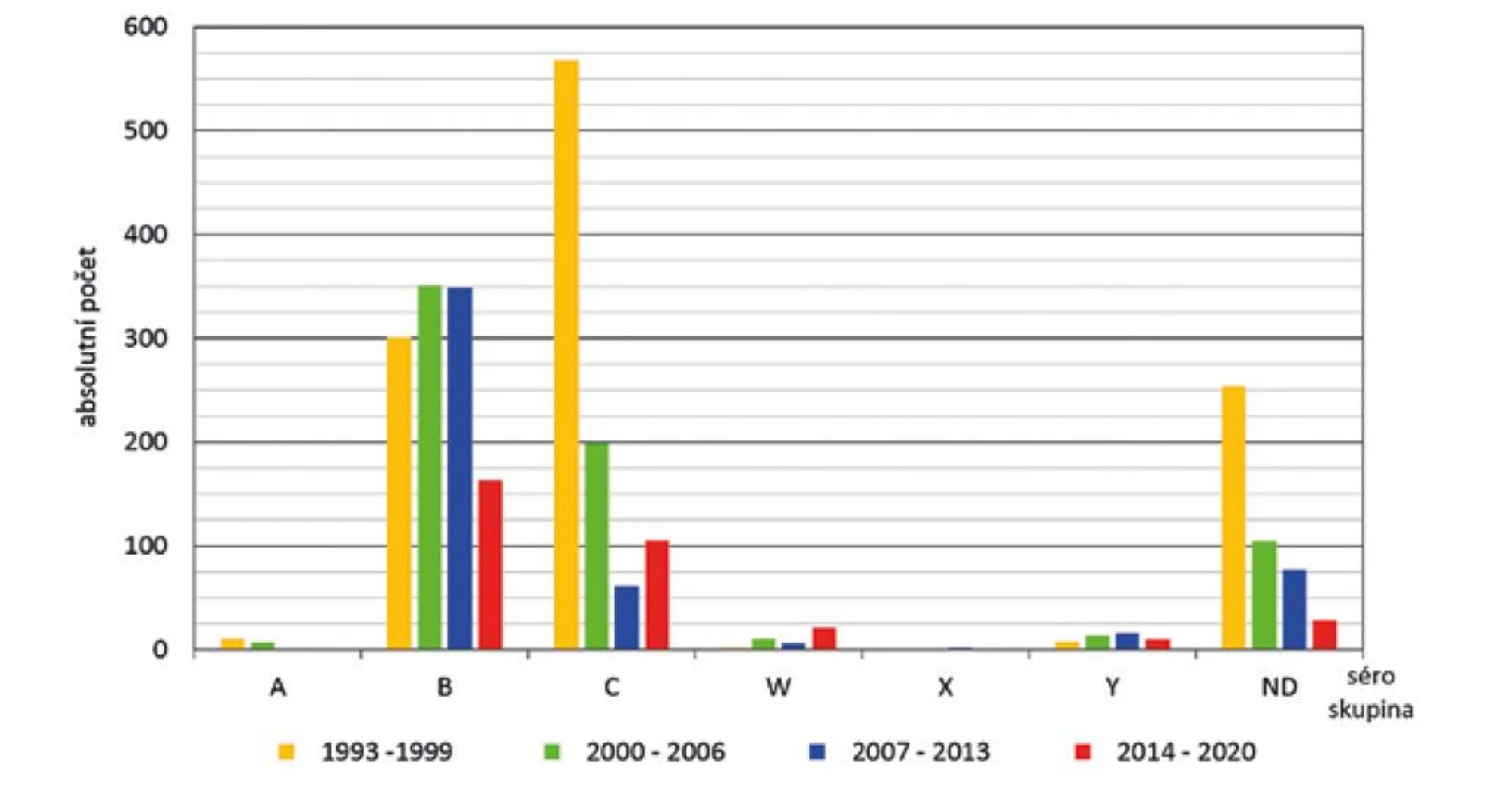
Nejvýraznější pokles počtu IMO z hlediska věkových skupin byl zaznamenán ve skupině 15–19 roků (321, 188, 92 a 44 onemocnění) – obr. 6. V nejmladších věkových skupinách byl pokles počtu onemocnění pomalejší: ve věku 0–11 měsíců: 179, 110, 82 a 62 onemocnění; ve věku 1–4 roky: 246, 104, 118 a 61 onemocnění a obě věkové skupiny v posledním období početně převýšily věkovou skupinu 15–19 roků. V ostatních věkových skupinách byl pokles počtu onemocnění pomalý, ve věkové skupině 65 a více roků byl počet onemocnění ve všech srovnávaných obdobích podobný, s mírným vzestupem v posledním období.
Image 6. IMO dle séroskupin, věkových skupin a sledovaných čtyř období, ČR, 1993–2020, surveillance data
Figure 6. IMD cases by serogroup, age group, and study period, CR, 1993–2020, surveillance data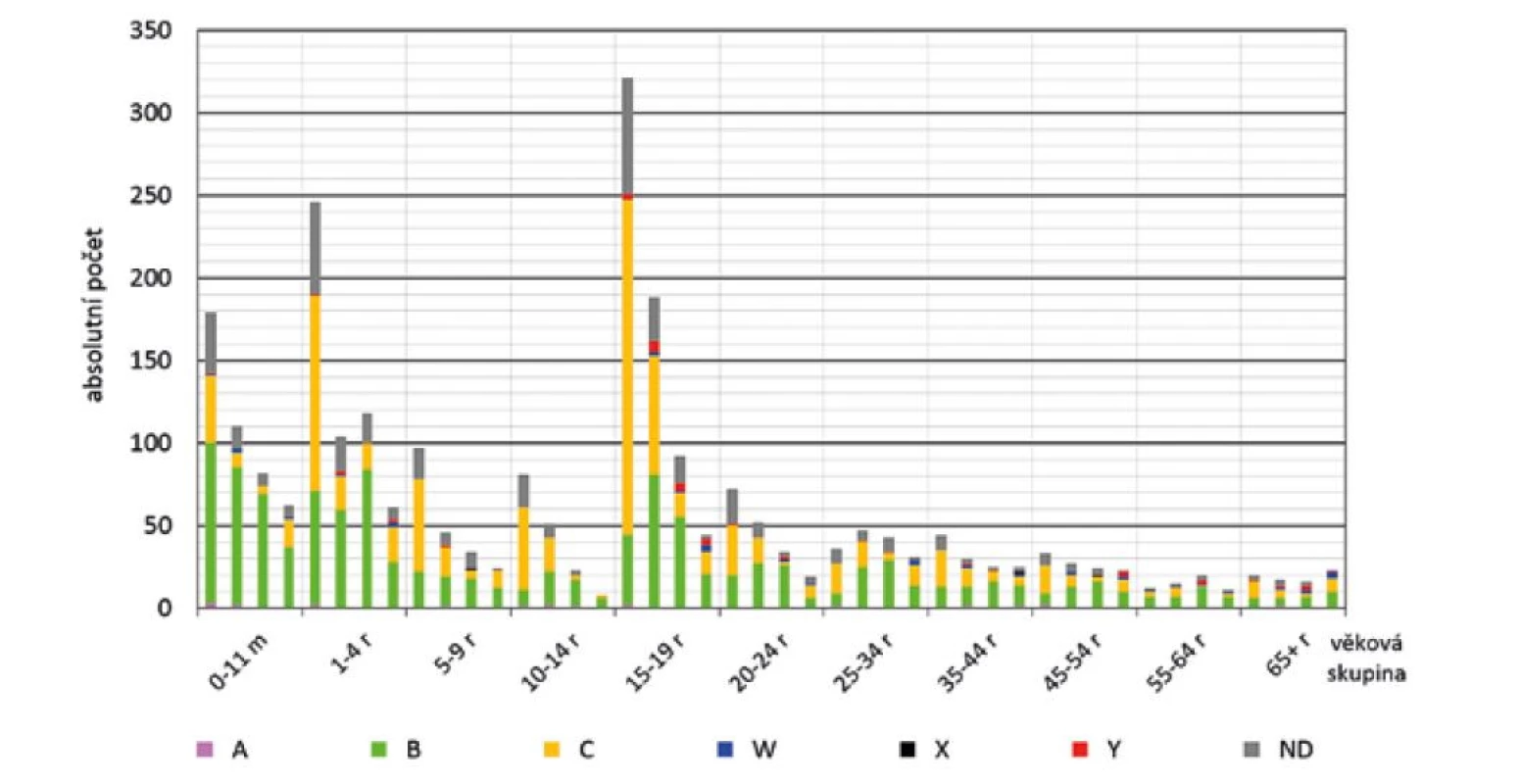
Ze zjištěných 2 674 IMO skončilo 272 úmrtím na IMO. Počet úmrtí ve čtyřech srovnávaných obdobích postupně klesal (119, 74, 46 a 33 úmrtí). Celková smrtnost IMO za celé sledované období byla 10,2 % a ve srovnávaných obdobích neklesala.
Z hlediska séroskupin za celé sledované období způsobily nejvyšší smrtnost meningokoky séroskupiny Y (14,6 %), následované séroskupinou W (12,5 %), séroskupinou C (12,0 %) a séroskupinou B (8,1 %) – obr. 7. Vysoká smrtnost meningokoků séroskupiny X (33,3 %, v grafu neuvedeno) je zatížena chybou malých čísel: za celé sledované období byla pouze 3 onemocnění způsobená séroskupinou X. Smrtnost způsobená meningokoky jednotlivých séroskupin se měnila v průběhu srovnávaných čtyř období – obr. 8. Nejvyšší smrtnost způsobily meningokoky séroskupiny Y v prvních dvou obdobích (25,0 % a 21,4 %) a na druhém místě ve smrtnosti byly meningokoky séroskupiny W v posledních dvou obdobích (16,7 % a 14,3 %). Třetí pozici ve smrtnosti měly meningokoky séroskupiny C, kde se hodnoty ve čtyřech srovnávaných obdobích pohybovaly v rozmezí 10,4 % až 13,1 %. Onemocnění způsobená meningokoky séroskupiny B vykazovala ve srovnávaných obdobích smrtnost v rozmezí 7,4 % až 10,4 %. V posledním srovnávaném období byla nejvyšší smrtnost způsobená meningokoky séroskupiny W, zatímco smrtnost způsobená meningokoky séroskupin B, C a Y byla v tomto období na podobných hodnotách v rozmezí 10,0 % až 10,4 %. Onemocnění způsobená meningokoky séroskupiny A vykazovala smrtnost pouze ve druhém období (14,3 %).
Image 7. Smrtnost IMO dle séroskupin, ČR, 1993–2020, surveillance data
Figure 7. IMD case fatality rate by serogroup, CR, 1993–2020, surveillance data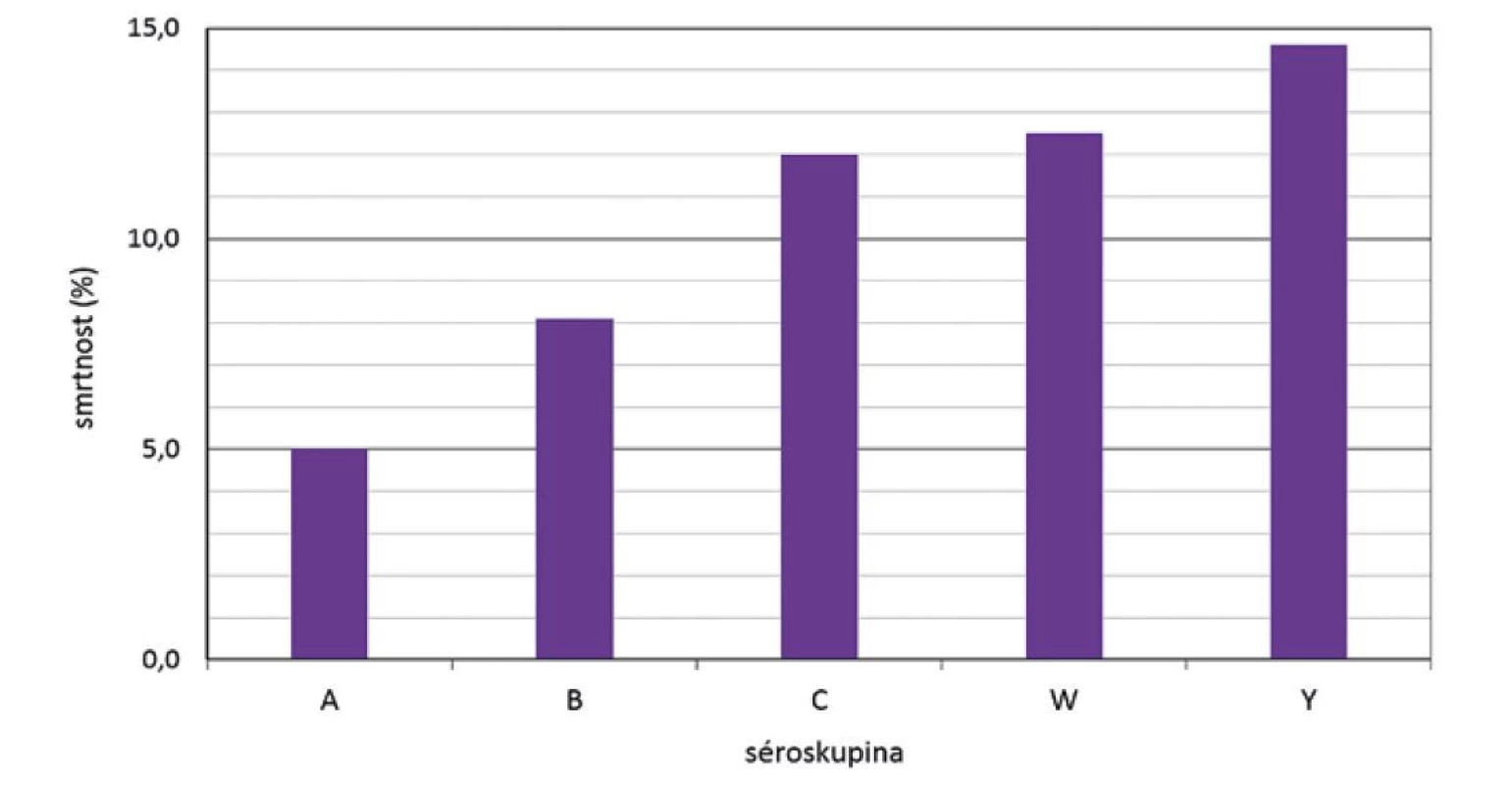
Image 8. Smrtnost IMO dle séroskupin a sledovaných čtyř období, ČR, 1993–2020, surveillance data
Figure 8. IMD case fatality rate by serogroup and study period, CR, 1993–2020, surveillance data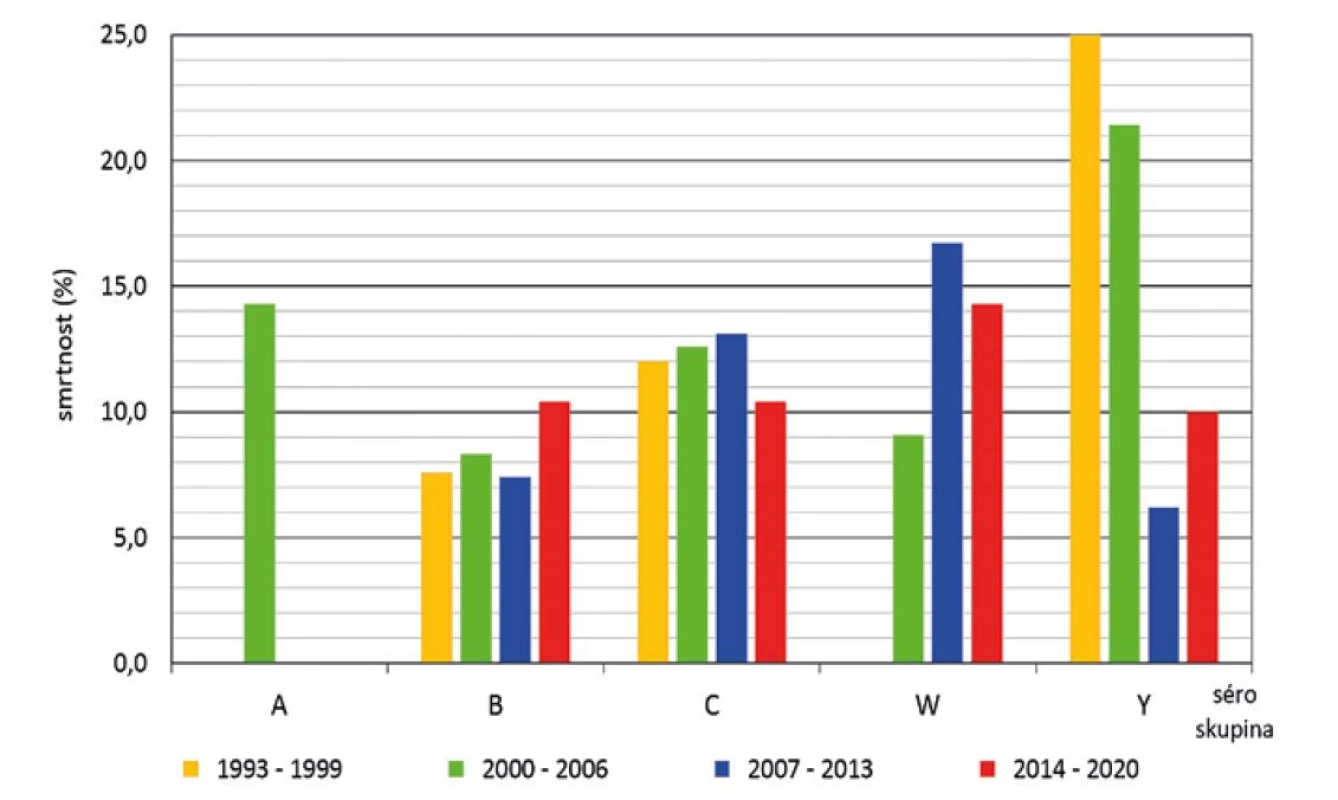
Z hlediska věkových skupin za celé sledované období byla nejvyšší smrtnost zjištěna ve skupině 65 a více roků (24,7 %), na dalších pozicích byly věkové skupiny 0–11 měsíců, 1–4 roky, 20–24 roků a 45–54 roků, kde se smrtnost pohybovala mezi 11,2 % a 11,9 % – obr. 9. Věkově specifickou smrtnost ve srovnávaných čtyřech obdobích ilustruje obrázek 10.
Image 9. Smrtnost IMO dle věkových skupin, ČR, 1993–2020, surveillance data
Figure 9. IMD case fatality rate by age group, CR, 1993–2020, surveillance data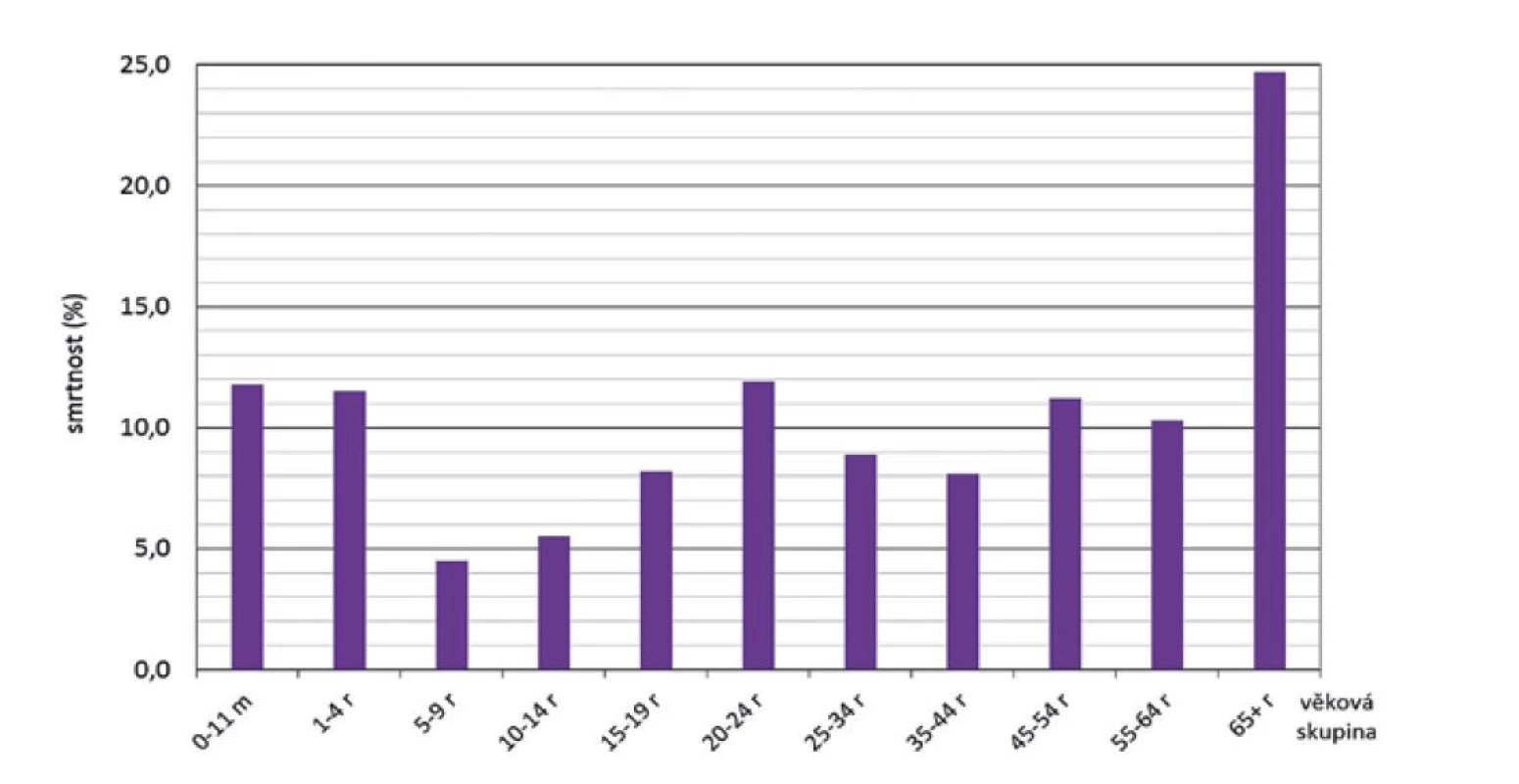
Image 10. Smrtnost IMO dle věkových skupin a sledovaných čtyř období, ČR, 1993–2020, surveillance data
Figure 10. IMD case fatality rate by age group and study period, CR, 1993–2020, surveillance data
WGS data IMO
Na fylogenetické síti jsou zobrazeny genetické vztahy 323 meningokoků z IMO v České republice mezi roky 1993–2020, které byly celogenomově osekvenovány – obr. 11. Tento soubor tvoří izoláty séroskupin: B (n = 173), C (n = 83), Y (n = 35), W (n = 24) a X (n = 3). U zbylých pěti izolátů nebyla séroskupina určena (NG). Nejpočetněji zastoupených bylo následujících osm klonálních komplexů: cc11 (n = 92), cc41/44 (n = 27), cc32 (n = 27), cc269 (n = 23), cc23 (n = 17), cc18 (n = 16), cc35 (n = 15) a cc865 (n = 10). V našem souboru byly dále zjištěny izoláty mnoha dalších komplexů: cc22, cc60, cc92, cc103, cc116, cc162, cc167, cc174, cc213, cc231, cc292, cc334, cc461, cc750 a cc1157. U 49 izolátů se objevila taková kombinace MLST genů, která nebyla zatím k žádnému klonálnímu komplexu přiřazena (ccUA).
Image 11. Genetická diverzita 323 izolátů z IMO, ČR, 1993–2020
Figure 11. Genetic diversity of 323 isolates from IMD, CR, 1993–2020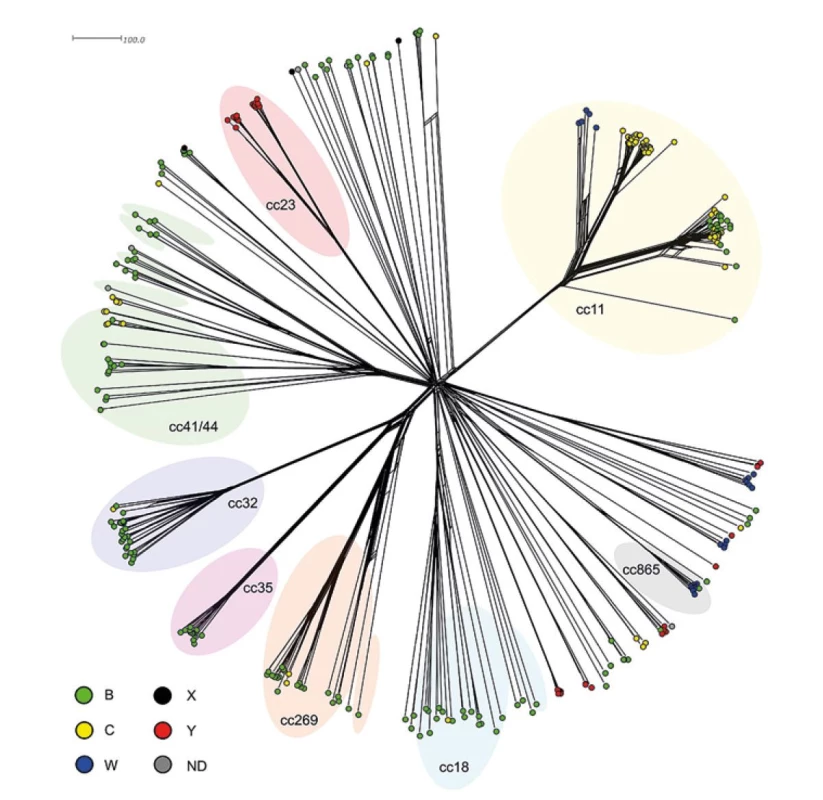
Nejpočetněji je na fylogenetické síti zastoupen klonální komplex cc11 (n = 92), který formuje dvě hlavní linie a obsahuje izoláty tří různých séroskupin: C, B a W. První linie je tvořena izoláty séroskupin C a B, které jsou blízce příbuzné a oproti očekávání netvoří samostatně stojící subpopulace, které by odpovídaly jejich séroskupinám. Od druhé linie komplexu cc11 rychle odstupuje subpopulace izolátů séroskupiny W a dále je tato linie tvořena výhradně izoláty séroskupiny C. Zajímavostí je také izolát séroskupiny B (ST-3537, cc11), který na fylogenetické síti leží zcela samostatně a nevykazuje příbuznost ani k jedné z hlavních linií cc11. Při pohledu na detailní fylogenetickou síť klonálního komplexu cc11 je patrné, že zatímco izoláty první hlavní linie byly zachyceny především v prvních dvou sledovaných obdobích 1993–2006, všechny izoláty tvořící druhou hlavní linii cc11 pochází z posledního sledovaného období (2014–2020) – obr. 12. Detailní fylogenetická síť cc11 také dokumentuje fakt, že izoláty séroskupiny C, cc11 z posledního sledovaného období tvoří dvě geneticky odlišné subpopulace – ST-11.F1 (n = 17) a ST-11.F2 (n = 20), které jsou definovány dvěma svými dominantními fenotypy: C: P1.5,2:F3-3:ST-11 (cc11); rST-2328; BAST-3 (ST-11.F1) a C: P1.5,2:F3-3:ST-11 (cc11); rST-51365; BAST-8 (ST-11.F2).
Image 12. Genetická diverzita 92 izolátů cc11 z IMO, ČR, 1993–2020
Figure 12. Genetic diversity of 92 cc11 isolates from IMD, CR, 1993–2020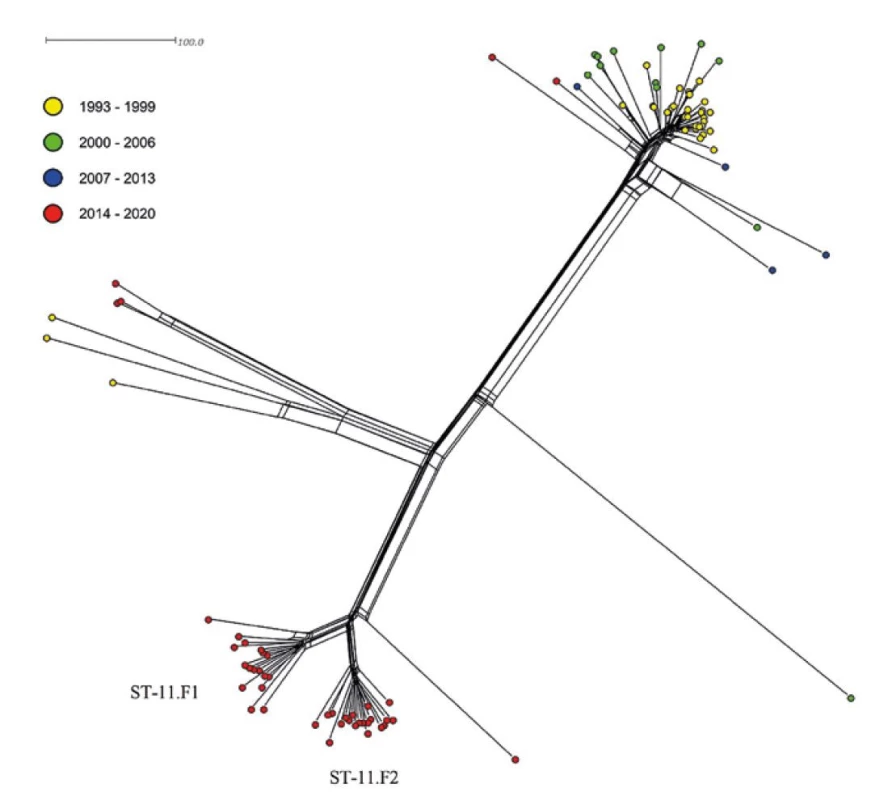
Klonální komplex cc41/44 je v souboru zastoupen 27 izoláty séroskupin B, C a NG, s jasnou převahou izolátů séroskupiny B – obr. 11. Při pohledu na fylogenetickou síť lze cc41/44 popsat jako jasně oddělený klastr izolátů, který je uvnitř vysoce heterogenní. Součástí tohoto genetického klastru jsou i izoláty, u kterých došlo k tak rozsáhlým mutacím MLST genů, že jejich ST nebyly ke komplexu cc41/44 přiřazeny, přestože jsou izolátům cc41/44 zřetelně příbuzné.
Další genetický klastr je tvořen izoláty tří vzdáleně příbuzných klonálních komplexů (cc32, cc35 a cc269), ve kterých dominuje opět séroskupina B. V rámci tohoto genetického klastru se formují dvě kompaktní linie komplexů cc32 a cc35, které jsou tvořeny vysoce příbuznými izoláty (především u cc35). Linie klonálního komplexu cc269 vykazuje vyšší míru vnitřní heterogenity a poměrně brzy od ní odstupují geneticky vzdálenější subpopulace izolátů cc269.
Séroskupina B je dominantní i u 16 izolátů vysoce heterogenního komplexu cc18, který, stejně jako cc41/44, sdružuje na fylogenetické síti i izoláty nepřiřazené k cc18.
Klonální komplex cc23 je tvořen výhradně izoláty séroskupiny Y a na fylogenetické síti je znázorněn jako kompaktní linie, která se rozděluje na dvě sesterské sublinie. Jedna z těchto sublinií je tvořena izoláty, které byly zachycené pouze v prvních dvou sledovaných obdobích (1993–2006), druhou sublinii tvoří převážně izoláty z let 2007–2013 (3. období).
Unikátní česká subpopulace osmi izolátů séroskupiny W (ST-3342, cc865), kterou jsme popsali v roce 2018 [23], tvoří spolu s jedním vysoce příbuzným izolátem séroskupiny B (ST-3342, cc865) z roku 2010 samostatně stojící genetický klastr, ke kterému dále patří pouze dva další izoláty: více příbuzný izolát séroskupiny B (ccUA) a vzdáleně příbuzný izolát Y (cc103). Všechny izoláty tohoto genetického klastru byly zachyceny výhradně ve 3. a 4. sledovaném období (2007–2020).
DISKUSE
Celosvětově je akceptována skutečnost, že IMO patří mezi nejzávažnější infekční onemocnění vzhledem k vysoké smrtnosti a výskytu závažných celoživotních následků u přeživších. Epidemiologie IMO se celosvětově neustále mění z časového i regionálních hlediska a k těmto změnám dochází vlivem kombinace sekulárních trendů výskytu IMO a vakcinačních strategií jednotlivých zemí. Ve světové literatuře je však málo publikací poskytujících analýzu epidemiologických i molekulárních dat IMO za delší časové období.
Data surveillance IMO v ČR jsou po celou dobu trvání od roku 1993 konzistentní a mezinárodně srovnatelná. Analýza dat za 28leté období surveillance IMO umožňuje hodnotit i ukazatele, které je v jednotlivých letech obtížné hodnotit, vzhledem k malým počtům onemocnění – distribuce séroskupin ve věkových skupinách, smrtnost v relaci k věkovým skupinám a séroskupinám, distribuce klonálních komplexů v relaci k séroskupinám a genetické vztahy mezi klonálními komplexy.
V posledních letech je celosvětově zaznamenán pokles incidence IMO, smrtnost však zůstává vysoká. Pokles IMO v ČR v posledních letech je tedy v souladu s celosvětovým trendem. Smrtnost IMO je v ČR nižší než v řadě zemí [1–3], v průběhu sledovaných let však nebyl u nás zaznamenán její pokles.
Za většinu IMO jsou celosvětově odpovědny meningokoky šesti séroskupin: A, B, C, W, X a Y, v zemích Evropy převažuje séroskupina B, se vzestupem séroskupin W a Y v posledních letech [1, 2, 13–15]. V ČR za 28leté období surveillance IMO výrazně převažují séroskupiny B a C, v nízké frekvenci jsou séroskupiny W a Y, které však vykazují vzestup v posledních obdobích a způsobují vysokou smrtnost.
Molekulární charakterizace meningokoků působících IMO celosvětově ukazuje, že většina onemocnění je způsobena klonálními komplexy (cc), které jsou označovány jako hypervirulentní a u některých klonálních komplexů byla prokázána spojitost se séroskupinami, například cc41/44 a cc32 jsou typické pro séroskupinu B, cc11 pro séroskupinu C a séroskupinu W, cc23 pro séroskupinu Y [16–18]. Výskyt klonálních komplexů působících IMO v České republice je z velké části v souladu s trendy pozorovanými v Evropě [19–21]. Nicméně některé naše výsledky se s evropskými trendy rozchází. Například zahraniční subpopulace séroskupiny W (cc11), nazývaná „novel-UK strain“ a působící v Anglii recentní vzestup IMO [18], byla v celém souboru českých izolátů zjištěna pouze jednou. Tato modifikace, která byla též zodpovědná za IMO na celosvětovém setkání skautů v Japonsku v roce 2015 a šířila se následně po Evropě [22], se do ČR nedostala, přestože čeští skauti se tohoto setkání účastnili.
V českém souboru izolátů séroskupiny W byla oproti zmíněné subpopulaci cc11 popsána unikátní subpopulace izolátů sekvenačního typu ST-3342 (cc865) [23]. Všechny tyto izoláty vykazují vzájemně vysokou příbuznost a byly zachyceny výhradně mezi lety 2011–2018. Vzácný sekvenační typ ST-3342 ve spojení se séroskupinou W byl podle mezinárodní databáze PubMLST detekován pouze v ČR. Ve spojení se séroskupinou B byl ST-3342 zaznamenán u izolátů z let 2010–2013 v ČR (n = 4) a Polsku (n = 3). Tyto skutečnosti spolu s pozicí izolátu B (ST-3342, cc865) uvnitř klastru osmi izolátů séroskupiny W na fylogenetické síti podporují teorii, podle které subpopulace izolátů W (ST-3342, cc865) vznikla na území ČR z izolátů N. meningitidis B změnou séroskupiny („capsule switching“) [24].
Díky metodě WGS bylo možné popsat i komplikované genetické vztahy izolátů hypervirulentního klonálního komplexu cc11, které by běžnými sekvenačními metodami působily jako identické. Izoláty séroskupiny C, cc11, které byly v ČR zachyceny v posledním sledovaném období (2014–2020) tvoří odlišnou linii, která je geneticky značně vzdálená od linie izolátů cc11 z předchozích tří období. V rámci této nové linie izolátů C, cc11 byly navíc popsány dvě oddělené subpopulace.
Vzhledem k opatřením proti onemocnění covid-19 byl i v ČR, podobně jako v jiných zemích, zaznamenán pokles IMO a dalších vzdušných bakteriálních nákaz [25–28]. Lze očekávat, že s uvolněním opatření dojde opět k vzestupu IMO, což bylo již zaznamenáno v Anglii u adolescentů a mladých dospělých koncem roku 2021 pro IMO způsobenému séroskupinou B, proti kterému nejsou adolescenti v Anglii očkováni [29]. V ČR, kde je legislativně zajištěna úhrada očkování MenB vakcínou a konjugovanou tetravakcínou A, C, W, Y od května 2020 pro malé děti a od ledna 2022 pro dospívající (je-li očkování zahájeno od dovršení čtrnáctého do dovršení patnáctého roku věku), lze očekávat, že i po uvolnění opatření proti onemocnění covid-19 nedojde k závažnému vzestupu IMO v těchto věkových skupinách, které byly v minulosti z hlediska výskytu IMO rizikové.
ZÁVĚRY
Nemocnost IMO v ČR postupně klesá, za 28leté období surveillance byl zjištěn pokles celkové nemocnosti z 2,2 na 0,2/100 000 obyvatel. Ve všech srovnávaných sedmiletých obdobích surveillance byla nejvyšší věkově specifická nemocnost v nejmladší věkové skupině 0–11 měsíců, na druhém místě byla věková skupina 1–4 roky, na třetím místě věková skupina 15–19 roků. Za celé sledované období nejvíce IMO způsobily meningokoky séroskupiny B (43,6 %), následované séroskupinou C (34,9 %). Zastoupení těchto séroskupin se však ve srovnávaných čtyřech obdobích surveillance lišilo: v prvním období byla nejčetnější séroskupina C, od druhého období byla nejčetnější séroskupina B. Meningokoky séroskupin W a Y byly určeny jako původci IMO u méně než 2 % případů (1,5 %, resp. 1,8 %), s postupným vzestupným trendem v jednotlivých obdobích. Celková smrtnost IMO za celé sledované období byla 10,2 % a na rozdíl od nemocnosti neklesala. Z hlediska věkových skupin za celé sledované období vykázala nejvyšší smrtnost skupina 65 a více roků (24,7 %), na dalších pozicích byly věkové skupiny 0–11 měsíců, 1–4 roky, 20–24 roků a 45–54 roků, kde se smrtnost pohybovala mezi 11,2 % a 11,9 %. Nejvyšší smrtnost za celé sledované období vykazovaly meningokoky séroskupiny Y (14,6 %), následované séroskupinou W (12,5 %), séroskupinou C (12,0 %) a séroskupinou B (8,1 %).
Data WGS českých izolátů z IMO z let 1993–2020 ukázala nejpočetnější zastoupení osmi klonálních komplexů: cc11, cc44/41, cc32, cc267, cc23, cc18, cc35 a cc865. Izoláty séroskupiny C, cc11 z posledního sledovaného období tvoří dvě vzájemně geneticky odlišné subpopulace s odlišnými fenotypy, které jsou geneticky vzdálené od linie izolátů cc11 z prvních dvou období. Ve studovaném souboru byla zastoupena unikátní česká subpopulace izolátů séroskupiny W (ST-3342, cc865), zachycená pouze v posledních dvou sledovaných obdobích (2007–2020), jejíž pozice na fylogenetické síti podporuje teorii, že tato subpopulace séroskupiny W vznikla na území ČR z izolátů séroskupiny B mechanismem změny séroskupiny („capsule switching“). Klonální komplexy cc41/44, cc32, cc267, cc18 a cc35 jsou v převážné většině tvořeny izoláty séroskupiny B, zatímco cc23 je tvořen výhradně izoláty séroskupiny Y. Dynamika změn genetických vztahů mezi izoláty působící IMO v ČR v průběhu sledovaných 28 let ukazuje důležitost sledování WGS dat, která spolu s epidemiologickými daty jsou podkladem k upřesňování vakcinační strategie.
Analýza dat surveillance za 28leté období potvrzuje, že současné nastavení vakcinační strategie v ČR, tj. očkování malých dětí a adolescentů kombinací vakcíny MenB a konjugované tetravakcíny A, C, W, Y, nejlépe odpovídá dlouhodobé epidemiologické situaci IMO v ČR.
Poděkování
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NV19-09-00319.
Do redakce došlo dne 29. 4. 2022.
Adresa pro korespondenci:
MUDr. Pavla Křížová, CSc.
SZÚ Praha
Šrobárova 49/48
100 00 Praha 10
e-mail: pavla.krizova@szu.cz
Sources
1. Parikh SR, Campbell H, Bettinger JA, et al. The everchanging epidemiology of meningococcal disease worldwide and the potential for prevention through vaccination. J Infect, 2020; 81(4):483–498. DOI: 10.1016/j.jinf.2020.05.079. PMID: 32504737.
2. Whitaker R, Gomes Dias J, Ramliden M, et al. The epidemiology of invasive meningococcal disease in EU/EEA countries, 2004 – 2014. Vaccine, 2017; 35(16):2034–2041. DOI: 10.1016/j.vaccine. 2017.03.007. PMID: 28314560.
3. European Centre for Disease Prevention and Control. Invasive meningococcal disease. In: ECDC. Annual epidemiological report for 2017. Stockholm: ECDC; 2019.
4. Křížová P, Rožnovský L. Meningokokové onemocnění. MAXDORF 2011, ISBN 978-80-7345-239-1.
5. Česká vakcinologická společnost ČLS JEP. Doporučení a stanoviska [online]. 2022. Dostupné na www: https://www.vakcinace. eu/doporuceni-a-stanoviska
6. Národní referenční laboratoř pro meningokokové nákazy. Očkování proti meningokokovým onemocněním [online]. Dostupné na www: www.szu.cz/ockovani-proti-meningokokovym-onemocnenim
7. Vyhláška MZ č. 473/2008 Sb. Vyhláška o systému epidemiologické bdělosti pro vybrané infekce [online]. Dostupné na www:<www.zakonyprolidi.cz/cs/2008-473>
8. EUR-Lex. Access to European Union law [online]. 2018. Dostupné na www: 9. Český statistický úřad. Věkové složení obyvatelstva [online]. Dostupné na www: <https://eur-lex.europa.eu/legal-content/CS/TXT/?qid=1551343581293&uri=CELEX:32018D0945>
9. Český statistický úřad. Věkové složení obyvatelstva [online]. Dostupné na www: <https://www.czso.cz
10. Národní referenční laboratoř pro meningokokové nákazy. Vybrané publikace [online]. Dostupné na www: http://www.szu.cz/nrl-pro-meningokokove-nakazy-publikace
11. PubMLST database: Public databases for molecular typing and microbial genome diversity. Dostupné na www: <https://pubmlst.org/organisms/neisseria-spp/>
12. Honskus M, Okonji Z, Musílek M, et al. Detailed molecular characterization of Neisseria meningitidis isolates by whole genome sequencing (WGS), Czech Republic, 2010–2019. Epidemiol Mikrobiol Imunol, 2021; 70(3):168–177. PMID: 34641691.
13. Ladhani SN, Beebeejaun K, Lucidarme J, et al. Increase in endemic Neisseria meningitidis capsular group W sequence type 11 complex associated with severe invasive disease in England and Wales. Clin Infect Dis. 2015; 60(4):578–585. DOI: 10.1093/cid/ ciu881. PMID: 25389259.
14. Törös B, Hedberg ST, Jacobsson S, et al. Surveillance of invasive Neisseria meningitidis with a serogroup Y update, Sweden 2010 to 2012. Euro Surveill. 2014; 19(42):20940. DOI: 10.2807/1560 - 7917.es2014.19.42.20940. PMID: 25358044.
15. Bröker M, Emonet S, Fazio C, et al. Meningococcal serogroup Y disease in Europe: Continuation of high importance in some European regions in 2013. Hum Vaccin Immunother. 2015; 11(9):2281-6. DOI: 10.1080/21645515.2015.1051276. PMID: 26036710.
16. Caugant DA. Genetics and evolution of Neisseria meningitidis: importance for the epidemiology of meningococcal disease. Infect Genet Evol. 2008; 8(5):558–565. DOI: 10.1016/j.meegid. 2008.04.002. PMID: 18479979.
17. Watkins ER, Maiden MC. Persistence of hyperinvasive meningococcal strain types during global spread as recorded in the PubMLST database. PLoS One. 2012; 7(9):e45349. DOI: 10.1371/ journal.pone.0045349. PMID: 23028953.
18. Lucidarme J, Hill DM, Bratcher HB, et al. Genomic resolution of an aggressive, widespread, diverse and expanding meningococcal serogroup B, C and W lineage. J Infect. 2015; 71(5):544 - 552. DOI: 10.1016/j.jinf.2015.07.007. PMID: 26226598.
19. Brehony C, Jolley KA, Maiden MC. Multilocus sequence typing for global surveillance of meningococcal disease. FEMS Microbiol Rev. 2007; 31(1):15–26. DOI: 10.1111/j.1574-6976.2006.00056.x. PMID: 17168997.
20. Bratcher HB, Brehony C, Heuberger S, et al. Establishment of the European meningococcal strain collection genome library (EMSC-GL) for the 2011 to 2012 epidemiological year. Euro Surveill. 2018; 23(20):17-00474. DOI: 10.2807/1560-7917. ES.2018.23.20.17-00474. PMID: 29790460.
21. Rodgers E, Bentley SD, Borrow R, et al. The global meningitis genome partnership. J Infect. 2020; 81(4):510–520. DOI: 10.1016/j. jinf.2020.06.064. PMID: 32615197.
22. Lucidarme J, Scott KJ, Ure R, et al. An international invasive meningococcal disease outbreak due to a novel and rapidly expanding serogroup W strain, Scotland and Sweden, July to August 2015. Euro Surveill. 2016; 21(45):30395. DOI: 10.2807/1560-7917. ES.2016.21.45.30395. PMID: 27918265.
23. Honskus M, Okonji Z, Musílek M, et al. Whole genome sequencing of Neisseria meningitidis W isolates from the Czech Republic recovered in 1984-2017. PLoS One. 2018; 13(9):e0199652. DOI: 10.1371/journal.pone.0199652. PMID: 30212468.
24. Tzeng YL, Thomas J, Stephens DS. Regulation of capsule in Neisseria meningitidis. Crit Rev Microbiol. 2016; 42(5):759-772. DOI: 10.3109/1040841X.2015.1022507. PMID: 26089023.
25. Brueggemann AB, Jansen van Rensburg MJ, Shaw D, et al. Changes in the incidence of invasive disease due to Streptococcus pneumoniae, Haemophilus influenzae, and Neisseria meningitidis during the COVID-19 pandemic in 26 countries and territories in the Invasive Respiratory Infection Surveillance Initiative: a prospective analysis of surveillance data. Lancet Digit Health. 2021; 3(6):e360-e370. DOI: 10.1016/S2589-7500(21)00077-7. PMID: 34045002.
26. Alderson MR, Arkwright PD, Bai X, et al. Surveillance and control of meningococcal disease in the COVID-19 era: A Global Meningococcal Initiative review. J Infect. 2022; 84(3):289-296. DOI: 10.1016/j.jinf.2021.11.016. PMID: 34838594.
27. Taha MK, Deghmane AE. Impact of COVID-19 pandemic and the lockdown on invasive meningococcal disease. BMC Res Notes. 2020; 13(1):399. DOI: 10.1186/s13104-020-05241-9. PMID: 32854773.
28. Subbarao S, Campbell H, Ribeiro S, et al. Invasive Meningococcal Disease, 2011-2020, and Impact of the COVID-19 Pandemic, England. Emerg Infect Dis. 2021; 27(9):2495-2497. DOI: 10.3201/ eid2709.204866. PMID: 34193335.
29. Clark SA, Campbell H, Mensah AA, et al. An increase in group B invasive meningococcal disease among adolescents and young adults in England following easing of COVID-19 containment measures [Preprint]. Dostupné na www: <https://ssrn.com/abstract=3998164>
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2022 Issue 3-
All articles in this issue
- Analýza epidemiologických a molekulárních dat surveillance invazivního meningokokového onemocnění v České republice za období 1993–2020
- Zriedkavá toxoplazmová infekcia oka a centrálneho nervového systému u HIV pozitívneho pacienta
- Současné trendy v epidemiologii malárie
- K významnému životnému jubileu prof. RNDr. Františka Ondrisku, PhD.
- Jaké rizikové faktory ovlivňují hospitalizaci u potvrzených případů černého kašle u kojenců v České republice?
- Rekreačné bazény plnené termálnou mineralizovanou vodou sú potenciálnymi rezervoármi patogénnych Vibrio spp.
- Nový pohled na indikační kritéria pro podání monoklonálních protilátek proti covid-19 v éře očkování
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zriedkavá toxoplazmová infekcia oka a centrálneho nervového systému u HIV pozitívneho pacienta
- Současné trendy v epidemiologii malárie
- Analýza epidemiologických a molekulárních dat surveillance invazivního meningokokového onemocnění v České republice za období 1993–2020
- Jaké rizikové faktory ovlivňují hospitalizaci u potvrzených případů černého kašle u kojenců v České republice?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

