-
Medical journals
- Career
Listerióza – analýza výskytu humánních případů v České republice v letech 2008–2018
Authors: M. Špačková 1; M. Gašpárek 2; F. Stejskal 3,4,5
Authors‘ workplace: Oddělení epidemiologie infekčních nemocí, Centrum epidemiologie a mikrobiologie, Státní zdravotní ústav, Praha 1; Národní referenční centrum pro analýzu epidemiologických dat, Oddělení biostatistiky, Státní zdravotní ústav, Praha 2; Klinika infekčních nemocí, 2. lékařské fakulty Univerzity Karlovy a Nemocnice Na Bulovce, Praha 3; Infekční oddělení Krajské nemocnice Liberec 4; Ústav imunologie a mikrobiologie, 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 5
Published in: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 1, s. 42-51
Category: Original Papers
Overview
Cíl práce: Cílem předkládané práce je podat přehled současných znalostí o listerióze u lidí a analyzovat dostupná epidemiologická data výskytu tohoto onemocnění v České republice v letech 2008–2018.
Metody: Byla provedena rešerše dostupné literatury a dále deskriptivní analýza lidských infekcí vyvolaných listeriemi v České republice v letech 2008–2018, na základě dat zaznamenaných v systému pro hlášení infekčních onemocnění (EpiDat do roku 2017, ISIN za rok 2018). Pro zpracování a analýzu dat byl použit program MS Excel 2010. Incidenční mapy byly vytvořeny pomocí ECDC Map Maker tool (EMMa).
Výsledky: V České republice bylo v letech 2008–2018 hlášeno celkem 380 případů listeriózy (průměrná roční incidence 0,33/100 000 obyvatel). Nejvyšší průměrná věkově specifická incidence byla zaznamenána ve věkové skupině 0 letých (1,85/100 000) a potom u osob starších 60 let (průměrná incidence 0,95/100 000). Podle pohlaví bylo ve sledovaném období detekováno celkem 222 případů u mužů a 158 u žen, incidence 0,39/100 000 a 0,27/100 000, respektive. Podle krajů byla nejvyšší průměrná roční incidence v letech 2008–2018 zaznamenána v krajích Moravskoslezském (0,6/100 000) a Plzeňském (0,57/100 000). Hospitalizováno bylo 96,3 % hlášených případů a bylo nahlášeno celkem 81 případů úmrtí v souvislosti s listeriózou (u 50 případů úmrtí byla listerióza uvedena také jako přímá příčina úmrtí). Sezonní výskyt byl nejvyšší v období červen až říjen a dále v lednu. V posledních 11 letech pozorujeme v České republice oscilující trend onemocnění. Epidemie ani importované případy nebyly v tomto období v systému hlášeny.
Závěry: V posledních letech byl v zemích Evropské unie zaznamenán významný nárůst onemocnění listeriózou, zatímco v České republice pozorujeme spíše oscilující trend s velmi mírným nárůstem počtu případů. Všeobecně se jedná především o zvýšený výskyt onemocnění u osob starších 64 let (zejména pak osob starších 84 let). Vakcína proti infekcím způsobeným L. monocytogenes dosud neexistuje, proto je jedinou dostupnou prevencí osvěta konzumentů, zejména rizikových skupin, a dodržování hygienických zásad při výrobě a manipulaci s potravinami.
Klíčová slova:
listerióza – Listeria monocytogenes – epidemiologie – Česká republika – alimentární infekce
ÚVOD
Listerie jsou ubikviterní bakterie, běžně přítomné v životním prostředí; půdě, povrchových vodách, na rostlinách, v siláži [1], a také v trávicím traktu divokých i domácích savců a ptáků [2, 3]. Pro člověka je nejvýznamnější Listeria monocytogenes, podmíněně patogenní bakterie, která vyvolává závažnou antropozoonózu, listeriózu. L. monocytogenes přechodně osídluje zažívací trakt a může způsobovat různě závažná onemocnění; od akutních febrilních gastroenteritid až po invazivní onemocnění s obrazem sepse, meningitidy či meningoencefalitidy [1]. Rizikovými skupinami pro rozvoj závažných onemocnění jsou zejména jedinci s oslabenou obranyschopností organismu, novorozenci, těhotné ženy a starší osoby [1]. V posledních letech zaznamenáváme v zemích Evropské unie (EU) významný nárůst onemocnění listeriózou, zatímco v České republice (ČR) pozorujeme spíše oscilující počty případů.
Historie
L. monocytogenes byla poprvé popsána Murrayem et al. v roce 1926 při vyšetřování onemocnění králíků a morčat v domech péče o zvířata v Cambridge v Anglii [4]. Vzhledem k výrazné monocytóze, kterou u postižených králíků onemocnění způsobovalo, byly tyto bakterie pojmenovány Bacterium monocytogenes [4]. V roce 1927 byly tytéž bakterie izolovány Piriem u smrtelného onemocnění písečných krys (tzv. „nemoc Tygří řeky“) v Jižní Africe a byly pojmenovány Listerella hepatolytica [5]. Později bylo zjištěno, že toto pojmenování bylo již dříve použito pro jiný mikroorganismus, a bakterie byla Piriem v roce 1940 přejmenována na rod Listeria [6]. První lidské infekce, jejichž klinické projevy nebo patologicko-anatomická symptomatologie odpovídaly obrazu listeriové infekce, byly popsány již počátkem 20. století. První bakteriologicky ověřené případy listeriózy u lidí popsal v roce 1929 Nyfeld u pacientů s tonzilitidou a uzlinovým syndromem [7]. Listerie byly izolovány z hemokultur a likvoru pacientů s meningitidou [8]. Hromadný výskyt vrozené listeriózy byl v Evropě poprvé popsán ve Spolkové republice Německo v roce 1949 jako granulomatosis infantiseptica (podle charakteristických granulomů v tkáních novorozenců) [9]. První epidemie listeriózy u lidí způsobená konzumací kontaminovaných potravin byla popsána až v roce 1981 Schlechem [1, 10].
Charakteristika rodu Listeria
V současnosti rod Listeria zahrnuje 22 druhů bakterií, které jsou zařazeny do jedné ze dvou skupin; Listeria sensu stricto, kam patří také L. monocytogenes, a Listeria sensu lato [1, 11]. Pro člověka je za patogenní považován pouze druh L. monocytogenes; grampozitivní, fakultativně anaerobní, nesporulující, pohyblivá, tyčkovitá bakterie, u které dále rozlišujeme 13 sérotypů podle somatických O antigenů a bičíkových H antigenů [1]. Většina lidských infekcí (> 90 %) je vyvolána sérotypy 1/2a, 1/2b, 1/2c a 4b [1, 3]. U imunosuprimovaných osob byly vzácně popsány také infekce L. grayi, L. seeligeri a L. ivanovii [12–14] . Pro epidemiologické studie sérotypizace není dostatečná, proto se používají další metody; pulzní gelová elektroforéza (PFGE), ribotypizace, multilokusová enzymová elektroforéza a celogenomová sekvenace [15]. L. monocytogenes se odlišuje od dalších druhů schopností vytvořit úzkou zónu beta-hemolýzy na krevním agaru, která je vázána na přítomnost listeriolysinu O, významného faktoru virulence [16]. Listerie jsou fakultativně intracelulární, netvoří spory ani pouzdra, jsou schopné množení a růstu v širokém teplotním rozmezí (0–42 °C), čili i při chladničkových teplotách. Ideální teplota pro růst listerií je 30–37 °C [2]. Listerie také tolerují až 10% koncentraci NaCl [17] a relativně nízké pH [18]. Selektivní média se používají k izolaci ze vzorků, které obsahují větší množství druhů bakterií (stolice, potraviny).
Epidemiologie listeriózy
K přenosu listerií na člověka dochází nejčastěji kontaminovanými potravinami. Ve vzácných případech může být infekce přenesena přímým kontaktem s nakaženým zvířetem [14]. Listerie mají velkou schopnost přežívat v potravinářských plodinách [19, 20] a tvořit biofilm na površích potravinářských zařízení [21]. K primární kontaminaci potravin může dojít obsahem střev jatečních zvířat, trusem ptáků, hlodavců či hmyzem, půdou a hnojem [22]. K sekundární kontaminaci dochází při nedodržení zásad správné výrobní a hygienické praxe v průběhu výroby a uchovávání potravin [23]. Rizikovými potravinami jsou především potraviny určené k přímé spotřebě; neuvařené nebo nedostatečně tepelně upravené párky, klobásy, salámy, nedostatečně tepelně upravená drůbež, jiné krájené masné výrobky, ryby a výrobky z ryb (zejména uzené a syrové nakládané ryby), měkké sýry a lahůdky, cukrářské výrobky, paštiky, nepasterizované mléko a jiné mléčné výrobky, a v posledních letech se jako vehikulum uplatňuje stále častěji také zelenina [24, 25]. Inhibice L. monocytogenes je ovlivněna hodnotou pH sýru a obsahem L(+) laktátu [26]. Pasterizace účinně inhibuje listerie v syrovém mléce [27]. Vstupní branou infekce je nejčastěji sliznice zažívacího traktu, ale také respirační nebo urogenitální trakt. U profesionálních onemocnění farmářů, veterinářů či řezníků pak porušená kůže nebo spojivka [8]. Inkubační doba listeriózy není přesně známa; u zdokumentovaných případů se pohybovala v rozmezí 1–70 dnů (průměrně 8 dnů) po pozření kontaminované potravy. Bývá delší u těhotných žen a naopak kratší například u febrilních gastroenteritid [1].
Podle odborné skupiny pro alimentární onemocnění Světové zdravotnické organizace (Foodborne Disease Burden Epidemiology Reference Group, FERG) byl pro rok 2010 odhadnut celosvětový výskyt listeriózy na 14 169 případů a počet úmrtí způsobených listeriemi na 3 175 [28]. V novějších metaanalýzách byl odhad ještě vyšší – 23 150 případů a 5 463 úmrtí [29]. Dvacet jedna procent případů bylo zaznamenáno v souvislosti s těhotenstvím [29]. Ve 28 členských zemích EU bylo v roce 2017 hlášeno 2 480 případů listeriózy (incidence 0,48/100 000; 39 případů hlášeno v rámci 10 epidemií) [24].
Podle stávající platné legislativy „Prováděcí rozhodnutí Komise (EU) 2018/945 ze dne 22. června 2018 o přenosných nemocích a souvisejících zvláštních zdravotních problémech, které musí být podchyceny epidemiologickým dozorem, a o příslušných definicích případů“ je hlášení listeriózy povinné ve všech členských státech EU, Islandu, Norsku a Švýcarsku. Dobrovolný systém hlášení dosud má pouze Belgie, Lucembursko a Velká Británie.
Patogeneze
Minimální infekční dávka pro člověka není u listeriózy známa. Závisí na stavu imunity hostitele a také virulenci konkrétního kmene. Rozvoj klinicky manifestního onemocnění probíhá ve dvou fázích:
1. Ve střevě dochází pomocí aktivní endocytózy k průniku listerií do epiteliálních buněk tenkého střeva a jejich pomnožení v makrofázích.
2. Pokud rezidentní makrofágy a monocyty nejsou schopny pozdržet rozvoj generalizované infekce, dochází k poškození cílových orgánů, především centrálního nervového systému a v těhotenství placenty [30].
Při generalizované infekci vznikají v postižených orgánech specifické granulomy (listeriomy), což jsou drobné bělavé uzlíky viditelné makroskopicky [30]. Specifické povrchové proteiny, které jsou kovalentně vázány k peptidoglykanu a na C konci mají specifický motiv LPXTG umožňují adhezi listerií k mukóze střevního epitelu. Pomocí povrchového proteinu internalinu, který reaguje s E-cadherinem, receptorem na epiteliálních buňkách a makrofázích, je iniciována fagocytóza. Pomocí listeriolysinu O, “pore-forming” toxinu a fosfolipázy listerie unikají z fagozomu, a tak se brání intracelulárnímu usmrcení. Uvnitř buněk se listerie pohybují směrem k cytoplazmatické membráně podél polymerizovaného aktinu, k jehož aktivaci dochází pomocí povrchového proteinu ActA. Na cytoplazmatické membráně indukují tvorbu filopodií a jsou pohlceny sousedními buňkami (makrofágy, enterocyty, hepatocyty). Tímto způsobem listerie unikají působení hostitelské imunity (protilátkám, komplementu, neutrofilním leukocytům) a dochází k šíření infekce v organismu. Protilátková imunitní odpověď v průběhu onemocnění listeriózou nehraje klíčovou roli a netvoří ochranu proti sekundární infekci [31]. Monoklonální protilátky proti listeriolysinu O (jenomu z faktorů virulence listerií) mohou poskytnout určitou ochranu proti úniku listerií z fagozomů [31]. Protilátky spolu s B lymfocyty umožňují rychlejší nástup T lymfocytární imunitní odpovědi [31].
Klinické formy infekce listeriemi u lidí
Klinický průběh infekce závisí na věku a imunitě hostitele. Asymptomatické nosičství listerií bylo pomocí pozitivních kultivací stolice detekováno přibližně u 5 % osob (1–15 %) [3, 32]. Listerie byly vykultivovány také z poševního sekretu zdravých žen [33, 34]. U starších osob s oslabenou obranyschopností organismu je [1] nejčastějším klinickým projevem listeriózy bakteriemie, která může nebo nemusí být spojena s postižením centrálního nervového systému [29]. Listeriová meningitida a meningoencefalitida je jednou z nejčastějších bakteriálních meningitid (spolu s H. influenzae, S. pneumoniae, N. meningitidis a Streptococcus sk. B) a má z nich nejvyšší smrtnost (22 %) [2]. Nástup meningoencefalitidy může být prudký, s horečkou, intenzivní bolestí hlavy, nauzeou, zvracením a příznaky meningeálního dráždění, nebo může být subakutní, obzvláště u imunokompromitovaných nebo starších osob. Až 11 % novorozenců a 30 % dospělých má po prodělání listeriové meningitidy trvalé následky, jako jsou parézy končetin či mozkových nervů, mentální deficit aj. [35–37]. Málo častým až výjimečným projevem listeriové encefalitidy je rhombencefalitida, která se většinou vyskytuje u dříve zdravých dospělých osob (92 %) [38, 39]. Nejprve se objevuje horečka provázená nevolností, zvracením a bolestmi hlavy, následují poruchy funkce hlavových nervů, mozečku nebo hemiparézy, hypestezie a poruchy vědomí. Strnulost šíje se iniciálně objevila pouze u 55 % dosud popsaných případů [39]. Zhruba u 40 % pacientů onemocnění vyústí v respirační selhání [2]. Průměrná smrtnost rhombencefalitidy dosahuje 51 %, u neléčených pacientů je 100 %, při léčbě ampicilinem nebo penicilinem méně než 30 %. Mozkový absces vzniká u 10 % listeriových infekcí CNS, často je provázen bakteriemií a meningitidou. Smrtnost je vysoká a u přeživších až v 61 % přetrvávají neurologické potíže [2, 39]. Mezi komplikace invazivního onemocnění listeriózou patří cholecystitida, peritonitida, pleuropulmonární infekce, artritidy, osteomyelitida, perikarditida, myokarditida a endokarditida [2]. Lokalizované formy infekce jsou vzácné. Mohou být způsobeny přímou inokulací listerií; zahrnují konjunktivitidu, kožní infekce s tvorbou podkožních abscesů a lymfadenitidou [40].
Případy listeriózy v souvislosti s těhotenstvím jsou definovány jako infekce matky, plodu anebo novorozence do 28 dnů po porodu [14]. Listerióza matky získaná v těhotenství je velmi závažným zdravotním rizikem pro plod. K nákaze dítěte může dojít transplacentárně (vrozená listerióza), při průchodu porodními cestami nebo nozokomiálním přenosem [41]. Případy listeriózy v souvislosti s těhotenstvím tvoří 21–27 % všech sporadických případů listeriózy [29, 33]. Incidence listeriózy u novorozenců v Evropě je 4,7–30/100 000 živě narozených dětí (průměrně 8,6/100 000) [33, 42]. Manifestace onemocnění u dětí je nejčastější v průběhu prvních dvou týdnů života, v dalším časovém období její výskyt prudce klesá a po 2. měsíci života je u zdravého dítěte extrémně vzácná [43]. Zvýšené riziko infekce u gravidních žen je důsledkem snížené imunity, užívání antacid a suplementace železa, jež je důležitým růstovým a virulentním faktorem listerií [37, 44]. Lokální útlum specifické buněčné imunity, který je nezbytným předpokladem imunologické tolerance plodu, vede ke zvýšené vnímavosti těhotných žen k infekcím vyvolaným intracelulárními patogeny [45]. Nejvýraznější oslabení Th1-buněčné imunity je pozorováno ve třetím trimestru těhotenství, zejména ve 26. až 30. gestačním týdnu, kdy je riziko listeriózy 17–100krát vyšší než u běžné populace [2, 46]. U matky probíhá onemocnění asymptomaticky (> 30 %) nebo jako lehké onemocnění s febriliemi a chřipkovými příznaky, které se projeví 1–5 dní před vypuzením plodu. Je-li však infekce komplikována chorioamnitidou, febrilie přetrvávají až do ukončení těhotenství. V prvním trimestru je infekce listeriózou u žen pozorována pouze vzácně [47]. Ve druhém trimestru infekce matky končí většinou potratem, kdy u dítěte není zánětlivá reakce plně rozvinuta. Při infekci ve třetím trimestru je průběh protrahovanější a u plodu často nacházíme hnisavou meningitidu [48]. Infekce proniká do placenty hematogenní cestou; v trofoblastu se listerie replikují skryty před imunitními mechanismy, vzniká vilitida a mikroabscesy placenty, které se následně stávají zdrojem reinfekce orgánů matky [49]. Eliminace infekce matky je v tomto případě možná pouze vypuzením infikovaného plodu (potratem nebo předčasným porodem). Po vypuzení plodu se stav matky rychle upraví i bez léčby [2]. Novorozenecká listerióza se vyskytuje ve dvou formách, časné a pozdní. Syndrom časné sepse se rozvíjí záhy po porodu anebo v průběhu prvního týdne života a provází jej respirační insuficience, horečka, vyrážka, otitida, hypotermie, cyanóza, křeče či hnisavá konjunktivitida. V tomto případě je infekce pravděpodobně získaná in utero. Pozdní nástup meningitidy nebo sepse se projeví od jednoho do několika týdnů po porodu. Nákaza byla získána ingescí plodové vody při průchodu porodními cestami [2, 14]. Vzácně se popisuje granulomatosis infantiseptica s množstvím mikroabscesů a granulomů v játrech, slezině, CNS, nadledvinách a kůži novorozence. U včas léčených dětí má onemocnění dobrou prognózu i v případě závažného průběhu onemocnění [14, 50]. Nejčastějším klinickým projevem novorozenecké listeriózy je bakteriemie (30,7 %), dále byly zaznamenány případy infekce CNS (15,2 %) u nichž ve 43,8 % přetrvávaly neurologické následky, a v 9,2 % případů u živě narozených dětí skončilo onemocnění úmrtím [29].
Rizikovými faktory pro vznik onemocnění u lidí jsou věk 0–28 dní, více než 64 let, imunosuprese, onemocnění ledvin, jater, diabetes mellitus a těhotenství [2]. U pacientů neutropenických, splenektomovaných, s poruchou komplementu nebo tvorby protilátek není pozorován zvýšený výskyt invazivní listeriózy [2]. Děti ve věku 1–4 roky podle výsledků metaanalýzy onemocní pouze ve 2 %, což je méně než v ostatních věkových skupinách [29]. V Evropě bylo ve věkové skupině 0–4letých v roce 2010 85 % případů hlášeno u novorozenců [42]. Nejčastějšími predispozičními faktory pro onemocnění listeriózou mimo těhotenství jsou hematologické malignity a solidní tumory (incidence 13/100 000), imunosupresivní terapie a stav po transplantaci orgánů (incidence 200/100 000) [37]. Incidence listeriózy u HIV pozitivních je 52/100 000 a u nemocných AIDS 115/100 000. Mnoha případům listeriózy u HIV pozitivních osob je pravděpodobně zabráněno rutinní profylaxí Pneumocystis jirovecii trimetoprim-sulfametoxazolem [14]. Nejvíce případů listeriózy u HIV pozitivních pacientů se vyskytuje v pokročilém stadiu nemoci při počtu CD4 T-lymfocytů < 100/mm3 [2]. V souvislosti s alkalizací žaludku jsou pro onemocnění listeriózou rizikovými užívání laxativ, antagonistů H2 receptorů, inhibitorů protonové pumpy nebo achlorhydrie [51]. Opakovaně byly rovněž popsány případy listeriové meningitidy nebo bakteriemie nastupující po jiné bakteriální infekci trávicího traktu či po gastroduodenoskopii, po operaci žaludečních vředů nebo kolonoskopii [2]. U 10–30 % případů onemocnění listeriózou nebyly zjištěny žádné predispoziční ani jiné rizikové faktory [37, 52].
Diagnostika listeriózy
Na listeriovou infekci je třeba pomýšlet při vážném onemocnění novorozenců, meningitidě a encefalitidě u osob starších 50 let, u imunokompromitovaných jedinců, těhotných žen s chřipkovými příznaky a při náhlém epidemickém výskytu gastroenteritid. Diagnostika invazivních forem listeriózy je založena na kultivaci z primárně sterilního biologického materiálu (krve, likvoru nebo amniotické tekutiny). U předčasných a febrilních porodů se ke kultivaci dále odesílá plodová voda, stěry z placenty, mekonia, lochií nebo ušní výtěry novorozence. Je také možné zaslat stěry z porodních cest matky. U novorozenců s projevy sepse je důležitým materiálem žaludeční nebo tracheální aspirát. Listerie dobře vyrostou během 36 hodin na běžných kultivačních mediích. K odlišení od difteroidů je třeba využít biochemické testy. Pro rychlou diagnostiku lze využít mikroskopický průkaz grampozitivních tyček v mekoniu [2]. Pro PCR diagnostiku jsou vhodné vzorky z krve, mozkomíšního moku a z likvoru. Sérologická diagnostika, ani stanovení hladin protilátek proti listeriolyzinu O (LLO) nejsou při akutní formě listeriózy užitečné vzhledem ke zkřížené reaktivitě se stafylokoky, enterokoky a Bacillus spp. Stanovení diagnózy by mělo být (kromě případů rhombencefalitidy) založeno na průkazu patogenu. V případě rhombencefalitidy je kultivace z mozkomíšního moku pozitivní pouze ve 41 % případů a z krve u 61 % případů [39]. Vhodnou zobrazovací diagnostickou metodou k detekci rhombencefalitidy je magnetická rezonance (vhodnější než CT) [2]. V případě horečky a chřipkových či gastrointestinálních příznaků u těhotných žen by měla být odebrána hemokultura. Kultivace z poševních stěrů nebo stolice není v těchto případech k diagnostice vhodná, neboť je pozitivní asi u 5 % zdravých osob [32, 33]. Pitevní nález je charakteristický; exantém, ložiskové změny v játrech a nadledvinách plodu, hnisavá meningitida a atypické ložiskové změny v placentě podobné bílým infarktům. Pitvu je možné doplnit kultivačním vyšetřením tkání plodu.
Terapie
Antibiotická terapie je i přes dobrou citlivost listerií na většinu antibiotik limitovaná, protože žádný z přípravků nepůsobí baktericidně [43, 53]. Lékem první volby je ampicilin nejlépe v kombinaci s gentamicinem, v případě přecitlivělosti je lékem volby trimetoprim-sulfametoxazol [43]. Délka trvání léčby listeriové meningitidy by měla být 3 týdny, u nemocných s rhombencefalitidou či mozkovým abscesem minimálně 6 týdnů. Léčba endokarditidy u dospělých pacientů by měla trvat 4–6 týdnů [43]. Smyslem terapie těhotných žen je především prevence transplacentárního přenosu infekce na plod. U těhotných žen s horečnatým onemocněním a pozitivní epidemiologickou anamnézou je doporučen odběr hemokultur a poté perorální podání aminopenicilinu [33]. U přecitlivělých na penicilinová a jiná betalaktamová antibiotika je možno použít makrolidy (spiramycin nebo erytromycin) [43]. Trimetoprim-sulfametoxazol lze podat pouze ve druhém a třetím trimestru (dva týdny před porodem se musí vysadit). Jsou-li přítomny klinické známky sepse nebo chorioamnitidy, je nutná parenterální léčba ampicilinem, případně vankomycinem nebo meropenemem. Časná diagnostika a léčba listeriové infekce matky zvyšuje šance na porod zdravého dítěte [2, 46]. Lékem volby invazivních listeriových infekcí novorozenců je parenterálně podávaný ampicilin v kombinaci s gentamicinem [43, 46].
METODY
V ČR je povinnost hlášení infekčních onemocnění dána zákonem č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů, a v souladu s vyhláškou č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce. Byla provedena rešerše dostupné literatury a deskriptivní analýza výskytu listeriózy v ČR v období od 1. ledna 2008 do 31. prosince 2018 v rámci systému pro hlášení infekčních onemocnění (EpiDat, v roce 2018 ISIN). Pracovali jsme s diagnózou A32 podle Mezinárodní klasifikace nemocí (10. revize). Byly analyzovány základní epidemiologické charakteristiky: pohlaví, věk, kraj, hospitalizovanost, sezonnost a úmrtí. Sezonnost byla zpracována v EpiDat podle data prvních příznaků a v ISIN podle data vykázání. Systém pro hlášení infekčních onemocnění v ČR není primárně určen k vykazování úmrtnosti. Data o úmrtí byla analyzována s vědomím, že výsledky nebudou zcela odpovídat reálné situaci v populaci. Pro zpracování dat byl využit MS Excel 2010. Incidenční mapy byly vytvořeny pomocí ECDC Map Maker tool (EMMa) [54]. Incidence onemocnění byla přepočítána na 100 000 obyvatel středního stavu populace ČR podle odhadu Českého statistického úřadu vždy k 1. červenci daného roku.
VÝSLEDKY
V ČR bylo v letech 2008–2018 hlášeno celkem 380 případů listeriózy (průměrná roční incidence 0,33/100 000 obyv., v rozmezí 0,25–0,44/100 000 obyv.) – graf na obrázku 1. Ve sledovaném období byl zaznamenán spíše oscilující trend onemocnění. Nejvíce onemocnění bylo zaznamenáno v roce 2016 (n = 46), nejméně v roce 2010 (n = 26). Epidemie nebyly v rámci systému pro hlášení infekčních onemocnění v tomto období hlášeny. Stejně tak nebyly hlášeny importované případy. Nejvyšší průměrná věkově specifická incidence byla zaznamenána ve věkové skupině 0 let (1,85/100 000) a potom u osob starších 60 let (průměrná incidence 0,95/100 000) – graf na obrázku 2. Ve věkové skupině 10–19letých nebyl v tomto období v ČR hlášen žádný případ. V souvislosti s graviditou byl zaznamenán 1 případ onemocnění plodu a 9 případů onemocnění diagnostikovaného u novorozence postnatálně – 5 u dívek, 5 u chlapců. Podle pohlaví bylo ve sledovaném období detekováno celkem 222 případů u mužů a 158 u žen, incidence 0,39/100 000 a 0,27/100 000 – graf na obrázku 3. Podle krajů byla nejvyšší průměrná roční incidence v letech 2008–2018 zaznamenána v krajích Moravskoslezském (0,6/100 000) a Plzeňském (0,57/100 000) – graf na obrázku 4.
Image 1. Počet případů a incidence onemocnění listeriózou v České republice v letech 2008–2018, EpiDat, ISIN
Figure 1. Listeriosis cases and incidence rates in the Czech Republic in 2008–2018, EpiDat, ISIN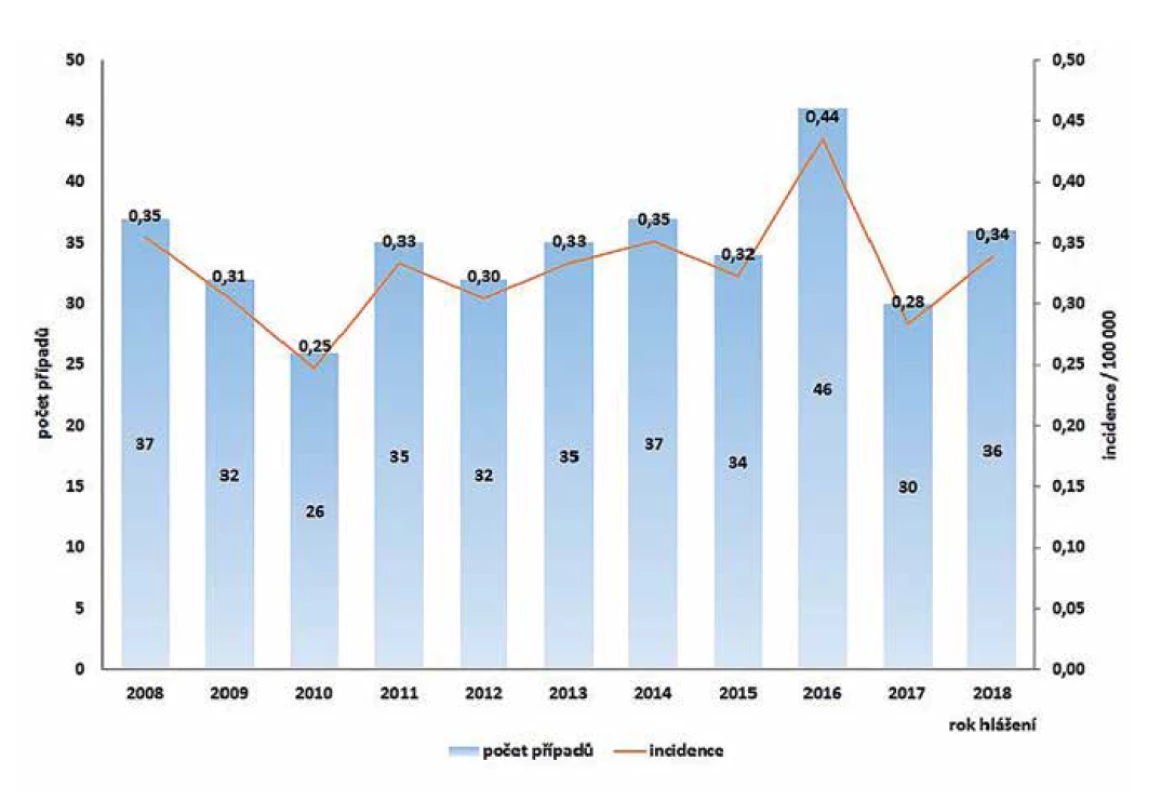
Image 2. Průměrná věkově specifická incidence onemocnění listeriózou podle věkových skupin v České republice v letech 2008–2018, EpiDat, ISIN
Figure 2. Average age-specific incidence of listeriosis by age group in the Czech Republic in 2008–2018, EpiDat, ISIN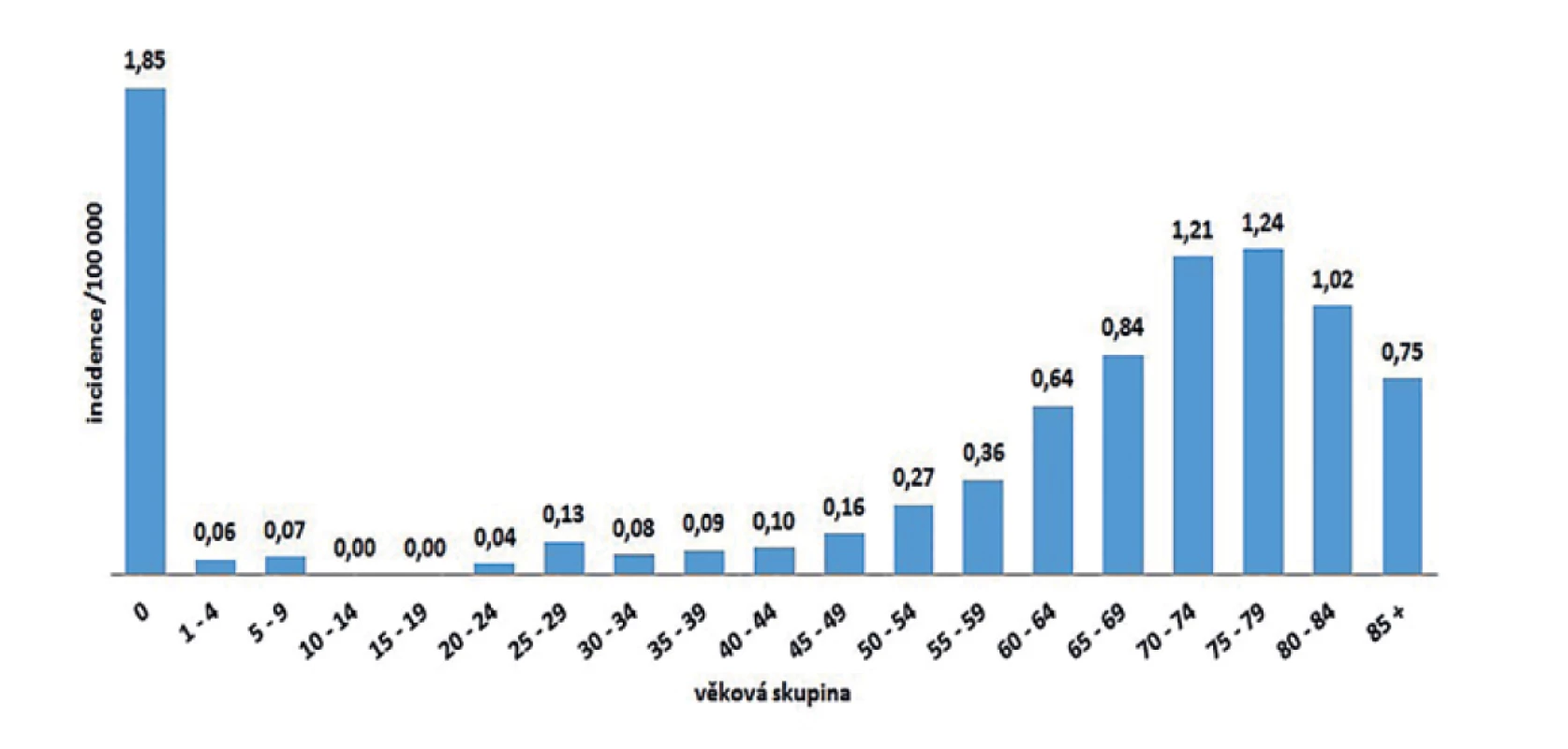
Image 3. Počet a incidence případů listeriózy podle roku hlášení a pohlaví v České republice v letech 2008–2018, EpiDat, ISIN
Figure 3. Listeriosis cases and incidence rates by reporting year and gender in the Czech Republic in 2008–2018, EpiDat, ISIN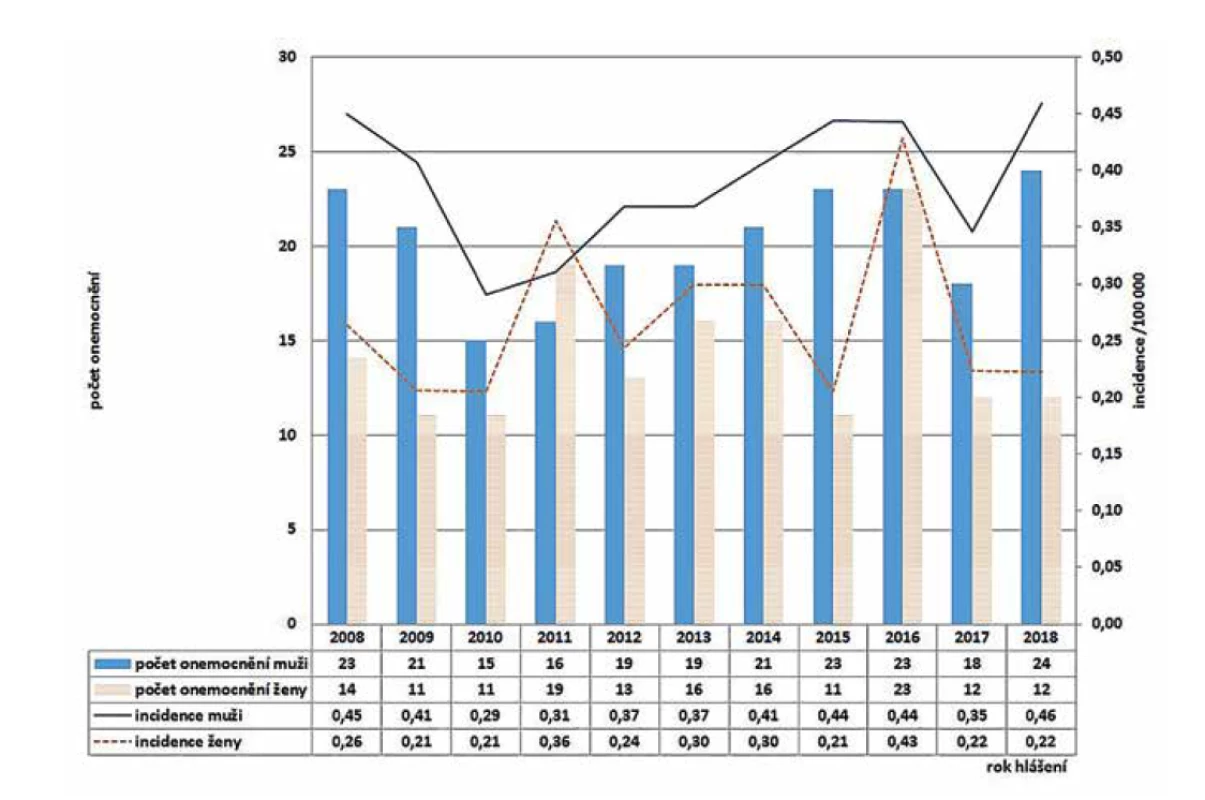
Image 4. Průměrná roční incidence případů listeriózy podle krajů v České republice v letech 2008–2018, EpiDat, ISIN
Figure 4. Average annual incidence of listeriosis by administrative region of the Czech Republic in 2008–2018, EpiDat, ISIN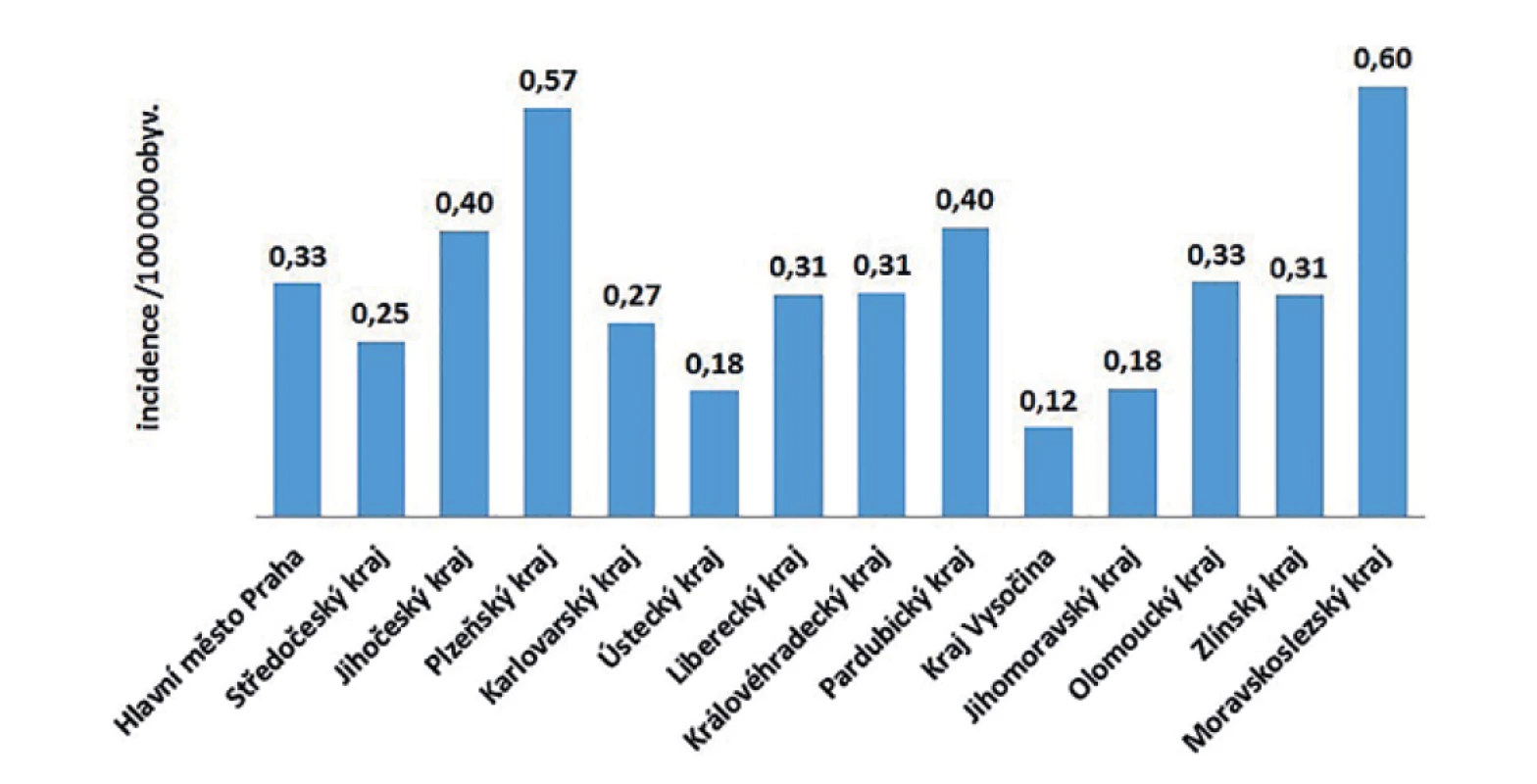
Ve sledovaném období bylo s diagnózou listeriózy hospitalizováno 96,3 % hlášených případů (v jednotlivých letech v rozmezí 90,6–100 %). V souvislosti s listeriózou bylo hlášeno celkem 81 úmrtí; 46 u mužů (56,8 %). Podle věkových skupin byla 2 úmrtí zaznamenána u 2 novorozených dívek, 1 úmrtí ve věkové skupině 5–9 let, 28 případů úmrtí ve věku od 25 do 64 let a nejvíce případů úmrtí bylo zaznamenáno u osob starších 65 let (n = 50). U 50 případů úmrtí byla listerióza uvedena také jako přímá příčina úmrtí. Celková průměrná smrtnost byla 21,3 %, nejvyšší věkově specifická smrtnost byla zaznamenána ve věkových skupinách 80–84 let (38,5 %), 75–79 let (29,5 %) a u starších 84 let (28,6 %). Průměrná smrtnost u lidí starších 64 let byla 24,9 %.
Typická sezonnost výskytu onemocnění listeriózou nebyla v ČR pozorována. Graf na obrázku 5 uvádí celkové počty detekovaných případů listeriózy podle jednotlivých měsíců, kdy nejméně případů bylo hlášeno v prosinci (za 11leté období celkem 19 případů) a nejvíce v měsících červen a říjen (za 11leté období celkem 41 případů v obou měsících).
Image 5. Kumulativní počet a průměrný počet případů listeriózy podle měsíce onemocnění v České republice v letech 2008–2018, EpiDat, ISIN
Figure 5. Cumulative and average numbers of listeriosis cases by month of onset in the Czech Republic in 2008–2018, EpiDat, ISIN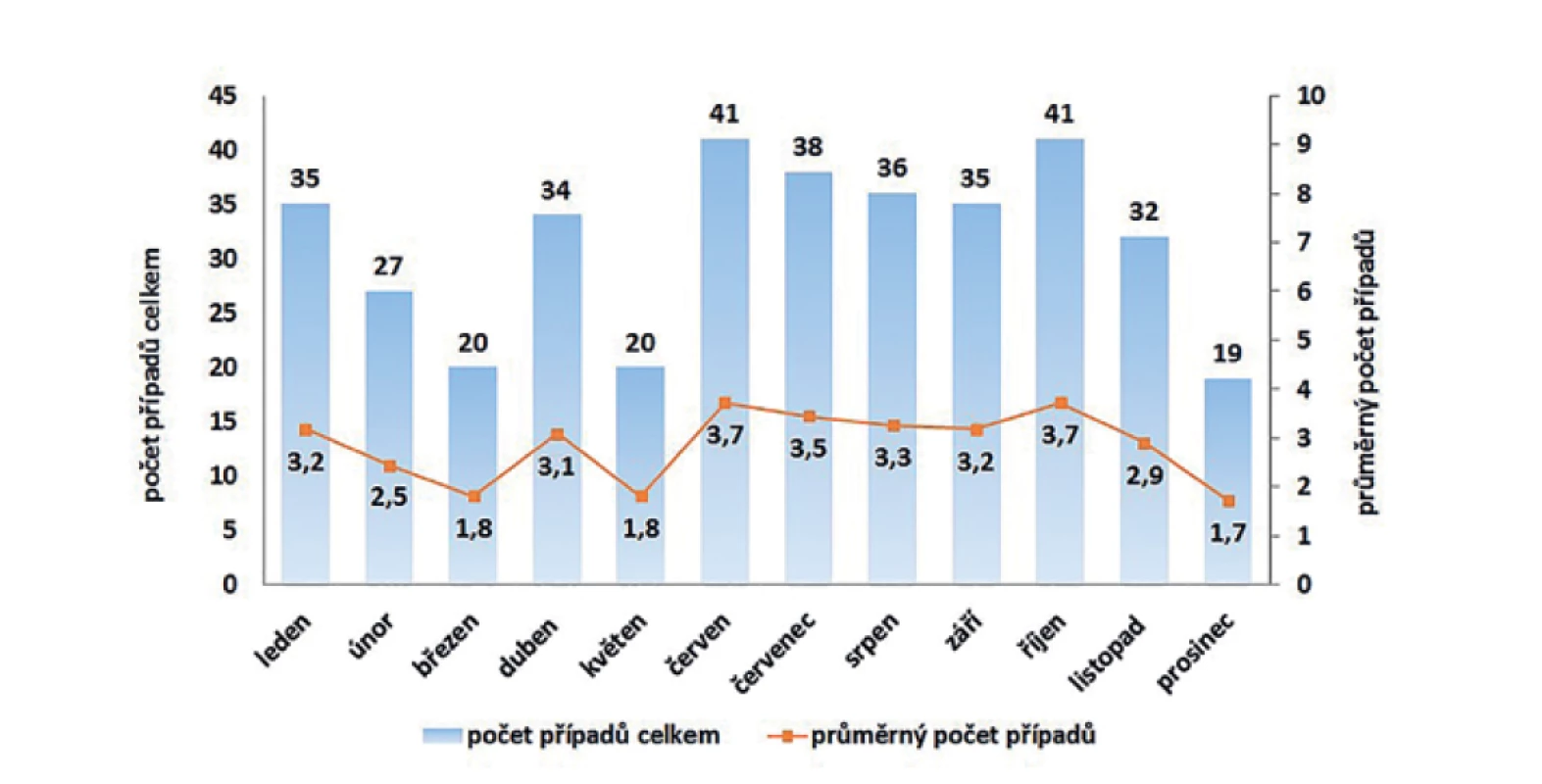
DISKUSE A ZÁVĚR
V posledních 11 letech (období 2008–2018) se počet případů onemocnění listeriózou a průměrná roční incidence (0,33/100 000 obyvatel, v rozmezí od 0,25–0,44/100 000 obyvatel) v ČR významně nemění. Pozorujeme spíše oscilující trend na rozdíl od zemí EU, kde byl v letech 2008–2017 (i samostatně pro období 2013–2017) pozorován signifikantní nárůst počtu případů onemocnění listeriózou (p < 0,01) [24]. Žádný z členských států (ČR nevyjímaje) však nezaznamenal klesající trend onemocnění. Průměrná incidence listeriózy v EU byla v roce 2017 0,48/100 000 případů [55]. Nejvyšší incidenci na 100 000 obyvatel hlásily Finsko (1,62), Dánsko (1,01), Německo (0,88), Lucembursko (0,85), Švédsko (0,81) a Belgie (0,8). Nejnižší incidenci hlásily Bulharsko, Chorvatsko, Kypr, Malta a Rumunsko (≤0,2/100 000 obyvatel) [24]. ČR zaznamenala v roce 2017 průměrnou incidenci 0,28/100 000 obyvatel, čímž se v tomto roce zařadila mezi země s nejnižší incidencí tohoto onemocnění v EU. Skandinávské země mají konstantně vyšší incidenci než ostatní evropské země [50]. Zvýšený výskyt listeriózy v těchto zemích je dáván do souvislosti s vyšším podílem konzumace syrových nakládaných ryb. Vysoká koncentrace L. monocytogenes v uzených rybách byla zjištěna také v Polsku, Nizozemí, Itálii, ČR a Německu [56].
Šestnáct států EU hlásilo v roce 2017 celkem 227 úmrtí na listeriózu (smrtnost 13,8 %). Nejvíce úmrtí bylo zaznamenáno ve Francii (59) a v Německu (27) [55]. Nejčastěji bylo onemocnění hlášeno u osob starších 64 let (smrtnost 15,5 %) a zejména pak u osob starších 84 let (smrtnost 24,2 %) [55]. V ČR byla v letech 2008–2018 zaznamenána průměrná smrtnost 21,3 %, u osob starších 64 let (24,9 %) a starších 84 let (28,6 %). V ČR tedy byla zaznamenána vyšší průměrná smrtnost, než je průměrná smrtnost v zemích EU, včetně osob starších 64 let; tento rozdíl však může být způsoben chybou malých čísel. Ve věkové skupině starších 84 let se specifická smrtnost ČR a zemí EU takřka shoduje. Většina zaznamenaných případů listeriózy je v zemích EU endemických (99,8 %), s nejvyšším výskytem onemocnění v letních měsících a dalším vrcholem v lednu (pravděpodobně díky zvýšené konzumaci lososů, sýrů a masných produktů v období Vánoc) [24]. V ČR je shodně sezonní výskyt nejvyšší v období červen až říjen a dále v lednu.
Ačkoliv v literatuře bylo publikováno několik epidemií listeriózy v České republice [57, 58], v informačním systému pro hlášení infekčních nemocí nebyly ve sledovaném období žádné epidemie listeriózy hlášeny. V rámci zasílání závěrečných zpráv o epidemiích v ČR na Státní zdravotní ústav také nebyly epidemie listeriózy hlášeny. Zdroj nákazy u většiny sporadických případů zůstává neobjasněn, pouze u některých případů (32 %) se podařilo prokázat alimentární původ [39]. Vzhledem k obtížné eliminaci bakterií z výrobních zařízení, může výjimečně docházet k výskytu listeriemi kontaminovaných šarží potravin v tržní síti i po řadu let a potom se mohou vyskytovat i četnější sporadické případy. V Evropě bylo v posledních letech zaznamenáno několik epidemií způsobených konzumací potravin kontaminovaných listeriemi, ale sporadické výskyty nadále tvoří většinu hlášených případů listeriózy [24].
Podle krajů byla nejvyšší průměrná roční incidence v letech 2008–2018 zaznamenána v krajích Moravskoslezském (0,6/100 000) a Plzeňském (0,57/100 000), nejnižší v krajích Vysočina (0,12/100 000), Ústeckém (0,18/100 000) a Jihomoravském (0,18/100 000). Příčina geograficky rozdílné incidence v rámci ČR není známa.
Vakcína proti infekcím způsobeným L. monocytogenes dosud neexistuje, proto je jedinou dostupnou prevencí dodržování hygienických zásad zejména v procesu výroby potravin, ale také při manipulaci s nimi. Rizikovými skupinami pro onemocnění listeriózou jsou nadále imunokomprimované či starší osoby a plody těhotných žen, nicméně zásady správné hygienické praxe by měly být dodržovány všude; v potravinářství i v domácnostech. K minimalizaci rizika nákazy je nezbytná důkladná tepelná příprava stravy (zejména té z živočišných zdrojů), důkladné omytí syrového ovoce a zeleniny před jídlem, oddělené skladování syrového masa od ostatních hotových potravin, důsledné mytí rukou a kuchyňského náčiní a vyvarování se konzumace nepasterizovaného mléka a výrobků z něj. Těhotným ženám a imunokompromitovaným osobám se doporučuje omezit konzumaci opakovaně ohřívaných a dlouhodobě v chladničce skladovaných potravin, dále není doporučeno jíst měkké a zrající sýry. Prodejci by měli na trh uvádět pouze potraviny od prověřených výrobců, dodržovat chladírenský řetězec, potraviny uchovávat odděleně (z důvodu možné zkřížené kontaminace) a snažit se zamezit riziku sekundární kontaminace (např. čištěním a dezinfekcí nástrojů a jiného zařízení ve styku s potravinami, nevkládáním cenovek do potravin a ověřováním účinnosti sanitačních postupů). Také je nutné dbát na dodržování zásad osobní hygieny zaměstnanců včetně pravidelného proškolování. Listerie málokdy překročí legislativně nařízené limity v potravinách určených k přímé spotřebě, které představují nejběžnější zdroj alimentárních nákaz člověka. Je však důležité, aby spotřebitelé řádně dodržovali pokyny výrobců pro skladování potravin a zásady zacházení s potravinami dané národní a mezinárodní legislativou.
Evropské středisko pro prevenci a kontrolu nemocí (ECDC) pracuje společně s členskými státy na zlepšení monitorování onemocnění z potravin a vody včetně listeriózy, u které rychlejší detekce nadměrného výskytu či šíření nákazy může zabránit dalším případům. Od roku 2006 je pro členské státy EU platné nařízení evropské komise 2073/2005/ES o mikrobiologických kritériích pro potraviny určené k přímé spotřebě, které stanoví udržování koncentrace L. monocytogenes v potravinách pod 100 KTJ/g. Toto nařízení bylo doplněno nařízením 1441/2007/ES, které dále rozepisuje limity pro L. monocytogenes pro jednotlivé typy potravin a podle jejich určení. Od 1. března 2019 byla zahájena rozšířená surveillance listeriózy založená na datech celogenomového sekvenování a hlášení do evropského surveillance systému (TESSy) by mělo probíhat v reálném čase. Postupně by se k tomuto programu měly připojit všechny členské státy EU/EAA. Listerióza i v České republice představuje nepříliš časté, ale závažné onemocnění s vysokou mortalitou, zvláště pro novorozence a imunokompromitované osoby. Pro příznivější průběh onemocnění je důležitá včasná diagnostika a léčba. Nejdůležitější je však prevence; zabránění primární i sekundární kontaminace v průběhu výroby, skladování a distribuce potravin.
Do redakce došlo dne 7. 2. 2020.
Adresa pro korespondenci:
MUDr. Michaela Špačková
CEM, Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: michaela.spackova@szu.cz
Sources
1. Chlebicz A, Śliżewska K. Campylobacteriosis, salmonellosis, yersiniosis, and listeriosis as zoonotic foodborne diseases: a review. Int J Environ Res Public Health, 2018;15(5):863.
2. Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett‘s Principles and Practice of Infectious Diseases: 2–Volume Set. Philadelphia: Elsevier Saunders; 2014. p. 2383–2390.
3. Swaminathan B, Gerner-Smidt P. The epidemiology of human listeriosis. Microbes Infect, 2007;9(10):1236–1243.
4. Murray EGD, Webb RA, Swann MBR. A disease of rabbits characterised by a large mononuclear leucocytosis, caused by a hitherto undescribed bacillus Bacterium monocytogenes (n. sp.). J Pathol Bacteriol, 1926;29(4):407–439.
5. Pirie JH. A new disease of veld rodents ‘tiger river disease’. Publ. S. Afr. Inst. Med. Res, 1927;3(13):163–187.
6. Pirie JHH. Listeria: Change of Name for a Genus Bacteria. Nature, 1940;145(3668):264–264.
7. Nyfeld A. Etiologie de la mononucleose infectieuse. Compt. Rend. Soc. Biol., 1929(101): 590–592.
8. Hird DW. Review of evidence for zoonotic listeriosis. J Food Prot, 1987;50(5):429–433.
9. Reiss H, Potel J, Krebs A. Granulomatosis infantiseptica, eine durch einen spezifischen Erreger hervorgerufene fetale Sepsis. J Mol Med, 1951;29(1):29.
10. Schlech III WF, Lavigne PM, Bortolussi RA, et al. Epidemic listeriosis – evidence for transmission by food. N Engl J Med, 1983;308(4):203–206.
11. Leibniz Institute DSMZ. LPSN – List of Prokaryotic names with Standing in Nomenclature. 2020 [cit. 12.6.2020]. Dostupný na www: https://lpsn.dsmz.de/species?page=L.
12. Guillet C, Join-Lambert O, Le Monnier A, et al. Human listeriosis caused by Listeria ivanovii. Emerg Infect Dis, 2010;16(1):136.
13. Salimnia H, Patel D, Lephart P, et al. Listeria grayi: vancomycin-resistant, gram‐positive rod causing bacteremia in a stem cell transplant recipient. Transpl Infect Dis, 2010;12(6):526–528.
14. Allerberger F. Listeria. In: Foodborne diseases. Springer; 2007 : 27–39.
15. Pietzka A, Allerberger F, Murer A, et al. Whole genome sequencing based surveillance of L. monocytogenes in food for early detection and investigations of listeriosis outbreaks. Front Public Health, 2019;7 : 139.
16. Maury MM, Chenal-Francisque V, Bracq-Dieye H, et al. Spontaneous loss of virulence in natural populations of Listeria monocytogenes. Infect Immun, 2017;85(11).
17. McClure P, Roberts T, Oguru PO. Comparison of the effects of sodium chloride, pH and temperature on the growth of Listeria monocytogenes on gradient plates and in liquid medium. Lett Appl Microbiol, 1989;9(3):95–99.
18. Vázquez-Boland JA, Kuhn M, Berche P, et al. Listeria pathogenesis and molecular virulence determinants. Clin Microbiol Rev, 2001;14(3):584–640.
19. Thévenot D, Delignette-Muller M-L, Christieans S, et al. Serological and molecular ecology of Listeria monocytogenes isolates collected from 13 French pork meat salting–curing plants and their products. Int J Food Microbiol, 2006;112(2):153–161.
20. López V, Villatoro D, Ortiz S, et al. Molecular tracking of Listeria monocytogenes in an Iberian pig abattoir and processing plant. Meat Sci, 2008;78(1-2):130–134.
21. Borucki MK, Peppin JD, White D, et al. Variation in biofilm formation among strains of Listeria monocytogenes. J Appl Environ Microbiol, 2003;69(12):7336–7342.
22. Ivanek R, Gröhn YT, Wiedmann M. Listeria monocytogenes in multiple habitats and host populations: review of available data for mathematical modeling. Foodborne Pathog Dis, 2006;3(4):319–336.
23. Bortolussi R. Listeriosis: a primer. Can Med Assoc J, 2008;179(8):795–797.
24. European Food Safety Authority, European Centre for Disease Prevention Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2016. EFSA J, 2017;15(12):5077.
25. Allerberger F, Wagner M. Listeriosis: a resurgent foodborne infection. Clin Microbiol Infect, 2010;16(1):16–23.
26. Millet L, Saubusse M, Didienne R, et al. Control of Listeria monocytogenes in raw-milk cheeses. Int J Food Microbiol, 2006;108(1):105–114.
27. Valdramidis V, Geeraerd A, Gaze J, et al. Quantitative description of Listeria monocytogenes inactivation kinetics with temperature and water activity as the influencing factors; model prediction and methodological validation on dynamic data. J Food Eng, 2006;76(1):79–88.
28. Havelaar AH, Kirk MD, Torgerson PR, et al. World Health Organization global estimates and regional comparisons of the burden of foodborne disease in 2010. PLoS Med, 2015;12(12):e1001923.
29. De Noordhout CM, Devleesschauwer B, Angulo FJ, et al. The global burden of listeriosis: a systematic review and meta-analysis. Lancet Infect Dis, 2014;14(11):1073–1082.
30. Bednář M, Fraňková V, Schindler J, et al. Lékařská mikrobiologie. Praha: Marvil, 1996;2.
31. Zenewicz LA, Shen H. Innate and adaptive immune responses to Listeria monocytogenes: a short overview. Microbes Infect, 2007;9(10):1208–1215.
32. Grif K, Patscheider G, Dierich M, et al. Incidence of fecal carriage of Listeria monocytogenes in three healthy volunteers: a one-year prospective stool survey. Eur J Clin Microbiol Infect Dis, 2003;22(1):16–20.
33. Janakiraman V. Listeriosis in pregnancy: diagnosis, treatment, and prevention. Rev Obstet Gynecol, 2008;1(4):179.
34. Lennon D, Lewis B, Mantell C, et al. Epidemic perinatal listeriosis. Pediatr Infect Dis, 1984;3(1):30–34.
35. Jones EM, McCulloch SY, Reeves DS, et al. A 10 year survey of the epidemiology and clinical aspects of listeriosis in a provincial English city. J Inf, 1994;29(1):91–103.
36. Büla CJ, Bille J, Glauser MP. An epidemic of food-borne listeriosis in western Switzerland: description of 57 cases involving adults. Clin Infect Dis, 1995;20(1):66–72.
37. Rocourt J. Risk factors for listeriosis. Food Control, 1996;7(4-5):195–202.
38. Kayaaslan BÜ, Akıncı E, Bilen Ş, et al. Listerial rhombencephalitis in an immunocompetent young adult. Int J Infect Dis, 2009;13(2):e65–e67.
39. Armstrong RW, Fung PC. Brainstem encephalitis (rhombencephalitis) due to Listeria monocytogenes: case report and review. Clin Infect Dis, 1993;16(5):689–702.
40. Godshall CE, Suh G, Lorber B. Cutaneous listeriosis. J Clin Microbiol, 2013;51(11):3591–3596.
41. Jágrová Z, Karpíšková R, Marešová M, et al. Nozokomiální přenos listeriózy. Epidemiol Mikrobiol Imunol, 2014;63(2):113–115.
42. European Centre for Disease Prevention Control. Annual epidemiological report on communicable diseases in Europe 2010. ECDC; 2010.
43. Kosina MP, Krausová MJ, Kračmarová MR. Listeriové meningitidy. Interní medicína pro praxi, 2007 : 19–20.
44. Southwick FS, Purich DL. Intracellular pathogenesis of listeriosis. N Engl J Med, 1996;334(12):770–776.
45. Redline RW, Lu CY. Role of local immunosuppression in murine fetoplacental listeriosis. J Clin Invest, 1987;79(4):1234–1241.
46. Mylonakis E, Paliou M, Hohmann EL, et al. Listeriosis during pregnancy: a case series and review of 222 cases. Medicine, 2002;81(4):260–269.
47. Al-Tawfiq JA. Listeria monocytogenes bacteremia in a twin pregnancy with differential outcome: fetus papyraceus and a full-term delivery. J Microbiol Immunol Infect, 2008;41(5):433–436.
48. Lallemand AV, Gaillard DA, Paradis PH, et al. Fetal listeriosis during the second trimester of gestation. Pediatr Pathol, 1992;12(5):665–671.
49. Bakardjiev AI, Theriot JA, Portnoy DA. Listeria monocytogenes traffics from maternal organs to the placenta and back. PLoS pathogens, 2006;2(6):e66.
50. Smith B, Kemp M, Ethelberg S, et al. Listeria monocytogenes: maternal-foetal infections in Denmark 1994–2005. Scand J Infect Dis, 2009;41(1):21–25.
51. Schuchat A, Deaver KA, Wenger JD, et al. Role of foods in sporadic listeriosis: I. Case-control study of dietary risk factors. JAMA, 1992;267(15):2041–2045.
52. Kasper S, Huhulescu S, Auer B, et al. Epidemiology of listeriosis in Austria. Wien Klin Wochenschr, 2009;121(3-4):113.
53. Hof H. Therapeutic options. FEMS Immunol Med Microbiol, 2003;35(3):203–205.
54. European Centre for Disease Prevention and Control. ECDC Map Maker tool (EMMa). 2019.
55. European Food Safety Authority, European Centre for Disease Prevention Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food‐borne outbreaks in 2017. EFSA J, 2018;16(12):e05500.
56. Todd E, Notermans S. Surveillance of listeriosis and its causative pathogen, Listeria monocytogenes. Food Control, 2011;22(9):1484–1490.
57. Gelbíčová T, Zobanikova M, Tomáštíková Z, et al. An outbreak of listeriosis linked to turkey meat products in the Czech Republic, 2012–2016. Epidemiol Infect, 2018;146(11):1407–1412.
58. Fretz R, Pichler J, Sagel U, et al. Update: Multinational listeriosis outbreak due to ‘Quargel’, a sour milk curd cheese, caused by two different L. monocytogenes serotype 1/2a strains, 2009–2010. Euro Surveill, 2010;15(16):19543.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2021 Issue 1-
All articles in this issue
- Opakovaně negativní PCR u pacientů s projevy covid-19: Mají či nemají infekci SARS-CoV-2?
-
Invazivní pneumokoková onemocnění u dospělých pacientů hospitalizovaných v Nemocnici Na Bulovce:
sérotypový replacement po zavedení plošné vakcinace dětí - Zkušenosti s léčbou virové hepatitidy C u injekčních uživatelů návykových látek v programu substituční léčby metadonem
- Analýza invalidity pro onemocnění HIV za roky 2010–2018
- Preventivní opatření, rizikové chování a nejčastější zdravotní obtíže u českých cestovatelů: prospektivní dotazníková studie u pacientů ošetřených na ambulanci cestovní medicíny
- Listerióza – analýza výskytu humánních případů v České republice v letech 2008–2018
- Enzymová léčba infekcí kůže a měkkých tkání
- Potenciálny problém spoločného výskytu pandemického covidu-19 a sezónnej chrípky
-
Zemřel MUDr. Vladimír Zikmund, CSc.
(27. 5. 1925–18. 10. 2020) - Za MUDr. Vladimírem Verhunem
- Reinfekce covidem-19
- Prvé laboratórne potvrdené invazívne meningokokové ochorenie séroskupiny C s abdominálnou klinickou prezentáciou na Slovensku, 2019
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Opakovaně negativní PCR u pacientů s projevy covid-19: Mají či nemají infekci SARS-CoV-2?
- Listerióza – analýza výskytu humánních případů v České republice v letech 2008–2018
- Reinfekce covidem-19
- Enzymová léčba infekcí kůže a měkkých tkání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

