-
Medical journals
- Career
Jak v praxi zlepšit morfologickou diagnostiku systémových vaskulitid
Authors: Eva Honsová
Authors‘ workplace: AeskuLab Patologie, Praha
Published in: Čes.-slov. Patol., 56, 2020, No. 2, p. 68-73
Category: Reviews Article
Overview
Nejčastějšími systémovými vaskulitidami dospělých jsou ANCA pozitivní vaskulitidy. Jde o autoimunní onemocnění se specifickými protilátkami k antigenům granul neutrofilů a lyzozomům monocytů. Skupina ANCA pozitivních vaskulitid zahrnuje 3 klinické fenotypy onemocnění, mezi které patří granulomatóza s polyangiitidou (dříve Wegenerova granulomatóza), mikroskopická polyangiitida a eosinofilní granulomatóza s polyangiiitidou (dříve syndrom Churga - Straussové). Klasickou morfologii, která je obdobná ve všech postižených lokalitách, představuje nekrotizující zánět cév malých a středních kalibrů, často venul, kapilár nebo arteriol, typicky s fibrinoidní nekrózou cévní stěny. Následky tohoto stavu jsou jednak krvácení do okolí a dále ischémie a nekrózy na periferii cévního zásobení. Typicky postiženými lokalitami, se kterými se patolog setkává v bioptické praxi, jsou: oblast ORL, plíce, kůže, GIT a ledviny. Cílem tohoto přehledu je poskytnout ucelený přehled významných histopatologických nálezů.
ANCA pozitivní vaskulitidy jsou závažná život ohrožující onemocnění, proto vyžadují rychlou diagnózu a odpovídající terapii.
Klíčová slova:
ANCA pozitivní vaskulitidy – GPA – MPA – histopatologie
Nejčastějšími systémovými vaskulitidami dospělých jsou ANCA pozitivní vaskulitidy (AAV). Jde o autoimunní onemocnění s protilátkami, které jsou specifické k antigenům granul neutrofilů a lyzozomům monocytů (AntiNeutrophil Cytoplasmic Antibody). Podle imunofluorescenční reakce je lze rozdělit na dvě skupiny, jednou jsou c-ANCA, tj. ANCA protilátky s cytoplasmatickou pozitivitou. Druhou představuje skupina p-ANCA, což jsou protilátky s perinukleární pozitivitou. V obou skupinách je více antigenů, proti kterým se tvoří protilátky (proteináza-3, lactoferin, lysosym, myeloperoxidáza, cathepsin G, elastáza atd). Ale pouze protilátky proti jednomu antigenu z každé skupiny vedou k rozvoji AAV. Ve skupině c-ANCA je to proteináza-3 (PR3) a ve skupině p-ANCA je to myeloperoxidáza (MPO). K detekci PR3 a MPO se využívá metoda ELISA, která na rozdíl od imunofluorescence identifikuje nikoli skupinu, ale cíleně jeden antigen.
Objev ANCA protilátek se datuje na počátek 80. let minulého století a po dlouhou dobu nebylo jasné, zda jde o epifenomén nebo zda jsou ANCA protilátky opravdu příčinou onemocnění. Několik experimentů i výjimečná situace v humánní medicíně s přenosem protilátek z matky na novorozené dítě (a rozvojem plicní hemoragie a onemocnění ledvin u novorozence) doložily, že ANCA protilátky onemocnění způsobují (1,2,3). Patogeneze a patofyziologie nejsou ještě detailně známé (viz článek v tomto čísle), ale detekce ANCA protilátek se používá jako diagnostické kritérium a současně se jejich titr dá částečně použít jako marker aktivity onemocnění. V séru pacientů s morfologicky i klinicky typickou AAV nedokáží konvenční sérologické testy vždy detekovat ANCA protilátky. Jde především o pacienty, u kterých byl dalšími technikami (tandemová hmotnostní spektrometrie) identifikován specifický MPO epitop (4). Překvapivě jde o imunodominantní epitop s odpovídajícími protilátkami, jejichž zamaskování přirozeným inhibitorem (proteinem séra) způsobí, že jsou běžnými technikami nedetekovatelné (stejný mechanismus může být za mnoha dalšími tzv. sérologicky negativními autoimunními onemocněními).
Historicky skupina AAV zahrnovala 3 klinické fenotypy onemocnění, mezi které patřila granulomatóza s polyangiitidou (dříve Wegenerova granulomatóza, GPA), mikroskopická polyangiitida (MPA) a eosinofilní granulomatóza s polyangiiitidou (syndrom Churga –Straussové, EGPA). Obvyklou situací bylo, že klinické zařazení jako GPA doprovázely PR3 protilátky a pacienti s MPA měly MPO protilátky. To platilo jen v širším centru Gaussovy křivky; a dokud se onemocnění nezačala klasifikovat jako AAV, někteří autoři vedli nekonečné terminologické diskuze o přesném zařazení choroby u konkrétního pacienta. Onemocnění má rozdílnou geografickou a etnickou distribuci; v severních částech Evropy jsou častější případy s PR3 protilátkami. V jižní Evropě, v Asii včetně Číny a Japonska jsou častější případy s anti-MPO. V ČR s lokalizací ve střední Evropě je výskyt PR3 a MPO ANCA pozitivních vaskulitid přibližně stejný. V současné době se předpokládá, že důvodem rozdílné etnické a geografické distribuce jsou genetické faktory. Genetické studie z posledních let identifikovaly rozdílné polymorfismy HLA antigenů, které doprovázejí PR3 a MPO AAV (5,6). To, že PR3 AAV se raritně vyskytuje v Číně a v Japonsku je vysvětlováno faktem, že v těchto populacích jsou raritní HLA antigeny a genetické varianty, které jsou časté u pacientů s PR3 AAV (HLA-DPB1*0401 a PI*Z alela SERPINA1) (7). Vedle toho mají obě sérologické skupiny rozdílný cytokinový profil i odpověď k léčbě anti-CD20 (8,9). Proto se dnes považuje za fakt, že pacienti by mohli profitovat ze zařazení na základě sérologie a nikoli podle klinického syndromu.
Onemocnění je nejčastěji systémové a postihuje různé orgánové lokality; a to jak současně, tak i postupně. Mezi nejběžněji postižené orgány patří oblast ORL a horních cest dýchacích, klouby, kůže, plíce a ledviny. AAV může mít i izolované renální nebo plicní postižení.
Výskyt ANCA pozitivních vaskulitid v populaci v posledních letech narůstá, roční incidence se udává od 10-47/1 milion obyvatel. Nejčastěji jsou postiženi pacienti kolem 60 let, ale onemocnění se může vyskytovat v jakékoli věkové skupině. V různých souborech je 10-20 % pacientů mladších 25 let, včetně dětí a přibližně 25 % pacientů starších 75 let.
Mimo nefrologii a nefropatologii jsou vaskulitidy diagnosticky podceňovanou kategorií. Protože jde o zánětlivé onemocnění, stále existuje v patologii představa, že je to něco extrémně vzácného, co je navíc „jen zánětlivé“, takže se tomu nemusí věnovat pozornost, s jakou se hodnotí a kategorizují maligní tumory různých lokalizací. Jde o tragický omyl, protože jak bohužel stále dokládají kazuistiky, tento typ léčitelného onemocnění dokáže zabít během 3 měsíců. Roční incidence AAV je vyšší než incidence všech nádorů měkkých tkání, bohužel tomu dlouhodobě neodpovídá trénink lékařů nejen v patologii.
Obecně lze říct, že u případů PR3 AAV jsou častější akutní nekrotizující léze s minimem jizvení a u MPO AAV jsou častější kombinace sklerotizujících lézí s malým rozsahem nekróz. Protože ANCA vaskulitidou může být postižena céva jakéhokoli kalibru, jakékoli lokalizace a v každém orgánu, který má krevní zásobení, je zřejmé, že onemocnění má téměř neomezené spektrum klinických projevů a také, že biopsie s vaskulitidou může pocházet prakticky z jakékoli lokality. Klinické symptomy jsou důsledkem kombinace celkových projevů v rámci chronického zánětlivého onemocnění a ložiskových změn vznikajících jako výsledek tkáňové ischemie (tj. při povrchu ulcerace – nejen kůže, ale i GIT; a ve tkáni infarkt). U jednotlivého pacienta je závažnost vaskulitidy daná lokalizací a rozsahem postižených cév, to vše v souvislosti s věkem a celkovým stavem nemocného.
PATOLOGIE
Morfologické znaky PR3 AAV a MPO AAV jsou stejné. Typickou charakteristikou je fibrinoidní nekróza cévní stěny, obvykle venuly nebo arterioly a kapilaritida, postižená ale může být jakákoli céva, včetně arterií větších kalibrů i aorty. Pro patology jsou vedle ledvin, obvyklými lokalitami vyskytujícími se v biopsiích především vzorky z oblastí ORL (nosních dutin, ucha a horních cest dýchacích), kůže, GIT a plic. Současně je nutné mít na paměti, že kromě nefropatologie, patolog nedostává biopsii s diagnózou vaskulitidy a téměř nikdy není uvedeno ani klinické podezření na vaskulitidu. Obvyklé klinické diagnózy jsou nespecifické popisy nebo suspektní tumor.
V různých lokalizacích můžeme s vysokou pravděpodobností odhadnout, jaký typ vaskulitické afekce ve vzorcích bude. V ORL oblasti, v biopsiích kůže a v GIT půjde převážně o aktivní nekrotizující vaskulitidu (PR3 AAV). V plicích a v ledvinách můžeme očekávat směs aktivních i chronických hojících se nebo zhojených cévních lézí. Ve všech lokalitách je nutné cíleně posoudit venuly a kapiláry, což od patologa vyžaduje soustředit se na detail a také si uvědomit, že z klasického barvení H&E, vaskulitidu skoro nikdy nepoznám. H&E neposkytuje dostatečné detailní rozlišení struktur cévní stěny. Nekrotizující fibrinoidní průsak je v H&E růžový a nenápadný jako pozadí nejrůznějších jiných afekcí. Proto při podezření na vaskulitidu je vždy výhodné použít jakékoli barvení detekující elastiku. Destrukce elastiky je jedním ze znaků vaskulitidy (Obr. 1). Další velmi přínosné barvení je stříbření (Jones methenamine silver s dobarvením), které impregnuje bazální membrány a zcela vynechává nekrotické úseky, které se tím stanou nápadnými a dobře přehlednými (Obr. 2). Postižení cév bývá segmentální a v postiženém segmentu je typický fibrinoidní průsak, vytvářející tenká síťovitě uspořádaná vlákna, někdy s radiálním řazením (Obr. 3). Zánět, který navazuje, může být velmi diskrétní nebo jsou nekrotické rozsáhlé úseky cév a pak je zánět denzní, nekrotizující a doprovází ho krvácení při destrukci cévní stěny.
Image 1. Plíce s vaskulitidou. V přehledném malém zvětšení je snadno identifikovatelná vaskulitida cévy vpravo dole, kde chybí elastika cca v polovině obvodu. V malém zvětšení nelze spolehlivě rozpoznat, do jaké míry se afekce jizví a zda je ještě aktivní (barvení HE s elastikou). 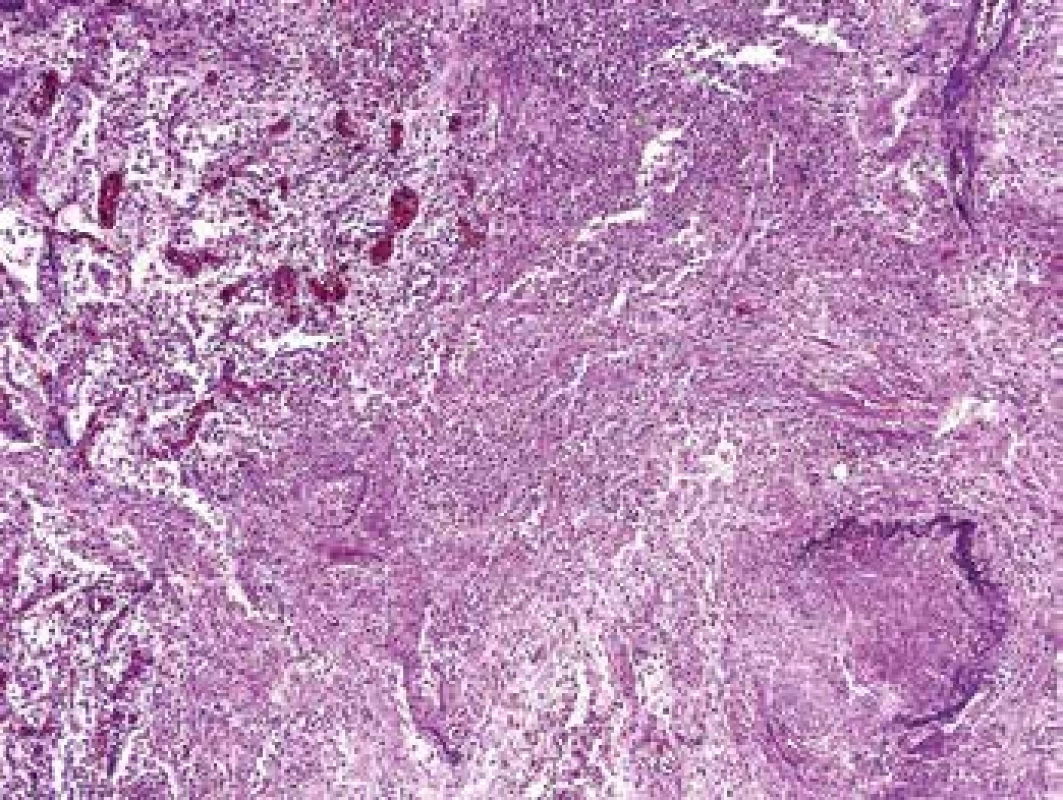
Image 2. Ledvina s nekrotizující vaskulitidou cévy mimo glomeruly. Stříbření ozřejmí původní nedestruovanou cévní stěnu, fibrinoidní nekróza (šipka) zůstane sytě růžová a vynikne oproti pozadí se zánětem (PASM, Jones methenamine silver s dobarvením). 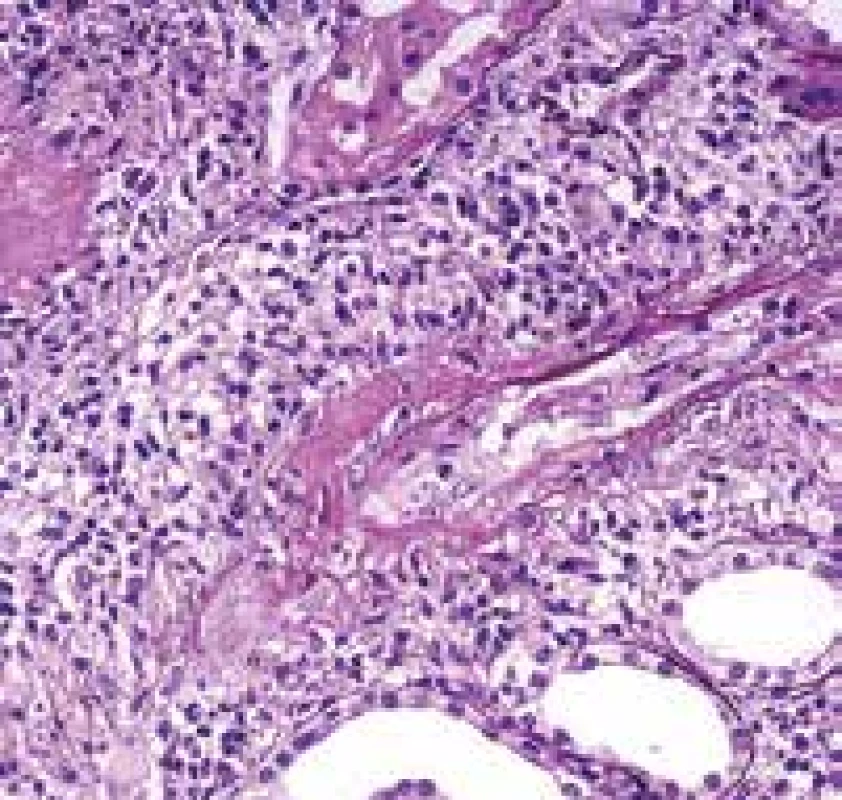
Image 3. Detail vaskulitidy v biopsii kůže s průsakem fibrinu vytvářející typickou paprsčitou síťovitou strukturu v místě postižení tenkostěnné cévy. V okolí jsou četné polynukleáry (barvení HE s elastikou). 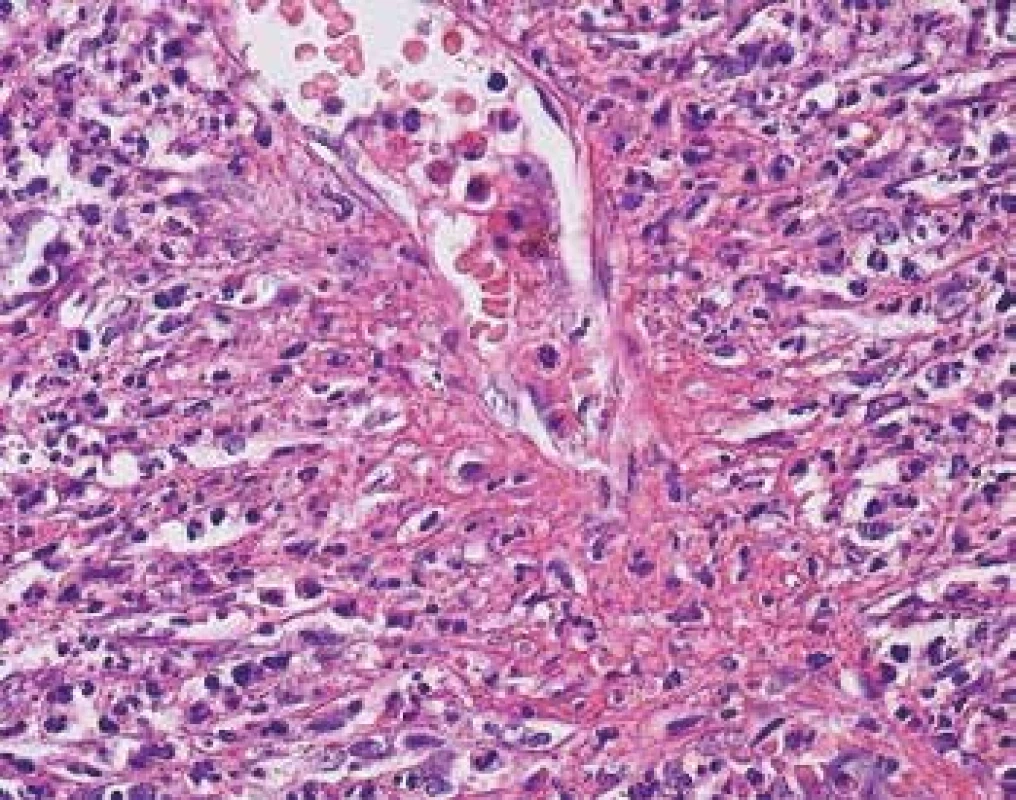
Oblast ORL
Protože oblast ORL je častěji postižena v průběhu PR3 AAV, afekce, které budou v biopsii, budou převážně aktivní tj. s čerstvými nekrózami drobných cév a s denzní pestrou zánětlivou celulizací v okolí. Proto je nutné cíleně posoudit venuly a kapiláry a soustředit se na detail (Obr. 4,5). Zánětlivá celulizace je variabilní, může být diskrétní s příměsí polynukleárů a fokálně i četných eozinofilů (eozinofily jsou pravidelnou komponentou PR3 AAV i v jiných lokalitách a neznamenají alergii). Nebo mohou být zánětlivá ložiska velmi intenzivní včetně nekrotického rozpadu tkáně v místech, kde je velmi obtížné vaskulitidu identifikovat. Onemocnění je fokální a použití různých typů barvení (HE s elastikou, Srel, PASM, PAS) s prokrojením afekce, jsou imperativem. Pokud i přesto váhám s diagnózou, lze v diagnostickém závěru doporučit detekci ANCA protilátek (např. větou: Ve vzorku je denzní smíšená zánětlivá celulizace, která překrývá původní struktury tkáně. K definitivní interpretaci je nezbytná znalost sérologie ANCA protilátek).
Image 4. Vaskulitida v biopsii z oblasti ORL. Arterii bez nekrózy v dolní části snímku doprovází žíla s rozsáhlou fibrinoidní nekrózou stěny (šipky). Vpravo krvácení (barvení HE s elastikou). 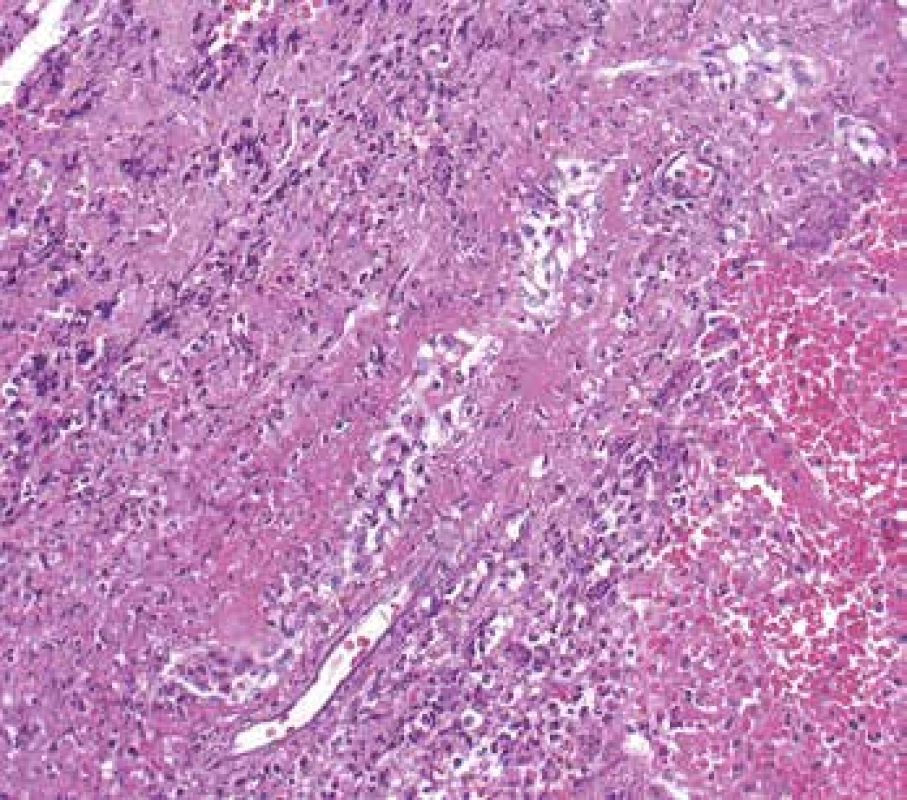
Image 5. Vaskulitida v biopsii z oblasti ORL. Nahoře svalová arterie bez nekrózy a pod ní je na snímku vena se zánětlivou destrukcí stěny, fokálně s kompletní destrukcí elastiky (šipky) a s fibrinoidní nekrózou cévní stěny, fibrinoidní průsak je žlutý (barvení Srel). 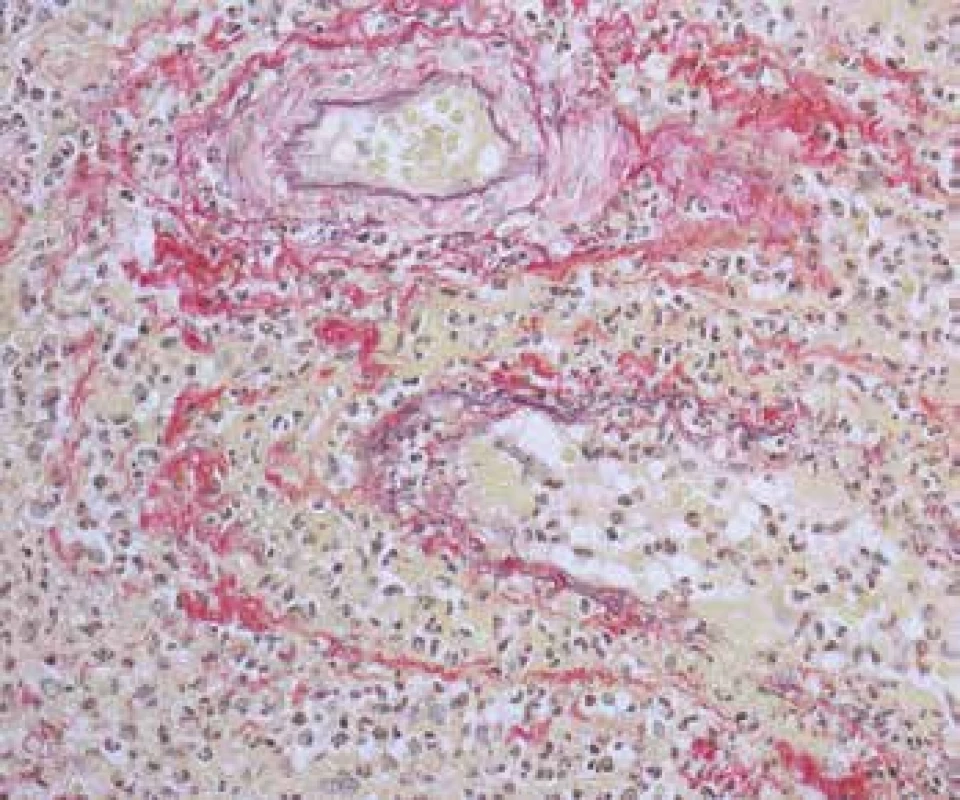
Kůže
Druhou klasickou lokalizací, kde se lze s morfologií vaskulitidy setkat, jsou biopsie kůže. Nomenklatuře vaskulitid v kůži je věnován dodatek k mezinárodnímu konsensu tzv. Chapel Hill nomenklatuře vaskulitid (10,11).
Morfologie ANCA pozitivní vaskulitidy v této lokalizaci nemusí být vždy charakterizovaná fibrinoidní nekrózou. U části pacientů lze identifikovat postižení drobných cév, které se popisně udává jako tzv. leukocytoklastická vaskulitida. I v kůži jsou nejčastěji postiženými cévami venuly a kapiláry, i když postiženy mohou být arterioly i arterie. Tomu odpovídá kožní manifestace od purpury po hluboké ulcerace. V morfologii je stejně jako v předchozím segmentální fibrinoidní nekróza cévní stěny (Obr. 3). V kožních biopsiích je častěji než v jiných lokalitách vidět reakce okolního endotelu, který zduří a postaví se napříč a vyčnívá do lumen cévy. V blízkosti takového endotelu bývá v okolí nebo v dalších řezech vaskulitida (Obr. 6). Dobrým klinickým znakem je fakt, že vaskulitické léze jsou obvykle velmi bolestivé.
Image 6. Vaskulitida v kožní biopsii. Céva vlevo dole je normální. Céva uprostřed má fibrinoidní nekrózu v horní části snímku, část endotelu se „postavila“ napříč a vyčnívá do lumen (barvení HE s elastikou). 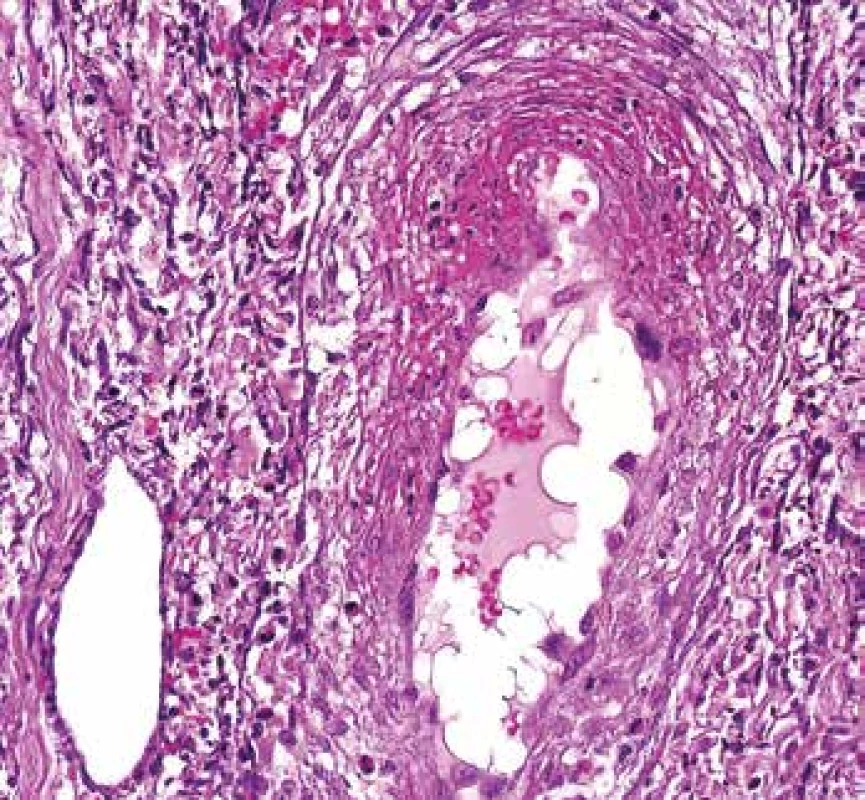
V diferenciální diagnostice jsou vaskulitidy jiné než ANCA pozitivní, proto je pravidlem provedení imunofluorescenční detekce imunoglobulinů a frakcí komplementu. V podstatě jde o využití znalostí z nefropatologie, kde byly ANCA pozitivní vaskulitidy diagnostikované jako samostatná kategorie již v 80. letech minulého století. V ledvině je typická imunofluorescence bez depozit (pauciimunní) na rozdíl od imunokomplexových onemocnění. Toho se využívá v kožní patologii a kombinací pozitivních průkazů se odlišují ostatní vaskulitidy a vaskulopatie s kožními projevy. Mezi nejčastější patří IgA vaskulitida (Henoch-Schonleinova purpura), s depozity IgA ve stěně cév. Kryoglobulinémie má obvykle IgG a IgM (nebo IgG a IgA) pozitivní insudáty, vyklenující se do lumin cév.
Plíce
Postižení plic je pravidelnou součástí ANCA pozitivních vaskulitid (80 % pacientů s PR3 AAV a 30 % pacientů s MPO AAV). V plicích může být postižený jakýkoli kalibr cévy, proto i morfologické projevy mohou být velmi pestré, od floridních nekrotizujících cévních lézí, přes kapilaritidu, po všechny fáze hojení s cévními uzávěry a zánětem v okolí. Tomu odpovídá postižení tkáně s plicní hemoragií při kapilaritidě, ložiskovými nodulárními lézemi včetně kavitací, které na zobrazovacích metodách snadno napodobují tumory nebo infekce; po plicní fibrózu.
Identifikovat vaskulitidu v malých vzorcích endobronchiálních biopsií může být velmi komplikované a dvojnásobně zde platí, že rozpoznání detailů je klíčem k diagnóze. Snazší to mají specialisté a nefropatologové, protože obvykle mají zkušenost s využíváním speciálních barvení a také jsou na takový typ práce zvyklí.
Vedle bioptického materiálu patolog potřebuje rozpoznat morfologii vaskulitidy i v autoptických vzorcích. Obecná pravidla týkající se série barvení umožňujících identifikovat struktury cévní stěny platí i zde (Obr. 7,8). Speciální pozornost vyžaduje rozpoznání kapilaritidy s krvácením do alveolů, což je život ohrožující stav, který může vést rychle k smrti. Rozpoznání kapilaritidy v nekroptickém materiálu je velmi komplikované a tak je onemocnění i z autoptického materiálu nepochybně poddiagnostikované. Klinik onemocnění obvykle charakterizuje jako atypickou pneumonii, nejspíše virové etiologie s krvácením do plic a patolog dá takové diagnóze za pravdu.
Image 7. Biopsie plic s floridní vaskulitidou, s kompletní destrukcí elastiky v postiženém segmentu cévní stěny a s radiálním řazením zánětlivých elementů a vláken fibrinu (barvení Srel). 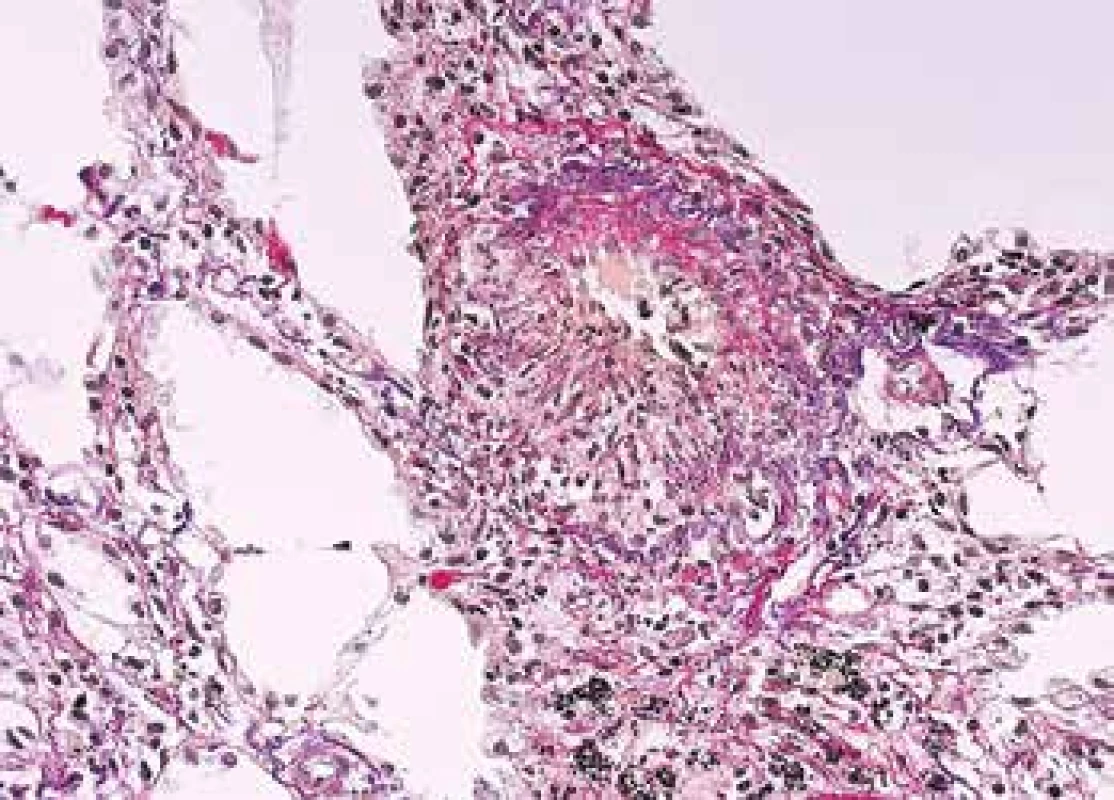
Image 8. Biopsie plic s vaskulitidou, se segmentální destrukcí cévní stěny, se zánětem v postiženém úseku cévní stěny i v okolí (barvení HE s elastikou). 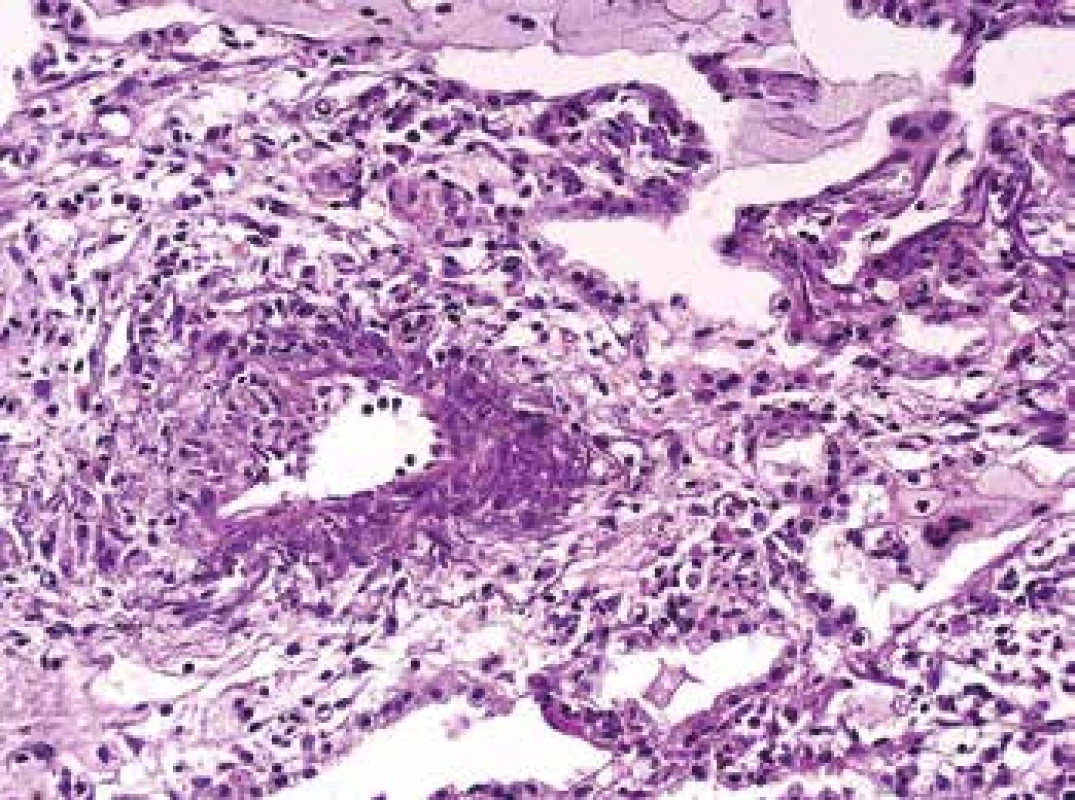
Postižení GIT
Až 50 % pacientů s AAV má postižení GIT (žaludek, střeva). Biopticky verifikované postižení jater je extrémně vzácné. Důvod proč nejsou v průběhu systémových vaskulitid téměř nikdy postižena játra, přestože obsahují myriády kapilár, není jasný. Můžeme spekulovat, že roli bude hrát tolerogenní prostředí jater, které se vyrovnává s antigeny ze střev a také fakt, že v játrech se normálně imunokomplexy neutralizují.
V žaludku a ve střevech jsou vaskulitické projevy relativně běžné a jejich morfologie je obdobná jako v jiných orgánech. V endoskopických vzorcích jde převážně o kapilaritidu a vaskulitidu venul (Obr. 9).
Image 9. Endoskopická biopsie žaludku s vaskulitidou s cirkulární fibrinoidní nekrózou venul a s denzní zánětlivou celulizací v okolí (barvení HE). 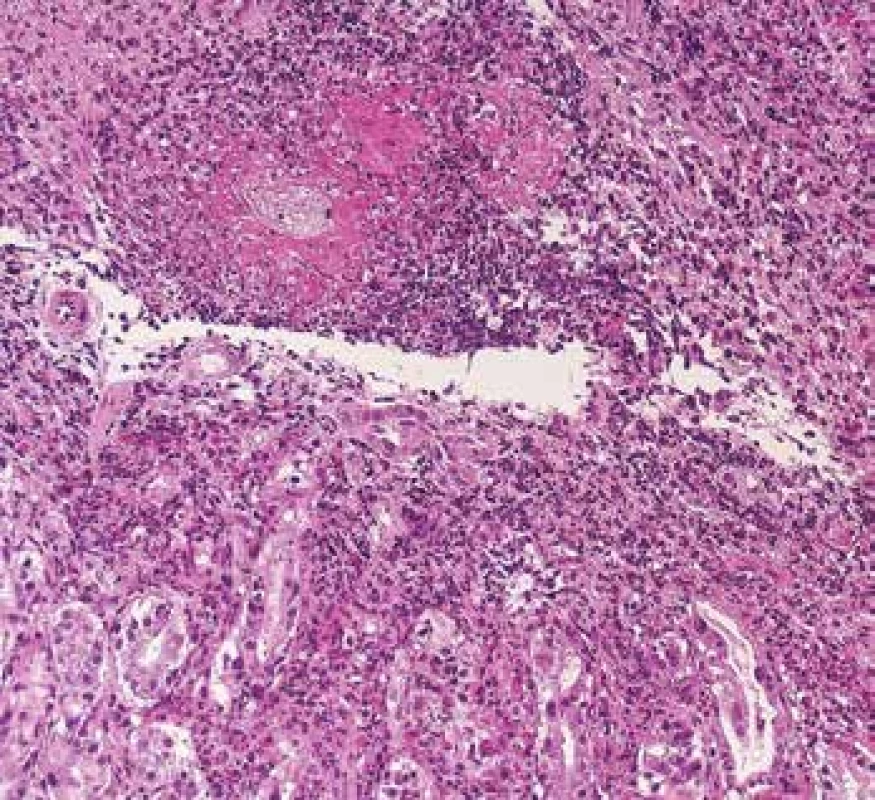
Postižení ledvin
Ledviny jsou v průběhu AAV postiženy pravidelně, většinou jde o projevy systémového postižení, kdy předcházelo postižení více lokalit, často kloubů, oblasti ORL a horních cest dýchacích spolu s celkovými projevy chronického zánětu. Někdy je postižení ledvin první manifestací a v době diagnózy jde o izolované renální postižení. V morfologii je typická negativní imunofluorescence (nejsou depozita) a nekrotizující glomerulonefritida (GN) se srpky různého stáří. Postižení je obvykle velmi variabilní, v časných fázích může být v rámci vyšetření jedné biopsie na mnoha sklech prakticky normální morfologie glomerulů a typická diagnostická léze tj. segmentální nekróza trsu je zastižená jen v okraji vzorku v několika řezech, přestože pacient má významný stupeň akutního selhání (Obr. 10). Typické pro AAV v ledvině je fakt, že glomeruly jsou bez proliferace, tj. nepostižené glomeruly mají normální morfologii. To nemá žádná jiná GN, proto se dá na diagnózu usuzovat i bez imunofluorescence (např. v bioptických vzorcích z resekcí z blízkosti nádoru). Pokročilejší stavy mají rozsáhlejší postižení glomerulů, jak co do jejich počtu, tak co do rozsahu postižení v jednotlivých glomerulech (Obr. 11). Na nekrózy navazují srpky, které jsou nejprve epitelové (dobře ovlivnitelné terapií), později fibroepitelové a fibrózní. Pokud je postižení glomerulu globální často dojde též ke kompletní destrukci Bowmanského pouzdra, která bývá granulomatózní. Nekróza v glomerulu se časem zjizví a zůstane segmentální nebo globální sklerotizace. Sklerotizace a fibrózní srpky jsou jizvy, které z klinického pohledu představují irreversibilní ztrátu, která pokud přesáhne kompenzatorní mechanismy, povede dále k progresi jizvení a nevratnému selhání funkce ledvin (Obr. 12). Postižení glomerulů doprovází pestrá zánětlivá celulizace v intersticiu, často akcentovaná v okolí postižených glomerulů (periglomerulitida). S větším postižením glomerulů se objevují i významné změny tubulů s akutním ischemickým poškozením, které může vést až k deskvamaci epitelu proximálních tubulů. V luminech kanálků mohou být erytrocyty (z glomerulů při rupturách GBM), detritus, fibrinogen a bílkovinné válce. Vedle glomerulů je někdy zastižena i vaskulitida dalších cév, nejčastěji arteriol v hilu, ale i cév mimo glomeruly, v intersticiu (Obr. 2). Při postižení cév velkých kalibrů mohou být nekrózy mapovité, rozsáhlé.
Image 10. Časná fáze ANCA pozitivní GN, s normálním glomerulem vlevo. Vpravo s fibrinoidní nekrózou (kapilaritidou) a se segmentálním epitelovým srpkem (barvení AFOG). 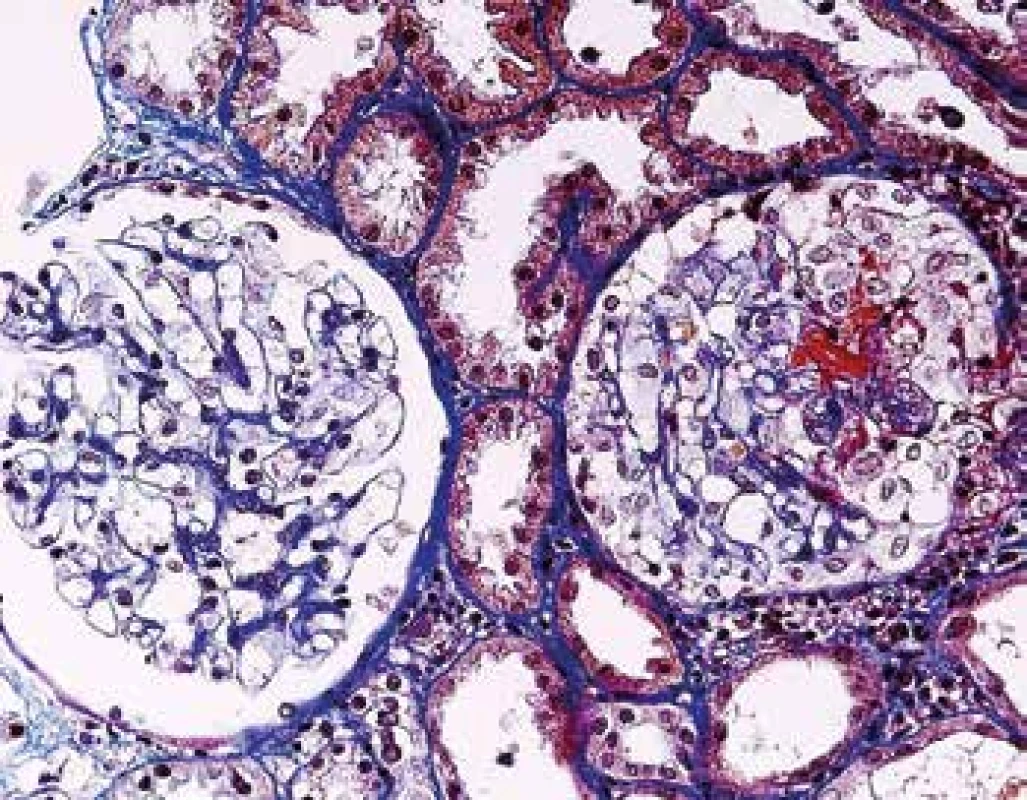
Image 11. Rozsáhlá nekróza glomerulu, včetně vaskulitidy hilové arterioly (žlutě) a tvořící se objemný epitelový srpek (barvení Srel). 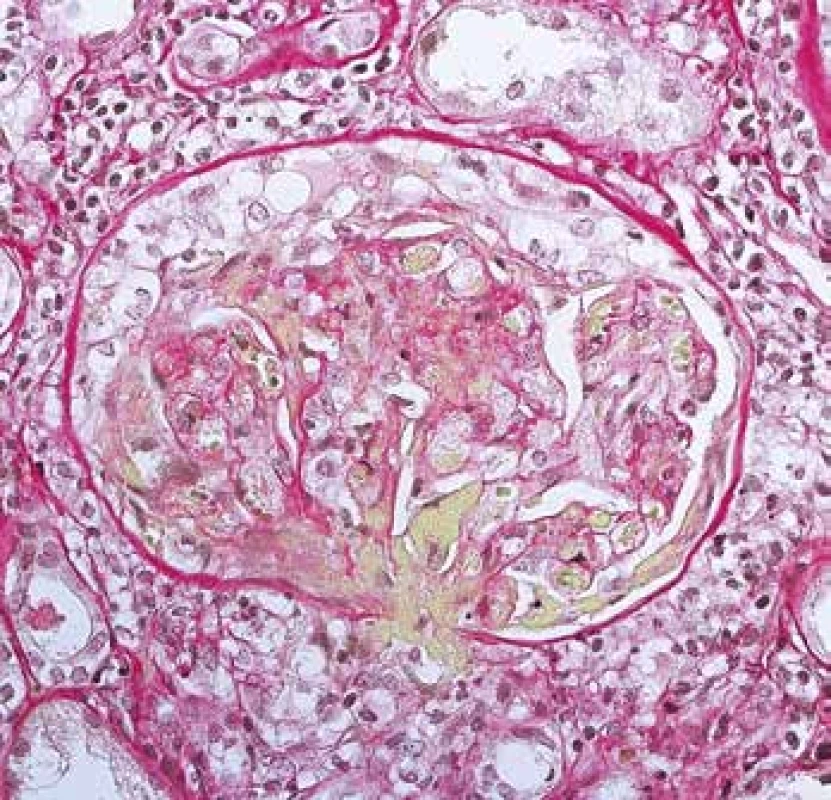
Image 12. Rezidua po proběhlé atace vaskulitidy s granulomatózní destrukcí Bow. pouzder. Glomeruly jsou zjizvené, zaniklé se zánětem v okolí. Takto irreversibilní poškození se vyvine během 3. týdnů (barvení Srel). 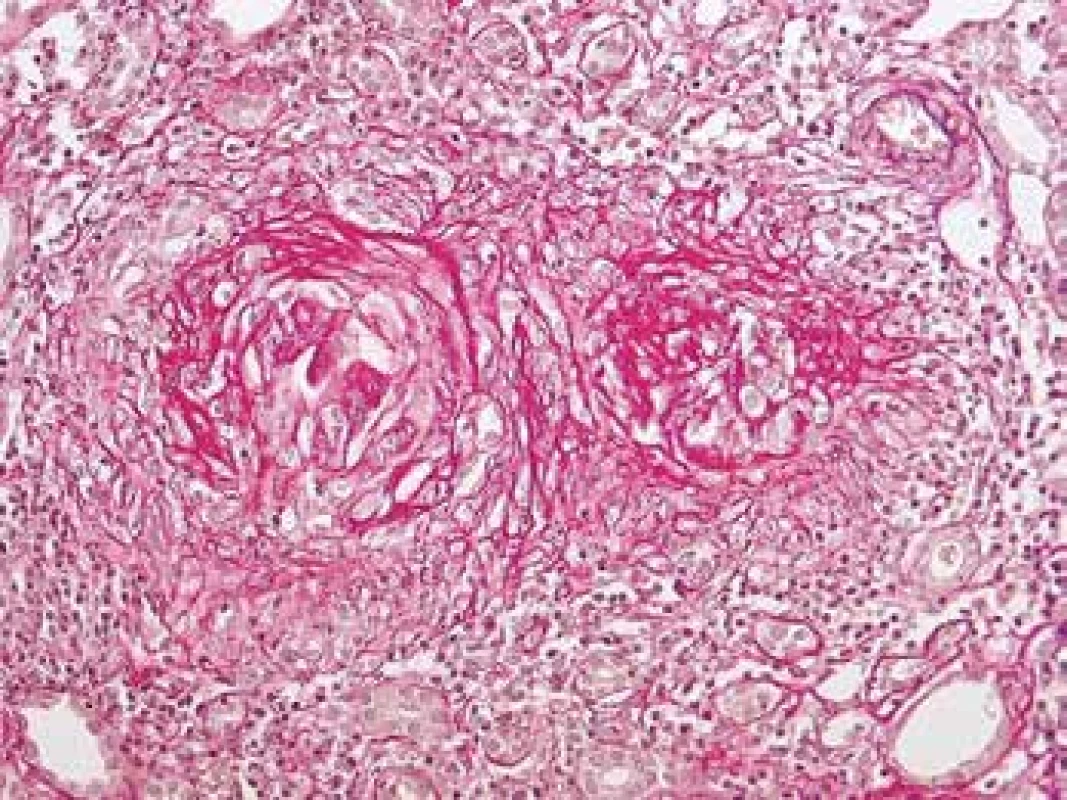
Diagnóza AAV v ledvině v rukou zkušeného nefropatologa nebývá komplikovaná; tou se stane u pacientů s kombinací s další diagnózou, která modifikuje nebo překrývá diagnostické znaky. Protože onemocnění je nejčastější ve vyšších věkových skupinách, kombinace s hypertenzí, aterosklerózou a diabetickou nefropatií je pravidlem. Možné jsou i kombinace s dalšími imunokomplexovými GN.
DIFERENCIÁLNÍ DIAGNÓZA
V diferenciální diagnostice, která by interferovala s morfologií vaskulitidy, toho moc nenajdeme. Zvažovat můžeme infekční vaskulitidy, převážně mykotické. Většinou jde o diagnózu nekroptickou a rozpoznání nečiní velké potíže. Mezi další infekce pravidelně postihující cévy patří CMV a pseudomonádové vaskulitidy, i zde rozpoznání není většinou komplikované.
Vynecháme-li infekční vaskulitidy, zůstane u autoimunních systémových vaskulitid nejdůležitější skutečností rozpoznat, že se o vaskulitidu s jistotou či pravděpodobně jedná. K tomu je třeba změnit „školský pohled“, kdy vaskulitida rovná se arteritida. Pravý opak je pravdou, nejčastější systémové vaskulitidy dospělých jsou vaskulitidy postihující převážně venuly a kapiláry. Druhým úkolem je rozpoznání fibrinoidní nekrózy, pokud je vaskulitida jakékoli cévy s fibrinoidní nekrózou, jde s velmi vysokou pravděpodobností AAV. Druhou možností je polyarteritis nodosa. Vzhledem k tomu, že polyarteritis nodosa je extrémně vzácné onemocnění pouze svalových arterií (z definice nesmí mít postižení arteriol, venul a kapilár a k tomu musí být ANCA negativní) je tato diagnóza velmi nepravděpodobná; a navíc jde o diagnózou z vyloučení (až když jsou ANCA protilátky negativní). Podobně je třeba si uvědomit, že jiné časté vaskulitidy, především temporální arteritida, představuje onemocnění, do jejíž morfologie fibrinoidní nekróza cévní stěny nepatří. Nutno zdůraznit, že rozpoznání vaskulitidy s fibrinoidní nekrózou vede s vysokou pravděpodobností k diagnóze AAV. Obecně ale zařazuje ten ze specialistů, kdo má v ruce výsledky protilátek a klinická data, což je nejčastěji klinik. V nefropatologii je morfologie tak typická, že diagnóza paucimunní nekrotizující GN se srpky je prakticky synonymem pro AAV. Pokud je současně vaskulitida hilových arteriol nebo cév mimo glomeruly, je diagnóza AAV jistá.
Patolog nemusí mít obavy z koincidence fibrinoidní nekrózy cévní stěny v rámci akcelerované nebo maligní hypertenze, protože v ledvinách má jinou morfologii a nefropatolog to pozná. V jiných orgánech se v průběhu ataky maligní hypertenze biopsie neindikuje.
Samostatnou a rozšiřující se skupinou AAV jsou vaskulitidy doprovázející užívání některých léků. Mezi dobře známé patří: prophylthiouracil, hydralazin, anti-TGF, levamisol (příměs v kokainu). Obvykle vyvolávají produkci MPO protilátek a většina pacientů má převážně kožní projevy, onemocnění ledvin vyvine cca 15 % z nich a morfologické projevy jsou zcela identické s klasickou AAV.
Během posledního desetiletí se objevily práce dokládající vznik AAV v souvislosti s onkologickou léčbou s tzv. onko-imunoterapií (checkpoint inhibitors, CTLA-4, PD-1, PD-L1). Jde o látky blokující negativní kostimulaci T lymfocytů, což vede ke zlepšení proti-nádorové imunitní odpovědi. Tím navodí záměrnou imunitní dysregulaci; a to může mít za následek rozvoj onemocnění s dysregulací imunity včetně AAV. Až 10 % pacientů s touto léčbou vyvine nějakou formu muskuloskletální nebo tzv. revmatologické manifestace nově vzniklého onemocnění. Pokud se hodnotí i bolesti kloubů, číslo vzroste na 40 %.
ZÁVĚR
Protože AAV jsou vaskulitidy malých cév a současně jde nejčastější systémové vaskulitidy dospělých, hledat morfologii vaskulitidy je nutné na jiných cévách než na arteriích, a to především na venulách a kapilárách. To vyžaduje soustředit se na detail a také si uvědomit že z klasického barvení HE, vaskulitidu skoro nikdy nepoznám, protože HE neposkytuje dostatečné detailní rozlišení struktur cévní stěny. Použití různých typů barvení především s detekcí elastiky (HE s elastikou, Srel, PASM, PAS) a prokrojení afekce s více řezy představují základ diagnózy. Na vaskulitidu je třeba v bioptické praxi myslet, zvl. v typických lokalitách a v autoptické diagnostice u celkových zánětlivých stavů s negativními hemokulturami. Mezi nejběžněji postižené lokality patří oblast ORL a horních cest dýchacích, ledviny, kůže, plíce a také GIT. Onemocnění má geografické a etnické rozdíly ve výskytu dané genetickým pozadím. Proto se v posledních letech preferuje účelnější dělení podle sérologických podskupin (PR3 AAV, MPO AAV) a nikoli podle klinických kategorií. Protože jde o velmi závažná a agresivní onemocnění, je zřejmé, že jen rychlá diagnóza vede k odpovídající léčbě, která umožní pacientům zachování ledvinné funkce a někdy jim zachrání život.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, PhD.
AeskuLab Patologie, k.s.
Evropská 2589/33b
16000 Praha 6
e-mail: honsova.eva@aeskulab.cz
Sources
1. Jennette JC, Xiao H, Falk RJ. Pathogenesis of vascular inflammation by anti-neutrophil cytoplasmatic antibodies. J Am Soc Nephrol 2006; 17 : 1235-1242.
2. Xiao H, Heeringa P, Hu P et al. Antineutrophil cytoplasmatic antibodies specific for myeloperoxidase cause glomerulonephritis and vasculitis in mice. J Clin Invest 2002; 110 : 955-963.
3. Schlieben DJ, Korbet SM, Kimura RE et al. Pulmonary-renal syndrome in a newborn with placental transmission of ANCAs. Am J Kidney Dis 2005; 45 : 758-761.
4. Roth A, Ooi JD, Hess JJ at al. Epitope specificity determines pathogenicity and detectability in ANCA-associated vasculitis. J Clin Invest. 2013; 123 : 1773-1783.
5. Xie G, Roshandel D, Sherva R, et al. Association of granulomatosis with polyangiitis (Wegener’s) with HLA-DPB1*04 and SEMA6A gene variants: evidence from genome-wide analysis. Arthritis and rheumatism 2013; 65 : 2457-2468.
6. Lyons PA, Rayner TF, Trivedi S et al. Genetically distinct subsets within ANCA-associated vasculitis. N Engl J Med 2012; 367 : 214–223.
7. Watts RA, Scott DG. ANCA vasculitis over the world. What do we learn from country differences? Presse Med 2013; 42 : 591-593.
8. Berti A, Warner R, Johnson K et al. Brief report: Circulating cytokiny profiles and antineutrophil cytoplasmatic antibody specificity in patients with antineurophil cytoplasmatic antibody-associated vasculitis. Arthritis Rheumatol 2018; 70 : 1114-1121.
9. Unizony S, Villareal M, Miloslavsky EM et al. Clinical outcomes of treatment of anti-neutrophil cytoplasmatic antibody (ANCA) associated vasculitis based on ANCA type. Ann Rheum Dis 2016; 75 : 1166-1169.
10. Jennette JC, Falk RJ, Bacon PA et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis and rheumatism 2013; 65 : 1-11.
11. Sunderkötter CH, Zelger B, Chen KR, et al. Nomenclature of Cutaneous Vasculitis: Dermatologic Addendum to the 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheumatol 2018; 70 : 171-184.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2020 Issue 2-
All articles in this issue
- Úvod do diagnostiky vaskulitid – „pattern based“ přístup a diferenciální diagnostika z pohledu morfologie
- Editorial
- Už asi není udržitelné fungovat bez subspecializací
- Monitor aneb nemělo by Vám uniknout, že...
- Patofyziologické mechanismy rozvoje ANCA asociovaných vaskulitid
- Jak v praxi zlepšit morfologickou diagnostiku systémových vaskulitid
- Primární vaskulitidy – současná diagnostika a léčba
- Sekundární vaskulitidy – opomíjené manifestace řady onemocnění
- Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika
- Jaká je vaše diagnóza?
- Jaká je vaše diagnóza? Odpověď: Mukozálny hamartóm zo Schwannovych buniek pripomínajúci taktilné Wagnerove-Meissnerove telieska
- Případ amébové kolitidy s endoskopickými i histopatologickými rysy Crohnovy choroby
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primární vaskulitidy – současná diagnostika a léčba
- Sekundární vaskulitidy – opomíjené manifestace řady onemocnění
- Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika
- Patofyziologické mechanismy rozvoje ANCA asociovaných vaskulitid
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

