-
Medical journals
- Career
Molekulární patologie plicních karcinomů pro rutinní praxi – update 2017
: Radoslav Matěj 1,2; Zdeněk Rohan 1,2; Kristýna Němejcová 2; Pavel Dundr 2
: Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha 1; Ústav patologie, 1. lékařská fakulta, Univerzita Karlova a VFN v Praze 2
: Čes.-slov. Patol., 53, 2017, No. 4, p. 159-166
: Reviews Article
Molekulárně patologická klasifikace tzv. nemalobuněčných plicních karcinomů (NSCLC) prodělává prudký rozvoj, zejména s ohledem na vývoj nových speciálních terapeutických metod cílených na specifické molekulárně-genetické aberace NSCLC. Tato skupina nádorů je typická variabilitou nejen ve svém klinickém průběhu a histopatologickém obraze, ale i v molekulárně-genetických charakteristikách. Především u plicních adenokarcinomů vedly nové poznatky k zásadní změně v přístupu k diagnostice a léčbě. Identifikace specifických genových aberací umožnila u části těchto nádorů nasazení tzv. cílené (biologické) léčby a tím zlepšení prognózy pacientů. Navíc se v poslední době prudce rozšířily možnosti imunoterapie jak u adenokarcinomů, tak karcinomů dlaždicobuněčných. Pro správnou diagnostickou praxi je třeba nejen provést správnou diagnózou, ale zcela zásadní je účelné nakládání s nádorovou tkání. V současné době se rutinně detekují mutace v genu pro receptor epidermálního růstového faktoru – EGFR a detekce přestavby ALK. Další markery s potenciálně prediktivním významem zahrnují mutace genu kódujícího protein b-raf – BRAF, přestavbu genu ROS1, a pro využití imunoterapie se standardizuje diagnostické využití exprese PD-L1. Sdělení shrnuje základní poznatky o diagnosticky a prakticky relevantních molekulách, jejichž analýza je zásadní podmínkou indikace moderní, cílené terapie a zároveň přehledně sumarizuje současně platné postupy v diagnostice maligních nádorů plic.
Klíčová slova:
NSCLC – plicní adenokarcinom – EGFR – ALK – BRAF – KRAS – RET – MET – PD-L1 – ROS1
Jen málokterá oblast patologie prodělává v poslední době tak dynamický rozvoj jako klasifikace a diagnostika nádorů plic (1). Tyto změny jsou podmíněny poznatky o úloze jednotlivých patogenních mutací při vzniku a rozvoji nádorů, zároveň ale též rozšiřujícími se možnostmi morfologické diagnostiky podepřené imunohistochemií (2). V neposlední řadě je podkladem vývoj nových léčiv, která přímo zasahují do karcinogeneze plicních nádorů. Zavedení mnohých nových histochemických a imunohistochemických metod napomáhá zlepšení diagnostické výtěžnosti, rovněž spolu s rozmachem molekulárně-biologických metod, které jsou nezastupitelné v tzv. prediktivní diagnostice (zpřesnění specifických podskupin nádorových či nenádorových lézí pro moderní, tzv. biologickou léčbu)(3).
NSCLC patří mezi solidní nádory s vysokou mutační zátěží, ale jen některé z mutací jsou významné z hlediska tumorigeneze, tzv. „driver“ mutace. Výskyt jednotlivých typů mutací je však odlišný u různých subtypů NSCLC – v tomto kontextu nabývá na zásadním významu přesná diagnostika jednotlivých subtypů a rozdělení karcinomu plic na malobuněčný karcinom (SCLC) a NSCLC je v současné době zcela nedostatečné. Komplexní analýza dlaždicobuněčných karcinomů odhalila vysokou mutační nálož, což odráží mutagenní efekt kouření, které je s tímto typem karcinomu silně asociováno. Dlaždicobuněčné karcinomy jsou charakterizovány alterací v počtu kopií genů, časté jsou i mutace genu TP53, CDKN2A, PTEN, PIK3CA, NOTCH1, FGFR1, RB1 a další (4-6). U části primárních plicních adenokarcinomů byly popsány charakteristické mutace v EGFR, BRAF a MET a přestavby zahrnující ALK a ROS1, proti kterým je v současné době dostupná cílená terapie, ať už v rutinní praxi, či ve fázi klinických studií (3). Zásadní přelomové změny zasáhly oblast imunoterapie, kde zejména blokování molekul PD-1 a PD-L1 dává potenciální naději na významně delší přežití pacientům, jejichž prognóza byla dosud velice špatná (7,8).
EGFR
Receptor pro epidermální růstový faktor (EGFR – epidermal growth factor receptor) je kódován na krátkém raménku 7. chromozomu (7p11.2) a patří do HER/erbB rodiny transmembránových receptorů s cytoplazmatickou tyrosinkinázovou aktivitou, která zahrnuje HER1 (EGFR/erbB1), HER2 (neu/erbB2), HER3 (erbB3) a HER4 (erbB4). Podstatou aktivace EGFR je vazba ligandu (např. EGF, TGF-α) na extracelulární doménu receptoru, což vede ke změně jeho konformace a vzniku homodimerů (EGFR–EGFR) či heterodimerů (např. EGFR–neu). Tato konformační změna je zásadní pro následnou aktivaci cytoplazmatické tyrosinkinázové domény, která pak dále interaguje s dalšími (tzv. adaptorovými) molekulami s návazností řady signálních kaskád. Aktivace EGFR má za následek řadu změn v genové a proteinové expresi buňky, což vede, z hlediska nádorové transformace, zejména k podpoře proliferace, motility, angiogeneze, invazivního růstu, odolnosti vůči buněčné smrti a vzniku metastatického fenotypu buněk (9,10). EGFR byl v roce 2004 identifikován jako jeden z významných terapeutických cílů nemalobuněčného karcinomu plic (NSCLC). V bělošské populaci je četnost mutací EGFR v NSCLC přibližně 10–15 %; v asijské populaci je prevalence mutací v EGFR vyšší a může dosahovat až 45–50 %. Přestože jsou mutace v EGFR poměrně častým jevem nejenom u plicních karcinomů, mutace lokalizované v exonech 18 – 21, které kódují tyrosinkinázovou doménu EGFR, jsou pro NSCLC specifické a nebyly detekovány v karcinomech tlustého střeva, pankreatu, prostaty, močového měchýře, prsu a ani v neuroendokrinních karcinomech (11). Primární plicní karcinomy nesoucí mutaci EGFR jsou charakteristické svým častějším výskytem u osob ženského pohlaví bez anamnézy chronického nikotinismu, vyšší výskyt je, jak již bylo zmíněno, popisován u asijské populace (12).
Funkce EGFR může být narušena zvýšenou (konstitutivní) aktivitou tyrosinkinázové domény EGFR, což je spojováno s faktem, že podstatná většina doposud známých proonkogenních mutací EGFR je právě v oblasti tyrozinkinázové domény. Na zvýšené aktivitě EGFR se však dále může podílet i amplifikace genu na úrovni DNA. Onkogenní mutace EGFR se z praktického hlediska dělí na „aktivující“ a „rezistentní“. Aktivující mutace v intracelulární tyrozinkinázové doméně EGFR vedou k jeho zvýšené a neregulované aktivitě a tím významně podporují nádorový růst. Syntetické molekuly označované jako inhibitory tyrozinkináz (tyrosine-kinease inhibitors, TKIs) mají schopnost tuto aberantní aktivitu EGFR zablokovat. Rezistentní mutace v tyrozinkinázové doméně EGFR změní strukturu vazebného místa pro TKIs a tím znemožní jejich působení na aktivitu EGFR. Tyto mutace vedou k rezistenci nádoru k léčbě TKIs, a proto jsou označované jako „rezistentní“. Nejčastější rezistentní mutací je T790M – na 790. pozici EGFR je tyrozin (T) nahrazen metioninem (M). Tato (či jiné rezistentní) mutace se může u části nádorů vyskytovat na jedné molekule EGFR spolu s mutací aktivující již primárně – nádory se proto označují jako primárně rezistentní a jsou příčinou selhání léčby TKIs. Jako sekundárně rezistentní nádory se pak označují ty, u kterých rezistentní mutace (i v tomto případě nejčastěji T790M) vznikají v důsledku selekce nádorových klonů vlivem podané léčby TKIs a často podmiňují progresi nádoru či tzv. „stable disease“ i přes podávanou terapii TKIs (13,14).
V současnosti jsou v EU a USA registrovány TKIs gefitinib, erlotinib a afatinib, nově osimertinib, který by měl být schopen inhibovat tyrozinkinázovou aktivitu EGFR s T790M mutací (15).
Mechanismy nádorové rezistence však kromě rezistentních mutací v EGFR zahrnují tzv. adaptivní mechanismy, kdy se selekčním tlakem TKIs preferují klony nádorových buněk s mutacemi v dalších molekulách signální dráhy EGFR (např. NF-κB či STAT3).
V současné době je u NSCLC při jeho první diagnóze z malého vzorku (či opakované diagnóze při relapsu onemocnění), po určení jeho histologického typu, proto nutné provést analýzu mutačního statutu EGFR se zaměřením na detekci aktivujících a rezistentních mutací.
Mutace EGFR byly doposud prakticky výhradně popisovány u primárních plicních adenokarcinomů, spíše ojediněle pak byly popsány i v adenoskvamózním karcinomu a zcela výjimečně i u primárního plicního dlaždicobuněčného karcinomu, přičemž nebyly popsány u mucinózních, „salivary-gland type“ a neuroendokrinních karcinomů plic (16,17). Typický adenokarcinom s mutací v EGFR je morfologicky charakterizován lepidickým typem růstu spolu s acinární či papilární složkou, bez nekróz a bez výraznějších cytologických atypií. V imunohistochemickém vyšetření jsou tyto nádory obvykle TTF-1 a napsin A pozitivní a p63/p40 negativní (16,18,19).
Pro diagnostiku mutací EGFR lze v současné době využít metody zahrnující různé modality sekvenační analýzy, metody založené na PCR či reverzní hybridizaci PCR produktů na stripy. Pro rutinní diagnostickou praxi však existují metody a postupy, kterými lze senzitivitu zvýšit (např. makro-/mikrodisekce). Metody využívající in situ hybridizace (FISH) nejsou pro detekci mutací EGFR vhodné, i když je známo, že EGFR může být v nádorech amplifikován. V provedených studiích neměl počet kopií EGFR prediktivní ani prognostický význam. Většímu zájmu se těší imunohistochemická metoda detekce pomocí monoklonálních protilátek namířených proti specifickým nejčastějším mutacím molekul EGFR, nicméně výsledky doposud provedených studií nejsou jednoznačné (20-22). Imunohistochemické vyšetření zatím tedy nelze považovat za adekvátní a plnohodnotnou náhradu molekulárně-patologického vyšetření genu EGFR.
ALK
Přestavby zahrnující ALK (anaplastic lymphoma kinase; lokus 2p23) byly poprvé popsány u anaplastického velkobuněčného T-lymfomu (přestavba NPM–ALK). Dále byly nalezeny například u inflamatorního myofibroblastického tumoru (23, 24), některých karcinomů ledviny (25) a v roce 2007 byly podrobně popsány u přibližně 5 % adenokarcinomů plic (26). Nejčastěji popisovaná přestavba u NSCLC je delece a následná inverze na krátkém raménku 2. chromozomu – inv(2)(p21p23), která vede ke vzniku fúzního produktu EML4–ALK (EML – echinoderm microtubule associated protein-like 4) (27). Možností přestavby je hned několik, přičemž se liší délka EML4 části fúzního genu, délka ALK zůstává stejná (26). Většina zlomů genu ALK je lokalizována mezi exonem 19 a 20, avšak u EML4 je oblast zlomu velmi variabilní a v současné době již bylo identifikováno více než 21 variant translokace EML4-ALK (28). Kromě toho jsou popsány další fúzní partneři ALK zahrnující kinesin family 5B, TRK-fused gene (TFG) a kinesin light chain (29-32). Poměrně typický je pro přestavbu ALK převažující výskyt u mladých nekuřáků (či lehkých kuřáků). Klinické studie prokázaly u pacientů s pozitivitou ALK benefit z léčby tyrozin-kinázovými inhibitory ALK (crizotinib)(33). V současné době jsou již dostupné inhibitory ALK druhé (ceritinib) a třetí generace (afitinib)(34). Přestavby zahrnující ALK se až na jednotlivé výjimky ve většině případů navzájem vylučují s mutacemi EGFR (35).
Klinicky se NSCLC s přestavbou ALK často diagnostikují v pokročilém stadiu a spíše u nekuřáků nebo lehkých kuřáků ve věku 40–60 let. Histopatologicky se obvykle jedná o hůře diferencované adenokarcinomy charakterizované solidním a/nebo acinárním růstem, nekrózami, často s nápadnou příměsí lymfocytů i přítomností buněk vzhledu pečetního prstenu (36). Rovněž může být přítomna dlažicobuněčná komponenta, či se může jednat i o adenoskvamózní karcinom, přestavba EML4–ALK byla popsána i u mukoepidermoidního karcinomu. Imunohistochemický profil odpovídá nádorům odvozeným z tzv. terminální rezervní jednotky – jsou TTF-1 a napsin A pozitivní a p63/p40 a CK5/6 negativní (18,27,35,37,38). Zajímavé je, že v jedné studii byla u části buněk s morfologií buněk typu pečetního prstenu pozorována koexprese TTF-1 a p63 (39).
Diagnostika přestavby ALK na molekulární úrovni se opírá zejména o metody in situ hybridizace (FISH), v současné době se však do praxe prosadila i metoda nepřímé imunohistochemie využívající monoklonální protilátky se zvýšenou senzitivitou i specificitou pro ALK přestavby (40-42).
I přes relativně nízký výskyt jsou NSCLC s přestavbou ALK v popředí zájmu, a to vzhledem k dostupnosti účinných inhibitorů ALK, crizotinibu, které v klinických studiích prodloužily významně přežívání pacientů s touto aberací (33).
BRAF
Protein BRAF (v-raf murine sarcoma viral oncogene homolog B) je serin/threoninová proteinová kináza, která je zapojena v signální kaskádě RAS-RAF. Aktivující mutace BRAF postihující kinázovou doménu (ve většině případů mutace p.V600E), jsou časté u melanomu (43) a byly rovněž popsány u dalších nádorů včetně kolorektálního karcinomu (43) a papilárního karcinomu štítné žlázy (44). U NSCLC tvoří minoritní podíl – přibližně 3 % (45). Vzhledem k dostupnosti již registrovaného inhibitoru mutovaného BRAF (p.V600E), vemurafenibu, který se užívá v léčbě pokročilých stadií maligního melanomu, je analýza BRAF statutu u pacientů s plicním adenokarcinomem dalším možným krokem.
KRAS
Gen KRAS (Kirsten rat sarcoma viral oncogene homolog) patří do rodiny RAS onkogenů (spolu s NRAS a HRAS), jejichž aktivita je regulována vazbou a štěpením GTP (guanosin trifosfát). Aktivovaný KRAS má na sobě navázaný GTP, který je následně hydrolyzován na GDP a tím se KRAS inaktivuje. Podstatou onkogenní aktivity KRAS jsou mutace inhibující hydrolýzu GTP, což vede ke zvýšené aktivitě KRAS. Protein KRAS je zapojen jako jeden z hlavních regulátorů signální dráhy RAS-RAF a je také zapojen do signalizace PI3K-AKT-mTOR (46).
Mutace KRAS jsou popisovány u celé řady nádorů zahrnující kolorektální karcinomy, karcinomy plic, prsu, močového měchýře, žaludku a pankreatu. Přibližně 20 % primárních plicních adenokarcinomů nese mutaci KRAS, u dlaždicobuněčných karcinomů či u malobuněčného karcinomu jsou mutace KRAS popisovány zcela výjimečně. Plicní adenokarcinomy s mutovaným KRAS se vyskytují spíše u mužů kuřáků a je pro ně typická kratší doba přežití (47,48). Typicky se jedná o solidně rostoucí adenokarcinomy s nekrózami, buněčnými atypiemi a přítomností tumor-infiltrujících lymfocytů. Pozitivita TTF-1 byla pozorována u většiny adenokarcinomů s mutovaným KRAS non-mucinózního typu; u mucinózních adenokarcinomů bylo TTF-1 většinou negativní (19).
Přítomnost mutace KRAS u plicních karcinomů lze považovat za prognostický marker; její prediktivní hodnota je značně omezená (47,49,50). Současné poznatky navíc ukazují, že mutace v EGFR a KRAS se navzájem téměř vždy vylučují a tudíž lze předpokládat, že je-li přítomna mutace v EGFR, je riziko primární rezistence proti EGFR inhibitorům založené na konstitutivní aktivitě mutovaného KRAS zanedbatelné (51).
DALŠÍ POTENCIÁLNÍ MARKERY
Přibližně u 1 – 7 % pacientů s primárním plicním adenokarcinomem lze nalézt amplifikaci onkogenu MET, což je receptor s tyrosinkinázovou aktivitou (známý také jako HGFR – hepatocyte growth factor receptor) spřažený se signálními drahami RAS-RAF a PI3K-AKT-mTOR (obr. 1)(52). Jeho role jako onkogenního aktivátoru výše uvedených drah je analogická EGFR, navíc je zvýšená aktivita MET podkladem až 20 % případů sekundární rezistence k léčbě inhibitory tyrosinkinázové aktivity EGFR (52). V poslední době se ukazuje, že terapeuticky ovlivnitelné, a tedy klinicky významné, mohou být nejen případy s amplifikací MET, ale i případy s jeho overexpresí či s mutací v exonu 14.
Další genetickou alterací identifikovanou u plicních adenokarcinomů je přestavba genu RET, nejčastěji s fúzním partnerem KIF5B, ale i s dalšími, jako je např. CCDC6, TRIM33 a NCOA4 (53). Onkogenem je zde RET, receptor s tyrosinkinázovou aktivitou, jehož aktivující mutace jsou známy u syndromů MEN 2A a MEN 2B, ztráta funkce RET je popisována v rámci patogeneze Hirschsprungovy choroby (54). Incidence přestavby RET je však u NSCLC velmi nízká, vyskytuje se asi u 1 % adenokarcinomů a zcela výjimečně u dlaždicobuněčných karcinomů.
Další zajímavou a již prakticky využitelnou aberací je přestavba zahrnující onkogen ROS1, který je svou aktivitou podobný ALK. Podoba však nezůstává pouze u aktivity, ale stejně jako pro ALK bylo i pro ROS1 nalezeno několik fúzních partnerů a také morfologie „ALK+“ a „ROS1+ adenokarcinomů“ si jsou velmi podobné (32). Tato podoba s ALK může být potenciálním benefitem při užití inhibitoru ALK crizotinibu, kdy nádory s přestavbou ROS1 mohou dokonce lépe odpovídat na terapii.
DLAŽDICOBUNĚČNÝ PLICNÍ KARCINOM
Skvamocelulární karcinom plic je etiologicky nejčastěji spojován s působením karcinogenů vzniklých spalováním tabáku a cigaretového papíru často velmi pochybných kvalit a složení, a proto lze očekávat, že genové a proteinové alterace budou u těchto nádorů velmi variabilní, mnohočetné a poměrně nespecifické. I proto jsou výsledky molekulárních a genomických studií a jejich následné převedení do konkrétních diagnostických a léčebných postupů stále problematické. Přesto lze předpokládat existenci přítomnosti společných molekulárních jmenovatelů typických pro metaplastický, dysplastický následně i invazivní fenotyp těchto lézí bronchiálního epitelu (4). Nejčastěji se v tomto kontextu popisují amplifikace genu pro FGFR1 (fibroblast growth factor receptor 1) a mutace v FGFR2, DDR2 (discoidin domain receptor tyrosine kinase 2) a PIK3CA (phosphatidylinositol-bisphosphate 3-kinase). V současnosti probíhají klinické zkoušky s inhibitory FGFR1 a DDR2, u kterých byla u pacientů se skvamocelulárním karcinomem popsána velmi nadějná terapeutická odpověď, nicméně tyto výsledky je zatím třeba hodnotit s nadhledem a vyčkat dalších prospektivních studií a metaanalýz (3,4,6,55).
IMUNOTERAPIE – PD-1/PD-L1
Princip imunoterapie nádorových onemocnění je poměrně starý, avšak praktický význam poznatků nádorové imunobiologie spadá až do přelomu druhého tisíciletí, kdy byly objeveny klíčové molekuly CTLA-4 (cytotoxic T-lymphocyte antigen 4), PD-1 (programed death receptor-1), TIM-3 (T-cell immunoglobulin domain and mucin domain-3), LAG-3 (lymphocyte activation gene-3 protein) a další (56). Zjistilo se, že interakce T-lymfocytů a jejich význam v zánětlivé odpovědi jsou velmi podobné imunitní odpovědi na nádorový proces. Nádorová buňka má schopnost exprimovat molekuly, které jí umožní uniknout interakci s imunitním systémem (tzv. imunitnímu dohledu). Dojde-li k zablokování těchto klíčových receptorových molekul látkami známými jako tzv. checkpoint inhibitory, může být nádor rozpoznán imunitním systémem a následně zničen. Prvním prakticky využitým přípravkem byl inhibitor receptorové molekuly CTLA-4 (ipilimumab) v léčbě melanomu (57). Do centra zájmu výzkumu se však dostaly zejména inhibitory PD-1 a jeho ligandu PD-L1. V současné době existuje několik různých molekul, které blokují PD-1 či PD-L1 a jejich účinek byl prokázán na celé řadě nádorů včetně skupiny tzv. nemalobuněčných plicních karcinomů (7,58). Zásadním problémem zůstává, jak vyselektovat nádory, které budou reagovat na imunoterapii (59). Jedním z možných postupů se jeví analýza imunohistochemické exprese PD-1 a PD-L1 na nádorových elementech, případně exprese na s tumorem asociovaných lymfocytech (60-62).
Testování exprese PD-L1 u nemalobuněčných karcinomů plic (NSCLC) nabylo na praktickém významu v průběhu roku 2016 v souvislosti s rostoucí dostupností léčby zaměřené na blokování receptoru PD-1 či jeho ligandu PD-L1. Situace byla zpočátku značně nepřehledná, registrační studie 4 přípravků (nivolumab, pembrolizumab, durvalumab, atezolizumab) pracovaly se 4 různými protilátkami (klony 28-8, 22C3, SP263 a SP142) od různých firem s prováděním testování na odlišných platformách (Dako a Ventana, Roche) (63,64). V rámci registračních studií však byla nastavena i různá kritéria pozitivity. Při schvalování léčby FDA byla léčba pembrolizumabem svázána s testováním s PD-L1 IHC 22C3 pharmDx kitem (Dako) v rámci tzv. „companion diagnostic“. Testování u nivolumabu bylo charakterizováno jako „complementary diagnostic“ kitem IHC 28-8 pharmDx (Dako), tedy diagnostika doporučená, nikoliv pro indikaci léčby závazná. Jednotlivé hranice pozitivity byly definovány různě, u pembrolizumabu, nivolumabu a durvalumabu se hodnotí pouze rozsah exprese v nádorových buňkách, u atezolizumabu jde o kombinaci exprese v nádorových buňkách a ve stromálních lymfocytech.
Je zřejmé, že PD-L1 není optimální prediktor, protože i pacienti zcela negativní mohou, byť v menším procentu, profitovat z léčby. Lepší prediktor však v současné době známý není (65). V testování zůstává neustále řada nejasností. Zcela klíčová je heterogenita exprese PD-L1 v nádorové tkáni, která při diagnostice z malého vzorku v žádném případě nereflektuje většinu nádorové populace (66). Dále je velmi kontroverzní otázka změny exprese PD-L1 v souvislosti s chemoterapií a jinými modalitami protinádorové terapie a v neposlední řadě změny v expresi mezi primárním nádorem a metastázou (67,68).
SOUČASNÉ DOPORUČENÉ POSTUPY VYŠETŘOVÁNÍ
Diagnostika plicních karcinomů prošla během posledních několika let řadou změn ať už na poli klasifikace plicních adenokarcinomů či charakteristiky cílů specifické terapie. Změna histopatologické klasifikace a diagnostického algoritmu při vyšetřování NSCLC je shrnuta v mezinárodních konsenzech (2,51,69) a doporučeních. Z nich vychází také „Doporučený postup pro histologické vyšetření karcinomu plic“ vydaný v roce 2013 Společností českých patologů (dostupný ke stažení na www.patologie.info/standardy.php), který prošel již druhou revizí, naposledy 1. 12. 2016 v rámci tzv. Mutation day, kdy se na společném jednání zástupců Společnosti českých patologů (SČP), České onkologické společnosti (ČOS) a České pneumologické a ftizeologické společnosti (ČPFS) za účasti zástupců plátců, Státního ústavu pro kontrolu léčiv a Ministerstva zdravotnictví ČR byly domluveny konsenzuální postupy pro prediktivní testování u plicních karcinomů.
V současnosti je doporučováno u všech nádorů určených jako primární plicní adenokarcinom provést analýzu mutačního stavu genu EGFR a přestavby ALK, a to na pracovištích tzv. referenčních laboratoří, jejichž seznam je na stránkách SČP i ČOS. Analýza mutačního stavu KRAS u plicních adenokarcinomů není v současné době z důvodů uvedených výše v textu indikována, pokud není užito metodik tzv. NGS (Next-Generation Sequencing), kde může být molekula součást panelu více genů. Pro imunohistochemické stanovení exprese PD-L1 je v současné době možné záměně užít dvou klonů protilátek, 22C3 a 28-8. Přehled současného stavu vyšetřovaných markerů, metod jejich detekce a potenciálních léčebných přístupu shrnuje tabulka (tab. 1).
1. Přehled nejčastějších relevantních aberací, jejich diagnostika a potenciální léčba. 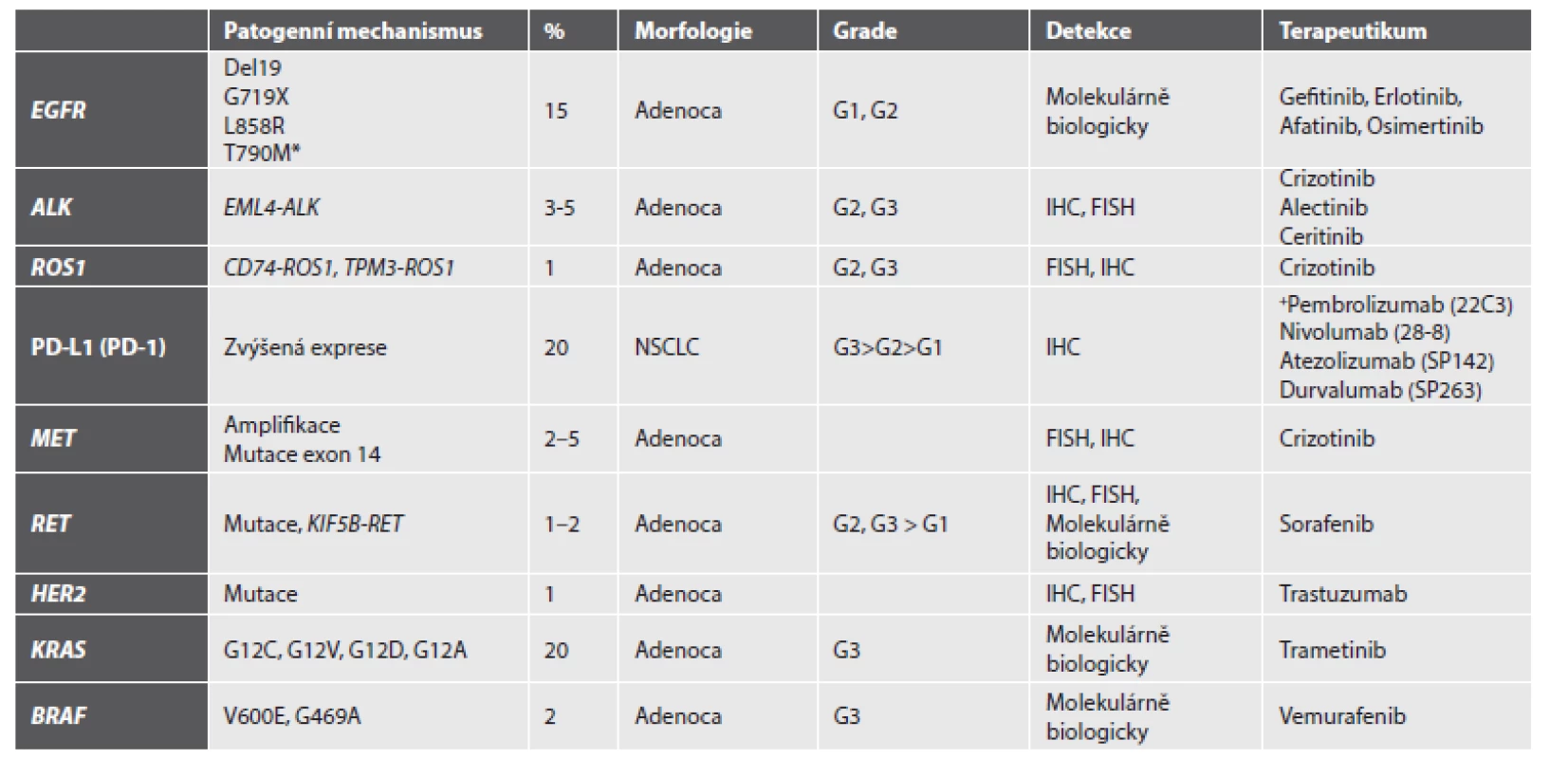
* rezistentní mutace; FISH fluorescenční in situ hybridizaci; G grade; IHC imunohistochemické metody detekci; NSCLC nemalobuněčný plicní karcinom Jako optimální metody pro diagnostiku mutací EGFR se jeví izolace DNA z nádorové tkáně a následná analýza potenciálních patogenních variací genu EGFR pomocí různých metod s dostatečnou citlivostí. Lze užít metody real-time PCR, reverzní hybridizace produktů PCR na tzv. „stripu“, sekvenace genu EGFR na přístroji druhé generace sekvenátorů (NGS), ale využít i dalších nových a až překotně se rozvíjejících metodik. Molekulární analýzu lze provést jak z bronchoskopického vzorku fixovaného ve formolu a zalitého do parafinu, tak i z cytologického nátěru. Nutno však upozornit, že diagnostika nádorů pouze z cytologických nátěrů je v současné době nevhodná, neumožňuje imunohistochemické dovyšetření se stanovením přesného typu NSCLC, také nelze provést vyšetření cytogenetické ke stanovení přestavby genu ALK a ROS1. Každý cytologický odběr ze suspektního plicního nádoru by měl tedy být kromě nátěru doprovázen i odběrem materiálu na cytoblok.
Současné molekulární metody umožňují detekovat i <1 % mutované DNA na pozadí nemutované, proto lze analyzovat i vzorky tkáně, ve kterých je zastoupení nádorových buněk malé. Prakticky však je žádoucí a v doporučených postupech vyžadované zastoupení alespoň 10 % nádorové tkáně, doporučené množství nádorových buněk je 400, ale se stoupající citlivostí buněk bude zřejmě požadované množství klesat. Vždy je ale zásadní, aby přibližné zastoupení nádorových buněk ve tkáni provedl kvalifikovaný patolog.
Samostatnou kapitolou je vyšetřování tzv. tekutých biopsií („liquid biopsy“), tedy detekce volné DNA (cfDNA) z krve. Jde o kontroverzní téma, u kterého zatím nebylo dosaženo jednoznačného konsenzu, jaké bude postavení této slibné diagnostické metodiky v procesu stanovování prediktivních markerů u nádorů plic, ale i například nádorů tlustého střeva (70). V současnosti platí, že tuto metodiku lze u NSCLC využít v případech nemožností detekce mutačního statutu nádorových buněk z biopsie, nebo nemožnosti rebiopsie u případů předpokládané rezistentní mutace (71,72).
Přítomnost přestavby ALK lze diagnostikovat buď pomocí metod využívajících in situ hybridizace (FISH) nebo imunohistochemicky.
Jako zlatý standard diagnostiky ALK byla až donedávna nahlížena metoda FISH. Vzhledem k poměrné finanční náročnosti této metody a potřebě vhodného přístrojového vybavení a trénovaného personálu, i s ohledem na poměrně nízkou frekvenci výskytu přestavby ALK u pacientů s NSCLC se však metoda FISH nejeví zejména pro screening jako optimální. Jako alternativa se nabízí zejména imunohistochemické stanovení exprese proteinu ALK, které však v minulosti naráželo na nízkou senzitivitu vyšetření související s v té době dostupným klonem protilátky proti ALK (ALK1). V posledních letech se však objevily nové klony protilátek, z nichž zejména dva (D5F3 a 5A4) vykazují dostatečnou senzitivitu i specifitu. Tyto klony protilátek byly nejprve používány jako screeningová metoda pro selekci případů vyšetřovaných následně metodou FISH. Metoda FISH v tomto algoritmu byla nadále považována za jedinou metodu, na podkladě jejíhož výsledku může být indikována léčba ALK inhibitory. Recentní práce srovnávající expresi ALK na imunohistochemické úrovni s výsledky přestavby genu ALK hodnocenými metodou FISH však ukázaly vysokou shodu mezi oběma testy. Metaanalýza 12 studií celkem hodnotících 3754 případů NSCLC prokázala, že v případě jakékoliv IHC pozitivity (tedy 1+, 2+, 3+) je senzitivita IHC vyšetření 99 % a specifita 86 %, v případě pozitivity pouze 2+ a 3+ je senzitivita 86 % a specifita 98 %, a v případě pozitivity pouze 3+ je senzitivita 56 % a specifita 100 % (73). Nicméně existují i práce poukazující na možnou diskordanci mezi IHC a FISH (74).
Hodnocení exprese ALK se liší s ohledem na použitou protilátku, resp. s ohledem na fakt, je-li použito vyšetření certifikovaným kitem Ventana ALK D5F3 CDx Assay, nebo samostatně jedna z protilátek (D5F3 či 5A4) v rámci validovaného laboratorního postupu, avšak nikoliv v rámci kitu.
V kontextu uvedeného se pro diagnostiku ALK jeví jako nejvhodnější algoritmus kombinující imunohistochemické vyšetření a vyšetření metodou FISH, kdy případy IHC zcela negativní (0) jsou nahlíženy jako negativní bez nutnosti dalšího ověření metodou FISH. Případy s IHC skóre 1+ a 2+ či případy nejednoznačné při vyšetření kitem vyžadují dovyšetření metodou FISH. Případy IHC 3+ či případy hodnocené jako pozitivní při vyšetření kitem jsou ALK pozitivní bez nutnosti dalšího ověření metodou FISH. V rámci tzv. Mutation day vzešel konzensus:
- i) vyšetření ALK je prováděno reflexně u totožných typů nádorů, jako EGFR. Primární je vyšetření imunohistochemickou metodou (s použitím primárních protilátek klonů D5F3 nebo 5A4), u případů, které jsou slabě či středně silně pozitivní, případně nejednoznačné (při vyšetření kitem), je výsledek následně konfirmován metodou FISH;
- ii) za ALK pozitivní jsou považovány nádory imunohistochemicky silně pozitivní nebo FISH pozitivní;
- iii) testování bude prováděno dle uvedeného schématu (kombinace IHC a ISH) (obr. 1);
- iv) testování RT-PCR není v tuto chvíli doporučováno;
- v) testování u dlaždicobuněčného karcinomu se provádí jen na žádost klinika.
1. Metastáza plicního adenokarcinomu v jaterním parenchymu s přestavbou ALK pozitivní v imunohistochemickém průkazu pomocí protilátky klonu 5A4 (A) a metodou FISH (B) 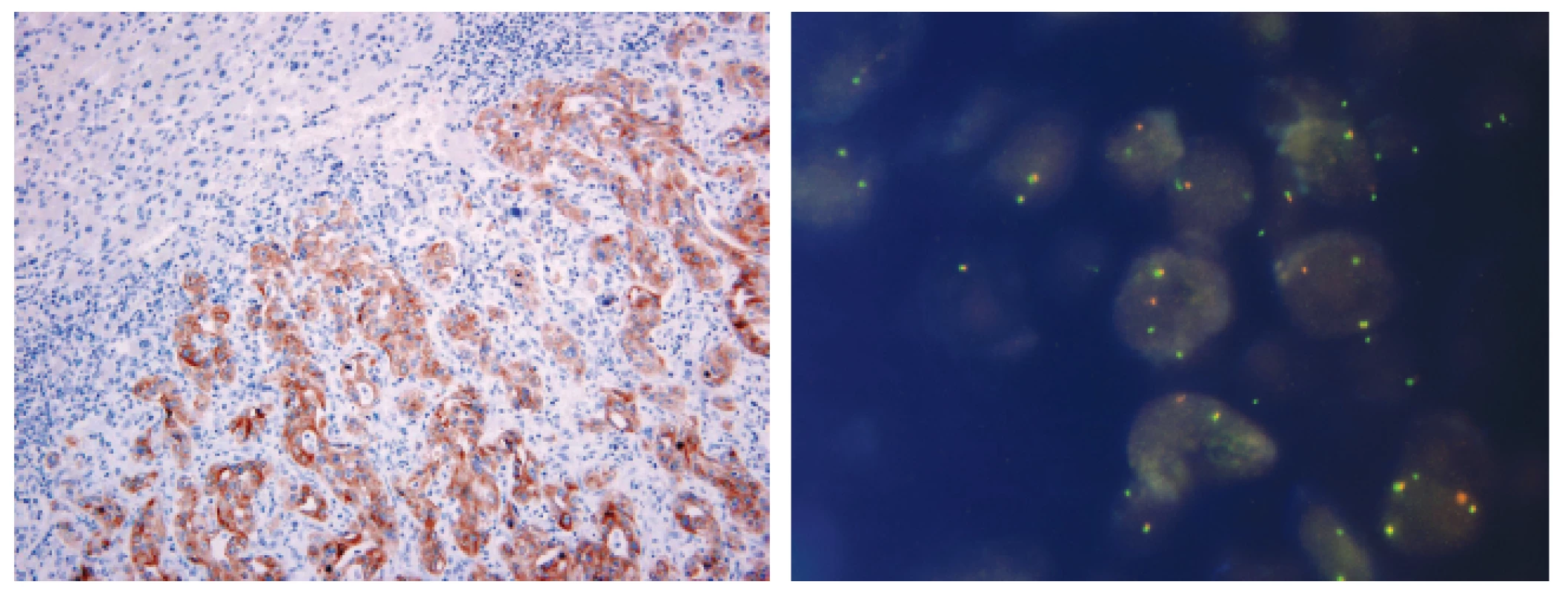
Jako zlatý standard diagnostiky přestavby genu ROS1 je v současné době nahlíženo vyšetření metodou FISH, vzhledem nízkému výskytu mutací je však tato metoda pro plošný screening nevhodná. Obdobně jako u ALK se tedy nabízí algoritmus kombinující vyšetření IHC a FISH (75) V současné době je dostupná pro tyto účely jediná validovaná protilátka (klon D4D6). Validační studie prokázala vysokou senzitivitu i specifitu této protilátky ve srovnání s metodou FISH – v případě IHC 3+ byla senzitivita 87,5 % a specifita 98 %; v případě IHC 2+ a IHC 3+ byla senzitivita 100 % a specifita 92 % (76). Cílem screeningového vyšetření je dosáhnout co největší senzitivity, v případě ROS1 se tedy jako algoritmus nabízí pro následné testování metodou FISH vybrat všechny případy při IHC vyšetření hodnocené jako 2+ a 3+ (obr. 2). V současné době se však na rozdíl od jiných zemí plošný screening ROS1 v ČR neprovádí, vyšetření je indikováno pouze na žádost ošetřujícího onkologa.
2. Plicní adenokarcinom s přestavbou ROS1 v imunohistochemickém průkazu pomocí protilátky klonu D4D6. 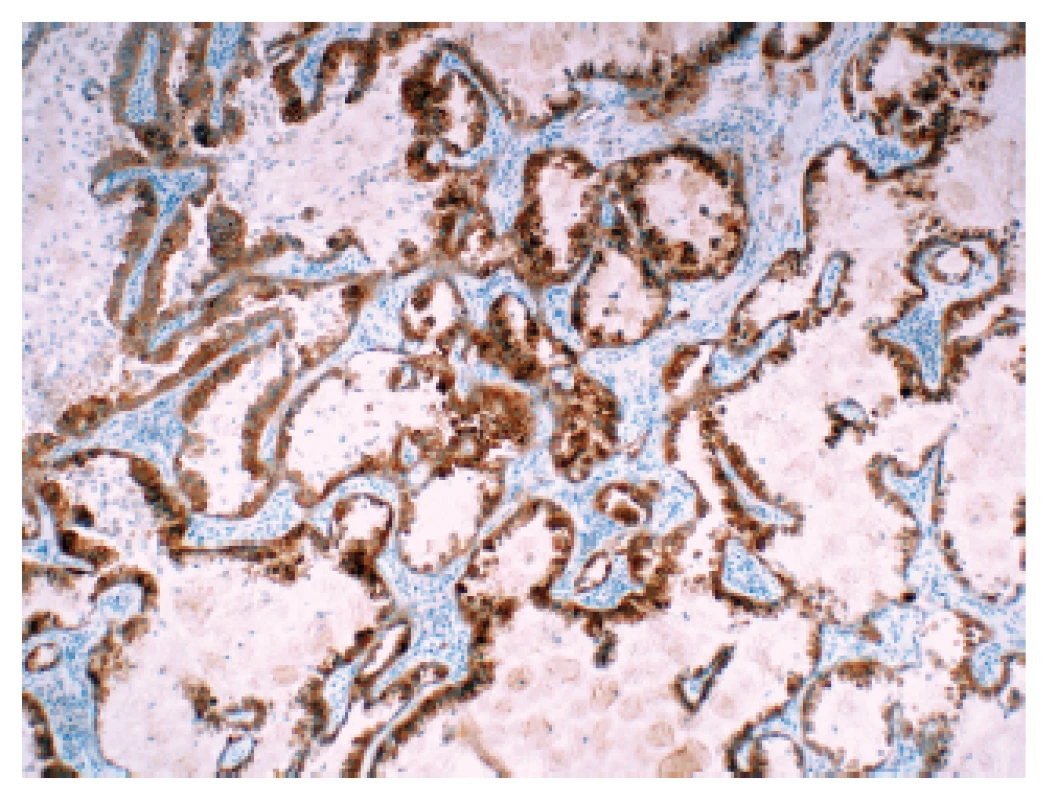
Pokud jde o testování PD-L1, v současnosti jsou dostupné diagnostické protilátky klonů 22C3 a 28-8, testování probíhá v laboratořích sítě tzv. referenčních laboratoří. Je možné použít záměně jakoukoliv ze dvou protilátek (22C3, 28-8), metoda však musí být každou laboratoří řádně validovaná a používaná v souladu s nastavenými pravidly (77). Zcela zásadním aspektem testování exprese PD-L1 je jednotnost výstupů vyšetření z různých laboratoří, protože umožní snadnou orientaci klinikům i v případě přechodu pacienta do jiného zařízení, než ve kterém testování proběhlo. S ohledem na testování v nádorové tkáni panuje shoda na tom, že se hodnotí pouze membránová exprese PD-L1 bez ohledu na její rozsah (kompletní/inkompletní) a intenzitu (slabá/střední/silná). Důležité je hodnotit expresi pouze na vitálních nádorových elementech, nehodnotit oblasti s nekrózami či apoptózami, odlišit expresi v makrofázích (což může být občas dosti problematické), která se vyskytuje normálně. Je zcela zásadní dodržovat všechny obecné principy správného hodnocení imunohistochemických vyšetření, které i přes určitá specifika exprese PD-L1 nejsou nijak odlišné od jiných protilátek. Minimální počet nádorových buněk pro hodnocení je stanoven na 100, byť i se jedná o hladinu do určité míry arbitrární. S ohledem na tkáň, ze které je možné testovat, se jako relevantní jeví testování z bioptických vzorů primárních nádorů i metastáz (78). V případě cytologií je testování možné pouze u materiálu zpracovaném metodou cytobloku, avšak nikoliv z výpotků, nýbrž pouze z primárních nádorů či z metastáz. Cytologické nátěry jsou pro testování technicky zcela nevhodné. Každý report hodnocení exprese PD-L1 musí dle konsenzu obsahovat typ použité protilátky a závěr, ve kterém bude explicitně uveden výsledek v podobě buď „negativní – exprese PD-L1 zastižena v < 1 % nádorových buněk“ nebo „pozitivní – exprese PD-L1 zastižena v ...“ s uvedením % pozitivních buněk. Uvedení % pozitivních buněk u nádorů je zcela zásadní s ohledem na fakt, že exprese představuje kontinuum. Jsou sice určité klinicky významnější hladiny stanovené jako cut-off(s) pozitivity pro jednotlivé léky, nicméně v současné době přetrvává nejistota ohledně cut off(s) pro praktickou indikaci léčby u různých přípravků i různých linií léčby. V této situaci je tedy zapotřebí, aby měl klinik k dispozici údaj, na podkladě kterého se pak může o léčbě kvalifikovaně rozhodnout bez ohledu na současné hranice k indikacím léčby, které se pravděpodobně mohou v blízké budoucnosti nadále měnit (obr. 3).
3. Pozitivita PD-L1 u plicního adenokarcinomu <b>(A)</b> a dlaždicobuněčného karcinomu <b>(B)</b> imunohistochemicky protilátkou klonu 22C3. 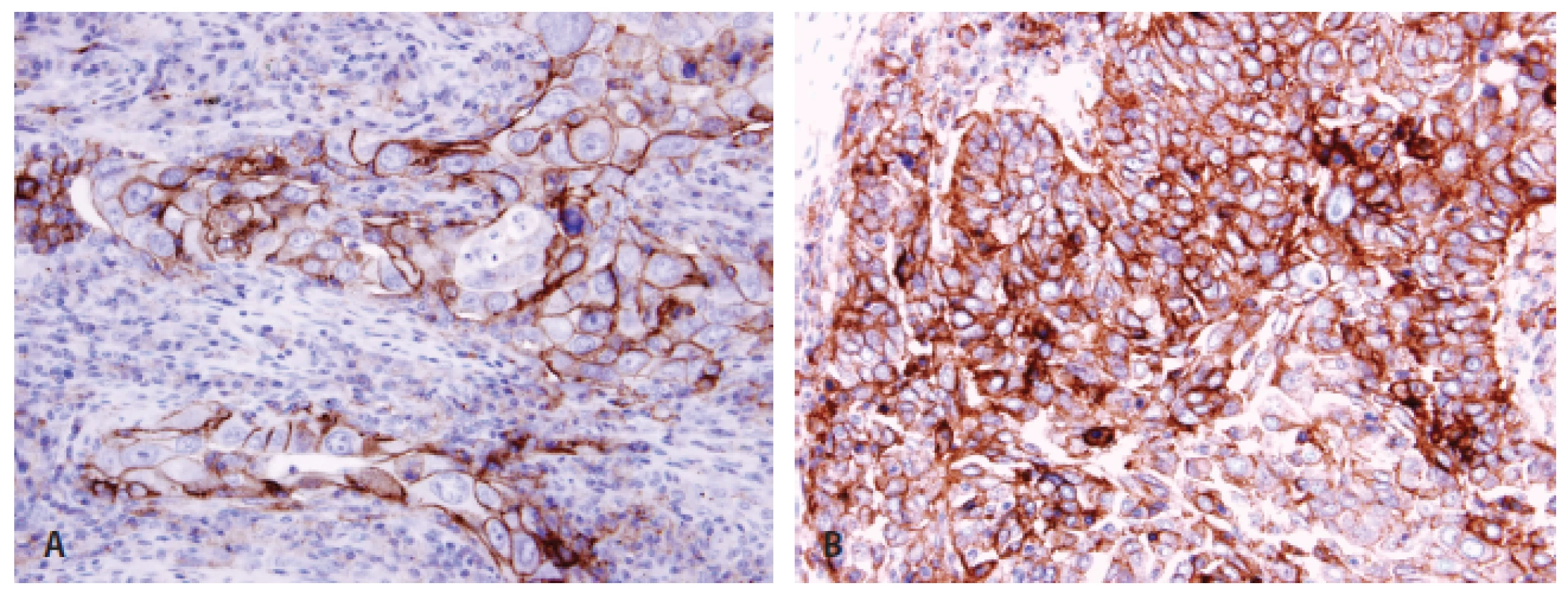
ZÁVĚR
Optimalizace postupů a multidisciplinární přístup k diagnostice NSCLC spočívající v úzké spolupráci pulmoonkolooga, histopatologa a molekulárního biologa vede ke zvýšení efektivity diagnostických postupů. Bez harmonizace a úzké spolupráce nelze dosáhnout optimálních výsledku, ba co více, je možné dojít k výsledkům zavádějícím a v konečném důsledku poškozujícím pacienta. Současně platný konsenzus vyšetřovacích postupů se zřejmě i v budoucnosti bude měnit v souladu s novými poznatky a postupy, zejména s ohledem na nová potenciálně zásadní léčiva. Zásadním problémem však je ekonomický aspekt vyšetřovacích postupů, který bude záležet na možnostech úhrady plátců poskytovatelům, což se jeví jako poměrně složitý problém.
PODĚKOVÁNÍ
Práce podpořena MZČR (projekt RVO-VFN 64165), Univerzitou Karlovou (projekt Progres Q28/LF1) a projektem OPPK (Výzkumné laboratoře nádorových onemocnění, CZ.2.16/3.1.00/24509).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
doc. MUDr. Radoslav Matěj, Ph.D.
Oddělení patologie a molekulární medicíny
Thomayerova nemocnice
Vídeňská 800
14059 Praha 4 – Krč
tel.: 261 083 741
email: radoslav.matej@ftn.cz
Sources
1. Rohan Z, Matejčková M, Matěj R. Molekulární patologie plicních karcinomů. Cesk Patol 2014; 50(2): 71-75.
2. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Fourth edition. Lyon, France: IARC Press; 2015.
3. Soo RA, Stone EC, Cummings KM, et al. Scientific Advances in Thoracic Oncology 2016. J Thorac Oncol 2017.
4. Drilon A, Rekhtman N, Ladanyi M, Paik P. Squamous-cell carcinomas of the lung: emerging biology, controversies, and the promise of targeted therapy. The Lancet Oncology 2012; 13(10): e418-e426.
5. Gandara DR, Hammerman PS, Sos ML, Lara PN, Jr., Hirsch FR. Squamous cell lung cancer: from tumor genomics to cancer therapeutics. Clin Cancer Res 2015; 21(10): 2236-2243.
6. Liao RG, Jung J, Tchaicha J, et al. Inhibitor-sensitive FGFR2 and FGFR3 mutations in lung squamous cell carcinoma. Cancer Res 2013; 73(16): 5195-5205.
7. Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373(17): 1627-1639.
8. Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387(10027): 1540-1550.
9. Roskoski R, Jr. The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacol Res 2014; 79 : 34-74.
10. Wee P, Wang Z. Epidermal Growth Factor Receptor Cell Proliferation Signaling Pathways. Cancers (Basel) 2017; 9(5).
11. Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005; 97(5): 339-346.
12. Chapman AM, Sun KY, Ruestow P, Cowan DM, Madl AK. Lung cancer mutation profile of EGFR, ALK, and KRAS: Meta-analysis and comparison of never and ever smokers. Lung Cancer 2016; 102 : 122-134.
13. Castellanos E, Feld E, Horn L. Driven by Mutations: The Predictive Value of Mutation Subtype in EGFR-Mutated Non-Small Cell Lung Cancer. J Thorac Oncol 2017; 12(4): 612-623.
14. Lee DH. Treatments for EGFR-mutant non-small cell lung cancer (NSCLC): The road to a success, paved with failures. Pharmacol Ther 2017; 174 : 1-21.
15. Pirker R. Third-generation epidermal growth factor receptor tyrosine kinase inhibitors in advanced nonsmall cell lung cancer. Curr Opin Oncol 2016; 28(2): 115-121.
16. Zakowski MF, Hussain S, Pao W, et al. Morphologic features of adenocarcinoma of the lung predictive of response to the epidermal growth factor receptor kinase inhibitors erlotinib and gefitinib. Arch Pathol Lab Med 2009; 133(3): 470-477.
17. Sartori G, Cavazza A, Sgambato A, et al. EGFR and K-ras mutations along the spectrum of pulmonary epithelial tumors of the lung and elaboration of a combined clinicopathologic and molecular scoring system to predict clinical responsiveness to EGFR inhibitors. Am J Clin Pathol 2009; 131(4): 478-489.
18. Yousem SA. Role of molecular studies in the diagnosis of lung adenocarcinoma. Mod Pathol 2012; 25 Suppl 1: S11-17.
19. Rekhtman N, Ang DC, Riely GJ, Ladanyi M, Moreira AL. KRAS mutations are associated with solid growth pattern and tumor-infiltrating leukocytes in lung adenocarcinoma. Mod Pathol 2013; 26(10): 1307-1319.
20. Allo G, Bandarchi B, Yanagawa N, et al. Epidermal growth factor receptor mutation-specific immunohistochemical antibodies in lung adenocarcinoma. Histopathology 2014; 64(6): 826-839.
21. Isaksson S, Bendahl PO, Salomonsson A, et al. Detecting EGFR alterations in clinical specimens-pitfalls and necessities. Virchows Arch 2013; 463(6): 755-764.
22. Wen YH, Brogi E, Hasanovic A, et al. Immunohistochemical staining with EGFR mutation-specific antibodies: high specificity as a diagnostic marker for lung adenocarcinoma. Mod Pathol 2013; 26(9): 1197-1203.
23. Lawrence B, Perez-Atayde A, Hibbard MK, et al. TPM3-ALK and TPM4-ALK oncogenes in inflammatory myofibroblastic tumors. Am J Pathol 2000; 157(2): 377-384.
24. Griffin CA, Hawkins AL, Dvorak C, Henkle C, Ellingham T, Perlman EJ. Recurrent involvement of 2p23 in inflammatory myofibroblastic tumors. Cancer Res 1999; 59(12): 2776-2780.
25. Debelenko LV, Raimondi SC, Daw N, et al. Renal cell carcinoma with novel VCL-ALK fusion: new representative of ALK-associated tumor spectrum. Mod Pathol 2011; 24(3): 430-442.
26. Horn L, Pao W. EML4-ALK: honing in on a new target in non-small-cell lung cancer. J Clin Oncol 2009; 27(26): 4232-4235.
27. Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers. J Thorac Oncol 2008; 3(1): 13-17.
28. Ou SH, Bartlett CH, Mino-Kenudson M, Cui J, Iafrate AJ. Crizotinib for the treatment of ALK-rearranged non-small cell lung cancer: a success story to usher in the second decade of molecular targeted therapy in oncology. Oncologist 2012; 17(11): 1351-1375.
29. Choi YL, Takeuchi K, Soda M, et al. Identification of novel isoforms of the EML4-ALK transforming gene in non-small cell lung cancer. Cancer Res 2008; 68(13): 4971-4976.
30. Sasaki T, Rodig SJ, Chirieac LR, Janne PA. The biology and treatment of EML4-ALK non-small cell lung cancer. Eur J Cancer 2010; 46(10): 1773-1780.
31. Takeuchi K, Choi YL, Togashi Y, et al. KIF5B-ALK, a novel fusion oncokinase identified by an immunohistochemistry-based diagnostic system for ALK-positive lung cancer. Clin Cancer Res 2009; 15(9): 3143-3149.
32. Togashi Y, Soda M, Sakata S, et al. KLC1-ALK: a novel fusion in lung cancer identified using a formalin-fixed paraffin-embedded tissue only. PLoS One 2012; 7(2): e31323.
33. Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013; 368(25): 2385-2394.
34. Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 2014; 370(13): 1189-1197.
35. Rodig SJ, Mino-Kenudson M, Dacic S, et al. Unique clinicopathologic features characterize ALK-rearranged lung adenocarcinoma in the western population. Clin Cancer Res 2009; 15(16): 5216-5223.
36. Zhao F, Xu M, Lei H, et al. Clinicopathological characteristics of patients with non-small-cell lung cancer who harbor EML4-ALK fusion gene: a meta-analysis. PLoS One 2015; 10(2): e0117333.
37. Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK lung cancers are characterized by rare other mutations, a TTF-1 cell lineage, an acinar histology, and young onset. Mod Pathol 2009; 22(4): 508-515.
38. Popat S, Gonzalez D, Min T, et al. ALK translocation is associated with ALK immunoreactivity and extensive signet-ring morphology in primary lung adenocarcinoma. Lung Cancer 2012; 75(3): 300-305.
39. Yoshida A, Tsuta K, Watanabe S, et al. Frequent ALK rearrangement and TTF-1/p63 co-expression in lung adenocarcinoma with signet-ring cell component. Lung Cancer 2011; 72(3): 309-315.
40. To KF, Tong JH, Yeung KS, et al. Detection of ALK rearrangement by immunohistochemistry in lung adenocarcinoma and the identification of a novel EML4-ALK variant. J Thorac Oncol 2013; 8(7): 883-891.
41. Han XH, Zhang NN, Ma L, et al. Immunohistochemistry reliably detects ALK rearrangements in patients with advanced non-small-cell lung cancer. Virchows Arch 2013; 463(4): 583-591.
42. Mino-Kenudson M, Chirieac LR, Law K, et al. A novel, highly sensitive antibody allows for the routine detection of ALK-rearranged lung adenocarcinomas by standard immunohistochemistry. Clin Cancer Res 2010; 16(5): 1561-1571.
43. Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417(6892): 949-954.
44. Kimura ET, Nikiforova MN, Zhu Z, Knauf JA, Nikiforov YE, Fagin JA. High prevalence of BRAF mutations in thyroid cancer: genetic evidence for constitutive activation of the RET/PTC-RAS-BRAF signaling pathway in papillary thyroid carcinoma. Cancer Res 2003; 63(7): 1454-1457.
45. Paik PK, Arcila ME, Fara M, et al. Clinical characteristics of patients with lung adenocarcinomas harboring BRAF mutations. J Clin Oncol 2011; 29(15): 2046-2051.
46. Chetty R, Govender D. Gene of the month: KRAS. J Clin Pathol 2013; 66(7): 548-550.
47. Sun JM, Hwang DW, Ahn JS, Ahn MJ, Park K. Prognostic and predictive value of KRAS mutations in advanced non-small cell lung cancer. PLoS One 2013; 8(5): e64816.
48. Riely GJ, Marks J, Pao W. KRAS mutations in non-small cell lung cancer. Proc Am Thorac Soc 2009; 6(2): 201-205.
49. Campos-Parra AD, Zuloaga C, Manriquez ME, et al. KRAS mutation as the biomarker of response to chemotherapy and EGFR-TKIs in patients with advanced non-small cell lung cancer: clues for its potential use in second-line therapy decision making. Am J Clin Oncol 2015; 38(1): 33-40.
50. Naidoo J, Drilon A. KRAS-Mutant Lung Cancers in the Era of Targeted Therapy. Adv Exp Med Biol 2016; 893 : 155-178.
51. Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013; 8(7): 823-859.
52. Bean J, Brennan C, Shih JY, et al. MET amplification occurs with or without T790M mutations in EGFR mutant lung tumors with acquired resistance to gefitinib or erlotinib. Proc Natl Acad Sci USA 2007; 104(52): 20932-20937.
53. Kohno T, Ichikawa H, Totoki Y, et al. KIF5B-RET fusions in lung adenocarcinoma. Nat Med 2012; 18(3): 375-377.
54. Pan ZW, Li JC. Advances in molecular genetics of Hirschsprung’s disease. Anat Rec (Hoboken) 2012; 295(10): 1628-1638.
55. Kim HS, Mitsudomi T, Soo RA, Cho BC. Personalized therapy on the horizon for squamous cell carcinoma of the lung. Lung Cancer 2013; 80(3): 249-255.
56. Linsley PS, Brady W, Urnes M, Grosmaire LS, Damle NK, Ledbetter JA. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991; 174(3): 561-569.
57. Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363(8): 711-723.
58. Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med 2015; 372(21): 2018-2028.
59. Lee CK, Man J, Lord S, et al. Checkpoint Inhibitors in Metastatic EGFR-Mutated Non-Small Cell Lung Cancer-A Meta-Analysis. J Thorac Oncol 2017; 12(2): 403-407.
60. Shien K, Papadimitrakopoulou VA, Wistuba, II. Predictive biomarkers of response to PD-1/PD-L1 immune checkpoint inhibitors in non-small cell lung cancer. Lung Cancer 2016; 99 : 79-87.
61. Taube JM, Klein A, Brahmer JR, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res 2014; 20(19): 5064-5074.
62. Bishop JA, Taube JM, Su A, et al. Secretory Carcinoma of the Skin Harboring ETV6 Gene Fusions: A Cutaneous Analogue to Secretory Carcinomas of the Breast and Salivary Glands. Am J Surg Pathol 2017; 41(1): 62-66.
63. Scheel AH, Dietel M, Heukamp LC, et al. Harmonized PD-L1 immunohistochemistry for pulmonary squamous-cell and adenocarcinomas. Mod Pathol 2016; 29(10): 1165-1172.
64. Kerr KM, Tsao MS, Nicholson AG, et al. Programmed Death-Ligand 1 Immunohistochemistry in Lung Cancer: In what state is this art? J Thorac Oncol 2015; 10(7): 985-989.
65. Kerr KM, Hirsch FR. Programmed Death Ligand-1 Immunohistochemistry: Friend or Foe? Arch Pathol Lab Med 2016; 140(4): 326-331.
66. Rehman JA, Han G, Carvajal-Hausdorf DE, et al. Quantitative and pathologist-read comparison of the heterogeneity of programmed death-ligand 1 (PD-L1) expression in non-small cell lung cancer. Mod Pathol 2017; 30(3): 340-349.
67. Lim SH, Hong M, Ahn S, et al. Changes in tumour expression of programmed death-ligand 1 after neoadjuvant concurrent chemoradiotherapy in patients with squamous oesophageal cancer. Eur J Cancer 2016; 52 : 1-9.
68. Kim S, Koh J, Kwon D, et al. Comparative analysis of PD-L1 expression between primary and metastatic pulmonary adenocarcinomas. Eur J Cancer 2017; 75 : 141-149.
69. CAP/IASLC/AMP Molecular Testing Guideline: Open Comment Period [Available from: https://www.iaslc.org/articles/capiaslcamp-molecular-testing-guideline-open-comment-period.
70. Rachiglio AM, Esposito Abate R, Sacco A, et al. Limits and potential of targeted sequencing analysis of liquid biopsy in patients with lung and colon carcinoma. Oncotarget 2016; 7(41): 66595-66605.
71. Reck M, Hagiwara K, Han B, et al. ctDNA Determination of EGFR Mutation Status in European and Japanese Patients with Advanced NSCLC: The ASSESS Study. J Thorac Oncol 2016; 11(10): 1682-1689.
72. Oxnard GR, Thress KS, Alden RS, et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2016; 34(28): 3375-3382.
73. Jiang L, Yang H, He P, et al. Improving Selection Criteria for ALK Inhibitor Therapy in Non-Small Cell Lung Cancer: A Pooled-Data Analysis on Diagnostic Operating Characteristics of Immunohistochemistry. Am J Surg Pathol 2016; 40(5): 697-703.
74. Zhou J, Zhao J, Sun K, et al. Accurate and economical detection of ALK positive lung adenocarcinoma with semiquantitative immunohistochemical screening. PLoS One 2014; 9(3): e92828.
75. Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer. Nat Med 2012; 18(3): 378-381.
76. Matsuura S, Shinmura K, Kamo T, et al. CD74-ROS1 fusion transcripts in resected non-small cell lung carcinoma. Oncol Rep 2013; 30(4): 1675-1680.
77. Hirsch FR, McElhinny A, Stanforth D, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol 2017; 12(2): 208-222.
78. Sholl LM, Aisner DL, Allen TC, et al. Programmed Death Ligand-1 Immunohistochemistry--A New Challenge for Pathologists: A Perspective From Members of the Pulmonary Pathology Society. Arch Pathol Lab Med 2016; 140(4): 341-344.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2017 Issue 4-
All articles in this issue
- Molecular pathology of lung cancer in routine diagnostic practice: 2017 update
- Molecular mechanisms of primary and secondary resistance, molecular-genetic features and characteristics of KIT/PDGFRA non-mutated GISTs
-
Hamartoma of mature cardiac myocytes.
Autopsy case report - What´s new in Ewing-like sarcoma family? Soft tissue and bone sarcomas with CIC/BCOR rearrangement. Review of the literature and first personal experience
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- What´s new in Ewing-like sarcoma family? Soft tissue and bone sarcomas with CIC/BCOR rearrangement. Review of the literature and first personal experience
- Molecular pathology of lung cancer in routine diagnostic practice: 2017 update
- Molecular mechanisms of primary and secondary resistance, molecular-genetic features and characteristics of KIT/PDGFRA non-mutated GISTs
-
Hamartoma of mature cardiac myocytes.
Autopsy case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

