-
Medical journals
- Career
HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax
Authors: Marián Švajdler 1,2; Jan Laco 3; Ondrej Ondič 1,2; Jana Kašpírková 1,2; Roman Mezencev 4; Michal Michal 1,2; Alena Skálová 1,2
Authors‘ workplace: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 2; Fingerlandův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta a Univerzitní nemocnice Hradec Králové, Česká republika 3; Integrated Cancer Research Center, School of Biology and Parker H. Petit Institute of Bioengineering and Biosciences, Georgia Institute of Technology, Atlanta, GA, USA 4
Published in: Čes.-slov. Patol., 52, 2016, No. 3, p. 130-138
Category: Reviews Article
Overview
HPV-asociovaný skvamocelulárny karcinóm (SCC) orofaryngu predstavuje špecifickú klinicko-patologickú podskupinu nádorov hlavy a krku so signifikantne lepšou prognózou v porovnaní s HPV-negatívnymi SCC. Morfologicky sa väčšinou jedná o nekeratinizujúci SCC, signifikantá časť HPV-asociovaných SCC orofaryngu však má variantnú morfológiu. Dôkaz prítomnosti transkripčne aktívnej infekcie HPV v orofaryngeálnych SCC poskytuje nenahraditeľnú prognostickú informáciu, ktorá dokonca nahrádza formálny histopatologický grading. V prehľadovom článku prinášame sumár aktuálnych vedomostí o HPV-asociovanom SCC orofaryngu ako aj HPV-asociovaných SCC ostatných non-orofaryngeálnych oblastí. Diskutovaná je úloha HPV testovania v diagnostike metastáz SCC z neznámeho origa v oblasti hlavy a krku.
Kľúčové slová:
skvamocelulárny karcinóm – HPV – hlava a krk – orofaryngeálny karcinóm – nazofaryngeálny karcinóm – sinonazálny karcinóm
Ľudský papillomavírus (human papillomavirus, HPV) patrí medzi najdôležitejšie onkogénne vírusy u človeka. V súčasnosti je pomerne presne klasifikovaných približne 170 HPV typov, a je predpoklad, že počet nových typov, podtypov a variánt ďalej porastie vďaka využitiu nových techník molekulovej biológie (1,2). Perzistentná infekcia mukozálnnymi high-risk HPV typmi (HR-HPV) je príčinou vzniku väčšiny skvamocelulárnych karcinómov (SCC) a adenokarcinómov krčka maternice a veľkej časti karcinómov vulvy, pošvy, penisu a análnych karcinómov (3-5). Existujú čoraz presvedčivejšie dôkazy, že HPV sa spolu s UV žiarením podieľa aj na vzniku kožných malignít, aj keď úloha HPV (predovšetkým kožných β-HPV typov) pri vzniku pre-malígnych a malígnych lézií kože nie je úplne presne pochopená a je stále predmetom diskusií (6,7).
Na možnú úlohu HPV v etiopatogenéze karcinómov oblasti hlavy a krku po prvý krát poukázal Syrjänen a spol. v roku 1983 (8). Následne mnohé štúdie dokázali asociáciu medzi HPV a SCC hlavy a krku, najmä u orofaryngeálnych SCC (OP-SCC) (9-13). HPV-asociovaný OP-SCC (HPV+ OP-SCC) je v súčasnosti považovaný za samostatnú klinickú jednotku. Tieto karcinómy sú charakterizované nižším vekom výskytu (< 60 rokov), asociáciou so sexuálnym správaním, často negatívnou fajčiarskou anamnézou a, čo je najdôležitejšie, signifikantne lepšou prognózou v porovnaní s HPV-negatívnymi OP-SCC a to napriek častým metastázam v lymfatických uzlinách a vyššiemu N štádiu (14-17). Okrem OP-SCC možno HPV detekovať aj v časti non-orofaryngeálnych SCC. Udávaný výskyt je však značne variabilný a je závislý od anatomickej lokalizácie, etnicity študovanej populácie a predovšetkým od metodiky použitej na detekciu HPV (18). Prognostický význam prítomnosti HPV v non-orofaryngeálnych SCC je však prinajmenšom sporný. V nasledujúcom prehľade prinášame aktuálne poznatky o HPV asociovaných SCC hlavy a krku s praktickými odporúčaniami pre prax.
HPV-ASOCIOVANÝ SKVAMOCELULÁRNY KARCINÓM OROFARYNGU
Orofarynx je časť hltana, ktorá je ohraničená rovinou hornej plochy mäkkého podnebia a hornou plochou os hyoideum, respektíve spodinou vallecula epiglottica. SCC orofaryngu zahŕňa nádory, ktoré sú lokalizované na (i) na zadnej tretine (koreni) jazyka a na vallecula epiglottica; (ii) podnebných mandliach, fossa tonsillaris a sliznici podnebných oblúkov; (iii) spodnej strane mäkkého podnebia, vrátane uvuly a (iv) na zadnej stene orofaryngu (19).
Prevalencia HPV+ OP-SCC je relatívne vysoká predovšetkým na koreni jazyka (jazyková mandľa) a podnebných mandliach, v porovnaní s ostatnými časťami orofaryngu (12,13). Podľa prác zo Spojených štátov je s HPV asociovaných až ~ 70 - 80 % OP-SCC (10,20,21). Prevalencia HPV+ OP-SCC v Európe je vo všeobecnosti nižšia (v rozmedzí 3 % - 79 %) (22,23), pričom výrazne závisí od študovanej populácie, časového obdobia štúdie a úspešnosti implementácie programov na zníženie fajčenia v konkrétnej krajine (všeobecne vyšší podiel HPV+ OP-SCC v krajinách s klesajúcim počtom fajčiarov). Aj v populáciách, kde je stále výrazný podiel fajčiarov je však zaznamenaný signifikantný nárast HPV+ OP-SCC (11,24). Metaanalýzou štúdií týkajúcich sa európskych krajín (roky 2002-2012) bola zistená celková prevalencia HPV v karcinómoch hlavy a krku na úrovni 40%, pričom najvyššia prevalencia bola zistená v karcinómoch tonzily a bázy jazyka (66,4% a 47,2%) (13).
V českej a slovenskej populácii sú za hlavné rizikové faktory OP-SCC tradične považované fajčenie a konzumácia alkoholu. Dáta o prevalencii HPV v OP-SCC v českej populácii sú limitované malým počtom vyšetrených pacientov, naznačujú však možnosť signifikanej úlohy HPV v patogenéze OP-SCC. Klozar a spol. dokázali prítomnosť HPV v 50 zo 71 (70%) OP-SCC, pričom najvyšší výskyt HPV bol dokázaný v karcinómoch tonzily (41/51 prípadov; 80%) a bázy jazyka (5/10 prípadov; 50%) (25). V ďalšej českej štúdii Laco a spol. dokázali prítomnosť HPV pomocou DNA in situ hybridizácie v 21 z 22 OP-SCC (26). Podľa našich vedomostí, podobná štúdia týkajúca sa slovenských pacientov nebola doteraz publikovaná.
Morfológia typického HPV-asociovaného orofaryngeálneho skvamocelulárneho karcinómu
V drvivej väčšine prípadov HPV+ OP-SCC morfologicky rekapituluje morfológiu epitelu tonzilárnych krýpt, teda miesta, kde tieto karcinómy najčastejšie vznikajú. HPV+ OP-SCC má typický „bazaloidný“ vzhľad nekeratinizujúceho SCC (NKSCC), charakterizovaný bunkami oválneho až vretenitého tvaru s vysokým nukleocytoplazmatickým pomerom, syncyciálnym spôsobom rastu, bez identifikovateľných intercelulárnych mostíkov (obr. 1). Častá je centrálna nekróza, niekedy až cystická degenerácia. Cytoplazmatická alebo extracelulárna keratinizácia chýba alebo ju možno zastihnúť iba v malom rozsahu (<10% buniek). V prípade, že je keratinizácia extenzívnejšia (>10% plochy tumoru), možno takýto tumor klasifikovať ako nekeratinizujúci SCC s maturáciou, alebo ako hybridný SCC (obr. 2) (27). Kolonizácia povrchového epitelu tonzily je sekundárny fenomén, prechod medzi karcinómom a normálnym epitelom je abruptný, bez prechodov alebo jednoznačnej prekurzorovej intraepitelovej in situ lézie. Karcinóm často invaduje v podobe hniezd s „pushing“ okrajmi, s nejasnou hranicou medzi epitelom a strómou, ktorá je často prekrytá lymfocytmi. Dezmoplastická reakcia na inváziu je často minimálna, alebo úplne chýba. Preto je takmer nemožné spoľahlivo posúdiť moment, kedy je už karcinóm invazívny. Tonzilárny epitel navyše nemá kontinuálnu bazálnu membránu, ktorú by malígne bunky museli prerušiť a je dobre známe, že aj veľmi malé a klinicky okultné karcinómy, veľké často iba niekoľko milimetrov, ktoré sa histologicky javia ako „in situ“, môžu mať uzlinové metastázy. Pre vyššie uvedené skutočnosti sa v praxi nedoporučuje tieto lézie diagnostikovať ako in situ lézie, ale vždy ako karcinóm (28,29).
Image 1. Nekeratinizujúci HPV-asociovaný orofaryngeálny karcinóm, tvorený ovoidnými bunkami s vysokým nukleocytoplazmatickým pomerom, syncyciálnym spôsobom rastu, bez intercelulárnych mostíkov. Imunohistochemicky typická difúzna silná pozitivita expresie proteínu p16 (vložený obrázok). 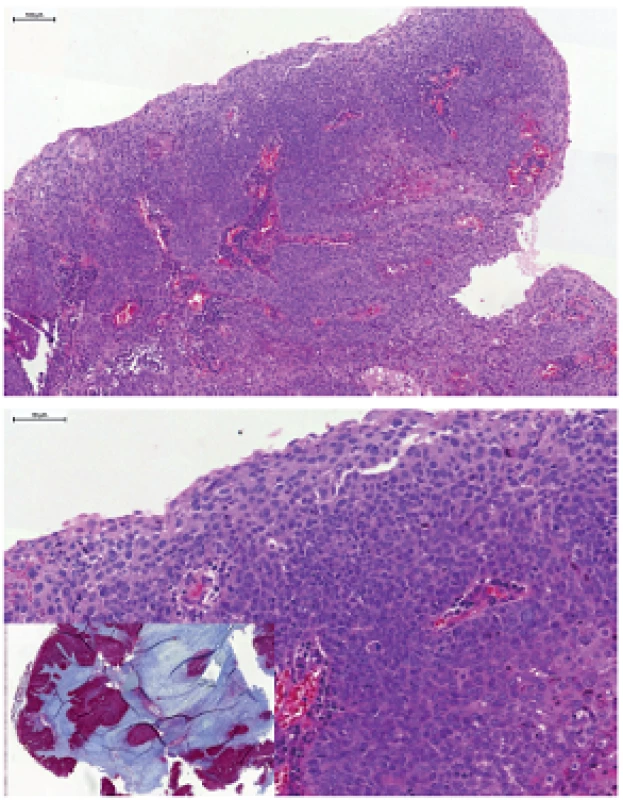
Image 2. Nekeratinizujúci karcinóm s maturáciou (hybridný SCC), tvorený prevažne „bazaloidnými“ bunkami oválneho až vretenitého tvaru, s hniezdami keratinizujúcich buniek s hojnou eozinofilnou cytoplazmou a tvorbou intercelulárnych mostíkov. 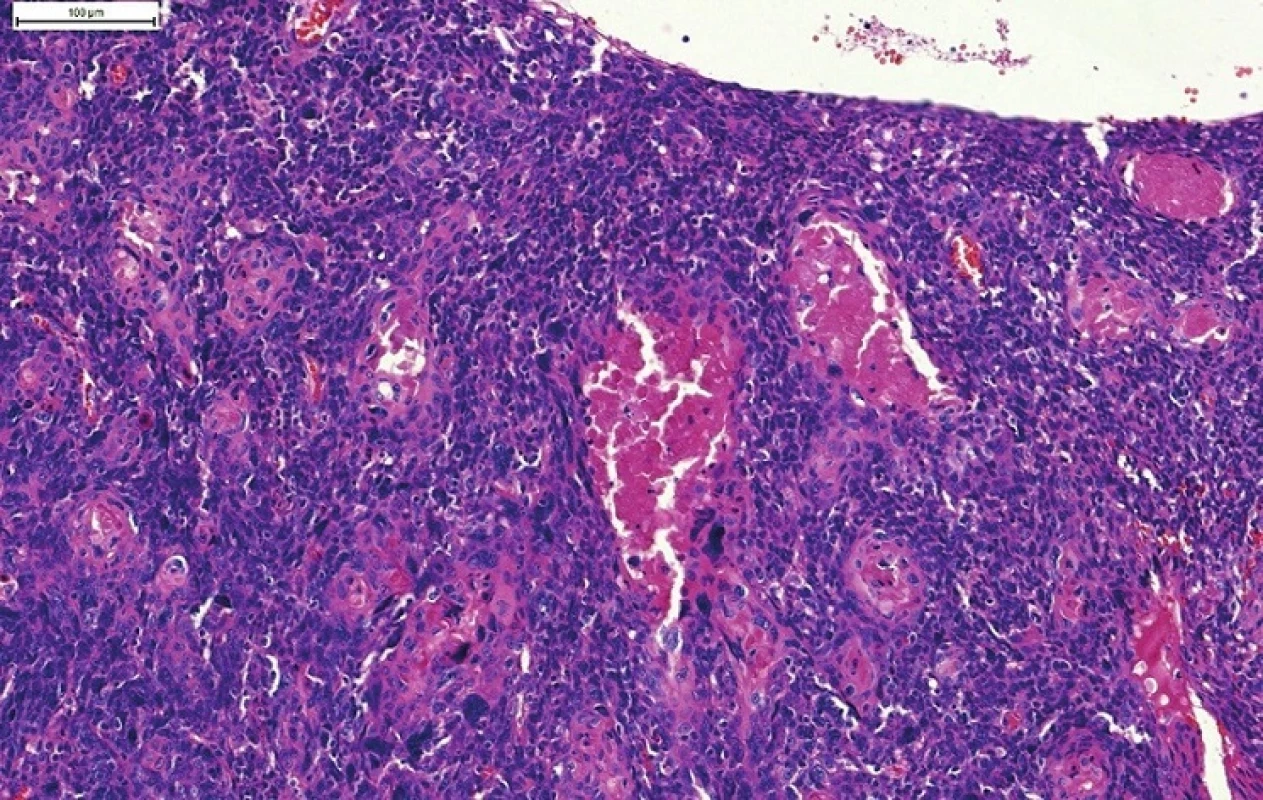
Grading a staging HPV-asociovaného orofaryngeálneho skvamocelulárneho karcinómu
Grade nádoru je semikvantitatívne vyjadrenie stupňa diferenciácie, t.j. ako sa tumor podobá na normálne tkanivo, z ktorého vzniká. Podľa klasických kritérií používaných na grading keratinizujúcich SCC (podľa Brodersa), je väčšina HPV+ OP-SCC klasifikovaná ako nízko diferencovaný/nediferencovaný SCC, keďže sa vôbec nepodobajú na povrchový skvamózny epitel. Pretože však väčšina HPV-asociovaných OP-SCC vzniká v morfologicky odlišnom epiteli tonzilárnych krýpt, ktorého morfológiu HPV+ OP-SCC väčšinou rekapituluje, nekeratinizujúci HPV+ OP-SCC môže byť považovaný za dobre diferencovaný tumor (28). Informácia o „nízkom stupni diferenciácie“ podľa tradičného gradingu je navyše v rozpore s klinickým správaním väčšiny týchto nádorov. Preto viacerí autori doporučujú nevykonávať formálny grading nekeratinizujúceho HPV+ OP-SCC, ale ani ďalších podtypov HPV+ OP-SCC, keďže prítomnosť HPV až na malé výnimky signifikantne zlepšuje prognózu aj inak klinicky agresívnych podtypov SCC (viď nižšie) (28,29). Keďže je HPV+ OP-SCC asociovaný s dobrou prognózou, v súčasnosti prebieha množstvo štúdií, ktoré týmto pacientom ponúkajú deintezifikovanú terapiu s cieľom znížiť výskyt postterapeutických komplikácií, ktoré sú asociované s tradičnou kombinovanou chemoradioterapiou. Na druhej strane je dôležité identifikovať pacientov s vysokým rizikom, u ktorých by deintenzifikovaná liečba bola nedostatočná. Je napríklad známe, že fajčenie znižuje prognostický význam HPV pozitivity OP-SCC (30,31), spoľahlivé biomarkery agresivity HPV+ OP-SCC však v súčasnosti nie sú známe. Podľa zatiaľ jedinej štúdie prítomnosť anaplázie (≥ 3 jadrá nádorových buniek s priemerom ≥ 5 jadier lymfocytov, t.j. ~ 25 µm, v ktoromkoľvek zornom poli x40) alebo mnohojadrových nádorových buniek (≥ 3 nádorové bunky s viacerými jadrami v ktoromkoľvek zornom poli x40) bola asociovaná s horším prežívaním, nezávisle od ostatných faktorov, vrátane prítomnosti HPV (32). Podobne zatiaľ iba v experimentálnej rovine zostáva pokus o identifikáciu klinicky agresívnej podskupiny HPV+ OP-SCC pomocou kvantitatívnej morfometrie digitálnych obrazov (33). Alternatívou pre stratifikáciu rizika a výber vhodnej terapie by mohla v budúcnosti byť molekulárna subklasifikácia OP-SCC (34).
Aktuálne platný TNM systém pre orofaryngeálny karcinóm bol odvodený z výsledkov liečby OP-SCC asociovaného s fajčením a bez asociácie s HPV. Existujú čoraz presvedčivejšie dôkazy, že tento stagingový systém je nevhodný na spoľahlivé predpovedanie prognózy HPV+ OP-SCC (35). Nedávno bol navrhnutý nový/aktualizovaný TNM systém, špecifický pre HPV+ OP-SCC, ktorý okrem anatomických faktorov zohľadňuje aj neanatomické faktory (vek a fajčenie) a omnoho spoľahlivejšie predpovedá prognózu (35). Je pravedpodobné, že HPV-asociovaný a HPV-negatívny orofaryngeálny karcinóm budú mať v budúcnosti samostatný TNM staging systém.
Morfologické varianty HPV-asociovaného orofaryngeálneho skvamocelulárneho karcinómu
Menej často má HPV+ OP-SCC inú morfológiu ako NKSCC/hybridný SCC. Varianty HPV+ OP-SCC zahŕňajú keratinizujúci, papilárny, bazaloidný, adenoskvamózny, lymfoepiteliálny, vretenobunkový (sarkomatoidný) a malobunkový karcinóm (36).
Keratinizujúci skvamocelulárny karcinóm (KSCC) je kompletne tvorený vyzrievajúcimi skvamóznymi bunkami bez prítomnosti nekeratinizujúcich oblastí (obr. 3). Aj keď drvivá väčšina KSCC orofaryngu nie je asociovaná s HPV, v malej časti prípadov možno dokázať prítomnosť transkripčne aktívnej HPV infekcie (37). V doposiaľ najväčšej štúdii KSCC orofaryngu, sedem z 54 prípadov difúzne exprimovalo proteín p16. HPV E6/E7 RNA bola dokázaná v piatich zo šiestich vyšetrených p16-pozitívnych prípadov, ale iba v jedinom p16-negatívnom prípade. Aj keď išlo iba o malý súbor pacientov, expresia p16 v KSCC bola asociovaná so signifikantne lepšou prognózou (37).
Image 3. Keratinizujúci HPV-asociovaný karcinóm, kompletne tvorený vyzrievajúcimi skvamóznymi bunkami bez prítomnosti nekeratinizujúcich oblastí (A). Na rozdiel od nekeratinizujúceho SCC, v keratinizujúcich karcinómoch je častá dezmoplastická reakcia strómy (B). Imunohistochemicky typická difúzna silná pozitivita expresie proteínu p16 (vložený obrázok). 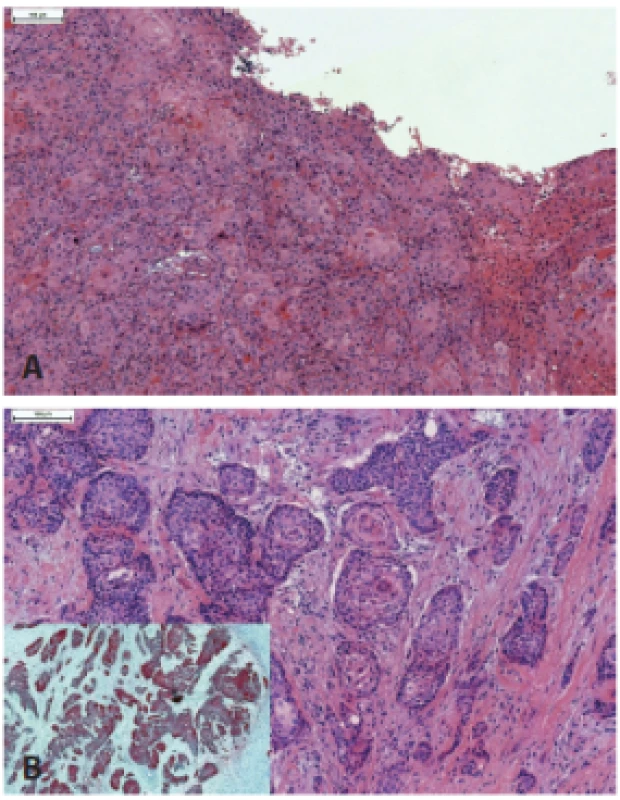
Papilárny skvamocelulárny karcinóm (PSCC) je charakterizovaný exofytickým papilárnym spôsobom rastu a excelentnou prognózou, najmä ak nie je prítomná invazívna komponenta SCC (obr. 4). Väčšina HPV+ PSCC je lokalizovaná v orofaryngu, laryngu alebo sinonazálnom trakte, raritne v ústnej dutine alebo hypofaryngu (38-40). Nádorové bunky majú v typickom prípade imatúrny „bazaloidný“ vzhľad NKSCC, vzácne vykazujú rôzny stupeň keratinizácie (38-40). Vo všeobecnosti je PSCC oblasti hlavy a krku asociovaný s dobrou prognózou a nie je isté, či prítomnosť HPV signifikantne mení prognózu, aj keď jedna štúdia dokázala trend k lepšiemu prežívaniu v HPV+ prípadoch (40).
Image 4. Papilárny SCC s exofytickým papilárnym spôsobom rastu (A), typicky tvorený nekeratinizujúcimi bunkami (B). 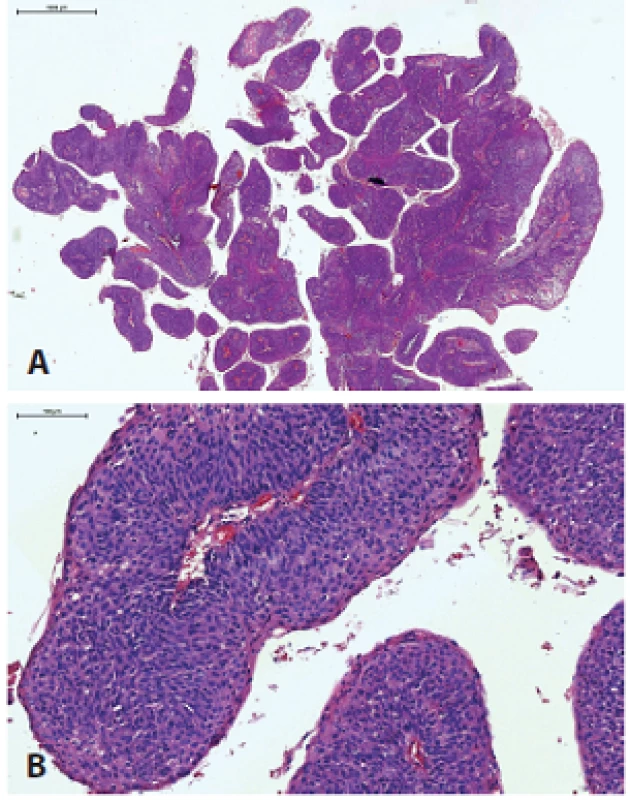
NKSCC je často zamieňaný za bazaloidný skvamocelulárny karcinóm (BSCC). Aj keď sa BSCC čiastočne podobá na NKSCC, predstavuje samostatnú klinicky agresívnu high grade variantu SCC oblasti hlavy a krku. Najčastejšie sa BSCC vyskytuje v laryngu a hypofaryngu, v orofaryngu je vzácny. BSCC je charakterizovaný solídnym alebo lobulárnym („jigsaw puzzle“) spôsobom rastu, niekedy s periférnym palisádovaním buniek, abruptnými fókusmi keratinizácie alebo prítomnosťou ťažkej dysplázie povrchového epitelu, častým výskytom komedo-nekróz, malých cystických priestorov s materiálom pozitívnym vo farbení PAS alebo Alciánovou modrou a prítomnosťou stromálnej hyalinizácie alebo myxoidného bazofilného materiálu, pripomínajúceho mucín. Nádorové bunky nie sú na rozdiel od NKSCC pretiahnutého až vretenitého tvaru ale sú prevažne okrúhle, s hyperchrómnymi jadrami (obr. 5) (28,29). Väčšina (~ 75%) orofaryngeálnych BSCC je HPV-pozítívnych a v porovnaní s HPV negatívnymi BSCC orofaryngu ako aj BSCC iných oblastí, ktoré sú iba vzácne HPV-pozitívne, majú signifikantne lepšiu prognózu (41,42).
Image 5. Bazaloidný SCC, charakterizovaný lobulárnym („jigsaw puzzle“) spôsobom rastu, ložiskovo s periférnym palisádovaním, stromálnou hyalinizáciou a myxoidným bazofilným materiálom pripomínajúcim mucín. Nádorové bunky sú na rozdiel od nekeratinizujúceho SCC prevažne okrúhle, s hyperchrómnymi jadrami. 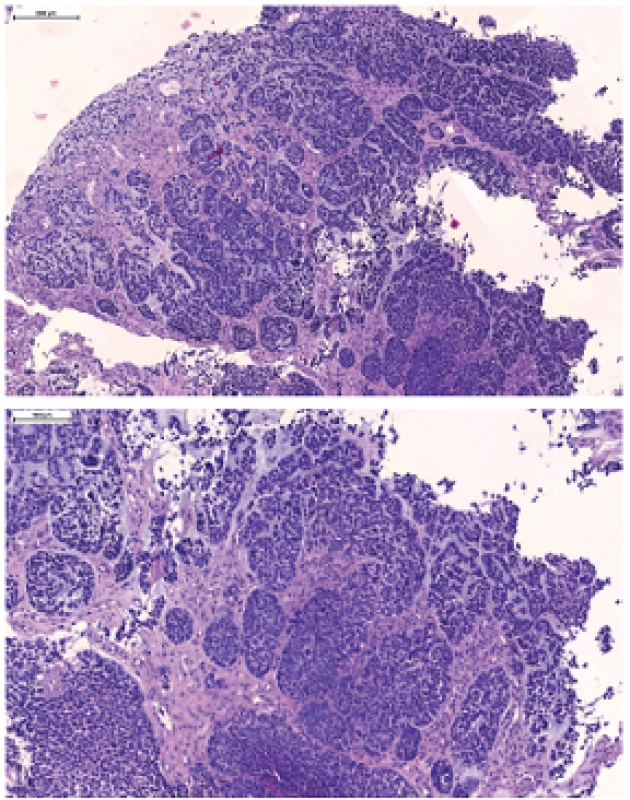
Adenoskvamózny karcinóm (AdSC) je vzácny a vo všeobecnosti agresívny podtyp SCC, charakterizovaný bifázickou proliferáciou keratinizujúceho SCC a adenokarcinómu, pričom jednotlivé zložky sú morfologicky oddelené, nie premiešané, bez prítomnosti intermediárnych buniek (na rozdiel od mukoepidermoidného karcinómu). Je častejší v laryngu a ústnej dutine ako v orofaryngu (43,44). Komponenta SCC je v podobe in situ karcinómu alebo invazívneho SCC, zložka adenokarcinómu býva prítomná v hlbších častiach tumoru a je charakterizovaná tubulárnou/duktálnou diferenciáciou, typicky s intra - alebo extracelulárnou produkciou mucínu (43). V jednej z najväčších publikovaných sérií, Masad a spol. vyšetrili prítomnosť HPV v 18 prípadoch AdSC oblasti hlavy a krku (16 AdSC laryngu a hypofaryngu, 4 ústnej dutiny, 3 orofaryngu a 3 sinonazálne AdSC) (43). Prítomnosť replikačne aktívnej HPV infekcie dokázali v dvoch orofaryngeálnych a jednom AdSC z nosovej dutiny. Obaja pacienti s orofaryngeálnym HPV+ AdSC boli nažive a bez známok ochorenia 103 a 24 mesiacov od stanovenia diagnózy. Tieto dáta sú značne limitované nízkym počtom pacientov, naznačujú však lepšiu prognózu orofaryngeálnych HPV+ AdSC.
Radkay-Gonzales a spol. nedávno popísali zvláštny podtyp HPV-asociovaného adenoskvamózneho karcinómu s riasinkovými bunkami (45). Išlo o sedem prípadov morfologicky unikátneho tumoru (4 orofaryngeálne, 3 s neznámym origom v oblasti hlavy a krku), ktoré sa líšili od klasického AdSC prítomnosťou zložky blandne vyzerajúceho prevažne nekeratinizujúceho SCC s mikrocystickým/kribriformným usporiadaním, premiešaného s bunkami produkujúcimi mucín (pripomínajúc tak mukoepidermoidný karcinóm) (obr. 6A), alebo s prítomnosťou tubuloglandulárnych formácií s luminálnymi kolumnárnymi bunkami bez mucínprodukcie a abluminálnymi nekeratinizujúcimi skvamóznami elementami. Vo všetkých prípadoch boli minoritne v glandulárnej komponente prítomné bunky s riasinkami (obr. 6B) (45). Všetky prípady mali multilokulárne alebo makrocystické metastázy v lymfatických uzlinách. Na základe malého počtu pacientov nemožno zo štúdie vyvodiť definitívne závery týkajúce sa prognózy tohoto podtypu AdSC, ale zdá sa, že HPV+ AdSC s riasinkami môže mať relatívne dobrú prognózu, keďže ochoreniu podľahol jediný pacient s metastázami v pľúcach.
Image 6. Adenoskvamózny karcinóm s mikrocystickým usporiadaním, tvorený nekeratinizujúcim SCC premiešaným s bunkami produkujúcimi mucín (pripomína mukoepidermoidný karcinóm) (A, hematoxylín-eozín, zväčšenie x10). Kolumnárne bunky s riasinkami (B, hematoxylín-eozín, zväčšenie x40). Obrázky láskavo poskytol Raja R. Seethala, Presbyterian University Hospital, Pittsburgh, USA. 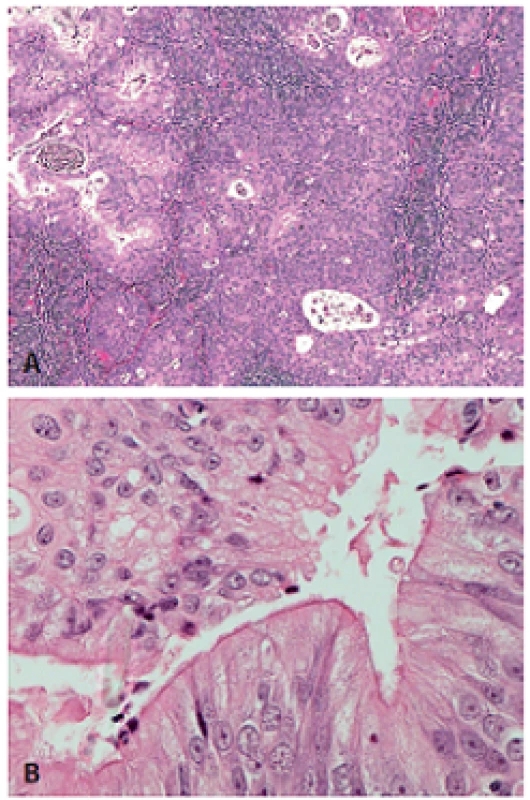
Nediferencovaný (lymfoepiteliálny) karcinóm (LELC) orofaryngu je vzácny tumor, morfologicky podobný nekeratinizujúcemu nediferencovanému nazofaryngeálnemu karcinómomu (NPCa). Je charakterizovaný bunkami s vezikulárnymi jadrami s nápadnými jadierkami a objemnou cytoplazmou s nejasnými kontúrami, syncyciálnym spôsobom rastu v pruhoch, menších solídnych hniezdach alebo po jednotlivých bunkách a zápalovým pozadím tvoreným lymfocytmi a plazmatickými bunkami (36,48). Dôležitú úlohu v patogenéze NPCa hrá Epstein-Barrovej vírus (EBV), najmä v endemických oblastiach a NPCa nekeratinizujúceho typu (47-49). Na rozdiel od NPCa, LELC orofaryngu sú konzistentne EBV-negatívne a ~ 90 % je asociovaných s infekciou HPV (50,51). Napriek „nediferencovanému“ vzhľadu sa zdá, že HPV+ LELC orofaryngu majú dobrú prognózu, porovnateľnú s inými HPV+ OPSCC.
Vretenobunkový (sarkomatoidný) skvamocelulárny karcinóm (SSCC) je vzácna varianta SCC, charakterizovaná bifázickou proliferáciou konvenčného SCC a vretenobunkovej komponenty, ktorá na jednom konci spektra môže pripomínať reaktívnu fibroblastickú proliferáciu alebo, na opačnom konci spektra, môže imitovať naozajstný sarkóm (28,36). V prípade, že je zastúpená iba vretenobunková zložka (až 1/3 prípadov), ktorá navyše pomerne často stráca expresiu keratínov, môže byť odlíšenie SSCC od benígnych a malígnych mezenchymálnych lézií problematické (52). Bishop a spol. zistili prítomnosť HPV16 v troch z desiatich orofaryngeálnych SSCC. Žiaden z 27 non-orofaryngeálnych SSCC nebol HPV-pozitívny (52). Naopak, Watson a spol. nedokázali prítomnosť HPV ani v jednom z piatich orofaryngeálnych SSCC a zistili prítomnosť HPV v jednom z dvanástich SSCC dutiny ústnej a jednom prípade z hypofaryngu/laryngu (53). Na základe malého počtu HPV+ SSCC orofaryngu sa nemožno vyjadriť k prognóze tejto varianty. Vo všeobecnosti má však SSCC oblasti hlavy a krku prognózu podobnú konvenčnému SCC. Keďže je však infekcia HPV viazaná na epitelové bunky, dôkaz prítomnosti HPV (je prítomný v konvenčnej ako aj vretenobunkovej zložke SSCC) môže slúžiť ako diagnostická pomôcka pri odlišovaní SSCC od mezenchymálnych lézií orofaryngu (52,53).
Malobunkový karcinóm orofaryngu je extrémne vzácny tumor, morfologicky identický s malobunkovými karcinómami iných lokalít (t.j. ide o nízko diferencovaný neuroendokrinný karcinóm). Bishop a Westra zistili prítomnosť HPV v piatich z deviatich prípadov, pričom v štyroch prípadoch mal karcinóm prítomnú zložku konvenčného HPV+ nekeratinizujúceho karcinómu (54). Kraft a spol. popísali osem prípadov malobunkového karcinómu orofaryngu, z ktorých bolo sedem HPV-pozitívnych; jeden prípad mal zachytenú zložku konvenčného skvamocelulárneho karcinómu a jeden prípad zložku stredne diferencovaného neuroendokrinného karcinómu (55). Klinicky sa jednalo o agresívne tumory, často so vzdialenými metastázami v čase prezentácie. HPV+ malobunkový karcinóm orofaryngu sa teda prognosticky nelíši od malobunkového karcinómu v typickejších lokalitách. Rozpoznanie malobunkovej zložky je preto dôležité, aj keď z hľadiska morfológie nie vždy jednoduché. Imunohistochemicky malobunková komponenta vždy vykazuje pozitivitu neuroendokrinných markerov (synaptofyzín, chromogranín) a stratu markerov skvamóznej diferenciácie (CK5/6, p63) (28).
HPV V NON-OROFARYNGEÁLNYCH KARCINÓMOCH HLAVY A KRKU
Aj keď sa HPV+ SCC vyskytujú aj v iných podoblastiach hlavy a krku mimo orofaryngu, skutočná incidencia non-orofaryngeálnych HPV-asociovaných SCC je pravdepodobne nadhodnotená (28). Podľa nedávno publikovaného prehľadu literatúry (18) bola publikovaná prevalencia detekcie HPV v karcinómoch ústnej dutiny 20 %, v karcinómoch laryngu 24 %, v karcinómoch sinonazálneho traktu 30 %, v nazofaryngeálnych karcinómoch 31 % a v kontrolách od zdravých jedincov 7 %, pričom jednotlivé publikácie udávali hodnoty v rozmedzí 0 - 100 %. Za nadhodnotenie úlohy HPV v non-orofaryngeálnych SCC je pravdepodobne zodpovedných viacero faktorov. Napríklad, HPV-asociovaný nazofaryngeálny karcinóm v niektorých prípadoch predstavuje iba šírenie HPV+ SCC z orofaryngu (56). Na druhej strane, počet HPV-asociovaných non-orofaryngeálnych SCC nadhodnocuje použitie vysoko citlivých PCR metód, ktoré nie sú schopné odlíšiť biologicky relevantnú HPV infekciu od inaktívnej infekcie alebo kontaminácie vzorky. Pri použití špecifickejších metód, ktoré detekujú iba transkripčne aktívnu infekciu HPV (viď nižšie) a po vylúčení nádorov, ktoré infiltrujú viaceré anatomické oblasti je skutočné zastúpenie HPV+ SCC v oblasti ústnej dutiny, hypofaryngu a laryngu na úrovni 0% až 5,9% (55-58), v oblasti sinonazálneho traktu ~ 20% (56,59-64) a v oblasti nazofaryngu 5-30% (66-69). V retrospektívnej štúdii 62 slovenských a českých pacientov s nazofaryngeálnym karcinómom (NPCa) sme dokázali prítomnosť HPV iba u jedinej pacientky (70). Zdá sa teda, že v našej populácii HPV nehrá signifikantnú úlohu v patogenéze NPCa, aj keď je počet vyšetrených pacientov limitovaný. Naopak, až v 86% prípadov (53/62) sme dokázali prítomnosť EBV. Metaanalýzou štúdií, ktoré súčasne zisťovali prítomnosť HPV ako aj EBV v NPCa u pacientov kaukazkej rasy sme zistili, že zastúpenie HPV+ NPCa je ~ 36 % (ak bol HPV detekovaný pomocou PCR), respektíve ~ 32 % (HPV detekovaný pomocou p16/in situ hybridizácie), kým prevalencia EBV pozitivity je ~42 %. Naša populácia pacientov s NPCa sa teda z hľadiska zastúpenia HPV a EBV viac podobá populáciám v endemických oblastiach (70).
Na záver možno skonštatovať, že na rozdiel od OP-SCC, prítomnosť HPV v non-orofaryngeálnych SCC hlavy a krku je relatívne obmedzená a vo všeobecnosti nie je asociovaná s lepšou prognózou, aj keď sú dáta značne limitované a budú potrebné ďalšie štúdie (18,70,71). Jedinou výnimkou môžu byť HPV+ karcinómy sinonazálneho traktu. Podľa dvoch štúdií (63,64) by mohla byť prítomnosť transkripčne aktívnej infekcie HPV v sinonazálnych karcinómoch asociovaná s lepšou prognózou, aj keď je tento záver značne limitovaný nízkym počtom pacientov, veľkou heterogenitou histologických podtypov a rozličnými metódami použitými na liečbu pacientov. Rutínne testovanie non-orofaryngeálnych SCC hlavy a krku na prítomnosť HPV v súčasnosti nie je doporučované.
DIAGNOSTICKÁ APLIKÁCIA HPV TESTOVANIA – METASTÁZY Z NEZNÁMEHO ORIGA
Veľkú časť malignít oblasti hlavy a krku tvoria metastázy v lymfatických uzlinách z neznámého origa. Predstavujú 3 - 9 % všetkých malignít tejto oblasti (69-71) a vo väčšine prípadov (53 - 90 %) sa histologicky jedná o SCC (72,73,75). Väčšina cervikálnych metastáz je solídnych, SCC Waldayerovho prstenca však často vytvárajú objemné cystické metastázy, ktoré klinicky, radiologicky a dokonca aj histomorfologicky môžu napodobovať branchiogénnu (lymfoepiteliálnu) cystu. Podľa dvoch veľkých štúdií boli cystické metastázy karcinómov z oblasti Waldayerovho prstenca identifikované v 20 % a 61,3 % prípadov (76,77). Z opačného pohľadu, vo väčšine prípadov cystických metastáz SCC je identifikované origo v orofyryngu, najmä v podnebnej mandli a na koreni jazyka (76-82). Je známe, že HPV+ OP-SCC si v metastázach zachováva prítomnosť transkripčne aktívnej infekcie HPV, ako aj overexpresiu proteínu p16 (76,83-85) a mnohé štúdie dokázali, že prítomnosť HPV v p16-pozitívnej solídnej alebo cystickej metastáze s vysokou pravdepodobnosťou predpovedá origo v orofaryngu (85-89).
Tu je nutné zdôrazniť, že nie všetky cystické metastázy v oblasti hlavy a krku majú origo v orofaryngu (77,81). Vzácne môžu cystické metastázy vytvoriť karcinómy nazofaryngu, hypofaryngu, laryngu, ústnej dutiny, prínosových dutín alebo pažeráka (80-82,90). V retrospektívnej štúdii cystických metastáz SCC s neznámym origom z plzeňského registra až 30 % (6/20) pochádzalo z non-orofaryngeálnej oblasti, pričom v troch prípadoch sa jednalo o metastázu EBV-asociovaného nazofaryngeálneho karcinómu. Pridanie testu na prítomnosť EBV (EBV in situ hybridizácia) v p16/HPV-negatívnych prípadoch môže v časti prípadov odhaliť nazofaryngeálne origo a ušetriť pacientov od zbytočných diagnostických procedúr (napr. diagnostická bilaterálna tonzilektómia) (obr. 7) (91).
Image 7. EBV in situ hybridizácia (EBER). Typická pozitivita vo všetkých nádorových bunkách v cystickej metastáze z neznámeho origa. Pridanie testu na prítomnosť EBV v prípade p16/HPV-negatívnej metastázy môže v časti prípadov odhaliť okultné origo v nazofaryngu. 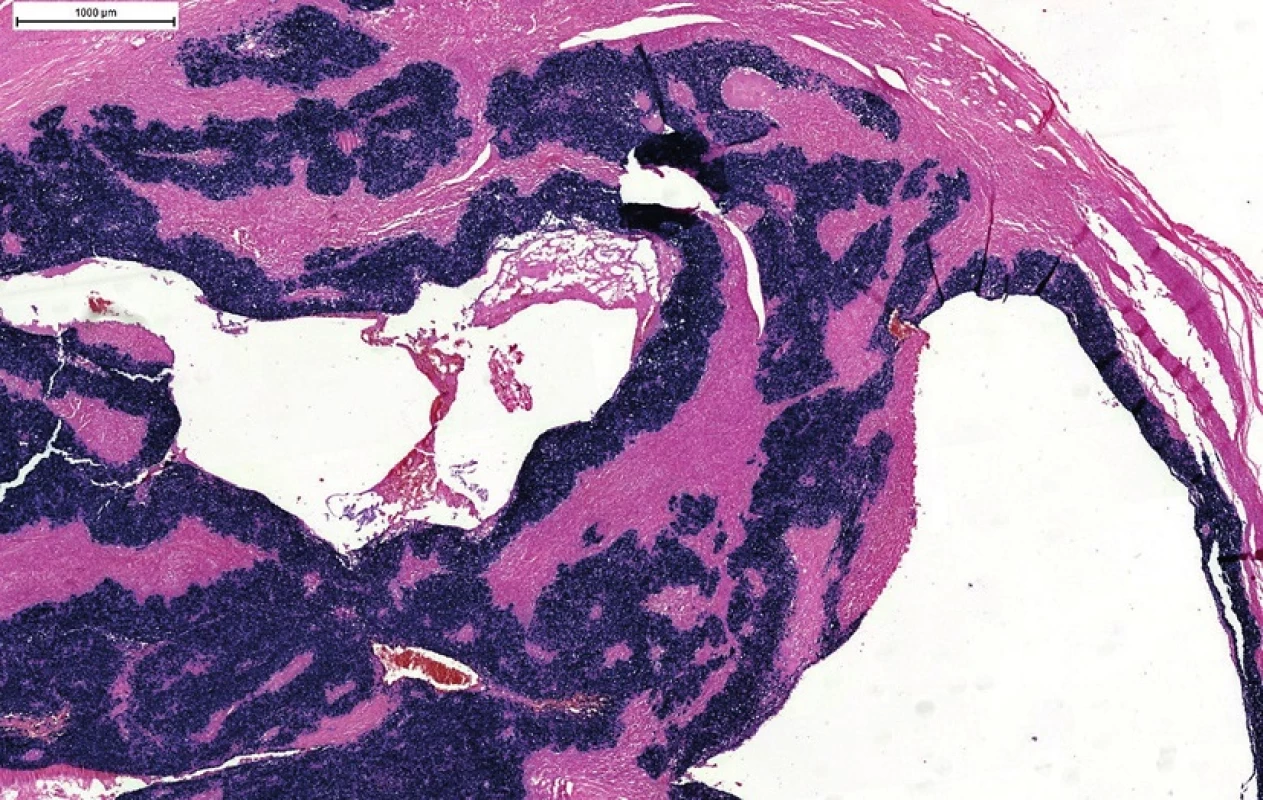
Ako náhradný marker HR-HPV infekcie v cervikálnych ako aj orofaryngeálnych karcinómoch je často používaná imunohistochemická detekcia proteínu p16 (92,93). Aj keď má expresia p16 takmer 100% senzitivitu pre detekciu HR-HPV v OP-SCC, špecificita je iba na úrovni ~ 80% (tj. cca 20% p16-pozitívnych OPSCC je HPV negatívnych) (94). Napriek tomu, že konkordancia medzi expresiou p16 a prítomnosťou HR-HPV nie je dokonalá, imunohistochemické vyšetrenie expresie p16 niektorí autori navrhujú ako samostatný a jediný test na detekciu HR-HPV a klinickú stratifikáciu OP-SCC (21,95). Senzitivita a špecificita samotného imunohistochemického vyšetrenia p16 v prípade metastáz z neznámého origa však nie je známa. Pri diagnostike metastáz z neznámého origa je nutné pamätať na skutočnosť, že overexpresia p16 bola popísaná okrem HPV+ OP-SCC aj v iných benígnych a malígnych léziách, ktoré môžu byť v diferenciálnej diagnóze. Cao a spol. popísali pozitivitu p16 v 43% (16/37) benígnych lymfoepiteliálnych cýst, ako aj v 5/12 cytologických vzoriek z týchto cýst. Žiadna z týchto lézií však nebola HPV-pozitívna (95). V zhode s vyššie uvedenou prácou, sme fokálnu imunohistochemickú pozitivitu p16 dokázali v 9 z 11 (81,8 %) prípadov benígnych lymfoepiteliálnych cýst (2015, nepublikované dáta). Na rozdiel od HPV+ metastáz OP-SCC, ktoré majú difúznu expresiu p16 (> 70 %, viď nižšie), expresia p16 v benígnych cystách nikdy nebola prítomná vo viac ako 50 % buniek. Expresia p16 je ďalej bežná v pľúcnych malobunkových karcinómoch (97), ktoré však nebývajú HPV-pozitívne (98) ako aj orofaryngeálnych malobunkových karcinómoch, ktoré sú ale takmer vždy HPV-pozitívne (viď vyššie) (54,55). Difúzna a silná pozitivita p16 bez asociácie s HPV bola zistená v piatich prípadoch sinonazálneho nediferencovaného karcinómu (99). Signifikantná pozitivita p16 (> 50 % nádorových buniek) bola popísaná v 6/20 ezofageálnych SCC, 7/20 pľúcnych SCC a 8/20 SCC kože, pričom HR-HPV bol detekovaný iba v jedinom ezofageálnom prípade (100). Podobne, časť uroteliálnych karcinómov a uroteliálnych karcinómov so skvamóznou diferenciáciou vykazuje p16-pozitivitu bez asociácie s HR-HPV (101).
Pretože je špecificita p16-pozitivity vo vzťahu k diagnostike HPV-pozitívnych nádorov relatívne nízka, na podporenie klinicky najpravdepodobnejšieho orofaryngeálneho origa p16-pozitívnej metastázy SCC z neznámeho origa je vždy nutné vykonať špecifický dôkaz prítomnosti HPV. Ako bolo diskutované vyššie, HPV-pozitívne SCC sa vzácne vyskytujú aj v iných podoblastiach hlavy a krku, najpravdepodobnejšie origo p16/HPV+ metastázy je však v klinicky okultnom karcinóme orofaryngu.
METÓDY DETEKCIE RELEVANTNEJ (TRANSKRIPČNE AKTÍVNEJ) INFEKCIE HPV
HPV status v OP-SCC poskytuje dôležitú prognostickú informáciu a je pravdepodobné, že v blízkej budúcnosti bude rozhodovať aj o spôsobe liečby, napr. o použití deintezifikovanej chemo/radioterapie. HPV testovanie OP-SCC je v súčasnosti nevyhnutnou podmienkou pre zaradenie pacientov do klinických štúdií. HPV-pozitivita v metastázach z neznámého origa navyše umožňuje zacielenie diagnostických a chirurgických postupov na oblasť orofaryngu a vo vybraných prípadoch umožňuje obmedziť ožarovanie iba na túto oblasť aj v prípade, že sa primárne ložisko nenájde. Ide o vyšetrenie, ktoré je zahrnuté vo viacerých významných klinických a patologických odporúčaniach (napr. College of American pathologists, the Royal college of pathologists, NCCN guidelines). Napriek zjavnému významu a dôležitosti HPV testovania, neexistuje všeobecný konsenzus akú stratégiu a ktoré z viacerých dostupných metód na dôkaz HPV treba použiť (102,103). Výber metodiky by mal vychádzať zo zistení, že klinicky dobrá prognóza HPV+ OP-SCC je limitovaná iba na nádory s transkripčne aktívnou HPV infekciou (102,103). Ideálny test by mal mať vysokú senzitivitu a špecificitu, primeranú cenu a mal by byť dostatočne jednoduchý na rutínne použitie.
V HPV+ karcinómoch vírusové onkoproteíny E6 a E7 HR-HPV typov funkčne inaktivujú proteín p53 a pRb (retinoblastoma protein), čo následne vedie k overexpresii tumor supresorového proteínu p16. Niektorí autori preto navrhujú použiť na detekciu HR-HPV a klinickú stratifikáciu OP-SCC samotné imunohistochemické vyšetrenie expresie proteínu p16, ktoré je najlacnejšou a najdostupnejšou alternatívou (21,95). Najlepšia korelácia expresie p16 a prítomnosti HPV v OP-SCC (neplatí to pre NOP-SCC) je v prípade ak sa za pozitívny výsledok považuje jadrová a cytoplazmatická expresia ≥ 70 % nádorových buniek (94). Samotná imunohistochemická expresia p16 však môže byť považovaná za zástupný „surrogate“ marker aktívnej HPV infekcie iba v prípade, ak má karcinóm charakteristickú morfológiu, t.j. ide o NKSCC alebo hybridný SCC. V prípade, že sa jedná o p16-pozitívny karcinóm s variantnou morfológiou (viď vyššie) alebo v prípade imunohistochemickej negativity v nekeratinizujúcom OP-SCC, je nutné doplniť HPV špecifický test.
Za „zlatý štandard“ dôkazu biologicky aktívnej infekcie je považovaný dôkaz E6/E7 mRNA metódou reverznej transkripcie a polymerázovej reťazovej reakcie (RT-PCR). Toto vyšetrenie je však technicky náročné a problémom môže byť kvalita mRNA v parafínovom materiáli; na dosiahnutie optimálnych výsledkov je nutné čerstvo zmrazené tkanivo (102,103).
PCR dôkaz HPV DNA fylogeneticky konzervatívnych génov L1/E1 (prípadne doplnené o vyšetrenie typovo špecifických génov E6/E7) je metodódou s vysokou senzitivitou, ktorá je všeobecne a relatívne jednoducho použitelná aj na parafínovom materiáli (101). Samotná detekcia HVP DNA je však pomerne nešpecifická, keďže neodlíši aktívnu infekciu od inaktívnej infekcie (tzv. „passenger“ HPV), prípadne kontamináciu vzorky. V kombinácii s imunohistochemickým vyšetrením expresie p16 je však HPV DNA najpoužívanejším spôsobom detekcie aktívnej HPV infekcie; iba p16 IHC+/HPV PCR+ tumory môžu byť považované za HPV-asociované (102).
Vysoko špecifický dôkaz relevantnej HPV infekcie, navyše s priamou vizualizáciou v nádorovom tkanive poskytuje DNA in situ hybridizácia (ISH). Problémom DNA ISH je však relatívne nízka senzitivita, ktorá je na úrovni iba ~ 70% (102,103) Relatívne časté sú aj problémy s interpretáciou pre prítomnosť artefaktov; z vlastnej skúsenosti vieme, že na dosiahnutie optimálych výsledkov je nutná dokonalá fixácia a spracovanie tkaniva.
Nádejnou alternatívou k DNA ISH je vyšetrenie pomocou metódy RNA ISH (obr. 8) (57,58,65). Senzitivita a špecificita vyšetrenia sa blížia „zlatému štandardu“. Nevýhodami sú zatiaľ malé skúsenosti s metodikou, relatívna technická náročnosť a vyššia cena.
Image 8. Pozitívny výsledok RNA in situ hybridizácie v nekeratinizujúcom SCC tonzily (HPV RNAscope ISH, zväčšenie x40). 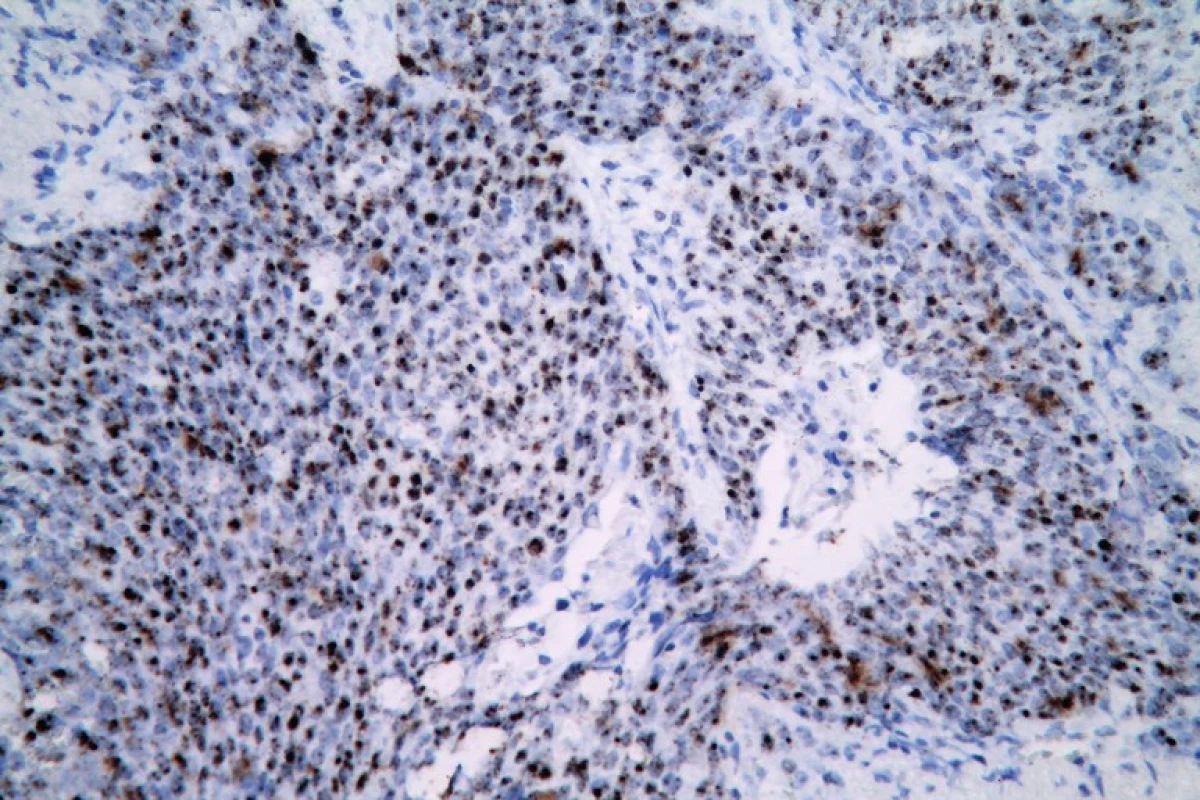
ZÁVER
HPV-asociovaný orofaryngeálny skvamocelulárny karcinóm je v súčasnosti považovaný za samostatnú klinickú jednotku so signifikantne lepšou prognózou v porovnaní s HPV-negatívnymi karcinómami. V typickom prípade má HPV+ OP-SCC charakteristickú morfológiu nekeratinizujúceho SCC, v malej časti prípadov má však variantnú „high grade“ morfológiu, ktorá však v prípade HPV-pozitivity väčšinou nie je asociovaná s horšou prognózou. Dôkaz biologicky aktívnej HPV infekcie v OP-SCC je preto v súčasnosti nenahraditeľným vyšetrením, ktoré poskytuje dôležitú prognostickú informáciu a je kľúčovým kritériom pre zaradenie pacienta do klinickej štúdie. Dôkaz HPV v p16-pozitívnej metastáze SCC z neznámeho origa v oblasti hlavy a krku môže efektívne nasmerovať diagnostiku a cielenú lečbu na oblasť orofaryngu. Aj keď je s HPV infekciou asociovaná aj časť non-orofaryngeálnych SCC hlavy a krku, rutínne HPV testovanie týchto nádorov nie je vzhľadom na nedostatok dôkazov o prognostickom význame vyšetrenia v súčasnosti odporúčané. Vo všeobecnosti neexistuje konsenzus týkajúci sa optimálnej metodiky na dôkaz transkripčne aktívnej HPV infekcie. Jedným z najpraktickejších a najpoužívanejších spôsobov je skríningové imunohistochemické vyšetrenie expresie proteínu p16 (cut-off ≥ 70% pozitívnych buniek) doplnené vysoko senzitívnym HPV DNA PCR vyšetrením. Novým „zlatým štandardom“ by sa však v blízkej budúcnosti mohla stať metóda HPV RNA ISH.
PREHLASENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Marián Švajdler
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň, Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Sources
1. de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology 2004; 324(1): 17-27.
2. de Villiers EM. Cross-roads in the classification of papillomaviruses. Virology 2013; 445(1-2): 2-10.
3. Katzenellenbogen RA, Galloway DA. Human papillomavirus-associated cancers. In: Khalili K, Jeang KT, eds. Viral oncology: Basic science and clinical applications (1st ed). New Yersey: Wiley-Blackwell; 2009 : 1–23.
4. Muñoz N, Castellsagué X, de González AB, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine 2006; 24 Suppl 3: S3/1–10.
5. Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189(1): 12–19.
6. Quint KD, Genders RE, de Koning MN, et al. Human Beta-papillomavirus infection and keratinocyte carcinomas. J Pathol 2015; 235(2): 342-354.
7. Švajdler M Jr, Mezencev R, Kašpírková J, et al. Human papillomavirus infection and p16 expression in extragenital/extraungual Bowen disease in immunocompromised patients. Am J Dermatopathol. In press 2016.
8. Syrjänen KJ, Pyrhönen S, Syrjänen SM, Lamberg MA. Immunohistochemical demonstration of human papilloma virus (HPV) antigens in oral squamous cell lesions. Br J Oral Surg 1983; 21(2): 147–153.
9. Gillison ML, Koch WM, Capone RB, et al. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 2000; 92(9): 709-720.
10. Chaturvedi AK, Engels EA, Pfeiffer RM, et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29(32): 4294-4301.
11. Tinhofer I, Jöhrens K, Keilholz U, et al. Contribution of human papilloma virus to the incidence of squamous cell carcinoma of the head and neck in a European population with high smoking prevalence. Eur J Cancer 2015; 51(4): 514-521.
12. Garnaes E, Kiss K, Andersen L, et al. A high and increasing HPV prevalence in tonsillar cancers in Eastern Denmark, 2000-2010: the largest registry-based study to date. Int J Cancer 2015; 136(9): 2196-2203.
13. Abogunrin S, Di Tanna GL, Keeping S, Carroll S, Iheanacho I. Prevalence of human papillomavirus in head and neck cancers in European populations: a meta-analysis. BMC Cancer 2014; 14 : 968.
14. Chernock RD, El-Mofty SK, Thorstad WL, Parvin CA, Lewis JS Jr. HPV-related nonkeratinizing squamous cell carcinoma of the oropharynx: utility of microscopic features in predicting patient outcome. Head Neck Pathol 2009; 3(3): 186-194.
15. Chaturvedi AK. Epidemiology and clinical aspects of HPV in head and neck cancers. Head Neck Pathol 2012; 6: Suppl 1: S16–24.
16. Ang KK, Harris J, Wheeler R, et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363(1): 24–35.
17. Fakhry C, Westra WH, Li S, et al. Improved survival of patients with human papillomavirus-positive head and neck squamous cell carcinoma in a prospective clinical trial. J Natl Cancer Inst 2008; 100(4): 261–269.
18. Isayeva T, Li Y, Maswahu D, Brandwein-Gensler M. Human papillomavirus in non-oropharyngeal head and neck cancers: a systematic literature review. Head Neck Pathol 2012; 6: Suppl 1: S104–120.
19. Patel S, Shah JP. Pharynx. In: Edge SB, Byrd DR, Carducci MA, Compton CA, eds. AJCC Cancer Staging Manual (7th ed). New York: Springer; 2009 : 41-56.
20. Singhi AD, Westra WH. Comparison of human papillomavirus in situ hybridization and p16 immunohistochemistry in the detection of human papillomavirus-associated head and neck cancer based on a prospective clinical experience. Cancer 2010; 116(9): 2166-2173.
21. Lewis JS Jr, Thorstad WL, Chernock RD, et al. p16 positive oropharyngeal squamous cell carcinoma:an entity with a favorable prognosis regardless of tumor HPV status. Am J Surg Pathol 2010; 34(8): 1088-1096.
22. Rodrigo JP, Heideman DA, García-Pedrero JM, et al. Time trends in the prevalence of HPV in oropharyngeal squamous cell carcinomas in northern Spain (1990-2009). Int J Cancer 2014; 134(2): 487-492.
23. Näsman A, Attner P, Hammarstedt L, et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer 2009; 125(2): 362-366.
24. Rietbergen MM, Leemans CR, Bloemena E, et al. Increasing prevalence rates of HPV attributable oropharyngeal squamous cell carcinomas in the Netherlands as assessed by a validated test algorithm. Int J Cancer 2013; 132(7): 1565-1571.
25. Klozar J, Kratochvil V, Salakova M, et al. HPV status and regional metastasis in the prognosis of oral and oropharyngeal cancer. Eur Arch Otorhinolaryngol 2008; 265 Suppl 1: S75-82.
26. Laco J, Vosmikova H, Novakova V, et al. The role of high-risk human papillomavirus infection in oral and oropharyngeal squamous cell carcinoma in non-smoking and non-drinking patients: a clinicopathological and molecular study of 46 cases. Virchows Arch 2011; 458(2): 179-187.
27. El-Mofty SK, Patil S. Human papillomavirus (HPV)-related oropharyngeal nonkeratinizing squamous cell carcinoma: characterization of a distinct phenotype. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101(3): 339–345.
28. Westra WH. The pathology of HPV-related head and neck cancer: implications for the diagnostic pathologist. Semin Diagn Pathol 2015; 32(1): 42-53.
29. Lewis JS Jr, Chernock RD. Human papillomavirus and Epstein Barr virus in head and neck carcinomas: suggestions for the new WHO classification. Head Neck Pathol 2014; 8(1): 50-58.
30. Ang KK, Harris J, Wheeler R, et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363(1): 24-35.
31. Gillison ML, Zhang Q, Jordan R, et al. Tobacco smoking and increased risk of death and progression for patients with p16-positive and p16-negative oropharyngeal cancer. J Clin Oncol 2012; 30(17): 2102-2111.
32. Lewis JS Jr, Scantlebury JB, Luo J, Thorstad WL. Tumor cell anaplasia and multinucleation are predictors of disease recurrence in oropharyngeal squamous cell carcinoma, including among just the human papillomavirus-related cancers. Am J Surg Pathol 2012; 36(7): 1036–1046.
33. Lewis JS Jr, Ali S, Luo J, Thorstad WL, Madabhushi A. A quantitative histomorphometric classifier (QuHbIC) identifies aggressive versus indolent p16-positive oropharyngeal squamous cell carcinoma. Am J Surg Pathol 2014; 38(1): 128-137.
34. Nakano T, Yamamoto H, Nakashima T, et al. Molecular subclassification determined by human papillomavirus and epidermal growth factor receptor status is associated with the prognosis of oropharyngeal squamous cell carcinoma. Hum Pathol 2016; 50(4): 51-61.
35. Huang SH, Xu W, Waldron J, et al. Refining American Joint Committee on Cancer/Union for InternationalCancer Control TNM stage and prognostic groups for human papillomavirus-related oropharyngeal carcinomas. J Clin Oncol 2015; 33(8): 836-845.
36. El-Mofty SK. Human papillomavirus-related head and neck squamous cell carcinomavariants. Semin Diagn Pathol 2015; 32(1): 23-31.
37. Cai C, Chernock RD, Pittman ME, El-Mofty SK, Thorstad WL, Lewis JS Jr. Keratinizing-type squamous cell carcinoma of the oropharynx: p16 overexpression is associated with positive high-risk HPV status and improved survival. Am J Surg Pathol 2014; 38(6): 809-815.
38. Jo VY, Mills SE, Stoler MH, Stelow EB. Papillary squamous cell carcinoma of the head and neck: frequent association with human papillomavirus infection and invasive carcinoma. Am J Surg Pathol 2009; 33(11): 1720–1724.
39. Yang CH, Huang CC, Ko MT, Wei YC, Hwang CF. Human papillomavirus infection and papillary squamous cell carcinoma in the head and neck region. Tumour Biol 2013; 34(1): 301-307.
40. Mehrad M, Carpenter DH, Chernock RD, et al. Papillary squamous cell carcinoma of the head and neck: clinicopathologic and molecular features with special reference to human papillomavirus. Am J Surg Pathol 2013; 37(9): 1349–1356.
41. Begun S, Westra WH. Basaloid squamous cell carcinoma of the head and neck is a mixed variant that can be further resolved by HPV status. Am J Surg Pathol 2008; 32(7): 1044–1050.
42. Chernock RD, Lewis JS Jr, Zhang Q, El-Mofty SK. Human papillomavirus positive basaloid squamous cell carcinoma of the upper aerodigestive tract: a distinct clinicopathologic and molecular subtype of basaloid squamous cell carcinoma.Human Pathol 2010; 41(7): 1016–1023.
43. Cardesa A, Zidar N, Alos L. Adenosquamous carcinoma. In: Barnes EL, Eveson JW, Reichart P, Sideransky D, eds. Pathology and genetics of head and neck tumors. World Health Organization Classification of Tumors. Lyon: IARC Press; 2005 : 130-131.
44. Masand RP, El-Mofty SK, Ma XJ, Luo Y, Flanagan JJ, Lewis JS Jr. Adenosquamous carcinoma of the head and neck: relationship to human papillomavirus and review of literature. Head Neck Pathol 2011; 5(2): 108–116.
45. Radkay-Gonzalez L, Faquin W, McHugh JB, Lewis JS Jr, Tuluc M, Seethala RR. Ciliated adenosquamous carcinoma: expanding the phenotypic diversity of human papillomavirus-associated tumors. Head Neck Pathol. In press 2015.
46. Wenig BM. Lymphoepithelial-like carcinomas of the head and neck. Semin Diagn Pathol 2015; 32(1): 74-86.
47. Peterrsson F. Nasopharyngeal carcinoma: a review. Semin Diagn Pathol 2015; 32(1): 54-73.
48. Perez-Ordoñez B. An update on Epstein-Barr virus and nasopharyngeal carcinogenesis. Head Neck Pathol 2007; 1(2): 141-145.
49. Tsao SW, Tsang CM, To KF, Lo KW. The role of Epstein-Barr virus in epithelial malignancies. J Pathol 2015; 235(2): 323-333.
50. Singhi AD, Stelow EB, Mills SE, Westra WH. Lymphoepitheliallike carcinoma of the oropharynx: a morphologic variant of HPV related head and neck carcinoma. Am J Surg Pathol 2010; 34(6): 800–805.
51. Carpenter D, El-Mofty SK, Lewis JS Jr. Undifferentiated carcinoma of the oropharynx: a human papillomavirus-associated tumor with favorable prognosis. Mod Pathol 2011; 24(10): 1306–1312.
52. Bishop JA, Montgomery EA, Westra WH. Use of p40 and p63 immunohistochemistry and human papillomavirus testing as ancillary tools for the recognition of head and neck sarcomatoid carcinoma and its distinction from benign and malignant mesenchymal processes. Am J Surg Pathol 2014; 38(2): 257–264.
53. Watson RF, Chernock RD, Wang X, et al. Spindle cell carcinomas of the head and neck rarely harbor transcriptionally-active human papillomavirus. Head Neck Pathol 2013; 7(3): 250–257.
54. Bishop JA, Westra WH. Human papillomavirus-related small cell carcinoma of the oropharynx. Am J Surg Pathol 2011; 35(11): 1679–1684.
55. Kraft S, Faquin WC, Krane JF. HPV-associated neuroendocrine carcinoma of the oropharynx: a rare new entity with potentially aggressive clinical behavior. Am J Surg Pathol 2012; 36(3): 321–30.
56. Singhi AD, Califano J, Westra WH. High-risk human papillomavirus in nasopharyngeal carcinoma. Head Neck 2012; 34(2): 213–218.
57. Lewis JS Jr, Ukpo OC, Ma XJ, et al. Transcriptionally-active high-risk human papillomavirus is rare in oral cavity and laryngeal/hypopharyngeal squamous cell carcinomas--a tissue microarray study utilizing E6/E7 mRNA in situ hybridization. Histopathology 2012; 60(6): 982 – 991.
58. Bishop JA, Ma XJ, Wang H, et al. Detection of transcriptionally active high-risk HPV in patients with head and neck squamous cell carcinoma as visualized by a novel E6/E7 mRNA in situ hybridization method. Am J Surg Pathol 2012; 36(12): 1874–1882.
59. Chernock RD, Wang X, Gao G, et al. Detection and significance of human papillomavirus, CDKN2A(p16) and CDKN1A(p21) expression in squamous cell carcinoma of the larynx. Mod Pathol 2013; 26(2): 223–231.
60. Lingen MW, Xiao W, Schmitt A, et al. Low etiologic fraction for high-risk human papillomavirus in oral cavity squamous cell carcinomas. Oral Oncol 2013; 49(1): 1–8.
61. Bishop JA, Guo TW, Smith DF, et al. Human papillomavirus-related carcinomas of the sinonasal tract. Am J Surg Pathol 2013; 37(2): 185–192.
62. Thavaraj S. Human papillomavirus-associated neoplasms of the sinonasal tract and nasopharynx. Semin Diagn Pathol 2016; 33(2): 104-111.
63. Alos L, Moyano S, Nadal A, et al. Human papillomaviruses are identified in a subgroup of sinonasal squamous cell carcinomas with favorable outcome. Cancer 2009; 115(12): 2701–2709.
64. Larque AB, Hakim S, Ordi J, et al. High-risk human papillomavirus is transcriptionally active in a subset of sinonasal squamous cell carcinomas. Mod Pathol 2014; 27(3): 343–351.
65. Laco J, Sieglová K, Vošmiková H, et al. The presence of high-risk human papillomavirus (HPV) E6/E7 mRNA transcripts in a subset of sinonasal carcinomas is evidence of involvement of HPV in its etiopathogenesis. Virchows Arch 2015; 467(4): 405-415.
66. Robinson M, Suh YE, Paleri V, et al. Oncogenic human papillomavirus-associated nasopharyngeal carcinoma: an observational study of correlation with ethnicity, histological subtype and outcome in a UK population. Infect Agent Cancer 2013; 8(1): 30.
67. Lin Z, Khong B, Kwok S, et al. Human papillomavirus 16 detected in nasopharyngeal carcinomas in white Americans but not in endemic southern Chinese patients. Head Neck 2014; 36(5): 709–714.
68. Dogan S, Hedberg ML, Ferris RL, Rath TJ, Assaad AM, Chiosea SI. Human papillomavirus and Epstein-Barr virus in nasopharyngeal carcinoma in a low-incidence population. Head Neck 2014; 36(4): 511–516.
69. Stenmark MH, McHugh JB, Schipper M, et al. Nonendemic HPV-positive nasopharyngeal carcinoma: association with poor prognosis. Int J Radiat Oncol Biol Phys 2014; 88(3): 580–588.
70. Švajdler M Jr, Kašpírková J, Mezencev R, et al. Human papillomavirus and Epstein-Barr virus in nasopharyngeal carcinoma in a non-endemic eastern european population. Neoplasma 2016; 63(1): 107-114.
71. Salazar CR, Smith RV, Garg MK, et al. Human papillomavirus-associated head and neck squamous cell carcinoma survival: a comparison by tumor site and initial treatment. Head Neck Pathol 2014; 8(1):77-87.
72. Arrangoiz R, Galloway TJ, Papavasiliou P, Ridge JA, Lango MN. Metastatic cervical carcinoma from an unknown primary: literature review. Ear Nose Throat J 2014; 93(4-5): E1–E10.
73. Strojan P, Ferlito A, Medina JE, et al. Contemporary management of lymph node metastases from an unknown primary to the neck: I. A review of diagnostic approaches, Head Neck 2013; 35(1): 123-132.
74. Park JM, Jung CK, Choi YJ, et al. The use of an immunohistochemical diagnostic panel to determine the primary site of cervical lymph node metastases of occult squamous cell carcinoma. Hum Pathol 2010; 41(3): 431-437.
75. Layfield LJ. Fine-needle aspiration in the diagnosis of head and neck lesions: a review and discussion of problems in differential diagnosis. Diagn Cytopathol 2007; 35(12): 798-805.
76. Goldenberg D, Begum S, Westra WH, et al. Cystic lymph node metastasis in patients with head and neck cancer: An HPV-associated phenomenon. Head Neck 2008; 30(7): 898-903.
77. Regauer S, Mannweiler S, Anderhuber W, et al. Cystic lymph node metastases of squamous cell carcinoma of Waldeyer‘s ring origin. Br J Cancer 1999; 79(9-10): 1437-1442.
78. Granström G, Edström S. The relationship between cervical cysts and tonsillar carcinoma in adults. J Oral Maxillofac Surg 1989; 47(1): 16-20.
79. Flanagan PM, Roland NJ, Jones AS. Cervical node metastases presenting with features of branchial cysts. J Laryngol Otol 1994; 108(12): 1068-1071.
80. Gourin GC, Johnson JT. Incidence of unsuspected metastases in lateral cervical cysts. Laryngoscope 2000; 110(10 Pt 1): 1637-1641.
81. Thompson LD, Heffner DK. The clinical importance of cystic squamous cell carcinomas in the neck: a study of 136 cases. Cancer 1998; 82(5): 944-956.
82. Verma K, Mandal S, Kapila K. Cystic change in lymph nodes with metastatic squamous cell carcinoma. Acta Cytol 1995; 39(3): 478-80.
83. Mehrad M, Zhao H, Gao G, Wang X, Lewis JS Jr. Transcriptionally-active human papillomavirus is consistently retained in the distant metastases of primary oropharyngeal carcinomas. Head Neck Pathol 2014; 8(2): 157-163.
84. Morani AC, Eisbruch A, Carey TE, Hauff SJ, Walline HM, Mukherji SK. Intranodal cystic changes: a potential radiologic signature/biomarker to assess the human papillomavirus status of cases with oropharyngeal malignancies. J Comput Assist Tomogr 2013; 37(3): 343-345.
85. Yasui T, Morii E, Yamamoto Y, et al. Human papillomavirus and cystic node metastasis in oropharyngeal cancer and cancer of unknown primary origin. PLoS One 2014; 9(4): e95364.
86. Begum S, Gillison ML, Ansari-Lari MA, Shah K, Westra WH. Detection of human papillomavirus in cervical lymph nodes: a highly effective strategy for localizing site of tumor origin. Clin Cancer Res 2003; 9(17): 6469-6475.
87. El-Mofty SK, Zhang MQ, Davila RM. Histologic identification of human papillomavirus (HPV)-related squamous cell carcinoma in cervical lymph nodes: a reliable predictor of the site of an occult head and neck primary carcinoma. Head Neck Pathol 2008; 2(3): 163-168.
88. Weiss D, Koopmann M, Raudack C. Prevalence and impact on clinicopathological characteristics of human papillomavirus-16 DNA in cervical lymph node metastases of head and neck squamous cell carcinoma. Head Neck 2011; 33(6): 856-862.
89. Park GC, Lee M, Roh JL, et al. Human papillomavirus and p16 detection in cervical lymph node metastases from an unknown primary tumor. Oral Oncol 2012; 48(12): 1250-1256.
90. Zhang GZ, Liu ZL, Gong JS, Cheng ZQ, Ke C. Cystic metastatic nasopharyngeal carcinoma presenting as branchial cleft cyst: report of two cases and review of the literature. J Oral Maxillofac Surg 2014; 72(11): 2366-2374.
91. Švajdler M Jr, Kašpírková J, Hadravský L, et al. Origin of cystic squamous cell carcinoma metastases in head and neck lymph nodes: Addition of EBV testing improves diagnostic accuracy. Pathol Res Pract. In press 2016.
92. Bergeron C, Ronco G, Reuschenbach M, et al. The clinical impact of using p16(INK4a) immunochemistry in cervical histopathology and cytology: an update of recent developments. Int J Cancer 2015; 136(12): 2741–2751.
93. Venuti A, Paolini F. HPV detection methods in head and neck cancer. Head Neck Pathol 2012; 6 Suppl 1: S63-74.
94. Grønhøj Larsen C, Gyldenløve M, Jensen DH, et al. Correlation between human papillomavirus and p16 overexpression in oropharyngeal tumours: a systematic review. Br J Cancer 2014; 110(6): 1587-1594.
95. Lewis JS Jr. p16 Immunohistochemistry as a standalone test for risk stratification in oropharyngeal squamous cell carcinoma. Head Neck Pathol 2012; 6 Suppl 1: S75-S82.
96. Cao D, Begum S, Ali SZ, Westra WH. Expression of p16 in benign and malignant cystic squamous lesions of the neck. Hum Pathol 2010; 41(4): 535-539.
97. Yuan J, Knorr J, Altmannsberger M, et al. Expression of p16 and lack of pRB in primary small cell lung cancer. J Pathol 1999; 189(3): 358-362.
98. Hartley CP, Steinmetz HB, Memoli VA, Tafe LJ. Small cell neuroendocrine carcinomas of the lung do not harbor high-risk human papillomavirus. Hum Pathol 2015; 46(4): 577-582.
99. Wadsworth B, Bumpous JM, Martin AW, Nowacki MR, Jenson AB, Farghaly H. Expression of p16 in sinonasal undifferentiated carcinoma (SNUC) without associated human papillomavirus (HPV). Head Neck Pathol 2011; 5(4): 349-354.
100. Doxtader EE, Katzenstein AL. The relationship between p16 expression and high-risk human papillomavirus infection in squamous cell carcinomas from sites other than uterine cervix: a study of 137 cases. Hum Pathol 2012; 43(3): 327-332.
101. Alexander RE, Hu Y, Kum JB, et al. p16 expression is not associated with human papillomavirus in urinary bladder squamous cell carcinoma. Mod Pathol 2012; 25(11): 1526-1533.
102. Kašpírková J, Ondič O, Černá K, Skálová A. Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk Patol 2013; 49(1): 29-34.
103. Bishop JA, Lewis JS Jr, Rocco JW, Faquin WC. HPV-related squamous cell carcinoma of the head and neck: An update on testing in routine pathology practice. Semin Diagn Pathol 2015; 32(5): 344-351.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2016 Issue 3-
All articles in this issue
- „Hassalloidné“ telieska v pľúcach u dieťaťa s epidermolysis bullosa junctionalis a s Bartovým syndrómom
- HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax
- Novinky v molekulární diagnostice karcinomů slinných žláz: „translokační karcinomy“
- Kazuistika: Diagnóza až pod mikroskopem - diseminovaná echinokokóza multilokulárního vzhledu s protoskolexy
- Poorly differentiated sinonasal tract malignancies: A review focusing on recently described entities
- Rozlišování různých typů dysplazie v Barrettově jícnu - první krok k harmonizaci gradingu
- Submukózny kalcifikujúci fibrózny tumor žalúdka – kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax
- Poorly differentiated sinonasal tract malignancies: A review focusing on recently described entities
- Kazuistika: Diagnóza až pod mikroskopem - diseminovaná echinokokóza multilokulárního vzhledu s protoskolexy
- Novinky v molekulární diagnostice karcinomů slinných žláz: „translokační karcinomy“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

