-
Medical journals
- Career
Morfologie gastroezofageálního refluxu
: Ondřej Daum; Bohuslava Kokošková; Marián Švajdler
: Bioptická laboratoř, s. r. o., Plzeň ; Šiklův ústav patologie LF UK a FN Plzeň
: Čes.-slov. Patol., 52, 2016, No. 1, p. 15-22
: Reviews Article
Současná definice gastroezofageální refluxní choroby jícnu je založena především na klinických kritériích, jejichž přesná korelace je poměrně obtížná. Role patologa spočívá především v potvrzení morfologických změn způsobených gastroezofageálním refluxem. Tradiční hodnocení regresivních, zánětlivých a reaktivních změn v dlaždicovém epitelu jícnu postrádá dostatečnou senzitivitu a specificitu, a proto se v současné době obrací pozornost k chronickým metaplastickým změnám sliznice jícnu, přičemž tato je definována jako jakýkoli typ sliznice nacházející se proximálně od sliznice oxyntické (odpovídající fundické sliznici žaludku). Při refluxu se tato sliznice, za normálních okolností krytá dlaždicovým epitelem, mění ve sliznici kolumnární, v níž lze dále podle morfologie žlázek a imunofenotypu jejich buněk diferencovat sliznici oxyntokardiackou, kardiackou, sliznici s intestinální metaplázií a intermediární typ kardiacké sliznice s expresí intestinálního transkripčního faktoru CDX2, ale bez pohárkových buněk. Právě poslední dva slizniční typy jsou nyní považovány za hlavní kandidáty pro neoplastickou transformaci, zatímco oxyntokardiacká sliznice je považována za geneticky stabilní kompenzatorní změnu bez nebezpečí další progrese. Hodnocení dysplastických změn (intraepiteliální neoplázie) žlázového epitelu jícnu je natolik obtížné a pro osud pacienta rozhodující, že vyžaduje nutnost druhého čtení. V další progresi adenokarcinomu jícnu je pro histopatologa zásadní nezaměnit invazi do prostoru mezi dvěma vrstvami rozštěpené lamina muscularis mucosae se skutečnou infiltrací submukózy s odlišným prognostickým významem. Největší výzvou pro další pokrok v porozumění biologii gastroezofageální refluxní choroby by mělo být objasnění skutečného vlivu suprese sekrece kyselé žaludeční šťávy na vznik adenokarcinomu distálního jícnu.
Klíčová slova:
jícen – ezofagitida – refluxní – gastroezofageální reflux – GERD – kardie – Barrett
Dosavadní průběh 21. století by se do jisté míry dal z pohledu gastroenteropatologa označit jako 15 let bojů o kardii, o definici toho, co je v jícnu normální, a o kritéria refluxní ezofagitidy. Navzdory počátečním porodním bolestem, argumentačním klamům a zažitým postupům nakonec převážně došlo k přehodnocení paradigmat a (přestože ne všechny detaily jsou spolehlivě objasněny) díky tomu doznala změn i histopatologická diagnostika refluxní ezofagitidy a dalších morfologických následků gastroezofageálního refluxu. Dílčí poznatky z této oblasti již byly několikrát publikovány na stránkách Česko-slovenské patologie.
Tento článek se snaží o zprostředkování uceleného přehledu o současném (často kompromisním) převládajícím pohledu na problematiku gastroezofageálního refluxu, aniž by si činil nárok na konečné zodpovězení všech otázek a objasnění významu všech výsledků dosavadních pozorování.
BARRETŮV JÍCEN A KOLUMNÁRNÍ SLIZNICE JÍCNU – VZESTUP A PÁD „FYZIOLOGICKÉ SLIZNICE KARDIE“
Přítomnost kolumnární sliznice v jícnu (columnar-lined esophagus, CLE) byla popisována, zejména v asociaci s peptickou ulcerací této sliznice, již v počátcích 20. století (1). Přestože byla zpočátku mylně interpretována i jako sliznice tubulárního žaludku vytaženého do hrudníku v důsledku kongenitálně krátkého jícnu (2,3), sám Dr. Barrett uznal svůj omyl a tento typ sliznice lokalizoval do jícnu, přičemž použil termín CLE (4), ačkoli později se vžilo pro tento stav eponymické označení Barrettův jícen. Poté, co byly v CLE rozeznány tři různé typy epitelu, původně popsané jako fundický, junkční a specializovaný (dnes označovaný jako intestinální) (5), přičemž výskyt adenokarcinomu jícnu byl asociován právě se specializovaným typem epitelu (6), byla diagnóza Barrettova jícnu omezena na podmnožinu CLE charakterizovanou přítomností intestinální metaplázie (7).
Nešťastným momentem se stala definice „normální histologické kardie“ nebo „fyziologické sliznice kardie“ jako přítomnost junkčního typu CLE v distálních 2 cm jícnu, a to bez důkazů pro skutečně fyziologický charakter této sliznice, nemluvě o arbitrárním stanovení její délky (8). Ačkoli tedy pro koncept 2 cm dlouhé normální „histologické“ kardie nebylo žádné opodstatnění, byl přijat na celém světě a dodnes přetrvává v učebnicích histologie.
Teprve před 15 lety se začal tento koncept hroutit, a to zejména díky přelomovým publikacím Parakramy T. Chandrasomy, který sumarizoval výsledky předešlých i vlastních studií do těchto hlavních bodů svědčících pro teorii, že „normální“ histologická kardie neexistuje, ale je statisticky významně asociovaná, pravděpodobně i způsobená gastroezofageálním refluxem, a je tak nejčasnějším histologickým projevem gastroezofageální refluxní choroby (gastroesophageal reflux disease, GERD) (9,10):
- v autoptické histologické studii oblasti gastroezofageální junkce (GEJ) ve většině případů nebyla sliznice kardie vůbec nalezena
- výskyt a délka této sliznice vzrůstá s věkem (a tedy pravděpodobně s dlouhodobým působením zevních faktorů, nejspíše GERD)
- výskyt a délka sliznice kardie je asociována s výsledky pHmetrických a manometrických studií jícnu, které svědčí pro GERD
- v případech, kdy byla sliznice kardie identifikována, byla v ní přítomna chronická zánětlivá celulizace, přičemž si lze jen stěží představit, že by zánětem byla postižena normální sliznice (při vyloučení jiných příčin než GERD, tedy zejména helikobakterové infekce) (11).
Zároveň byly na základě těchto poznatků postulovány základní body nového konceptu:
- V oblasti GEJ se vyskytují pouze dva druhy normální, tedy fyziologické sliznice:
- dlaždicový epitel sliznice jícnu (squamous mucosa, SM)
- oxyntická sliznice (oxyntic mucosa, OM, v předchozím konceptu „fundická sliznice“)
- Za patologických okolností, zejména v rámci GERD, se mohou vyskytovat tyto typy sliznice metaplastické:
- oxyntokardiacká sliznice (oxyntocardiac mucosa, OCM)
- kardiacká sliznice (cardiac mucosa, CM, v předchozím konceptu „junkční sliznice“, v současnosti existuje konflikt názorů na vhodnost českého překladu, lze se tedy setkat i s termíny „kardiální sliznice“ nebo „sliznice typu kardie“, přičemž žádný není ideální a všechny mají své nevýhody, proto zde dáváme přednost přímému převodu z původního anglického termínu)
- intestinální sliznice (intestinal mucosa, IM, v předchozím konceptu „specializovaná sliznice“)
- Kardiacká sliznice je lokalizačně vždy sliznicí jícnu. Takzvaná „žaludeční kardie“ ve skutečnosti neexistuje. Případná přítomnost CM v oblasti endoskopicky lokalizované jako fundus žaludku je důsledkem ochabnutí a zkrácení délky dolního jícnového svěrače (svěrače kardie, lower esophageal sphincter, LES) v důsledku GERD, které vede k dilataci distálního jícnu a jeho „detubulizaci“, což vytváří dojem lokalizace v žaludečním fundu (12).
- Horní hranicí žaludku není endoskopicky detekovaný konec slizničních řas žaludku, ale horní okraj OM. Cokoli, co je nad touto linií, patří ve skutečnosti do jícnu, byť „ventrikulizovaného“ (viz bod 3). Tato teze byla podpořena i topografickou asociací OCM a CM s jícnovými submukózními žlázkami, které se v žaludku nevyskytují (13).
- CM představuje iniciální nestabilní typ sliznice vznikající při poškození SM refluxem. IM představuje další progresi poškození sliznice spojené s její genetickou destabilizací vedoucí k potenciálně onkogenním mutacím, zatímco OCM je znakem stabilizace a rezistence vůči dalším následkům refluxu (14).
Je pravda, že nejprve byl tento nový koncept přijímán spíše skepticky (15), zejména s odkazem na starší i aktuální studie histologie GEJ v pediatrické populaci a u fetů prokazující univerzální výskyt „normální“ CM (16-19). Nicméně práce kriticky zaměřené na odlišení CM od vývojových fází sliznice GIT a interpretačních artefaktů potvrdily absenci kardie u fetů a ve zdravé dětské i dospělé populaci (20-24). Vzhledem k diskrepancím mezi výsledky jednotlivých studií však část významných autorit zastává kompromisní přístup, který nevylučuje, že se může vyskytovat v oblasti GEJ fyziologicky přítomná sliznice typu CM, ovšem v segmentu kratším než 0,4 mm (25).
Samozřejmě se nabízí otázka, zda existence „normální“ CM není pouze akademickým problémem, jestli má nějaký význam i pro běžnou bioptickou praxi. Odpověď je jednoduchá: Jen díky konceptu kauzální asociace CM s GERD lze dnes histologicky potvrdit klinicky zřejmou refluxní ezofagitidu v bioptickém materiálu neobsahujícím ani IM ani reaktivní změny v SM, což je bohužel většina případů. IM je totiž relativně pozdní a pouze ložiskově přítomnou komplikací GERD, reaktivní změny SM zase postrádají dostatečnou senzitivitu a specificitu. Většinou je jedinou známkou GERD přítomnost CM v jícnu, což bylo důvodem frustrující a zahanbující „neschopnosti“ patologa diagnostikovat refluxní ezofagitidu u jednoznačně symptomatických pacientů. Podobně důležitý je z téhož konceptu vyplývající závěr, že „adenokarcinomy kardie“, případně i „proximálního žaludku“, jsou ve skutečnosti adenokarcinomy distálního jícnu (26,27).
AKTUÁLNÍ POHLED NA HISTOLOGII CLE A DIAGNOSTICKÉ ZNAKY REFLUXNÍ EZOFAGITIDY
Tradiční diagnostika refluxní ezofagitidy se soustředila na změny v SM (dlaždicovém epitelu jícnu). Nedávný projekt Esohisto stanovil konsenzuální guidelines pro hodnocení změn SM opírající se o skórovací systém založený na (semi)kvantitativním hodnocení těchto znaků: poměr tloušťky bazální zóny epitelu k celé jeho tloušťce, poměr délky stromálních papil k celkové tloušťce dlaždicového epitelu, počet intraepiteliálních neutrofilů, eozinofilů a lymfocytů, a přítomnost a charakter dilatace intercelulárních prostorů (tedy vlastně spongiózy). Ač jde jistě o teoreticky cennou a metodicky velmi zdařilou studii, komplikovanost skórovacího systému, stejně jako fakt, že všechny uvedené změny jsou poměrně nespecifickou reakcí na poškození epitelu celou škálou příčin, konkrétní podobu skórovacího systému zde neuvádíme a odkazujeme čtenáře na zdrojovou publikaci (28).
Na Esohisto projekt částečně navázala studie histoGERD validující význam změn v SM, ale i význam nálezu CLE pro diagnostiku GERD. Je sice pravda, že tato rakousko-německá studie se nepřiklání otevřeně a bez výhrad k postulátům Chandrasomy jako jediná srovnatelná studie české provenience (29), i přesto ale její závěr ponechává jen minimální prostor pro jiný než tento výklad původu CM: „Asociace CM se symptomy refluxu, dalšími histologickými změnami asociovanými s GERD a endoskopickým obrazem ezofagitidy svědčí pro to, že poškození a reparace sliznice navozená GERD přispívá k jejímu vzniku a/nebo expanzi”. Dalším závěrem studie histoGERD je tvrzení, že přítomnost CLE je znakem chronického GERD, zatímco změny v SM reflektují akutní GERD, respektive aktivitu chronické GERD (30,31). Z toho vyplývá, že klasický grading refluxní ezofagitidy podle Knuffa a Leappeho (32,33) založený na změnách SM neodpovídá skutečné biologii změn odehrávajících se v distálním jícnu a neměl by být v patologické zprávě uváděn jako samostatný údaj. Shrnutím dosavadních poznatků lze dospět ke stanovení těchto nejdůležitějších diagnostických znaků refluxní ezofagitidy (obr. 1):
1. Přehledný obraz morfologických změn při refluxní ezofagitidě. 
Abnormální kolumnární sliznice mezi dlaždicovým epitelem jícnu (zelená šipka) a oxyntickou sliznicí fundu žaludku (modrá šipka) (HE, 40x). - přítomnost jiné sliznice mezi fyziologicky se vyskytující SM jícnu a OM (obr. 2) proximálního žaludku, tedy tzv. „mezery mezidlaždicovým epitelem a oxyntickou sliznicí“ (squamo-oxyntic gap (SOG)), do jehož spektra patří OCM charakterizovaná mucinózními žlázkami s parietálními buňkami (obr. 3), CM charakterizovaná mucinózními žlázkami bez parietálních buněk (obr. 4) a IM charakterizovaná přítomností pohárkových buněk (obr. 5) (34)
- vrstevnatý epitel (multilayered epithelium, ME) kombinující znaky epitelu dlaždicového a cylindrického (obr. 6), s plochými buňkami ve vrstvách bazálních a cylindrickými buňkami při povrchu (35-40)
2. Oxyntická sliznice žaludečního fundu. 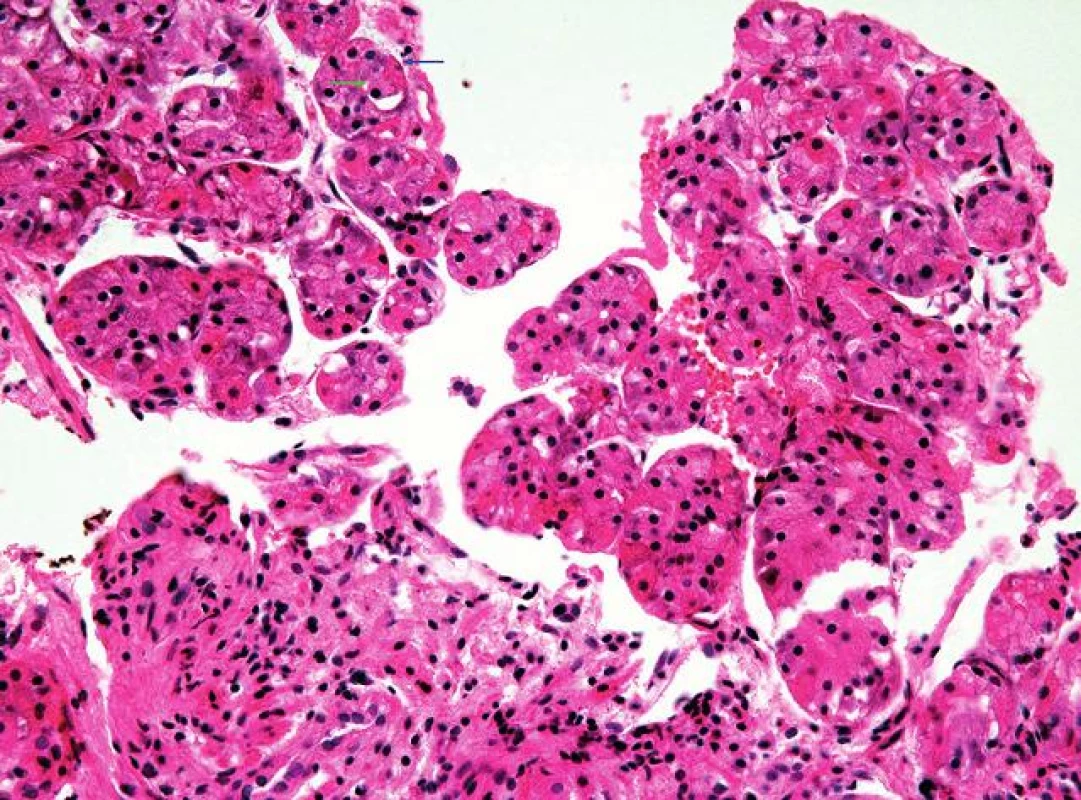
Oxyntická sliznice je charakterizována žlázkami tvořenými buňkami hlavními (zelená šipka) a parietálními (modrá šipka) (HE, 400x). 3. Oxyntokardiacká sliznice jícnu. 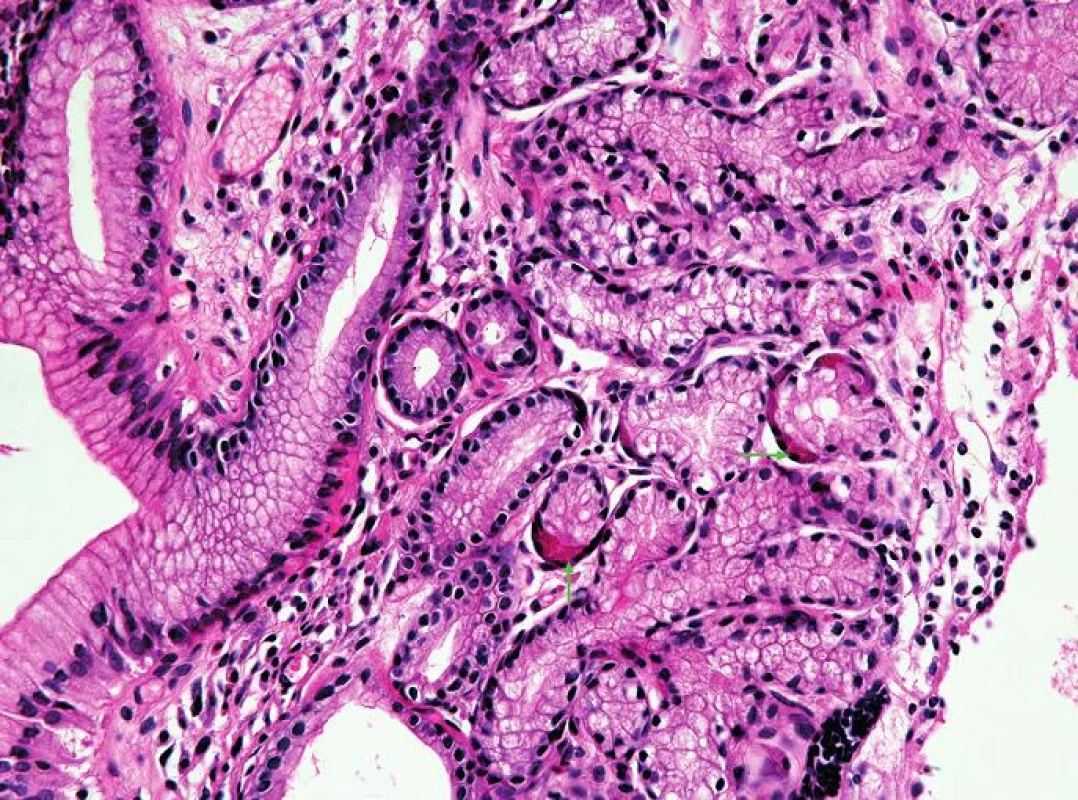
Oxyntokardiacká sliznice je charakterizována přítomností parietálních buněk (zelené šipky) v mucinózních žlázkách (HE, 400x). 4. Kardiacká sliznice jícnu. 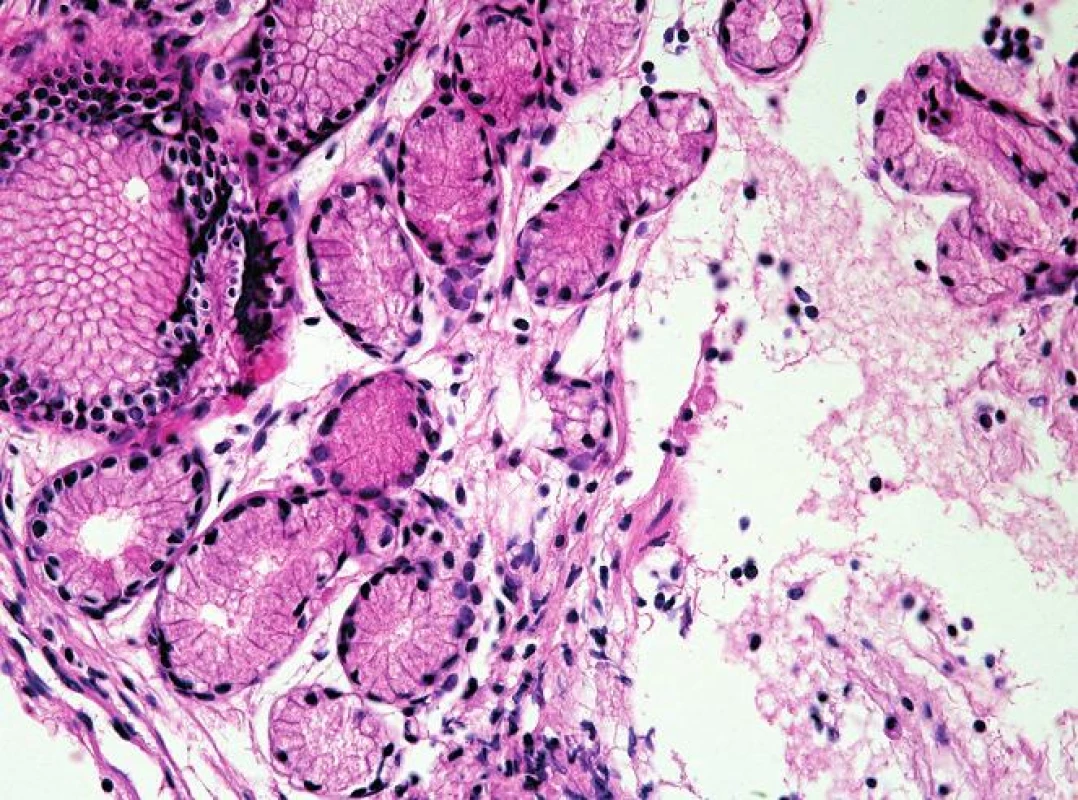
Kardiacká sliznice je charakterizována přítomností mucinózních žlázek pylorického typu bez parietálních buněk (HE, 400x). 5. Intestinální metaplázie sliznice jícnu. 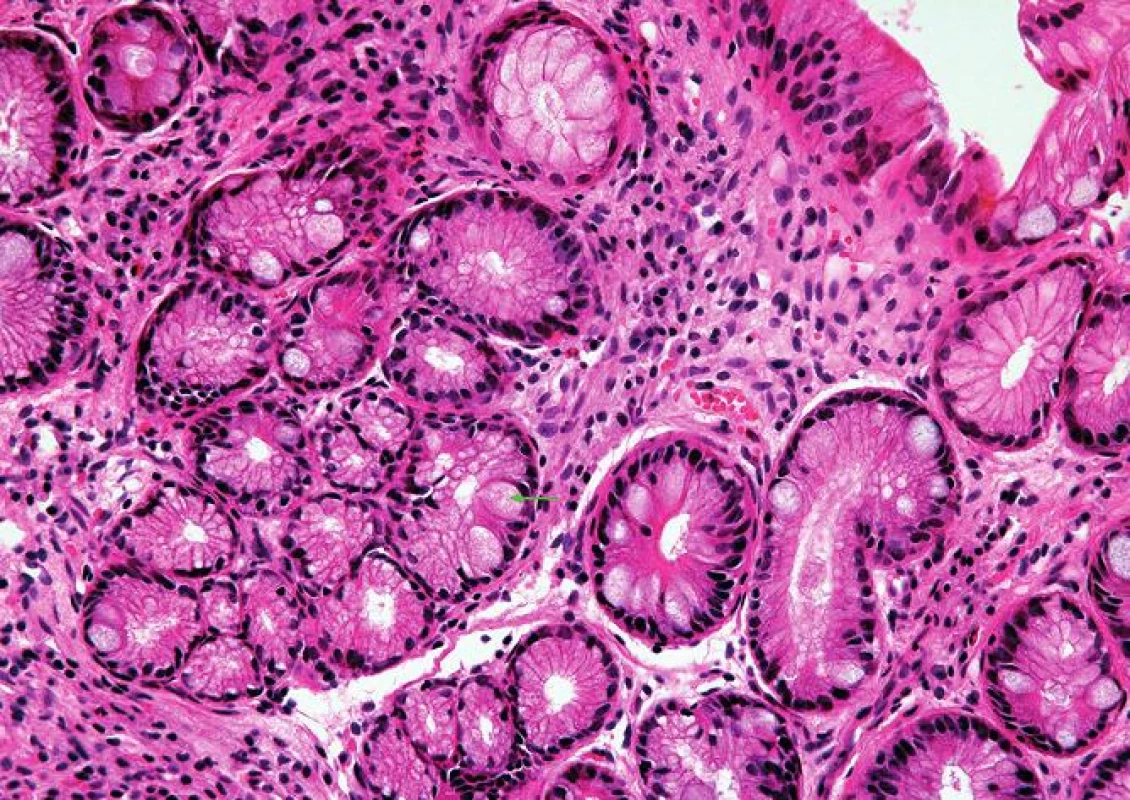
Intestinální metaplázie je charakterizována přítomností pohárkových buněk (zelená šipka) (HE, 400x). 6. Vrstevnatý epitel sliznice jícnu. 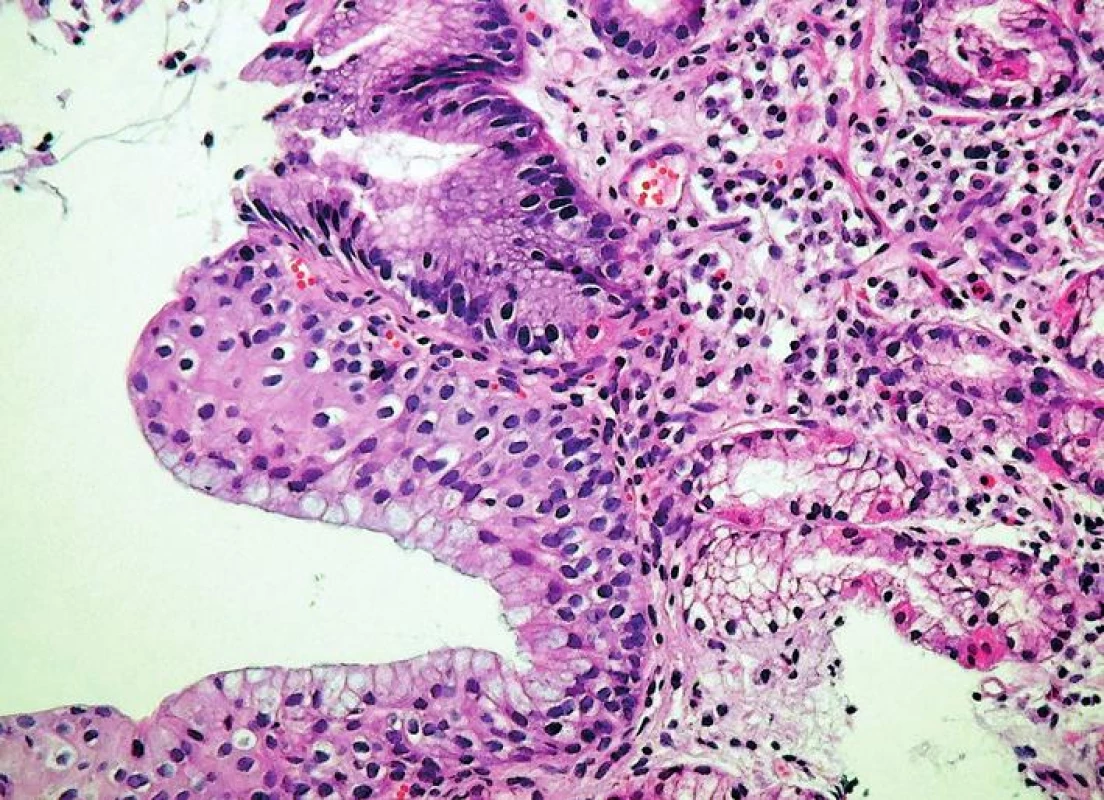
Tento typ epitelu tvoří přechodnou zónu mezi epitelem dlaždicovým a kolumnárním, spojuje tedy v sobě fenotyp obou druhů epitelů (HE, 400x). Pro úplnost je třeba dodat, že v zóně SOG lze kromě hlavních diagnostických typů sliznice zastihnout ještě další metaplastické změny, zejména pankreatickou acinární metaplázii (41, 42) a metaplázii v řasinkový epitel připomínající bronchiální sliznici (43). Tyto změny sice nemají samostatný diagnostický význam, protože se vždy vyskytují v terénu výše uvedených hlavních histologických znaků GERD, je však třeba s možností jejich výskytu počítat.
BARRETTŮV JÍCEN ZDE A NYNÍ
Definice a tedy i diagnostická kritéria Barrettova jícnu podléhají změnám v čase i prostoru. Nejprve, jak již bylo uvedeno výše, byly odpovídající histologické struktury považovány za sliznici žaludku kraniálně dislokovaného kvůli kongenitálně krátkému jícnu (2,3), poté byly tyto struktury rozpoznány jako ezofageální a termín Barrettův jícen byl použit jako synonymum pro CLE, až nakonec bylo toto eponymon rezervováno pro CLE s komponentou intestinální metaplázie („no goblets – no Barrett´s“).
V současné době ovšem existují regionální variace v diagnostických kritériích, což je podmíněno rozdílným přístupem jednotlivých odborných společností k novým poznatkům o biologii CLE a onkogenním potenciálu jeho různých forem získaným v posledních 15 letech. Zjednodušeně lze říci, že zatímco ve Velké Británii (44) a v Japonsku (45) k diagnóze Barrettova jícnu stačí histologický průkaz CLE v endoskopicky abnormální sliznici, v USA (46) a v kontinentální Evropě (včetně ČR) je stále vyžadována přítomnost IM (a tedy pohárkových buněk) v CLE (47). Z hlediska patologa může určitý problém představovat požadavek endoskopického průkazu abnormální sliznice jícnu, jednak protože, jak již bylo uvedeno výše, endoskopické rozlišení mezi sliznicí jícnu a žaludku není spolehlivé, jednak protože tak vytváří jistý terminologický rozpor v případě pozitivního mikroskopického a negativního endoskopického nálezu. Z těchto důvodů se doporučuje pro odpovídající histologický obraz používat místo pojmu Barrettův jícen termín Barrettova sliznice (48).
Současné doporučení pro histologickou diagnostiku Barrettova jícnu v ČR lze sumarizovat takto:
- popsat zastižený SOG s uvedením jednotlivých typů CLE, zejména je nutné se vyjádřit k přítomnosti/nepřítomnosti IM
- v závislosti na lokálních zvyklostech a domluvě s gastroenterologem je možné pro případy CLE s IM užít termín „Barrettova sliznice“
- termín „Barrettův jícen“ použít v případě pozitivního nálezu pouze pro případy klinikem uvedeného podezření na Barrettův jícen, respektive endoskopického průkazu CLE
- dále popsat přítomnost/nepřítomnost intraepiteliální či invazivní neoplázie.
DETAILNÍ POHLED NA POPULACI BUNĚK V BARRETTOVĚ SLIZNICI
Ještě nedávno převládal model progrese změn v reakci na poškození SM jícnu při GERD založený na pozorování morfologických změn ve světelném mikroskopu (obr. 7). Zároveň byl uznáván předpoklad, že pouze přítomnost IM v CLE (tedy Barrettův jícen v kontinentálním evropském pojetí) představuje riziko pro vznik adenokarcinomu (49).
7. Tradiční morfologické pojetí progrese změn epitelu jícnu při poškození gastroezofageálním refluxem. 
Poškození SM při refluxu vede přes mezistupeň ME ke kolumnární metaplázii sliznice, a to jednak ve formě OCM, jednak ve formě CM. Zatímco OCM je považována za geneticky stabilní, bez rizika další progrese, CM je charakterizována genetickou nestabilitou s možností další progrese v IM. Teprve přítomnost IM je ale v tomto modelu považována za prekurzor neoplastických změn. SM: dlaždicový epitel (squamous mucosa), ME: vrstevnatý epitel (multilayered epithelium), OCM: oxyntokardiacká sliznice (oxyntocardiac mucosa), CM: kardiacká sliznice (cardiac mucosa), IM: intestinální metaplázie Imunohistochemické studie však přinášejí komplexnější pohled na buněčné složení jednotlivých typů CLE. Distribuce imunoexprese základních produktů jednotlivých typů buněk sice odpovídá buněčným typům stanoveným na základě konvenční histologie, markery časnější intestinální diferenciace ale nově definují tzv. CDX2-pozitivní CM (CDX2+CM), tedy sliznici tvořenou mucinózními žlázkami bez pohárkových buněk, avšak s expresí intestinálního transkripčního faktoru CDX2 (tab. 1) (50). To samozřejmě nastoluje otázku možnosti neoplastického potenciálu tohoto druhu sliznice (obr. 8) (51).
1. Charakteristika buněčné populace žlázek CLE. 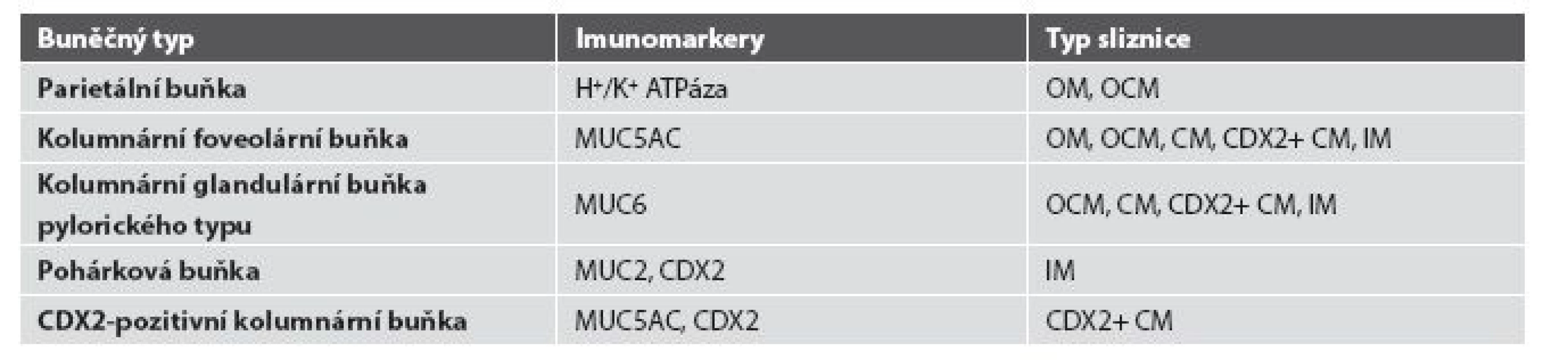
MUC2: intestinální apomucin pohárkových buněk, MUC5AC: apomucin foveolárních buněk, MUC6: apomucin pylorických žlázových buněk, CDX2: intestinální transkripční faktor caudal type homeobox 2, OM: oxyntická sliznice, OCM: oxyntokardiacká sliznice, CM: kardiacká sliznice, CDX2+ CM: CDX2-pozitivná kardiacká sliznice, IM: intestinální metaplázie 8. Kombinace imunohistochemického a tradičního morfologického pojetí progrese změn epitelu jícnu při poškození gastroezofageálním refluxem. 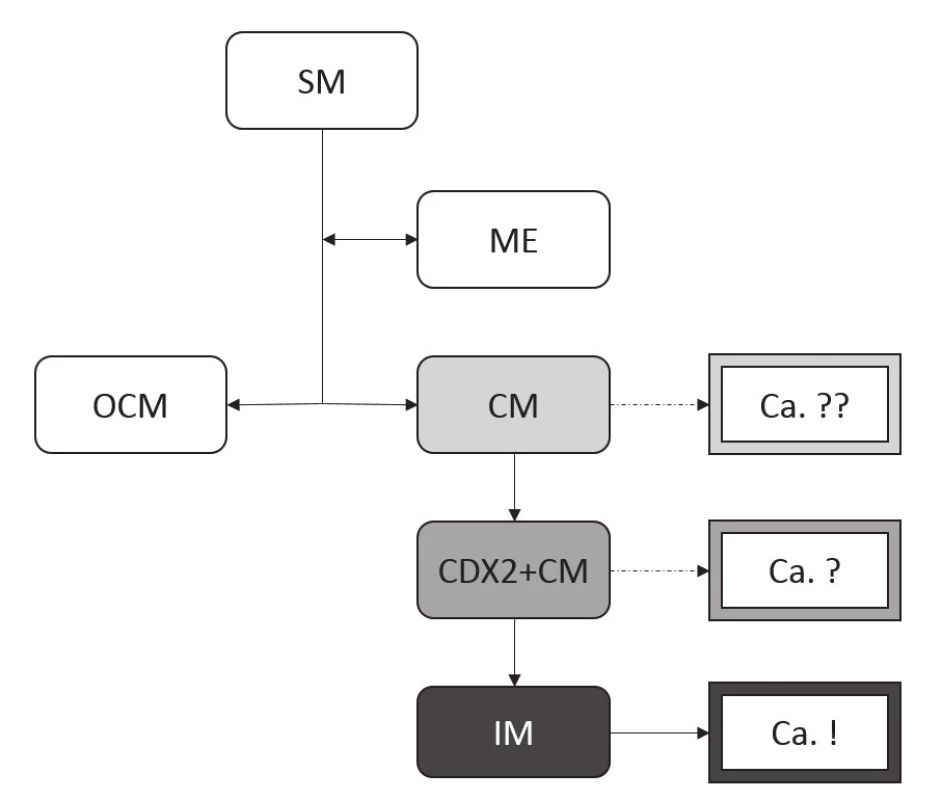
Základní body tohoto modelu jsou shodné s modelem tradičním. Novým prvkem je přítomnost kardiacké sliznice exprimující intestinální transkripční faktor CDX2 (CDX2+CM), přičemž se připouští možnost nádorové transformace tohoto buněčného typu, ačkoli za hlavní prekurzor adenokarcinomu je stále považována IM. Neoplastický potenciál samotné CM je stále považován za málo významný až nevýznamný. (Zkratky viz obr. 7.) Recentní studie analyzující směr diferenciace drobných, tedy incipientních, adenokarcinomů jícnu a okolní dysplastické i nedysplastické sliznice CLE dokonce zcela obrací tradiční představy o roli IM v karcinogenezi (52). Návrh změny paradigmatu se zakládá zejména na těchto nálezech:
- Nezávislost rizika vzniku adenokarcinomu jícnu na přítomnosti nebo nepřítomnosti IM v rámci CLE v klinických studiích.
- Absence asociace přítomnosti IM v okolní sliznici s velikostí tumoru (logicky by v případě malých tumorů, které dosud „nestihly přerůst“ původní prekancerózu, měla tato zůstat v blízkosti tumoru zachována). Přítomnost (a rozsah) IM koreluje pouze s celkovým rozsahem CLE.
- V okolí většiny (69,2 %) tumorů menších než 1 cm nebyla vůbec IM zastižena.
- Většina (85 %) všech adenokarcinomů distálního jícnu vykazovala smíšený intestinální a gastrický fenotyp. V kategorii miniaturních adenokarcinomů menších než 0,5 cm jich dokonce 50 % bylo imunofenotypizováno jako gastrické.
- Bez ohledu na absenci pohárkových buněk a intestinálních markerů MUC2 a CD10 se v CM v blízkosti tumoru, stejně jako v samotném nádoru, zvyšovala exprese CDX2.
Hypotézu, že adenokarcinom distálního jícnu asociovaný s GERD vzniká spíše v terénu CDX2+CM, zatímco IM je pouhým epifenoménem nebo náhodným a nevinným svědkem (obr. 9), podporuje dále teoretický předpoklad, že pohárkové buňky IM jsou terminálně diferencované a tedy jako prekurzor adenokarcinomu mohou být méně vhodné než CDX2-pozitivní kolumnární buňky (51).
9. Nově navržený model vztahu buněčných populací CLE ke karcinogenezi v terénu GERD. 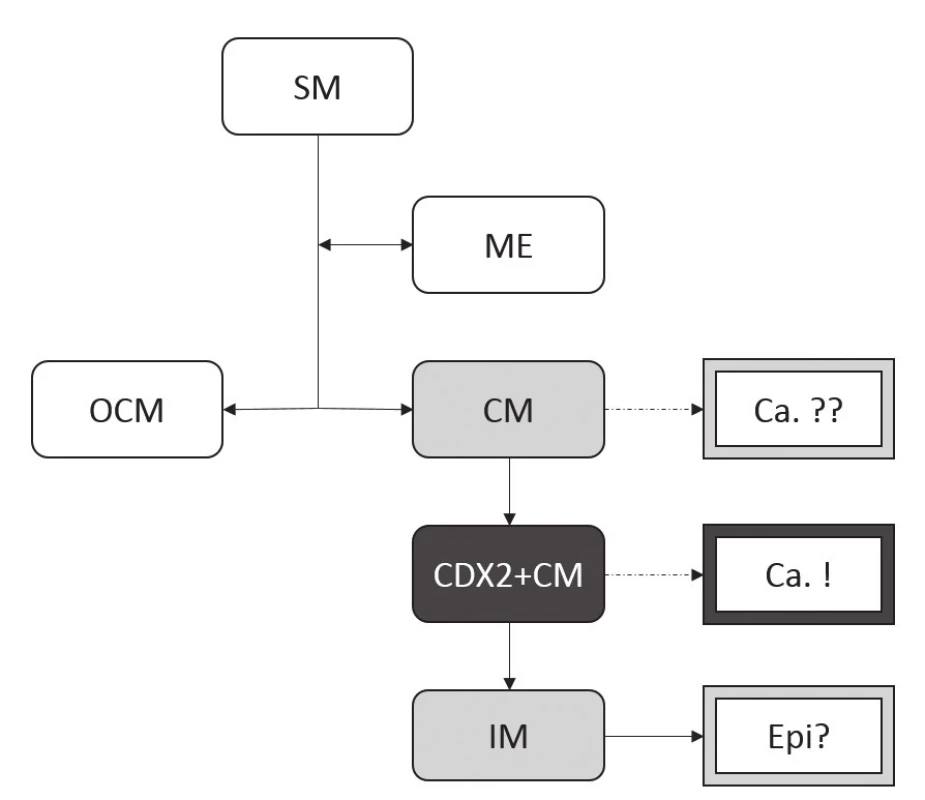
Na rozdíl od schématu demonstrovaného v Obr. 8 se v nově navrženém modelu za hlavní buněčnou populaci asociovanou se vznikem adenokarcinomu jícnu pokládá CDX2+CM. IM tak může být pouhým epifenoménem, nikoli skutečnou prekurzorovou lézí. Vztah samotné CM k neoplastické transformaci zůstává nadále nejasný, podobně jako v předchozím schématu. (Zkratky viz obr. 7.) Nejvíce kacířská myšlenka se však týká vlivu složení žaludečního (a duodenálního) obsahu na maligní zvrat metaplastických buněk CLE. Nelze totiž vyloučit, že běžná medikamentózní terapie (založená hlavně na supresi sekrece HCl inhibitory protonové pumpy) nesnižuje riziko vzniku adenokarcinomu, ba že ho dokonce může zvyšovat. Samotná HCl ve skutečnosti zodpovídá pouze za poškození SM a její následnou kolumnární metaplázii, karcinogenní účinek však pravděpodobně nemá. Naopak je možné, že má efekt protektivní, a to díky precipitaci a biologické inaktivaci žlučových kyselin při nízkém pH. Z toho vyplývá, že pouhá suprese sekrece HCl bez omezení refluxu (tedy indukce „alkalického refluxu“) může zvyšovat riziko vzniku adenokarcinomu v CLE, na rozdíl od chirurgické léčby fundoplikací, která skutečně omezí gastroezofageální reflux (53).
KRITICKÉ BODY V HISTOLOGICKÉM HODNOCENÍ INTRAEPITELIÁLNÍ NEOPLÁZIE A ADENOKARCINOMU V TERÉNU CLE
Z pohledu patologa je nejobtížnější situací odlišit reaktivní změny od změn dysplastických na jedné straně a rozlišení intraepiteliální neoplázie vysokého stupně (high grade intraepithelial neoplasia, HGIEN) od invazivního adenokarcinomu na straně druhé, zejména v malých endoskopických vzorcích. Přes řadu imunohistochemických markerů s různou statistickou významností (Ki-67, p53, p16, cyklin D1, AMACR, CDC2/CDK1) (54,55) stále hlavní roli v diagnostice hraje konvenční histologie (tab. 2). Alarmující jsou studie porovnávající primární diagnózu intraepiteliální neoplázie nízkého stupně (low grade intraepithelial neoplasia, LGIEN) s druhým čtením expertem na gastroenteropatologii, v níž pouze 27 % primárních diagnóz korespondovalo s druhým čtením (56). Naopak „přediagnostikovaná“ HGIEN s ještě potenciálně závažnějšími terapeutickými důsledky byla zjištěna zhruba v polovině případů (57). Tato hrozivá čísla implikují nutnost druhého čtení dysplastických změn v CLE.
2. Morfologické znaky intraepiteliální neoplázie a adenokarcinomu jícnu. 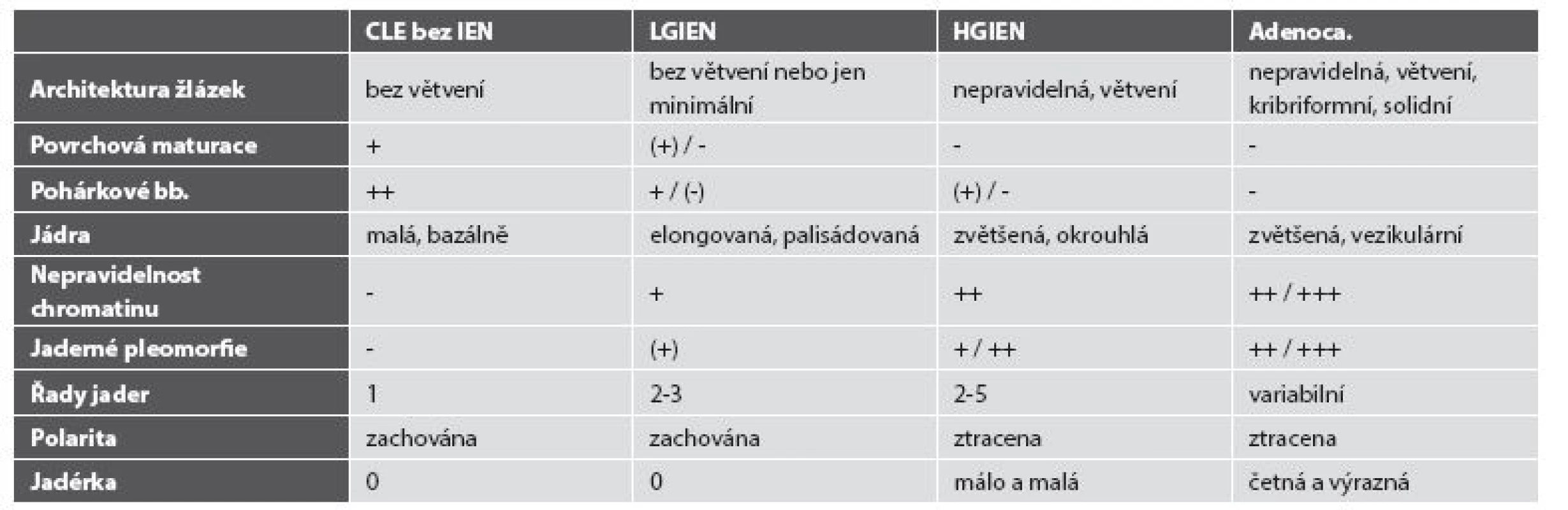
CLE bez IEN: kolumnární sliznice jícnu bez intraepiteliální neoplázie, LGIEN: intraepiteliální neoplázie nízkého stupně, HGIEN: intraepiteliální neoplázie vysokého stupně. S výše uvedenými pochybami o kruciální úloze IM v karcinogenezi souvisí i současné tendence rozlišovat intraepiteliální neoplázie (nejen) v terénu CLE podle markerů různých směrů diferenciace na typ intestinální (adenomatózní), gastrický (foveolární) a hybridní (58). Vzhledem k prostorovým možnostem tohoto přehledu a nedávné publikaci Chlumské et al. na toto téma odkazujeme pro bližší informace na uvedený článek (59).
V diagnóze adenokarcinomu se kromě znaků uvedených v tab. 2 uplatňuje zejména nález anastomozujících žlázek splývajících ve větší plochy nádorových buněk, přítomnost izolovaných nádorových buněk v proprii a malých zaúhlených žlázek. Naopak dezmoplastické stroma se objevuje až při infiltraci submukózy, nelze se tedy na jeho přítomnost spoléhat v případě časných forem adenokarcinomu.
Dalším kritickým bodem v histologickém hodnocení adenokarcinomu jícnu je rozlišení mezi stádiem pT1a a pT1b, tedy správné určení invaze do submukózy. V terénu CLE totiž dochází k duplikaci lamina muscularis mucosae a vzniká tak nový prostor mezi jejími dvěma vrstvami, přičemž pouze invaze skrz spodní vrstvu duplikované svaloviny odpovídá infiltraci skutečné submukózy, s čímž je asociováno vyšší riziko lymfatických metastáz a lokální recidivy (60-62).
ZÁVĚR
Poškození jícnu gastroezofageálním refluxem vede k sekvenci metaplastických změn, do jejichž škály patří ME, OCM, CM, CDX2+CM a IM. Výskyt jakéhokoli z těchto slizničních typů v lokalizaci endoskopistou označenou za distální jícen, kardii nebo subkardiální zónu žaludku svědčí pro refluxní ezofagitidu a odpovídá chronickému poškození sliznice jícnu refluxem. Reaktivní změny v dlaždicovém epitelu samotném postrádají dostatečnou senzitivu i specificitu a jejich použití pro diagnostiku refluxní ezofagitidy je obsoletní. Jejich přítomnost svědčí pouze pro aktivitu GERD.
Barrettův jícen je v současné době v ČR definován jako přítomnost IM v endoskopicky detekovaném CLE. Mikroskopický nález IM bez klinického údaje o CLE by měl být označen jako „Barrettova sliznice“.
K neoplastické transformaci podle tradičního pohledu dochází v zóně IM, nové poznatky však svědčí pro možnou dominantní úlohu CDX2+CM v karcinogenezi, přičemž nelze vyloučit možnost kauzální asociace s alkalizací obsahu gastroezofageálního refluxu při farmakoterapii inhibitory protonové pumpy.
ZKRATKY
CDX2+CM - CDX2-pozitivní kardiacká sliznice
CLE - kolumnární metaplázie sliznice jícnu (columnar-lined esophagus)
CM - kardiacká sliznice (cardiac mucosa)
GEJ - gastroezofageální junkce
GERD - gastroezofageální refluxní choroba (gastroesophageal reflux disease)
GIT - gastrointestinální trakt
HGIEN - intraepiteliální neoplázie (dysplázie) vysokého stupně (high grade intraepithelial neoplasia)
IEN - intraepitelální neoplázie, dysplázie
IM - intestinální metaplázie LES - svěrač kardie, dolní jícnový svěrač (lower esophageal sphincter)
LGIEN - intraepiteliální neoplázie (dysplázie) nízkého stupně (low grade intraepithelial neoplasia)
ME - vrstevnatý epitel (multilayered epithelium)
OCM - oxyntokardiacká sliznice (oxyntocardiac mucosa)
SM - dlaždicový epitel (squamous mucosa)
SOG - patologická kolumnární sliznice mezi SM a OM (squamo-oxyntic gap)
PODĚKOVÁNÍ
Práce vznikla za částečné podpory výzkumného projektu SVV 260171/2015 a grantu IGA NT14227.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13,
305 99 Plzeň
tel.: +420377402523
e-mail: DAUM@fnplzen.cz
Sources
1. Jackson C. Peptic ulcer of the esophagus. JAMA 1929; 92(5): 369-372.
2. Findlay L, Kelly AB. Congenital shortening of the oesophagus and the thoracic stomach resulting therefrom. Proc R Soc Med 1931; 24(11): 1561-1578.
3. Barrett NR. Chronic peptic ulcer of the oesophagus and ‘oesophagitis’. Br J Surg 1950; 38(150): 175-182.
4. Barrett NR. The lower esophagus lined by columnar epithelium. Surgery 1957; 41(6): 881 - 894.
5. Paull A, Trier JS, Dalton MD, Camp RC, Loeb P, Goyal RK. The histologic spectrum of Barrett’s esophagus. N Engl J Med 1976; 295(9): 476-480.
6. Haggitt RC, Tryzelaar J, Ellis FH, Colcher H. Adenocarcinoma complicating columnar epithelium-lined (Barrett’s) esophagus. Am J Clin Pathol 1978; 70(1): 1-5.
7. Reid BJ, Weinstein WM. Barrett’s esophagus and adenocarcinoma. Annu Rev Med 1987; 38(38): 477-492.
8. Hayward J. The lower end of the oesophagus. Thorax 1961; 16(1): 36-41.
9. Chandrasoma PT, Der R, Ma Y, Dalton P, Taira M. Histology of the gastroesophageal junction: an autopsy study. Am J Surg Pathol 2000; 24(3): 402-409.
10. Chandrasoma PT, Lokuhetty DM, Demeester TR, et al. Definition of histopathologic changes in gastroesophageal reflux disease. Am J Surg Pathol 2000; 24(3): 344-351.
11. Der R, Tsao-Wei DD, Demeester T, et al. Carditis: a manifestation of gastroesophageal reflux disease. Am J Surg Pathol 2001; 25(2): 245-252.
12. Chandrasoma P, Wijetunge S, Ma Y, Demeester S, Hagen J, Demeester T. The dilated distal esophagus: a new entity that is the pathologic basis of early gastroesophageal reflux disease. Am J Surg Pathol 2011; 35(12): 1873-1881.
13. Chandrasoma P, Makarewicz K, Wickramasinghe K, Ma Y, Demeester T. A proposal for a new validated histological definition of the gastroesophageal junction. Hum Pathol 2006; 37(1): 40-47.
14. Chandrasoma PT, Der R, Dalton P, et al. Distribution and significance of epithelial types in columnar-lined esophagus. Am J Surg Pathol 2001; 25(9): 1188-1193.
15. Owen DA. Gastritis and carditis. Mod Pathol 2003; 16(4): 325-341.
16. Kilgore SP, Ormsby AH, Gramlich TL, et al. The gastric cardia: fact or fiction? Am J Gastroenterol 2000; 95(4): 921-924.
17. Zhou H, Greco MA, Daum F, Kahn E. Origin of cardiac mucosa: ontogenic consideration. Pediatr Dev Pathol 2001; 4(4): 358-363.
18. Glickman JN, Fox V, Antonioli DA, Wang HH, Odze RD. Morphology of the cardia and significance of carditis in pediatric patients. Am J Surg Pathol 2002; 26(8): 1032-1039.
19. Derdoy JJ, Bergwerk A, Cohen H, Kline M, Monforte HL, Thomas DW. The gastric cardia: to be or not to be? Am J Surg Pathol 2003; 27(4): 499-504.
20. Sarbia M, Donner A, Gabbert HE. Histopathology of the gastroesophageal junction: a study on 36 operation specimens. Am J Surg Pathol 2002; 26(9): 1207-1212.
21. Hadravská Š, Chlumská A, Boudová L, Mukenšnabl P, Šulc M. The histological findings in the gastroesophageal junction of fetuses. Cesk Patol 2004; 40(1): 7-10.
22. Chandrasoma P. Cardiac mucosal changes in a pediatric population. Am J Surg Pathol 2003; 27(2): 274-275.
23. Chandrasoma PT, Der R, Ma Y, Peters J, Demeester T. Histologic classification of patients based on mapping biopsies of the gastroesophageal junction. Am J Surg Pathol 2003; 27(7): 929-936.
24. Park YS, Park HJ, Kang GH, Kim CJ, Chi JG. Histology of gastroesophageal junction in fetal and pediatric autopsy. Arch Pathol Lab Med 2003; 127(4): 451-455.
25. Odze RD. Unraveling the mystery of the gastroesophageal junction: a pathologist’s perspective. Am J Gastroenterol 2005; 100(8): 1853-1867.
26. Chandrasoma P, Wickramasinghe K, Ma Y, DeMeester T. Adenocarcinomas of the distal esophagus and “gastric cardia” are predominantly esophageal carcinomas. Am J Surg Pathol 2007; 31(4): 569-575.
27. Wijetunge S, Ma Y, DeMeester S, Hagen J, DeMeester T, Chandrasoma P. Association of adenocarcinomas of the distal esophagus, “gastroesophageal junction,” and “gastric cardia” with gastric pathology. Am J Surg Pathol 2010; 34(10): 1521-1527.
28. Fiocca R, Mastracci L, Riddell R, et al. Development of consensus guidelines for the histologic recognition of microscopic esophagitis in patients with gastroesophageal reflux disease: the Esohisto project. Hum Pathol 2010; 41(2): 223-231.
29. Chlumská A, Boudová L, Beneš Z, Zámečník M. Histopathologic changes in gastroesophageal reflux disease. A study of 126 bioptic and autoptic cases. Cesk Patol 2007; 43(4): 142-147.
30. Langner C, Schneider NI, Plieschnegger W, et al. Cardiac mucosa at the gastro-oesophageal junction: indicator of gastro-oesophageal reflux disease? Data from a prospective central European multicentre study on histological and endoscopic diagnosis of oesophagitis (histoGERD trial). Histopathology 2014; 65(1): 81-89.
31. Schneider NI, Plieschnegger W, Geppert M, et al. Validation study of the Esohisto consensus guidelines for the recognition of microscopic esophagitis (histoGERD Trial). Hum Pathol 2014; 45(5): 994-1002.
32. Leape LL, Bhan I, Ramenofsky ML. Esophageal biopsy in the diagnosis of reflux esophagitis. J Pediatr Surg 1981; 16(3): 379-384.
33. Knuff TE, Benjamin SB, Worsham GF, Hancock JE, Castell DO. Histologic evaluation of chronic gastroesophageal reflux. An evaluation of biopsy methods and diagnostic criteria. Dig Dis Sci 1984; 29(3): 194-201.
34. Chandrasoma P, Wijetunge S, Demeester SR, Hagen J, Demeester TR. The histologic squamo-oxyntic gap: an accurate and reproducible diagnostic marker of gastroesophageal reflux disease. Am J Surg Pathol 2010; 34(11): 1574-1581.
35. Shields HM, Zwas F, Antonioli DA, Doos WG, Kim S, Spechler SJ. Detection by scanning electron microscopy of a distinctive esophageal surface cell at the junction of squamous and Barrett’s epithelium. Dig Dis Sci 1993; 38(1): 97-108.
36. Boch JA, Shields HM, Antonioli DA, Zwas F, Sawhney RA, Trier JS. Distribution of cytokeratin markers in Barrett’s specialized columnar epithelium. Gastroenterology 1997; 112(3): 760-765.
37. Shields HM, Rosenberg SJ, Zwas FR, Ransil BJ, Lembo AJ, Odze R. Prospective evaluation of multilayered epithelium in Barrett’s esophagus. Am J Gastroenterol 2001; 96(12): 3268-3273.
38. Glickman JN, Chen YY, Wang HH, Antonioli DA, Odze RD. Phenotypic characteristics of a distinctive multilayered epithelium suggests that it is a precursor in the development of Barrett’s esophagus. Am J Surg Pathol 2001; 25(5): 569-578.
39. Wieczorek TJ, Wang HH, Antonioli DA, Glickman JN, Odze RD. Pathologic features of reflux and Helicobacter pylori-associated carditis: a comparative study. Am J Surg Pathol 2003; 27(7): 960-968.
40. Glickman JN, Spechler SJ, Souza RF, Lunsford T, Lee E, Odze RD. Multilayered epithelium in mucosal biopsy specimens from the gastroesophageal junction region is a histologic marker of gastroesophageal reflux disease. Am J Surg Pathol 2009; 33(6): 818-825.
41. Krishnamurthy S, Dayal Y. Pancreatic metaplasia in Barrett’s esophagus. An immunohistochemical study. Am J Surg Pathol 1995; 19(10): 1172-1180.
42. Wang HH, Zeroogian JM, Spechler SJ, Goyal RK, Antonioli DA. Prevalence and significance of pancreatic acinar metaplasia at the gastroesophageal junction. Am J Surg Pathol 1996; 20(12): 1507-1510.
43. Takubo K, Vieth M, Honma N, et al. Ciliated surface in the esophagogastric junction zone: a precursor of Barrett’s mucosa or ciliated pseudostratified metaplasia? Am J Surg Pathol 2005; 29(2): 211-217.
44. Fitzgerald RC, di Pietro M, Ragunath K, et al. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut 2014; 63(1): 7-42.
45. Takubo K, Aida J, Naomoto Y, et al. Cardiac rather than intestinal-type background in endoscopic resection specimens of minute Barrett adenocarcinoma. Hum Pathol 2009; 40(1): 65-74.
46. Spechler SJ, Sharma P, Souza RF, Inadomi JM, Shaheen NJ. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus. Gastroenterology 2011; 140(3): 1084-1091.
47. Lukáš K, Bureš J, Drahoňovský V, et al. Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009. Vnitr Lek 2009; 55(10): 967-975.
48. Faller G, Borchard F, Ell C, et al. Histopathological diagnosis of Barrett’s mucosa and associated neoplasias: results of a consensus conference of the Working Group for Gastroenterological Pathology of the German Society for Pathology on 22 September 2001 in Erlangen. Virchows Arch 2003; 443(5): 597-601.
49. Chandrasoma P, Wijetunge S, DeMeester S, et al. Columnar-lined esophagus without intestinal metaplasia has no proven risk of adenocarcinoma. Am J Surg Pathol 2012; 36(1): 1-7.
50. Hahn HP, Blount PL, Ayub K, et al. Intestinal differentiation in metaplastic, nongoblet columnar epithelium in the esophagus. Am J Surg Pathol 2009; 33(7): 1006-1015.
51. McDonald SAC, Graham TA, Lavery DL, Wright NA, Jansen M. The Barrett´s gland in phenotype space. Cell Mol Gastroenterol Hepatol 2015; 1(1): 41-54.
52. Watanabe G, Ajioka Y, Takeuchi M, et al. Intestinal metaplasia in Barrett’s oesophagus may be an epiphenomenon rather than a preneoplastic condition, and CDX2-positive cardiac-type epithelium is associated with minute Barrett’s tumour. Histopathology 2015; 66(2): 201-214.
53. Lagergren J, Bergstrom R, Lindgren A, Nyren O. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 1999; 340(11): 825-831.
54. Hansel DE, Dhara S, Huang RC, et al. CDC2/ CDK1 expression in esophageal adenocarcinoma and precursor lesions serves as a diagnostic and cancer progression marker and potential novel drug target. Am J Surg Pathol 2005; 29(3): 390-399.
55. Shi XY, Bhagwandeen B, Leong AS. p16, cyclin D1, Ki-67, and AMACR as markers for dysplasia in Barrett esophagus. Appl Immunohistochem Mol Morphol 2008; 16(5): 447 - 452.
56. Duits LC, Phoa KN, Curvers WL, et al. Barrett’s oesophagus patients with low-grade dysplasia can be accurately risk-stratified after histological review by an expert pathology panel. Gut 2015; 64(5): 700-706.
57. Sangle NA, Taylor SL, Emond MJ, Depot M, Overholt BF, Bronner MP. Overdiagnosis of high-grade dysplasia in Barrett’s esophagus: a multicenter, international study. Mod Pathol 2015; 28(6): 758-765.
58. Khor TS, Alfaro EE, Ooi EM, et al. Divergent expression of MUC5AC, MUC6, MUC2, CD10, and CDX-2 in dysplasia and intramucosal adenocarcinomas with intestinal and foveolar morphology: is this evidence of distinct gastric and intestinal pathways to carcinogenesis in Barrett Esophagus? Am J Surg Pathol 2012; 36(3): 331-342.
59. Chlumská A, Mukenšnabl P, Waloschek T, Zámečník M. Dysplázie žaludku. Histologické typy a jejich význam. Kongresové noviny (32 český a slovenský gastroenterologický kongres) 2011; 32(2): 5.
60. Abraham SC, Krasinskas AM, Correa AM, et al. Duplication of the muscularis mucosae in Barrett esophagus: an underrecognized feature and its implication for staging of adenocarcinoma. Am J Surg Pathol 2007; 31(11): 1719-1725.
61. Estrella JS, Hofstetter WL, Correa AM, et al. Duplicated muscularis mucosae invasion has similar risk of lymph node metastasis and recurrence-free survival as intramucosal esophageal adenocarcinoma. Am J Surg Pathol 2011; 35(7): 1045-1053.
62. Holscher AH, Bollschweiler E, Schroder W, Metzger R, Gutschow C, Drebber U. Prognostic impact of upper, middle, and lower third mucosal or submucosal infiltration in early esophageal cancer. Ann Surg 2011; 254(5): 802-807.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2016 Issue 1-
All articles in this issue
- Skin cell response after jellyfish sting
- Postinfectious glomerulonephritis in adults: a hidden face of an old disease
- Serrated adenomas and carcinomas of the colon
- Morphology of the gastroesophageal reflux disease
- Pathology of non-reflux esophagitides
- Follicular and mantle cell lymphoma diagnosed in biopsies of gastroenterocolic region
- Hypoglycemia in a solitary fibrous tumor of the liver
- Clinicopathological correlations of the immunoprofile in diffuse large B-cell lymphoma NOS - a single institution’s experience
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Serrated adenomas and carcinomas of the colon
- Morphology of the gastroesophageal reflux disease
- Follicular and mantle cell lymphoma diagnosed in biopsies of gastroenterocolic region
- Skin cell response after jellyfish sting
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

