-
Medical journals
- Career
Mikrovaskulární denzita v lymfomech - hodnocení a klinický význam
: Pavla Veselá 1; Zbyněk Tonar 2; Ludmila Boudová 1
: Šiklův ústav patologie, Fakultní nemocnice a Lékařská fakulta UK v Plzni 1; Ústav histologie a embryologie a Biomedicínské centrum LF UK v Plzni 2
: Čes.-slov. Patol., 51, 2015, No. 2, p. 94-98
: Reviews Article
V posledních letech je u solidních nádorů i u lymfomů zaváděna do léčebných protokolů antiangiogenní terapie. To je jedním z důvodů, proč se podrobněji zkoumají parametry popisující nádorovou vaskularizaci, z nichž nejvýznamnější jsou mikrovaskulární denzita a imunohistochemická exprese VEGF (vascular endotelial growth factor) a jeho receptorů. Tento text shrnuje různé metody zjišťování mikrovaskulární denzity a prognostický vliv mikrovaskulární denzity u lymfomů.
Klíčová slova:
mikrovaskulární denzita - lymfom - prognóza
Nedílnou součástí nádorového růstu je aktivní angiogeneze v nádoru. Tento poznatek již začátkem sedmdesátých let popsal u solidních nádorů Folkman (1), dle něhož se prostou difúzí nádorová tkáň může živit jen do 1 - 2 mm in vivo a 2 - 4 mm in vitro. Pak je již zcela nutné vlastní cévní zásobení a tehdy dojde k tzv. angiogennímu přepnutí (angiogenní switch), kdy převáží angiogenní faktory nad antiangiogenními a dochází k novotvorbě cév. Hlavní příčinou spuštění tohoto procesu je tkáňová hypoxie. U hematologických malignit novotvorba cévních struktur probíhá podobně jako v jiných tkáních za pomoci dvou cest. Jednou z nich je vaskulogeneze, tj. migrace progenitorových endoteliálních buněk z kostní dřeně, které se následně diferencují do zralých endotelií. Tento způsob je nezávislý na preexistujících cévách. Druhým mnohem významnějším způsobem je angiogeneze, odpovídající pučení již existujících cév s migrací zralých endoteliálních buněk (2). Hlavním spouštěcím faktorem je hypoxie, dále např. cytokiny či růstové faktory jako PDGF (platelet derived growth factor), či bFGF (basic fibroblast growth factor). Při hypoxii se uplatňuje von Hippel-Lindauův gen, který napomáhá stabilizaci a následnému transportu transkripčního faktoru HIF-1 alfa (hypoxia inducible factor alpha) do jádra, kde se váže se specifickou sekvencí HRE (hypoxia response element) a tak stimuluje transkripci a navazující expresi VEGF (vascular endotelial growth factor), který je považován za hlavní angiogenní faktor. Jeho podtypy VEGF-A, VEGF-B a VEGF-E stimulují proliferaci a migraci endotelií a zvyšují cévní permeabilitu, zatímco VEGF-C a VEGF-D vedou k stimulaci lymfangiogeneze (2). VEGF není faktorem specifickým pro lymfatické uzliny s nádorem, nýbrž je exprimován i v normálních uzlinách (3,4). VEGF-A působí na endotel prostřednictvím receptorů VEGFR-1 (vascular endotelial growth factor receptor) a VEGFR-2 (5), které prostřednictvím své tyrosinkinázové aktivity spouštějí kaskádu intracelulárních informačních molekul („druhých poslů“). VEGFR-1 má pravděpodobně duální funkci a může se uplatňovat při podpoře, ale i útlumu angiogeneze, zatímco stimulace VEGFR-2 je považována za jednoznačně mitogenní faktor endotelií (6-9). Oba typy receptorů mohou být navíc v cílových tkáních tumoru zvýšeně externalizovány (up-regulace), což vede k vyšší senzitivitě na VEGF, nebo internalizovány (down-regulace), což snižuje odpověď na VEGF (6).
Nejrozšířenějším způsobem popisu míry angiogeneze v tkáni je mikrovaskulární denzita, o čemž svědčí mimo jiné více než 9000 publikací s heslem „microvessel density“ v databázi PubMed. Tato metoda je pro svou jednoduchost velmi oblíbená. Její aplikace a interpretace však má kromě výhod i některá omezení.
MIKROVASKULÁRNÍ DENZITA
Mikrovaskulární denzita (MVD) je velmi často používána s cílem popsat intenzitu angiogeneze ve tkáních, nejčastěji nádorových. Pojmu mikrocévy (angl. microvessels) odpovídají nejdrobnější cévy, tedy arterioly, metarterioly, prekapiláry, vlastní kapiláry, postkapiláry a venuly. Mikrovaskulární denzita pak odpovídá hustotě cévních profilů zastižených na řezu přepočtené na jednotku plochy tkáňového řezu nebo jeho analyzované části.
Problémem u mikrovaskulární denzity je způsob jejího stanovení, protože najít dvě studie u jednoho typu nádoru prováděné stejnou metodou s použitím shodné protilátky je spíše výjimkou než pravidlem.
Používané imunoprotilátky
Odlišnosti ve studiích jsou už při použití jednotlivých endoteliálních protilátek pro vyznačení cévních struktur. Lze použít buď panendoteliální markery či markery vážící se na aktivované/proliferující endotelie.
Z panendoteliálních markerů je nejužívanějším CD31. Jeho výhodou je, že nebarví lymfatické cévy. Naopak nevýhodou však může být, že reaguje i se zánětlivými buňkami jako jsou makrofágy, plazmocyty, neutrofily či lymfocyty, což může být problém u nádorů s výraznějším zánětlivým pozadím, obzvlášť při počítačové analýze obrazu. Dalším je CD34, u něhož jsou omezení v případě některých stromálních nádorů. U absolutních hodnot MVD stanovených imunoreakcí s protilátkou CD34 je při porovnání s CD31 třeba vzít v úvahu, že CD34 barví i část lymfatických cév, podobně jako další panendoteliální marker - faktor VIII. Omezením pro využití u faktoru VIII jsou také zjištění, že v některých orgánech chybí na části endoteliální populace, která není co do exprese imunohistochemicky využitelných povrchových molekul zcela homogenní (10,11). Studie porovnávající dva a více panendoteliálních markerů na sousedních řezech identickými bločky nádorové tkáně jsou vzácné (12) a nelze je bohužel zcela zobecňovat, protože mají vypovídací hodnotou omezenou na konkrétní orgán, na němž byly provedeny.
Druhou skupinou jsou markery vážící se na aktivované/proliferující endotelie. Příkladem je nestin (13) a CD 105 (endoglin) (14), které značí proliferující a nezralé endotelie. Způsobem zjištění míry proliferace endotelií může být také dvojité imunohistochemické barvení spojující proliferační marker Ki-67 a endoteliální marker (15).
Způsoby hodnocení MVD
Vlastní stanovení hodnoty MVD lze provést různými způsoby (10,11,15). Metoda tzv. hot spots, zvaná také podle Weidnera (16), je patrně nejužívanější. Je založena nejdříve na nalezení tzv. hot spots, tj. při malém zvětšení nalezení okrsků s nejvyšší mikrovaskulární denzitou, a v nich je pak v definované ploše při větším zvětšení spočítán počet drobných cévních prostor (jedno zorné pole při zvětšení 200x odpovídá ploše 0,74 mm2, u 400x 0,19 mm2). Kritériem pro započtení mikrocévy není přítomnost vlastního lumen (může kolabovat či být komprimováno při odběru či zpracování bločku) či erytrocytů, je to pouze imunohistochemická pozitivita vybraného endotelového markeru v endotelové buňce či jejich clusteru. Naopak cévy většího kalibru s přítomnosti hladké svaloviny ve stěně se již jako mikrocévy nezapočítávají. Tento způsob je používán jak při manuálním počítání jednotlivých mikrocév, tak při použití počítačové analýzy obrazu, kdy jsou jednotlivé tzv. hot spots manuálně nalezeny a teprve vyfocená zorná pole analyzuje počítač. Je nutno poznamenat, že tzv. hot spots se nacházejí především na periferii nádoru, MVD je nejvyšší při jeho kontaktu se zdravou tkání, směrem do centra se snižuje (11). Některé studie však upozorňují na nedostatečnou opakovatelnost subjektivního výběru těchto oblastí maximální vaskularizace (17-19). Mikrovaskulární denzita získaná analýzou tzv. hot spots je interpretována jako číselný popis zastoupení nejvíce prokrvených míst tumoru s nejvyšší novotvorbou cév (18). Charakter vzorců rozmístění mikrocév v tumorech (tzv. vascular pattern) může být však velmi heterogenní a takto získaná mikrovaskulární denzita nemusí vypovídat o nádoru jako celku, nýbrž o jeho biologicky nejaktivnějších oblastech s tím omezením, že nedokáže rozlišit poměrné zastoupení těchto center angiogeneze ve vyšetřovaném nádoru nebo jeho částce. Případy s několika izolovanými hot spots pak vedou ke stejnému číselnému výsledku jako tumor, jehož celé růstové čelo či dokonce celá periferie jeví zvýšenou neovaskularizaci.
Další možností využití počítačové analýzy při zjišťování hodnot MVD je počítání v systematicky náhodně vybraných arbitrárně stanovených zorných polích (18,20), tedy zorných polí v přesně stanovené vzdálenosti od sebe. Proto nejprve provádíme systematické vzorkování zorných polí v rámci řezu s cílem zajistit standardizovaný rozestup mezi snímanými zornými poli (obr. 1A). Po technické stránce lze systematický rozestup zorných polí v osách XY mikroskopického posuvu garantovat buďto pomocí mikroskopu s motorizovaným stolkem, nebo i manuálním posuvem o určitý počet zorných polí, což je v praxi úkon proveditelný s dostatečnou přesností. Tento způsob vzorkování zajistí, aby se jednotlivé oblasti řezu s mnohdy rozmanitou hustotou mikrocév podílely na výsledné hodnotě reprezentující celý řez vahou úměrnou četnosti svého výskytu v preparátu. K vlastnímu počítání cévních profilů v zorném poli lze pak s výhodou použít klasického počítacího rámečku, kde jsou počítačovým programem s interaktivní kontrolou odečítajícího nalézány profily odpovídající mikrocévám (obr. 1B) (18,21). Výsledky MVD získané počítačovou analýzou vybraných polí korelují s výsledky získanými manuálním počítáním jak u metody hot spots (22), tak u metody systematicky náhodně vybraných polí (20). Obecně je hlavní výhodou počítačové analýzy obrazu časová úspora a omezení subjektivních vlivů jednotlivých odečítajících. Je zde i možnost získat další údaje o vaskularitě v daném zorném poli, jmenovitě o ploše či průměru cévních lumen (23). Je nutné poznamenat, že zapojení obrazové analýzy klade vysoké nároky na uniformitu barvení a eliminaci artefaktů.
1. Stanovení mikrovaskulární denzity pomocí metody systematického náhodného výběru zorných polí v definované oblasti. <b>A</b>: vzorkování v mantle cell lymfomu (MCL) infiltrujícím sliznici tlustého střeva (hematoxylin-eosin, zvětšení 50x). <b>B</b>: označení počítaných profilů mikrocév v jednom zorném poli MCL v lymfatické uzlině s využitím počítacího rámečku pro tzv. nevychýlené počítání (42), který sestává ze zakázaných linií (červeně, protínající cévní profily nejsou započítány) a povolených linií (zeleně přerušovaně, dotýkající se cévní profily jsou započítány) (protilátka CD34, zvětšení 200x). 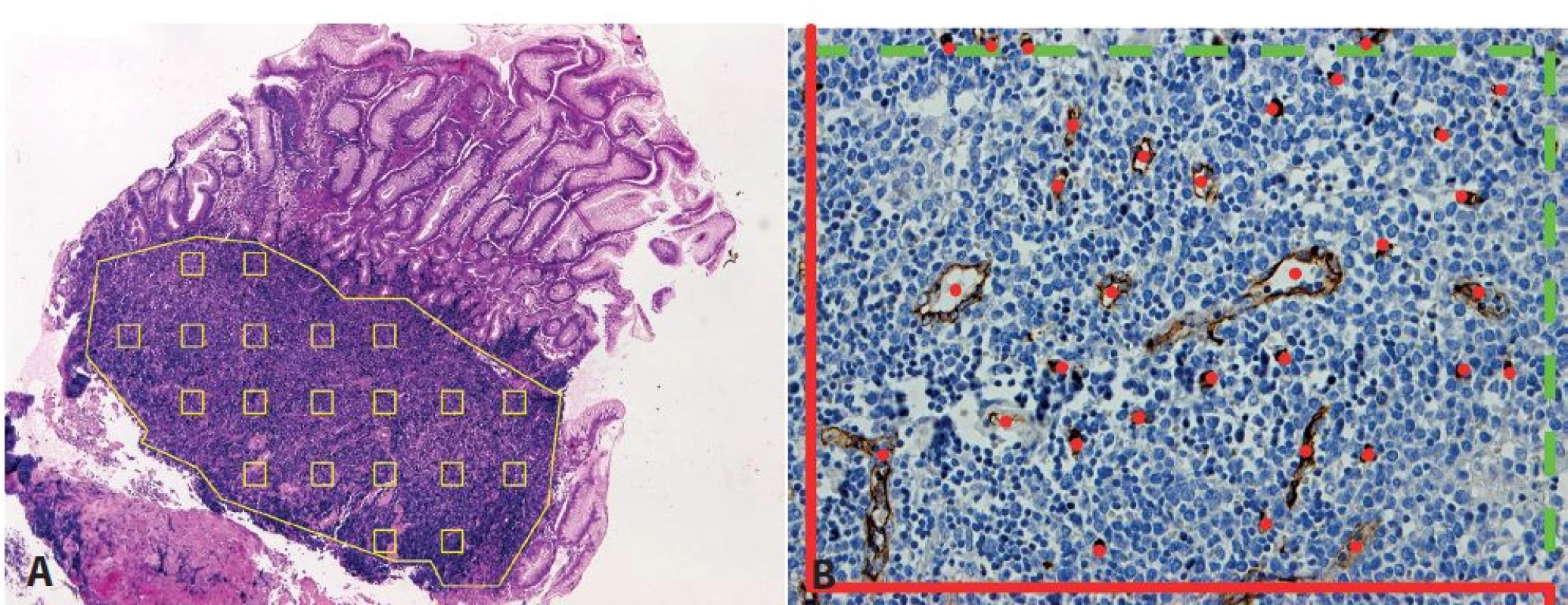
Dalším způsobem počítačové analýzy obrazu je skenování celého preparátu a počítání mikrocév na celé ploše s následným přepočtením na jednotku plochy (24), kde je vytvořen virtuální řez pomocí skeneru pro digitalizaci skla, který je následně celý pomocí programů pro analýzu obrazu vyhodnocen. Tato strategie se nazývá „whole mount pathology“ či „whole slide imaging“ a umožňuje systematické vyšetření celé plochy řezu tak, aby i zde měla data získaná z jednotlivých oblastí váhu úměrnou svému zastoupení (25). Analýzou po sobě následujících řezů je možné rovněž vytvořit trojrozměrný obraz cévních struktur, z něhož je možné zjistit procentuální objemové zastoupení cév na objemu vyšetřované tkáně (mikrovaskulární objem)(26). Trojrozměrné rekonstrukce cévních stromů nabízejí sice současně i zajímavé vizualizace, svou pracností se však obvykle vymykají požadavkům rutinního odečtu mikrocév.
Další způsobem zjišťování hodnot MVD je tzv. Chalkley count. V tomto případě se po nalezení oblastí obsahující nejvíce drobných cév použije speciální okulár s mřížkou s 25 náhodně rozloženými body na velkém zvětšení 200 - 250x, ten je pak rotován tak, aby co nejvíce bodů bylo na stěně cév či uvnitř jejich lumen a tyto body jsou pak spočítány (obr. 2), tato hodnota je pak použita pro porovnání mezi jednotlivými vzorky. Tento způsob spíše popisuje míru plochy cév v daném zorném poli než jejich hustotu (27).
2. Projekce Chalkley count mřížky na mantle cell lymfom (protilátka CD34, zvětšení 200x). 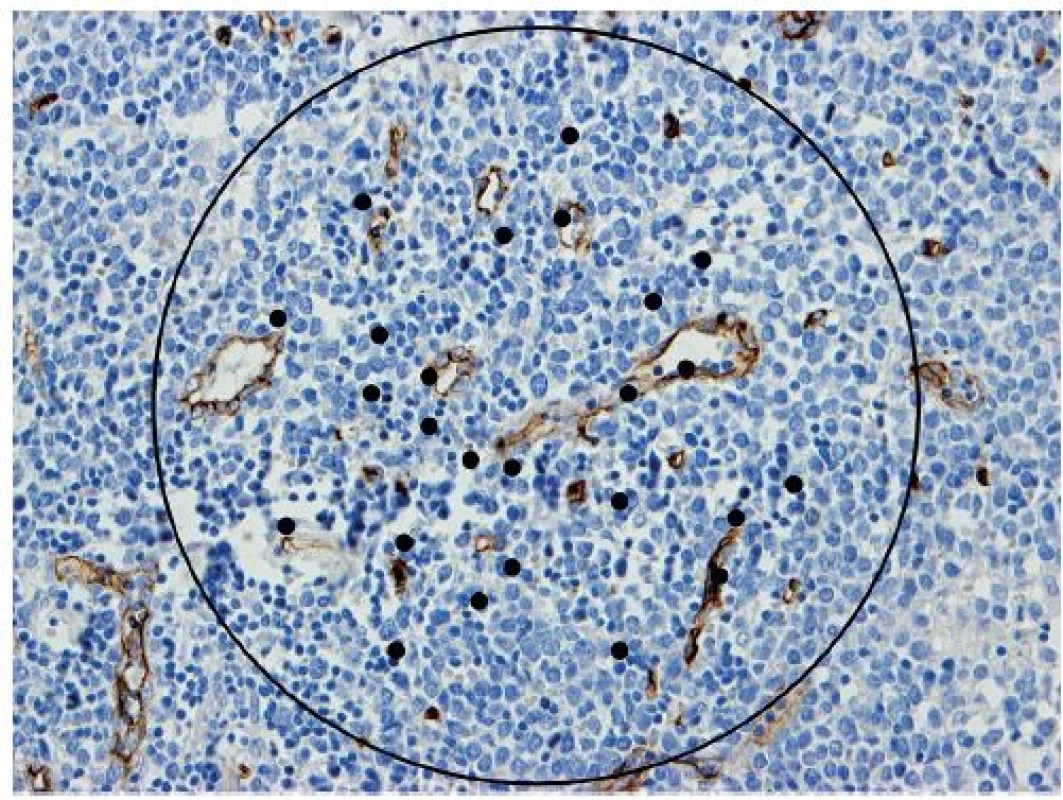
Výjimečně používanou metodou je semikvantitativní stanovení MVD, tedy určení nízké, střední a vysoké MVD dle subjektivního hodnocení posuzovatele. Hlavním problémem tohoto způsobu je velmi subjektivní hodnocení s vysokou variabilitou mezi posuzovateli, naopak za výhodu lze považovat nízkou časovou náročnost. U solidních nádorů byla prokázána korelace mezi kvantitativní a semikvantitativní metodou (28).
PROGNOSTICKÝ VLIV MIKROVASKULÁRNÍ DENZITY V LYMFOMECH
Mikrovaskulární denzita je dle Ribattiho výrazně vyšší u lymfomů s nízkým stupněm malignity než u zdravé tkáně a ještě výrazně vyšší u lymfomů s vysokým stupněm malignity (29). Naopak Ridell popisuje, že mimo chronické lymfatické leukémie jsou hodnoty MVD ostatních lymfomů nižší než u lymfadenitidy (30). Jeho výsledkům jsou podobná zjištění od solidních nádorů, kdy u mnohých z nich (prs, mozek, plíce, tlusté střevo) je hodnota MVD nižší než u původní nenádorové tkáně (31). Za důvod se považuje fakt, že hodnoty MVD jsou nižší proto, že nádorová tkáň má nižší spotřebu kyslíku než normální tkáň (32).
U jednotlivých typů lymfomů lze ze stávajících studií ohledně hodnot mikrovaskulární denzity učinit závěr, že agresivnější lymfomy mívají vyšší absolutní hodnotu MVD. Jmenovitě Tzankov pomocí protilátky CD34 (33) zjišťuje nejvyšší hodnotu MVD u difúzního velkobuněčného B-lymfomu (DLBCL), dalšími v pořadí jsou folikulární lymfom, lymfom z plášťových buněk (mantle cell lymfom, MCL), lymfom z malých B-lymfocytů/chronická lymfatická leukémie (B-SLL/B-CLL). Jorgensen (27) s využitím protilátky CD34 zjišťuje, že nejvyšší hodnotu MVD má periferní T lymfom (PTCL), střední hodnotu DLBCL a nejnižší má folikulární lymfom, a to v intrafolikulární oblasti, je zajímavé, že když byly hodnoty MVD zjišťovány v interfolikulárních oblastech, byly hodnoty výrazně vyšší než jsou hodnoty MVD u PTCL. Výsledky byly v této studii shodné, ať byla použita Chalkley count metoda či metoda hot spots. Naproti tomu Ridell pomocí imunoprotilátky CD34 popisuje vyšší MVD u chronické lymfatické leukémie, zatímco agresivnější lymfomy (MCL, DLBCL) ji mají nižší (30).
Problémem při porovnání studií věnovaných prognostickému vlivu MVD u jednotlivých typů lymfomů je jednak různý způsob zjišťování MVD a také použití různých protilátek.
Toto lze dokumentovat u DLBCL, kde jedna studie byla provedena pomocí protilátky CD34 (34), zatímco druhá pomocí CD31 (35). V první studii (34) bylo zjištěno, že zvýšené hodnoty MVD jsou spojeny s horším přežitím (P = 0,047), avšak nebylo možné stanovit jasný předěl v hodnotě MVD mezi skupinami s lepší a horší prognózou, při rozdělení dle mediánu nebyl rozdíl mezi skupinami prokázán u celkového přežití (medián přežití 77 a 48 měsíců, P = 0,065), ani u doby přežití bez progrese (progression free survival - PFS) (medián PFS 47 a 28 měsíců, P = 0,17). Naproti tomu, ve druhé studii (35) se případy dělily dle mediánu MVD a je zde vliv těchto skupin MVD na 4 leté celkové přežití (78 resp. 54 %, P = 0,001) a 4 leté PFS (65 resp. 48 %, P = 0,048). Přestože v obou publikacích byl prokázán negativní vliv vyšších hodnot MVD na přežití pacientů, výsledky obou studií jsou vzhledem k parametrům vzájemně neporovnatelné.
V případě klasického Hodgkinova lymfomu (většina případů odpovídala variantě nodulární skleróza) byla hodnota MVD zjišťována pomocí protilátky CD34 (36). Případy byly rozděleny dle mediánu, u případů s nízkou MVD je 5leté přežití 94%, u vysoké MVD 84% (P = 0,0397).
V případě folikulárního lymfomu byla publikována studie prováděná pomocí protilátky CD34 (37), kde byly případy rozděleny na třetí tercil a zbývající část případů. V případě 3. tercilu dle hodnot MVD je lepší celkové přežití (94 vs. 50 měsíců, P = 0,03) i PFS (47 vs. 13 měsíců, P = 0,02). Naopak ve studii s použitím protilátky CD31 (38) je u případů s vyšší MVD horší celkové přežití i PFS.
U chronické lymfatické leukémie v kostní dřeni nebyl ve 2 studiích pomocí faktoru VIII či CD34 zjištěn prognostický vliv MVD, pouze hodnoty MVD zjištěné pomocí CD34 jsou významně vyšší než hodnoty získané pomocí faktoru VIII (39,40).
V případě lymfomu z plášťových buněk byla studie prováděna pomocí imunoprotilátky proti CD34 při využití počítačové analýzy náhodně vybraných 20 polí, prognostický vliv MVD byl zjištěn pouze u celkového přežití u skupiny pacientů léčených konvenční terapií (P = 0,04), nikoli u pacientů s intenzivní terapií ani u celého souboru pacientů z populační studie (21).
MIKROVASKULÁRNÍ DENZITA V HODNOCENÍ ÚČINNOSTI ANTIANGIOGENNÍ TERAPIE
U MVD se v případě aplikace antiangiogenní terapie nabízí také možnost využít ji jako faktor ukazující efektivitu této léčby. Při tomto použití roste význam hodnocení založeného na kvantifikaci celého řezu tak, aby statistická váha různých oblastí nádoru byla úměrná jejich zastoupení na řezu (25). Je vhodné mít na paměti, že MVD je číselným zlomkem, přičemž při antiangiogenní terapii může být ovlivněn jak jeho čitatel (množství cév), tak jmenovatel (plocha řezu, v níž se tyto cévy vyskytují). Například úbytek cév provázený proporcionálním zmenšením tumoru vyústí v nezměněnou MVD, přestože terapeutického ovlivnění mohlo být částečně dosaženo. U nádorů obsahujících složku, která z principu není nositelem vaskularizace (epitelová složka karcinomů), se do výsledné MVD promítá i poměr mezi epitelovými nádorovými buňkami a nádorovým vaskularizovaným stromatem. Tento aspekt sice u lymfomů odpadá, ale při interpretaci dat MVD je vhodné mít na paměti, že MVD nepopisuje vaskulární inhibici nezávisle na ostatním prostředí, ale je to spíše komplex změn ovlivněný iniciální vaskulární supresí a následně interakcí mezi vaskulárními a nádorovými elementy. Při podání antiangiogenní léčby totiž nejdříve dochází k inhibici, případně eliminaci kapilár, následované eliminací nádorových buněk a celý tento proces ovlivňuje hodnoty MVD. Nejdříve dochází k jejich rychlejšímu poklesu a později se pokles hodnot MVD v odebraných vzorcích během léčby zpomaluje. U některých nádorů může dojít po ukončení terapie k zvýšení hodnot MVD na předterapeutické hodnoty, přestože efekt antiangiogenní léčby u pacienta je zdokumentován, a to v případech, kdy terapie významně nenaruší metabolické potřeby či produkci angiogenních faktorů nádorových buněk (32). U solidních nádorů se ukazuje, že efekt antiangiogenní terapie se významněji neliší u případů s nízkou ani vysokou hodnotou MVD nádoru. Jen je popsáno, že při poklesu MVD ve vzorku z doby terapie je terapie efektivní (11), avšak pokud k poklesu nedochází či naopak dochází k zvýšení hodnoty MVD, vůbec to nevylučuje efektivitu terapie (32). Tento jev byl mimo jiné popsán při použití thalidomidu u mnohočetného myelomu, kde byl patrný významný pokles MVD pouze u části případů s terapeutickým efektem (41). U lymfomů tyto poterapeutické změny ještě nebyly podrobněji zkoumány.
ZÁVĚR
MVD je v případě mnoha hematologických malignit prokázán jako další prognostický faktor. Problémem je, že u většiny typů nádorových onemocnění jsou k dispozici pouze jedna či dvě studie, tedy praktické využití je třeba podrobněji a rozsáhleji studovat a také stanovit standardně opakovatelný a rychlý způsob, jak hodnotit MVD v denní praxi patologa. Pro hodnocení efektivity antiangiogenní léčby se stanovování hodnot během a po terapii dosud nejeví jako přínosné, stejně jako pro výběr pacientů vhodných k antiangiogenní léčbě.
PODĚKOVÁNÍ
Práce byla podpořena projektem ED2.1.00/03.0076 Evropského fondu pro regionální rozvoj, grantem Interní grantové agentury Ministerstva zdravotnictví ČR NT 12193-5 a částečně financována projektem PRVOUK P36 Univerzity Karlovy v Praze.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Pavla Veselá
Šiklův ústav patologie
Dr. E. Beneše 13, 305 99 Plzeň
tel.: 377 402 294, fax: 377 402 634
e-mail: veselap@fnplzen.cz
Sources
1. Folkman J. Tumor angiogenesis factor. Cancer Res 1974; 34 : 2109-2113.
2. Klener P. Angiogeneze jako součást nádorového „ekosystému“ a možnosti jejího ovlivnění. Klin Onkol 2010; 23(1): 14-20.
3. Turley H, Scott PA, Watts VM, Bicknell R, Harris AL, Gatter KC. Expression of VEGF in routinely fixed material using a new monoclonal antibody VG1. J Pathol 1998; 186 : 313-318.
4. Wolfesberger B, Guija de Arespacohaga A, Willmann M, et al. Expression of vascular endothelial growth factor and its receptors in canine lymphomas. J Comp Pathol 2007; 137(1): 30-40.
5. Quinn TP, Peters KG, De Vries C, Ferrara N, Williams LT. Fetal liver kinase 1 is a receptor for vascular endothelial growth factor and is selectively expressed in vascular endothelium. Proc Natl Acad Sci USA 1993; 90 : 7533-7537.
6. Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9(6): 669-676.
7. Rahimi N. VEGFR-1 and VEGFR-2: two non-identical twins with a unique physiognomy. Front Biosci 2006; 11 : 818-829.
8. Roskoski R Jr. VEGF receptor-tyrosine kinases: structure and regulation. Biochem Biophys Res Commun 2008; 375 : 287-291.
9. Shibuya M. Differential roles of vascular endothelial growth factor receptor-1 and receptor-2 in angiogenesis. J Biochem Mol Biol 2006; 39 : 469-478.
10. Vermeulen PB, Gasparini G, Fox SB, et al. Quantification of angiogenesis in solid human tumours: an international consensus on the methodology and criteria of evaluation. Eur J Cancer 1996; 32A(14): 2474-2484.
11. Nico B, Benagiano V, Mangieri D, Maruotti N, Vacca A, Ribatti D. Evaluation of microvascular density in tumors: pro and contra. Histol Histopathol 2008; 23 : 601-607.
12. Norrby K, Ridell B. Tumour-type-specific capillary endothelial cell stainability in malignant B-cell lymphomas using antibodies against CD31, CD34 and Factor VIII. AMPIS 2003; 111 : 483-489.
13. Tichý M, Tichá V, Ščudla V, Šváchová M, Zapletalová J. Analýza angiogeneze v kostní dřeni u plazmocytárního myelomu. Cesk Patol 2010; 46(1): 15-19.
14. Sugita Y, Takase Y, Mori D, Tokunaga O, Nakashima A, Shigemori M. Endoglin (CD 105) is expressed on endothelial cells in the primary central nervous system lymphomas and correlates with survival. J Neurooncol 2007; 82 : 249-256.
15. Vermeulen PB, Gasparini G, Fox SB, et al. Second international consensus on the methodology and criteria of evaluation of angiogenesis quantification in solid human tumours. Eur J Cancer 2002; 38 : 1564-1579.
16. Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis - correlation in invasive breast carcinoma. N Engl J Med 1991; 324 : 1-8.
17. Fox SB, Harris AL. Histological quantitation of tumour angiogenesis. AMPIS 2004; 112(7-8): 413-430.
18. Tonar Z, Egger GF, Witter K, Wolfesberger B. Quantification of microvessels in canine lymph nodes. Microsc Res Tech 2008; 71 : 760-772.
19. Preusser M, Heinzl H, Gelpi E, et al. Histopathologic assessment of hot-spot microvessel density and vascular patterns in glioblastoma: Poor observer agreement limits clinical utility as prognostic factors-A translational research project of the European Organization for Research and Treatment of Cancer Brain Tumor Group. Cancer 2006; 107 : 162-170.
20. Brawer MK, Deering RE, Brown M, Preston SD, Bigler SA. Predictors of pathologic stage in prostatic carcinoma. The role of neovascularity. Cancer 1994; 73 : 678-687.
21. Veselá P, Tonar Z, Šálek D, et al. Microvessel density of mantle cell lymphoma. A retrospective study of its prognostic role and the correlation with the Ki-67 and the mantle cell lymphoma international prognostic index in 177 cases. Virchows Arch 2014; 465(5): 587-597.
22. Rana C, Sharma S, Agrawal V, Singh U. Bone marrow angiogenesis in multiple myeloma and its correlation with clinicopathological factors. Ann Hematol 2010; 89 : 789-794.
23. Kašparová P, Smolej L. Angiogeneze v kostní dřeni u pacientů s chronickou lymfocytární leukémií. Cesk Patol 2007; 43(2): 50–58.
24. Chantrain CF, DeClerck YA, Groshen S, McNamara G. Computerized quantification of tissue vascularization using high-resolution slide scanning of whole tumor sections. J Histochem Cytochem 2003; 51(2): 151-158.
25. Liu W, Xu J, Wang M, Wang Q, Bi Y, Han M. Tumor-derived vascular endothelial growth factor (VEGF)-a facilitates tumor metastasis through the VEGF-VEGFR1 signaling pathway. Int J Oncol 2011; 39(5): 1213-1220.
26. Liu YA, Pan ST, Hou YC, et al. 3-D Visualization and Quantitation of Microvessels in Transparent Human Colorectal Carcinoma. PLoS One 2013; 8(11): e81857.
27. Jorgensen JM, Sorensen FB, Bendix K, et al. Angiogenesis in non-Hodgkin‘s lymphoma: clinico-pathological correlations and prognostic significance in specific subtypes. Leuk Lymphoma 2007; 48(3): 584-595.
28. Fox SB, Leek RD, Weekes MP, Whitehouse RM, Gatter KC, Harris AL. Quantitation and prognostic value of breast cancer angiogenesis: comparison of microvessel density, chalkley count, and computer image analysis. J Pathol 1995; 177(3): 275-283.
29. Ribatti D, Vacca A, Nico B, Fanelli M, Roncali L, Dammacco F. Angiogenesis spectrum in the stroma of B-cell non-Hodgkin‘s lymphomas. An immunohistochemical and ultrastructural study. Eur J Haematol 1996; 56(1-2): 45-53.
30. Ridell B, Norrby K. Intratumoral microvascular density in malignant lymphomas of B-cell origin. AMPIS 2001; 109 : 66-72.
31. Eberhard A, Kahlert S, Goede V, Hemmerlein B, Plate KH, Augustin HG. Heterogeneity of angiogenesis and blood vessel maturation in human tumors: implications for antiangiogenic tumor therapies. Cancer Res 2000; 60(5): 1388-1393.
32. Hlatky L, Hahnfeldt P, Folkman J. Clinical application of antiangiogenic therapy: microvessel density, what it does and doesn’t tell us. J Natl Cancer Inst 2002; 94(12): 883-893.
33. Tzankov A, Heiss S, Ebner S, et al. Angiogenesis in nodal B cell lymphomas: a high throughput study. J Clin Pathol 2007; 60 : 476-482.
34. Gratzinger D, Zhao S, Tibshirani RJ, et al. Prognostic significance of VEGF, VEGF receptors, and microvessel density in diffuse large B cell lymphoma treated with anthracycline-based chemotherapy. Lab Invest 2008; 88 : 38-47.
35. Cardesa-Salzmann TM, Colomo L, Gutierrez G, et al. High microvessel density determines a poor outcome in patients with diffuse large B-cell lymphoma treated with rituximab plus chemotherapy. Haematologica 2011; 96(7): 996-1001.
36. Korkolopoulou P, Thymara I, Kavantzas N, et al. Angiogenesis in Hodgkin’s lymphoma: a morphometric approach in 286 patients with prognostic implications. Leukemia 2005; 19 : 894-900.
37. Koster A, van Krieken JH, MacKenzie MA, et al. Increased vascularization predicts favorable outcome in follicular lymphoma. Clin Cancer Res 2005; 11 : 154-161.
38. Taskinen M, Jantunen E, Kosma VM, Bono P, Karjalainen-Lindsberg ML, Leppä S. Prognostic impact of CD31-positive microvessel density in follicular lymphoma patients treated with immunochemotherapy. Eur J Cancer 2010; 46(13): 2506-2512.
39. Smolej L, Kašparová P. Choice of endothelial marker is crucial for assessment of bone marrow microvessel density in chronic lymphocytic leukemia. AMPIS 2008; 116(12): 1058-1062.
40. Antic D, Jovanovic MP, Fekete MD, Cokic V. Assessment of bone marrow microvessel density in chronic lymphocytic leukemia. Appl Immunohistochem Mol Morphol 2010; 18(4): 353-356.
41. Singhal S, Mehta J, Desikan R, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341(21): 1565-1571.
42. Gundersen HJG. Notes on the estimation of numerical density of arbitrary particles. The edge effects. J Microsc 1977; 111 : 219-223.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2015 Issue 2-
All articles in this issue
- Molecular pathology of endometrial carcinoma – a review
- Practical comments on examination of placenta in the second and third trimester of gravidity
- Unusual lung finding of massive alveolar filling with foamy macrophages in congenital epidermolysis bullosa after amnion fluid aspiration in 15-day-old newborn without any clinical signs of respiratory impairment
- Microvascular density in lymphomas - evaluation methods and clinical impact
- EGFR in triple negative breast carcinoma: significance of protein expression and high gene copy number
- Celiac disease-like enteropathy due to antihypertensive therapy with the angiotensin-II receptor type 1 inhibitor eprosartan
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Practical comments on examination of placenta in the second and third trimester of gravidity
- Molecular pathology of endometrial carcinoma – a review
- EGFR in triple negative breast carcinoma: significance of protein expression and high gene copy number
- Unusual lung finding of massive alveolar filling with foamy macrophages in congenital epidermolysis bullosa after amnion fluid aspiration in 15-day-old newborn without any clinical signs of respiratory impairment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

