-
Medical journals
- Career
Imunofenotypizace průtokovou cytometrií v patologii
: Petra Manďáková; Jarmila Čandová
: Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole, Praha
: Čes.-slov. Patol., 49, 2013, No. 4, p. 126-130
: Review articles
Průtoková cytometrie je moderní analytická metoda používaná v klinických i výzkumných laboratořích k imunofenotypizaci vybraných buněčných subpopulací v suspenzi (periferní krve, aspirátu kostní dřeně, mozkomíšního moku atd., ale i buněčné suspenzi získané z nefixovaného solidního tumoru). Poskytuje současně informace o četných povrchových nebo intracelulárních znacích analyzovaných elementů. V klinické praxi k tomu využívá fluorescenčních monoklonálních protilátek proti povrchovým nebo intracelulárním antigenům, které jsou asociovány s určitým typem buněk (T-lymfocyty, B-lymfocyty, apod.), jejím vývojovým stádiem nebo monoklonalitou (např. lehké řetězce povrchových imunoglobulinů).
Pravděpodobně nejširšího využití dosáhla metoda v diagnostice hematologických malignit, kde právě rychlá a přesná diagnostika dává lékaři stěžejní informace ke správnému stanovení diagnózy a k výběru optimální léčby, následně lze takřka v reálném čase sledovat efekt léčby.Klíčová slova:
průtoková cytometrie – imunofenotypizace – non-Hodgkinské lymfomy
Průtoková cytometrie je laboratorní metoda používaná pro měření různých parametrů buněk. Jedná se o bioanalytickou metodu, která spojuje principy fluorescenční mikroskopie a hematologického analyzátoru. Je využitelná v mnoha vědeckých disciplínách. Největší uplatnění však našla v medicíně a biologii.
S myšlenkou průtokové cytometrie nás seznamuje v roce 1934 Andrew Moldavan, ovšem jeho prototyp zařízení nebyl nikdy sestrojen. Průtoková cytometrie se zrodila v roce 1949 díky Wallace H. Coulteru, který zkonstruoval přístroj schopný počítat krevní buňky v proudícím roztoku. Na principu Coulterova counteru vyvinul Mack Fulwyler a Marvin Van Dilla z Los Alamos National Laboratory první průtokový cytometr, který separoval částice podle jejich velikosti (1-4). Tento přístroj byl posléze zdokonalen doplněním detektorů fluorescence a byl představen Leonardem Herzenbergem a jeho pracovní skupinou ze Stanfordské Univerzity jako první funkční FACS (flurescence-activated cell sorter) (3,5).
PRINCIP METODY
Termín „průtoková cytometrie“ je používán od roku 1976. Cytometrie umožňuje analyzovat v krátkém čase velký počet částic a cytometrická data dovolují statistické zhodnocení jednotlivých buněčných subpopulací zejména podle relativní buněčné velikosti, granularity a intenzity fluorescenčního signálu pro různé testované vlastnosti díky použití vybraných specifických fluorescenčně značených protilátek (6-13).
Průtoková cytometrie funguje na principu hydrodynamické fokusace. Jednotlivé buňky v izotonickém roztoku (nosná tekutina, tzv. sheat fluid) protékají velmi tenkou tryskou do silnější kapiláry, kterou nosná tekutina proudí. Buňky usměrněné do tenkého proudu postupují jedna za druhou průtokovou komůrkou, kde protínají nejčastěji laserový monochromatický světelný paprsek. Částice fyzikálně lomí, odrážejí a rozptylují laserové světlo procházející optickou soustavou, jejímiž základními prvky jsou filtry propouštějící světlo o definovaných vlnových délkách (band pass, short pass a long pass filtry). Jednotlivé signály jsou převedeny na elektrické impulzy a zesíleny fotonásobičem (obr. 1) (7).
1. Zjednodušené schéma průtokového cytometru. Analyzovaná buněčná suspenze je unášena tzv. nosnou kapalinou, kterou je modifikovaný fyziologický roztok, k ideální pozici vzhledem k senzorům. Poloha jednotlivých částic je kontrolována hydrodynamickou fokusací nosné kapaliny. Do laminárně proudící nosné kapaliny je vstřikován vzorek tak, aby měřícím bodem procházela v okamžiku analýzy právě jedna buňka. Když se analyzovaná částice potká s laserovým paprskem, dochází k odrazu světla v přímém úhlu (signál je zachycen FSC detektorem, udává informace o velikosti buněk), k lomu světelného paprsku pod úhlem 90° (signál je zachycen SSC detektorem, lom světla je ovlivněn hlavně granularitou částic a členitostí buněčného jádra) a pokud jsou na buňkách navázány fluorescenčně značené protilátky, po excitaci fluorochromů dojde k emisi světla o příslušných délkách, které jsou zaznamenávány do detektorů odpovídajících fluorescencí (na schématu detektor FL1 a FL2 fluorescence). Počet detektorů fluorescence závisí na výbavě průtokového cytometru. Díky sběrné optice (systém zrcadel a filtrů) je usměrněno světlo různých vlnových délek na příslušné detektory. 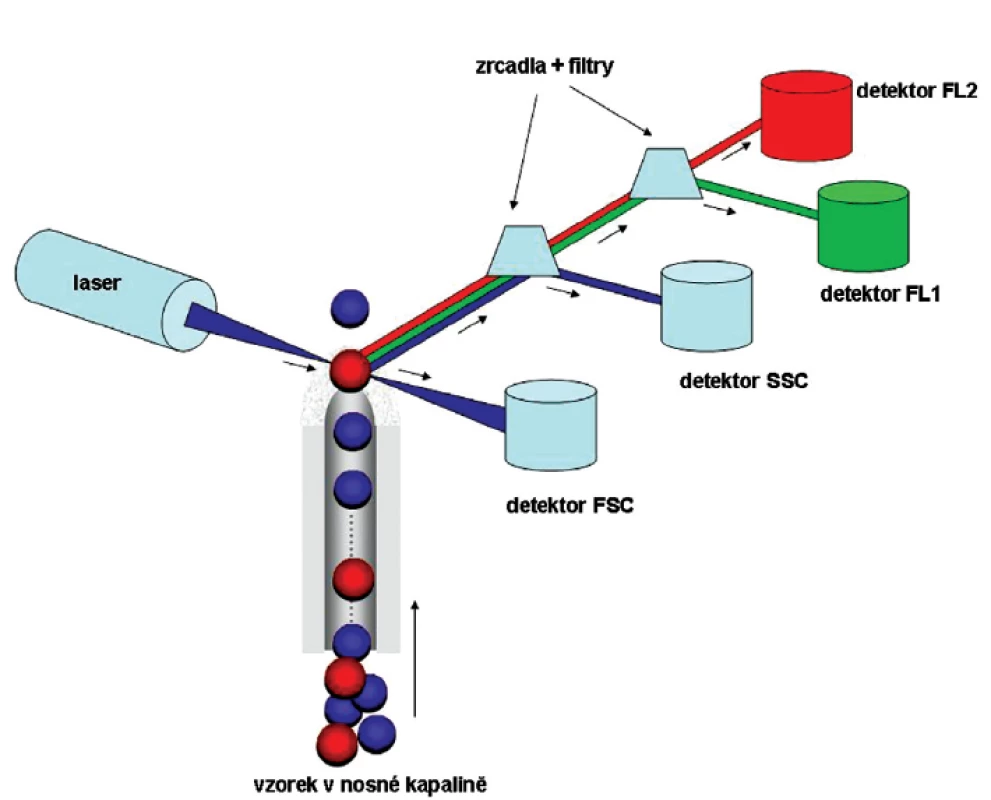
Měřenými parametry jsou zejména rozptyl světla v malém úhlu, tzv. „forward scatter“ (FSC – je přímo úměrný velikosti buněk) a rozptyl světla v úhlu 90°, tzv. „side scatter“ (SSC – je ovlivněn hlavně granularitou částic a členitostí buněčného jádra). Kromě těchto základních fyzikálních vlastností lze pomocí fluorescenčně značených protilátek rozlišovat buněčné subpopulace podle exprese povrchových i intracelulárních antigenů. Laserový paprsek excituje fluorochrom protilátky, tím je emitováno světlo o určité vlnové délce, které se skrz příslušné filtry optické soustavy dostává do příslušného detektoru fluorescence (obr. 1).
V současné době je na trhu k dispozici celá řada protilátek vhodných pro imunofenotypizaci průtokovou cytometrii. Jsou značené různými fluorochromy (např. námi nejčastěji používané: FITC, PE, PerCP-Cy5.5, PC7, APC, APC-Cy7, PB aj.), čímž je zaručena kombinovatelnost protilátek proti různým antigenům v jednom vzorku. Díky vícebarevnému značení je možné snáze posoudit případnou aberantní koexpresi vyšetřovaných znaků. Velkou výhodou multiparametrické průtokové cytometrie je možnost rozlišení i minoritních buněčných subpopulací.
Většina monoklonálních protilátek je zaměřena proti antigenům krevních buněk. Lze však imunofenotypizovat i nehematologické buňky. Cytometricky je rovněž možné zjišťovat přítomnost intracelulárních virů (např. HIV-1, CMV nebo EBV) (14-16), existují také monoklonální protilátky k identifikaci bakterií a parazitů (15).
V diagnostice lymfoproliferativních onemocnění se s výhodou využívá také analýza DNA. Metoda je založená na schopnosti některých barviv vázat se stechiometricky na nukleové kyseliny (např. propidium jodid (PI), DAPI aj.). Buňky obarvené těmito barvivy po ozáření světlem o příslušné vlnové délce emitují světlo jiné vlnové délky. Pokud je barvivo podáno v nadbytku, je intenzita fluorescence jednotlivých buněk přímo úměrná obsahu DNA v buňce. Cytometrista díky ní rozpozná, zda jsou vyšetřované buňky diploidní nebo je přítomen určitý podíl buněk aneuploidních. Analýza DNA navíc umožňuje rozlišit podíl proliferujících buněk – ať už diploidních nebo aneuploidní frakce – tzn. buněk v S a G2/M fázi, čímž je metoda nápomocná v rozlišení nízce maligních a vysoce maligních procesů (obr. 2).
2. Analýza DNA. Jednoparametrický histogram znázorňuje na ose x intenzitu signálu související s množstvím navázaného fluorescenčního barviva propidium iodidu (PI) a na ose y množství buněk. Cytometrická analýza DNA je založená na schopnosti PI vázat se stechiometricky na nukleové kyseliny. Pokud je barvivo podáno v nadbytku, je intenzita fluorescence jednotlivých buněk přímo úměrná obsahu DNA v buňce. U diploidních buněk v G0/G1 fázi je poloviční ve srovnání s buňkami v G2/M fázi. U S fáze, díky tomu, že dochází k syntéze DNA, se fluorescence buněk zvyšuje. Cytometrista však není schopen pomocí této metody odlišit buňky v G0 fázi od buněk v G1 fázi, stejně jako buňky v G2 fázi od buněk v M fázi, jelikož obsah DNA je ve srovnávaných fázích cyklu stejný. Uvedený histogram ilustruje směs diploidních a aneuploidních buněk izolovaných z tkáně suspektního non-Hodkinského lymfomu, které se liší obsahem DNA a proliferační aktivitou. Diploidní buňky (znázorněny červeně) vykazují nižší proliferační index (součet buněk v S a G2/M fázi) než aneuploidní buňky (znázorněny žlutûě, které mají kromě vyššího proliferačního indexu i vyšší obsah DNA díky chromozomálním aberacím. Analýza DNA zjistila vysokou proliferační aktivitu vyšetřovaných diploidních i aneuploidních buněk a prokázala chromozomální aberace, což nasvědčuje vysoce malignímu procesu. Nález byl v korelaci s imunofenotypizací průtokovu cytometrií a histologickým vyšetřením, které prokázaly infiltraci tkáně velkobuněčným lymfomem (DLBCL). 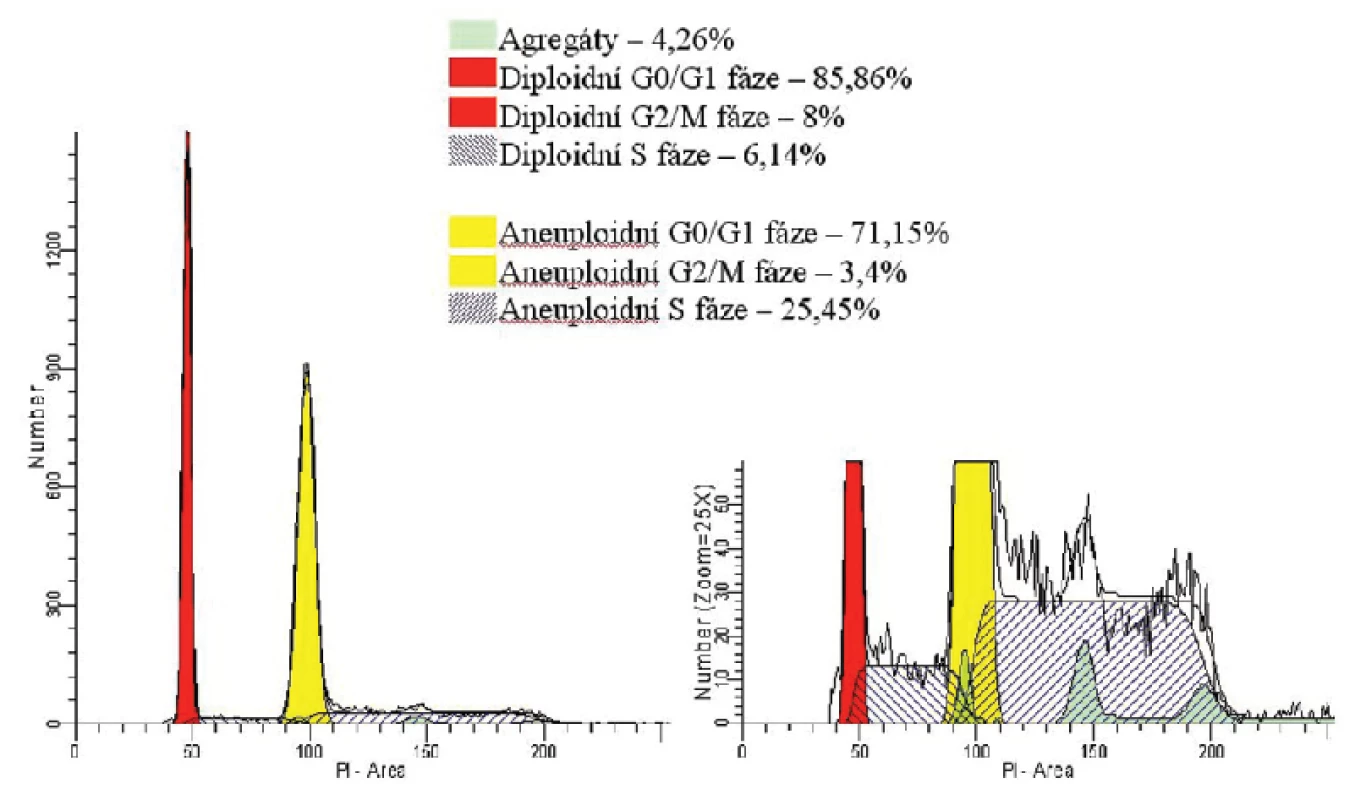
Z dalších možností uvádíme alespoň některé příklady uplatnění: stanovení funkční aktivity leukocytů, průkaz protilátek, analýza apoptózy, průkaz intracelulárních cytokinů nebo stanovení intracelulárního vápníku. Některé vyšetřovací postupy jsou rutinně využívány v klinických laboratořích, jiné nalézají své uplatnění především v laboratořích výzkumných (tab. 1).
1. Možnosti využití průtokové cytometrie. 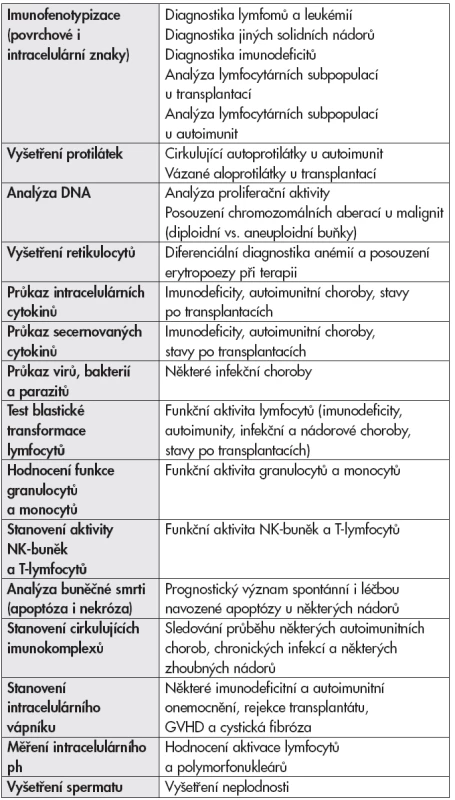
VYŠETŘOVANÝ MATERIÁL
Metodou průtokové cytometrie lze imunofenotypizovat buňky v suspenzi. Nejčastěji bývá vyšetřována periferní krev, aspirát kostní dřeně, event. mozkomíšní mok a další buněčné suspenze. Je však velmi důležité vyšetřit také nativní bioptické vzorky solidního nádoru a stanovit imunofenotyp nádorových buněk. Poté je daleko snazší identifikovat i malé subpopulace nádorových buněk v rámci stagingu a restagingu. Nativní bioptický vzorek je neprodleně po odběru doručen do laboratoře a zpracován do buněčné suspenze buď mechanickou homogenizací nebo enzymatickým trávením.
CYTOMETRICKÁ DATA
Počítačové zpracování naměřených dat umožňuje získat imunofenotyp jednotlivých buněčných subpopulací. Výstupem měření jsou výsledky v grafické a číselné podobě. Ke grafickému zobrazení naměřených dat se používají jednak jednoparametrické histogramy, kde na ose x znázorňujeme intenzitu signálu a na ose y množství buněk (obr. 2) nebo dvouparametrické grafy – „dot-ploty“ – kdy na ose x je vynesena intenzita jednoho a na ose y intenzita druhého signálu. Množství buněk potom odpovídá hustotě zobrazených bodů v grafu, jelikož každý zobrazený bod v dot-plotu představuje změřenou buňku (obr. 3).
3. Analýza cytometrických dat, vzorek periferní krve se suspekcí na lymfoproliferativní onemocnění. Dot-plot SSC/FSC znázorňuje rozložení buněk podle granularity (SSC) a velikosti (FSC) – dle těchto parametrů rozlišujeme buněčné subpopulace lymfocytů, monocytů, granulocytů a debris. V rámci počítačového zpracování naměřených dat je možné „zagatovat“ určitou subpopulaci, u které dále vyhodnotíme expresi či absenci námi měřených parametrů. „Gatujeme“ populaci lymfocytů a ve druhém dot-plotu CD19 FITC / CD5 PE již zobrazujeme pouze vybrané buňky. V tomto dot-plotu můžeme rozpoznat čtyři buněčné subpopulace: v kvadrantu 1 – buňky neexprimující ani molekulu CD19 ani molekulu CD5, buňky se vyznačují pouze svou autofluorescení; v kvadrantu 2 – buňky s expresí molekuly CD19, po vazbě fluorescenční protilátky anti-CD19 FITC se zvýšila intenzita jejich fluorescence (B-lymfocyty); v kvadrantu 3 – buňky s expresí molekuly CD5, po vazbě fluorescenční protilátky anti-CD5 PE se rovněž zvýšila intenzita jejich fluorescence (T-lymfocyty); v kvadrantu 4 – buňky s koexpresí molekuly CD19 a CD5 (aberantní koexprese u nádorových buněk) Koexprese molekuly CD19 a CD5 je typická pro chronickou lymfocytickou leukémii a pro lymfom z buněk pláště, přesnější určení je potom možné díky podrobnější imunofenotypizaci. 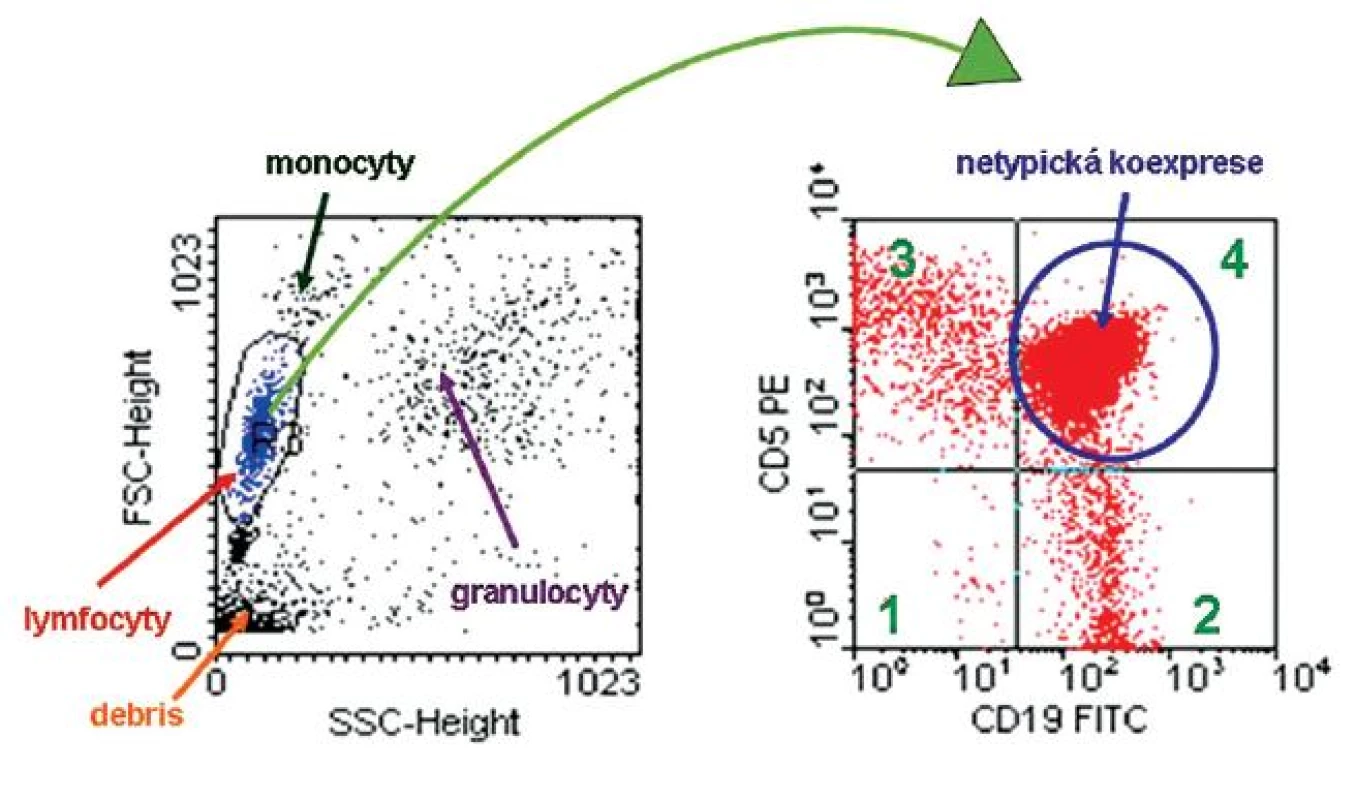
V dot-plotech můžeme zobrazit jednak buňky dle velikosti a granularity nebo podle intenzity fluorescenčního signálu, na základě čehož získáváme informace o přítomnosti či absenci vyšetřovaných antigenů. V rámci analýzy cytometrických dat je možné analyzovat vybrané buněčné subpopulace a jiné z analýzy „vypnout“. Proces vybírání buněčné subpopulace, kterou dále charakterizujeme z hlediska exprese námi testovaných znaků, označujeme „gatování“. Údaje získané měřením jsou archivovány v elektronické podobě.
VYUŽITÍ METODY V PATOLOGII
Imunofenotypizace hematologických malignit, která je nejhojněji využívanou analýzou průtokové cytometrie, je prováděna pod záštitou různých klinik, oddělení a ústavů. Komplexní diagnostika hematologických malignit zahrnuje širokou paletu vyšetření, které dohromady skládají informace vedoucí k identifikaci a klasifikaci onemocnění. Cílem vyšetření je zjistit maximum validních informací o expresi diagnosticky relevantních markerů.
Na našem pracovišti se nejčastěji setkáváme s diagnostikou non-Hodgkinských lymfomů. Pro diagnostiku Hodgkinských lymfomů není metoda průtokové cytometrie vhodným nástrojem, jelikož diagnostické buňky se ve tkáních nachází v minimálním množství a jsou při analýze snadno přehlédnutelné, event. se v buněčné suspenzi nevyskytují vůbec, díky limitaci metody při přípravě buněčné suspenze.
Non-Hodgkinské lymfomy jsou odvozené od B-lymfocytů, T-lymfocytů nebo vzácně z NK buněk (17). Každá skupina je představována řadou nozologických jednotek, jejichž hranice nejsou vždy ostře vyjádřeny, mnohá onemocnění se pak mohou transformovat a poté mění své biologické i klinické charakteristiky.
B-NHL
WHO klasifikace rozděluje B-NHL na lymfomy vycházející z prekurzorů B-řady a lymfomy vznikající ze zralých periferních B-lymfocytů. Jednotlivé B-NHL jsou dále do daných kategorií zařazeny na základě kombinace morfologických, imunofenotypických a molekulárně-genetických vlastností nádorových buněk současně s klinickými charakteristikami choroby. Na obr. 4 je znázorněn přehled nejčastějších typů B-NHL a základní zjednodušené schéma jejich imunofenotypizace pomocí FACS.
4. Zjednodušené schéma imunofenotypizace nejčastějších B-NHL. V případě suspekce na B-lymfoproliferativní onemocnění posuzujeme expresi B-lymfocytárních znaků (obvykle CD19, CD20, CD79 aj.) a pokud se jedná o nádorový proces ze zralých B-lymfocytů, je zásadní rovněž průkaz klonality pomocí vyšetření lehkých povrchových řetězců imunoglobulinů kappa a lambda. Prokážeme-li ve vzorku monoklonální populaci B-lymfocytů, díky dalším vyšetřovaným znakům můžeme posoudit, o kterů B-lymfom se může jednat. <em>CLL = chronická lymfocytická leukémie; MCL = lymfom z buněk pláště; FL = folikulární lymfom; MZL =lymfom marginální zóny; BL = Burkittův lymfom; DLBCL = difúzní velkobuněčný B lymfom.</em> 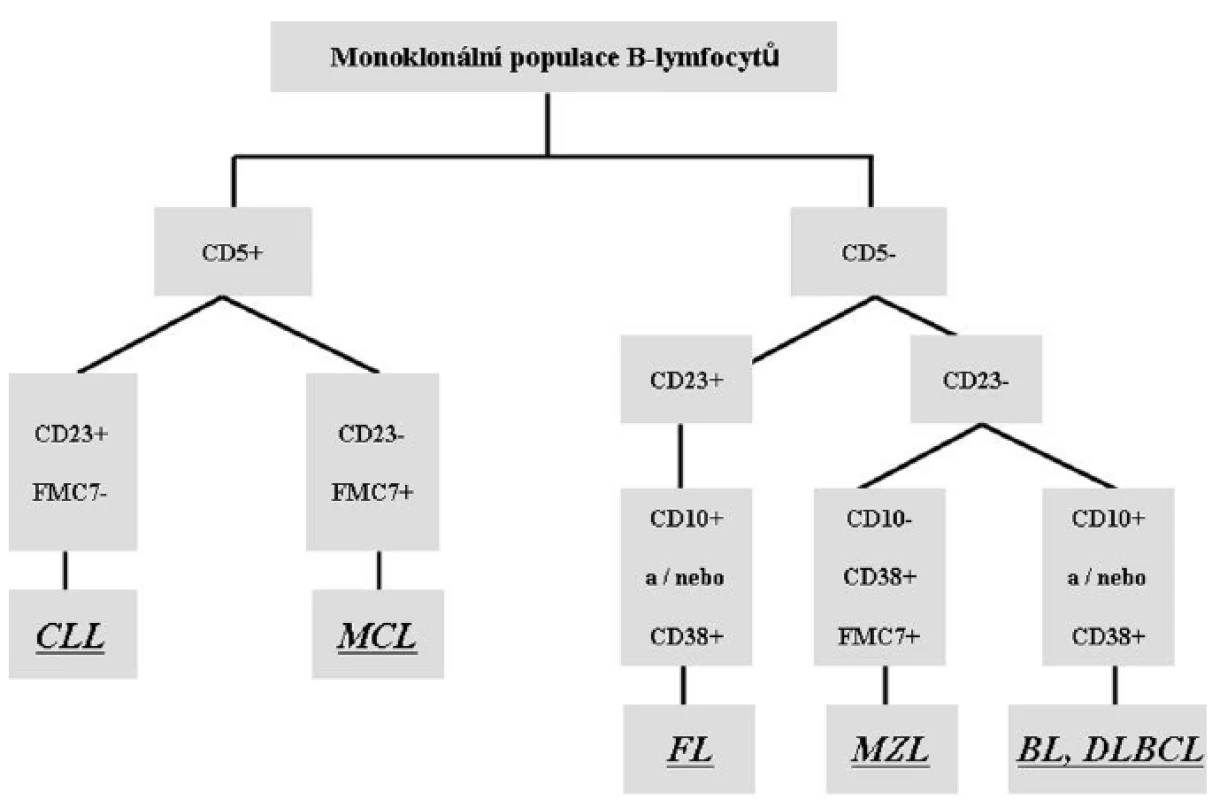
Cytometrická diagnostika B-NHL ze zralých B-lymfocytů se opírá zejména o průkaz monoklonální populace pomocí stanovení exprese lehkých povrchových řetězců imunoglobulinů kappa nebo lambda. Cytometrické vyšetření klonality vychází ze znalosti fyziologického poměru lehkých povrchových řetězců kappa a lambda, který je 3 : 2. Pokud je tento poměr signifikantně narušen, nález nasvědčuje přítomnosti klonální populace zralých B-lymfocytů. Pro diagnostiku B-NHL ze zralých B-lymfocytů je průtoková cytometrie vysoce spolehlivá a je účinným nástrojem pro rychlé stanovení diagnózy.
T/NK-NHL
Stejně jako B-NHL, vznikají i T/NK-NHL z prekurzorových a zralých T-lymfocytů event. NK buněk. V případě diagnostiky T/NK-NHL je však rozpoznání nádorových buněk komplikovanější a cytometrista se snaží nádorové buňky hledat podle případného aberantního imunofenotypu. Není však pravidlo, že by se nádorová buňka musela vyznačovat aberantní koexpresí vyšetřovaných znaků. Pro T/NK-NHL může být cytometrie vhodnou diagnostickou metodou právě v případě, že je zjištěna přítomnost aberantního imunofenotypu.
ZÁVĚR
V případě, že lékař-patolog disponuje metodou průtokové cytometrie, otevírají se mu nové možnosti diagnostiky. Na základě peroperačního vyšetření může indikovat potřebná vyšetření, tedy i imunofenotypizaci průtokovou cytometrií. Předností cytometrické analýzy je její rychlost. Již za dvě hodiny může znát první výsledek. I v případě, že z výsledků průtokové cytometrie nelze vždy jednoznačně určit diagnózu, její velký význam spočívá v tom, že může směrovat další kroky patologa ve vyšetřovacím postupu. Další její velkou výhodou je, že v případě průkazu přítomnosti nádorových buněk s určitým imunofenotypem (obr. 5), je průtoková cytometrie vhodným nástrojem při stagingu a restagingu onemocnění. Lze snáze identifikovat minoritní populace nádorových buněk, které by mohly být pod hranicí mikroskopické detekce.
5. Ukázky výsledků vyšetření průtokovu cytometrií. A. <em>Nativní bioptický odběr z ilea se suspekcí na non-Hodgkinský lymfom.</em> Bioptický vzorek ilea byl po mechanické homogenizaci naznačen komerčně dodávanými fluorescenčními protilátkami (kappa FITC / lambda PE / CD20 PerCPCy5.5 / CD38 PC7 / CD10 APC / CD19 APCCy7 / CD5 PB). Cytometrická analýza prokázala klonální populaci velkých lymfocytů (buňky označené modře) s fenotypem CD19+ CD20+ lambda+ CD10+ CD5- CD38-/+. Kromě nádorových buněk je přítomna populace polyklonálních malých B-lymfocytů (zobrazeny červeně a světle zeleně) a populace malých T-lymfocytů (tmavě zelené buňky). Nález průtokové cytometrie zjistil infiltraci ilea high-grade folikulárním lymfomem. 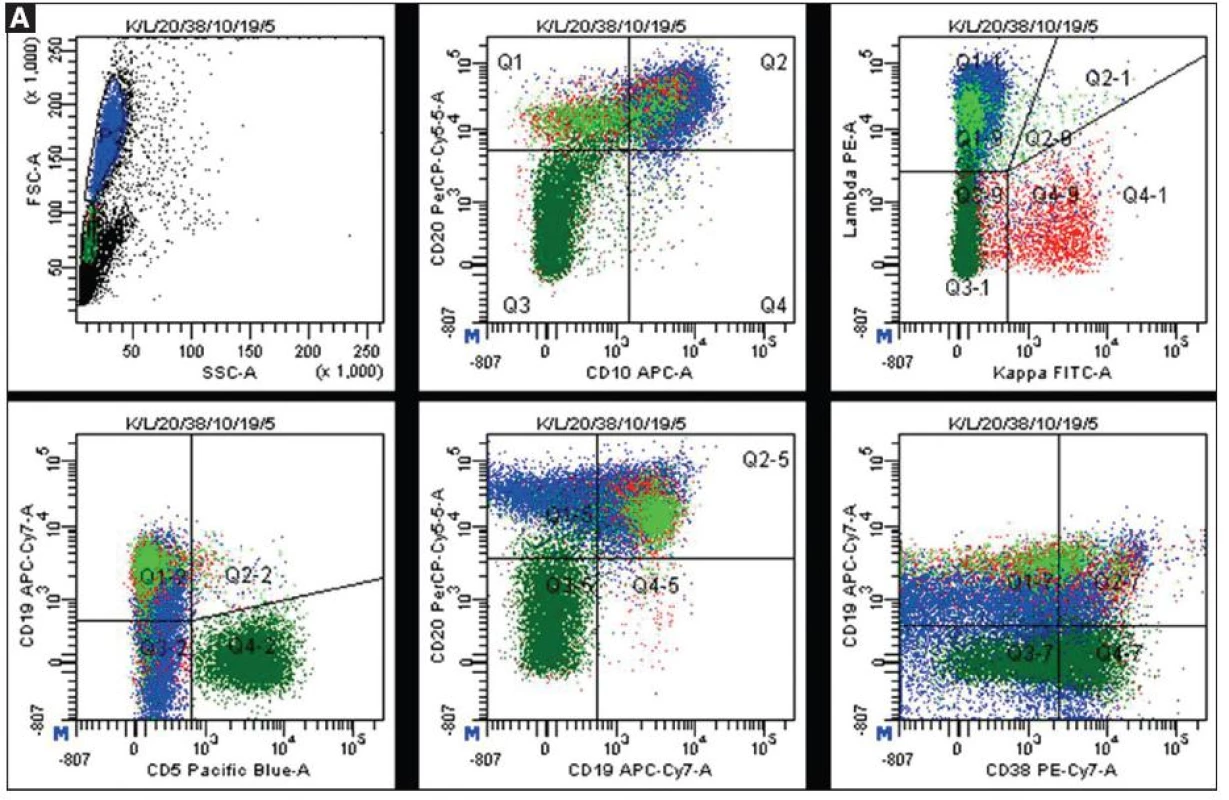
B. <em>Aspirát kostní dřeně, staging high-grade folikulárního lymfomu.</em> Aspirát kostní dřeně odebraný v odběrové zkumavce s EDTA byl naznačen komerčně dodávanými fluorescenčními protilátkami (kappa FITC / lambda PE / CD20 PerCPCy5.5 / CD38 PC7 / CD10 APC / CD19 APCCy7 / CD5 PB). Cytometrická analýza prokázala minoritní klonální populaci malých lymfocytů (buňky označené červeně) s fenotypem CD19+ CD20+ lambda+ CD10+ CD5- CD38+ (0,5 % z celku). Nádorové buňky byly v rámci stagingu hledány cíleně, což bylo možné díky znalosti jejich imunofenotypu stanoveném při cytometrickém vyšetření primárního nádoru. Tím lze zvýšit citlivost metody. Cytometrický nález prokázal infiltraci kostní dřeně folikulárním lymfomem. 
Každá vyšetřovací metoda má své výhody a své limitace (18,19). Pro určení správné diagnózy je na místě dostupné vyšetřovací metody kombinovat a interpretovat získané výsledky po vzájemné korelaci nálezů. Jelikož patolog dovede nejlépe posoudit reprezentativnost odběru pro konkrétní vyšetření, je vhodné doporučit spolupráci cytometristy s patologem při zajištění dělby vzorků.
PODĚKOVÁNÍ
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064206 (FN MOTOL).
Adresa pro korespondenci:
RNDr. Petra Manďáková, Ph.D.
Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole
V Úvalu 84, Praha 5, 150 06
tel.: 2 2443 5658, 5644; fax: 2 2443 5620
e-mail: p.mandak@email.cz
Sources
1. Fulwyler MJ. Electronic separation of biological cells by volume. Science 1965; 150 : 910-911.
2. Robinson JP. Mack Fulwyler in his own words. Cytometry Part A 2005; 67A: 61-67.
3. Herzenberg LY. FACS innovation: a view from Stanford. Clin Invest Med 2004; 27 : 240-252.
4. Zuba-Surma EK, Kucia M, Abdel-Latif A, Lillard JW Jr., Ratajczak MZ. Folia Histochem Cytobiol 2007; 45 : 279-290.
5. Hulett HR, Bonner WA, Barrett J., Herzenberg LA. Cell sorting: automated separation of mammalian cells as a function of intracellular fluorescence. Science 1969; 166 : 747-749.
6. Shapiro HM. Multistation multiparameter flow cytometry: a critical review and rationale. Cytometry 1983; 3 : 227-243.
7. Shapiro HM. Practical flow cytometry. Alan R. Liss, Inc: New York; 1988.
8. Radcliff G, Jaroszeski MJ. Basics of flow cytometry. Methods Mol Biol 1998; 91 : 1-24.
9. Jaroszeski MJ, Radcliff G. Fundamentals of flow cytometry. Mol Biotechnol 1999; 11 : 37-53.
10. Maftah A, Huet O., Gallet PF, Fatinaud MH. Flow cytometryęs contribution to the measurement of cell functions. Biol Cell 1993; 78 : 85-93.
11. Stewart CC. Clinical applications of flow cytometry. Immunologic methods for measuring cell membrane and cytoplasmic antigens. Cancer 1992; 69 : 1543-1552.
12. Davey HM. Flow cytometric techniques for the detection of microorganisms. Methods Cell Sci 2002; 24 : 91-97.
13. Arora SK. Analysis of intracellular cytokines using flowcytometry. Methods Cell Sci 2002; 24 : 37-40.
14. Gadol N, Crutcher GJ, Busch MP. Detection of intracellular HIV in lymphocytes by flow cytometry. Cytometry 1994; 15 : 359-370.
15. Riley RS, Mahin EJ. Clinical applications of flow cytometry. ASCP: San Francisco; 1990.
16. Croudr J, Leitenberg D, Smith BR, Howe JG. Epstein-Barr virus suspension cell assay using in situ hybridization and flow cytometry. Cytometry 1997; 29 : 50-57.
17. Jaffe ES, Harris NL, Stein H, Vardiman JW. WHO classification of tumours; Pathology and genetics of tumours of hematopoietic and lymphoid tissue. IARC Press: Lyon; 2001 : 135-174.
18. Manďáková P, Campr V, Kodet R. Korelace výsledků průtokové cytometrie a morfologických nálezů v diagnostice maligních lymfomů z B buněk. Čas Lék Čes 2003; 142 : 651-655.
19. Manďáková P, Kortánková H, Machovcová A, Campr V. Imunofenotypizace kožních T-lymfomů. Čes-slov Derm 2006; 2 : 82-87.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2013 Issue 4-
All articles in this issue
- Fluorescence in situ hybridization on histologic sections
- Laser capture microdissection and its practical applications
- Immunophenotypization by means of flow cytometry in pathology
- Minimal residual disease – detection possibilities in haematological and non-haematological malignancies
- How to improve the histopathological diagnosis of hepatocellular benign affections (adenoma versus focal nodular hyperplasia) in daily practice?
- Mucinous carcinoma (non-intestinal type) arising in the ovarian mature cystic teratoma - a case report
- Eosinophilic dysplasia of the cervix associated with HPV 6 infection – case report and review of the literature
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- How to improve the histopathological diagnosis of hepatocellular benign affections (adenoma versus focal nodular hyperplasia) in daily practice?
- Immunophenotypization by means of flow cytometry in pathology
- Minimal residual disease – detection possibilities in haematological and non-haematological malignancies
- Fluorescence in situ hybridization on histologic sections
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

