-
Medical journals
- Career
Neuropatologická diagnostika v dětské onkologii pohledem klinika
Authors: D. Sumerauer; M. Zápotocký
Authors‘ workplace: Klinika dětské hematologie o onkologie UK 2. LF a FN Motol, Praha
Published in: Čes.-slov. Patol., 48, 2012, No. 2, p. 72-74
Category: Review Articles – Neuropathology
Overview
Léčba nádorů mozku u dětí a adolescentů je náročný úkol vyžadující multidisciplinární přístup a spolupráci mnoha odborností. V posledních letech diagnostika a léčba mozkových nádorů dosáhly významného pokroku. U řady onemocnění, zvláště embryonálních nádorů mozku, byly identifikovány klinicky relevantní biomarkery, které jsou využívány pro stratifikaci do léčebných skupin. Spolupráce kliniků, patologa a molekulárního biologa je tak zásadní pro úspěšnou terapii. Článek představuje některé významné příklady spolupráce v dětské neuro-onkologii.
Klíčová slova:
nádory mozku – neuropatologie – léčbaNádory centrálního nervového systému (CNS) jsou nejčastější solidní nádory u dětí a adolescentů, představují přibližně 20 – –25 % dětských malignit s incidencí 3,2 nových onemocnění na 100 000 dětí mladších 15 let věku. Jedná se o heterogenní skupinu onemocnění podle histogenetického původu, biologického chování, lokalizace, klinických příznaků a věku manifestace. Léčba nádorů CNS zůstává přes pokrok dosažený v posledních letech obtížná, léčebné výsledky nekopírují zlepšení dokumentované u jiných nádorových onemocnění dětského věku, například dětských leukémií. Nádory CNS jsou tak nyní nejčastější příčinou úmrtí na nádorové onemocnění u dětí s mortalitou 0,9–1,1 na 100 000 dětí. Navíc, řada dětí si po úspěšné léčbě nádoru mozku odnáší do života výrazný handicap, limitující jejich další uplatnění.
Péče o pacienty s nádory CNS je mezioborová, v případě nádorů CNS u dětí a adolescentů se na péči o pacienty podílí dětský onkolog, neurochirurg, patolog, radioterapeut, neuroradiolog, neurolog, psycholog, fyzioterapeut, genetik a řada dalších.
Neuropatolog je nedílnou součástí neuroonkologického týmu. Pro svou práci musí mít přístup ke všem dostupným klinickým informacím, výsledkům laboratorních vyšetření i zobrazovacích metod. Patolog například jistě ocení informaci o pozitivitě nádorových markerů (AFP, ß-hCG) v likvoru případně séru při hodnocení drobného bioptického vzorku germinomu CNS. Podobně charakteristický MRI obraz některých nádorů, například pilocytárního astrocytomu jako dobře ohraničeného nádoru s cystickou komponentou a nádorovým nodulem ve stěně cysty, nebo MRI obraz při diagnóze gliomatosis cerebri může patologovi významně pomoci.
Diagnostika nádorů CNS je komplexní, základem současné systematické klasifikace nádorů CNS je histopatologické a imunohistochemické vyšetření podle aktuální 4. revidované klasifikace nádorů CNS Světové zdravotnické organizace z roku 2007 (1).
V posledních letech rychle přibývá nových poznatků o biologii jednotlivých nádorů získané technikami molekulární genetiky a patologie. Byly identifikovány nové jednotky nádorů, zpřesnila se klasifikace nádorů stávajících, byl potvrzen význam řady prognostických znaků. Pro stanovení léčebného postupu a prognózu pacienta potřebujeme určit diagnózu rychle, přesně a získat co nejvíce klinicky relevantních poznatků. V současné době je zcela nezbytné, aby byl zajištěn biologický materiál nejen pro vlastní histopatologické vyšetření, ale i vyšetření doplňující, především molekulárně biologická, která se stávají nedílnou součástí diagnostických a léčebných postupů. Důležitá je tedy mezioborová spolupráce již v době plánovaní neurochirurgické intervence, ať již se jedná o kompletní odstranění nádoru nebo biopsii.
Standardem péče v dětské onkologii je léčba pacientů v rámci prospektivních, většinou mezinárodních, klinických studií. Jen tak je možné dosáhnout dalšího zlepšení léčebných výsledků u jinak vzácných onemocnění. Účast ve studiích se zastoupením všech spolupracujících oborů včetně patologie, umožní zajistit léčbu na nejvyšší dostupné úrovni.
Nejpropracovanější je v současnosti léčba pacientů s meduloblastomem (MBL). Aktuální WHO klasifikace nádorů CNS z roku 2007 rozlišuje pět variant meduloblastomu – meduloblastom klasický, meduloblastom desmoplastický, meduloblastom s extenzivní nodularitou, meduloblastom anaplastický a meduloblastom velkobuněčný (1). Toto dělení nelze pominout, protože jednotlivé histopatologické podtypy meduloblastomu se liší svou prognózou a některé podtypy jsou léčeny odlišně od ostatních. Stanovení diagnózy meduloblastom WHO gr. IV bez určení podtypu je v současné době pro klinickou praxi nedostatečné. Kromě histopatologického typu je pro volbu terapie a prognózu pacienta s meduloblastomem určující soubor dalších klinických, histopatologických a molekulárně biologických znaků. Rozlišujeme pacienty standardního rizika (Standard Risk – SR), z nichž je možné dostupnou terapií vyléčit více než 70 %, pacienty vysokého rizika (High Risk – HR) z nichž dlouhodobě přežívá více než 40 % pacientů a nově je definována skupina pacientů s mimořádně příznivou prognózou, s předpokládaným přežitím přesahujícím 90 %. U prognosticky nejpříznivější skupiny se připravuje léčebný režim redukující intenzitu protinádorové léčby s cílem snížit četnost a závažnost pozdních následků terapie, při zachování vynikajících léčebných výsledků (2,3). Do HR skupiny pacientů s meduloblastomem zařazujeme děti mladší tří let věku, pacienty s prokázanými metastázami včetně pozitivní cytologie mozkomíšního moku (M1 – M3 onemocnění podle Changovy klasifikace) a pacienty s prokázaným reziduem nádoru > 1,5 cm2 na pooperační MRI mozku. Mimo uvedené klinické charakteristiky dále pacienta do skupiny vysokého rizika řadí záchyt nepříznivé histologie (anaplastický MBL, velkobuněčný MBL) a/nebo průkaz amplifikace MYC nebo MYCN onkogenů metodou fluorescenční in situ hybridizace (FISH). Naproti tomu histopatologický průkaz desmoplastické varianty MBL, nebo meduloblastomu s extenzivní nodularitou u nemocného dítěte je spojený s lepší prognózou. Tato skutečnost byla opakovaně potvrzena i u dětí < 3 let, které vždy považujeme za rizikové. Většinu kojenců s desmoplastickým meduloblastomem a meduloblastomem s extenzivní nodularitou lze vyléčit intenzivní chemoterapií bez nutnosti léčebného ozáření (2–4).
Nejpříznivější prognózu mají pacienti s aktivací Wnt signalizační kaskády (10–15 % pacientů s meduloblastomem), pokud u těchto nemocných neprokážeme jiné, výše popsané, nepříznivé klinické a molekulárně biologické znaky. Nádory Wnt podskupiny meduloblastomu jsou charakterizovány monozomií chromozómu 6, mutacemi CTNNB1 genu a jadernou akumulací ß-cateninu. Nukleární akumulací ß-cateninu lze detekovat imunohistochemicky, jako pozitivní v tomto případě hodnotíme nález při pozitivitě nejméně 10 % jader nádorových buněk. Pokud není vyšetření prováděno rutinně, klinik musí provedení imunohistochemického vyšetření vyžadovat (2,3).
V řadě studií byl prognostický význam uvedené stratifikace potvrzen. Přehledně informace podané v textu shrnuje tabulka č. 1. V současnosti je finalizována příprava prospektivní mezinárodní pan-Evropské studie PNET 5, která význam uvedených biomarkerů ověří prospektivně u skupiny pacientů s meduloblastomem starších 3 let věku. Participovat budou rovněž centra v České Republice, Klinika dětské hematologie a onkologie FN v Motole a Klinika dětské onkologie v Brně. Jednou z podmínek zařazení pacienta do klinického hodnocení je zajištění vzorku nádorové tkáně pro výše uvedená vyšetření a to včetně tkáně zmrazené (fresh frozen). Vzorky k vyšetření musí být standardně zpracovány v referenční laboratoři studie, s dostupností výsledků v krátkém časovém intervalu přibližně 4 týdnů po operaci. Je tedy potřebné, aby patolog sdílel společnou vizi a ochotu materiál k vyšetřením poskytnout. Rozsah vyšetření je nepodkročitelný, chybějící výsledky znemožní pacienta správně léčit.
Table 1. Současná stratifikace pacientů s meduloblastomem do rizikových skupin podle klinických, histopatologických, imunohistochemických a molekulárně biologických charakteristik. 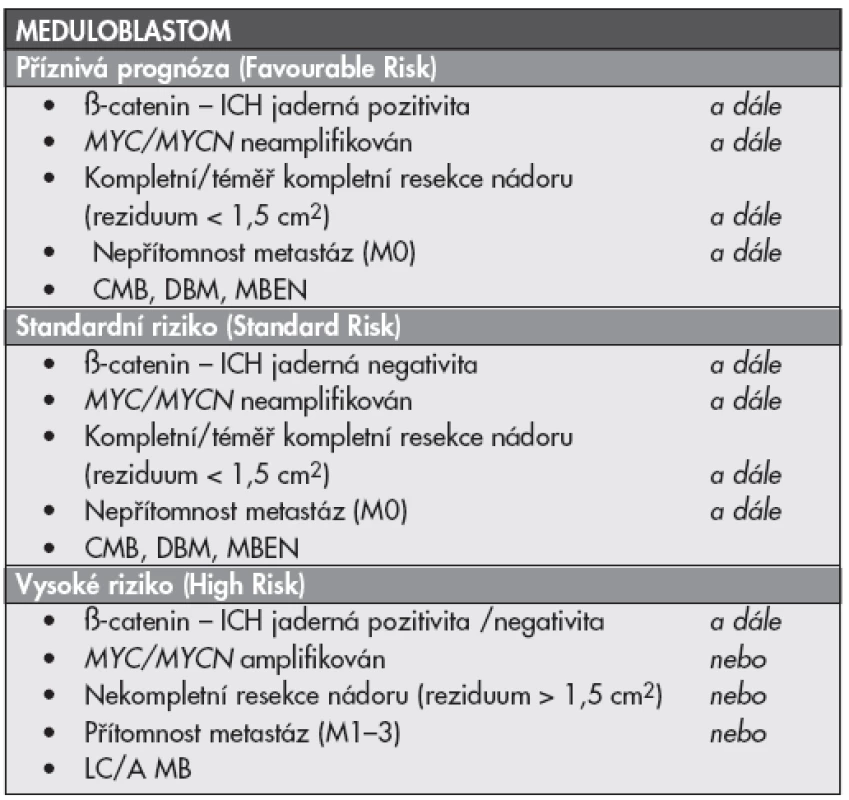
ICH – imunohistochemie; CMB – klasický meduloblastom; DBM – desmoplastický meduloblastom; MBEN – meduloblastom s extenzivní nodularitou; LC/A MB – meduloblastom velkobuněčný, anaplastický, M0, M1-3 – rozsah onemocnění podle Changovy klasifikace (2) Dalším embryonálním nádorem mozku v dětském věku je atypický teratoidní rhabdoidní nádor (ATRT, WHO gr. IV). Rhabdoidní nádory jsou agresivní, vysoce maligní nádory se kterými se často setkáváme u velmi malých dětí. Mimo ATRT mozku se setkáváme i s rhabdoidními nádory ledvin a rhabdoidními nádory měkkých tkání. ATRT je nádor s vysoce nepříznivou prognózu (5). V současnosti je pacient s rhabdoidním nádorem mozku léčen specifickým protokolem odlišným od léčby jiných embryonálních nádorů CNS, proto je jeho rozpoznání zásadní. Nádor je charakterizován bi-alelickou inaktivací genu SMARCB1 (hSNF5, INI1) na chromozómu 22q11 a ztrátou jaderné exprese INI1 proteinu v nádorových buňkách. U 25–35 % pacientů prokazujeme germinální mutaci/deleci genu SMARCB1 jako součást syndromu predispozice k rhabdoidním nádorům (Rhabdoid Tumor Predisposition Syndrome) (5,6). Ztráta jaderné exprese INI1 je pro ATRT charakteristická (ne však zcela specifická) a imunohistochemický průkaz exprese INI1 je v současné době standardním vyšetřením u pacientů s embryonálními nádory mozku, především u kojenců a předškolních dětí. Recentní publikace ukazují velmi vysokou frekvenci ATRT (1 : 1,5) u dětí s embryonálním nádorem mozku do 1 roku věku, ve skupině mladších 4 let tvoří rhabdoidní nádory 25 % (1 : 4) embryonálních nádorů mozku (7,8).
V případě dalších typů nádorů mozku u dětí je vhodné zmínit problematiku ependymomů. Ependymomy u dětí představují 10 % nádorů mozku a přibližně 30 % nádorů u dětí mladších tří let věku. Histopatologické vyšetření obtížně rozlišuje klasický ependymom (WHO gr. 2) a anaplastický ependymom (WHO gr. 3), častá je neshoda mezi diagnózou institucionální a referenčním čtením, rovněž zastoupení pacientů s anaplastickým ependymomem gr. 3 se v publikovaných studiích výrazně liší (10–80 %) (9). Pro klinika je však v obou případech léčba identická, cílem je lokoregionální kontrola onemocnění, které se snažíme dosáhnout resekcí nádoru a konformní 3D radioterapií. Chemoterapie nemá v léčbě pacientů s ependymomem dosud pevné místo, využíváme ji především u kojenců, pacientů s reziduálním nádorem po operaci, případně u pacientů s metastázami. Dostupnou léčbou se daří vyléčit 40–70 % pacientů s ependymomem podle věku, rozsahu onemocnění a možnosti chirurgické resekce nádoru (9). Pomocí technik molekulární biologie se recentně podařilo prokázat, že i v případě ependymomů se jedná o heterogenní skupinu nádorů zahrnující minimálně dva podtypy s odlišným biologickým chováním a tyto lze odlišit, mimo jiné, pomocí imunohistochemického barvení s použitím protilátek proti lamininu alfa-2 (LAMA2) a neurálnímu epidermálnímu růstovému faktoru 2 (NELL2) (10). Další studie musí nicméně tato prvotní data validovat.
U dalších nádorů CNS u dětí a dospívajících byla v posledních letech identifikována řada genetických změn, které je odlišují od nádorů dospělých (11). Například high grade gliomy (HGG) v dětském věku jsou geneticky odlišné od HGG dospělých, bohužel získané poznatky dosud nepřinesly zásadní změnu v léčebných postupech. Nejrozšířenější dostupná léčba, radioterapie s konkomitantním temozolomidem a navazujícím blokovým podáním temozolomidu po maximální bezpečné resekci nádoru nezlepšila přežití dětských pacientů oproti historickým kontrolám, nadále přežívá pouze 10–30 % pacientů (12,13). Obávaným mozkovým nádorem dětského věku je potom prakticky vždy fatální difúzní infiltrativní gliom pontu (DIPG). U tohoto nádoru je v době stanovení diagnózy úloha patologa omezená, k diagnóze postačuje typický MRI obraz nádoru, rychlý nástup a charakter klinických obtíží. Pro tento nádor neexistuje léčba s kurativním potenciálem, naprostá většina pacientů onemocnění podlehne do 1 roku od stanovení diagnózy. Z tohoto důvodu je v posledních letech věnována snaha DIPG lépe charakterizovat. Některá pracoviště se vydala cestou stereotaktických biopsií, jiné pracovní skupiny preferují odběr tkání při autopsii (14). Provedené studie prokázaly, že lze takto izolovat dokonce nádorové buněčné linie. I zde je zásadní úloha patologů pro lepší poznání nádorů CNS s cílem zvýšit šanci na vyléčení dětských pacientů s mozkovými nádory.
ZÁVĚR
Pro onkologa je patolog klíčovým partnerem, jeho úloha v diagnostice a léčbě nádorů mozku je zásadní. Podmínkou kvalitní péče o neuroonkologické pacienty je úzká mezioborová spolupráce a sdílení dostupných informací, ideálně formou klinicko-patologických seminářů (tzv. „tumor-boardů“). Je důležité, aby onkolog i patolog byli zahrnuti do péče časně, již v době přípravy k neurochirurgické intervenci, je-li tato plánována. Zásadní význam pro diagnostiku i další léčbu má správný odběr tkáně pro histopatologické a molekulárně-biologické vyšetření, tedy mimo kvalitní fixaci tkáně ve formolu, vždy zajistit i vzorek nefixovaný, určený k rychlé diagnostice (zmrazený řez) a uchování reprezentativní zmrazené nádorové tkáně v tkáňové bance pro další vyšetření. V neposlední řadě je důležité referenční hodnocení histopatologických nálezů, ideálně na mezinárodní úrovni, které se stává standardem v rámci prospektivních klinických studií.
PODĚKOVÁNÍ
Podpořeno VZ MZO FNM2005.
Adresa pro korespondenci:
MUDr. David Sumerauer, Ph.D.
Klinika dětské hematologie o onkologie UK 2. LF a FN Motol
V Úvalu 84, Praha 5
tel.: +420 224436401
fax: +420 224436420
e-mail: david.sumerauer@fnmotol.cz
Sources
1. Louis DN, Oghaki H, Wiestler OD, et al., The 2007 WHO classification of tumors of the central nervous system. Acta Neuropathol 2007; 114(2): 97–109.
2. Ellison DW, Kocak M, Dalton J, et al., Definition of Disease-Risk Stratification Groups in Childhood Medulloblastoma Using Combined Clinical, Pathologic and Molecular Variables. J Clin Oncol 2010; 29(11): 1400–1407.
3. Pizer BL, Clifford SC, The potential impact of tumour biology on impoved clinical practice for medulloblastoma: progress towards biologically driven clinical trials. Br J Nerosurg 2009; 23(4): 364–375.
4. von Bueren AO, von Hoff K, Pietsch T, et al., Treatment of young children with localized medulloblastoma by chemotherapy alone: results of the prospective, multicenter trial HIT 2000 confirming the prognostic impact of histology. Neuro Oncol 2011; 13(6): 669–679.
5. Pfister SM, Korshunov A, Kool M, Hasselblatt M, Eberhart C, Taylor MD, Molecular diagnostics of CNS embryonal tumors. Acta Neuropathol 2010; 120(5): 553–566.
6. Eaton KW, Tooke LS, Wainwright LM, Judkins AR, Biegel JA, Spectrum of SMARCB1/INI1 mutations in familial and sporadic rhabdoid tumors. Pediatr Blood Cancer 2011; 56(1): 7–15.
7. von Hoff K, Hinkes B, Dannenmann-Stern E, et al., Frequency, risk-factors and survival of children with atypical teratoid rhabdoid tumors (AT/RT) of the CNS diagnosed between 1988 and 2004, and registered to the German HIT database. Pediatr Blood Cancer 2011; 57(6): 978–985.
8. Woehrer A, Slavc I, Waldhoer T, et al., Incidence of atypical teratoid/rhabdoid tumors in children: a population-based study by the Austrian Brain Tumor Registry, 1996-2006. Cancer 2010; 116(24): 5725–5732.
9. Kilday JP, Rahman R, Dyer S, et al., Pediatric ependymoma: biological perspectives. Mol Cancer Res 2009; 7(6): 765–786.
10. Witt H, Mack SC, Ryzhova M, et al., Delineation of Two Clinically and Molecularly Distinct Subgroups of Posterior Fossa Epandymoma. Cancer Cell 2011; 20(2): 143–157.
11. Pfister SM, Hartman C, Korshunov A, Histology and Molecular Pathology of Pediatric Brain Tumors, J Child Neurol 2009; 24(11): 1375–1386.
12. Cohen KJ, Pollack IF, Zhou T, et al., Temozolomide in the treatment of high-grade gliomas in children: a report from the Children’s Oncology Group. Neuro Oncol 2011; 13(3): 317–323.
13. MacDonald TJ, Aguilera D, Kramm CM, Treatment of high-grade glioma in children and adolescents. Neuro Oncol 2011; 13(10): 1049–1058.
14. Angelini P, Hawkins C, Laperriere N, Bouffet E, Bartels U, Post mortem examinations in diffuse intrinsic pontine glioma: challenges and chances. J Neurooncol 2011; 101(1): 75–81.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2012 Issue 2-
All articles in this issue
- Neurodegenerativní onemocnění: přehled současné klasifikace a diagnostických neuropatologických kritérií
-
José Juan Verocay, „el patólogo de Praga“
(ke 100. výročí jeho pražské habilitace) - Vybrané biomarkery primárnych nádorov centrálneho nervového systému: krátky prehľad
- Neuropatologická diagnostika v dětské onkologii pohledem klinika
- Neuropatologie farmakorezistentní epilepsie - strukturální podklad a mechanismy epileptogeneze
- Mikropapilární uroteliální karcinom ureteru
- Smíšený myxoidní low grade endometriální stromální sarkom a hladkosvalový nádor dělohy. Popis případu
- Ganglioneuróm s perineurálnou diferenciáciou. Kazuistika
- Periferní neuropatie u Whippleovy choroby: Popis případu
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neurodegenerativní onemocnění: přehled současné klasifikace a diagnostických neuropatologických kritérií
- Neuropatologie farmakorezistentní epilepsie - strukturální podklad a mechanismy epileptogeneze
- Vybrané biomarkery primárnych nádorov centrálneho nervového systému: krátky prehľad
- Periferní neuropatie u Whippleovy choroby: Popis případu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

