-
Medical journals
- Career
KARCINOM Z MERKELOVÝCH BUNĚK – IMUNOHISTOLOGICKÁ STUDIE V SOUBORU 11 PACIENTŮ
: T. Jirásek 1; R. Matěj 1,2; L. Pock 3; I. Knotková 1; V. Mandys 1
: Ústav patologie 3. LF UK a FNKV, Praha 1; Oddělení patologie a molekulární medicíny, FTNsP, Praha 2; Dermatohistopatologická laboratoř, Praha 3
: Čes.-slov. Patol., 45, 2009, No. 1, p. 9-13
: Original Article
Cílem práce bylo v souboru jedenácti karcinomů z Merkelových buněk ověřit imunohistologický profil známých a v běžné praxi rutinně užívaných diferenciačních znaků a v těchto nádorech charakterizovat expresi dvou markerů časných fází neuronální diferenciace, reelinu a β-tubulinu třídy III, které dosud nebyly v karcinomech z Merkelových buněk studovány. Ve všech sledovaných nádorech jsme zjistili příznačnou „čepičkovitou“ pozitivitu cytokeratinu 20, negativitu cytokeratinu 7 a tyroidálního transkripčního faktoru 1 (TTF-1) a známky neuroendokrinní diferenciace detekované pomocí protilátek proti neuron specifické enoláze (NSE) a chromograninu A (CgA). Zajímavým zjištěním byla vysoká četnost fokální perinukleární pozitivity cytokeratinů v nádorových buňkách při použití protilátky MNF116, a to i ve dvou případech lokálních recidiv jednoho z vyšetřených nádorů, kde nádorové buňky v recidivujících ložiscích ztratily charakteristickou expresi cytokeratinu 20. Námi studované karcinomy z Merkelových buněk vykazovaly ve většině případů (91%) pozitivitu β-tubulinu třídy III při použití protilátky TU-20, zatímco detekce tohoto antigenu pomocí protilátky TuJ-1 byla překvapivě ve všech studovaných nádorech negativní. Průkaz reelinu byl ve všech případech karcinomu z Merkelových buněk v našem souboru negativní, s výjimkou jednoho nádoru, který vykazoval slabou cytoplazmatickou pozitivitu v menší části nádorových buněk.
Klíčová slova:
karcinom z Merkelových buněk – β-tubulin třídy III – TU-20 – TuJ-1 – reelinKarcinom z Merkelových buněk je relativně vzácný primární kožní maligní novotvar. Klinicky se obvykle manifestuje jako nodulární, někdy na povrchu exulcerovaná afekce červenofialové barvy, která postihuje oblasti kůže exponované slunečnímu záření, nejčastěji obličej a končetiny (18, 19). Nádor je charakteristický pro dospělý věk, nicméně jeho výskyt byl popsán i v dětském věku (22). Častěji se vyskytuje u mužů, většina lézí měří méně než 2 cm v průměru (13). Z pohledu běžné histopatologické praxe je tato afekce řazena do spektra kožních nádorů z malých modrých buněk (1, 20). Nádor je tvořen menšími, fenotypicky primitivními, poměrně uniformními buňkami, které mají relativně chudou cytoplazmu (obr. 1A). Jádra nádorových buněk jsou okrouhlá, měchýřkovitá, s jemnou chromatinovou kresbou a četnými nukleoly (4) (obr. 1B). Příznačná je vysoká mitotická aktivita nádorových buněk, zastiženy mohou být i mitózy atypické. Nádor obvykle vytváří větší solidní ložiska vykazující charakteristický infiltrativní růst difuzního typu, méně často lze zastihnout tvorbu formací trabekulárních (25).
Beta tubulin třídy III je protein o molekulové hmotnosti 50 kD, kódovaný genem lokalizovaným na dlouhém raménku 16. chromozomu. Jako člen tubulinové „rodiny“ se podílí na tvorbě mikrotubulů. V současné době je pokládán za jeden z markerů časných fází neuronální diferenciace, a to jak za vývojových podmínek (3, 10, 14), tak i ve tkáni nádorové (12). Reelin je extracelulární glykoprotein o molekulové hmotnosti 420 kD, kódovaný genem RELN, lokalizovaným na sedmém chromozomu; uplatňuje se jako klíčový regulátor migrace neuronů při vývoji mozkové tkáně (5). Kromě zásadního vlivu ve vývoji CNS byla exprese reelinu zjištěna v celé řadě tkání mimo CNS (periferní nervový systém, játra, ledviny, pohlavní orgány, Langerhansovy ostrůvky a další), což svědčí pro širší spektrum biologických funkcí tohoto proteinu. Nověji byla popsána úloha změny exprese genu RELN v inhibici migrace buněk pankreatických nádorů (21). Zvýšená produkce reelinu byla zjištěna v nádorových buňkách karcinomu jícnu (24) a u karcinomu prostaty korelovala s nižší diferenciací a agresivitou nádoru.
Cílem naší práce bylo na vlastním souboru karcinomů z Merkelových buněk zjistit expresi β-tubulinu třídy III a reelinu, která podle dostupných informací nebyla dosud v tomto nádoru studována.
MATERIÁL A METODY
Ve studii jsme použili 13 bioptických vzorků karcinomu z Merkelových buněk, které pocházely od 11 pacientů. Bločky tkání byly získány z bioptického archivu Ústavu patologie 3. LF UK a FNKV a Dermatohistopatologické laboratoře v Praze z let 1997 až 2007. Všechny studované vzorky byly fixovány 10% formalinem a zpracovány běžnou parafínovou technikou. Tkáňové řezy o tloušťce 5 μm byly barveny hematoxylinem a eozínem a pomocí imunohistologických metod.
Imunohistochemie
Přehled použitých protilátek, jejich zdroj a ředění jsou uvedeny v tabulce 1. Všechny protilátky byly ředěny v Dako Antibody Diluent (DakoCytomation, Glostrup, Dánsko). Všechny vyšetřované vzorky byly zpracovány standardním imunohistochemickým postupem. Jako detekční systém byl použit En - Vision™ Kit (DakoCytomation, Glostrup, Dánsko), reakce byly vizualizovány pomocí 3, 3 diaminobenzidinu (Fluka, Buchs, Švýcarsko). Buněčná jádra byla dobarvována pomocí Harrisova hematoxylinu. Jako pozitivní kontrola pro protilátky TuJ-1 a TU-20 byly použity Purkyňovy buňky lidského mozečku, jako pozitivní kontrola pro protilátku detekující reelin byla použita tkáň nízce diferencovaného (G3) karcinomu prostaty, jako pozitivní kontrola pro protilátku detekující TTF-1 sloužila tkáň lidské štítné žlázy. Výsledky imunohistochemických reakcí byly hodnoceny semikvantitativně pomocí optického mikroskopu v celých vyšetřených řezech takto: 0: negativní reakce, 1: < 30 % pozitivních nádorových buněk, 2 : 30–60 % pozitivních nádorových buněk, 3: > 60 % pozitivních nádorových buněk.
1. Souhrn použitých primárních protilátek 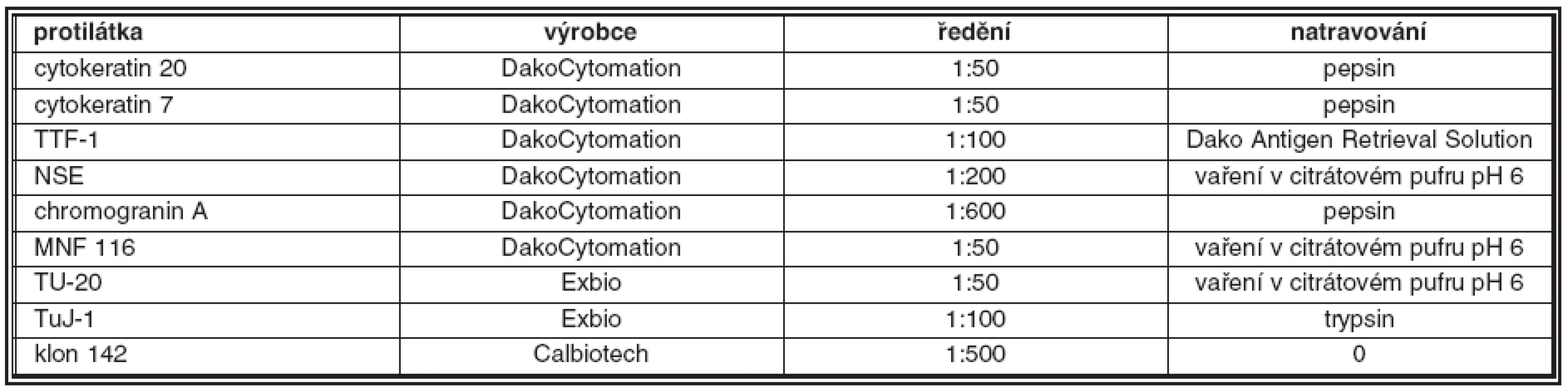
VÝSLEDKY
Výsledky jsou shrnuty v tabulce 2. Soubor sestával z jedenácti pacientů, od kterých bylo studováno celkem třináct vzorků. V pěti případech se jednalo o muže, v šesti o ženy. Průměrný věk pacientů činil 76,1 roku s rozmezím od 48 do 89 let. Primární nádory byly lokalizovány ve třech případech v kůži předloktí, ve čtyřech případech v oblasti čela a tváří, v jednom případě v oblasti levé paže. V jednom případě byl nádor lokalizován v oblasti levé gluteální krajiny a ve zbývajících dvou případech nebyla přesná lokalizace nádoru klinikem uvedena. V jednom případě (č. 10) byly v archivu nalezeny vzorky z opakované recidivy nádoru v místě předchozí operace, ke které došlo s odstupem sedmi (č. 10a) a jedenácti (č. 10b) měsíců po exstirpaci primárního nádoru v oblasti čela. Imunofenotypicky odpovídaly všechny vyšetřené nádory karcinomu z Merkelových buněk. Primární nádory vykazovaly v 100 % čepičkovitou paranukleární cytoplazmatickou pozitivitu CK 20 (obr. 1C), v devíti případech (82 %) bylo pozitivních více než 60 %, ve dvou případech (18 %) méně než 30 % nádorových buněk; buňky obou recidiv nádoru č. 10 byly CK 20 negativní. Až na jednu výjimku (případ č. 7), kde jsme zastihli několik drobných skupinek nádorových buněk vykazujících čepičkovitou paranukleární cytoplazmatickou pozitivitu (obr. 2B), byly zbývající nádory (92 %) CK 7 negativní. Vyšetřené vzorky vykazovaly ve 100 % čepičkovitou paranukleární cytoplazmatickou pozitivitu při použití protilátky MNF116; ve dvanácti vzorcích (92 %) bylo pozitivních více než 60 % nádorových buněk, v jednom případě (8 %) méně než 30 % nádorových buněk; tento případ (č. 8) vykazoval i nižší expresi CK 20 (viz tabulka 2). Buňky obou recidiv nádoru č. 10 vykazovaly pozitivitu při detekci protilátkou MNF 116 (obr. 2A). Studovaný soubor nádorů vykazoval konzistentní negativitu TTF-1 v 100% případů. Exprese CgA byla zastižena v deseti vzorcích (77 %) (obr. 1D), osm pozitivních vzorků vykazovalo pozitivitu v 30–60 % nádorových buněk, jeden vzorek ve více než 60 %, jeden vzorek pouze v nečetných rozptýlených nádorových buňkách; tři vzorky (23 %) byly negativní. Buňky obou recidiv nádoru č. 10 byly CgA negativní. Exprese NSE byla zastižena v jedenácti vzorcích (85 %), devět pozitivních vzorků (70 %) vykazovalo pozitivitu ve více než 60 %, dva vzorky (15 %) pak ve 30–60 % nádorových buněk; dva vzorky (15 %) byly negativní. Každý ze studovaných nádorů vykazoval expresi NSE a/nebo CgA. Výsledky imunodetekce β-tubulinu třídy III se výrazně lišily v závislosti na použité primární protilátce: při použití protilátky TU-20 vykazovalo 12 vzorků (92 %) difuzní intenzivní cytoplazmatickou pozitivitu, 10 vzorků (77 %) v téměř 100 % (obr. 2C), 2 vzorky (15 %) v asi 50 % nádorových buněk, jeden vzorek (8 %) vykazoval negativitu TU-20. Detekce β-tubulinu třídy III pomocí protilátky TuJ-1 byla ve všech vyšetřených vzorcích negativní (obr. 2D). Slabá difuzní cytoplazmatická pozitivita reelinu byla zastižena v asi 10 % nádorových buněk v jednom z případů (8 %), ostatní vzorky (92 %) byly negativní.
1. 1A, B. Karcinom z Merkelových buněk, HE, 100x (A) a 400x (B) 1C. Čepičkovitá („dot-like“) pozitivita cytokeratinu 20 v cytoplazmě nádorových buněk, 400krát 1D. Jemně granulární pozitivita chromograninu A v cytoplazmě nádorových buněk, 400krát 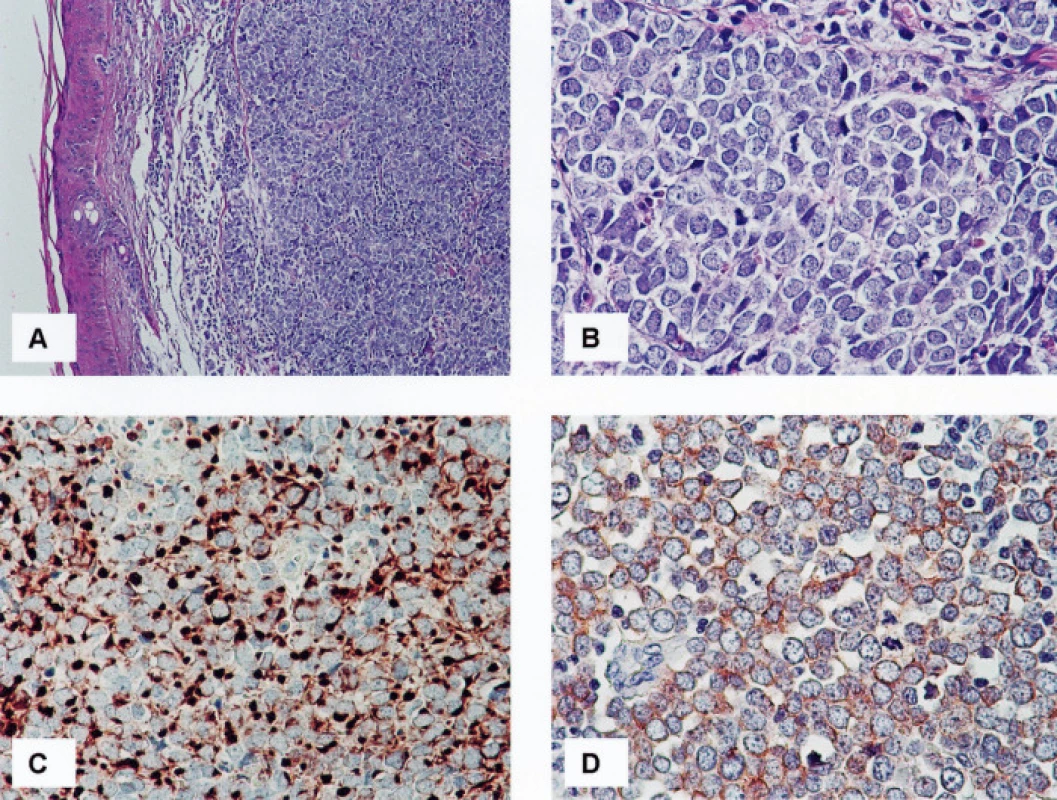
2. Základní klinické údaje a výsledky imunohistochemických reakcí v souboru pacientů 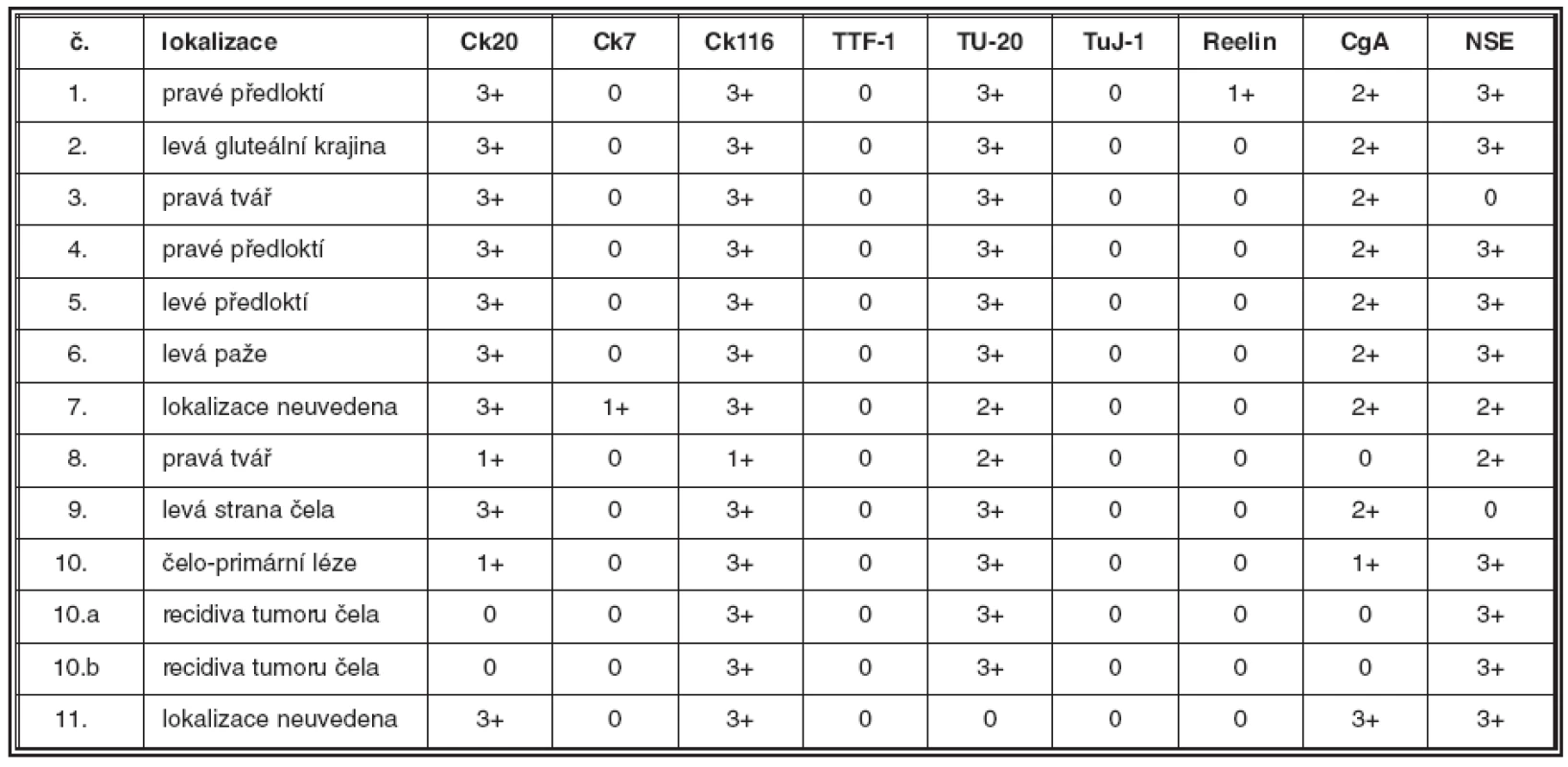
Legenda: Ck20:cytokeratin 20, Ck7: cytokeratin 7, Ck116: MNF116, TTF-1: Thyroid Transcription Factor-1, CgA: chromogranin A, NSE: neuron specifická enoláza, č.: pořadové číslo pacienta, výsledky imunohistochemických reakcí: 0 - negativní reakce, 1 - 33 % nebo méně pozitivních nádorových buněk, 2 - 34-66 % pozitivních nádorových buněk, 3 - více než 66 % pozitivních nádorových buněk 2. 2A. Čepičkovitá pozitivita MNF 116 v cytoplazmě nádorových buněk v jedné ze dvou vyšetřených lokálních recidiv karcinomu z Merkelových buněk, 400krát 2B. Ložisko čepičkovité pozitivity cytokeratinu 7 v cytoplazmě nádorových buněk v jednom z vyšetřených karcinomů, 400krát 2C, D. Detekce beta tubulinu třídy III. Pomocí protilátky TU-20 je zastižena intenzivní difuzní pozitivita v cytoplazmě nádorových buněk (C), imunodetekce pomocí protilátky TuJ-1 je negativní (D), 400krát (C, D) 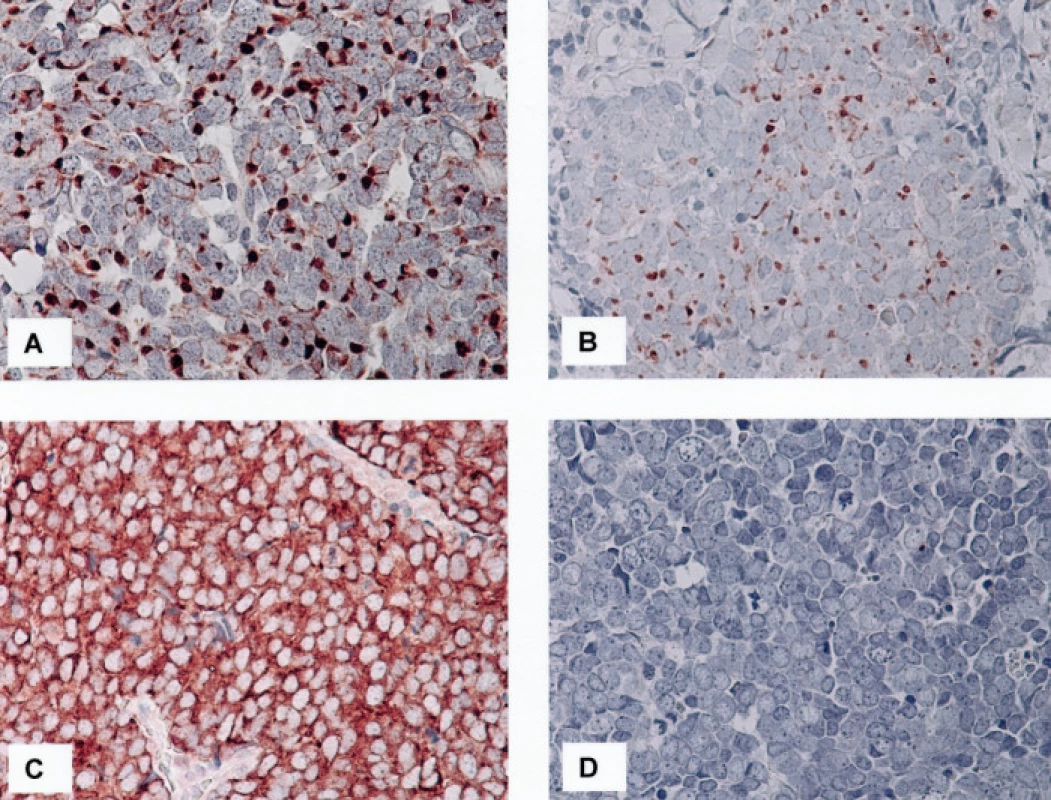
DISKUSE
Karcinom z Merkelových buněk patří ke vzácným kožním nádorům. Stejně jako ostatní neuroendokrinní karcinomy vykazuje znaky epitelové i neuroendokrinní diferenciace. Histopatologická diferenciální diagnostika zahrnuje několik maligních nádorů, mezi které patří zejména malobuněčný maligní melanom, kožní lymfomy, některé formy bazaliomu, Ewingův sarkom a kožní metastázy malobuněčného karcinomu, které představují v běžné diagnostické praxi asi největší diferenciálně diagnostický problém. Diagnóza karcinomu z Merkelových buněk vychází ze základního histologického obrazu solidně uspořádaného nádoru sestávajícího z fenotypicky primitivních polygonálních buněk. Diagnózu je vždy nutné potvrdit imunohistologickým vyšetřením znaků epitelové a neuroendokrinní diferenciace. V současné době se doporučuje vyšetřit nádor panelem protilátek, který zahrnuje CK 20, CK 7, TTF-1, NSE a/nebo neurofilamenta, případně chromogranin A. Buňky Merkelova karcinomu vykazují příznačnou čepičkovitou („dot-like“) pozitivitu nízkomolekulárních cytokeratinů, jako je CK 20. Detekce CK 7 a TTF-1 je typicky negativní; tento nález svědčí proti možnosti kožní metastázy malobuněčného plicního karcinomu, který má být typicky CK 20 negativní, CK 7 pozitivní a TTF-1 pozitivní. Většina popsaných nádorů vykazuje pozitivitu NSE a neurofilament, pozitivita chromograninu A bývá variabilně zastižena jen v menším procentu případů. Nádorové buňky karcinomu z Merkelových buněk jsou typicky negativní v detekci S-100 proteinu, karcinoembryonálního antigenu a lymfocytárních markerů (20).
Charakteristiky našeho souboru nemocných odpovídají, pokud se týče věku nemocných a lokalizace nádorů, dříve publikovaným datům. Tumory se vyskytovaly převážně v osluněných oblastech kůže, v obličeji a na končetinách. Imunohistochemický profil studovaných nádorů byl vcelku typický a odpovídal dříve publikovaným údajům. Ke zvláštním patřil v našem souboru nádor č. 7, u kterého byla patrná kromě výrazné čepičkovité pozitivity CK 20 i fokální perinukleární cytoplazmatická pozitivita CK 7 v drobných okrscích nádorových buněk. Tento nález diagnózu karcinomu z Merkelových buněk nevylučuje, pozitivní imunodetekce CK 7 zde byla již dříve vzácně popsána, včetně případů, které vykazují CK 7 pozitivitu a zároveň jsou CK 20 negativní (6). Ztrátu exprese CK 20 jsme zaznamenali u obou lokálních recidiv jednoho z nádorů (případ č. 10). V této souvislosti se jako zajímavé ukazuje zjištění, že buňky tohoto recidivujícího nádoru si zachovaly charakteristickou čepičkovitou distribuci cytokeratinů, detekovatelnou pomocí protilátky MNF116. Použití protilátky MNF116 se tedy jeví jako přínosné v diagnosticky obtížných případech karcinomu z Merkelových buněk s odlišným imunohistochemickým profilem exprese CK 20. Z analýzy ostatních studovaných případů je zřejmé, že protilátka MNF116 vcelku věrně kopíruje stupeň exprese CK 20 v nádorových buňkách.
Naše výsledky přinášejí nové poznatky o expresi β-tubulinu třídy III v neuroendokrinních karcinomech. Získané výsledky potvrdily náš původní předpoklad, že karcinomy z Merkelových buněk budou vykazovat, podobně jako gastroenteropankreatické NET (8) a plicní karcinoidy (11), pozitivitu tohoto časného markeru neuronální diferenciace. Pozorovaný výrazný rozdíl v imunodetekci β-tubulinu třídy III při použití protilátky TU-20 a TuJ-1 zjištěný u námi sledovaných karcinomů z Merkelových buněk se liší od našich dřívějších pozorování exprese β-tubulinu třídy III v souborech různých karcinomů (9) a v souboru kolorektálních karcinomů různého stupně diferenciace (7). Výrazný rozdíl mezi reaktivitou protilátek TU-20 a TuJ-1 byl pozorován ve skupině dlaždicobuněčných karcinomů, které vykazovaly pozitivitu β-tubulinu třídy III při použití protilátky TuJ-1 (23), zatímco při použití protilátky TU-20 byl výsledek negativní (2). Pozorované rozdíly v imunoreaktivitě obou protilátek jsou v literatuře vysvětlovány rozdílem ve dvou aminokyselinových zbytcích v C-koncové části β-tubulinu třídy III kuřecí mozkové tkáně, specificky rozpoznávaným protilátkou TuJ-1 a lidské mozkové tkáně, rozpoznávané protilátkou TU-20 (2, 15, 16). Dalším možným vysvětlením je známá a častá posttranslační modifikace C-konce různých izotypů β - tubulinů, případně interakce této oblasti s proteiny vážícími mikrotubuly (MAPs), která může změnit antigenní vlastnosti této oblasti (16).
Exprese reelinu v karcinomech z Merkelových buněk nebyla dosud studována. Reelin, který byl popsán jako regulátor migrace mozkových buněk během vývoje, byl nově popsán jako potenciální prognostický marker v nízce diferencovaných prostatických karcinomech. Změny jeho exprese byly popsány i v karcinomech slinivky a jícnu (21, 24). Naše výsledky ukazují, že reelin není exprimován v buňkách karcinomu z Merkelových buněk, i když se jedná o vysoce maligní nádory vykazující známky neuronální i neuroendokrinní diferenciace. Význam tohoto nálezu a jeho vztah k histogenezi karcinomu z Merkelových buněk zbývá vysvětlit.
Závěrem je možné konstatovat, že exprese β-tubulinu třídy III v karcinomech z Merkelových buněk vykazuje významné rozdíly v závislosti na typu primární protilátky, která je použita k jeho imunodetekci. Z hlediska diagnostické praxe se jako zajímavé jeví použití protilátky MNF 116 ke zjištění exprese cytokeratinů v nádorových buňkách, zejména v diagnosticky obtížnějších případech, jakými mohou být například lokální recidivy nádoru.
Práce byla podpořena projektem „Onkologie“ MSM 0021620808 Ministerstva školství, mládeže a tělovýchovy České republiky.
MUDr. Tomáš Jirásek, Ph.D.,
Ústav patologie 3. LF UK a FNKV,
Šrobárova 50,
100 34 Praha 10,
tel.: 267163199,
e-mail: tjirasek@fnkv.cz
Sources
1. Bayrou, O., Avril, M. F., Charpentier, P., et al.: Primary neuroendocrine carcinoma of the skin. Clinicopathologic study of 18
cases. J Am Acad Dermatol., 24, 1991, s. 198–207.
2. Dráberová, E., Lukás, Z., Ivanyi, D., et al.: Expression of class III beta-tubulin in normal and neoplastic human tissues. Histochem
Cell Biol., 109, 1998, s. 231–239.
3. Easter, S. S. Jr., Ross, L. S., Frankfurter, A.: Initial tract formation in the mouse brain. J Neurosci., 13, 1993, s. 285–299.
4. Gaudin, P. B., Rosai, J.: Florid vascular proliferation associated with neural and neuroendocrine neoplasms. A diagnostic clue
and potential pitfall. Am J Surg Pathol., 19, 1995, s. 642–652.
5. Herz, J., Chen, Y.: Reelin, lipoprotein receptors and synaptic plasticity. Nat Rev Neurosci., 7, 2006, s. 850–859.
6. Jensen, K., Kohler, S., Rouse, R. V.: Cytokeratin staining in Merkel cell carcinoma: an immunohistochemical study of cytokeratins
5/6, 7, 17, and 20. Appl Immunohistochem Mol Morphol., 8, 2000, s. 310–315.
7. Jirásek, T., Cipro, S., Musilová, A., et al.: Expression of class III β-tubulin in colorectal carcinomas: an immunohistochemical study
using TU-20 and TuJ-1 antibody. Indian J Med Res. v tisku 8. Jirásek, T., Mandys, V., Viklický, V.: Expression of class III betatubulin
in neuroendocrine tumours of gastrointestinal tract. Folia Histochem Cytobiol., 40, 2002, s. 305–310.
9. Jirásek, T., Písaríková, E., Viklický, V., Mandys, V.: Expression of class III beta-tubulin in malignant epithelial tumours: an immunohistochemical study using TU-20 and TuJ-1 antibodies. Folia Histochem Cytobiol., 45, 2007, s. 41–45.
10. Katsetos, C. D., Frankfurter, A., Christakos, S., et al.: Differential localization of class III, beta-tubulin isotype and calbindin -
D28k defines distinct neuronal types in the developing human cerebellar cortex. J Neuropathol Exp Neurol., 52, 1993, s. 655–666.
11. Katsetos, C. D., Kontogeorgos, G., Geddes, J. F., et al.: Differential distribution of the neuron-associated class III beta-tubulin
in neuroendocrine lung tumors. Arch Pathol Lab Med., 124, 2000, s. 535–544.
12. Katsetos, C. D., Legido, A., Perentes, E., Mörk, S. J.: Class III beta-tubulin isotype: a key cytoskeletal protein at the crossroads
of developmental neurobiology and tumor neuropathology. J Child Neurol., 18, 2003, s. 851–866.
13. Kohler, S., Kerl, H.: Merkel cell carcinoma. In: LeBoit, P. E., Burg, G., Weedon, D., et al., eds. World Health Organization
Classification of Tumours. Pathology and Genetics of Skin Tumours. Lyon: IARC Press, 2006, s. 272–273.
14. Kukharskyy, V., Sulimenko, V., Macůrek, L., et al.: Complexes of gamma-tubulin with nonreceptor protein tyrosine kinases Src
and Fyn in differentiating P19 embryonal carcinoma cells. Exp Cell Res., 298, 2004, s. 218–228.
15. Lobert, S., Frankfurter, A., Correia, J. J.: Binding of vinblastine to phosphocellulose-purified and alpha beta-class III tubulin: the
role of nucleotides and beta-tubulin isotypes. Biochemistry, 34,1995, s. 8050–8060.
16. LudueĖa, R. F.: Are tubulin isotypes functionally significant. Mol Biol Cell., 4, 1993, s. 445–457.
17. Perrone, G., Vincenzi, B., Zagami, M., et al.: Reelin expression in human prostate cancer: a marker of tumor aggressiveness
based on correlation with grade. Mod Pathol., 20, 2007, s. 344–351.
18. Pilotti, S., Rilke, F., Lombardi, L.: Neuroendocrine (Merkel cell) carcinoma of the skin. Am J Surg Pathol., 6, 1982, s. 243–254.
19. Ratner, D., Nelson, B. R., Brown, M. D., Johnson, T. M.: Merkel cell carcinoma. J Am Acad Dermatol., 29, 1993, s. 143–156.
20. Santa Cruz, D. J.: Tumors of the skin. In: Fletcher, C. D. M., ed. Diagnostic Histopathology of Tumors. 3rd ed., Philadelphia:
Churchill Livingstone Elsevier, 2007, s. 1465–1466.
21. Sato, N., Fukushima, N., Chang, R., et al.: Differential and epigenetic gene expression profiling identifies frequent disruption of
the RELN pathway in pancreatic cancers. Gastroenterology, 130, 2006, s. 548–565.
22. Schmid, C., Beham, A., Feichtinger, J., et al.: Recurrent and subsequently metastasizing Merkel cell carcinoma in a 7-year-old
girl. Histopathology, 20, 1992, s. 437–439.
23. Scott, C. A., Walker, C. C., Neal, D. A., et al.: Beta-tubulin epitope expression in normal and malignant epithelial cells. Arch
Otolaryngol Head Neck Surg., 116, 1990, s. 583–589.
24. Wang, Q., Lu, J., Yang, C., et al.: CASK and its target gene Reelin were co-upregulated in human esophageal carcinoma. Cancer
Lett., 179, 2002, s. 71–77.
25. Walsh, N. M.: Primary neuroendocrine (Merkel cell) carcinoma of the skin: morphologic diversity and implications thereof. Hum Pathol., 32, 2001, s. 680–689.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2009 Issue 1
Most read in this issue- Histological Differential Diagnosis of Hydatidiform Moles and Hydropic Abortions
- Post-Radiation Dedifferentiation of Meningioma into Chondroblastic Osteosarcoma
- Merkel Cell Carcinoma – Immunohistochemical Study in a Group of 11 Patients
- Diagnostic Possibility of Celiac Disease in Bioptic Practise
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

