-
Medical journals
- Career
HISTOLOGICKÁ DIFERENCIÁLNÍ DIAGNOSTIKA HYDATIDÓZNÍCH MOL A HYDROPICKÝCH ABORTŮ
: M. Zavadil; J. Feyereisl; V. Hejda; L. Krofta; P. Šafář
: Ústav patologie 3. LF UK a FNKV, Praha 1; Oddělení patologie a molekulární medicíny, FTNsP, Praha 2; Dermatohistopatologická laboratoř, Praha 3
: Čes.-slov. Patol., 45, 2009, No. 1, p. 3-8
: Original Article
Cíl studie:
Popsat diagnostické postupy umožňující histologickou diferenciální diagnostiku moly hydatidózy kompletní, moly hydatidózy kompletní nezralé, moly hydatidózy, parciální moly proliferans a hydropického abortu.Metodika:
Práce zahrnuje 1321 parciálních, hydatidózních mol, 805 kompletních mol, 524 proliferujících mol a přes 2500 hydropických abortů diagnostikovaných a léčených v Centru pro trofoblastickou nemoc v ČR (CTN – ČR), Ústavu pro péči o matku a dítě (ÚPMD) Praha – ČR, a dále 2896 těchto lézí vyšetřených v CTN konzultačně. Materiál byl vyšetřen rutinní histopatologickou metodikou doplněnou u vybraných případů vyšetřením imunohistologickým a korelován s cytogenetickými a molekulárně genetickými závěry a klinickým průběhem.Výsledky:
Uvedeny diagnostické postupy umožňující diferenciální diagnózu mezi molou hydatidózou kompletní zralou, nezralou kompletní molou, parciální molou, proliferujíci molou a hydropickým abortem. Je definováno 14 histologických parametrů, které jsou nejčastější, jednotlivě nebo v kombinacích, u různých typů mol a hydropických abortů. Je upozorněno na chyby v histologické diagnostice při korelaci s cytogenetickými a molekulárně genetickými závěry. Je navržen spolehlivý způsob jak eliminovat vliv těchto chyb na možný rozvoj trofoblastické nemoci.Závěr:
Práce popisuje histologickou diferenciální diagnostiku moly hydatidózy kompletní, moly hydatidózy parciální, moly hydatidózy kompletní nezralé, proliferující moly a hydropického abortu.Klíčová slova:
mola hydatidóza kompletní – nezralá mola hydatidóza kompletní – parciální mola hydatidóza – mola proliferans – hydropický abort – diferenciální diagnostikaHydatidózní moly znali již staří Římané a Egypťané a pokládali je za parazitární onemocnění. Ve středověku považovali jednotlivé hydatidy za začarované děti a někdy je i křtili (11). Teprve v 19. století pařížská porodní bába Boivenová rozpoznala, že mola je edematózně změněná placenta. Vznik edému přisuzoval Park (13) hyperplazii trofoblastu, Hertig (4) nepřítomnosti cév v klcích. Patogeneze byla odkryta až pomocí chromozomálního polymorfismu využívajícího pruhování chromozomů (16, 17, 18). Cytogeneticky tak byly definovány: 1. Kompletní hydatidózní mola (MHK), která vzniká z vajíčka, které ztratilo během meiózy všechny své mateřské chromozomy (empty ovum). Toto „prázdné“ vajíčko je většinou oplozeno jednou spermií s následnou reduplikací chromozomů. To vede ke vzniku diploidní androgenní zygoty. 2. Parciální hydatidózní mola (MHP) vzniká oplozením normálního vajíčka dvěma spermiemi. To vede ke vzniku triploidní zygoty se dvěma třetinami otcovských chromozomů a jednou třetinou mateřských. Díky mateřským chromozomům se u MHP embryo vždy vyvíjí. Zcela výjimečně, těžce malformované, se může dožít až termínu porodu. U MHK se embryo vzhledem k absenci mateřských chromozomů prakticky nevyvíjí. V bioptickém materiálu je proto nezachytíme. Histologický obraz MHK se s délkou těhotenství velmi výrazně mění. MHK proto nově rozdělujeme na staré, tj. plně vyvinuté moly, pro které užíváme název „zralé“, a na mladé, které označujeme jako „nezralé“ . Hranice mezi oběma je přibližně mezi 1. a 2. trimestrem. Zralé MHK jsou lehce makroskopicky i mikroskopicky diagnostikovatelné (generalizovaný excesivní edém, avaskulární klky s hyperplazií trofoblastu na její periferii a atrofií v centrálních partiích). Diagnóza nezralé MHK je složitější, protože její obraz se makro i mikroskopicky přibližuje MHP. Těmto obrazům se navíc blíží tzv. hydropický abort (HA), geneticky zcela odlišný (trizomie, monozomie, translokace, mateřské triploidie aj.). Diferenciálně diagnostické obtíže a záměna těchto entit jsou poměrně časté (1, 12). Z hlášení zasílaných do Centra pro trofoblastickou nemoc v České republice z jednotlivých patologických a bioptických pracovišť včetně fakultních jsme zjistili, že většina bioptického materiálu získaného z evakuací a kyretáží dutiny děložní je vyšetřována rutinním způsobem. Proto jsme tuto práci zaměřili na histopatologickou metodiku a o speciálních metodách se zmíníme jen okrajově v diskusi.
Materiál a metodika
Práce se opírá o klinicko-patologický materiál zachycený v Centru pro trofoblastickou nemoc v ČR od 1955–2008, který zahrnuje 1321 parciálních hydatidózních mol, 805 kompletních mol, 524 proliferujících mol a přes 2500 hydropických abortů léčených a diagnostikovaných v CTN a dále konzultační materiál zachycující 2896 mol. Bioptický materiál byl zpracován rutinní histopatologickou metodikou doplněnou u vybraných případů imunohistologickým vyšetřením a korelován s cytogenetickými a molekulárně genetickými závěry. Hydatidózní moly byly rozděleny podle klasifikace WHO, vycházející z cytogenetických nálezů, na parciální, kompletní a proliferující – invazivní moly (19). Kompletní moly byly dále rozděleny na zralé a nezralé. Do souboru byly zavzaty ještě hydropické aborty pro jejich částečnou histologickou podobnost s hydatidózními molami.
Histologickou diagnózu stanovujeme kvantitativním vyhodnocením 14 morfologických parametrů, které jsme sestavili pro přehled do tabulky 1.
1. Histologická diagnostika hydatidózních mol a hydropických abortů (CTN 2008) 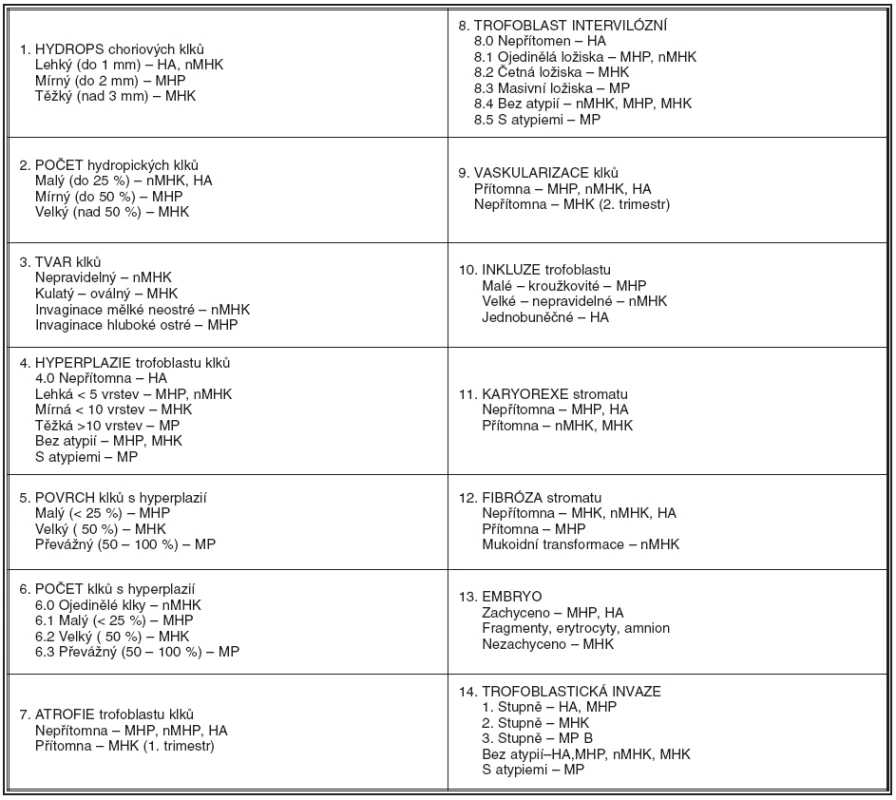
Výsledky
1. Hydrops choriových klků.
Hodnotíme podle největšího průměru choriových klků. Normální velikost klků závisí na délce těhotenství. Připomeňme, že klky v 1. trimestru měří cca 170 μm a postupně se zmenšují až do porodu. Patologické zvětšení klků u mol je způsobeno edémem a potřebuje ke svému vzniku určitý čas. Arbitrárně rozeznáváme 3 stupně:
- lehký hydrops – do 1 mm,
- mírný hydrops – do 3 mm,
- těžký hydrops – více než 3 mm.
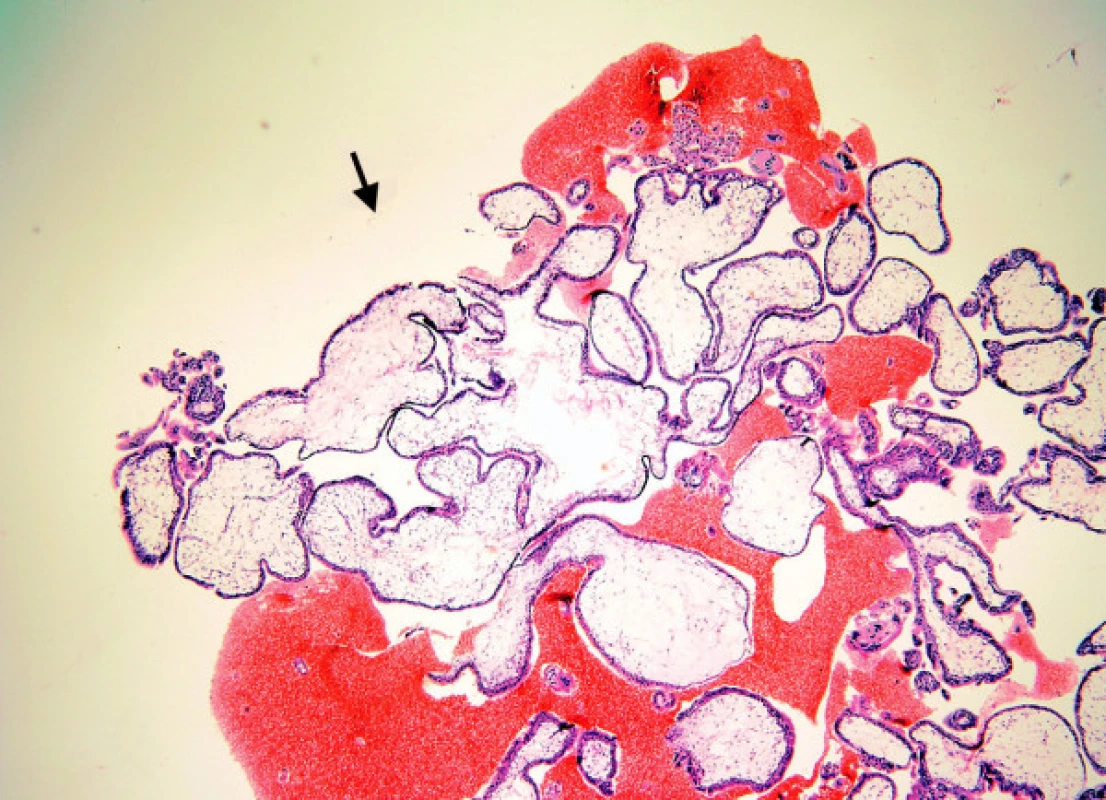
Lehký hydrops je charakteristický pro spontánní hydropické aborty (HA), které v době jejich zachycení mají většinou nejkratší dobu těhotenství (obr. 1). Mírný hydrops do 3 mm bývá u parciálních hydatidózních mol (MHP), které jsou vzhledem k ultrazvukové identifikaci embrya, ale obtížnému UZ rozpoznání, evakuovány později, na hranici 1. a 2. trimestru. Těžký hydrops klků nad 3 mm, nezřídka až 10 mm, je typický pro zralé kompletní moly (MHK), evakuované ve 2. trimestru. Staré MHK jsme vídali v době před zavedením UZ, dnes se s nimi setkáváme méně často. Častěji dnes zachytíme kompletní moly nezralé (nMHK), označované též jako časné či mladé. Umožnila to sofistikovaná ultrazvuková diagnostika, která je schopna odhalit absenci embrya již v 6. až 8. týdnu, což vede k mnohem dřívější evakuaci dělohy, většinou v 1. trimestru. Vzhledem ke krátké době gravidity je hydrops klků mnohem menší, kolem 1 mm, a jejich počet bývá malý. To může vést k chybné diagnóze HA, eventuálně MHP.
1. Hydropický abort: edém klků (šipka), bez hyperplazie trofoblastu. (Zvětšení všech obrázků 50krát, HE) 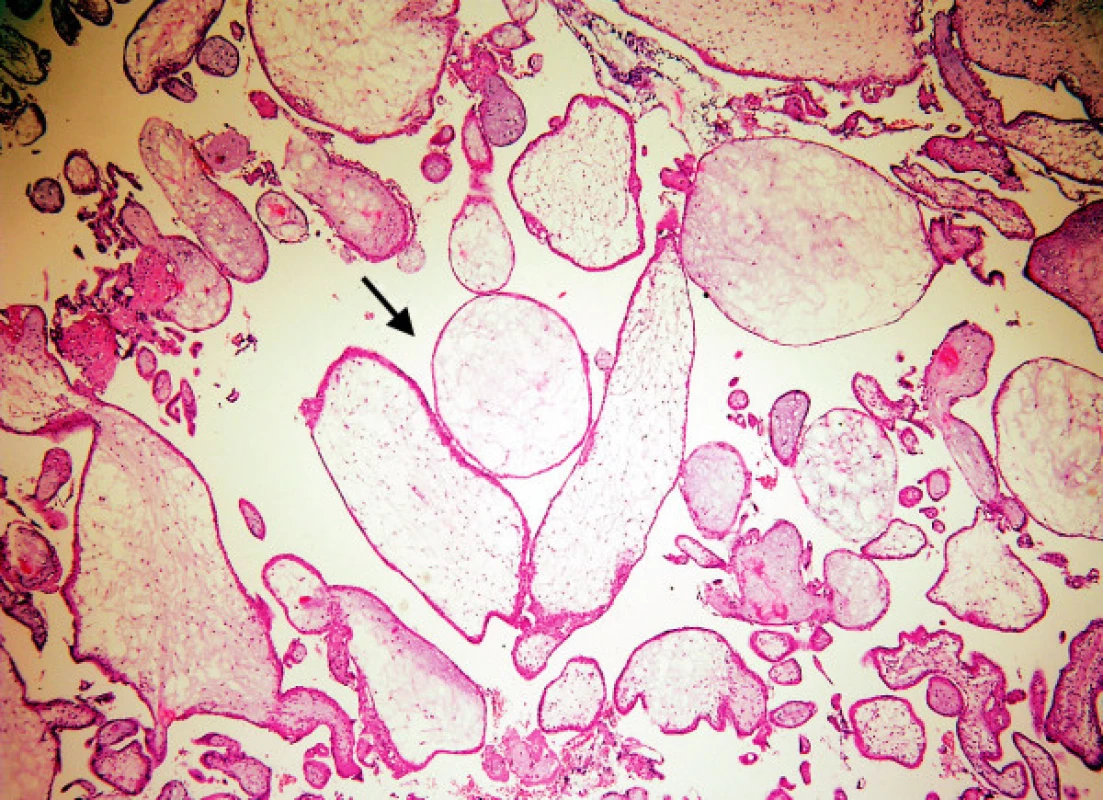
2. Počet hydropických klků
je podobně jako jejich zvětšení závislý na délce těhotenství. Generalizovaný hydrops zahrnující až 100 % klků, vyžaduje ke svému vzniku 16–20 týdnů. nMHK staré jen 6–8 týdnů a HA mohou mít jen ojedinělé klky hydropické. S pokračující délkou gravidity se jejich počet zvětšuje.
Pro spolehlivé hodnocení počtu hydropických klků je nutné mít k dispozici alespoň 100 klků z různých míst. Neadekvátní množství materiálu může vést k chybné diagnóze. Malý počet hydropických klků do 25 % se vyskytuje u nMHK a HA. Mírný počet hydropických klků do 50 % nacházíme nejčastěji u MHP. Velký počet hydropických klků přes 50 % je typický pro MHK. Těžký generalizovaný hydrops dosahující až 100 % klků je patognomický pro velmi staré MHK, se kterými se dnes setkáváme zřídka.
3. Tvar klků.
Zde hodnotíme plynulost kontury klků. Nepravidelný tvar (obr. 3) se vyskytuje u nMHK, někdy i s drobnými „polypoidními“ vychlípeninami trofoblastu, současně se stromatem, které připomínají vývoj sekundárních klků v časném vývoji placenty. Tyto změny se nesmí splést s „vroubkováním“ povrchu typickým pro MHP. Charakteristické pro nMHK jsou mělké, neostré invaginace povrchu klků (obr. 2) do stromatu, které jsou zdrojem nepravidelných, velkých „trofoblastických inkluzí.“ Invaginace hluboké, úzké, označované jako „fjordovité“ (obr. 4) jsou typické pro MHP a jsou zdrojem charakteristických malých, kulatých inkluzí. Kulatý, oválný tvar klků spolu s těžkým hydropsem je patognomickým znakem staré MHK.
2. Nezralá mola hydatidosa completa: nepravidelný tvar klků, edém, lehká hyperplazie trofoblastu, mělké široké invaginace (šipka) 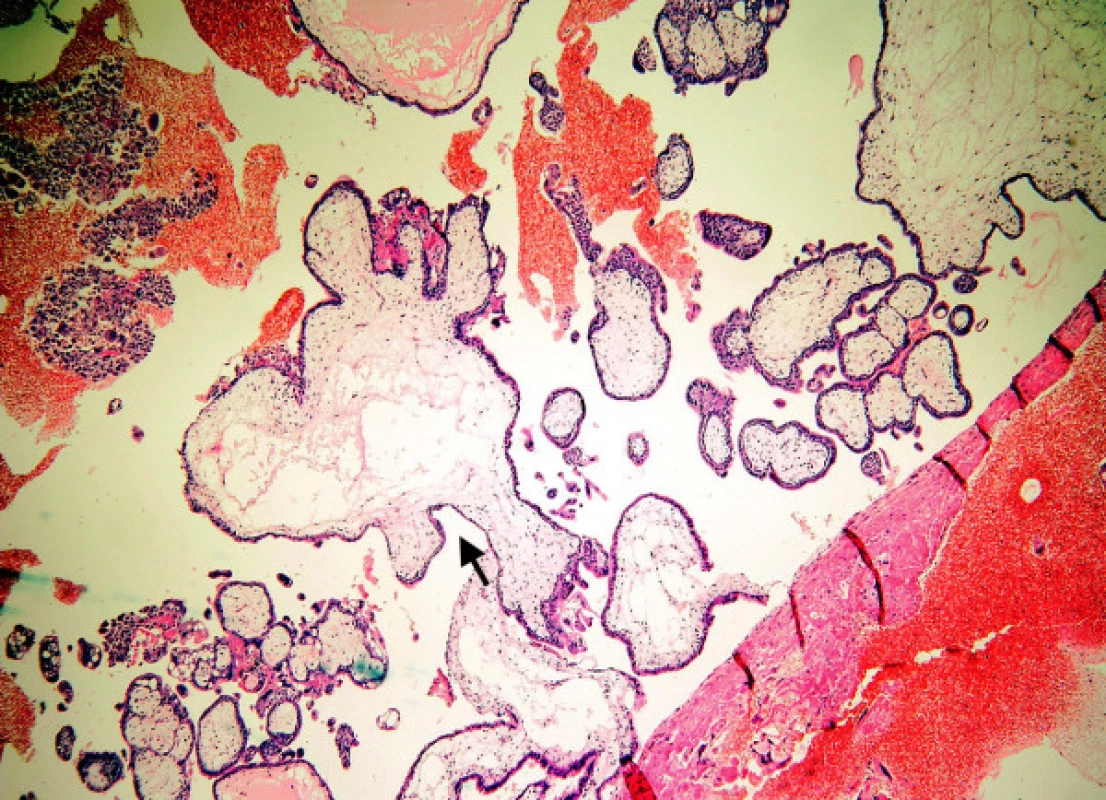
4. Mola hydatidosa partialis: hydropické i normální klky, lehká hyperplazie trofoblastu, hluboké, úzké „fjordovité“ invaginace (šipky) 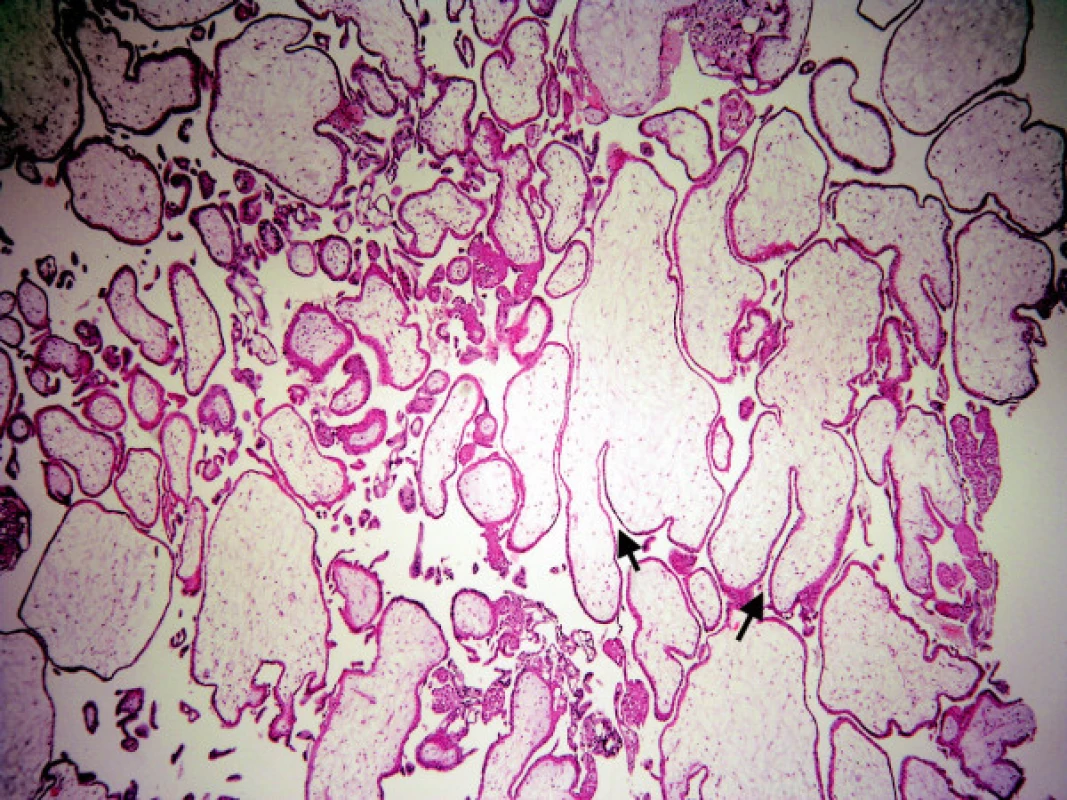
4. Hyperplazie trofoblastu klků
je stav, kdy povrch klků je kryt více než jednou vrstvou cytotrofoblastu a syncytiotrofoblastu. U hyperplazie musíme vyhodnotit její stupeň, jakou část klků zaujímá, počet klků s hyperplazií a přítomnost atypií. Hyperplazii hodnotíme v kolmici na povrch klků a rozeznáváme hyperplazii: 1. lehkou, do 5 vrstev trofoblastu, 2. mírnou, do 10 vrstev trofoblastu a 3. těžkou, více než 10 vrstev trofoblastu, s různým podílem cyto-intermedio a syncytiotrofoblastu.
Hyperplazie může být buď fokální a nepravidelně rozložená, nebo pokrývat část obvodu až celý obvod klků, bez atypií nebo s atypiemi.
Hyperplazie není přítomna u většiny HA. S velmi lehkou hyperplazií, nepravidelně rozmístěnou na obvodu klků, se setkáváme u nMHK. Hyperplazie zde má formu pupenů a může se vyskytnout i u nehydropických klků. Trofoblastické pupeny mohou přecházet v lehkou hyperplazii. Lehká hyperplazie je nejčastěji přítomna u MHP a většinou zabírá méně než 25 % povrchu. Syncytiotrofoblast zde může vytvářet „pentlicové“ mikrostruktury a často bývá vakuolizovaný. Pravidelně se opakující drobná ložiska lehké hyperplazie na obvodu klků se označují jako „vroubkování“ (scalloping). Vroubkování je typické pro MHP a většinou zaujímá jen část povrchu klků. Mírná hyperplazie většinou postihující méně než 50 % obvodu klků je charakteristická pro MHK. Někdy zde nalézáme lehkou nukleární polymorfii. Těžká hyperplazie je patognomická pro proliferující moly (MP) (obr. 6 – jednoduchá šipka). Hyperplastický vilózní trofoblast vytváří často objemná ložiska, která jsou zdrojem intervilózně uložených solidních ložisek trofoblastu charakterizujících MP. Větší ložiska hypertrofického vilózního trofoblastu se mohou vyskytnout u MHK.Tyto moly hodnotíme jako hraniční formy s přechodem v MP (obr. 6 – složená šipka). U MHP a MHK je hypertrofický trofoblast bez atypií. Těžká hyperplazie s atypiemi je znak definující MP.
5. Mola proliferans: těžká hyperplazie vilózního trofoblastu pokrývající celý obvod klků (malá šipka). Objemná ložiska intervilózního trofoblastu (velká šipka), atypie 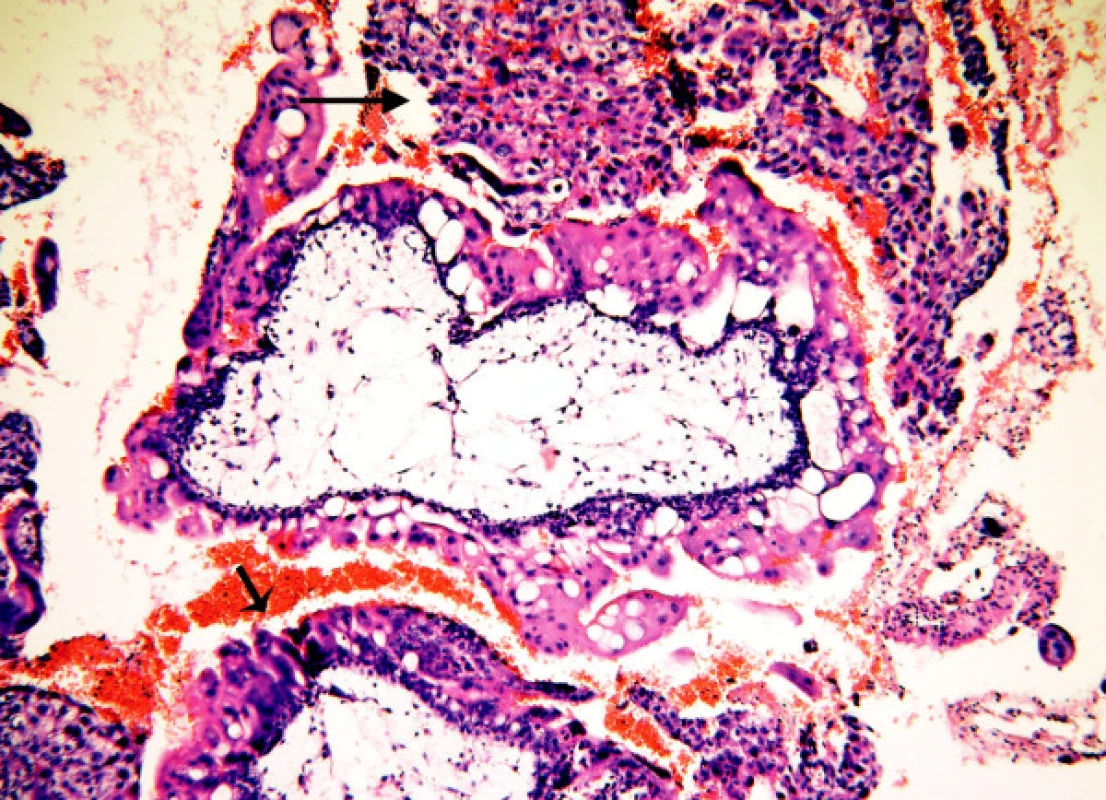
5. Povrch klků s hyperplazií
je významným diferenciálně diagnostickým znakem pro rozlišení různých typů mol. Malá část obvodu klků s hyperplazií do 25 % je charakteristická pro MHP. Velká část do 50 % povrchu klků ve fetomaternální junkci je typická pro MHK. Hyperplazie převážné části obvodu klků nad 50 %, často postihující celý obvod klků je patognomická pro MP.
6. Počet klků s hyperplazií
vilózního trofoblastu je dalším užitečným znakem umožňujícím rozlišit jednotlivé moly, máme-li k dispozici nejméně 100 klků. Ojedinělé klky s hyperplazií mívají nMHK. Malý počet klků (do 25 %) s hyperplazií je typický pro MHP. Velký počet klků (do 50 %) nacházíme u MHK. Převážný počet klků s hyperplazií 50–100 % je charakteristický pro MP.
7. Atrofický trofoblast
tvoří jen úzkou jednu vrstvu trofoblastu pokrývající klky. Setkáváme se s ním u starých MHK v jejich centrálních partiích a v naprosté většině u velkých hydropických avaskulárních klků s cisternami (obr. 5). V periferních částech těchto mol je trofoblast hyperplastický a v junkční zóně je přítomna trofoblastická invaze různého stupně. Atrofický trofoblast prakticky nikdy nezastihneme u nMHK a MHP a jen vzácně u HA.
8. Trofoblast intervilózní
vytváří různě velká intervilózní ložiska mezi jednotlivými klky. Je důležitým diferenciálně diagnostickým znakem. Za intervilózní trofoblast nesmíme zaměnit polární trofoblast kotvících klků.
Intervilózní trofoblast je nepřítomen u HA. Ojedinělá drobná ložiska se mohou vyskytovat u nMHK a MHP. Četná ložiska mají MHK. Masivní ložiska jsou typická pro MP, současně s různě pokročilými atypiemi. Atypie se nevyskytují u nMHK, MHP a MHK.
9. Vaskularizace klků.
Přítomnost a počet cév u hydatidózních mol závisí na délce těhotenství a přítomnosti živého embrya – fetu. Do 12. týdne lze cévy v klcích vždy prokázat. Jejich počet s pokračující délkou těhotenství klesá. Mladé nMHK v 1. trimestru mají klky vždy vaskularizované. MHK evakuované až v 2. trimestru jsou vždy avaskulární. MHP mají cévy, pokud je fetus živý. Cévy u MHP zanikají po smrti fetu a čím je interval mezi smrtí fetu a evakuací delší, tím méně cév lze v klcích prokázat. Staré MHP po smrti fetu jsou proto avaskulární – asi ve 30 % se u těchto mol vyskytují angiomatoidní malformované cévy. Cévy MHP bývají dobře rozlišitelné a často obsahují fetální jaderné erytrocyty. Naproti tomu cévy MHK bývají kolabované, nenápadné, prázdné. Stará poučka, že MHK jsou avaskulární a MHP vaskularizované, v této zjednodušené formě neplatí. Vaskularizaci jako diferenciálně diagnostický znak mezi MHP a MHK je nutno hodnotit s přihlédnutím k výše uvedeným skutečnostem. Pro vaskularizaci klků bývají často nMHK zaměněny za MHP.
10. Inkluze trofoblastu
jsou zvláštním histologickým fenoménem původně popsaným u MHP. Nejde ovšem o pravé inkluze, ale o hluboké, úzké, „fjordovité“ invaginace povrchu choriových klků do stromatu, zachycené na příčných řezech. Mají charakter malých kroužků umístěných ve stromatu klků, bez souvislosti s povrchem. Jejich trofoblastická výstelka, vzhledem k vzniku, má opačné vrstvení. Povrchovou vrstvu tvoří cytotrofoblast a spodní vrstvu syncytiotrofoblast. Malé inkluze jsou u MHP poměrně časté a vyskytují se také u nehydropických klků, proto je pokládáme za diagnosticky významné. Nutno však uvážit, že se mohou, i když vzácně, vyskytovat také u HA při trizomii 16 a 18 a monozomii 45 XO. V těchto případech však vždy chybí hyperplazie trofoblastu. Na rozdíl od těchto kulatých, malých inkluzí se setkáváme u nMHK s velkými, nepravidelnými inkluzemi a stejně opačně vrstveným cyto a syncytiotrofoblastem. Vznikají obdobně, příčným řezem širokých, nepravidelných invaginací. Od obou typů uvedených inkluzí musíme odlišit inkluze jednobuněčné, vznikající zanořením pouze cytotrofoblastu do stromatu. Vyskytují se u HA vyvolaných trizomiemi.
11. Karyorexe stromatu.
Karyorektický rozpad stromálních buněk je zatím nevysvětlený jev, který se vyskytuje u nMHK a můžeme ho pozorovat také u MHK před vznikem generalizovaného hydropsu. U MHP a HA se nevyskytuje. Je proto užitečným diferenciálně diagnostickým znakem.
12. Fibróza stromatu
se nevyskytuje u HA, nMHK a MHK. U MHP je tím větší čím delší je interval mezi odumřením plodu a evakuací. Staré avaskulární MHP po časné smrti plodu se proto vyznačují nápadnou fibrózou. Poměrně vzácně můžeme zachytit u nMHK mukoidní transformaci stromatu projevující se jeho bazofilní přeměnou.
13. Embryo
se u MHP a HA vyvíjí vždy. Zcela výjimečně může u MHP přežít až do termínu porodu. Většinou však odumírá na hranici 1. a 2. trimestru. V bioptickém materiálu zachytíme buď jeho části (20 %), fetální jaderné erytrocyty (50 %), nebo části amnia (30 %). U MHK se embryo sice také zakládá, ale odumírá po několika dnech. Proto ho v bioptickém materiálu nikdy nezachytíme.
14. Trofoblastická invaze
je přítomna u každé moly i HA. Její záchyt závisí na správném, frakcionovaném odběru.To znamená, že centrální části materiálu evakuovaného z dutiny děložní musí být dodány odděleně od materiálu získaného následnou kyretáží stěny dutiny děložní. Pokud tak klinik nečiní, je nutné ho na to upozornit. Intenzita trofoblastické invaze většinou koreluje s typem moly i HA. U HA a MHP bývá 1. stupeň, u MHK 2. stupeň, u MP 3. stupeň. Stupeň trofoblastické invaze hodnotíme podle počtu buněk intermediálního trofoblastu (jednojaderných i vícejaderných) zachycených v zorném poli obj. 40. První stupeň do dvaceti buněk, druhý stupeň do padesáti, třetí stupeň více než padesát elementů, někdy i s epiteloidní kohezí. U HA, MHP, nMHK, MHK je trofoblastická invaze bez atypií. Pro MP jsou atypie patognomické. MP s trofoblastickou invazí 3. stupně s atypiemi hyperplastického vilózního trofoblastu, vysokými proliferačními markery a masivními ložisky atypického intervilózního trofoblastu označujeme jako MP s přechodem v choriokarcinom a jsou indikací k chemoterapii.
Předpokladem správné histologické diagnózy je možnost vyhodnotit polovinu uvedených parametrů a uzavřít histopatologickou analýzu jako: 1. hydropický abort (obr. 1), 2. nezralou molu hydatidózu (obr. 2 a 3), 3. molu hydatidózu parcialis (obr. 4), 4. molu hydatidózu kompletní (obr. 5) či 5. molu proliferans (obr. 6). Připomeňme, že termín hydropický abort je klinickopatologická jednotka dnes již obecně používaná, nahrazující dřívější, čistě patologický termín hydropická degenerace choriových klků podle WHO (19). Pozorovat všech 14 parametrů není většinou možné. Zachytíme-li méně než polovinu znaků, kromě znaků jednoznačně patognomických, je histologická diagnóza pouze pravděpodobná. Tuto skutečnost je nutno v diagnostickém závěru uvést, protože klinik v těchto případech musí modifikovat svůj další postup.
6. Mola hydatidosa completa: těžký edém klků (mezi šipkami), atrofie trofoblastu centrálních částí moly, cisterny 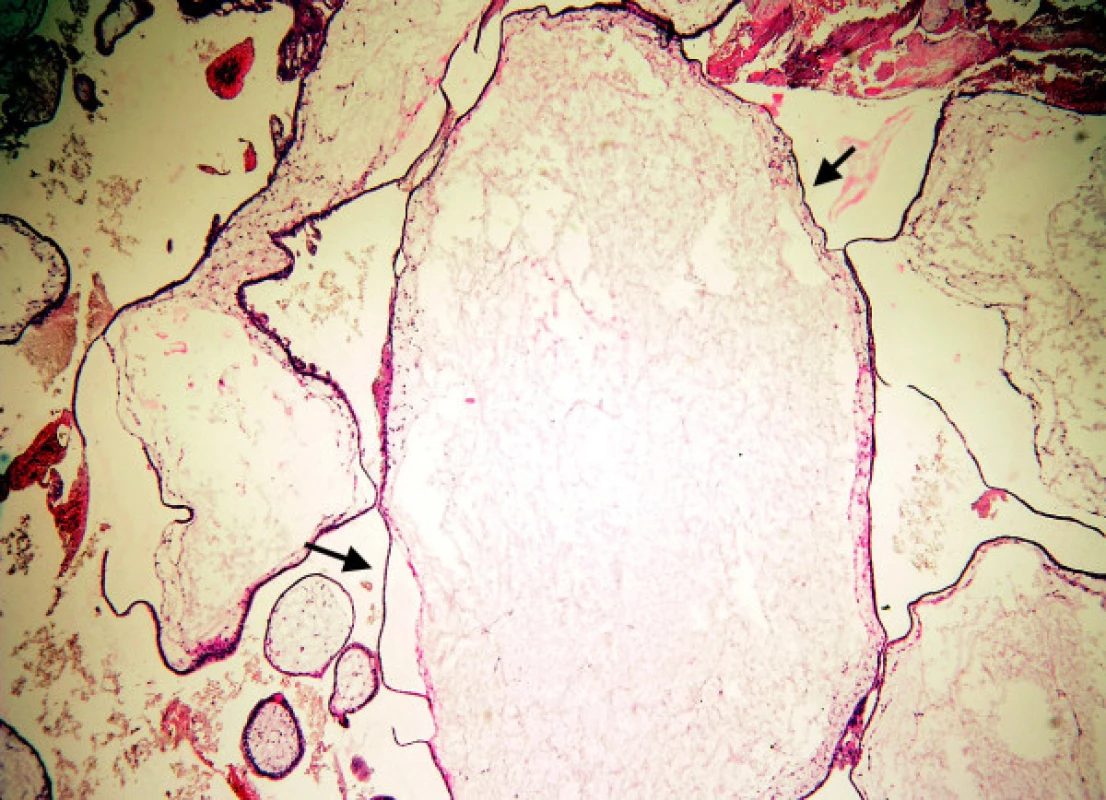
Histologické vyšetření nemůže vždy stoprocentně zajistit správnou diagnózu. Také doplnění a ověření každé bioptické diagnózy molekulárně genetickým vyšetřením není z ekonomických důvodů realizovatelné. V CTN více než 10 let uskutečňujeme a vzhledem k dobrým zkušenostem doporučujeme následující řešení:
U případů diagnostikovaných jako moly, vzhledem k možnosti vzniku perzistující trofoblastické nemoci a choriokarcinomu, lze nahradit drahé molekulárně genetické metody monitorováním hCG. U parciální moly půl roku, u kompletní moly 1 rok, u proliferující moly 2 roky. U bioptické diagnózy označené jako pravděpodobná MHP, MHK, nMHK, nebo HA stačí sledovat hCG do první negativity. Tento postup spolehlivě a včas zamezí vzniku nediagnostikované trofoblastické nemoci. V případě potřeby je možné konzultovat CTN – ČR (spojení viz níže). Molekulárně genetické vyšetření je indikováno u opakujících se hydropických potratů a mol, z genetických důvodů a u výzkumných projektů.
Diskuse
Histologická diagnostika hydatidózních mol prodělala několik etap, které souvisejí se zavedením nových vyšetřovacích metod. Jejich závěry umožnily přesněji rozlišit a klasifikovat histologické obrazy těchto lézí.
V 1. etapě vysvětloval mikroskopii kompletní hydatidózní moly její histologický obraz. Tato plně vyvinutá zralá mola, známá již Egypťanům, byla jedinou formou mol až do zavedení cytogenetických metod v 70. letech minulého století. Snad stojí za zmínku, že již v této etapě popsal Zavadil formu moly, kterou označil jako „mikromolu“ (20). Jak se ukázalo později, byly tyto „mikromoly“ ve skutečnosti buď MHP nebo nMHK.
Ve 2. etapě Vasilakos a další (18, 5, 16, 17) pomocí cytogenetického chromozomálního polymorfismu rozdělili hydatidózní moly na MHP a MHK. Současně definovali některé histologické znaky umožňující jejich histologické rozlišení, s důrazem na přítomnost cév v klcích u MHP a jejich absenci u MHK. Striktní ulpívání na této premise vedlo a stále vede k diagnostických chybám.
Třetí etapa začala zavedením molekulárně genetických metod (polymorfismu DNA), které umožnily odlišit od hydatidózních mol léze histologicky podobné, ale geneticky zcela odlišné (trizomie, translokace, monozomie, mateřské triploidie a jiné), jejíchž průvodním znakem je také hydrops klků a které proto zahrnujeme do společné histologické diagnózy jako hydropický abort (HA) (2, 6–8).
Čtvrtou etapu odstartovalo používání trojrozměrného ultrazvuku s dopplerovským principem, které umožňuje zjistit absenci embrya již v 6.–8. týdnu. Sofistikovaná UZ diagnostika spolu s molekulárně genetickou analýzou při známém stáří těhotenství umožnila vymezit histologický obraz nezralé kompletní moly jako podtyp MHK a odlišit ji od MHP. Díky výše uvedenému rozeznáváme dnes: 1. kompletní hydatidózní moly – zralé, 2. kompletní hydatidózní moly – nezralé, 3. parciální hydatidózní moly, jejichž histologický obraz také ovlivňuje délka těhotenství a délka přežívání plodu, a 4. hydropické aborty.
Diferenciální diagnostiku hydatidózních mol a hydropických abortů lze zpřesnit kromě chromozomálního DNA polymorfismu průtokovou cytometrií, obrazovou analýzou, fluorescenční in situ hybridizací a v poslední době chromozomální in situ hybridizací. Dále je možné použít některé imunohistologické metody, zejména PCNA, Ki67, P53 a P57. Nejvhodnější se ukázal P57, neboť je gynogenně exprimovaným cyklin dependentním inhibitorem humánních kináz a může být proto použit pro rozlišení HA od MHP a MHK, vzhledem k různému podílu mateřských genů u HA (50 %) a u MHP (33 %) a u MHK (0 %) (14). Gynekogenní triploidie, které tvoří 10–15 % všech triploidit, rozlišit nedovede. Méně vhodný je Ki67, rozlišující proliferační aktivitu cytotrofoblastu a intermediálního trofoblastu u hydatidózních mol od hydropických abortů (10). Jeho nevýhodou je, že je nutné hodnotit choriové klky jen určité stejné velikosti, vykrývající zorné pole při objektivu 20 a okuláru 10, jinak jsou výsledky irelevantní. PCNA a P53 byly vyhodnoceny jako nepoužitelné (15).
Metody užívající chromozomální a DNA polymorfismus jsou většinou časově a ekonomicky značně náročné. Nejvhodnější z nich je chromozomální in situ hybridizace umožňující rozpoznat triploidie se zachováním trvalého histologického obrazu při použití běžného mikroskopu (9). Vzhledem k tomu, že uvedené metody jsou pro většinu pracovišť jen těžce realizovatelné, domníváme se, že námi navržená histopatologická diagnostika je pro praxi dobře použitelná. Spolehlivě vylučuje vznik včas nediagnostikované trofoblastické nemoci i u pouze pravděpodobných diagnostických závěrů, použitím příslušných klinických postupů.
Závěr
Práce popisuje histologickou diagnostiku moly hydatidózy kompletní, zralé a nezralé, moly hydatidózy parciální, proliferující moly a hydropického abortu, opírající se o vyhodnocení 14 histologických znaků. Upozorňuje na chybné histologické diagnózy ve srovnání s cytogenetickými a molekulárně genetickými závěry. Předkládá spolehlivé řešení, vylučující možnost vzniku trofoblastické nemoci vlivem těchto chyb.
Doc. MUDr. Miloš Zavadil, DrSc.
Centrum pro trofoblastickou nemoc v ČR
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 10 Praha 4 – Podolí
email: zavadilctn@upmd.cz
Tel: 296511111‚ 296511595
Fax: 296511296
Sources
1. Bagshawe, K.D., Lawler, S. D., Paradinas, F.J. et al.: Gestational trophoblastic tumours following initial diagnosis of partial hydatiform mole. Lancet 335, 1990, s. 1074–76.
2. Fukunaga, M. Ushigome, Sand E. Y.: Incidence of hydatiform mole in Tokyo hospital: a 5 years (1989–1993) prospective morphological and flow cytometric study. Hum. Path., 26, 1995, s. 758–64.
3. Hemming, J. D., Quirke, P., Womak, C. et al.: Diagnosis of molar pregnancy and persistent trophoblastic disease by flow cytometry. J. Clin. Path., 40, 1987, s. 615–20.
4. Hertig, AT., Edmonds, H.W.: Genesis of hydatiform mole. Arch. Pathol., 30,1940, s. 260–91.
5. Kajii T., Kurashige, H., Ohama, K., Uchino, F: XY and XX complete mole: clinical and morphological correlations. Am. J. Obst. Gyn., 150, 1984, s. 57–64.
6. Lage, J. M., Mark, S.D:, Roberts, D.J. et al.: A flow cytometric study of 137 fresh hydropic placentas: correlation between types of hydatiform moles and DNA ploidy. Obst. Gyn., 79, 1992, s. 403–10.
7. Lage, J.M., Weinbery, D. S., Yavner, D.L., Bieber, F.R.: The biology of tetraploid and hydatiform moles: histopathology, cytogenetics and flow cytometry. Human Path., 20, 1989, s. 419–25.
8. Lawler, S.D., Fisher, R.A., Dent, J.: A prospective genetic study of complete and partial hydatiform moles. Am. J. Clin. Path., 164, 1991, s. 1270–7.
9. Maggiori, M. S., Peres. L. C.: Morphologic, immunohistological and chromosome in situ hybridization in the differential diagnosis of hydatiform mole and hydropic abortion. Eu. J. Obst. Gyn., 135, 2007, s. 170–176.
10. Miller, R. T.: Evalution of hydropic placentas (hydropic degeneration vs. partial mole vs. comlete mole). March 2003 www.propathlab.com
11. Ober, W.B., Fass, R. O.: The early history of choriocarcinoma. Journal of History of Medicine and Allied Sciences, 16, 1951, s. 49–73.
12. Paradinas, F.J. Browne, P., Fisher, R.A. et al.: A clinical histopathological and flow cytometric study of 149 complete moles,146 partial moles and 107 non - molar hydropic abortions. Histopathology, 28, 1996, s. 101–9.
13. Park, W. W.: Disorders arising from human trophoblast. Modern Trends in Pathology. Butterwoths, London, ed. D.H. Collins. 1959, s. 180–211.
14. Ramaguera, R. L., Rodriguez, M., M., Bruce, J., H., et al.: Molar gestation and hydropic abortions differentiated by p 57 immunohistostainig. Fet. Ped. Path., 23, 2004, s. 181–190.
15. Suresh, U., R.: Use of proliferation cell nuclear antigen immunoreactivity for distinguishing hydropic abortion from partial hydatiform moles. J. Clin. Path. 46, 1993, s. 48–50.
16. Szulman, A.E., Surti, U.: The syndromes of hydatiform mole. I. Cytogenetic and morphological correlations, Am. J. Obst. Gynec. 131, 1978, s. 665–71.
17. Szulman, A.E., Surti, U.: The syndromes of hydatiform mole. II. Morphologic evaluation of the complete and partial mole. Am. J. Obst. Gyn. 132, 1978, s. 20–27.
18. Vassilakos, P., Riotton, G. Kajii, T.: Hydatiform mole: two entities. A morphologic and cytogenetic study with clinical considerations. Am. J. Obst. Gyn., 127, 1977, s. 167–70.
19. World Health Organisation Scientific Group: Gestational trophoblastic diseases. Technical Report . 1983, Serie 692.
20. Zavadil,M.: Trophoblastic disease I–III. Acta Univ. Carol. Med. 19, 1973, s.1–107.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2009 Issue 1
Most read in this issue- Histological Differential Diagnosis of Hydatidiform Moles and Hydropic Abortions
- Post-Radiation Dedifferentiation of Meningioma into Chondroblastic Osteosarcoma
- Merkel Cell Carcinoma – Immunohistochemical Study in a Group of 11 Patients
- Diagnostic Possibility of Celiac Disease in Bioptic Practise
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career