-
Medical journals
- Career
Hormonálně senzitivní karcinom prostaty
: Nikol Rušarová 1,2; Marie Bartoušková 1; Hana Študentová 1
: Onkologická klinika, Fakultní nemocnice v Olomouci 1; Lékařská fakulta, Univerzita Palackého v Olomouci 2
: Ces Urol 2019; 23(4): 309-315
: Review article
Karcinom prostaty patří celosvětově mezi druhé nejčastější onemocnění postihující muže a jeho incidence stoupá s věkem. Přestože je u většiny pacientů onemocnění diagnostikováno a léčeno v časných stadiích, přibližně 10 % pacientů stále přichází již v metastatickém stadiu nemoci a část pacientů po lokoregionální terapii dospěje k relapsu. Současný výzkum vedl k rozvoji více léčebných modalit pro muže s pokročilým hormonálně senzitivním onemocněním, zahrnující kombinaci docetaxelu nebo abirateronu s androgen deprivační terapií.
Klíčová slova:
karcinom prostaty
ÚVOD
Karcinom prostaty patří mezi druhé nejčastější nádorové onemocnění postihující muže. V roce 2016 byla incidence karcinomu prostaty v České republice 141/100 000 mužů a mortalita v témže roce 30/100 000 mužů (1). V posledních několika letech lze pozorovat trend poklesu mortality a zvyšování incidence. Díky dostupnosti stanovení hladin PSA, možnostem léčby a průběhu se může karcinom prostaty řadit mezi chronická onemocnění. Klíčovým momentem v léčbě byl v roce 1941 objev Charlese Hugginse a Clarence Hodgese, kteří zjistili klíčovou souvislost mezi androgeny, bilaterální orchiektomií a později estrogenovou kastrací v léčbě karcinomu prostaty a v roce 1966 byl Charles Huggins za tento objev oceněn Nobelovou cenou (2, 3). Délka léčebné odpovědi na ADT je velmi variabilní a přibližně u 10–20 % pacientů během pěti let sledování dojde k progresi onemocnění do kastračně rezistentní fáze (4). V poslední době se v léčbě karcinomu prostaty změnilo mnohé. Může se zdát, že větší rozvoj se odehrál v léčbě CRPC, neboť nyní je k dispozici hned několik nových molekul, které rozšířily armamentárium léčebného ovlivnění této fáze onemocnění. Avšak pro hormonálně senzitivní onemocnění do nedávné doby byla jedinou možností androgen-deprivační terapie.
HORMONÁLNÍ LÉČBA
Karcinom prostaty patří mezi onemocnění, na jehož růstu se podílejí hormony a je tudíž ovlivnitelné hormonálními manipulacemi. Základním hormonem ovlivňujícím růst nádorových buněk prostaty je testosteron, který v téměř 90 % produkují Leydigovy buňky varlete. Minoritním podílem je testosteron produkován v kůře nadledvin (asi 5 %) a dále vzniká v periferní tukové tkáni konverzí z estradiolu. Vlastním účinným androgenem je dihydrotestosteron (DHT) vznikající z testosteronu působením enzymu 5α - reduktázy (5). V mnoha případech je jediným projevem metastatického rozsevu nemoci vzestup PSA. Ve většině případů platí, že karcinom prostaty, který dosud nebyl systémově léčený, je závislý na přítomnosti androgenů. Nedílnou součástí přístupu k systémové léčbě karcinomu prostaty je tedy snižování hladin testosteronu pomocí ADT či orchiektomií (OE). Stanovení hladin PSA v séru je nejjednodušší metoda monitorace od povědi na systémovou léčbu. Zahájení hormonální terapie je u pacientů individuální a řídí se přítomností symptomů, hodnotou PSA, stagingem a gradingem onemocnění. U pacientů se symptomatickým onemocněním by měla být ADT zahájena spíše dříve nežli později, naopak u pacientů s asymptomatickým onemocněním lze s léčbou vyčkat, neboť léčba by mohla negativně ovlivnit kvalitu života.
KOMBINOVANÁ TERAPIE V LÉČBĚ MHSPC
Přestože většina pacientů zpočátku velmi dobře reaguje na ADT, doba trvání léčby je omezená a u všech pacientů dojde k progresi onemocnění do kastračně rezistentní fáze. V poslední době prokázalo mnoho látek účinnost v léčbě CRPC, a proto se začaly tyto látky používat v léčbě mHSPC s potenciálním cílem zpomalit progresi onemocnění a zlepšit kvalitu života. Rezistence na ADT je do jisté míry zapříčiněna reaktivací androgenního receptoru v perzistující adrenální produkci androgenů, zvýšením intratumorózní produkce testosteronu a modifikací biologické charakteristiky androgenních receptorů.
Kombinace ADT s docetaxelem
Kombinace ADT s docetaxelem může poskytnout významné výhody u vybraných pacientů s metastatickým karcinomem prostaty. Docetaxel je standardně podáván v dávce 75 mg/m2 à tři týdny v léčbě metastatického kastračně rezistentního karcinomu prostaty (CRPC) již od roku 2004 (6, 7). První studií zkoumající přínos přidání docetaxelu k ADT byla studie GETUG-AFU 15, ve které bylo zařazeno necelých 400 pacientů s de novo diagnostikovaným CP nebo s CP po primární léčbě. Po mediánu sledování 50 měsíců byl OS prodloužen v rameni s kombinovanou terapií, nicméně nebylo dosaženo statistické významnosti (medián 58,9 měsíce vs. 54,2 měsíce, HR 1,01, 95 % CI 0,75–1,36, p = 0,955), lze tedy předpokládat, že soubor těchto pacientů byl poměrně malý (8).
Přínos kombinované terapie (ADT + docetaxel) byl poprvé prokázán u pacientů s vysokým podílem nemoci (high - volume disease), jak bylo definováno ve studii CHAARTED (přítomnost viscerálních metastáz a/nebo čtyř kostních metastáz, přičemž alespoň jedna z nich je umístěna mimo axiální skelet). Výsledky studie CHAARTED vzbudily velký rozruch. Toto tvrzení potvrdila později studie STAMPEDE. Ve studii CHAARTED bylo zařazeno 790 mužů s primárně diagnostikovaným CP, medián věku byl 64 let v kombinované skupině a 63 let v rameni s ADT, 65 % pacientů mělo high-volume disease. Pacienti byli léčeni kombinovanou terapií (ADT + docetaxel v dávce 75 mg/ m2 á tři týdny, šest cyklů, bez prednisonu) nebo samotnou ADT. Po mediánu sledování 28,9 měsíců se prokázalo, že kombinovaná terapie dosahuje o 13,6 měsíce delšího OS ve srovnání s ADT samotnou (57,6 měsíce vs. 44,0 měsíce, HR 0,61, 95 % CI 0,47–0,80, p < 0,001, graf 1). Průměrná doba do vývoje kastračně rezistentní formy onemocnění byla delší o 8,5 měsíce při kombinované terapii (20,2 měsíce vs. 11,7 měsíce, HR 0,61, 95 % CI 0,51–0,72, p < 0,001) a doba do klinické progrese byla prodloužena o 13,2 měsíce (HR 0,61, 95 % CI 0,50–0,75, p < 0,001). Z nežádoucích účinků se častěji při léčbě ADT a docetaxelem vyskytla febrilní neutropenie (6,1 % pacientů, tab. 1). Ohromný benefit z kombinované léčby docetaxelu s ADT ve smyslu významného prodloužení OS vedl k přepsání guidelines. Je doporučováno začínat s chemoterapií nejdříve po čtyřech měsících od zahájení ADT. Pacienti začínající s chemoterapií dříve než jeden měsíc od zahájení ADT měli častější výskyt nežádoucích účinků (9).
1. Přehled nežádoucích účinků při léčbě ADT + docetaxel, studie CHAARTED
Tab. 1. Summary of side effects of treatment with ADT + docetaxel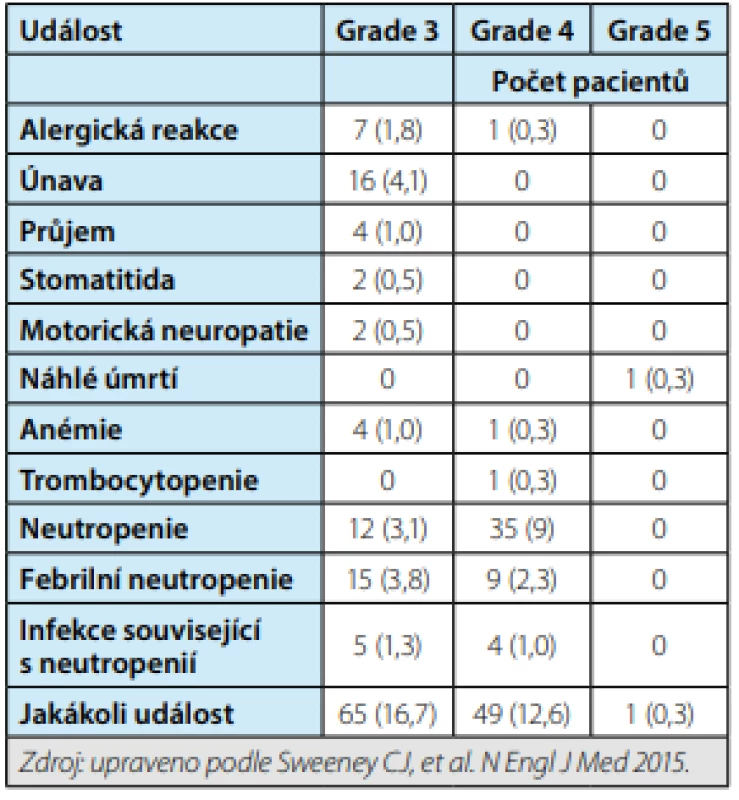
1. Kaplan-Meierova křivka celkového přežití u všech pacientů (CHAARTED)
Grapf 1. Kaplan-Meier estimate of overall survival – all pacient (CHAARTED trial)
Při následné analýze po 54 měsících bylo potvrzeno významné prodloužení OS u všech pacientů (medián 58 měsíců vs. 47 měsíců, HR 0,72, 95 % CI 0,59–0,89). Dále u 513 pacientů s high-volume disease byl prodloužen OS o celých 17 měsíců (49,2 měsíců vs. 32,2 měsíců, HR 0,60, 95 % CI 0,45–0,81, graf 2), na rozdíl u pacientů s low-volume disease, kde tento signifikantně významný rozdíl v OS prokázán nebyl (graf 3) (10).
2. Kaplan-Meierova křivka celkového přežití u pacientů s high-volume disease CHAARTED
Grapf 2. Kaplan-Meier estimate of overall survival – patients with high-volume disease (CHAARTED trial)
3. Kaplan-Meierova křivka přežití u pacientů s low-volume disease, CHAARTED
Grapf 3. Kaplan-Meier estimate of overall survival – patients with low-volume disease (CHAARTED trial)
Výsledky studie CHAARTED byly potvrzeny až studií STAMPEDE. Studie STAMPEDE je čtyřramenná studie porovnávající u 2 962 pacientů standardní léčbu HSPC s přidáním docetaxelu a kyseliny zoledronové. Zařazováni byli pacienti, kteří měli nově diagnostikovaný CP, metastatický či lokálně pokročilý, vysoce rizikový (T3–T4, Gleason skóre 9–10, PSA ≥ 40 ng/ml), nebo CP dříve léčený radikální prostatektomií či radioterapií. V rameni A pacienti dostávali ADT (1 184 pacientů), v rameni B byla ADT kombinovaná s kyselinou zoledronovou (4 mg á tři týdny šest cyklů, poté á čtyři týdny po dobu dvou let, 593 pacientů), ve třetím rameni C byla pacientům podávána ADT s přidáním šesti cyklů docetaxelu ve standardní dávce (75 mg/m2 á tři týdny šest cyklů, 592 pacientů) a v posledním čtvrtém rameni D byla podávána ADT s kyselinou zoledronovou a docetaxelem (593 pacientů). Po mediánu sledování 43 měsíců se opět prokázalo statisticky významné prodloužení mediánu OS (medián OS 81 měsíce pro rameno C vs. 71 měsíce pro rameno A, HR 0,78, 95 % CI 0,66–0,93, p = 0,006) a nebylo prokázáno zlepšení OS při přidání kyseliny zoledronové (medián OS 76 měsíce pro rameno D, HR 0,82, 95 % CI 0,69–0,97, p = 0,022). Významnější byl podíl toxicity u kombinované terapie (ADT + docetaxel 52 % vs. 32 % pro ADT samotné) (11). Docetaxel je poměrně výrazně toxické cytostatikum a vzhledem k populaci léčených pacientů (většinou starší muži s nezanedbatelnými komorbiditami) se může zdát docetaxel poněkud toxičtější variantou při výběru kombinované terapie. Největší prospěch z léčby docetaxelem měli pacienti s high-volume disase.
Kombinace ADT s abirateronem
Bylo prokázáno, že abirateron v kombinaci s prednisonem významně prodlužuje přežití u pacientů s metastatickým kastračně rezistentním karcinomem prostaty, kteří nebyli léčeni chemoterapií a u pacientů předléčených docetaxelem (12, 13). Standardní androgen-deprivační terapie byla také kombinována s abirateronem u mHSPC. Abirateron ireverzibilně inhibuje CYP 17, čímž dochází k blokování tvorby testosteronu jak v nadledvinách, tak ve varlatech a také v tumoru. Při blokování CYP 17 dochází rapidně k poklesu kortizolu s následným zvýšením ACTH, což může vést k projevům hypertenze a hypokalemie jako dvou nejčastějších nežádoucích účinků abirateronu. Z těchto důvodů se abirateron užívá v kombinaci s prednisonem, který zpětnou vazbou blokuje pokles kortizolu a ke zvýšení ACTH tedy nedochází. Přelomovým pro tuto kombinaci v indikaci mHSPC byl rok 2017, kdy byly na celosvětovém kongresu ASCO (American Society of Clinical Oncology) prezentovány a současně v prestižních časopisech publikovány výsledky studií LATITUDE a STAMPEDE, které prokázaly významný vliv na celkové přežití při přidání abirateronu k ADT.
V randomizované dvojitě zaslepené placebem kontrolované studii fáze III LATITUDE bylo 1 199 pacientů s nově diagnostikovaným HSPC náhodně přiděleno k podávání ADT + placeba či ADT + abirateronu (1 000 mg/den + prednison 5 mg/ den). Pacienti zařazeni do této studie měli vysoce rizikové onemocnění s přítomností nejméně dvou ze tří parametrů – Gleason skóre 8 nebo vyšší, alespoň tři kostní léze a měřitelné viscerální metastázy. Po mediánu sledování 30,4 měsíce (při plánované průběžné analýze, po 406 úmrtích) bylo prokázáno signifikantně významné prodloužení OS ve prospěch kombinované terapie. Medián OS nebyl v kombinované skupině dosažen, při terapii ADT byl medián OS 34,7 měsíce (HR 0,62, 95 % CI 0,51–0,76, p < 0,001, graf 4). Mimo prodloužení OS bylo také prokázáno zlepšení v přežití bez progrese (Progression - Free Survival – PFS) při přidání abirateronu k ADT, tedy o 53 % nižší relativní riziko radiografické progrese nebo úmrtí (medián 33,0 měsíce vs. 14,8 měsíce, HR 0,47, 95 % CI 0,39–0,55, p < 0,001, graf 5). Přidání abirateronu k ADT vede také ke snížení relativního rizika úmrtí o 38 %. Podobný stupeň přínosu byl zaznamenán i v sekundárních cílech (doba do progrese bolestí, doba do progrese PSA, doba do výskytu symptomatické kostní události, doba do zahájení chemoterapie), což přineslo významné zlepšení symptomů a zejména kvality života (14).
4. Kaplan-Meierova křivka celkového přežití, (LATITUDE)
Grapf 4. Kaplan-Meier estimate of overall survival (LATITUDE trial)
5. Kaplan-Meierova křivka doby progrese (LATITUDE)
Grapf 5. Kaplan-Meier estimate of progression-free surival (LATITUDE trial)
Druhou studií byla STAMPEDE, která randomizovala 1 917 mužů k podávání ADT v kombinaci s abirateronem. Populace pacientů ve studii byla heterogenní a zahrnovala pacienty jak s nově diagnostikovaným vysoce rizikovým karcinomem pro staty (94,9 % pacientů), tak pacienty s recidivou po radikální prostatektomii nebo radikální radioterapii (5,1 % pacientů). Medián sledování byl 40 měsíců se 184 úmrtími v kombinované skupině a 262 úmrtími ve skupině se samotnou ADT. Primárním cílem studie bylo OS, které bylo významně prodlouženo u kombinované terapie (třileté přežití 83 % vs. 76 %, HR 0,63, 95 % CI 0,52–0,76) (15). Z výsledků studií LATITUDE a STAMPEDE, které prokázaly významný vliv na OS při přidání abirateronu k ADT vyvstává otázka, jaká kombinovaná terapie by měla být považována za standardní léčbu. Abirateron má lepší profil nežádoucích účinků než docetaxel a je logisticky lepší pro svou perorální lékovou formu. Naopak doba trvání léčby abirateronem je delší, z čehož vyplývají dlouhodobé nežádoucí účinky glukokortikoidů (při nutnosti podávání prednisonu s abirateronem).
SOUČASNOST A BLÍZKÁ BUDOUCNOST
V současné době je v běhu několik klinických studií u pacientů s HSPC, které porovnávají ADT s přidáním enzalutamidu či apalutamidu. Za zmínku stojí studie ARCHES (NCT02677896), jejímž účelem je zhodnotit účinnost standardní ADT s přidáním enzalutamidu, primárním cílem bude radiografické PFS. Další v řadě probíhajících studií je studie ENZAMET (NCT02446405), která srovnává účinnost enzalutamidu s ADT oproti nesteroidnímu antiandgrogenu + ADT, primárním cílem bude OS. Ve studii TITAN (NCT02489318) je zkoumáno, zdali má přidání apalutamidu k ADT má vliv na prodloužení celkového přežití nebo doby do radiografické progrese. V rámci studie STAMPEDE probíhá v rameni J analýza s přidáním enzalutamidu ke kombinaci ADT s abirateronem, primárním cílem je OS. Probíhá i klinická studie PEACE-1 (NCT01957436), v této klinické studii jsou pacienti randomizováni do ramene A (ADT + docetaxel), ramene B (ADT + docetaxel + abirateron), do ramene C (ADT + docetaxel + lokální radioterapie) anebo do ramene D (ADT + docetaxel + abirateron + lokální radioterapie). Nicméně na výsledky těchto studií si prozatím budeme muset počkat (16).
ZÁVĚR
Díky velmi pozitivním výsledkům klinických studií (statisticky významné prodloužení OS) lze v současnosti považovat za nový standard léčby kombinovanou terapii ADT s docetaxelem či abirateronem, což je i součástí doporučení EAU a ESMO guidelines. Bohužel v České republice se prozatím jedná o off-label indikaci. Abirateron u nás má indikaci v léčbě vysoce rizikového metastatického HSPC, avšak úhrada v této indikaci k současnému datu nebyla plátci veřejného zdravotnictví stanovena. Podle současné úhradové vyhlášky je abirateron hrazen u pacientů s metastatickým kastračně rezistentním CP v kombinaci s prednisonem dříve léčených docetaxelem, nebo u asymptomatických či mírně symptomatických pacientů s metastatickým kastračně rezistentním karcinomem prostaty po selhání ADT před zahájením chemoterapie. Vzhledem k omezením úhradovými vyhláškami patří v České republice ke standardní a dostupné léčbě mHSPC stále pouze androgen-deprivační terapie.
Došlo: 24. 2. 2019
Přijato: 19. 5. 2019
Kontaktní adresa:
MUDr. Nikol Rušarová
Onkologická klinika,
Fakultní nemocnice v Olomouci
I. P. Pavlova 6,
779 00 Olomouc
e-mail: nikol.rusarova@fnol.cz
Střet zájmů: Žádný.
Prohlášení o podpoře: Tato práce vznikla za podpory grantového projektu Univerzity Palackého v Olomouci č. IGA_LF_2018_010.
Sources
1. Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [on - line]. Masarykova univerzita [2005] [cit. 2018–12–28]. Dostupný z URL: http://www.svod.cz.
2. Huggins C, Hodges CV. Studies on prostatic cancer: I. The effects of castration, of estrogen, and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1 : 293–297.
3. Huggins C, Stevens J, Hodges CV. Studies on prostatic cancer: II. The effects of castration on advanced carcinoma of the prostate gland. Arch Surg 1941; 43 : 209–223.
4. Kirby M, Hirst C, Crawford ED. Characterising the castration - resistant prostate cancer population: a systemic review. Int J Clin Pract. 2011; 65(11): 1180–1192.
5. Isaacs JT. The biology of hormone refraktory prostate cancer. Why does it develop? Clin North Am 1999; 26 : 263–273.
6. Petrylak DP, Tangen CM, Hussain MHA, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351(15): 1502–1512.
7. Berthold DR, Pond GR, Soban F, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol. 2008; 26(2): 242–245.
8. Gravis G, Fizazi K, Joly F, et al. Androgen - deprivation therapy alone or with docetaxel in non - castrate metastatic prostate cancer (GETUG - AFU 15): a randomised, open - label, phase 3 trial. Lancet Oncol 2013; 14(2): 149–158.
9. Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone -Sensitive Prostate Cancer. N Engl J Med 2015; 373(8): 737–746.
10. Kyriakopoulos CE, Chen YH, Carducci MA, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long - Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol 2018; 36(11): 1080–1087.
11. James ND, Sydes MR, Clarke NW, et al. Addition of docetaxel, zoledronic acid, or both to first - line long - term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387(10024): 1163–1177.
12. Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy - naive men with metastatic castration - resistant prostate cancer (COU - AA-302): final overall survival analysis of a randomised, double - blind, placebo - controlled phase 3 study. Lancet Oncol 2015; 16 : 152–160.
13. Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration - resistant prostate cancer: fi nal overall survival analysis of the COU - AA-301 randomised, double - blind, placebo-controlled phase 3 study. Lancet Oncol. 2012; 13(10): 983–992.
14. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration - Sensitive Prostate Cancer. N Engl J Med 2017; 377(4): 352–360.
15. James ND, de Bono JS, Spears MR, et al. Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 2017; 377(4): 338–351.
16. U.S. National Institutes of Health [online]. Home – ClinicalTrials.gov. [cit. 2018–12-20]. Dostupné z: https://clinicaltrials.gov/.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2019 Issue 4-
All articles in this issue
- Editorial
- Genitourinary tuberculosis
- Hormone sensitive prostate cancer
- Prevalence of uropathogens in urine and their resistance patterns: data analysis from a single centre
- A comparison of prostate volumes measured using transrectal ultrasound and magnetic resonance imaging; and the effect of their differences on PSA density
- Inguinal hernia repair and laparoscopic radical extraperitoneal radical prostatectomy
- Radiological regression of metastatic renal carcinoma after biological treatment with Sunitinib – case report and literature review
- Emphysematous cystitis in a 78 year old woman
- Patch-type robot-assisted bladder augmentation using da Vinci Xi
- Report from the 17th European Urology Residents Education Programme (EUREP)
- Precious Prague or Looking back at the 65th Annual Czech Urological Society Conference
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2018
- Laparoscopic transperitoneal reconstruction of retrocaval ureter – a case report
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A comparison of prostate volumes measured using transrectal ultrasound and magnetic resonance imaging; and the effect of their differences on PSA density
- Inguinal hernia repair and laparoscopic radical extraperitoneal radical prostatectomy
- Emphysematous cystitis in a 78 year old woman
- Hormone sensitive prostate cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

