-
Medical journals
- Career
PSA a jeho izoformy jako moderní markery karcinomu prostaty
Authors: Vojtěch Novák; Štěpán Veselý
Authors‘ workplace: Urologická klinika FN Motol a 2. LF UK, Praha
Published in: Ces Urol 2019; 23(3): 194-202
Category: Review article
Overview
moderní markery karcinomu prostaty. Rostoucí incidence karcinomu prostaty je jednoznačným důvodem k dalšímu výzkumu v oblasti diagnostiky a léčby tohoto onemocnění. Pokroky v léčbě lokalizovaných, ale především pokročilých stadií jsou v posledních letech skutečně obrovské. Každodenní praxe však ukazuje přetrvávající nedostatky diagnostických metod, obzvláště pak omezené možnosti určení rizikovosti pacientů. Vzhledem k vývoji současných trendů léčby karcinomu prostaty je evidentní nutností odlišit nejen pacienty, kteří mají či nemají karcinom prostaty, ale především posléze identifikovat ty, které toto onemocnění ohrožuje a je třeba jej agresivně léčit. Standardním, praxí a roky ověřeným markerem, splňujícím alespoň částečně tyto požadavky, je prostatický specifický antigen (PSA). Cílem tohoto článku je ukázat výhody, ale i nedostatky využití tohoto tradičního markeru a představit nedávno identifikované izoformy PSA, které mohou v kombinaci se standardním PSA zpřesnit diagnostiku a detekci rizikových pacientů.
Klíčová slova:
Izoformy – karcinom prostaty – markery – prostatický specifický antigen – určení rizikovosti
ÚVOD
Karcinom prostaty se stal v posledních desítkách let díky zlepšujícím se diagnostickým metodám v čele s prostatickým specifickým antigenem (PSA) nejčastěji diagnostikovaným nádorovým onemocněním u mužů a druhou nejčastější příčinou úmrtí na nádorové onemocnění. Roční počet nově diagnostikovaných karcinomů prostaty je pouze v Evropě odhadovaný na 2,6 milionů (1). Nárůst incidence je každý rok o 2–3 % (2). Tento nárůst detekce především časných stadií je jednoznačně na vrub rozšíření využívání PSA. Pozitivním důsledkem tohoto rozšíření je dle mnoha studií prokázaný pokles pokročilých stadií karcinomu prostaty včetně prodloužení nádorově specifického přežití (3, 4). V průběhu posledních let se však objevil i negativní dopad téměř plošného zavedení PSA, a to právě v detekci významného množství nízcerizikového, tzv. klinicky nesignifikantního karcinomu. Takový karcinom by v dlouhodobém horizontu pacienta velmi pravděpodobně zdravotně neohrozil. Naopak radikální léčba klinicky nesignifikantního karcinomu s sebou nese nemalá rizika nežádoucích účinků, které mohou významně snížit kvalitu života pacienta. Tento fenomén se nazval tzv. overtreatmentem a právě jeho snižování je jedním z cílů zavádění nových markerů. Potřeba hledání nových markerů, které by zvýšily schopnost odlišení rizikovosti pacientů společně se standartním PSA, je tedy jednoznačná. Právě v kombinaci jednotlivých markerů se zdá být budoucnost jejich využití. Ideální marker nebo markery by tedy zvýšily jinak nízkou přesnost samotného PSA v predikci rizikovosti karcinomu prostaty. Všichni víme, že možností léčby karcinomu prostaty dle současných doporučení Evropské urologické asociace (EAU) je celá řada, počínaje aktivním sledováním u nízcerizikových karcinomů po klasické operační či onkologické metody (5). A právě při rozhodování o léčebném postupu by byly jistě další ukazatelé rizikovosti pacienta vítány. Izoformy PSA se zdají být v tomto směru velmi nadějnými markery a jejich použití v klinické praxi by mohlo usnadnit naše často složité rozhodování o léčbě a osudu pacienta.
SOUČASNÉ VYUŽÍVÁNÍ PSA A ODVOZENÝCH HODNOT
Zavedení PSA způsobilo skutečný zlom v diagnostice karcinomu prostaty a umožnilo především diagnostikovat časnější stadia tohoto onemocnění. S rozšiřováním tohoto markeru se však také objevila řada nedostatků a otázek, které jsou s jeho použitím spojené. Především jde o fakt, že zvýšená hladina PSA byla prokázána i u řady dalších onemocnění (hyperplazie prostaty, močová infekce), navíc i v souvislosti s některými vyšetřeními (endoskopie močových cest). Historicky často tradovaná možná elevace PSA po vyšetření per rektum byla naopak studiemi vyvrácena (6). Dalším nedostatkem je nejednoznačná hraniční hodnota, nad kterou by bylo možné považovat nález za podezřelý a indikovat další vyšetření. Dříve používaná hranice zvýšeného PSA nad 4 ng/ml musela být opuštěna, když bylo studiemi prokázáno, že až 25 % pacientů s diagnostikovaným karcinomem prostaty má PSA pod touto hranicí (7). Dle současných doporučení EAU bychom měli test PSA nabídnout informovanému muži nad 50 let, v případě Afroameričanů či rodinné anamnézy karcinomu prostaty nad 45 let, ovšem s ohledem na jejich celkový zdravotní stav. Další testování závisí na iniciální hodnotě markeru, a pokud je například hodnota u šedesátiletého pacienta nižší než 2 ng/ml, můžeme další odběr odložit až o osm let. Pokud je iniciální hodnota v rozmezí 2–10 ng/ml, je doporučeno doplnit jednu z dalších možných metod, ať už využití nomogramu, zobrazovacích metod (multiparametrické magnetické rezonance – mpMRI prostaty) či další onkomarker ze séra či z moči (Prostate Health Index – PHI, 4 K skóre, Progensa Prostate Cancer Gene 3 – PCA3) (5). Dalšími používanými veličinami odvozenými od PSA je PSA denzita, PSA velocita, zdvojovací čas a volné PSA. Bylo prokázáno, že PSA denzita, tedy hodnota PSA dělená objemem prostaty, který je měřený ultrazvukem či magnetickou rezonancí, zvyšuje detekci klinicky signifikantního karcinomu (8, 9). Stejně tak je doporučeno využití volného PSA jako doplňkového testu u pacientů s PSA 4–10 ng/ml, kdy hodnota nad 25 % snižuje pravděpodobnost karcinomu (10). Naproti tomu PSA velocita a zdvojovací čas, tedy výpočet změny hladiny PSA v čase, nezlepšil významně specificitu samotného PSA (11).
Table 1. PSA (prostatický specifický antigen), fPSA (volné PSA), PHI (Index zdraví prostaty), BCR (biochemická recidiva)
Tab. 1. PSA (Prostate specific antigen), fPSA (free PSA), PHI (Prostate health index), BCR (biochemical relapse)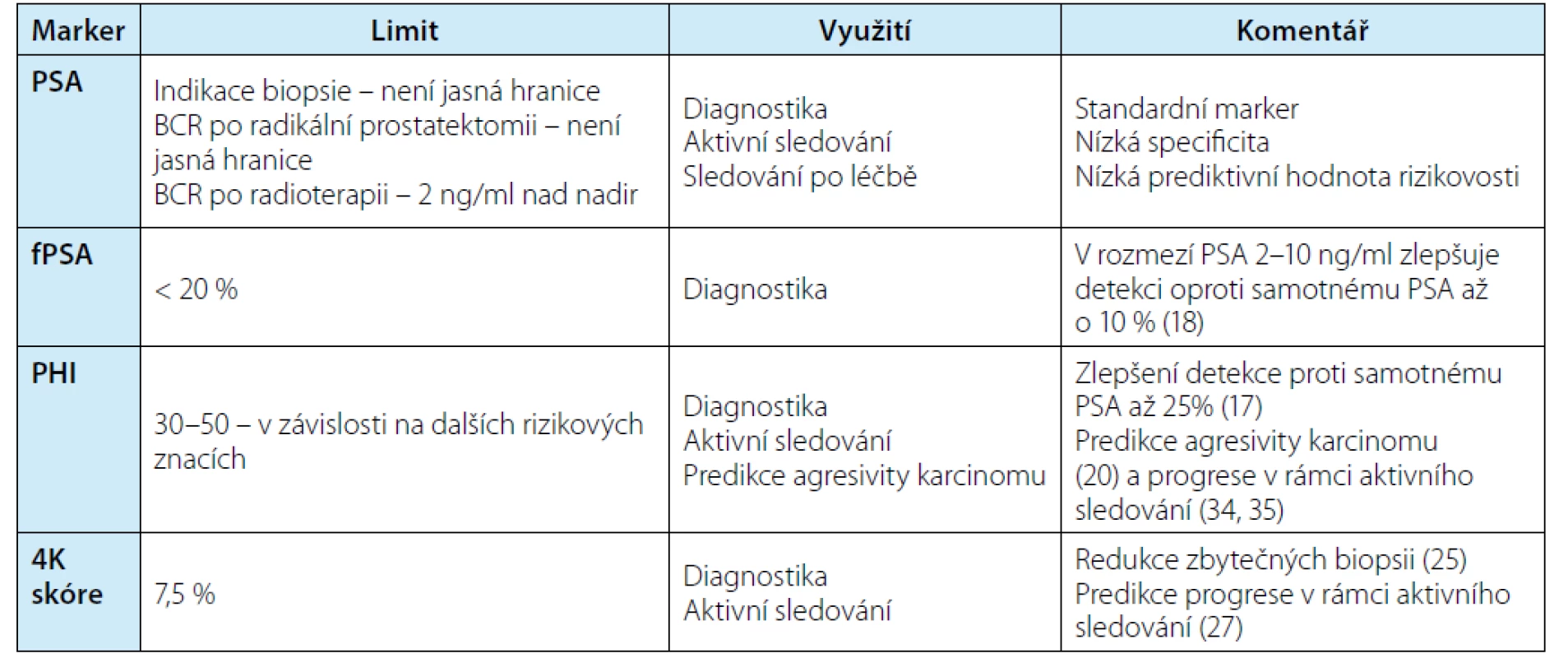
IZOFORMY PSA
Prostatický specifický antigen je lidský kallikrein s aktivitou serinové protézy, která je produkována epitelovými buňkami prostaty. Jeho účelem je udržování tekuté formy semenné tekutiny a tím podpora motility spermií. PSA je spolu s lidským kallikreinem 2 (hK2) ve vysoké koncentraci v prostatickém sekretu, v semenné tekutině, ale pouze v malé koncentraci v krvi. Aby se PSA dostal do krve, musí překonat bariéru zahrnující prostatickou bazální membránu, stroma, kapilární bazální membránu a kapilární endoteliální buňku (12). A právě poškozením této bariéry v rámci patologických procesů dochází k vzestupu PSA v krvi. PSA existuje v séru v několika různých izoformách (obr. 1). Predominantní formou je PSA vázaný v komplexu s inhibitorem proteázy alfa-1-antichymotrypsinem. Pouze 10–30 % je ve formě volného PSA (fPSA). Jednou z těchto volných forem je prekurzor PSA objevený v roce 1997, proPSA. Kromě tohoto prekurzoru se volné PSA skládá s multiřetězcové PSA (BPSA), která je více spojena s benigní hyperplazií prostaty (BHP) a intaktní či inaktivní PSA (iPSA), u které nebyl prokázán signifikantní rozdíl mezi pacienty s karcinomem prostaty a BHP (13).
Image 1. Izoformy PSA. cPSA (vázané PSA), BPSA (multiřetězcové PSA), iPSA (intaktní PSA), fPSA (volné PSA)
Fig. 1. PSA isoforms. cPSA (complexed PSA), BPSA (benign PSA), iPSA (intact PSA), fPSA (free PSA)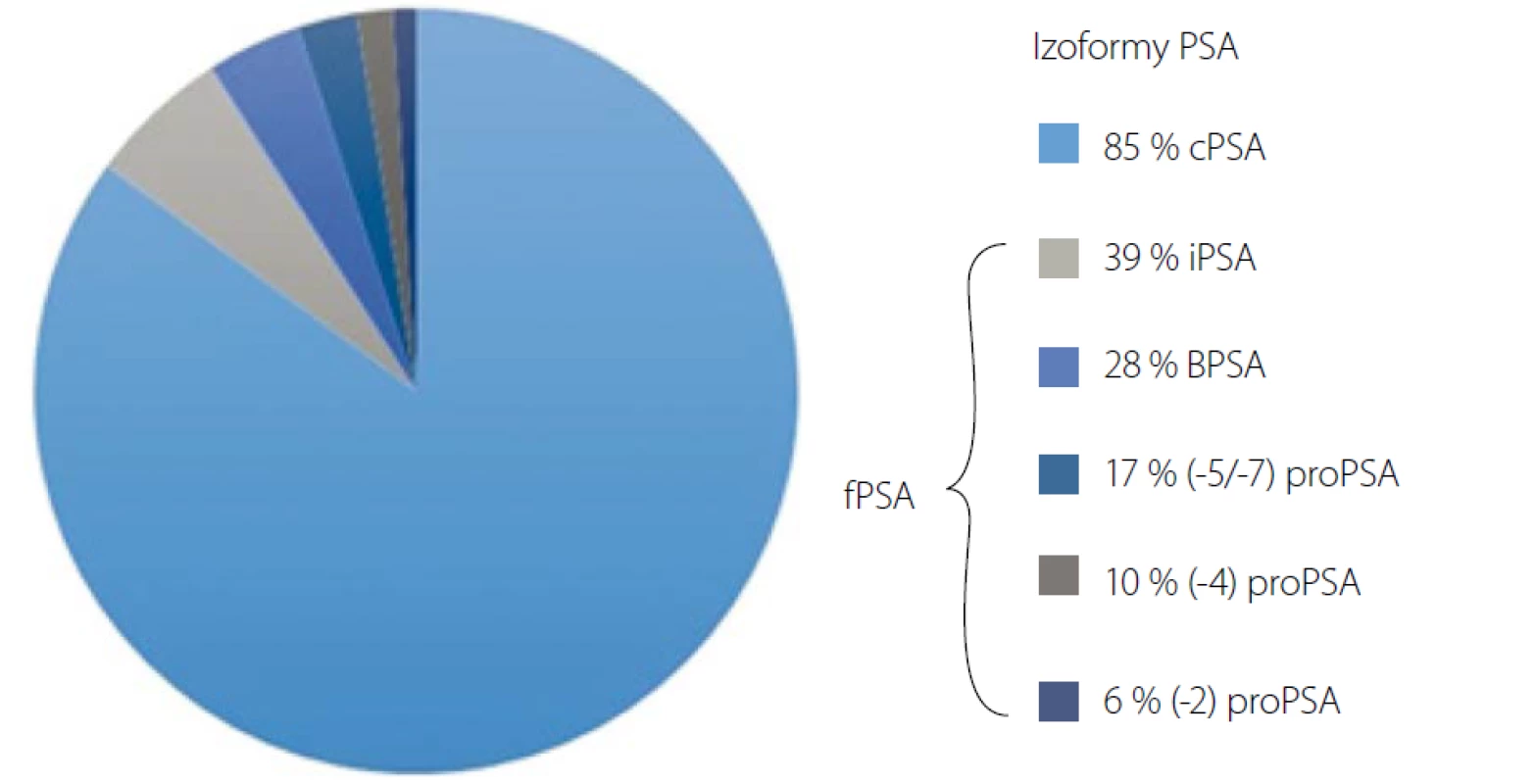
PROSTATE HEALTH INDEX (PHI)
Objevení natolik senzitivního a specifického markeru, který by sám o sobě stačil požadavkům diagnostiky, predikci rizikovosti ale i například sledování průběhu léčby karcinomu prostaty je nepravděpodobné. Jak již bylo zmíněno, budoucnost se ukazuje spíše v kombinaci markerů a vytváření panelů, kde by se senzitivity a specificity jednotlivých složek násobily. ProPSA jako jedna z forem volného PSA se nachází v séru v několika izoformách, [-2]proPSA,[-4]proPSA, [-5]proPSA a [-7]proPSA, nazvaných podle počtu aminokyselin v úvodní peptidové sekvenci (14). Změna na aktivní formu PSA je zajištěna enzymem hK2, který štěpí aminokyseliny jednotlivých izoforem. Bylo prokázáno, že [-2]proPSA je predominantně exprimováno v periferní zóně prostaty, která je nejčastějším místem výskytu karcinomu prostaty a je tedy logické, že právě [-2]proPSA je ve vyšší míře prokazováno u pacientů s karcinomem prostaty (15, 16). Tyto poznatky byly základem zavedení PHI, definovaného jako podíl [-2]proPSA a fPSA násobený odmocninou celkového PSA ((-2proPSA/fPSA) x√PSA). PHI se ukázal v řadě studií jako marker s velkým potenciálem pro zlepšení detekce karcinomu prostaty (17, 18, 19). Existují studie, které dokonce popisují velmi slibnou korelaci mezi PHI a agresivitou karcinomu prostaty (20). I v České republice byla v řadě studií prokázána vyšší senzitivita a specificita PHI a [-2]proPSA oproti klasickému PSA (21, 22, 23, 24). V současné době je použití těchto nových markerů schváleno ve více než pěti desítkách zemí světa včetně České republiky a je u nás hrazeno ze zdravotního pojištění.
K SKÓRE
Na kombinaci kallikreinových markerů (celkové PSA, volné PSA, intaktní PSA a hK2) s klinickým vyšetřením per rektum a věkem pacienta je založena další možnost zpřesnění predikce pozitivní biopsie, 4 K skóre, která by měla především vyústit ve snížení počtu zbytečných biopsií. V původní studii na každých 1 000 mužů s elevací PSA připadá redukce biopsií o 573 případů za cenu 71 nediagnostikovaných karcinomů prostaty (25). Tato studie a její výsledky byly v dalších letech potvrzeny na souboru více než 40 000 pacientů (26). 4 K skóre jako potencionální doplňkový marker karcinomu prostaty ke klasickému PSA, který by měl zvýšit senzitivitu a specificitu a pomoci zredukovat počet zbytečných biopsií, je zmiňován i v aktuálních doporučeních EAU (5). Objevují se však i práce možného využití 4 K skóre v rámci aktivního sledování pro nízcerizikový karcinom, kde může právě toto skóre předpovědět nález vysocerizikového karcinomu v rebiopsii (27).
DALŠÍ KANDIDÁTNÍ MARKERY
Další markery, jako jsou trasmembránové proteázy (PSMA‑prostatický specifický membránový antigen, 2-TMPRSS2-ERG – transmebránová serinová protéza 2), popřípadě genetické testy (SelectMDx, ConfirmMDx, ExoDx), jsou zatím povětšinou jen minimálně využívané v klinické praxi (28, 29, 30). Prognostické tkáňové markery (Oncotype, Prolaris, ProMark) jsou využívané ve Spojených státech, ovšem většímu rozšíření v Evropě brání jejich vysoká cena (31, 32). Využití detekce cirkulujících nádorových buněk (CTC), tzv. liquid biopsies, omezuje jejich malý počet v periferní krvi a naopak celá řada detekčních metod, které dávají rozdílné výsledky (33). Nejblíže většímu využití je PCA3 (Progensa prostate cancer antigen 3), vyšetřovaný v moči po masáži prostaty. Výsledky tohoto testu jsou však zatím rozporuplné a v současné době je jeho použití doporučeno před biopsií, ovšem ne při monitoraci pacientů v režimu aktivního sledování (5,34).
VYUŽITÍ MARKERŮ V REŽIMU AKTIVNÍHO SLEDOVÁNÍ
V posledních letech se objevila v doporučených postupech EAU tato nová možnost léčby karcinomu prostaty (5). Spočívá v důsledném sledování pacientů s nízcerizikovým karcinomem, u kterých je malé riziko progrese onemocnění. K zařazení do aktivního sledování musí pacienti splnit přesně daná kritéria (hodnoty PSA, Gleasonova skóre a další), a především musí souhlasit se striktním plánem dalšího sledování. Tento plán obsahuje pravidelné klinické kontroly s odběrem PSA a vyšetřením per rektum a opakované, tzv. konfirmační biopsie, kterým by měla vždy předcházet mpMRI, pokud již nebyla provedena před první biopsií (5). Jedním z možných používaných schémat pro aktivní sledování je protokol PRIAS (Prostate Cancer Research International: Active Surveillance) (35). Samotná hladina PSA má však v rámci aktivního sledování nízkou výpovědní hodnotu stran možné progrese nálezu (36). Také PSA zdvojovací čas či velocita mají v tomto ohledu rozporuplné výsledky (37, 38). Pouze PSA denzita > 0,5 se v několika studiích ukázala jako potencionální prediktor progrese nálezu v rámci rebiopsie (37, 39, 40). Novým slibným markerem v tomto ohledu se zdá být i PHI (41, 42), a stejně tak další marker obsahující izoformy PSA, tedy 4 K skóre (27). Objevují se i nomogramy na předpověď přehodnocení nálezu v rámci rebiopsie, které by mohly individualizovat protokol aktivního sledování pro každého pacienta (43, 44, 45).
VYUŽITÍ MARKERŮ PŘI SLEDOVÁNÍ PACIENTŮ PO RADIKÁLNÍ LÉČBĚ
Další zásadní roli hraje využití markerů při sledování po radikální prostatektomii či radioterapii, nebo během farmakologické léčby. Zachycení časné recidivy a tedy i včasná indikace další terapie je stěžejní pro prognózu našich pacientů. Po kurabilní radikální prostatektomii by měla hladina PSA klesnout na nedetekovatelnou hodnotu, za kterou se považuje hladina pod 0,01 ng/ml. V běžné klinické praxi má většina laboratoří k dispozici testy PSA s nižším detekčním limitem, tzv. ultrasenzitivní. Přínos těchto testů je však zatím předmětem debat. Nedetekovatelné hodnoty dosahují pacienti nejčastěji 6–8 týdnů po operaci. Avšak přibližně u třetiny pacientů se během deseti let po operaci objeví významná elevace PSA, tzv. biochemická recidiva (BCR). Tato recidiva předpovídá možnou progresi onemocnění a je indikací k následné léčbě. Definice BCR se liší podle primární použité metody léčby. Po radikální prostatektomii v současné době není jasná hraniční hodnota PSA a jakýkoliv nárůst PSA je považován za BCR. Stejně tak není určená hodnota PSA, při které pacienty indikovat k adjuvantní či salvage radioterapii. Hodnota PSA nad 0,4 ng/ml však nejlépe předpovídá rozvoj metastáz. Po radioterapii se za BCR považuje vzestup PSA o 2 ng/ml nad nejnižší hodnotu PSA po léčbě (5, 46). Sledování PSA po léčbě karcinomu prostaty by mělo být dlouhodobé, neboť bylo prokázáno, že riziko vzniku BCR nikdy nedosáhne nuly (47). Nicméně víme, že BCR nastane u většiny pacientů v prvních třech letech po primární léčbě a dále riziko klesá (48). To je důvod, proč právě v prvních třech letech po primární léčbě je sledování nejintenzivnější. Odběr PSA, klinické vyšetření včetně vyšetření per rektum, je doporučeno provádět ve 3., 6. a 12. měsíci po léčbě, a dále každých šest měsíců do tří let od radikální léčby a následně jednou ročně (5). Existují stratifikační modely pro stanovení rizika následné terapie, vzniklé dle studie hodnotící dynamiku PSA velmi časně po operaci (49). Sledování PSA během farmakologické léčby vychází z předpokladu, že pokles PSA je indikátorem buněčné smrti nádorových buněk navozené léčbou. Proto je rychlost poklesu a hodnota PSA dobrým ukazatelem účinnosti léčby (50).
ZÁVĚR
Zásadním ukazatelem kvality onkomarkerů není pouze jejich diagnostická přesnost, ale také možnost zavedení do běžné klinické praxe, ať už z pohledu technologického či ekonomického. Právě tato kritéria splňují nové izoformy PSA. V kombinaci s celkovým PSA umožňují tyto izoformy významné zlepšení nejen diagnostiky karcinomu prostaty. Mají také místo ve sledování po radikální léčbě, nebo v predikci jejího selhání. Využití těchto nových markerů má možnost pravděpodobně významně omezit počet zbytečných biopsií prostaty a s nimi spojenou nadbytečnou léčbu. Kombinace nových markerů a stále se zdokonalujících zobrazovacích metod má potenciál zlepšit přesnost prediktivních nomogramů. Ty nám pak pomohou určit individuální riziko každého pacienta, podle kterého zvolíme adekvátní diagnostický popřípadě léčebný postup.
Došlo: 5. 7. 2019
Přijato: 19. 8. 2019
Kontaktní adresa
MUDr. Vojtěch Novák
Urologická klinika FN Motol a 2. LF UK
V Úvalu 84, 150 06 Praha 5
e-mail: vojtech.novak.lf2@gmail.com
Střet zájmů: Žádný.
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Hlavní stanovisko: Otázek v oblasti diagnostiky a predikce rizikovosti pacientů s karcinomem prostaty je stále nespočet. Prostatický specifický antigen (PSA) a jeho izoformy jsou dostupné kombinace markerů, které by mohly přinést další informace pro rozhodování o osudu pacientů a které stále nedosáhly maxima svého využití.
Sources
1. Siegel RL, Miller KD, Jemal A. Cancer statistics 2016. Cancer J Clin. 2016; 66 : 7–30.
2. Zhou CK, Check DP, Lortet‑Tieulent J, et al. Prostate cancer incidence in 43 populations worldwide: An analysis of time trends overall and by age group. Int J Cancer 2016; 138 : 1388–1400.
3. Andriole GL, Crawford ED, Grubb RL, et al. Prostate cancer screening in the randomized prostate, lung, colorectal, and ovarian cancer screening trial: mortality results after 13 years of follow up. J Natl Cancer Inst. 2012; 104 : 125–132.
4. Schroder FH, Hugosson J, Roobol MJ, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow up. Lancet 2014; 384 : 2027–2035.
5. Mottet N, Bellmunt J, Bolla M, et al. EAU‑ESTRO‑SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. 2017; 71(4): 618–629.
6. Crawford ED, Schutz MJ, Clejan S, et al. The effect of digital rectal examination on prostate‑specific antigen levels. JAMA 1992; 267(16): 2227–2228.
7. Thompson IM, Pauler DK, Goodman PJ, et al. Prevalence of prostate cancer among men with a prostate‑specific antigen level 4.0 ng per milliliter. N Engl J Med. 2004; 350 : 2239–2246.
8. Nordstrom T, Akre O, Aly M, et al. Prostate‑specific antigen (PSA) density in the diagnostic algorithm of prostate cancer. Prostate Cancer Prostatic, DiS. 2018; 21(1): 57–63.
9. Bhat NR, Vetter JM, Andriole GL, et al. Magnetic Resonance Imaging‑Defined Prostate‑Specific Antigen Density Significantly Improves the Risk Prediction for Clinically Significant Prostate Cancer on Biopsy. Urology 2018; 18 : 1324–1328.
10. Catalona WJ, Partin AW, Slawin KM, et al. Use of the percentage of free prostate‑specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: A prospective multicenter clinical trial. JAMA 1998; 279 : 1542–1547.
11. Vickers AJ, Savage C, O’Brien MF, et al. Systematic review of pretreatment prostate specific antigen velocity and doubling time as predictors for prostate cancer. J Clin Oncol. 2009; 27 : 398–403.
12. Lukeš M, Záleský M, Zachoval R, Urban M, Heráček J. Prostatický specifický antigen a karcinom prostaty. Klinická onkologie 2001; 14(4): 114–118.
13. Klečka J, Běhounek P, Hora M. Současné postavení PSA v diagnostice karcinomu prostaty. Urolog. praxi 2008; 9(4): 187–189.
14. Le BV, Griffi n CR, Loeb S, et al. [-2] Proenzyme prostate specific antigen is more accurate than total and free prostate specific antigen in differentiating prostate cancer from benign disease in a prospective prostate cancer screening study. J Urol. 2010; 183 : 1355–1359.
15. Mikolajczyk SD, Millar LS, Wang TJ, et al. A precursor form of prostate‑specific antigen is more highly elevated in prostate cancer compared with benign transition zone prostate tissue. Cancer Res. 2000; 60 : 756–759.
16. Mikolajczyk SD, Rittenhouse HG. Pro PSA: a more cancer specific form of prostate specific antigen for the early detection of prostate cancer. Keio J Med. 2003; 52, 86–91.
17. Jansen FH, van Schaik RH, Kurstjens J. Prostate‑specific antigen (PSA) isoform p2PSA in combination with total PSA and free PSA improves diagnostic accuracy in prostate cancer detection. Eur Urol. 2010; 57 : 921–927.
18. Guazzoni G, Nava L, Lazzeri M, et al. Prostate‑specific antigen (PSA) isoform p2PSA significantly improves the prediction of prostate cancer at initial extended prostate biopsies in patients with total PSA between 2.0 and 10 ng/ml: results of a prospective study in a clinical setting. Eur Urol. 2011; 60 : 214–222.
19. Catalona WJ, Partin AW, Sanda MG, et al. A multicenter study of [-2]pro‑prostate specific antigen combined with prostate specific antigen and free prostate specific antigen for prostate cancer detection in the 2.0 to 10.0 ng/ml prostate specific antigen range. J Urol. 2011; 185(5): 1650-1655.
20. Lazzeri M, Haese A, de la Taille A, et al. Serum isoform [-2] proPSA derivatives signifi cantly improve prediction of prostate cancer at initial biopsy in a total PSA range of 2–10 ng/ml: a multicentric European study. Eur Urol 2013; 63(6): 986–994.
21. Král M, Hradil D, Grepl M, et al. Prostate health index (PHI) u pacientů s karcinomem prostaty a s BPH. Česká urologie 2011; 15(Suppl 2): 16–68.
22. Klečka J, Hora M, Topolčan O, et al. Je proPSA více specifický marker pro detekci karcinomu prostaty. Ces Urol 2011; 15(Suppl 2): 16–68.
23. Fuchsová R, Topolčan O, Vrzalova J, et al. Přínos stanovení [-2]proPSA v diferenciální diagnostice karcinomu prostaty. Ces Urol 18(1): 21–25.
24. Čapoun O, Sobotka R, Soukup V, et al. Prostate health index (PHI) v primární diagnostice karcinomu prostaty. Ces Urol 2014; 18(Suppl 1): 21–109.
25. Vickers AJ, Cronin AM, Aus G, et al. A panel of kallikrein markers can reduce unnecessary biopsy for prostate cancer: Data from the European Randomized Study of Prostate Cancer Screening in Goteborg, Sweden. BMC Med. 2008; 6 : 19–24.
26. Stattin P, Vickers AJ, Sjoberg DD, et al. Improving the Specificity of Screening for Lethal Prostate Cancer Using Prostate‑specific Antigen and a Panel of Kallikrein Markers: A Nested Case‑Control Study. Eur Urol. 2015; 68(2): 207–213.
27. Lin DW, Newcomb LF, Brown MD, et al. Evaluating the Four Kallikrein Panel of the 4Kscore for Prediction of High‑grade Prostate Cancer in Men in the Canary Prostate Active Surveillance Study. Eur Urol 2017; 72 : 448-454
28. Tomlins SA, Day JR, Lonigro RJ, et al. Urine TMPRSS2:ERG plus PCA3 for individualized prostate cancer risk assessment. Eur Urol. 2016; 70(1): 45–53.
29. Van Neste L, Hendriks RJ, Dijkstra S, et al. Detection of high-grade prostate cancer using a urinary molecular biomarker-based risk score. Eur. Urol. 2016; 70(5): 740–748.
30. McKiernan J, Donovan MJ, O´Neill V, et al. A novel urine exosome gene expression assay to predict high grade prostate cancer at initial biopsy. JAMA 2016; 2(7): 882–889.
31. Klein EA, Cooperberg MR, Magi‑Galluzzi C, et al. A 17-gene assay to predict prostate cancer aggressiveness in the context of Gleason grade heterogeneity, tumor multifocality, and biopsy undersampling. Eur Urol. 2014; 66(3): 550–560.
32. Crawford ED, Scholz MC, Kar AJ, et al. Cell cycle progression score and treatment decisions in prostate cancer: results from an ongoing registry. Curr Med Res Opin. 2014; 30(6): 1025–1031.
33. Wyatt AW, Azad AA, Volik SV, et al. Genomic alterations in cell-free DNA and Enzalutamide resistence in castration-resistant prostate cancer. JAMA Oncol. 2016; 2(12): 1598–1606.
34. Crawford ED, Rove KO, Trabulsi EJ, et al. Diagnostic performance of PCA3 to detect prostate cancer in men with increased prostate specific antigen: a prospective study of 1,962 cases. J Urol. 2012; 188(5): 1726–1731.
35. Bul M, Zhu X, Valdagni R, et al. Active surveillance for low‑risk prostate cancer worldwide: the PRIAS study. Eur Urol 2013; 63 : 597–603.
36. Ross AE, Loeb S, Landis P, et al. Prostate‑specific antigen kinetics during follow‑up are an unreliable trigger for intervention in a prostate cancer surveillance program. J Clin Oncol 2010; 28 : 2810–2816.
37. San Francisco IF, Werner L, Regan MM, et al. Risk stratification and validation of prostate specific antigen density as independent predictor of progression in men with low risk prostate cancer during active surveillance. J Urol 2011; 185 : 471–476.
38. Whitson JM, Porten SP, Hilton JF, et al. The relationship between prostate specific antigen change and biopsy progression in patients on active surveillance for prostate cancer. J Urol 2011; 185 : 1656–1660
39. Dall’Era MA, Konety BR, Cowan JE, et al. Active surveillance for the management of prostate cancer in a contemporary cohort. Cancer 2008; 112 : 2664–2670.
40. Barayan GA, Brimo F, Begin LR, et al. Factors influencing disease progression of prostate cancer under active surveillance: a McGill University Health Center cohort. BJU Int 2014; 114: E99–E104.
41. Tosoian JJ, Loeb S, Feng Z, et al. Association of [-2]proPSA with Biopsy Reclassification During Active Surveillance for Prostate Cancer. J Urol 2012; 188 : 1131–1136.
42. Hirama H, Sugimoto M, Ito K, et al. The impact of baseline [-2]proPSA‑related indices on the prediction of pathological reclassification at 1 year during active surveillance for low‑risk prostate cancer: the Japanese multicenter study cohort. J Cancer Res Clin Oncol 2014; 140 : 257–263.
43. Ankerst DP, Xia J, Thompson IM, Jr, et al. Precision Medicine in Active Surveillance for Prostate Cancer: Development of the Canary‑Early Detection Research Network Active Surveillance Biopsy Risk Calculator. Eur Urol 2015; 68 : 1083–1088.
44. Mamawala MM, Rao K, Landis P, et al. Risk prediction tool for grade re‑classification in men with favourable‑risk prostate cancer on active surveillance. BJU Int 2017; 120 : 25–31.
45. Loeb S. Shift from protocol‑based to personalized medicine in active surveillance: beginning of a new era. BJU Int 2017; 120 : 3–4.
46. N Mottet RCN, van den Bergh, E Briers, et al. EAU guidelines on prostate cancer. Edn. presented at the EAU Annual Congress Barcelona 2019. ISBN 978-94-92671-05-9.
47. Zincke H, Oesterling JE, Blute ML, et al. Long‑term (15 years) results after radical prostatectomy for clinically localized (stage T2c or lower) prostate cancer. J Urol. 1994; 152 : 1850–1857.
48. Amling CL, Blute ML, Bergstralh EJ, et al. Long‑term hazard of progression after radical prostatectomy for clinically localized prostate cancer: continued risk of biochemical silure after 5 years. J Urol. 2000; 164 : 101–105.
49. Vesely S, Jarolim L, Schmidt M, et al. M. Stratification model based on early postprostatectomy prostate‑specific antigen kinetics may help to reduce the risk of overtreatment in candidates for adjuvant radiotherapy. Scand J Urol. 2017; 51(2): 114–119.
50. Sasaki T, Sugimura Y. The Importance of Time to Prostate-Specific Antigen (PSA) Nadir after Primary Androgen Deprivation Therapy in Hormone‑Naive Prostate Cancer Patients. J Clin Med. 2018; 7(12): 166–169.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2019 Issue 3-
All articles in this issue
- Editorial
- Prevention of thromboembolic complications in urology
- PSA and its isoforms as modern markers of prostate cancer
- Urological complications after kidney transplantation
- Laparoscopic partial nephrectomy: a comprehensive evaluation of single-centre perioperative outcomes
- Wunderlich’s syndrome – cohort of patients with spontaneous nontraumatic retroperitoneal hemorrhage
- Urothelial carcinoma of right renal pelvis and left distal urether
- Limits of nephron sparing surgery in renal tumors – tenfold partial nephrectomy in solitary kidney
- Bilateral kidney tumour as an incidental finding during ultrasound examination in an 82-year-old patient with urinary retention
- Centrally located cystic renal lesion of uncertian biological potential
- 3rd Ostrava Urological-Neurological Symposium
- Report on the 7th Annual Video Seminar „Tips and tricks in urological surgery”
- Report from the 26th annual meeting of Slovak urological society
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PSA and its isoforms as modern markers of prostate cancer
- Urological complications after kidney transplantation
- Wunderlich’s syndrome – cohort of patients with spontaneous nontraumatic retroperitoneal hemorrhage
- Urothelial carcinoma of right renal pelvis and left distal urether
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

