-
Medical journals
- Career
Adenokarcinom sigmoidální augmentace močového měchýře
Authors: Jan Schraml 1,2; Martina Chodacká 2; Marek Broul 1; Petra Hokůvová 1
Authors‘ workplace: Klinika urologie a robotické chirurgie, Masarykova nemocnice, o. z., KZ, a. s., Univerzita Jana Evangelisty Purkyně, Ústí nad Labem 1; Uroonkologický tým Komplexního onkologického centra, Masarykova nemocnice, o. z., KZ, a. s., Ústí nad Labem 2
Published in: Ces Urol 2018; 22(3): 197-202
Category: Case report
Overview
Autoři referují o případu ženy, která podstoupila v 21 letech augmentaci močového měchýře pomocí detubulizovaného segmentu sigmatu pro recidivující ulcerózní cystitidy. Léčba byla úspěšná, pacientka žila zcela normální plnohodnotný život, včetně úspěšného průběhu těhotenství s následným porodem per vias naturales. Pacientka neměla žádné urologické problémy a urologickou péči vyhledala až v 54 letech pro opakující se infekce dolních močových cest.
Vyšetření prokázalo nádor v augmentované časti močového měchýře. Přesto, že se jednalo o nízce diferencovaný adenokarcinom G3, podařilo se nádor radikálně odstranit a resekovanou část nahradit detubulizovaným ileálním štěpem. Pacientka je nyní osm měsíců po výkonu zcela bez obtíží, bez recidivy, provádí čistou intermitentní katetrizaci s občasnou spontánní mikcí, je kontinentní a pravidelně dispenzarizována uroonkologickým týmem.
Kazuistika je dokladem nutné pravidelné a trvalé dispenzarizace pacientů, kteří podstoupili rekonstrukční urologickou operaci s použitím střevního štěpu.
KLÍČOVÁ SLOVA
Augmentace močového měchýře, detubulizovaný segment sigmatu, ulcerózní cystitida, nádor augmentované časti močového měchýře, nízce diferencovaný adenokarcinom, čistá intermitentní katetrizace.
ÚVOD
Jednou z možných pozdních komplikací použití střevního štěpu u urologických rekonstrukčních výkonů je vznik sekundárního nádoru v použitém střevním segmentu. První zmínkou o těchto komplikacích představuje Hammerova publikace z roku 1929 (1), četnější publikace se objevují od 70. let minulého století (2, 3). Karcinom může postihnout jakýkoli použitý střevní segment, a to jak ileum (3), tak i kolon (4, 5). Od typu derivace a použité části gastrointestinálního traktu se odvíjí riziko sekundárního nádoru. Nejvyšší riziko vzniku sekundárního tumoru je u ureterosigmoidostomie, a to 2,58 %, a dále u sigmoideocystoplastiky (1,58 %). Riziko u ortotopické kolické náhrady je 0,97 % versus 0,05 % v případě ileální neoveziky. V případě srovnání ileální neoveziky s ileocékální neovezikou není signifikantního rozdílu v riziku vzniku sekundárního tumoru (6, 7, 8).
KAZUISTIKA
V roce 2017 vyhledala na žádost praktického lékaře naši péči pacientka, u které se vyskytly opakované symptomatické infekce dolních močových cest.
Při prvotním vyšetření na urologii byl zaznamenán masivní nález leukocytů a hlenu v moči. Na ultrazvuku zachycen megaureter na pravé straně s dilatací kalichopánvičkového systému a vyšetření močového měchýře ukázalo atypickou konfiguraci močového měchýře s jasnou intraluminální nádorovou masou.
Pacientka prodělala v 21 letech (před 33 lety) augmentaci močového měchýře pomocí detubulizovaného segmentu esovité kličky pro recidivují ulceroflegmonózní cystitidy. Léčba byla úspěšná, takže celou dobu nepotřebovala žádnou urologickou péči, spontánně močila, netrpěla na symptomatické infekce močových cest, dokonce s augmentovaným měchýřem porodila přirozenou cestou. Z dalších operací prodělala nekomplikovanou cholecystektomii, odstranění obou vaječníků, je sledována pro myom, trpí obezitou I. stupně (BMI 34,53) a je nikotinička. Chronickou medikaci neužívá.
Na vstupním CT – intravenózní urografii byla potvrzena dilatace pravého kalichopánvičkového systému a ureteru až na 15 mm, asymetrický tvar močového měchýře s laločnatou stěnou šíře 35 mm s postkontrastně se sytící masou s kalcifikacemi, do které je zavzat pravý ureter (obr. 1, 2, 3, 4). Koloskopické vyšetření u pacientky indikováno nebylo, ani její rodinná anamnéza neobsahuje kolorektální karcinom.
Image 1. CT vyšetření zachycující intraluminální expanzi v augmentovaném močovém měchýři
Fig. 1. CT examination capturing intraluminal expansion in the augmented bladder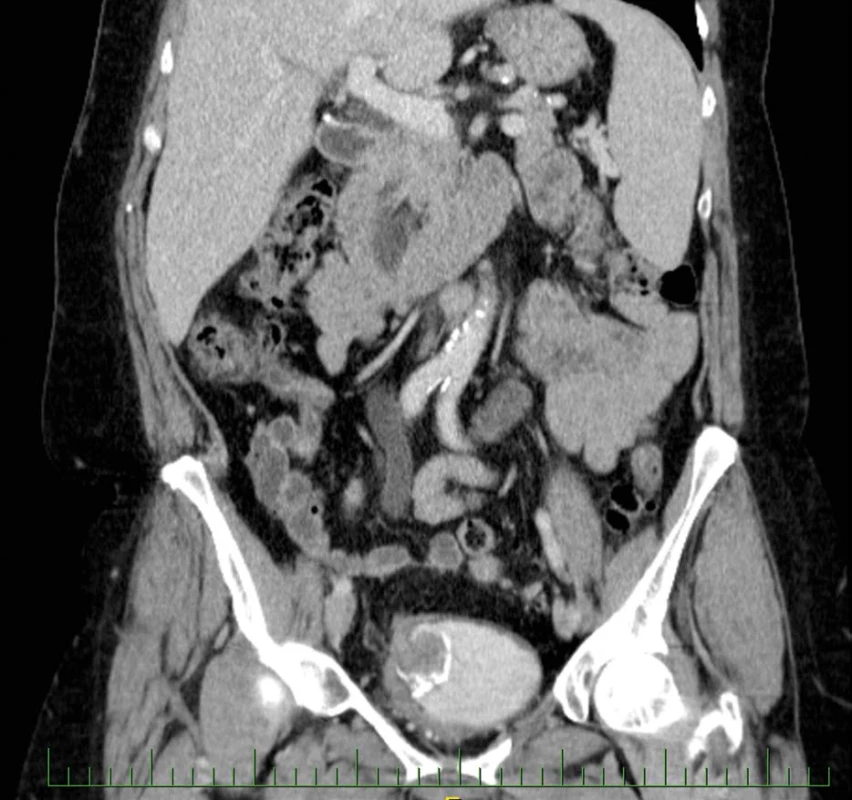
Image 2. CT vyšetření zachycující intraluminální expanzi v augmentovaném močovém měchýři
Fig. 2. CT examination capturing intraluminal expansion in the augmented bladder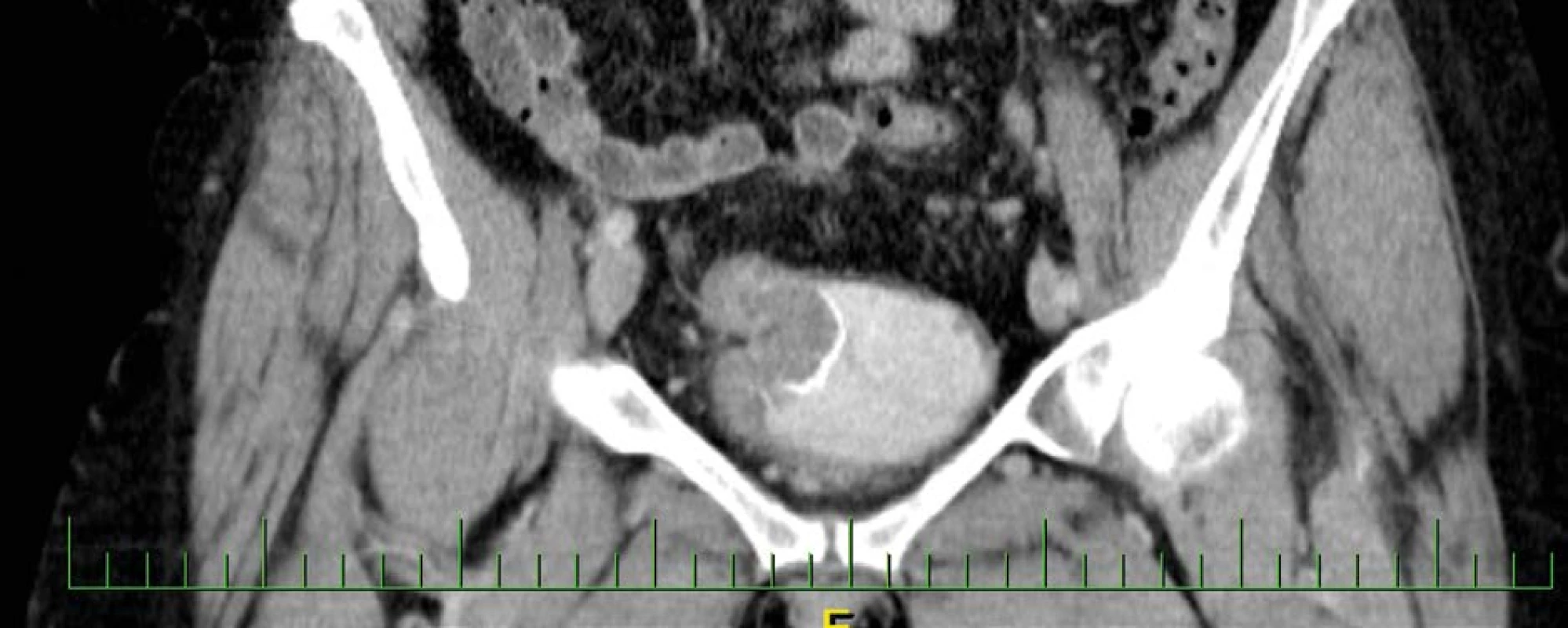
Image 3. CT vyšetření zachycující intraluminální expanzi v augmentovaném močovém měchýři
Fig. 3. CT examination capturing intraluminal expansion in the augmented bladder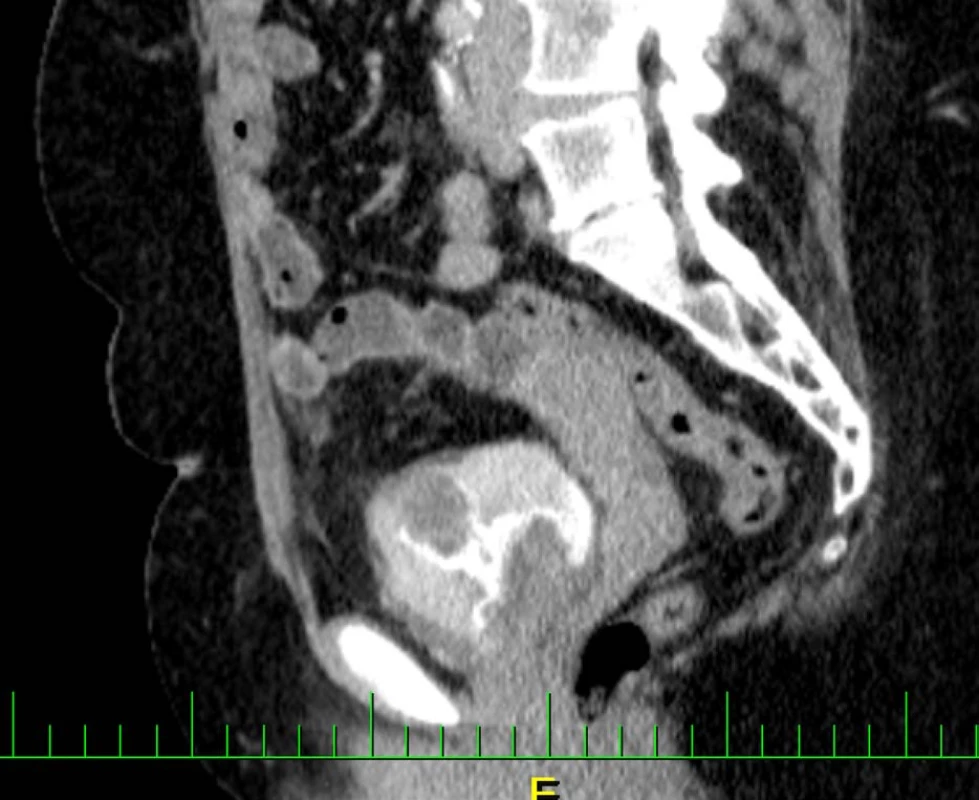
Image 4. CT vyšetření zachycující intraluminální expanzi v augmentovaném močovém měchýři
Fig. 4. CT examination capturing intraluminal expansion in the augmented bladder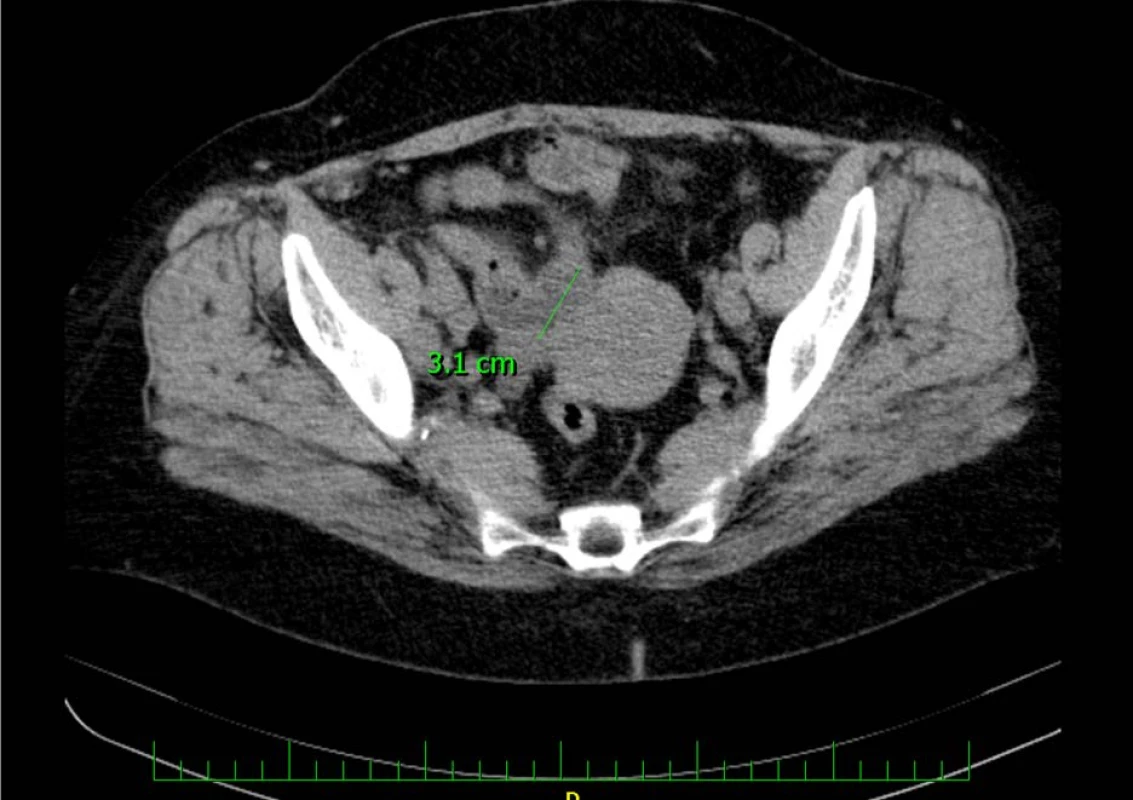
Při cystoskopii bylo nalezeno levé ústí ejakulující čirou moč, pravé ústí nebylo zachyceno, a augmentovaná část byla postižena endoskopicky neřešitelnou plošnou tumorózní infiltrací žlutavé barvy s nekrózami a inkrustacemi. Histologický nález z odebrané biopsie prokázal nekrotickou tkáň prostoupenou ložisky kalcifikací a hrudkami bakterií, dále drobné fragmenty vazivové tkáně prostoupené strukturami nízce diferencovaného adenokarcinomu s reziduální intracelulární PAS pozitivní hlenotvorbou. Nádor byl imunohistochemicky CK7, CK20 a CEA pozitivní, negativní pro GATA3 a p63. Nález uzavřen jako nízce diferencovaný adenokarcinom.
U pacientky, která neměla žádné známky diseminace, bylo indikováno radikální operační řešení. Byla poučena o možné ureteroileostomii, pokud by nebylo možné provést rekonstrukci dolních močových cest.
Vlastní výkon byl velmi náročný pro množství srůstů po předchozích výkonech a chronický fibrózní proces v pánvi. Byla provedena radikální resekce močového měchýře s augmentovanou střevní částí včetně závěsu a ponechána levá část trigona a hrdla močového měchýře. Peroperační biopsie prokázaly negativní okraje. K rekonstrukci byl okludován segment preterminálního ilea v délce 30 cm. Močový měchýř byl zrekonstruován pomocí detubulizovaného segmentu preterminálního ilea v délce 20 cm a z navazující nedetubulizované kličky byla vytvořena přívodná klička pro pravý močovod, jehož distální část byla resekována spolu s tumorem. Hojení po výkonu proběhlo bez obtíží a bez komplikací.
Patolog v definitivním preparátu prokázal nízce diferencovaný adenokarcinom G3, rozměrů 4 x 4 x 3 cm, s negativními resekčními okraji, bez metastáz ve třech lymfatických uzlinách (0/3).
Celotělové CT vyšetření neprokázalo generalizaci onemocnění a vstupní nádorové markery byly v normě. Pacientka byla uroonkologickým multidisciplinárním týmem indikována k adjuvantníchemoterapii – capecitabin v monoterapii. Pro výraznou gastrointestinální intoleranci (gr. 3) byla léčba po prvním cyklu ukončena.
Pacientka je nyní osm měsíců po výkonu zcela bez obtíží, bez recidivy, provádí čistou intermitentní katetrizaci s občasnou spontánní mikcí, je kontinentní a pravidelně dispenzarizována uroonkologickým týmem. Renální funkce jsou pouze minimálně zvýšené, urea 7,9 mmol/l a kreatinin 112 mmol/l. DISKUZE Použití střevního segmentu k rekonstrukci močových cest představuje významný přínos v případě potřeby náhrady močových cest. U mladšího pacienta je však vzhledem k předpokládanému dlouhodobému přežití vyšší riziko pozdní komplikace ve smyslu vzniku adenokarcinomu v použitém segmentu střeva. Obvyklá doba transformace normálních střevních buněk do nádorových je patrně méně než pět až deset let. Chronická expozice střevní sliznice močí může vést k její dysplázii. Přesný mechanizmus této kancerogeneze není znám, uvažuje se o chronickém zánětu nebo dráždění sliznice dlouhou expozicí moče (6), což podporují histologické změny s nálezem zánětlivých buněk.
Vyšetření moče nebo zobrazovací vyšetření k časné diagnóze takové komplikace nestačí. Klasické vyšetření močového sedimentu ztrácí svou základní vypovídající schopnost, protože nález leukocytů či erytrocytů je z naší zkušenosti takřka pravidlem. Spíše se orientujeme dle eventuálních výkyvů v do té doby stabilním chronickém nálezu. Minimálně pro pacienta zatěžující a mnohdy nápomocné je orientovat se podle cytologického vyšetření moče, i když i to je někdy, díky přítomnému hlenu ze střeva, svízelné hodnotit. Využití zobrazovacích metod má omezenou vypovídající schopnost a většinou zachytí až pokročilé nálezy, jako tomu bylo v tomto případě. Zkušenosti s využitím pozitronové emisní tomografie jsou velmi omezené. V případech dlouhodobého sledování je nutno kalkulovat s eventuální radiační zátěží, protože i ta zvyšuje riziko sekundárních malignit atd.
Je proto třeba do režimu dispenzárních kontrol zařadit pravidelné endoskopie v ročních intervalech, obvykle se doporučuje s endoskopickými kontrolami začít 5–10 let po výkonu (9, 10, 12). Použití moderních flexibilních přístrojů výrazně toto vyšetření zjednodušilo, takto se stávají dostupné i eventuální přívodné kličky střeva od močovodu k vlastní náhradě.
Při včasné diagnóze sekundárního tumoru v použitém střevním segmentu lze radikálním výkonem zahrnujícím rekonstrukci s použitím dalšího segmentu střeva pacienta ošetřit jak z onkologického hlediska, tak z hlediska obnovy funkci vývodných cest močových (11).
ZÁVĚR
V případech použití střevního segmentu k náhradě části močového traktu je nutné pomýšlet na možný vznik karcinomu v této části střeva. Je proto třeba pacienty doživotně patřičně dispenzarizovat a endoskopicky sledovat i s ohledem na tuto možnou pozdní komplikaci. Obvykle lze vznik karcinomu předpokládat deset a více let po operaci.
Věnováno památce zakladatele urologického oddělení v Ústí nad Labem doc. MUDr. Jiřímu Mikšovi, CSc., který položil základ Klinice urologie a robotické chirurgie MNUL a v roce 1984 provedl poměrně ojedinělou augmentaci močového měchýře pomocí detubulizovaného střevního segmentu.
Došlo: 20. 3. 2018
Přijato: 13. 7. 2018
Kontaktní adresa:
MUDr. Jan Schraml, Ph.D.
Klinika urologie a robotické chirurgie, Masarykova nemocnice, o.z., KZ, a.s.
Sociální péče 12a 401 13 Ústí nad Labem
e-mail: jan.schraml@kzcr.eu
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Sources
1. Hammer E. Cancer du colon sigmoide dix ans apres implantation des ureters d’une vessie extropiee. Journal of Urology 1929; 28 : 260–263.
2. Leadbetter GW, Zickerman P, Pierce E. Ureterosigmoideostomy and carcinoma of the colon. J Urol 1979; 121 : 732–735.
3. Leedham PW, England HR. Adenocacrinoma developing in an ileocystoplasty. Br J Urol 1973; 60 : 158–160.
4. Moorcraft J, DuBoulay CEH, Isaacson P, et al. Change in the mucosa of colon conduits with particular reference to the risk of malignat change. J Urol 1983; 55 : 185–188.
5. Kirby RS, Loyd‑Davis RW. Adenocacronima occuring within a cococystoplasty l 2013. British journal of urology 1985; 57.3 : 357-358.
6. Austen M, Kalble T. Secondary malignancies in different forms of urinary diversion using isolated gut. J Urol 2004; 172 : 831–838.
7. Lavelle J, Shenot P, Smith C, Chancellor MB. Re: secondary malignancies in different forms of urinary diversion using isolated gut. J Urol 2005; 173 : 1831, author reply 1832.
8. Kälble T, Hofmann I, Riedmiller H, Vergho D. Tumor growth in urinary diversion: a multicenter analysis. Eur Urol 2011; 60 : 1081–1086.
9. Bell MA, Wright EJ, Fang SH, Johnson MH, Sopko NA. Management of advanced adenocarcinoma in Indiana Pouch urinary diversion. Urol Case Rep. 2018; 17 : 53–55.
10. Sherman B, Taylor F. Adenocarcinoma in a Koff urinary ileal diversion. Urol Case Rep. 2017; 13 : 126–127.
11. Honeck P, Kienle P, Huck N, Neisius A, Thüroff J, Stein R. Adenocarcinoma in continent anal urinary diversion: is sigma rektum pouch surgical option after failed ureteroileostomy? Urology 2017; 103 : 209–213.
12. Skalka R, Kočvara R, Dítě Z, Dvořáček J, Hanuš T. Srovnání dlouhodobých výsledků u pacientů po augmentaci močového měchýře ileálním a gastrickým segmentem. Ces Urol 2013; 17(2): 109–117.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2018 Issue 3-
All articles in this issue
- Laparoskopická korekce parastomální kýly po laparoskopické radikální cystektomii
- Tranziční péče o pacienty s neurogenním měchýřem od puberty do dospělosti
- Rozšířená doporučení pro diagnostiku a léčbu dětí s nočním pomočováním
- Frekvence intermitentní katetrizace u pacientů se spinální lézí v České republice
- Vliv denzity a velikosti nefrolitiázy na výsledek flexibilní ureterorenoskopie s lasertrypsí konkrementu
- Adenokarcinom sigmoidální augmentace močového měchýře
- Splenogonadální fúze - rarita pro patologa a urologa
- The 6th video-seminar: Types and tricks in the urological surgery, report from congress
- Praha nejen stověžatá, ale i čtyřseturologická - zpráva z konání 16th European Urology Residents Education Programme
- 29th Annual Meeting of Pediatric Urologists‘ Report
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rozšířená doporučení pro diagnostiku a léčbu dětí s nočním pomočováním
- Vliv denzity a velikosti nefrolitiázy na výsledek flexibilní ureterorenoskopie s lasertrypsí konkrementu
- Frekvence intermitentní katetrizace u pacientů se spinální lézí v České republice
- Adenokarcinom sigmoidální augmentace močového měchýře
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

