-
Medical journals
- Career
Diagnostika onemocnění nadledvin – nejvýznamnější klinické syndromy, biochemický průkaz a úloha zobrazovacích metod
: Filip Čtvrtlík 1; Miroslav Heřman 1; Igor Hartmann 2; Tomáš Tichý 3
: Radiologická klinika FN a LF UP, Olomouc 1; Urologická klinika FN a LF UP, Olomouc 2; Ústav molekulární a klinické patologie FN a LF UP, Olomouc 3
: Ces Urol 2013; 17(1): 18-27
: Review article
Autoři v přehledovém článku nejprve prezentují rozdělení jednotlivých nejvýznamnějších klinických syndromů spojených s hyperfunkcí nadledvin. Je popsán jejich klinický obraz a laboratorní diagnostika. Dále je detailně probrána úloha zobrazovacích metod. Podrobně je popsán radiologický obraz nejčastějších patologických nálezů na nadledvinách a jsou zmíněny i některé méně časté léze. Článek uzavírá problematika incidentalomů nadledvin.
Klíčová slova:
hyperkortizolismus, hyperaldosteronismus, feochromocytom, tumory nadledvin, adenom nadledviny, karcinom nadledviny, metastázy nadledvin, incidentalomy nadledvin, výpočetní tomografie.ÚVOD
Diagnostika a management patologických stavů nadledvin nabývá v poslední době stále více na aktuálnosti v důsledku rychlého rozvoje a všeobecné dostupnosti laboratorních a zobrazovacích metod a také díky novým terapeutickým možnostem v této oblasti. Na podkladě výsledků hormonálních vyšetření a nálezu zobrazovacích metod je pacient dispenzarizován, léčen medikamentózně či indikován k operačnímu řešení. Mezi nejčastější klinické syndromy spojené s hyperfunkcí nadledvin patří hyperkortizolismus, hyperaldosteronismus a feochromocytom. Mezi nejčastější morfologické patologické nálezy na nadledvinách patří adenom, hyperplazie nadledvin, myelolipom, karcinom, feochromocytom a metastázy. Jednoznačně převažuje adenom nadledviny nalézaný v drtivé většině incidentálně. Úlohou urologa je u těchto stavů na podkladě výsledků endokrinologického vyšetření a radiologického nálezu indikovat operační řešení či pouze pacienta dispenzarizovat.
NEJVÝZNAMNĚJŠÍ KLINICKÉ SYNDROMY SPOJENÉ S HYPERFUNKCÍ NADLEDVIN
Hyperkortizolismus – Cushingův syndrom
Jde o onemocnění podmíněné dlouhodobým nadbytkem glukokortikoidů. Lze rozlišit několik základních typů:
- Centrální typ odpovídá nadprodukci adrenokortikotropního hormonu (ACTH) v hypofýze (v drtivé většině na základě adenomu hypofýzy).
- Periferní typ vzniká na podkladě primárních nádorů kůry nadledvin. Převážně je způsoben adenomem nadledvin, vzácněji karcinomem.
- Ektopická sekrece ACTH se může vyskytnout u některých maligních nádorů (až polovinu případů ektopické sekrece tvoří malobuněčný bronchogenní karcinom) (1).
- Vzácnými příčinami Cushingova syndromu jsou primární pigmentovaná nodulární adrenální nemoc (PPNAD) a ACTH independentní makronodulární adrenální hyperplazie (AIMAH) (1).
- Iatrogenní Cushingův syndrom vznikající chronickým podáváním glukokortikoidů.
Klinické projevy všech typů jsou převážně nespecifické: únava, svalová slabost, bolesti v zádech, změny osobnosti. Při fyzikálním vyšetření může být patrná obezita centrálního typu, měsíčkovitý obličej a hirzutismus. Charakteristicky se vyskytují také červenofialové strie. Dále Cushingův syndrom často provázejí poruchy funkce gonád, arteriální hypertenze, edémy, osteoporóza a diabetes mellitus.
V laboratorním screeningu Cushingova syndromu se nejčastěji používá průkaz zvýšeného odpadu kortizolu v moči za 24 hodin a rytmus plazmatického kortizolu. Dále se provádí nízkodávkovaný dexametazonový supresní test s 1 mg dexametazonu a stanovení hladiny adrenokortikotropního hormonu (ACTH). Tato hormonální vyšetření slouží nejen k potvrzení diagnózy Cushingova syndromu, ale také současně významným způsobem přispívají k rozlišení jeho jednotlivých forem.
Hyperaldosteronismus
Primární hyperaldosteronismus je onemocnění vyvolané nadměrnou sekrecí hormonu aldosteronu v kůře nadledvin. Patří mezi nejčastější příčiny sekundární hypertenze. Nadměrná sekrece aldosteronu u primárního hyperaldosteronismu je nezávislá na renin-angiotenzinovém systému, na rozdíl od hyperaldosteronismu sekundárního, což je zvýšená sekrece aldosteronu v důsledku zvýšené produkce reninu (vyskytuje se například u léčby diuretiky, stenózy renální tepny, kongestivních srdečních vad, jaterní cirhózy a dalších).
U primárního hyperaldosteronismu lze rozlišit několik forem. Převažující jsou tyto dvě formy: první zapříčiňuje adenom kůry nadledvin produkující aldosteron (Connův syndrom) a druhou skupinou je bilaterální hyperplazie nadledvin. Rozlišení obou těchto nejčastějších příčin primárního hyperaldosteronismu je zcela zásadní pro další terapeutický postup. Adenom nadledviny je indikován k adrenalektomii, na rozdíl od bilaterální hyperplazie, která je léčená medikamentózně. Laboratorní rozlišení mezi formami primárního hyperaldosteronismu není možné a výsledky CT či MRI nadledvin jsou mnohdy nejednoznačné (2). Zlatým standardem pro rozlišení obou forem primárního hyperaldosteronismu je separovaná katetrizace nadledvinných žil s odběrem vzorků krve na stanovení hladin aldosteronu a kortizolu, která zodpoví otázku, zda se jedná o hormonální nadprodukci unilaterální či naopak oboustrannou. Další skupiny jsou vzácné: unilaterální adrenální hyperplazie, familiární hyperaldosternonismus a karcinom produkující aldosteron (1).
Klinický obraz primárního hyperaldosteronismu je nespecifický. Mohou se vyskytnout příznaky vyplývající z hypokalémie: svalová slabost, únava, zácpa, parestezie a poruchy srdečního rytmu. Téměř vždy je přítomná středně těžká až těžká arteriální hypertenze. Popisované laboratorní známky jako hypokalémie, zvýšené vylučování draslíku a metabolická alkalóza se vyskytují přibližně jen u poloviny nemocných.
V laboratorní diagnostice jsou zásadní pro potvrzení diagnózy primárního hyperaldosteronismu hladiny plazmatického reninu a aldosteronu. Nejcitlivějším screeningovým testem je stanovení poměru koncentrace plazmatického aldosteronu k plazmatické reninové aktivitě. Screeningové vyšetření hyperaldosteronismu je indikováno u všech pacientů s farmakorezistentní hypertenzí, tedy kde nestačí tři antihypertenziva včetně diuretika v plné dávce. Ve sporných případech je k odlišení primárního hyperaldosteronismu vhodné provedení supresního testu k posouzení možnosti potlačení sekrece aldosteronu. Při laboratorní diagnostice primárního hyperaldosteronismu je vhodné upravit antihypertenzní medikaci, která může ovlivnit výsledek vyšetření. Jedná se především o diuretika, dále ACEI (inhibitory angiotenzin konvertujícího enzymu) a ARB (blokátory receptorů pro angiotensin II – sartany).
Laboratorními metodami ale nelze jednotlivé subtypy primárního hyperaldosteronismu odlišit. Každý pacient s primárním hyperaldosteronismem by měl podstoupit vyšetření zobrazovacími metodami (CT a MRI) minimálně z důvodu vyloučení rozsáhlé expanze na nadledvině charakteru karcinomu. Ale nález na CT může být ze spousty důvodů zavádějící (2), a proto se většina autorů přiklání k názoru, že katetrizaci nadledvinných žil je nutné provést před zvažovanou adrenalektomií u všech pacientů s primárním hyperaldosteronismem nezávisle na výsledcích CT (3–6).
Feochromocytom
Feochromocytom je tumor chromafinních buněk sympatoadrenálního systému s trvalou nebo paroxyzmální hypersekrecí katecholaminů způsobujících arteriální hypertenzi. Nejčastěji se vyskytuje ve dřeni nadledvin, může se však nacházet také extraadrenálně (tyto tumory jsou nazývány paragangliomy). Většina feochromocytomů je benigních.
Rozlišení biologické povahy feochromocytomu pouze na základě zobrazovacích metod bývá ve většině případů nemožné. Pouze pokud jsou přítomné vzdálené metastázy, lze říci, že se jedná o maligní variantu. Odlišení benigního a maligního feochromocytomu je velmi obtížné i pro histopatologa, protože při hodnocení preparátu nelze použít pouze pravidla obecné onkologie. Histologické hodnocení musí být komplexní a zahrnovat i imunohistochemické vyšetření proliferační aktivity. Pak se lze s určitou pravděpodobností vyjádřit k možnosti rekurence či metastáz (7). Obecně ale jsou přesvědčivé histopatologické známky maligního feochromocytomu stále kontroverzní. Díky této skutečnosti je nutné pacienty po operaci feochromocytomu dlouhodobě dispenzarizovat.
V 10 % jsou feochromocytomy oboustranné. Mohou být součástí syndromu familiární mnohočetné endokrinní adenomatózy typu II, kde se vyskytují společně s medulárním karcinomem štítné žlázy a adenomy příštitných tělísek.
Klinické příznaky bývají rozmanité. Typická pro diagnózu feochromocytomu je fixovaná či paroxyzmální hypertenze. Během paroxyzmu se může vyskytnout bolest hlavy, pocení, palpitace, bolest na hrudi, dušnost, studená a vlhká kůže, zblednutí, třes, úzkost, nervozita a dyspeptické potíže. Feochromocytom se také může manifestovat náhle vzniklým edémem plic. U neléčených feochromocytomů dochází k neuroretinopatii, kardiomyopatii a cévním mozkovým příhodám. Základním potvrzením diagnózy jsou zvýšené hladiny katecholaminů a jejich metabolitů v plazmě a v moči. Zlatým standardem v průkazu nadprodukce katecholaminů je stanovení plazmatického normetanefrinu a metanefrinu (8, 9). Před vlastním operačním řešením feochromocytomu je velmi důležitá řádná příprava alfa-blokátorem.
Nálezy na zobrazovacích metodách u onemocnění nadledvin
Úkolem zobrazovacích metod je co nejpřesněji popsat lézi na nadledvině, tedy její morfologické charakteristiky, zejména její strukturu a velikost. Současně by se měl hodnotící radiolog vyjádřit, zda považuje nález spíše za benigní či naopak maligní. Úkolem radiologa je rozlišit útvary na nadledvině na léze vhodné k operaci a ostatní nálezy. Dále je nutné posoudit vztah k sousedním orgánům a cévním strukturám, případně zodpovědět na další požadavky a otázky operatéra.
Adenom
Tento benigní nádor je nejčastějším tumorem nadledvin. Typická je pro něj ve srovnání s ostatními patologickými nálezy na nadledvinách menší velikost, která je při sledování na opakovaných CT vyšetřeních v drtivé většině stacionární. Obvykle je zachycen při zobrazovacích metodách zcela náhodně. Většinou má homogenní strukturu.
Obecně lze adenomy rozdělit do dvou skupin: na adenomy bohaté na obsah lipidů a naopak na adenomy chudé na lipidy. Tento fakt podmiňuje i obraz adenomů na CT a MRI vyšetření (10).
Převažující první skupina tvořící více než 70 % adenomů vykazuje díky vysokému obsahu intracytoplazmatických lipidů na nativním CT denzitu nižší než 10 HU (10, 11) (obr 1). Přibližně 30 % adenomů bohužel obsahuje málo lipidů, a mají tedy na nativních skenech denzitu vyšší než je 10 HU. Tento fakt zapříčiňuje závažný diferenciálně diagnostický problém vzhledem k odlišení dalších klinicky významných patologických nálezů s vyšší nativní denzitou. Pouze z nativního CT vyšetření tedy nelze odlišit adenom s nízkým obsahem lipidů od karcinomu, feochromocytomu či metastázy, eventuálně dalších méně častých nálezů na nadledvinách (hematom, ganglioneurom, lymfom a další). Protože po intravenózní aplikaci kontrastní látky (k.l.) mohou mít všechny tyto patologické nálezy opět stejný obraz, nemá samotné kontrastní vyšetření v rozlišení těchto skupin nálezů velký význam. Přínosem je pouze tehdy, pokud se provedou opožděné skeny s posouzením tzv. washout, tedy posouzení vyplavování kontrastní látky. U adenomů dochází k rychlému vyplavení k.l. ve srovnání karcinomy, metastázami a feochromocytomy (12–14).
1. Adenom pravé nadledviny. Mediálně od pravého laloku jater v dorzálním sousedství dolní duté žíly je patrný homogenní ostře ohraničený oválný útvar s nízkou nativní denzitou odpovídající adenomu. Nativní sken v transverzální rovině. Fig. 1. Right adrenal adenoma. An oval, well-circumscribed, homogeneous mass with a low native density corresponding to adenoma is seen medially to the right hepatic lobe located dorsally to the inferior vena cava. Non-contrast scan in the transverse plane. 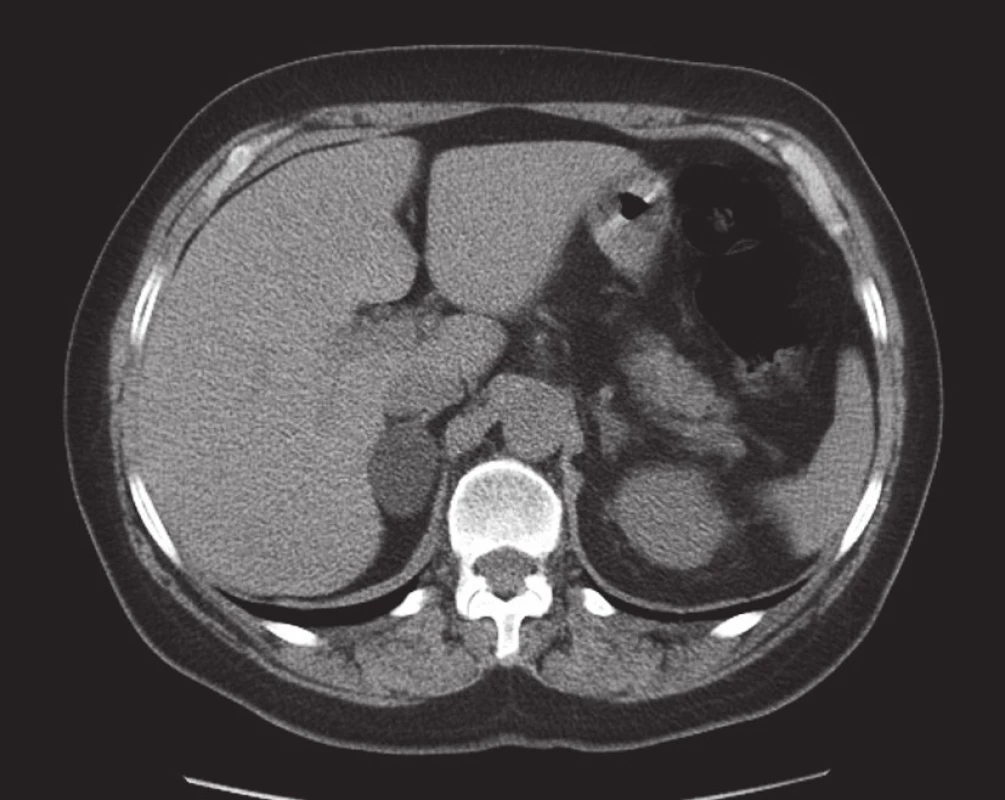
K verifikaci adenomů bohatých na obsah lipidů v cytoplazmě lze také použít vyšetření magnetickou rezonancí (MRI). Ta je schopná velmi dobře odlišit adenomy bohaté na obsah lipidů pomocí techniky „chemical shift imaging“ (10).
Pokud pacient podstoupí PET/CT vyšetření, v našich podmínkách nejčastěji PET/CT vyšetření pomocí 18F-fluorodeoxyglukózy (18F FDG PET/CT), drtivá většina adenomů radiofarmakum neakumuluje. Obecně 18F FDG PET/CT vyšetření má podle metaanalýz vysokou senzitivitu (97%) i specificitu (91%) v rozlišení mezi maligní a benigní adrenální lézí (15).
Myelolipom
Myelolipom paří mezi benigní tumory nadledvin. Je tvořený tukovou a hematopoetickou tkání. Je hormonálně zcela afunkční. Klinicky je asymptomatický, pouze objemné myelolipomy se mohou projevovat bolestí nebo způsobit retroperitoneální hemoragii. Myelolipomy rostou velmi pomalu. Nevyžadují žádnou léčbu, pouze větší symptomatické myelolipomy mohou být odstraněny chirurgicky. Na CT vyšetření mají díky obsahu tuku typicky nízkou denzitu, nižší než 0 HU často méně než –50 HU. Ta je pro přítomnost hematopoetické tkáně lehce vyšší než okolní retroperitoneální tuk. Díky svému typickému obrazu je diagnóza myelolipomu definitivní již z nálezu na CT či MRI (obr. 2). Při vyšetření 18F-fluorodeoxyglukózou PET/CT neakumuluje radiofarmakum.
2. Myelolipom levé nadledviny. Z dorzální části levé nadledviny vychází objemná kulovitá expanze s denzitami tuku dislokující kaudu pankreatu ventrálním směrem a levou ledvinu směrem kaudálním. Vpravo je konturovatelná zcela normální nadledvina. Postkontrastní sken v transverzální rovině. Fig. 2. Left adrenal myelolipoma. A large spherical expansion with fatty densities arises from the dorsal portion of the left adrenal gland, displacing the tail of pancreas ventrally and the left adrenal gland caudally. On the right, a perfectly normal adrenal gland is seen. Post-contrast scan in the transverse plane. 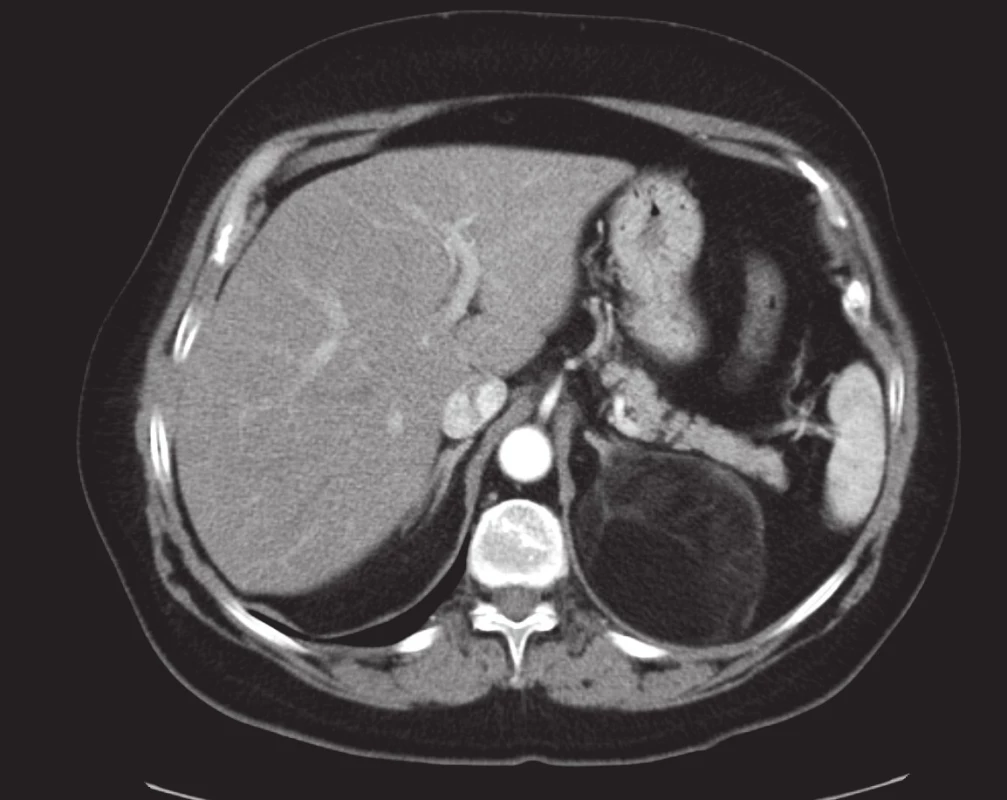
Karcinom
Adrenokortikální karcinomy patří mezi méně časté, ale klinicky velmi významné tumory s vysokým maligním potenciálem. Incidence karcinomu nadledviny se udává od jednoho do dvou případů na 1 milion obyvatel (16), prevalence se odhaduje 4–12 případů na 1 milion obyvatel (17). U 50–60 % pacientů se adrenokortikální karcinom projeví příznaky hyperfunkce nadledvin (16), nejčastěji jde o rychle progredující Cushingův syndrom (9).
V době diagnózy má adrenokortikální karcinom ve srovnání s adenomy signifikantně větší velikost (18) (obr. 3). V souboru pacientů, kteří podstoupili adrenalektomii na Urologické klinice Fakultní nemocnice Olomouc měřil největší adrenokortikální karcinom 28 × 20 cm a vážil 3,9 kg. Při vyšetření zobrazovacími metodami vykazuje často nápadně heterogenní strukturu. Na nativních skenech má denzitu vyšší než 10 HU. Může prorůstat okolní struktury a šířit se do adrenální, renální nebo i do dolní duté žíly. V čase je pro něj typická progrese velikosti. Při PET/CT vyšetření nacházíme u karcinomů nadledvin nápadně zvýšenou akumulaci 18F FDG.
3. Karcinom levé nadledviny. V levé části retroperitonea je patrná objemná heterogenně se sytící expanze dislokující okolní struktury. Levá ledvina je výrazně odtlačená kaudálním směrem. Postkontrastní sken v transverzální rovině. Fig. 3. Left adrenal carcinoma. A large heterogeneously enhanced expansion displacing the adjacent structures is apparent in the left side of the retroperitoneum. The left adrenal gland is markedly shifted in the caudal direction. Post-contrast scan in the transverse plane. 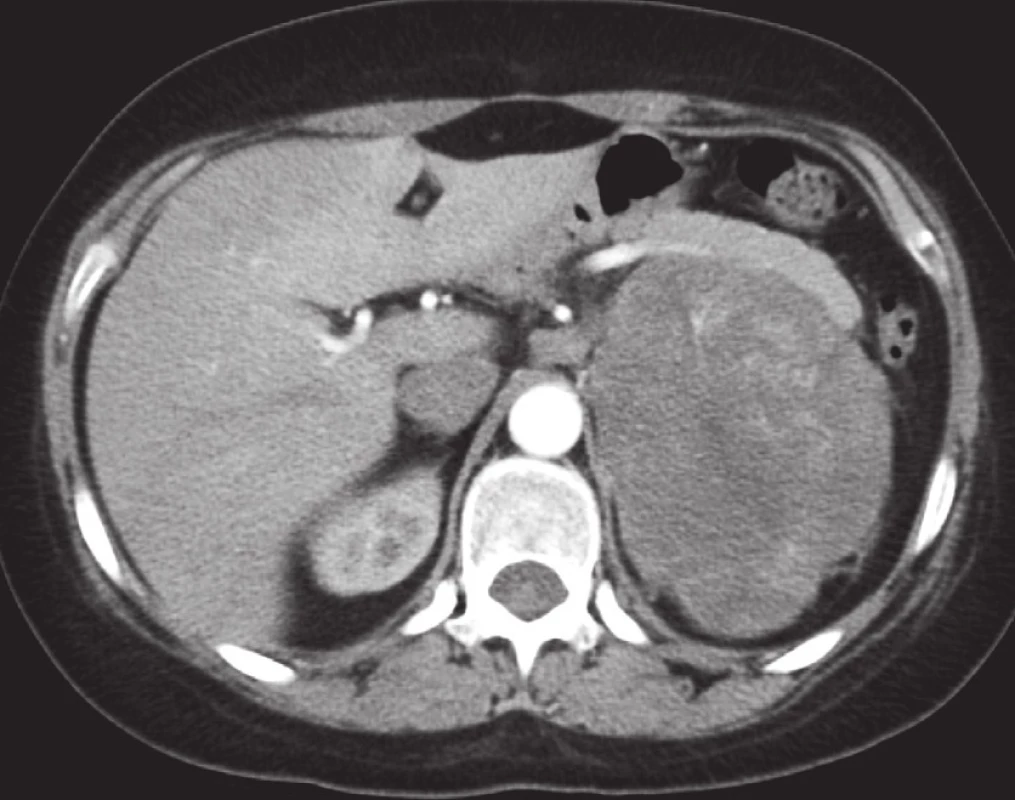
CT a zvláště PET/CT se používá ke stanovení stagingu tumoru a zvážení následného terapeutického postupu. Stadium I je charakteristické primárním adrenálním tumorem menším než 5 cm. Stadium II znamená primární adrenální tumor větší než 5 cm. V I. i II. stadiu nedochází k lokálnímu či vzdálenému šíření tumoru. Stadium III znamená primární tumor jakékoliv velikosti s šířením do periadrenálního tuku či regionálních lymfatických uzlin. Stadium IV je definováno jako primární tumor jakékoliv velikosti pronikající přilehlé orgány a přítomnost vzdálených metastáz. Prognóza adrenokortikálního karcinomu je všeobecně špatná.
Feochromocytom
Prevalence feochromocytomů se je odhadována od 1 : 4500 až 1 : 1700 s incidencí tři až osm případů na milion obyvatel (9). U feochromocytomu platí pravidlo 10 %: v 10 % se vyskytuje extraadrenálně, v 10 % je bilaterální a v 10 % je maligní. Klinicky je pro něj typická záchvatovitá či fixovaná arteriální hypertenze. V diagnostickém algoritmu se dnes v biochemickém průkazu uplatňuje vyšetření metanefrinů a normetanefrinů (8, 9). Obdobně jako karcinom bývá větší velikosti. Po aplikaci kontrastní látky na CT či MRI se často velmi intenzivně heterogenně sytí se zvýrazněním nekrotických okrsků (obr. 4). Současně má také na nativním CT denzitu vyšší než 10 HU. Jednoznačné odlišení od karcinomu či metastázy není pouze na základě zobrazovacích metod možné. Bohužel také nelze jednoznačně rozlišit benigní od maligní varianty feochromocytomu. Pouze při záchytu vzdálených metastáz lze vyslovit podezření, že se jedná o feochromocytom maligní povahy. Průměrný pětiletý interval přežití se pohybuje od 40 do 60 % (9). Na základě několika studií byl vyvrácen dříve přetrvávající mylný názor o možnosti vyvolání hypertenzní krize po aplikaci kontrastní látky (19). Na druhou stranu významně zvyšuje riziko vyplavení katecholaminů do oběhu případná biopsie. Proto je při klinickém podezření na feochromocytom biopsie kontraindikována. Při vyšetření 18F-fluorodeoxyglukózou PET/CT je většinou pozitivní. Toto vyšetření může také někdy pomoci v pátrání při extraadrenální lokalizaci feochromocytomu (20). Velmi dobře lze k detekci použít i scintigrafii radioaktivním jodem značený metajodobenzylguanidin 123I-MIBG (21). Toto vyšetření je však ve srovnání s PET/CT dražší a méně dostupné. V diagnostice feochromocytomu je také možné použít PET s 18F-fluorodopaminem, které je v současné době již dostupné i v naší republice. Rutinnímu využití však stále brání dostupnost a vysoká cena vyšetření.
4. Feochromocytom. V místě levé nadledviny nad horním polem levé ledviny je patrné nápadné kulovité ložisko, jehož periferní části se po i. v. aplikaci kontrastní látky intenzivně sytí. Vpravo je patrná zcela normální nadledvina. Postkontrastní sken v transverzální rovině. Fig. 4. Pheochromocytoma. In the left adrenal gland above the upper pole of the left kidney, a conspicuous spherical mass is seen; its peripheral portions are intensely enhanced following intravenous contrast agent administration. On the right, a perfectly normal adrenal gland can be seen. Post-contrast scan in the transverse plane. 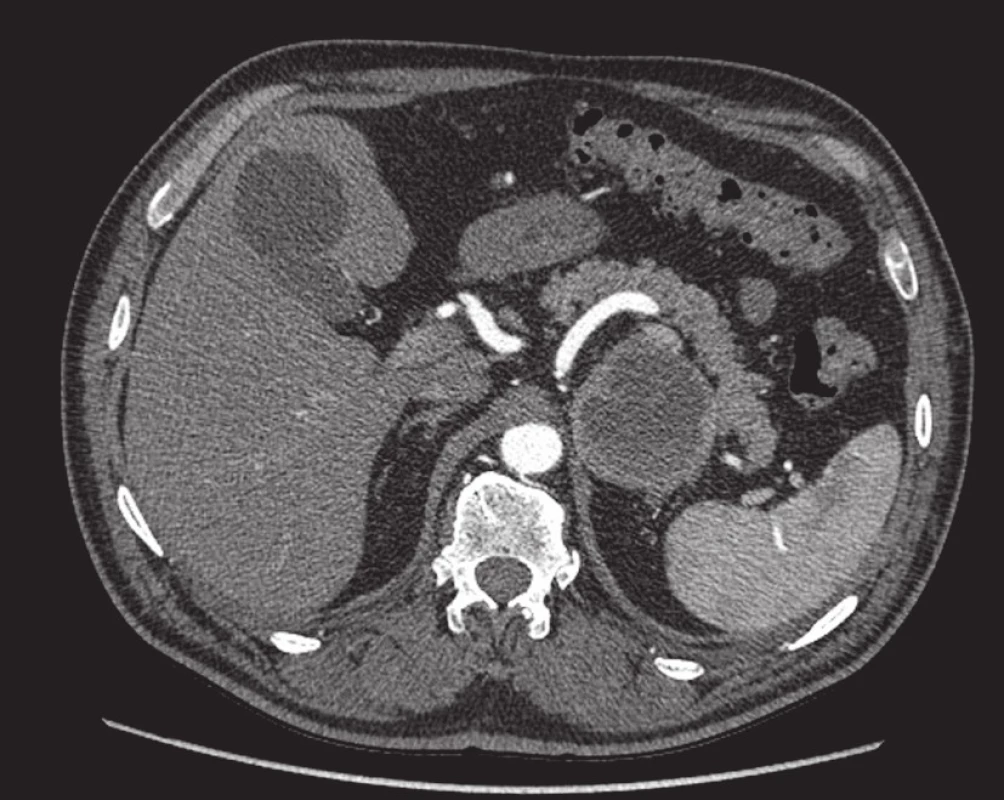
Metastázy
Nadledvina je velmi dobře vaskularizovaná, a je proto častým místem výskytu metastáz. Při pitvách jsou metastázy do nadledvin nalézány až u 27 % pacientů s maligními epiteliálními tumory (22).
Nejčastěji jde o metastatické postižení při bronchogenním karcinomu, karcinomu ledvin či prsu. U karcinomu ledviny se také může jednat o přímé prorůstání velkých tumorů ledvin nebo tumorů šířících se z horního pólu ledviny. Metastatické postižení nadledvin může být unilaterální, ale i oboustranné. Z morfologického hlediska vykazují metastázy velmi variabilní obraz i velikost. Může se jednat jen o drobné nodulace, ale i o objemné expanze s výrazně nehomogenní strukturou. Typické pro metastázy do nadledvin je progrese velikosti v čase. Na nativním CT mají nativní denzitu větší než 10 HU. Při větší velikosti jsou heterogenní struktury, což vynikne zejména po i.v. aplikaci k.l. (obr. 5). Při PET/CT vyšetření s 18F-fluorodeoxyglukózou vychytávají radiofarmakum. Významnou výjimkou jsou metastázy bronchioloalveolárního karcinomu či metastázy karcinoidu, které toto radiofarmakum neakumulují (23).
5. Metastázy do nadledvin. Výrazné zvětšení obou nadledvin kulovitými objemnými heterogenně se sytícími expanzemi. Postkontrastní sken. Fig. 5. Adrenal metastases. Marked enlargement of both adrenal glands caused by large spherical heterogeneously enhanced expansions. Post-contrast scan. 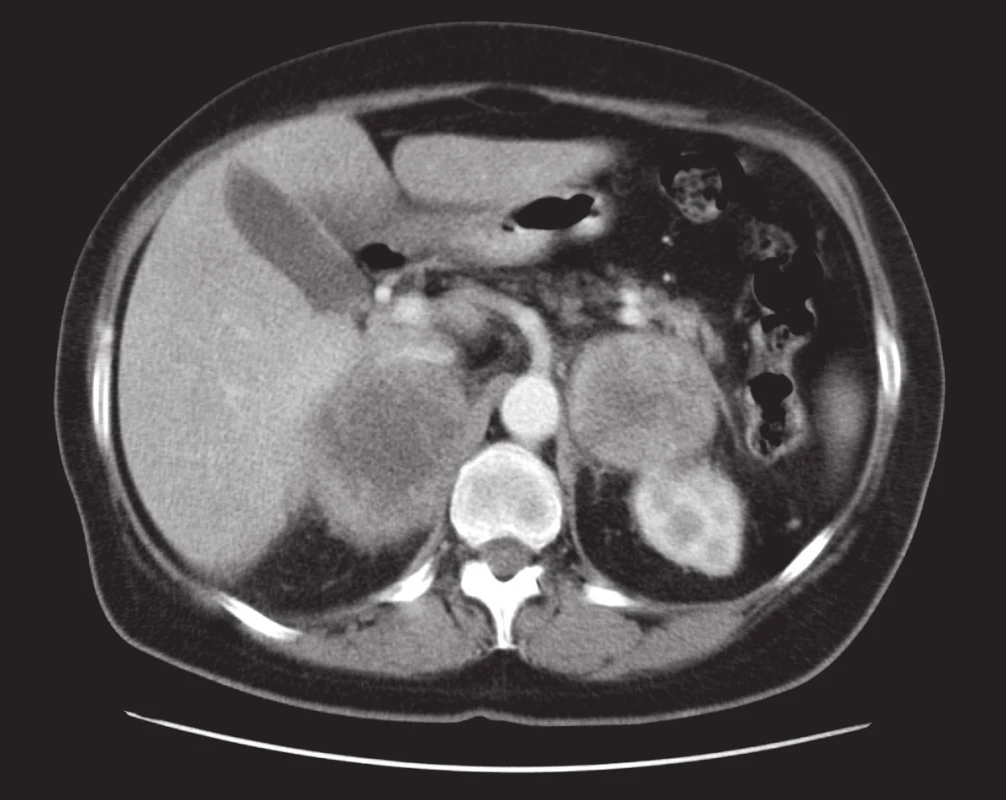
Ganglioneurom
Ganglioneurom je benigní tumor z gangliových buněk vyskytující se spíše v mladším věku. V CT nálezu dominuje kulovitý solidní tumor s ostrým ohraničením. Mohou se vyskytnout kalcifikace (24).
Non-hodgkinský lymfom (NHL)
Lymfom nadledviny patří mezi méně časté nálezy. Obraz lymfomu nadledviny na zobrazovacích metodách je nespecifický. Stanovení diagnózy lymfomu je důležité pro terapii, protože základem je chemoterapie a chirurgický výkon zde není indikován.
Neuroblastom
Jde o maligní rychle rostoucí velmi agresivní tumor vyskytující se v dětském věku vycházející ze dřeně nadledvin. Po Wilmsově tumoru je neuroblastom druhý nejčastější tumor v dutině břišní u dětí. Polovina až dvě třetiny břišních neuroblastomů vychází z nadledviny. Nejčastěji se vyskytuje ve věku mezi 1. a 5. rokem, ale může se vyskytnout i v novorozeneckém věku nebo může být diagnostikován i prenatálně. V době diagnózy již má přibližně 50 % pacientů metastázy (25). V biochemickém průkazu je typické zvýšení hladin derivátů katecholaminů (kyselina homovanilová a vanilmandlová) v moči. Diagnostiku neuroblastomu v dětském věku zahajuje ultrasonografické vyšetření. V CT obrazu je patrný objemný tumor přesahující střední čáru, s převládající heterogenní strukturou s přítomností kalcifikací, nekróz a krvácení. Tumor svým růstem zazdívá velké cévy retroperitonea, dislokuje okolní struktury a může se šířit i do páteřního kanálu nebo dolní duté žíly.
Cysty
Cysty jsou vzácným, často incidentálním nálezem v oblasti nadledvin. Mohou být endoteliální a méně i epiteliální a parazitární. Častější jsou pseudocysty vznikající jako následek krvácení (26). Pokud stěna cysty vykazuje na zobrazovacích metodách nodulární zesílení, je nutné diferenciálně diagnosticky zvážit možnost cystického tumoru nadledviny, zejména feochromocytomu a karcinomu (26).
Krvácení/hematom nadledviny
Krvácení do nadledvin se nejčastěji vyskytuje v novorozeneckém věku. V dospělém věku je krvácení vzácnější a u oboustranného postižení nejčastěji souvisí s poruchami koagulace (26). Častěji se v dospělém věku setkáváme s incidentálně zachyceným starým hematomem nadledviny, u něhož musíme diferenciálně diagnosticky na prvním místě zvažovat adenom chudý na lipidy, který může mít stejný obraz.
Obraz hematomu se vyvíjí podle jeho stáří. U akutní hemoragie do nadledvin je nadledvina zvětšená a neostře ohraničená. Později se formace stává více heterogenní. Nejčastěji se na zobrazovacích metodách setkáme již jen s kalcifikacemi jako následkem dříve proběhlého krvácení.
Tuberkulóza (TBC)
U dospělých dochází k postižení nadledvin v rámci postprimární TBC. V dnešní době se většinou setkáváme spíše u starší populace s kalcifikacemi nadledvin v rámci proběhlého onemocnění, které mohou být patrné i na prostém snímku.
Incidetalomy nadledvin
Vzhledem ke stále se zvyšující všeobecné dostupnosti zobrazovacích metod dochází ke stále častějšímu záchytu expanzí nadledvin. Incidentalom nadledviny je náhodně zachycený útvar na nadledvině vyšetřovacími metodami u pacientů, u nichž jsme nepředpokládali na nadledvinách patologický nález. Incidentalomy jsou nacházeny při CT vyšetření břicha přibližně v 5–10 % případů (27).
Při nálezu incidentalomu nadledviny je důležité vyloučení maligní povahy léze a sekreční aktivity útvaru.
Vyloučení či potvrzení sekreční aktivity, na němž se podílí endokrinolog, je poměrně snadné. Obtížnější je posouzení biologické povahy léze, ke které by se měl již při iniciálním vyšetření vyjádřit radiolog. Na podkladě zobrazovacích metod a hormonálních testů je buď indikováno operační řešení, nebo je pacient jen sledován. Eventuální bioptickou verifikaci před vlastní operací na našem pracovišti téměř nepoužíváme a v drtivé většině případů se o dalším postupu rozhodne jen na základě morfologického obrazu na zobrazovacích metodách a biochemického vyšetření sekreční aktivity. Diferenciální diagnostika a správná interpretace nálezu incidentalomu je velmi důležitá a rozhodnutí zvláště závažné v případech, když má pacient již známou extraadrenální malignitu (například karcinom plic), protože rozlišení povahy léze je pro další léčbu zcela kruciální: metastáza vyžaduje aktivní přístup naopak afunkční adenom stačí pouze dispenzarizovat.
Podle hormonální aktivity můžeme incidentalomy nadledvin rozdělit do dvou hlavních skupin: na tumory bez hormonální aktivity a na endokrinně aktivní tumory. Drtivou většinu tvoří afunkční léze (až 85 %) (28). Menší část pak tvoří léze s hormonální aktivitou, kdy se nejčastěji jedná o subklinický Cushingův syndrom (29). Histopatologicky patří mezi nejčastěji nalézané incidentalomy nadledvin adenomy, ostatní patologické nálezy jsou méně časté (myelolipomy, feochromocytomy, karcinomy, metastázy a další vzácné příčiny), přičemž procentuální zastoupení se u jednotlivých autorů liší (11, 30–32).
Stále nepanuje konsenzus ohledně nutnosti dalších kontrolních CT vyšetření a jejich četnosti (31, 32). Na našem pracovišti, pokud byla vyloučena hormonální aktivita incidentalomu, či nevysloveno podezření na malignitu útvaru, provádíme první kontrolní vyšetření zobrazovacími metodami za rok po iniciálním vyšetření.
ZÁVĚR
Onemocnění nadledvin je problematikou vyžadující multidisciplinární přístup. Na funkční diagnostice se podílí endokrinolog, jehož role je vyloučit klinické syndromy spojené s hormonální dysfunkcí nadledvin. Morfologická diagnostika je úkolem radiologa, který má za úkol co nejlépe popsat morfologii útvaru a vyjádřit se k jeho dignitě. Role urologa je komplexní posouzení těchto nálezů a následné rozhodnutí zda pacienta pouze dispenzarizovat či mu nabídnout operační řešení.
Došlo: 14. 1. 2013.
Přijato: 9. 2. 2013.
Kontaktní adresa
MUDr. Filip Čtvrtlík, Ph.D.
Radiologická klinika FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: Filip.Ctvrtlik@fnol.cz
Podpořeno projektem IGA UP LF 2013 002.
Střet zájmů: žádný.
Sources
1. Marek J. Endokrinní hypertenze. Praha: Galén 2004.
2. Čtvrtlík F, Köcher M, Černá M, Václavík J, Hartmann I. Současný stav v diagnostice primárního hyperaldosteronismu. Ces Radiol 2012; 66(2): 139–147.
3. Funder JW, Carey RM, Fardella C, Gomez-Sanchez, CE, Mantero F, Stowasser M, Young WF Jr, Montori VM. Case detection, diagnosis, and treatment of patients with primary aldosteronism: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2008; 93(9): 3266–3281.
4. Ballon M, Ceral J, Solař M, Krajina A, Raupach J, Ungermann L. Je průkaz adenomu nadledviny u pacientů s primárním hyperaldosteronizmem dostatečný pro indikaci adrenalektomie? Vnitř. Lék. 2009; 55(6): 555–559.
5. Kempers MJ, Lenders JW, van Outheusden L, van der Wilt GJ, Schultze Kool LJ, Hermus AR, Deinum J. Systematic review: diagnostic procedures to differentiate unilateral from bilateral adrenal abnormality in primary aldosteronism. Ann Intern Med 2009; 151(5): 329–337.
6. Nishikawa T, Omura M, Satoh F, Shibata H, Takahashi K, Tamura N, Tanabe A. Guidelines for the diagnosis and treatment of primary aldosteronism. Task Force Committee on Primary Aldosteronism, The Japan Endocrine Society. Endocr J 2011; 58(9): 711–721.
7. de Wailly P, Oragano L, Radé F, Beaulieu A, Arnault V, Levillain P, Kraimps JL. Malignant pheochromocytoma: new malignancy criteria. Langenbecks Arch Surg 2012; 397(2): 239–246.
8. Pacak K, Linehan WM, Eisenhofer G, Walther MM, Goldstein DS. Recent advances in genetics, diagnosis, localization, and treatment of pheochromocytoma. Ann Intern Med 2001; 134(4): 315–329.
9. Pacák K. Endokrinní nádory nadledvin v současné klinické praxi. Praha: Galén 2011.
10. Korobkin M, Giordano TJ, Brodeur FJ, Francis IR, Sigelnam ES, Quint LE, Dunnick NR, Heiken JP, Wangh H. Adrenal adenomas: ralationship between histologic lipid and CT a MRI findings. Radiology 1996; 200 : 743–747.
11. Boland GW, Blake MA, Hahn PF, Mayo-Smith WW. Incidental adrenal lesions: principles, techniques, and algorithms for imaging characterization. Radiology 2008; 249(3): 756–775.
12. Caoili EM, Korobkin M, Francis IR, Cohan RH, Platt JF, Dunnick NR, Raghupathi KI. Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology 2002; 222(3): 629–633.
13. Kebapci M, Kaya T, Gorbuz E Adapinar B, Kebapci N. Differentiation af adrenal adenomas (lipid rich and lipid poor) from nonadenomas by use of washout characteristics on delayed enhanced CT. Abdom Imag 2003; 28 : 709–715.
14. Szolar DH, Korobkin M, Reittner P, et al. Adrenocortical carcinomas and adrenal pheochromocytomas: mass and enhancement loss evaluation at delayed contrast-enhanced CT. Radiology 2005; 234 : 479–485.
15. Boland GW. Characterization od adrenal masses by using FDG PET: a systematic review and meta-analysis of diagnostic test performance. Radiology 2011; 259(1): 117–126.
16. Fassnacht M, Allolio B. Clinical management of adrenocortical carcinoma. Best Pract Res Clin Endocrinol Metab 2009; 23(2): 273–289.
17. Grumbach MM, Miller BM, Braunstein GD, Campbell KK, Carney JA, Godley PA, Hartus EL, Lee JK, Oertel YC. Management of clinical inapparent adrenal mass (incidentaloma). Ann Intern Med 2003; 138 : 424–429.
18. Zhang HM, Perrier ND, Grubbs EG, Sircar K, Ye ZX, Lee JE, Ng CS. CT features and quantification of the characteristics of adrenocortical carcinomas on unenhanced and contrast-enhanced studies. Clin Radiol 2012; 67(1): 38–46.
19. Bessell-Browne R, O’Malley ME. CT of Pheochromocytoma and Paraganglioma: Risk of Adverse Events with IV Administration of Nonionic Contrast Material. AJR Am J Roentgenol 2007; 188 : 970–974.
20. Ferdová E, Ferda J, Hes O, Daum O, Skalický T, Třeška V. Zobrazení feochromocytomů a paragangliomů retroperitonea pomocí 18F-FDG-PET/CT. Ceska Radiologie 2010; 64(4): 259–265.
21. Rubello D, Vui C, Casara M, Gross D, Fig LM, Shapiro B. Functional Scintigraphy of the Adrenal Gland. Eur J Endocrinol 2002; 147 : 13–27.
22. Lim JW, Kim HJ, Lee DH, Ko YT. Bilateral adrenal masses: Algorithm approach for diagnosis. Eur Radiol 2005; 15(Suppl 1): 455 (Abstr.).
23. Blake MA, Cronin CG, Boland GW. Adrenal imaging. AJR Am J Roentgenol 2010; 194(6): 1450–1460.
24. Ferozzi F, Tognini G, Giuliotti S, Zuccoli G, Zompatori M. Unusual tumors of the adrenals: CT, MR findings. Eur Radiol 2003; 13(Suppl 1): 459 (Abstr.).
25. Slovis TL. Caffey’s Pediatric Diagnostic Imaging.11. ed. Philadelphia: Elsevier 2008; 2215–2220.
26. Johnson PT. Adrenal Imaging with MDCT:Nonneoplastic Disease. AJR 2009; 193 : 1128–1135.
27. Vlahos I. CT of the adrenal: not just distinguishing non-adenoma versus adenoma. Clin Radiol 2012; 67(1): 47–48.
28. Mantero F, Terzolo M, Arnaldi G, Osella G, Masini AM, Ali A, Giovagnetti M., Opocher G, Angeli AA. Survey on Adrenal Incidentaloma in Italy. J Clin Endocrinol Metab 2000; 85 : 637–444.
29. Rossi R, Tauchmanova L, Luciano A, Martino M, Battista C, Viscovo L, Nuzzo V, Lombardi G. Subclinical Cushing’s Syndrome in Patients with Adrenal Incidentaloma: Clinical and Biochemical Features. J Clin Endocrinol Metab 2000; 85 : 1440–1448.
30. Ctvrtlík F, Herman M, Student V, Tichá V, Minarík J. Differential diagnosis of incidentally detected adrenal masses revealed on routine abdominal CT. Eur J Radiol 2009; 69(2): 243–252.
31. Zeiger MA, Thompson GB, Duh QY, Hamrahian AH, Angelos P, Elaraj D, Fishman E, Kharlip J. American Association of Clinical Endocrinologists; American Association of Endocrine Surgeons. American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons Medical Guidelines for the Management of Adrenal Incidentalomas: executive summary of recommendations. Endocr Pract 2009; 15(5): 450–453.
32. Aron D, Terzolo M, Cawood TJ. Adrenal incidentalomas. Best Pract Res Clin Endocrinol Metab 2012; 26(1): 69–82.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2013 Issue 1-
All articles in this issue
- Role of the urologist in the treatment of castration-resistant prostate cancer in the Czech Republic
- Diagnosing adrenal disease – most significant clinical syndromes, biochemical testing and role of imaging methods
- Self-inserting foreign bodies in urogenital tract for the purpose of sexual stimulation
- Testicular sperm aneu-ploidy in men with spinal cord injury
- Examination of the sentinel lymph node, mapping of the prostatic primary lymphatic drainage and assessment benefit of this diagnostic procedure for staging of the prostate cancer
- Life-threatening bleeding into the peritoneal cavity due to spontaneous rupture of angiomyolipoma
- Kidney morcellation after laparoscopic nephrectomy
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnosing adrenal disease – most significant clinical syndromes, biochemical testing and role of imaging methods
- Self-inserting foreign bodies in urogenital tract for the purpose of sexual stimulation
- Life-threatening bleeding into the peritoneal cavity due to spontaneous rupture of angiomyolipoma
- Kidney morcellation after laparoscopic nephrectomy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

