-
Medical journals
- Career
Genetické riziko karcinomu prostaty
Authors: Milan Král 1; Vlasta Vyhnánková 1; Vladimír Študent 1; Jan Bouchal 2
Authors‘ workplace: Urologická klinika LF UP a FN, Olomouc 1; Laboratoř molekulární patologie LF UP, Olomouc 2
Published in: Ces Urol 2010; 14(3): 139-147
Category: Review article
Overview
Karcinom prostaty je onemocnění, na jehož vzniku se kromě faktorů enviromentálních značnou měrou podílejí i faktory genetické. Přes extenzivní výzkum je však jeho etiopatogeneze jen velmi málo prozkoumaná. Podle genetické zátěže rozlišujeme karcinomy prostaty sporadické (nejčastější formy), familiární a hereditární. Mezi nejčastěji odhalené genetické odchylky u karcinomů prostaty patří změny v genetické informaci pro androgenový receptor, z dalších kandidátských genů jmenujme RNAseL v lokusu HPC1, geny ELAC2, MSR1, BRCA 1 a 2, fúzní geny TMPRSS2+ERG/ETV, KLF6 a řadu dalších. S rozvojem metod molekulární biologie se nám otevírají další možnosti pochopení příčiny vzniku karcinomu prostaty a ovlivnění dalšího průběhu choroby. Cílem předkládaného článku je prezentovat současný pohled na genetické riziko vzniku karcinomu prostaty.
Klíčová slova:
genetika, karcinom prostaty, riziko.Úvod
Karcinom prostaty (KP) patří v současné době mezi nejvýznamnější onkologická onemocnění postihující mužskou populaci s nejvyšší incidencí ze všech solidních nádorů a řadí se na druhé místo v mortalitě na nádorová onemocnění na světě (1). Zatímco se incidence neustále zvyšuje od osmdesátých let 20. století, kdy bylo do praxe zavedeno testování prostatického specifického antigenu (PSA), mortalita zůstává přibližně ve stejném rozmezí a k jejímu nárůstu nedochází. Právě vyšetřování PSA vedlo k významnému posunu v zastoupení jednotlivých stadií KP směrem k časnějším formám, tj. k migraci stadií, což významnou měrou ovlivnilo vyhlídky těchto pacientů.
Zatímco před „érou PSA“ byla většina karcinomů prostaty diagnostikována na podkladě rektálního vyšetření, po transuretrální resekci prostaty či transvezikální prostatektomii, v současné době je více jak 70 % karcinomů odhalených na podkladě elevace PSA, a tedy z časového hlediska o 10 a více let dříve. Díky screeningu je tak ovlivněn nejen časový faktor, ale i biologický charakter onemocnění. Dle nálezů v biopsiích jsou totiž detekovány nádory s nižším maligním potenciálem, tedy s nižším histopatologickým gradingem a pochopitelně i stagingem. Na druhou stranu je však celkové zastoupení agresivnějších karcinomů ovlivněno zpřísněním hodnocení dle doporučení urologických patologů z konference ISUP 2005, USA (2, 3).
Dle odhadů z registru National Cancer Institute (USA, program Surveillance, Epidemiology and End Results, SEER) je pro rok 2009 v USA očekáváno 192 280 nových případů karcinomů prostaty při současné mortalitě 27 360 případů. V České republice se pak incidence, resp. mortalita karcinomu prostaty pohybují dle údajů z roku 2007 na hodnotách 100,2/100 000, resp. 28,39/100 000 mužů (v absolutních číslech tedy incidence v České republice činí 5094 a mortalita 1443 mužů) (4).
Rizikové faktory karcinomu prostaty
Je všeobecně známo, že karcinom prostaty je multifaktoriální onemocnění, nebyla však dosud determinována jednoznačná a přesvědčivá příčina tohoto onemocnění. Ačkoli se předpokládá, že se na vzniku KP (spolu) podílejí faktory enviromentální, významnou, ne-li dominantní roli zde hraje genetická výbava (či zátěž) muže. Nasvědčuje tomu rozdíl v četnosti incidence, resp. mortality u bělošské vs. afroamerické populace mužů v USA (156, resp. 25 u bělochů vs. 248, resp. 59 u Afroameričanů/ 100 000 mužů) (1).
Z faktorů enviromentálních jmenujme příjem živočišných tuků, alkoholu, podstoupení vazektomie, kouření, obezitu, medikaci statinů, nesteroidních protizánětlivých preparátů, příjem vitaminů D a E, stopových prvků a minerálů (kalcium, selen, zinek) či sexuální aktivitu (Pozn.: Závěry studií na příčinnou souvislost některých faktorů, ať už protektivních či rizikových se však mohou výrazně lišit) (5).
Na pomezí faktorů zevního prostředí a faktorů genetických stojí androgeny, estrogeny, inzulín, IGF (insulin-like growth factor) a další hormony, jejichž hladiny mohou kolísat dle genetických predispozic jedinců a vnějších okolností (hormonální substituce, obezita, komorbidity) (6, 7).
Genetika a karcinom prostaty
Většina onkologických onemocnění obecně je způsobena vícečetnými mutacemi genů, ke kterým dochází v průběhu stárnutí buněk (působením fyzikálních, chemických či biologických mutagenů) a zpravidla současně na několika stupních. K těmto změnám dochází běžně v každé buňce, avšak ne každá taková změna musí zákonitě vést k maligní transformaci. Pokud reparační procesy (buněčné či na úrovni organismu) nejsou schopny eliminovat vzniknuvší nádorové buňky, rozbíhá se kaskáda neregulovatelného růstu a dělení nádorových buněk, v nichž bývá mj. potlačen proces apoptózy. Pokud však k takovýmto změnám/poškození genetické informace dojde v zárodečné buňce, přechází informace i na přímé potomky. Pro tento způsob přenosu onemocnění je charakteristické, že se v rodinách vyskytují některá onemocnění s vyšší frekvencí, časnějším nástupem, bilaterálním či multifokálním postižením, případně agresivnějším průběhem než v běžné populaci (tab. 1). Kromě mutačních terorií je velký důraz kladen i na teorii kmenových buněk, které se nepochybně podílejí na patogenezi (nejen nádorových) chorob.
Table 1. Příklady geneticky determinovaných onkologických onemocnění Table 1. Examples of genetically determined oncological diseases 
U geneticky determinovaných onemocnění lze pak často odhalit danou odchylku metodami molekulární genetiky (polymerázová řetězová reakce, fluorescenční in situ hybridizace, sekvenování genomu a další).
Z praktického hlediska lze karcinomy prostaty rozdělit do tří skupin: hereditární, familiární a sporadický. Z celkového počtu karcinomů prostaty se odhaduje, že ve více jak 85 % jde o sporadické formy a pouze 10–15 % karcinomů je geneticky determinováno (genetické faktory se nám pak daří s různou mírou spolehlivosti určit). Rozborem populačních studií byla zjištěna vyšší incidence karcinomů prostaty u přímých příbuzných v rámci rodiny (8, 9) (tab. 2). Nosičství tzv. vysoce rizikových „alel náchylnosti“ ke karcinomu prostaty je výrazně častější u mužů, u nichž je KP diagnostikován v časnějším věku (43 % u mužů mladší 55 let, 34 % u mužů mladších 70 let a 9 % mladších 85 let) (10, 11). Zatímco jako „sporadický“ je definován karcinom u muže s negativní rodinnou anamnézou, o „familiárním karcinomu“ mluvíme při postižení dvou či více mužů v rodině a „hereditární karcinom“ pak znamená postižení tří a více mužů v rodině, ve třech následujících generacích či postižení dvou mužů ve věku do 55 let.
Table 2. Vztah rodinné anamnézy a rizika vzniku karcinomu prostaty (upraveno dle 9) Table 2. Relation of family history and risk of prostate cancer (9) 
Z meta-analýzy 33 epidemiologických studií hodnotících riziko rodinné zátěže karcinomu prostaty vyplynulo, že relativní riziko vzniku KP u muže, jehož bratr má karcinom prostaty, je 3,4 oproti riziku 2,2 při postižení otce muže. Toto riziko se navíc zvyšuje, je-li postiženo více mužů v rodině v první linii než v linii druhé (12, 13).
Nejen rodinná anamnéza karcinomu prostaty zvyšuje jeho riziko u všech mužů v dané linii, ale taktéž i výskyt karcinomu prsu či ovaria u matky či sestry v dané rodině (i recipročně). Relativní riziko činí v tomto případě 1,7 a v případě anamnézy karcinomu prostaty a současně prsu/ovaria je pak toto riziko dokonce 5,8 (ačkoli jiné studie tyto závěry nepotvrdily) (14–16).
Segregační analýzy u pacientů se sporadickým a familiárním karcinomem odhalily, že se v drtivé většině familiárních karcinomů jedná o autozomálně dominantní typ dědičnosti a pouze v malém procentu o dědičnost recesivní či vázanou na chromozom X. Mluvíme o tzv. „genech náchylnosti ke karcinomu prostaty“ (viz níže). Podle tohoto modelu až 97 % nositelů takového genomu onemocní karcinomem prostaty, dosáhnou-li věku 85 let oproti 10 % mužů bez této genetické zátěže. Dále se tyto rizikové geny podílejí až na 65 % karcinomů prostaty diagnostikovaných před 65. rokem života (17, 18). Dalším přínosem jsou rozsáhlé epidemiologické studie hodnotící frekvenci výskytu karcinomu prostaty u monozygotních a dizygotních dvojčat. Z těchto jmenujme nejrozsáhlejší a nejvýznamnější studii vycházející z údajů databáze zahrnující údaje od téměř 16 000 dvojčat (veteráni 2. světové války, narozeni v letech 1917–1927 v USA). Karcinom prostaty byl diagnostikován u 1009 mužů, přičemž současný výskyt karcinomů u dvojčat monozygotních byl 27,1 % oproti 7,1 % u dizygotních (19). Závěry potvrdil ve švédské populaci dvojčat i Grönberg (20).
Biologické chování familiárních a hereditárních karcinomů
Byly publikovány studie srovnávající klinické a patologické parametry u mužů se sporadickým a hereditárním karcinomem prostaty indikovaných ke kurativní terapii (hodnotil se klinický a patologický staging, PSA, pooperační vývoj PSA a přežití specifické pro karcinom). Kupelian prezentoval výsledky 1038 pacientů léčených radikální prostatektomií či radioterapií (RT), přičemž muže rozdělil do skupiny s pozitivní a negativní rodinnou anamnézou. Přežití bez biochemické recidivy po 5 letech od kurativní terapie bylo 52 % u mužů bez rodinné zátěže oproti 29 % u mužů s familiárním karcinomem (21). Zcela diskordantně se k tomuto však staví závěry z dalších center. Skupina z Johns Hopkins Hospital hodnotila 94 pacientů s familiárním karcinomem oproti 562 pacientům se sporadickým karcinomem léčených radikální prostatektomií. V průběhu 65 měsíců nebyl shledán rozdíl v pooperačních parametrech ani intervalu do progrese (22). Hanlon (23) retrospektivně hodnotil 920 pacientů, kteří podstoupili RT bez neoadjuvantní hormonální léčby, přičemž 97 z nich splňovalo kritéria pro familiární či hereditární karcinom prostaty. Ačkoli šlo v tomto případě pouze o krátké období dispenzarizace, nebyly nalezeny rozdíly v četnosti či časnosti biochemického selhání. Ke stejným závěrům dospěl i již výše zmiňovaný Grönberg na švédské populaci mužů (24) a z recentnějších prací pak Herkommer a Rouprêt (25, 26).
Z epidemiologických studií vyplývá, že setrvale nejvyšší incidenci karcinomů prostaty mají skandinávské země. Opačně, incidence KP u Asiatů žijících v Asii je nejnižší na světě. Je však prokázáno, že četnost KP rapidně narůstá, dojde-li k migraci Asiatů například do USA, což podporuje domněnku úzké souvislosti změny stravovacích návyků a životního stylu. Četnost KP u Afroameričanů je taktéž výrazně vyšší než u bělochů žijících ve stejném prostředí. Afroameričani mají navíc ve srovnání s bělochy horší staging a grading karcinomu i agresivnější průběh onemocnění (27).
Genetické determinanty karcinomu prostaty
Androgenový receptor a metabolismus steroidních hormonů
Jedním z možných vysvětlení odlišného biologického chování KP u Afroameričanů je genetická výbava, a to konkrétně v genu pro androgenový receptor (AR). Tento je velmi podrobně prozkoumán právě pro svůj těsný vztah k fyziologické i patologické funkci prostatické buňky. Gen pro AR je lokalizován na krátkém raménku chromozomu X (Xq11-12), přičemž tento lokus patří mezi nejvíce konzervativní oblasti lidského genomu (s tímto souvisí i minimální množství mutací) (28, 29). Jeho velikost je přibližně 90 kbp a kóduje 918 aminokyselin. AR se skládá z transaktivační domény na N-konci řetězce, z domény vázající DNA a z ligand vázající domény na C-konci. Součástí receptoru je i oblast s aktivační funkcí na N-konci, které je zodpovědné za ligand independetní aktivaci receptoru (podstata aktivace AR i bez přítomnosti standardního ligandu, tj. dihydrotestosteronu a v menší míře testosteronu). Po aktivaci receptoru dochází k jeho působení v příslušných buňkách na cílové oblasti DNA (tzv. androgen responsive elements) a k expresi genetické informace zakódované v androgen-dependentních genech (např. PSA, růstové faktory EGFR, VEGF, IGF, KGF, ARA a mnoho dalších) (30). Variabilita v délce genu pro AR je dána polymorfizmem v jeho N-koncové oblasti. Počet opakování tripletu bází CAG (polyglutaminový úsek) a GGC (polyglycinový úsek) v 1. exonu genu pro AR je výrazně nižší u populace Afroameričanů než u bělochů. Normální počet glutaminových repetic je 8–35 a většina populace jich má 21. Polyglutaminové repetice kratší než 21 opakování mohou být spojeny s vyšším rizikem vzniku KP, jeho časnějším nástupem a agresivnější formou z důvodu pevnější vazby ligandu a chronické hyperstimulace androgenového receptoru ligandem (Afroameričané : běloši : Asiaté mají 18 : 21 : 22 repetic). Opačně pak vyšší počet polyglutaminových repetic (> 40) vede k alteraci interakce androgenový receptor-koaktivátor a důsledkem je například Kennedyho choroba či snížená fertilita. Počet repetic glycinu se pohybuje 10–30, ale dopad abnormálního počtu repetic na KP je zatím stále předmětem studia (oproti délce polyglutaminové sekvence, kde je důkazů pro souvislost s KP poměrně dost (31–35). Mutace genu pro AR se vyskytují s minimální frekvencí u lokalizovaného onemocnění (cca 1 %), naopak se tyto mutace vyskytují ve 30–45 % karcinomů metastázujících a rezistentních k hormonální ablační terapii (36).
V souvislosti genetickou predispozicí pro KP se diskutuje také o genu pro enzym 5α-reduktáza typu II (SRD5A2), jehož polymorfismus hraje významnou roli v metabolismu androgenů v prostatických buňkách. Multiplikované repetice dinukleotidů zvyšují aktivitu tohoto enzymu s následnou zvýšenou přeměnou testosteronu na účinnější dihydrotestosteron (Pozn.: Metaanalýza dat však v této souvislosti opět přesvědčivě nepotvrdila vyšší riziko KP.) (37). Cunningham analyzoval genetické variace i v dalších genech (celkem 25) zahrnutých do metabolismu androgenů i estrogenů, přičemž polymorfismy genů pro AKR1C3, NQO1 a GSTT1 byly slabě asociovány s familiárním KP (38).
Další alterace genomu a náchylnost ke karcinomu prostaty
Jak již bylo zmíněno výše, 85 % karcinomů prostaty je „sporadických“ a pouze 15 % zahrnuje tzv. familiární karcinom včetně hereditární formy. Právě častější výskyt v rámci rodin a časnější nástup onemocnění vedly k extenzivním studiím genomu za účelem odhalení rizikových genů pro KP či jejich lokusů (obdoba definování „high-risk“ genů BRCA1 a BRCA2 u karcinomu prsu a ovaria). Aby výzkum této problematiky probíhal systematicky, vytvořila se mezinárodní pracovní skupina – International Consortium of Prostate Cancer Genetics (ICPCG). Jejím účelem je vzájemná kooperace, sdílení získaných dat ještě před dílčím odpublikováním a vytváření metaanalýz (39). Dosud byla provedena řada studií, v nichž bylo identifikováno několik genů velmi pravděpodobně souvisejících s KP a o dalších genech se uvažuje (tab. 3) (7, 40–43).
Table 3. Přehled genů pravděpodobně souvisejících se vznikem karcinomu prostaty Table 3. Overview of prostate cancer susceptible genes 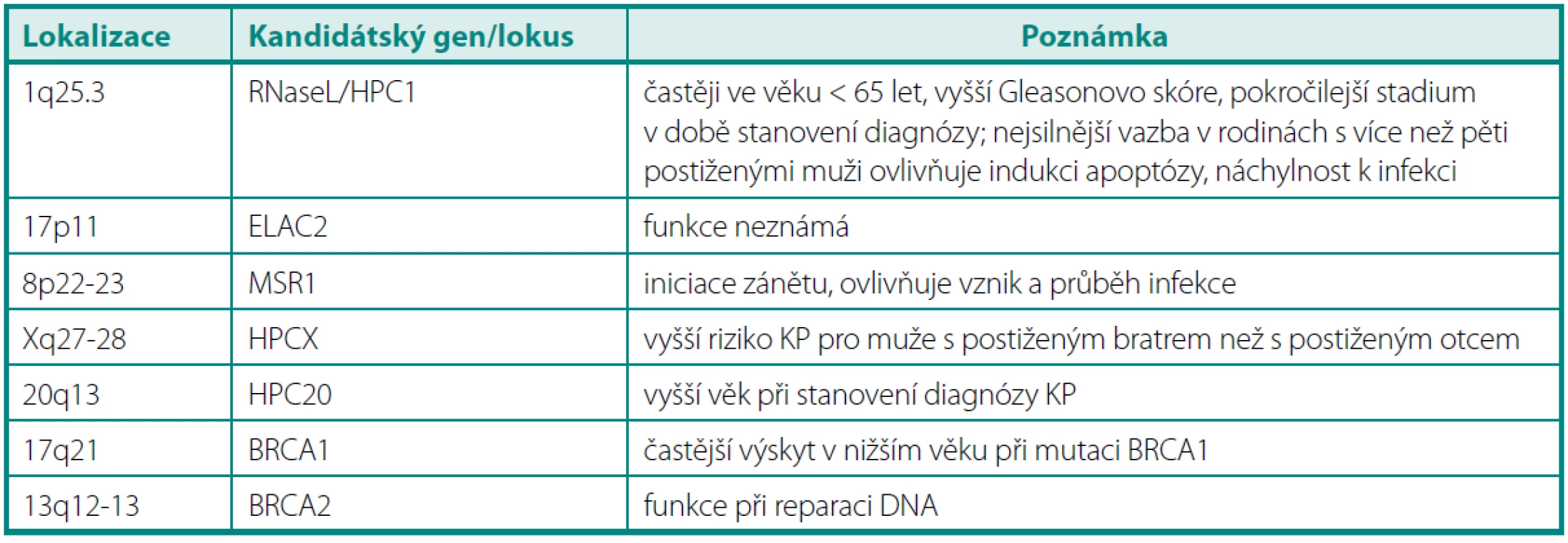
Ze všech testovaných kandidátských genů pro karcinom prostaty patří mezi nejvýznamnější RNAseL v lokusu HPC1, ELAC2 v lokusu HPC2, MSR1 na chromozomu 8, gen BRCA2, BRCA1 a další (44). Ačkoli byl projekt výzkumu lidského genomu (HUGO) již před několika lety zdárně ukončen, v současné době se mapují další a další lokusy označované jen jako další v pořadí (HPC1 - HPC20) a jsou odhalovány mutace v genech, o nichž se soudí, že jsou ve spojitosti se vznikem či progresí karcinomu prostaty – např. KLF6, PTEN, MAD1L1 a další (45).
Hereditary Prostate Cancer 1
Jde zřejmě o nejvýznamnější lokus dávaný do souvislosti s karcinomem prostaty, který je lokalizován na chromozomu 1q24-25. Na molekulární úrovni je vázán k tomuto lokusu gen RNAseL v poloze 1q25.3, kódující endoribonukleázu. Tento enzym má význam v imunitní odpovědi organismu na virové infekce (degradace jednovláknové RNA spolu s INF-α), dále pak v indukci apoptózy, v regulaci buněčného růstu a diferenciace buněk. Pro gen RNAseL je typická autozomálně dominantní dědičnost, přičemž tento gen má vysokou penetraci (tj. nositel jeho zmutované varianty má vysoké riziko, že u něj KP vznikne) (46). Bylo zjištěno, že muži s touto predispozicí mají nižší věk (< 65 let), horší Gleasonův grading a pokročilejší stadium v době stanovení diagnózy. Podrobnou analýzou genomu u 91 rodin postižených karcinomem prostaty z USA a Švédsku vyplynulo, že až v 35 % případů postižených mužů byl odhalen tento lokus, na němž došlo k mutaci. Mutace/polymorfismy tohoto genu jsou dávány do souvislosti nejen s narušením reakce na přítomnost RNA virů v organismu, ale jsou spojeny i s vyšším rizikem familiárního KP, ačkoli výsledky studií se v podrobnostech liší. Dle některých výzkumných skupin je význam RNAseL u hereditárního karcinomu pouze okrajový a významným se stává při postižení více jak čtyřech mužů v rodině, dle jiných je korelace HPC1 s KP u Afroameričanů i hispánských mužů jednoznačně prokázána (41, 47–50). Závěry studií v židovské komunitě Ashkenasi původně hovořící pro spojitost mezi karcinomem prostaty a mutací genu RNAseL však později potvrzeny nebyly (51, 52). V poslední době se objevily práce poukazující na velmi pravděpodobnou souvislost mezi narušením funkce endoribonukleázy RNAseL a přítomností viru XMRV (xenotropic murine leukemia virus-related virus), jehož DNA byla nalezena u 6 % KP a XMRV protein dokonce u 23 % karcinomů prostat (exprese byla primárně v maligních buňkách). KP s tímto přítomným virem vykazovaly mnohem častěji agresivnější biologické chování (53). Mezi další kandidátské geny v lokalizaci HPC1 patří gen pro cyklin-dependentní kinázu PCTAIRE, protoonkogen TRK a gen pro lidský laminin B2, přičemž se soudí, že by jejich ztrátová mutace či absence mohly vést k promoci karcinomu prostaty (30).
Hereditary Prostate Cancer 2
Jde o další lokus na chromozomu 17p11, u kterého se zvažovala souvislost predispozice pro KP. Až v nedávné době byl identifikován protein kódovaný genem v daném lokusu (ELA C homolog protein 2 neboli Zn-fosfodiesteráza). Nebyl však dosud neprokázán přímý vztah mezi mutací či polymorfismem v daném lokusu a karcinomem prostaty (54, 55).
Hereditary Prostate Cancer X
Jde o jeden z mála lokusů na chromozomu X podezřelých z možné souvislosti s hereditárním KP. Je lokalizován v pozici Xq27-28, kde se nachází mj. i sada genů SPANX – tyto jsou dávány do souvislosti i s jinou kancerogenezí než prostatickou (56). Právě vazbou na gonozom je zdůvodňován netypický způsob přenosu – studie prokázaly vyšší relativní riziko KP pro muže s bratrem postiženým karcinomem než pro muže s postiženým otcem. Předpokládá se, že je zodpovědný za 16 % hereditárně podmíněných karcinomů (57, 58).
Macrophage Scavenger Receptor 1 (MSR1)
Krátké raménko chromozomu 8 je charakteristické tím, že je v této oblasti lokalizována celá řada tumor supresorových genů, jejichž inaktivace je spojena s karcinogenezí nejen v prostatě, ale také v plicích, játrech či tlustém střevě. Fyziologická funkce MSR1 spočívá v modulaci interakce mezi cizorodou buňkou a makrofágy, jejich adhezí a fagocytozou. Nicméně ani metaanalýzou dat nebyla shledána jednoznačná korelace mezi lokusem pro MSR1 a hereditárním rizikem (59).
Breast Cancer Antigen 1 a 2
Jak již bylo zmíněno výše, používání genů BRCA1 a 2 se stalo běžnou praxí při vyšetřování genetických predispozic pro karcinom prsu a ovaria. Odhalení mutací v těchto genech u mužů je spojeno s vyšším rizikem hereditárního karcinomu (v případě BRCA1 se toto riziko týká mužů mladších 65 let, v případě BRCA2 je toto riziko dáno bez ohledu na věk, ačkoli v nižším věku je riziko ještě vyšší). Gen pro BRCA1 je lokalizován na 17q21, hraje klíčovou roli při udržování stability genomu kontrolou buněčného cyklu a opravou poškozené DNA. Lokalizace genu pro BRCA 2 je 13q12-13 a má obdobnou funkci jako BRCA1.
HPC20 Lokus se nachází na chromozomu 20q13. Předpokládá se, že pokud má vůbec nějaký význam u hereditárního karcinomu prostaty, pak se uplatňuje u mužů s karcinomem diagnostikovaným ve vyšším věku (60).
Mutace u sporadických karcinomů
Okolnosti, kdy dochází ke změně genetické informace v buňkách prostaty, nemusejí vždy nastat v předchozích generacích mužů ohrožených vznikem KP. Tyto změny se ve většině případů odehrávají zcela běžně v průběhu života a je otázka, zda ochranné mechanismy danou mutaci odhalí, jak vyhodnotí její závažnost a zda jsou schopny ji opravit. V opačném případě tak často iniciují klonální expanzi patologických buněk se všemi souvisejícími důsledky. Závažnost těchto změn spočívá také v tom, že těchto „sporadických karcinomů“ je až 85 % ze všech KP, ačkoli je jen minimální riziko přenosu na následující generaci mužů. Genetické změny mohou být v těchto případech (obdobně jako u hereditárních karcinomů) dány nejen jednobodovými mutacemi, ale i translokacemi genů. Význam této formy mutace byl zjištěn u tzv. fúze genu TMPRSS2 na ERG (61). TMPRSS2 je serinová proteáza, jejíž význam nebyl dosud přesně definován, nachází se v prostatických buňkách a podílí se na fyziologických i patologických procesech v buňce. Napojením TMPRSS2 na transkripční faktor ERG (ale i jiné, např. ETV1, 4 a další) se potencuje maligní potenciál buněk a tumorigeneze. Karcinomy prostaty s touto fúzí mají dle řady studií agresivnější chování a horší prognózu, ačkoliv výsledky jiných prací tuto hypotézu nepotvrzují (62, 63). Další genetickou změnou může být ztrátová mutace, např. u KLF6 (Krüppel-like factor 6 v lokusu chromozomu 10p15) a následná deregulace buněčné proliferace. Skutečně bylo prokázáno, že mutace u KLF6 se vyskytuje až v 55 % sporadických karcinomů prostat, ačkoliv se nepotvrdil původní předpoklad významu u geneticky podmíněných karcinomů (31, 64). Z dalších faktorů uveďme například mutace genů pro c-Myc, E-cadherin, NKX31 a mutace tumor supresorových genů PTEN, p53 či RB (65).
Závěr
Navzdory extenzivnímu výzkumu je karcinom prostaty z pohledu etiopatogeneze jen velmi málo prozkoumané onemocnění. S rozvojem metod molekulární patologie se otevírají nové možnosti časné diagnostiky, stanovení prognózy choroby i predikce výsledků léčby. S ohledem na současnou světovou incidenci a společenský dopad bude KP nadále stát v centru zájmu nejen urologů, patologů a onkologů, ale nepochybně (a ne-li jednou dokonce dominantně) molekulárních biologů a genetiků. Na klinické využití výše prezentovaných poznatků týkajících se genetického rizika u KP si však budeme muset ještě počkat.
Podpořeno interním grantem LF UP Olomouc č. 91110261.
Došlo: 23. 2. 2010
Přijato: 18. 5. 2010
Kontaktní adresa
Urologická klinika LF UP a FN
I. P. Pavlova 6,
775 20 Olomouc
e-mail: kral.milan@seznam.cz
Sources
1. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58 : 71–96.
2. Merrill RM, Stephenson RA. Trends in mortality rates in patients with prostate cancer during the era of prostate specific antigen screening. J Urol 2000; 163 : 503–510.
3. Epstein JI, Allsbrook WC Jr, Amin MB, et al. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29 : 1228–1242.
4. http://www.svod.cz
5. Strope SA, Andriole GL. Update on chemoprevention for prostate cancer. Curr Opin Urol 2010; 20 : 194–197.
6. Dvořáček J. Nádory prostaty. In: Dvořáček J, Babjuk M, et al. Onkourologie, 1. vydání. Praha: Galén 2005; 225–242.
7. Klein EA, Platz EA, Thompson IM. Epidemiology, Etiology, and Prevention of Prostate Cancer. In: Wein AJ, Kavoussi LR, et al. Campbell-Walsh Urology, 9th ed. Philadelphia: Saunders 2007; 2854–2867
8. Carter BS, Beaty TH, Steinberg GD, Childs B, Walsh PC. Mendelian inheritance of familial prostate cancer. Proc Natl Acad Sci USA 1992; 89 : 3367–3371.
9. Bratt O. Hereditary prostate cancer: clinical aspects. J Urol 2002; 168 : 906–913.
10. Carter BS, Bova GS, Beaty TH, et al. Hereditary prostate cancer: epidemiologic and clinical features. J Urol 1993; 150 : 797–802.
11. Schaid DJ, McDonnell SK, Blute ML, Thibodeau SN. Evidence for autosomal dominant inheritance of prostate cancer. Am J Hum Genet 1998; 62 : 1425–1438.
12. Zeegers MP, Jellema A, Ostrer H. Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: a meta-analysis. Cancer 2003; 97 : 1894–1903.
13. Bruner DW, Moore D, Parlanti A, Dorgan J, Engstrom P. Relative risk of prostate cancer for men with affected relatives: systematic review and meta-analysis. Int J Cancer 2003; 107 : 797–803.
14. Kalish LA, McDougal WS, McKinlay JB. Family history and the risk of prostate cancer. Urology 2000; 56 : 803–806.
15. Mastalski K, Coups EJ, Ruth K, Raysor S, Giri VN. Substantial family history of prostate cancer in black men recruited for prostate cancer screening: results from the Prostate Cancer Risk Assessment Program. Cancer 2008; 113 : 2559–2564.
16. Chen YC, Page JH, Chen R, Giovannucci E. Family history of prostate and breast cancer and the risk of prostate cancer in the PSA era. Prostate 2008; 68 : 1582–1591.
17. Valeri A, Briollais L, Azzouzi R, et al. Segregation analysis of prostate cancer in France: evidence for autosomal dominant inheritance and residual brother-brother dependence. Ann Hum Genet 2003; 67 : 125–137.
18. Verhage BA, Baffoe-Bonnie AB, Baglietto L, et al. Autosomal dominant inheritance of prostate cancer: a confirmatory study. Urology 2001; 57 : 97–101.
19. Page WF, Braun MM, Partin AW, Caporaso N, Walsh P. Heredity and prostate cancer: a study of World War II veteran twins. Prostate 1997; 33 : 240–245.
20. Gronberg H, Damber L, Damber JE. Studies of genetic factors in prostate cancer in a twin population. J Urol 1994; 152 : 1484–1487; discussion 1487–1489.
21. Kupelian PA, Kupelian VA, Witte JS, Macklis R, Klein EA. Family history of prostate cancer in patients with localized prostate cancer: an independent predictor of treatment outcome. J Clin Oncol 1997; 15 : 1478–1480.
22. Bova GS, Partin AW, Isaacs SD, et al. Biological aggressiveness of hereditary prostate cancer: long-term evaluation following radical prostatectomy. J Urol 1998; 160 : 660–663.
23. Gronberg H, Damber L, Tavelin B, Damber JE. No difference in survival between sporadic, familial and hereditary prostate cancer. Br J Urol 1998; 82 : 564–567.
24. Hanlon AL, Hanks GE. Patterns of inheritance and outcome in patients treated with external beam radiation for prostate cancer. Urology 1998; 52 : 735–738.
25. Herkommer K, Paiss T, Merz M, Gschwend JE, Kron M. Association of a positive family history with histopathology and clinical course in early-onset prostate cancer. Urologe A 2006; 45 : 1532–1539.
26. Roupret M, Fromont G, Bitker MO, Gattegno B, Vallancien G, Cussenot O. Outcome after radical prostatectomy in young men with or without a family history of prostate cancer. Urology 2006; 67 : 1028–1032.
27. Robbins AS, Yin D, Parikh-Patel A. Differences in prognostic factors and survival among White men and Black men with prostate cancer, California, 1995–2004. Am J Epidemiol 2007; 166 : 71–78.
28. Gottlieb B, Beitel LK, Wu JH, Trifiro M. The androgen receptor gene mutations database (ARDB): 2004 update. Hum Mutat 2004; 23 : 527–533.
29. Brooke GN, Bevan CL. The role of androgen receptor mutations in prostate cancer progression. Curr Genomics 2009; 10 : 18–25.
30. Lukeš M. Hereditární karcinom prostaty. In: Záleský M, Lukeš M. Molekulární genetika karcinomu prostaty. Praha: Galén 2002; 77–89.
31. Narla G, Friedman SL, Martignetti JA. Kruppel cripples prostate cancer: KLF6 progress and prospects. Am J Pathol 2003; 162 : 1047–1052.
32. Suzuki H, Ueda T, Ichikawa T, Ito H. Androgen receptor involvement in the progression of prostate cancer. Endocr Relat Cancer 2003; 10 : 209–216.
33. Chen C, Lamharzi N, Weiss NS, et al. Androgen receptor polymorphisms and the incidence of prostate cancer. Cancer Epidemiol Biomarkers Prev 2002; 11 : 1033–1040.
34. Silva Neto B, Koff WJ, Biolchi V, et al. Polymorphic CAG and GGC repeat lengths in the androgen receptor gene and prostate cancer risk: analysis of a Brazilian population. Cancer Invest 2008; 26 : 74–80.
35. Brinkmann AO. Molecular basis of androgen insensitivity. Mol Cell Endocrinol 2001; 179 : 105–109.
36. Marcelli M, Ittmann M, Mariani S, et al. Androgen receptor mutations in prostate cancer. Cancer Res 2000; 60 : 944–949.
37. Ntais C, Polycarpou A, Ioannidis JP. SRD5A2 gene polymorphisms and the risk of prostate cancer: a meta–analysis. Cancer Epidemiol Biomarkers Prev 2003; 12 : 618–624.
38. Cunningham JM, Hebbring SJ, McDonnell SK, et al. Evaluation of genetic variations in the androgen and estrogen metabolic pathways as risk factors for sporadic and familial prostate cancer. Cancer Epidemiol Biomarkers Prev 2007; 16 : 969–978.
39. Ostrander EA, Johannesson B. Prostate cancer susceptibility loci: finding the genes. Adv Exp Med Biol 2008; 617 : 179–190.
40. Stanford JL, McDonnell SK, Friedrichsen DM, et al. Prostate cancer and genetic susceptibility: a genome scan incorporating disease aggressiveness. Prostate 2006; 66 : 317–325.
41. Easton DF, Schaid DJ, Whittemore AS, Isaacs WJ. Where are the prostate cancer genes?
A summary of eight genome wide searches. Prostate 2003; 57 : 261–269.
42. Schaid DJ. The complex genetic epidemiology of prostate cancer. Hum Mol Genet 2004;
13(Spec No 1): R103–R121.
43. Hatcher D, Daniels G, Osman I, Lee P. Molecular mechanisms involving prostate cancer
racial disparity. Am J Transl Res 2009; 1 : 235–248.
44. Simard J, Dumont M, Labuda D, et al. Prostate cancer susceptibility genes: lessons learned
and challenges posed. Endocr Relat Cancer 2003; 10 : 225–259.
45. http://www.ncbi.nlm.nih.gov/entrez/ (OMIM – Online Mendelian Inheritance in Men)
46. Klein EA. Genetická náchylnost a oxidační stres u karcinomu prostaty: integrovaný model s doporučeními pro prevenci. Urol List 2006; 4(4): 19–24.
47. Smith JR, Freije D, Carpten JD, et al. Major susceptibility locus for prostate cancer on chromosome 1 suggested by a genome-wide search. Science 1996; 274 : 1371–1374.
48. Gronberg H, Isaacs SD, Smith JR, et al. Characteristics of prostate cancer in families potentially linked to the hereditary prostate cancer 1 (HPC1) locus. JAMA 1997; 278 : 1251–1255.
49. Li H, Tai BC. RNASEL gene polymorphisms and the risk of prostate cancer: a meta-analysis. Clin Cancer Res 2006; 12 : 5713–5719.
50. Shook SJ, Beuten J, Torkko KC, et al. Association of RNASEL variants with prostate cancer risk in Hispanic Caucasians and African Americans. Clin Cancer Res 2007; 13 : 5959–5964.
51. Rennert H, Bercovich D, Hubert A, et al. A novel founder mutation in the RNASEL gene, 471delAAAG, is associated with prostate cancer in Ashkenazi Jews. Am J Hum Genet 2002; 71 : 981–984.
52. Orr-Urtreger A, Bar-Shira A, Bercovich D, et al. RNASEL mutation screening and association study in Ashkenazi and non-Ashkenazi prostate cancer patients. Cancer Epidemiol Biomarkers Prev 2006; 15 : 474–479.
53. Schlaberg R, Choe DJ, Brown KR, Thaker HM, Singh IR. XMRV is present in malignant prostatic epithelium and is associated with prostate cancer, especially high-grade tumors. Proc Natl Acad Sci USA 2009; 106 : 16351–16356.
54. Rebbeck TR, Walker AH, Zeigler-Johnson C, et al. Association of HPC2/ELAC2 genotypes and prostate cancer. Am J Hum Genet 2000; 67 : 1014–1019.
55. Shea PR, Ferrell RE, Patrick AL, Kuller LH, Bunker CH. ELAC2 and prostate cancer risk in Afro-Caribbeans of Tobago. Hum Genet 2002; 111 : 398–400.
56. Kouprina N, Pavlicek A, Noskov VN, et al. Dynamic structure of the SPANX gene cluster mapped to the prostate cancer susceptibility locus HPCX at Xq27. Genome Res 2005; 15 : 1477–1486.
57. Baffoe-Bonnie AB, Smith JR, Stephan DA, et al. A major locus for hereditary prostate cancer in Finland: localization by linkage disequilibrium of a haplotype in the HPCX region. Hum Genet 2005; 117 : 307–316.
58. Farnham JM, Camp NJ, Swensen J, Tavtigian SV, Albright LA. Confirmation of the HPCX prostate cancer predisposition locus in large Utah prostate cancer pedigrees. Hum Genet 2005; 116 : 179–185.
59. Sun J, Hsu FC, Turner AR, et al. Meta-analysis of association of rare mutations and common sequence variants in the MSR1 gene and prostate cancer risk. Prostate 2006; 66 : 728–737.
60. Berry R, Schroeder JJ, French AJ, et al. Evidence for a prostate cancer-susceptibility locus on chromosome 20. Am J Hum Genet 2000; 67 : 82–91.
61. Tomlins SA, Rhodes DR, Perner S, et al. Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer. Science 2005; 310 : 644–648.
62. Jamaspishvili T, Kral M, Khomeriki I, Student V, Kolar Z, Bouchal J. Urine markers in monitoring for prostate cancer. Prostate Cancer Prostatic Dis 2010; 13 : 12–19.
63. Albadine R, Latour M, Toubaji A, et al. TMPRSS2-ERG gene fusion status in minute (minimal) prostatic adenocarcinoma. Mod Pathol 2009; 22 : 1415–1422.
64. Koivisto PA, Hyytinen ER, Matikainen M, Tammela TL, Ikonen T, Schleutker J. Kruppellike factor 6 germ-line mutations are infrequent in Finnish hereditary prostate cancer. J Urol 2004; 172 : 506–507.
65. Dong JT. Prevalent mutations in prostate cancer. J Cell Biochem 2006; 97 : 433–447.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology

2010 Issue 3-
All articles in this issue
- Infekce močových cest po cystektomii s kontinentní ortotopickou derivací – Vesica ileale padovana (V.I.P.)
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
- Genetické riziko karcinomu prostaty
- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Chronická urinární toxicita 3D-CRT a IMRT karcinomu prostaty
- Srovnání akutní toxicity radioterapie technikou IMRT a IMRT + HDR BRT u pacientů s karcinomem prostaty vysokého rizika rekurence
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

